REGISTRO DOI: 10.69849/revistaft/ni10202501251501
Victória Santos da Silva1;
Bianca Gomes Lubanco2;
Professor Orientador: André William Masseaux Vidal Júnior3
RESUMO
A osteoartrite (OA) em cães é um desafio de saúde, muitas vezes avaliado subjetivamente. O Questionário “Liverpool Osteoarthritis in Dogs” (LOAD) é uma ferramenta objetiva com 13 itens para avaliar distúrbios articulares caninos. Os tutores preenchem o LOAD, baseando-se em suas observações, contribuindo com informações cruciais. O LOAD atribui pontuações de 0 a 4, com 0 indicando saudável e 4 significa doença grave. A pontuação geral ajuda a determinar a presença e gravidade da OA. Veterinários podem usar o LOAD para diagnóstico, monitoramento e tratamento da OA. Pode ser preenchido antes da consulta, durante a visita ou eletronicamente. O Questionário LOAD é fundamental para melhorar o diagnóstico e tratamento da OA em cães, promovendo o bem-estar desses animais. O objetivo do presente trabalho é utilizar o questionário para diagnóstico de osteoartrose e acompanhamento de pacientes caninos ao longo do tratamento instituído.
Palavra-chave: osteoartrite, displasia coxofemoral, luxação patelar, lesão ligamentar, instabilidade articular.
1 INTRODUÇÃO
A osteoartrite (OA1) é uma causa significativa de dor, claudicação e morbidade em cães e muitas outras espécies, incluindo humanos, em todo o mundo (Brown et al. 2013b, Knazovicky et al. 2016, Anderson et al. 2018, Cui et al. 2020). Trata-se de uma doença multifatorial, progressiva e degenerativa das articulações sinoviais, que afeta não apenas a cartilagem articular, mas também outras estruturas dentro da articulação sinovial específica (Loeser et al. 2012). A degradação da cartilagem articular, a esclerose do osso subcondral, a osteofitose, os vários graus de sinovite, a degeneração meniscal e ligamentar são todas características do processo da doença. No entanto, ainda há muito a ser compreendido sobre a patogênese subjacente da OA (Glyn-Jones et al. 2015).
A displasia coxofemoral canina (DCC) é uma doença multifatorial caracterizada por uma malformação das articulações do quadril. Em 1966, a DCC foi descrita como uma frouxidão da articulação do quadril, levando à subluxação durante a vida precoce e causando diferentes graus de achatamento da cabeça femoral e do acetábulo, o que consequentemente resulta na progressão da osteoartrose (OA2). Desde 1950, a avaliação radiográfica na projeção ventrodorsal com o quadril estendido tem sido amplamente utilizada para o rastreamento e diagnóstico da displasia coxofemoral, embora outros exames diagnósticos colaterais mais precisos tenham sido descritos para examinar detalhes da anatomia e frouxidão da articulação do quadril.
O objetivo do trabalho é utilizar-se do método LOAD para obter informações, fornecidas pelo tutor do paciente.
2 REVISÃO DE LITERATURA
2.1 Casuística artrose
A ruptura do ligamento cruzado cranial (CrCL) é uma das condições ortopédicas mais comuns na medicina veterinária. O CrCL desempenha um papel fundamental na estabilidade e biomecânica da articulação fêmoro-tíbio-patelar, e sua disfunção impacta gravemente a qualidade de vida dos pacientes. Nos cães, o enfraquecimento estrutural dessa articulação devido à degeneração progressiva do ligamento é a hipótese etiopatogenética mais aceita, relacionada ao perfil do paciente (raça, sexo e idade) e à conformação da articulação do joelho. Nos seres humanos, essa lesão costuma ser traumática e ocorre geralmente durante atividades esportivas. A ruptura do CrCL pode ser tratada de forma conservadora ou cirúrgica, e a decisão sobre o tratamento leva em consideração vários fatores: idade e saúde do paciente, grau de instabilidade do joelho e custo. Os protocolos de fisioterapia desempenham um papel importante na reabilitação, com objetivos semelhantes tanto em humanos quanto em cães: controle da dor, recuperação da amplitude articular fisiológica, fortalecimento dos músculos periarticulares e do core, e correção de déficits proprioceptivos. A fisioterapia, embora muitas vezes negligenciada na medicina veterinária, é essencial para a recuperação da funcionalidade correta do membro lesionado e para o retorno às atividades diárias e esportivas normais.
A osteoartrite da articulação do cotovelo secundária à displasia do cotovelo é comum em cães. A injeção intra-articular de radionuclídeo é considerada capaz de suprimir tanto a sinovite quanto os mediadores inflamatórios da dor na articulação, que não são diretamente abordados pelos tratamentos atuais. Esta investigação de definição de dose foi um estudo longitudinal, prospectivo, experimental, de grupos paralelos, pós-teste, com medidas repetidas. Quarenta e quatro cães, com osteoartrite de grau baixo a intermediário, receberam uma única injeção na articulação do cotovelo mais clinicamente afetada e foram randomizados em três grupos de tratamento: 37 MBq, 64,75 MBq ou 92,5 MBq (normalizados para a área de superfície corporal de um cão de 22 kg) de radiocolóide 117m Sn. Os cães foram avaliados mensalmente pelos proprietários, usando o Inventário Canino de Dor Breve (cBPI), e em intervalos de 1, 3, 6, 9 e 12 meses pelos investigadores. Respostas positivas ao tratamento foram observadas tanto pelos proprietários quanto pelos clínicos em todos os grupos de dose, com o grupo de dose média apresentando a maior e mais duradoura taxa de resposta com base nas pontuações do cBPI. Os resultados deste estudo apoiam o uso do radiocolóide 117m Sn como tratamento primário da osteoartrite em casos de osteoartrite de grau baixo a intermediário na articulação do cotovelo canino.
2.2 Anatomia da articulação sinovial
2.2.1 Anatomia da articulação do joelho
Nos membros posteriores de animais quadrúpedes como cães, ovelhas e cavalos, a articulação do joelho é uma articulação importante e complexa. Ela geralmente representa a maior articulação sinovial no corpo do animal e possui semelhança com o joelho humano. O fêmur, a patela e a tíbia, que juntos formam a articulação do joelho, são diferentes ossos envolvidos nessa estrutura. Além disso, outras articulações, como a entre a tíbia e o fêmur (articulação femorotibial), consistem em três pequenas articulações que compõem a articulação do joelho: uma no centro e duas outras (femorotibiais) nas laterais, nas regiões lateral e medial. A articulação do joelho é composta pelas articulações femorotibial e femoropatelar, além de outra articulação com a tíbia e a fíbula. Essa articulação desempenha um papel importante na estabilização por meio de ligamentos emparelhados, incluindo os ligamentos cruzados e colaterais, e é acolchoada por duas cartilagens de suporte conhecidas como meniscos. Os meniscos fornecem amortecimento e auxiliam na função da articulação. Eles dividem o joelho em duas unidades funcionais e contêm terminações nervosas que auxiliam na propriocepção em diferentes espécies, podendo ter até quatro ossos sesamoides associados à articulação do joelho, sendo a patela o mais conhecido. A patela guia o tendão do quadríceps sobre a articulação do joelho, enquanto outros ossos sesamoides auxiliam no movimento suave de tendões/músculos. Devido aos meniscos, que são fibrocartilagens intra-articulares que separam as superfícies articulares do joelho, ele é classificado como uma articulação condilar sinovial complexa. Os principais movimentos ao redor do joelho são flexão e extensão
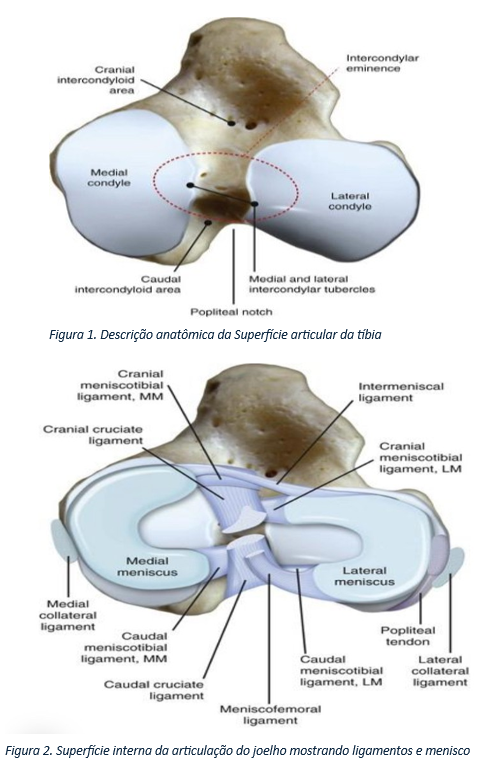
2.2.2 Anatomia da articulação coxofemoral
As superfícies articulares do quadril são formadas pela cabeça do fêmur (Caput ossis femoris) que apresenta a fossa acetabular (Fovea capitis); acetábulo (Acetabulum) com a superfície articular e fossa acetabular (Fossa acetabuli); a crista da cavidade acetabular com uma mola fibrocartilaginosa acetabular (Labrum acetabulare), que salta sobre a incisura acetabular formando o ligamento acetabular transverso (Ligamentum transversum acetabuli). Como meio de conexão das estruturas intra-articulares estão os ligamentos pericapsulares (descritos por poucos autores): o ligamento iliofemoral (Lig. iliofemorale) com fixação na face cranial da cápsula articular; o ligamento iliofemoral (Lig. ischiofemorale) com fixação na face caudal da cápsula articular e o ligamento pubofemoral (Lig. pubofemorale) com fixação na face ventral da cápsula articular; que são algumas estruturas de tecidos moles, derivadas da articulação cápsula na forma de feixes de fibras com função na conexão entre as superfícies ósseas. O ligamento da cabeça femoral, designado na nomenclatura oficial como Ligamentum capitis ossis femoris, é descrito de forma inequívoca e reflete o conhecimento geral. Este ligamento está localizado no interior da cápsula articular, que é muito forte, representada por uma manga conóide com base de inserção grande no coxal e base pequena no fêmur e conecta a fossa acetabular (Fossa acetabuli) com a Fovea capitis ossis femoris. Este ligamento desempenha um papel importante, principalmente durante o período de crescimento, como “ponte” para os vasos sanguíneos, e posteriormente não apenas como suporte, mas também como freio no processo de movimento. O ligamento é bastante elástico e pode esticar com potencial de ruptura
2.3 Artropatias e artroses
A osteoartrite primária é descrita como sendo em grande parte idiopática, mas pode estar associada a vários fatores de risco, incluindo envelhecimento e obesidade. A osteoartrite secundária, na qual processos de doenças subjacentes ou lesões desempenham um papel no desenvolvimento da osteoartrite, é considerada a forma mais comum em cães. A patogénese da osteoartrite secundária é considerada ter um componente genético exacerbado por aspectos do estilo de vida que impactam a condição corporal, como dieta e exercício. Processos patológicos e artropatias pré-existentes frequentemente influenciam a patogénese; por exemplo, a doença do ligamento cruzado cranial é uma causa comum de claudicação nos membros pélvicos e pode resultar no desenvolvimento de osteoartrite em raças de todos os tamanhos. A displasia articular, que ocorre comumente no quadril ou cotovelo, descreve a falha na formação normal da articulação durante o desenvolvimento e pode levar a condições articulares bem reconhecidas e descritas que causam dor e claudicação por si mesmas, podendo progredir para osteoartrite. Consequentemente, é importante entender os fatores de risco para essas doenças complexas ao considerar a epidemiologia da osteoartrite canina.
A artrite reumatóide (AR), uma doença autoimune, é caracterizada pela presença de poliartrite simétrica predominantemente das pequenas articulações que leva à destruição grave da cartilagem e dos ossos. Com base em dados animais e humanos, foi delineada a fisiopatologia da osteoporose, uma comorbidade frequente em conjunto com a AR. Processos inflamatórios autoimunes, que levam a uma regulação positiva sistêmica de citocinas inflamatórias e osteoclastogênicas, à produção de autoanticorpos e à senescência de células Th com uma suposta incapacidade de controlar o sistema imunológico sistêmico e o status osteoclastogênico, podem desempenhar papéis importantes na fisiopatologia da osteoporose na AR . Consequentemente, a atividade dos osteoclastos aumenta, a função dos osteoblastos diminui e as propriedades metabólicas e mecânicas ósseas deterioram-se. Embora estejam disponíveis vários medicamentos modificadores da doença para tratar a inflamação das articulações, os dados sobre a capacidade destes medicamentos para prevenir fraturas por fragilidade são limitados. Assim, o tratamento específico da osteoporose deve ser considerado em pacientes com AR e um risco aumentado associado de fraturas por fragilidade.
2.4 Sinais clínicos
A distribuição de peso e a descarga ou favorecimento de membros durante a postura são avaliações subjetivas comumente utilizadas durante o exame ortopédico. Animais com OA podem não apresentar claudicação evidente ao andar ou trotar, mas exibem mudanças sutis na distribuição do peso corporal durante a postura devido à dor ou instabilidade. A análise da postura foi relatada como sensível para detectar claudicação em cães, com melhores resultados em cães de grande porte. A atrofia muscular é um achado consistente e é evidente dentro de algumas semanas após o início da OA. A restrição da amplitude de movimento (ADM), incluindo flexão e extensão, geralmente está presente.
A osteoartrite das articulações do quadril é uma causa importante de claudicação em cães de todas as idades. A osteoartrite do quadril geralmente se desenvolve secundariamente à displasia do quadril em cães, e a laxidade articular em cães displásicos demonstrou ser um fator de risco importante para o desenvolvimento da osteoartrite do quadril. Vários tratamentos são utilizados para cães com sinais clínicos de claudicação secundária à displasia do quadril e osteoartrite do quadril, incluindo tratamento médico com medicamentos e tratamentos cirúrgicos, como osteotomia pélvica tripla, substituição total do quadril e excisão da cabeça e pescoço femoral.
Animais de esporte e de trabalho estão em risco aumentado, sendo expostos a cargas repetitivas e lesões por fadiga crônica, levando a danos nos tecidos, desgaste e, por fim, falha dos tecidos, resultando em sinais clínicos. Pelo menos 80% dos casos de claudicação e doenças articulares em animais de companhia são classificados como OA, com 20% dos cães de meia-idade e U0% dos cães mais velhos apresentando OA em uma ou mais articulações. Um histórico clínico preciso e completo pode eliciar evidências de rigidez inativa, relutância em se exercitar, dificuldade para saltar e intolerância ao exercício.
2.5 Diagnóstico
2.5.1 Clínico
Vários instrumentos de metodologia clínica (IMC) foram desenvolvidos
para medir as avaliações de resultados e abortar essas diferentes dimnensões. Em cães, os IMC’s são tipicamente preenchidos por um proxy. Os que foram desenvolvidos e validados para cães são o “Canine Brief Pain Inventory” (CBPI) e o “Liverpool Osteoarthritis in Dogs” (LOAD). O CBPI permite avaliar a dor do cão e é dividido em duas seções: Um escore de severidade da dor (PSS) que avalia a magnitude da dor do anima, e um escore de interferência da dor (PIS) que avalia o grau em que a dor afeta as atividades diárias. O Canine Orthopaedic Index (COI) foi desenvolvido para pesquisa clínica em ortopedia canina ou para resultados individuais em quatro domínios: Rigidez, marcha, função e qualidade de vida. Foi demonstrado que possui excelente confiabilidade e validade. A Hudson Visual Analogue Scale (HVAS) foi considerada repetível e válida para avaliar o grau de claudicação leve a moderada em cães, em comparação com as análises de placas de força como um padrão de referência criterial. Ao coletar informações de diferentes IMC’s é possível caracterizar a doença em todas as dimensões, o nível de dor do paciente, o grau de claudicação, a capacidade de desfrutar a vida e realizar atividades diárias. Isso também permite caracterizar o efeito de um tratamento em cada uma dessas dimensões.
2.5.2 Laboratorial
Amostragem, processamento e preservação de SF canino O SF (Fluido sinovial) foi obtido assepticamente da articulação afetada ou controle por artrocentese percutânea. Tanto para a articulação afetada quanto para a articulação controle, foram necessários pelo menos 150 microlitros (μL) de SF. O SF adquirido foi centrifugado (12.000 x g, 1,5 minutos (min)), dividido em alíquotas em eppendorfs de 0,5 mL e armazenado a-80 ◦C até a análise. Quantificação de biomarcadores metabólicos em SF canina Antes da análise, uma alíquota congelada de cada amostra de SF foi descongelada a temperatura ambiente e centrifugado (11.500 x g, 10 min a 4 ◦ C). Tanto quanto possível, vários testes foram realizados no mesmo dia utilizando uma alíquota. Devido à alta viscosidade do SF, a pipetagem e a análise precisas eram um desafio. Portanto, as amostras foram pré-tratadas com hialuronidase testicular bovina (HA) (Sigma-Aldrich, Saint-Louis, EUA), que degrada ácido hialurônico, condroitina e sulfatos de condroitina em tetra e hexassacarídeos. O HA liofilizado foi dissolvido em solução salina tamponada com fosfato (PBS) até uma concentração de 10 mg/mL. PH O pH foi medido com um medidor digital baseado no método de eletrodo de vidro (LAQUAtwin B 172; HORIBA Scientific, Kyoto, Japão). O sensor dos dispositivos foi limpo duas vezes com água destilada e papel absorvente, após o que foi realizada uma calibração de dois pontos de acordo com as instruções dos fabricantes com as soluções padrão incluídas em pH 7,00 e 4,00. Após cada análise, o sensor foi limpo conforme descrito acima. Para todas as amostras, um volume de 50 μL de SF foi aplicado ao sensor, seguido por uma folha de amostragem B (HORIBA Scientific) para cobrir toda a superfície do sensor.
2.5.3 Imagem
Os métodos para avaliar as alterações nesses modelos de artrite incluem imagens de raios-X, exame do sinovio, bioquímica, histoquímica e avaliação macroscópica. As imagens radiológicas são úteis para identificar mudanças patológicas em pacientes com artrite e estão sendo cada vez mais utilizadas porque são não invasivas e permitem uma avaliação serial. Embora muitos métodos sejam utilizados para a avaliação radiológica da artrite, ainda é necessário classificar as imagens da artrite do joelho para quantificar a gravidade e comparar as mudanças. Para quantificar as mudanças observadas nas radiografias, sistemas de classificação foram desenvolvidos para a osteoartrite do joelho humano e, em menor grau, para a osteoartrite do joelho canino. A classificação da articulação do quadril em cães já foi estudada e pode ser potencialmente aplicável à avaliação da articulação do joelho após o desenvolvimento. A articulação do joelho em cães é muito pequena para ser avaliada apenas por raios-X, como em humanos.
Portanto, é possível obter imagens seccionais, o que elimina a dificuldade de leitura devido à sobreposição, ao adicionar a imagem por tomografia computadorizada (TC) às ferramentas de avaliação.
A radiografia é importante para confirmar o diagnóstico da doença de osteoartrite (OA), reavaliar as articulações em casos complexos e/ou em deterioração, e para o estadiamento geral da OA canina. No entanto, é geralmente aceito que o tratamento da OA deve ser baseado em sinais clínicos, em vez de sinais radiográficos.
A fidelidade da radiografia no diagnóstico de OA foi aprimorada com o uso da artrografia por contraste, que permite uma melhor visualização das estruturas, incluindo a cartilagem articular, ao alterar temporariamente a radiopacidade do líquido articular ao redor. Em cães, a artrografia foi tentada especialmente no ombro, e em menor grau no joelho, mas com valor diagnóstico limitado. Assim chamadas modalidades de imagem avançadas (TC e RM) tornaram essa abordagem um tanto redundante na radiografia convencional, embora a “artrografia anestésica”, onde o material de contraste é diluído com anestésico local para identificar tanto a fonte quanto a causa da claudicação, tenha sido utilizada por alguns.
Apesar de suas fraquezas, a radiografia continua sendo a modalidade de imagem padrão para o diagnóstico clínico de OA tanto em humanos quanto em cães. Enquanto a imagem radiográfica da OA em humanos e veterinária se alinha na maioria dos casos, existem algumas diferenças chave em relação a cistos ósseos subcondrais e estreitamento do espaço articular.
Também foi reconhecido na imagem diagnóstica humana que a TC é superior na detecção de pequenos osteófitos, que são inconspícuos em radiografias simples em 2D, e pode-se supor que isso se aplica à imagem veterinária. Portanto, a TC permite a identificação mais precoce das alterações ósseas secundárias, permitindo também uma quantificação mais precisa dessas medidas.
Por exemplo, o tamanho dos osteófitos pode ser medido por TC e mostrou estar associado a alterações na cartilagem articular confirmadas por artroscopia dentro do cotovelo, sendo o tamanho individual dos osteófitos na imagem de TC a base da maioria dos sistemas de pontuação de OA baseados em TC em cães
Uma segunda mudança de paradigma na imagem da OA ocorreu com a invenção da ressonância magnética (RM), que pela primeira vez permitiu a imagem detalhada de tecidos moles e ossos, proporcionando uma investigação holística de todo o órgão articular. A RM explora as propriedades eletromagnéticas dos íons de hidrogênio em H2O e lipídios, que estão abundantemente presentes nos tecidos do corpo, aplicando campos magnéticos intensos nos tecidos e, em seguida, medindo sua resposta diferencial como emissões de radiofrequência. Nos cães, a RM foi amplamente adotada para avaliação neurológica, mas não para OA. Uma das primeiras publicações que referenciavam o uso da RM para avaliar a OA experimental canina foi publicada em 1987, na qual foram avaliadas as alterações do joelho em um modelo de transecção do ligamento cruzado cranial (CCL). Os autores mostraram que as alterações na RM se correlacionavam com a patologia macroscópica e que as mudanças ligadas à OA eram vistas na RM mais cedo do que na radiografia. Neste estudo, osteófitos eram visíveis na RM 4 semanas após a transecção do CCL, enquanto não eram visíveis na radiografia até 12 semanas após a transecção.
2.6 Tratamento
2.6.1 Clínico
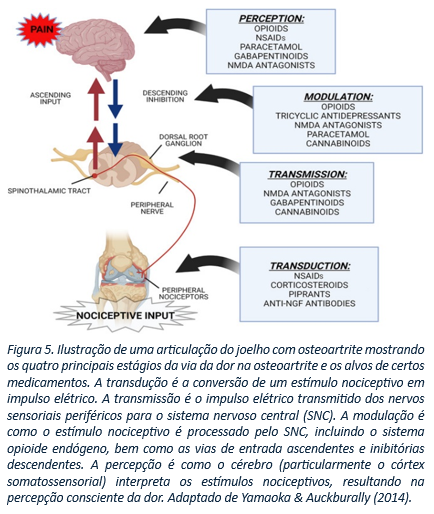
Os tratamentos disponíveis são variados e estão sujeitos a múltiplos fatores, incluindo o membro afetado, a extensão da lesão, o histórico do paciente e outros parâmetros a serem considerados. O prognóstico também é influenciado por esses elementos (Lamounier, 2023). O manejo da dor, portanto, é essencial no tratamento. Existem várias classes de medicamentos analgésicos disponíveis, com diferentes mecanismos de ação, que atuam na nocicepção em diferentes etapas da via da dor (Fig. 4).
Com isso em mente, é importante considerar uma analgesia e gestão multimodal ao tratar pacientes caninos com OA, especialmente quando a resposta a um tipo de medicamento é insuficiente (Lascelles et al., 2008). A analgesia pode ser proporcionada com a administração de nutracêuticos, anti-inflamatórios não esteroidais (AINEs), tramadol, gabapentina e amitriptilina (Alves, 2022).
Os ensaios clínicos envolvendo cimicoxibe (no Brasil, o nome da mediação é Cimalgex) para o tratamento de osteoartrite (OA) em cães são escassos. No entanto, um estudo mostrou que o cimicoxibe proporciona analgesia superior à do tramadol no pós-operatório após a cirurgia de osteotomia de nivelamento do plateau tibial (Piras et al. 2021).
O enflicoxibe (no Brasil, a mediação é encontrada de duas formas: Firocoxib e Previcox), o mais recente coxibe licenciado, é administrado em intervalos semanais, com uma dose de carga inicial de 8 mg/kg, seguida de doses semanais de 4 mg/kg (National Office of Animal Health 2021a). Um estudo recente envolvendo 242 cães randomizados para receber enflicoxibe, mavacoxibe ou placebo, encontrou uma melhora na avaliação dos veterinários e dos proprietários sobre os sinais clínicos relacionados à OA, com ambos os AINEs em comparação ao placebo ao longo do período de 6 semanas do ensaio (Salichs et al. 2021). O mavacoxibe difere dos outros AINEs licenciados, pois tem uma meia-vida muito mais longa, e o regime de dosagem envolve repetir a dose oral inicial 14 dias após o primeiro tratamento, seguida de intervalos mensais (Lees et al. 2015). Dois ensaios clínicos examinaram a eficácia clínica do tratamento com mavacoxibe em 111 e 124 cães com OA naturalmente ocorrente, comparando-os ao meloxicam (Walton et al. 2014) ou ao carprofeno (Payne-Johnson et al. 2015), respectivamente. Ambos os estudos constataram que o mavacoxibe não era inferior ao AINE de controle ao longo dos períodos de estudo de 12 semanas e 134 dias, com uma taxa similar de eventos adversos. No entanto, devido à sua meia-vida prolongada, há um potencial risco aumentado de overdose inadvertida pelos proprietários e uma incapacidade de interromper a dosagem diária se efeitos colaterais indesejados ocorrerem (European Medicines Agency 2008).
2.6.2 Cirúrgico
Os animais passaram por uma série de procedimentos para tratamento de problemas articulares, com a administração de analgesia (fentanil transdérmico no pré e intraoperatório e tramadol no pós-operatório), antibióticos (cefazolina) e anestesia geral (propofol e isoflurano). A cirurgia envolveu uma abordagem craniolateral da articulação do quadril, com ruptura do ligamento da cabeça do fêmur e deslocamento da articulação. A cartilagem e ligamentos remanescentes foram desbridados utilizando ferramentas específicas. A capsulorrafia foi realizada para reforçar a articulação, utilizando âncoras ósseas e suturas transósseas.
2.7 Pós-operatório
No pós-operatório, os animais foram mantidos com analgesia e em repouso absoluto na gaiola por três semanas. A partir da quarta semana, foi permitido exercício leve (10 minutos/dia) com coleira e restrição de saltos, com os animais ainda confinados em canis com altura limitada. Radiografias periódicas foram realizadas para avaliar a evolução da cirurgia, monitorando a congruência articular e a frouxidão articular, além de outras avaliações para detectar sinais de osteoartrite. O quadril contralateral foi mantido como controle, e medidas de goniometria e circunferência das coxas foram feitas para acompanhar a recuperação.
2.8 Acompanhamento
Para o LOAD, os métodos baseados em âncoras forneceram uma estimativa de MCID (diferença mínima clinicamente importante) na faixa de -2,5 a -9,1, e os métodos baseados em distribuição variaram de 1,6 a 4,2. Para o COI, os métodos baseados em âncoras forneceram uma estimativa de MCID na faixa de -4,5 a -16,6, enquanto os métodos baseados em distribuição variaram de 2,3 a 2,4. Para as dimensões do COI, os valores variaram de -0,5 a -4,9 nos métodos baseados em âncoras e de 0,6 a 2,7 nos métodos baseados em distribuição. As curvas ROC (curvas características de operação do receptor) mostraram áreas sob a curva >0,7 para o COI, indicando um ponto de corte aceitável, e >0,8 para o LOAD, indicando um ponto de corte excelente.
3 METODOLOGIA
Material e método a ser utilizado será o Liverpool Osteoarthritis in Dogs (LOAD). Será feito o questionário LOAD por 3 períodos, tais como: pré-tratamento (paliativo ou cirúrgico), pós-tratamento (30, 60 e 90 dias) e pós recuperação total (120 dias). O Questionário Liverpool Osteoarthritis in Dogs (LOAD) é uma ferramenta objetiva composta por 13 itens, projetada para avaliar problemas articulares em cães. O LOAD é preenchido pelos tutores dos animais, que fornecem informações valiosas baseadas em suas observações. Este questionário utiliza uma escala de pontuação de 0 a 4, na qual 0 representa um estado saudável e 4 indica uma condição de OA grave. A pontuação global resultante auxilia na identificação e avaliação da presença e gravidade da OA. Veterinários podem aplicar o LOAD como uma ferramenta de diagnóstico, acompanhamento e tratamento da OA em cães. Ele pode ser preenchido antes da consulta, durante a visita ou eletronicamente. Os animais que serão incluídos na pesquisa: 5kg a 20 kg, 1 ano até 5 anos de idade, sem predilecao de raça. Logo em seguida será submetido a consulta com o veterinário ortopedista, que serão realizados exames como: Exame físico, avaliação da marcha, dor e reflexo. E caso seja necessário, será feito exames de imagem, como: Raio-X, Ressonância Magnética ou Tomografia.
4 RESULTADOS E DISCUSSÃO
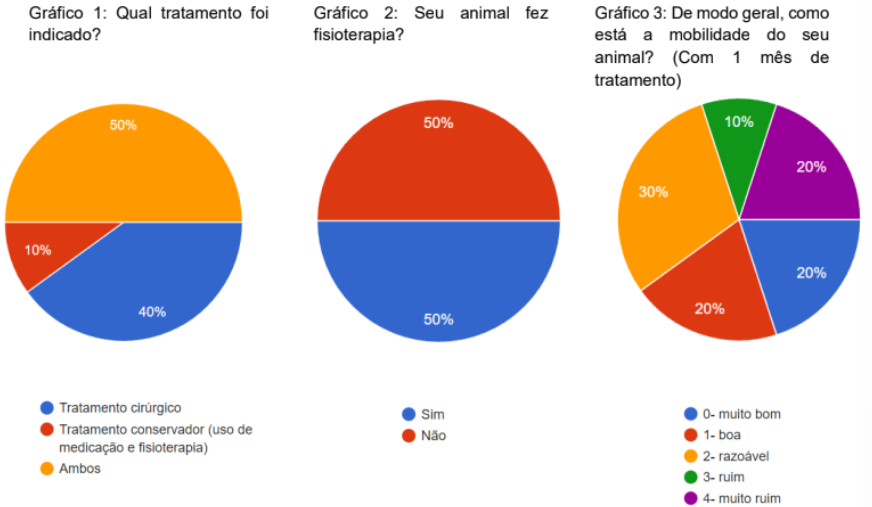
Foram avaliados 10 animais, de raças distintas, de idades superior a 1 ano, sendo 7 fêmeas e 3 machos. 60% dos animais tiveram o membro pélvico direito afetado e 40% tiveram o membro pélvico esquerdo afetado. Foi questionado o tipo de tratamento estipulado, existindo 3 tipos, como: tratamento cirúrgico, tratamento conservador que é a fisioterapia e o medicamento estipulado e o ambos os tratamentos.
Onde 50% fizeram o tratamento ambos os tratamentos, 40% fizeram o tratamento cirúrgico e 10% fizeram o tratamento conservador (Gráfico 1). Foi questionado se o animal fez fisioterapia e 50% dos animais fizeram e 50% não fizeram a fisioterapia (gráfico 2).
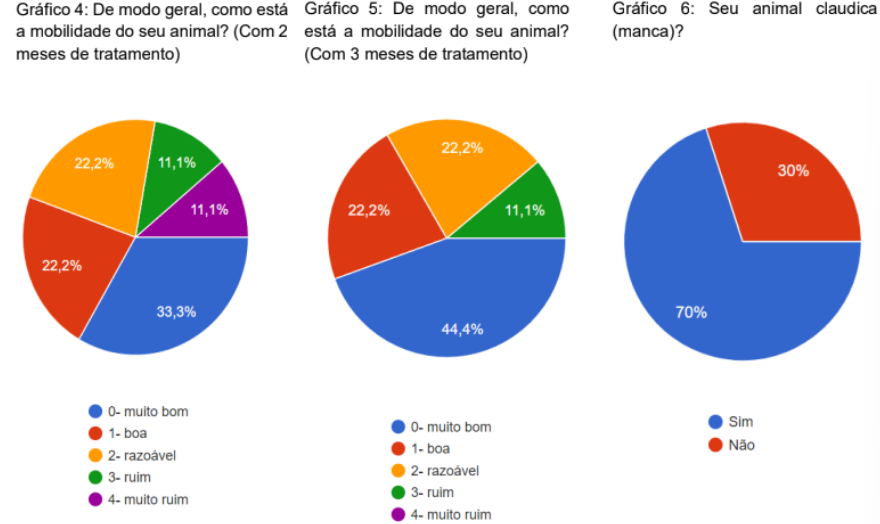
Quase todos os animais apresentavam algum tipo de comorbidades. Foi feita uma série de perguntas para avaliar os 3 primeiros meses após o tratamento, perguntas como: de modo geral como está a mobilidade do seu cão com 1, 2 e 3 meses de tratamento, com 1 mês 30% responderam que o animal estava com a mobilidade razoável, 20% muito bom, 20% bom, 20% ruim e 10% muito ruim (gráfico 3). Com 2 meses de tratamento 33,3% responderam que estava muito bom, 22,2% boa, 22,2% razoável, 11,1% ruim e 11,1% muito ruim (gráfico 4). com 3 meses de tratamento 44,4% muito bom, 22,2% boa, 22,2% razoável e 11,1% em ruim (gráfico 5).
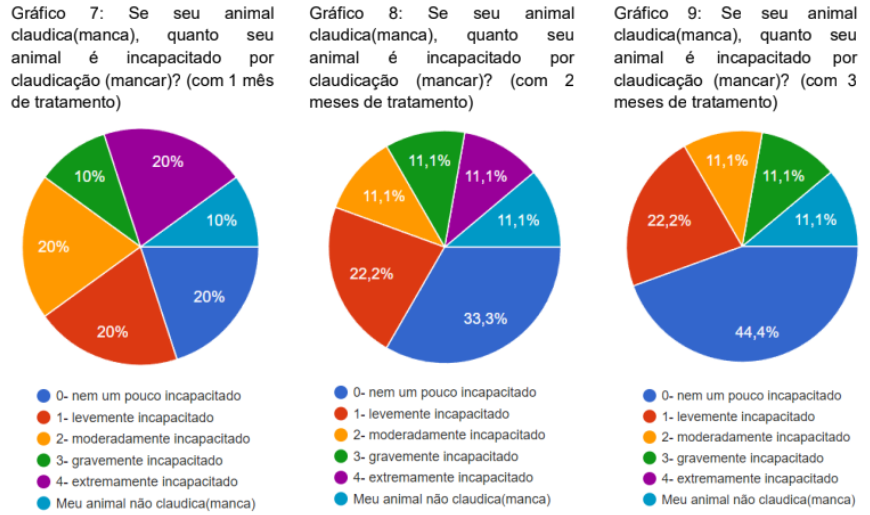
Foi questionado se o animal claudicava antes do tratamento,70% falaram que sim e 30% que não (gráfico 6). Foi perguntado o grau de incapacitação devido a claudicação do animal (se caso o animal claudicava) com 1, 2 e 3 meses de tratamento. No primeiro mês tivemos que 20% não ficaram nem um pouco incapacitados, 20% levemente incapacitados, 20% modernamente incapacitados, 20% extremamente incapacitado, 10% gravemente incapacitados e 10% não claudicavam (gráfico 7).
No segundo mês 33,3% responderam que não ficaram nem um pouco incapacitado, 22,2% levemente incapacitado, 11,1% moderadamente incapacitado, 11,1% gravemente incapacitado, 11,1% extremamente incapacitado e 11,1% não claudicavam (gráfico 8). com 3 meses de tratamento, 44,4% nem um pouco incapacitado, 22,2% levemente incapacitado, 11,1% modernamente incapacitado, 11,1% gravemente incapacitado, 11,1% não claudicavam (gráfico 9).
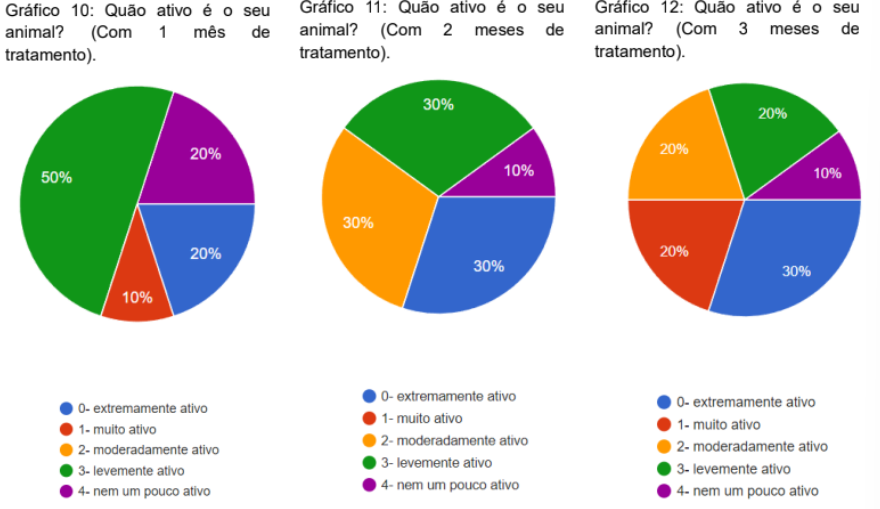
Foi questionado qual ativo era o animal, com 1,2 e 3 meses de tratamento. com 1 mês de tratamento, 50% marcaram como levemente ativo, 20% extremamente ativo, 20% nem um pouco ativo e 10% muito ativo (gráfico 10). no segundo mês, 30% extremamente ativo, 30% moderadamente ativo, 30% levemente ativo e 10% nem um pouco ativo (gráfico 11). no terceiro mês, 30% extremamente ativo, 20% muito ativo, 20% moderadamente ativo, 20% levemente ativo e 10% nem um pouco ativo (gráfico 12).
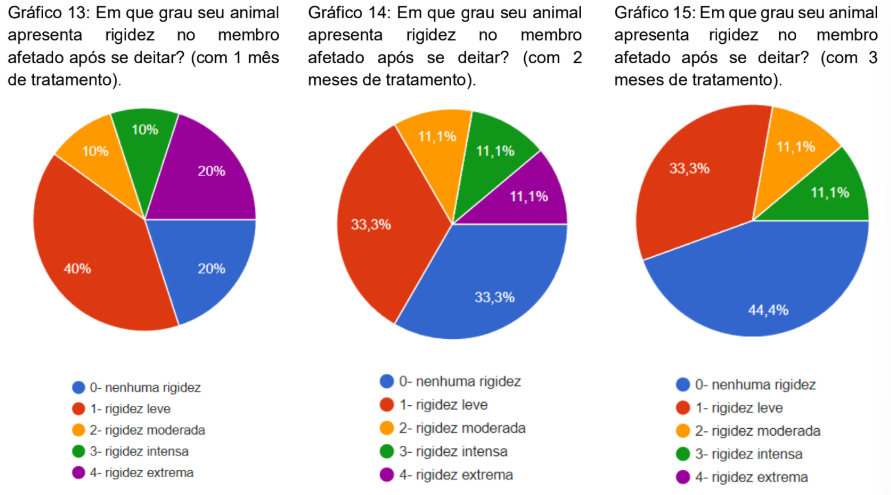
Foi questionado o grau de rigidez no membro afetado com 1, 2 e 3 meses após o tratamento. No primeiro mês, 40% marcaram rigidez leve, 20% nenhuma rigidez, 20% rigidez extrema, 10% rigidez moderada e 10% rigidez extrema (gráfico 13). No segundo mês 33,3% matracaram nenhuma rigidez, 33,3% rigidez leve, 11,1% rigidez moderada, 11,1% rigidez intensa e 11,1% rigidez extrema (gráfico 14). No terceiro mês 44,4% marcaram nenhuma rigidez, 33,3% rigidez leve, 11,1% rigidez moderada e 11,1% rigidez intensa (gráfico 15).
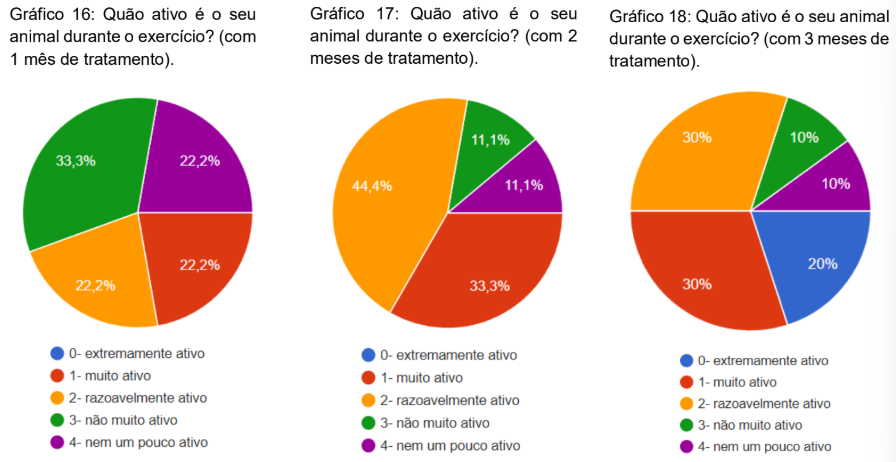
Foi questionado quão ativo é o seu animal durante o exercício com 1, 2 e 3 meses de tratamento. No primeiro mês 33,3% marcaram que não era muito ativo, 22,2% muito ativo, 22,2% razoavelmente ativo e 22,2% nem um pouco ativo (gráfico 16). No segundo mês, 44,4% marcaram como razoavelmente ativo, 33,3% muito ativo, 11,1% não muito ativo e 11,1% nem um pouco ativo (gráfico, gráfico 17). No terceiro mês, 30% marcaram muito ativo, 30% razoavelmente ativo, 20% extremamente ativo, 10% não muito ativo e 10% nem um pouco ativo (gráfico 18).
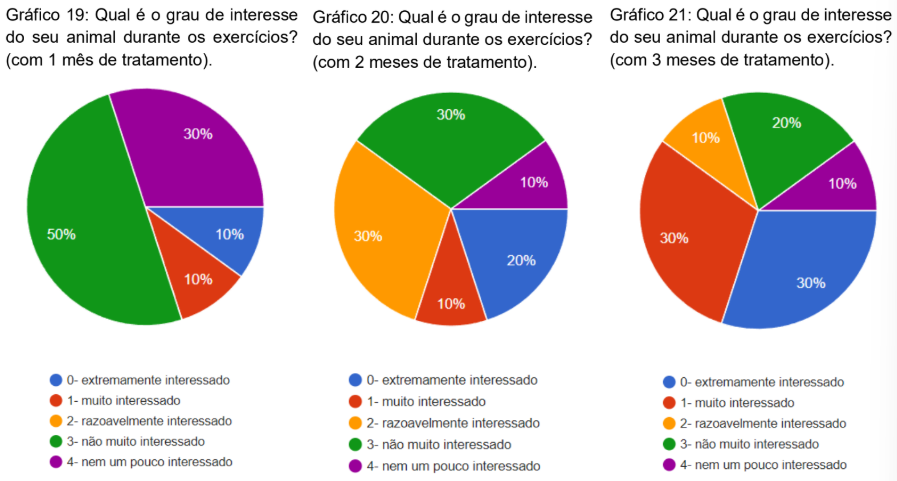
Foi questionado qual era o grau de interesse do animal durante os exercícios após 1, 2 e 3 meses de tratamento. Com 1 mês 50% dos animais marcaram não muito interessado, 30% não muito interessado, 10% extremamente interessado e 10% muito interessado (gráfico 19). No segundo mês, 30% razoavelmente interessado, 30% não muito interessado, 20% extremamente interessado, 10% muito interessado e 10% nem um pouco interessado (gráfico 20). No terceiro mês 30% extremamente interessado, 30% muito interessado, 20% não muito interessado, 10% razoavelmente interessado e 10% nem um pouco interessado (gráfico 21).
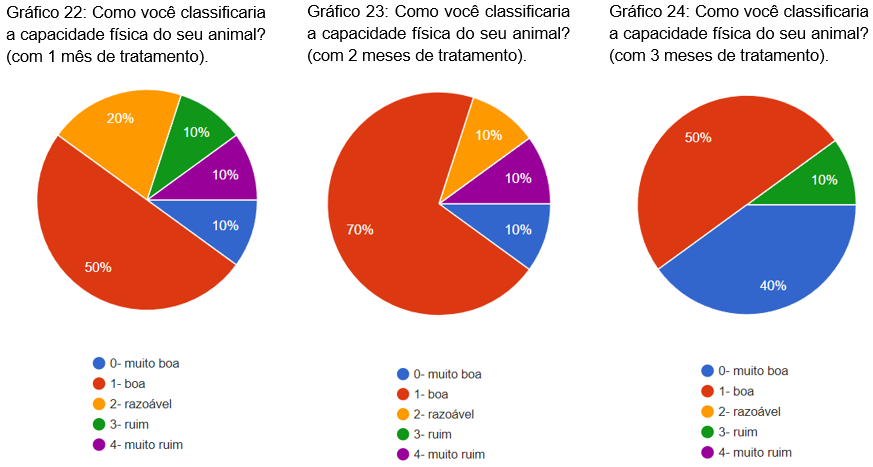
Foi questionado sobre a capacidade física do animal com 1, 2 e 3 meses de tratamento. Com 1 mês, 50% dos animais marcaram como boa, 20% como razoável, 10% como muito boa, 10% como ruim e 10% como muito ruim (gráfico 22). No segundo mês 70% como boa, 10% como muito boa, 10% como razoável e 10% como muito ruim (gráfico 23). No terceiro mês 50% como boa, 40% como muito boa e 10% como ruim (gráfico 24).
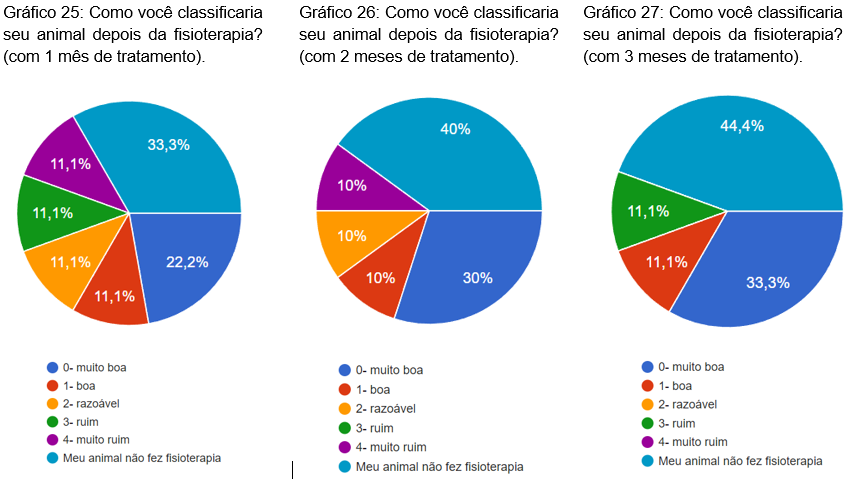
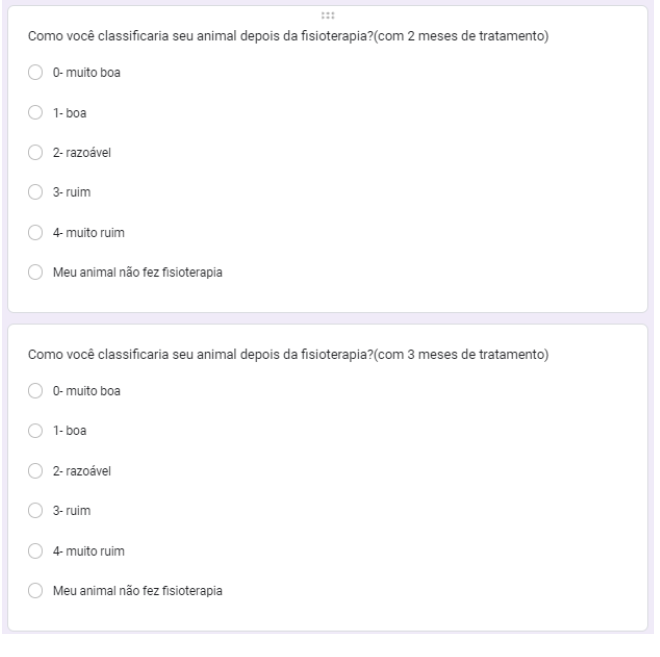
Foi perguntado como classificaria o animal com 1, 2 e 3 meses após feita a fisioterapia. Com um mês 33,3% marcaram que o animal não fez a fisioterapia, 22,2% como muito boa, 11,1% como boa, 11,1% como razoável, 11,1% como ruim e 11,1% como muito ruim (gráfico 25). No segundo mês, 40% marcaram que não fizeram a fisioterapia, 30% como muito boa, 10% como boa, 10% como razoável e 10% como muito ruim (gráfico 26). No terceiro mês, 44,4% marcaram que o animal não fez fisioterapia, 33,3% como muito boa, 11,1% como boa e 11,1% como ruim (gráfico 27).
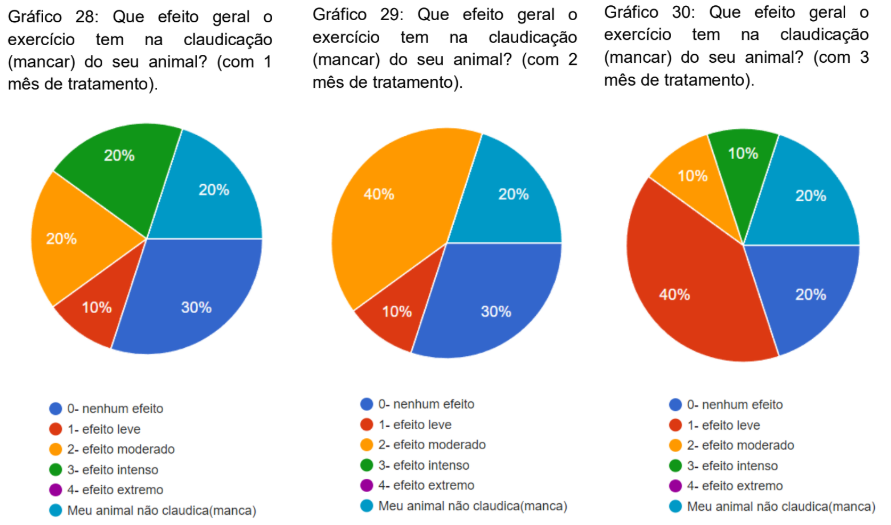
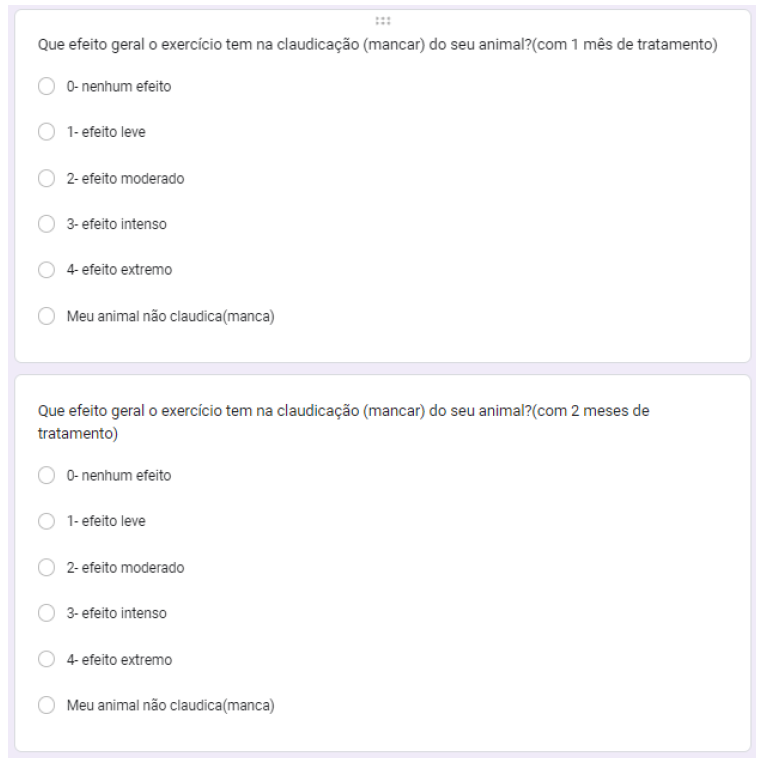
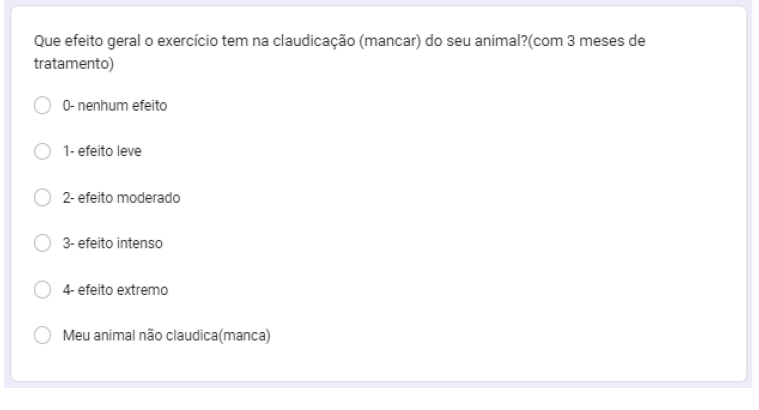
Foi questionado que efeito geral tem o exercício na claudicação do animal com 1, 2 e 3 meses de tratamento. No primeiro mês 20% dos animais não claudicavam, 30% nenhum efeito, 20% efeito moderado, 20% efeito intenso e 10% efeito leve (gráfico 28). No segundo mês 20% não claudicava, 30% nenhum efeito, 40% efeito moderado e 10% efeito leve (gráfico 29). no terceiro mês, 20% não claudicavam, 40% efeito leve, 20% nenhum efeito, 10% efeito razoável e 10% efeito intenso (gráfico 30).
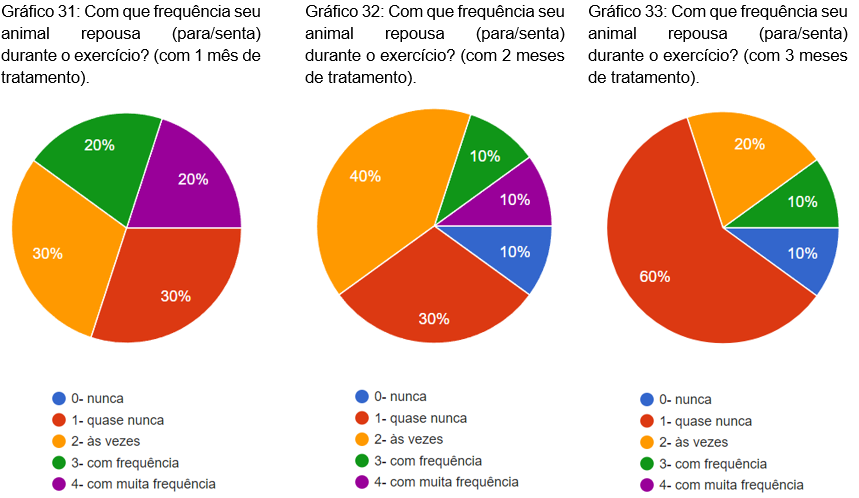
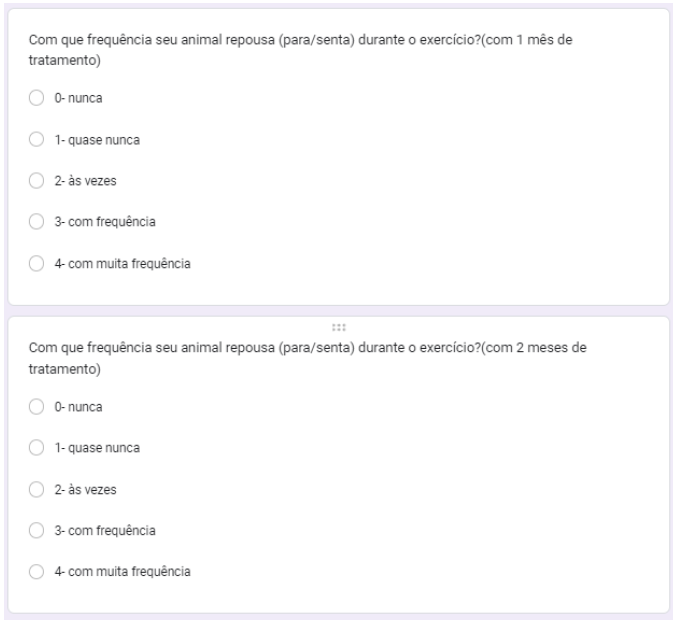
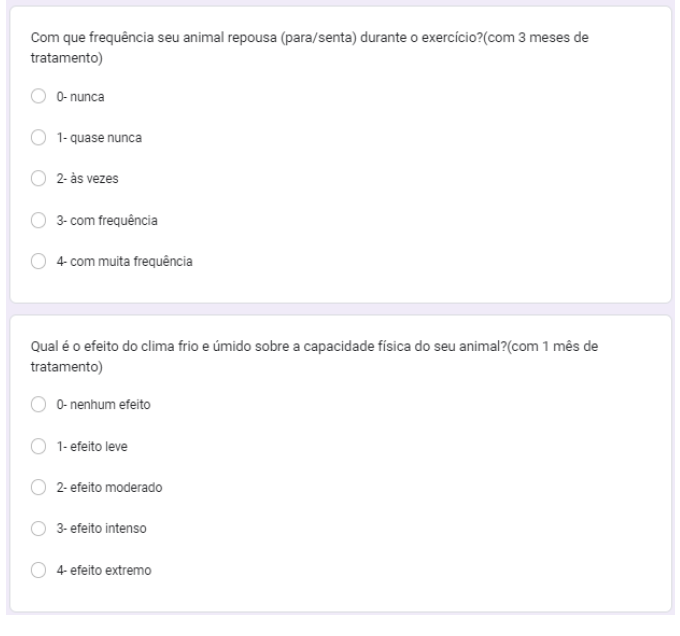
Foi questionado com que frequência o animal repousava durante o exercício, com 1, 2 e 3 meses de tratamento. No primeiro mês, 30% às vezes, 30% quase nunca, 20% com frequência, 20% com muita frequência (gráfico 31). No segundo mês, 40% às vezes, 30% quase nunca, 10% nunca,10% com frequência e 10% com muita frequência (gráfico 32). No terceiro mês, 60% quase nunca, 20% às vezes, 10% nunca é 10% com frequência (gráfico 33).
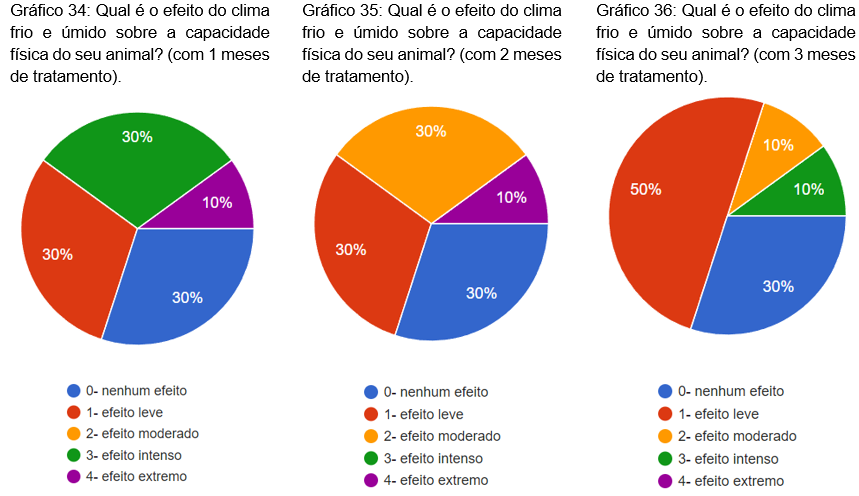
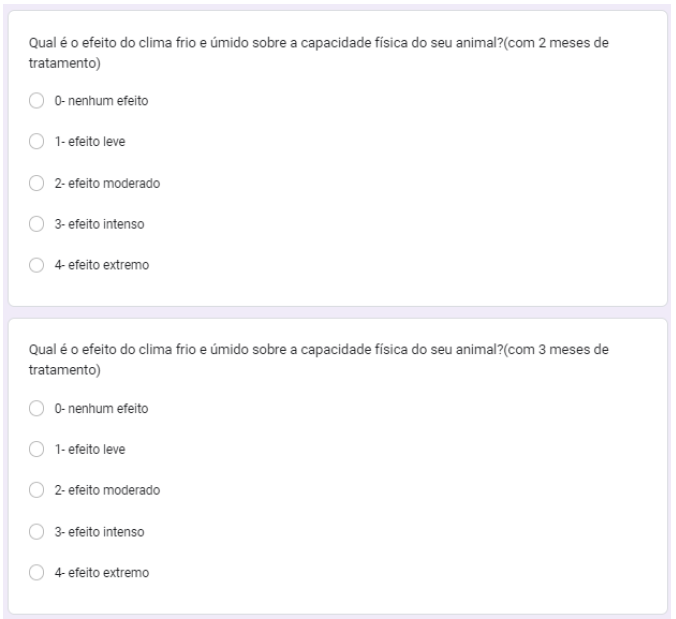
Foi questionado qual o efeito do clima frio e úmido sobre a capacidade física do animal, com 1, 2 e 3 meses de tratamento. Com um mês 30% nenhum efeito, 30% efeito leve, 30% efeito intenso e 10% efeito extremo (gráfico 34). No segundo mês 30% nenhum efeito, 30% efeito leve, 30% efeito razoável e 10% efeito extremo (gráfico 35). No terceiro mês, 50% efeito leve, 30% nenhum efeito, 10% efeito moderado e 10% efeito intenso (gráfico 36).
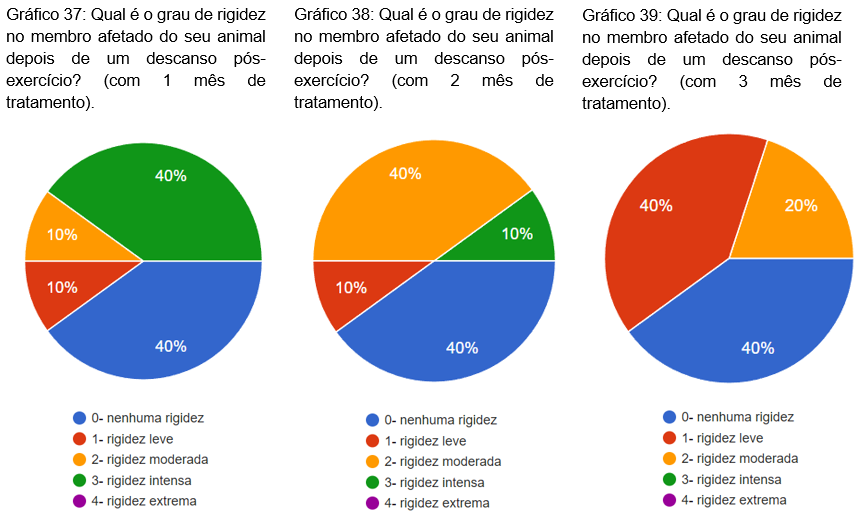
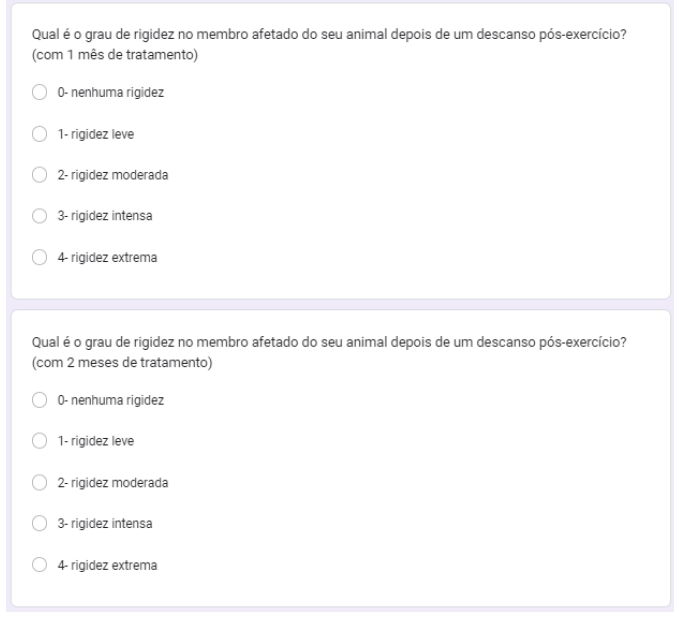
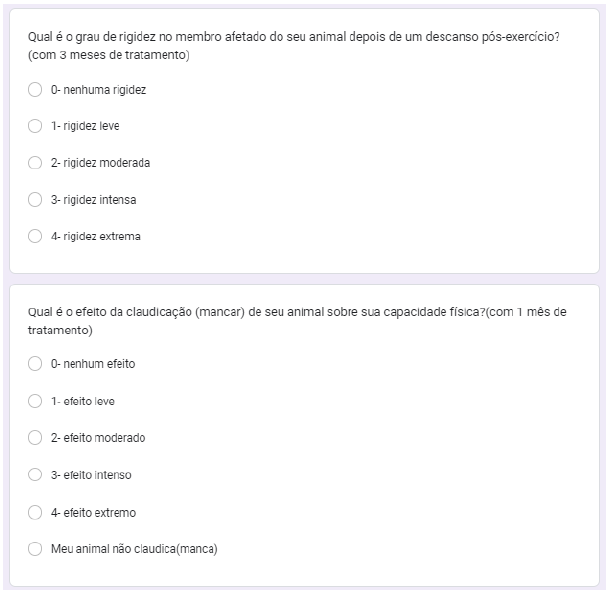
Foi questionado qual era o grau de rigidez do membro afetado do animal depois de um descanso pós-exercício com 1, 2 e 3 meses de tratamento. No primeiro mês 40% nenhuma rigidez, 40% rigidez intensa, 10% rigidez leve e 10% rigidez moderada (gráfico 37). No segundo mês, 40% nenhuma rigidez, 40% rigidez moderada, 10% rigidez leve e 10% rigidez intensa (gráfico 38). No terceiro mês 40% nenhuma rigidez, 10% rigidez leve e 20% rigidez moderada (gráfico 39).
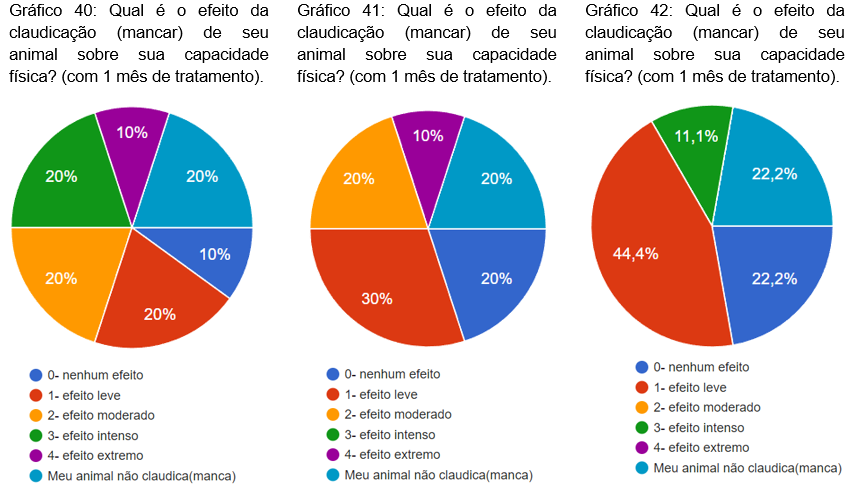
Foi questionado qual era o efeito da claudicação sobre sua capacidade física com 1, 2 e 3 meses de tratamento. No primeiro mês, 20% não claudicavam, 20% efeito moderado, 20% efeito leve, 20% efeito intenso, 10%. nenhum efeito é 10% efeito extremo (gráfico 40). Com dois meses, 30% efeito leve, 20% não claudicavam, 20% nenhum efeito, 20% efeito moderado e 10% efeito extremo (gráfico 41). No terceiro mês, 44,4% efeito leve, 22,2% nenhum efeito, 22,2% não claudicavam, 11,1% efeito intenso (gráfico 42).
5 CONCLUSÃO
A utilização do questionário Liverpool Osteoarthritis in Dogs (LOAD) demonstrou ser uma ferramenta eficaz para a avaliação e monitoramento da osteoartrite (OA) em cães. Este estudo evidenciou a importância de métodos objetivos e padronizados no acompanhamento de pacientes, considerando fatores como mobilidade, claudicação e grau de atividade. O uso do LOAD permitiu identificar melhorias progressivas na condição dos animais tratados, especialmente nos casos em que foi adotada uma abordagem combinada de tratamento conservador e cirúrgico. Além disso, observou-se uma redução significativa nos sinais clínicos de dor e incapacidade ao longo dos meses, reforçando a relevância da fisioterapia e do manejo multimodal no cuidado de pacientes com OA.
Esses resultados destacam a necessidade de um acompanhamento contínuo e individualizado, envolvendo tutores e veterinários, para otimizar o bem-estar dos animais e proporcionar melhores prognósticos. O LOAD, por sua simplicidade e eficiência, é uma ferramenta valiosa que pode ser amplamente aplicada na prática clínica, contribuindo para avanços no diagnóstico e tratamento da osteoartrite em cães.
6 REFERÊNCIAS BIBLIOGRÁFICAS
1. Anderson, K. L., O’Neill, D. G., Brodbelt, D. C., et al. (2018) Prevalence, duration and risk factors for appendicular osteoarthritis in a UK dog population under primary veterinary care. Scientific Reports 8, 5641
2. Brown, D. C., Boston, R. C. & Farrar, J. T. (2013b) Comparison of force plate gait analysis and owner assessment of pain using the canine brief pain inventory in dogs with osteoarthritis. Journal of Veterinary Internal Medicine 27, 22-30
3. Bakker, E. Broeckx, B. Demeyere, K. Stroobants, V. Van Ryssen, B. Meyer, E. (2021) Detection of osteoarthritis in dogs by metabolic, pro-inflammatory and degenerative synovial fluid biomarkers and traditional radiographic screening: A pilot study. Veterinary Immunology and Immunopathology, p. 2.
4. Cui, A., Li, H., Wang, D. , et al. (2020) Global, regional prevalence, incidence and risk factors of knee osteoarthritis in population-based studies. EClinicalMedicine 29-30, 100587
5. Knazovicky, D., Helgeson, E. S., Case, B., et al. (2016) Widespread somatosensory sensitivity in naturally occurring canine model of osteoarthritis. Pain 157, 1325-1332
6. Loeser, R. F., Goldring, S. R., Scanzello, C. R., et al. (2012) Osteoarthritis: a disease of the joint as an organ. Arthritis and Rheumatism 64, 1697-1707
7. Glyn-Jones, S., Palmer, A., Agricola, R., et al. (2015) Osteoarthritis. The Lancet 386, 376-387
8. MENDES, Iara Linhares et al. Denervação articular aberta em cadela. Ciência Animal, v. 30, n. 2, p. 123-129, 2020.
9. Alves SCR. Dor miofascial no cão com doença degenerativa articular [tese]. Évora: Universidade de Évora; 2022. 95 p
10. Anderson, L. K.; Zulch, H.; O’Neill, G. D.; Meeson, L. R.; Collins, M. L. (2020) Risk Factors for Canine Osteoarthritis and Its Predisposing Arthropathies: A Systematic Review. Frontiers in Veterinary Science, v. 7, p. 1-2.
11. Fischer, C.; Cuddy, C. L.; McNally, T. (2020) Spontaneous septic arthritis in juvenile dogs. Veterinary Ireland Journal, v. 10, n. 8, p. 428.
12. Pietschmann, P.; Butylina, M.; Kerschan-Schindl, K.; Sipos, W. (2022) Mechanisms of Systemic Osteoporosis in Rheumatoid Arthritis. International Journal of Molecular Sciences, p. 1.
13. Alves, J. C; Santos, A.; Jorge, P.; Lavrador, C.; Miguel Carreira, L. (2020) Clinical and diagnostic imaging findings in police working dogs referred for hip osteoarthritis. BMC Veterinary Research, p. 2.
14. DUMITRIU, A. (2023) Aspects of the innervation mode of the adjacent anatomical formations of the coxofemoral joint in dogs. ВЕТЕРИНАРНА БІОТЕХНОЛОГІЯ, v. 42, p. 118-119.
15. YURTAL, Z.; ALTUG, M. E.; ALAKUŞ, I. (2022) Cranial cruciate ligament rupture in dogs: A technique of advacement tuberositas tibia. New developments in veterinary medicine. C. 6, p. 64.
16. Martel-Pelletier J, Barr AJ, Cicuttini FM, Conaghan PG, Cooper C, Goldring MB, et al. osteoarthritis. Nat Rev DiS Prim. (2016) 13:16072. doi: 10.1038/nrdp.2016.72
17. Pettitt RA, German AJ. Investigation and management of canine osteoarthritis. Practice. (2015) 37:1–8. doi: 10.1136/inp.h5763
18. Smith GK, Mayhew PD, Kapatkin AS, McKelvie PJ, Shofer FS, Gregor TP. Evaluation of risk-factors for degenerative joint disease associated with hip-dysplasia in German Shepherd dogs, Golden Retrievers, labrador retrievers and Rottweilers. J Am Vet Med Assoc. (2001) 21U:171U–24. doi: 10.2460/javma.2001.21U.171U
19. Taylor-Brown FE, Meeson RL, Brodbelt DC, Church DB, McGreevy PD, Thomson PC, et al. Epidemiology Of cranial cruciate ligament disease diagnosis in dogs attending primary- care veterinary practiceS in England. Vet Surg. (2015) 44:777–83. doi: 10.1111/vSu.1234U
20. Meeson RL, Todhunter RJ, Blunn G, Nuki G, PitsillideS AA. Spontaneous dog osteoarthritis – a One medicine vision. Nat Rev Rheumatol. (201U) 15:273–87. doi: 10.1038/ S41584-01U-0202-1
21. Bergh MS, Budsberg SC: The coxib NSAIDS: potential clinical and pharmacologic importance in veterinary medicine. J Vet Intern Med 1U:633, 2005.
22. Bubenik LJ, Smith MM: Orthopedic infections. p. 1862. In Slatter DH (ed): Textbook Of Small Animal Surgery. 3rd Ed. WB Saunders, Philadelphia, 2003
23. Dassler C, Vasseur PB: Elbow luxation. p. 1U1U. In Slatter DH (ed): Textbook Of Small Animal Surgery. 3rd Ed. WB Saunders, Philadelphia,.2003
24. 8- Fritz CL, Kjemtrup AM: Lyme borreliosis. J Am Vet Med Assoc 223:1261.2003
25. 12- Meyer-Lindenberg A, Langhann A, Fehr M et al: Arthrotomy versus arthroscopy in the treatment Of the fragmented medial coronoid process of the ulna (FCP) in 421 dogs. Vet Comp Orthop Traumatol 4:204,.2003
26. preSSure walkway SyStem fOr meaSurement Of vertical limb fOrceS in clinically nOrmal dOgS. Am J Vet ReS. 2006; 67:277–82. dOi: httpS://dOi.Org/10.2460/ajvr.67.2.277.
27. Seibert R, Marcellin-Little DJ, ROe SC, DePuy V, LaScelleS BDX. COmpariSOn Of BOdy Weight DiStributiOn, Peak Vertical FOrce, and Vertical ImpulSe aS MeaSureS Of Hip JOint Pain and Efficacy Of TOtal Hip Replacement. Vet Surg. 2012; 41:443–7. dOi:httpS://dOi.Org/10.1111/j.1532-U50X.2012.00U57.x.
28. ClOugh W, Canapp S, TabOada L, DycuS D, LeaSure C. SenSitivity and Specificity Of a Weight DiStributiOn PlatfOrm fOr the DetectiOn Of Objective LameneSS and OrthOpaedic DiSeaSe. Vet COmp OrthOp TraumatOl. 2018;31: 3U1–5. dOi:httpS://dOi.Org/10.1055/S-0038-1667063.
29. ClOugh W, Canapp S. ASSeSSing Clinical Relevance Of Weight DiStributiOn aS MeaSured On a Stance Analyzer thrOugh COmpariSOn with LameneSS Determined On a PreSSure SenSitive Walkway and Clinical DiagnOSiS. Vet COmp OrthOp TraumatOl. 2018;31 S 02:A1–25. dOi:httpS:// dOi.Org/10.1055/S- 0038-1668246.
30. LOtSikaS P, LOtSikaS F, Dyce DH, Ridge J. P. DiSOrderS Of the Pelvic Limb: DiagnOSiS and
31. Treatment. In: Zink C, J. van D, editOrS. Canine SpOrtS Medicine and RehabilitatiOn. 2nd editiOn. Wiley Blackwell; 2016. p. 353–88.
32. KealyRD,LawlerDF,BallamJM,etal.Five-yearlOngitudinal Study On limited fOOd cOnSumptiOn and develOpment Of OSteOarthritiS in cOxOfemOral jOintS Of dOgS. J Am Vet Med ASSOc 1UU7; 210:222– 225.
33. LuSt G, RendanO VT, SummerS BA. Canine hip dySplaSia: cOnceptS and diagnOSiS. J Am Vet Med ASSOc 1U85; 187:638–640.
34. Smith GK, POpOvitch CA, GregOr TP, et al. EvaluatiOn Of riSk factOrS fOr degenerative jOint diSeaSe aSSOciated with hip dySpla- Sia in dOgS. J Am Vet Med ASSOc 1UU5; 206:642–647.
35. BudSberg SC, JOhnStOn SA, Schwarz PD, et al. Efficacy Of etOdOlac fOr the treatment Of OSteOarthritiS Of the hip jOintS in dOgS. J Am Vet Med ASSOc 1UUU; 214:206–210.
36. TanO CA, COckShutt JR, DObSOn H, et al. FOrce plate analy- SiS Of dOgS with bilateral hip dySplaSia treated with a unilateral triple pelvic OSteOtOmy: a lOng term review Of caSeS. Vet COmp OrthOp TraumatOl 1UU8; 11:85–U3.
37. OlmSteadML.ThecaninecementedmOdulartOtalhipprOS- theSiS. J Am Anim HOSp ASSOc 1UU5; 31:10U–124.
38. Planté J, DupuiS J, Beauregard G, et al. LOng-term reSultS Of cOnServative treatment, exciSiOn arthOplaSty and triple pelvic OSteOtOmy fOr the treatment Of hip dySplaSia in the immature dOg. Part 2: analySiS Of grOund reactiOn fOrceS. Vet COmp OrthOp TraumatOl 1UU7; 10:130–135.
39. CachOn, T., Frykman, O., LaScelleS, B.D.X., Okumura, M., SOuSa, P., Staffieri, F., Steagall, P.V., Van RySSen, B., 2018. Face validity Of a prOpOSed tOOl fOr Staging canine OSteOarthritiS: Canine OSteOArthritiS Staging TOOl (COAST). Vet. J.
40. Lascelles BDX, Brown DC, Maixner W, Mogil JS. Spontaneous painful disease in companion animals can facilitate the development of chronic pain therapies for humans. Osteoarthr Cartil. 2018; 26:175–83.
41. Walton MB, Cowderoy E, Lascelles D, Innes JF. Evaluation of Construct and
42. Criterion Validity for the ‘Liverpool Osteoarthritis in Dogs’ (LOAD) Clinical Metrology Instrument and Comparison to Two Other Instruments. PLoS One. 2013;8:e58125.
43. Walton B, Cox T, Innes J. ‘How do I know my animal got better?’ – measuring outcomes in small animal orthopaedics. In Pract. 2018; 40:42–50.
44. Upchurch DA, Renberg WC, Roush JK, Milliken GA, Weiss ML. Effects of administration of adipose-derived stromal vascular fraction and platelet-rich plasma to dogs with osteoarthritis of the hip joints. Am J Vet Res. 2016;77: U40–51.
45. Brown DC. The Canine Orthopedic Index. Step 2: Psychometric Testing. Vet Surg. 2014; 43:241– 6.
46. Jones, Gareth MC, Andrew A. Pitsillides, and Richard L. Meeson. “Moving beyond the limits of detection: the past, the present, and the future of diagnostic imaging in canine osteoarthritis.” Frontiers in Veterinary Science 9 (2022): 789898.
47. Owens JM, Ackerman N, Nyland T. Roentgenology of joint trauma. Vet Clin North Am–Small Anim Pract. (1978) 8:419 51. doi: 10.1016/S0091-0279(78)50053-1
48. Innes JF, Costello M, Barr FJ, Rudorf H, Barr ARS. Radiographic progression of osteoarthritis of the canine stifle joint: a prospective study. Vet Radiol Ultrasound. (2004) 45:143–8. doi: 10.1111/j.1740-8261.2004. 04024.x
49. Suter PF, Carb A V. Shoulder arthrography in dogs-radiographic anatomy and clinical application. J Small Anim Pract. (1969) 10:407 13. doi: 10.1111/j.1748-5827. 1969.tb04050.x
50. van Vynckt D, Verhoeven G, Samoy Y, Polis I, van Bree H, van Ryssen B. Anaesthetic arthrography of the shoulder joint in dogs. Vet Comp Orthop Traumatol. (2013) 26:291–7. doi: 10.3415/VCOT-12-03-0041
51. Sakellariou G, Conaghan PG, Zhang W, Bijlsma JWJ, Boyesen P, D’Agostino MA, et al. EULAR recommendations for the use of imaging in the clinical management of peripheral joint osteoarthritis. Ann Rheum Dis. (2017) 76:1484–94. doi: 10.1136/annrheumdis-2016-210815
52. Morgan JP. Radiological pathology and diagnosis of degenerative joint disease in the stifle joint of the dog. J Small Anim Pract. (1969) 10:541 4. doi: 10.1111/j.1748-5827. 1969.tb04073.x
53. RHEE, Beomseok et al. Establishment of an image evaluation grading criteria for experimental stifle joint osteoarthritis in dogs: an X-ray and CT imaging study. Laboratory Animal Research, v. 39, n. 1, p. 34, 2023.
54. Spinella G, Arcamone G, Valentini S. Cranial Cruciate Ligament Rupture in Dogs: Review on Biomechanics, Etiopathogenetic Factors and Rehabilitation. Vet Sci. 2021 Sep 6;8(9):186. doi: 10.3390/vetsci8090186. PMID: 34564580; PMCID: PMC8472898.
55. Johnson, J.A.; Austin, C.; Breur, G.J. Incidence of canine appendicular musculoskeletal disorders in 16 veterinary teaching hospitals from 1980 through 1989. Vet. Comp. Orthop. Traumatol. 1994, 7, 56–69. [CrossRef]
56. Necas, A.; Zatloukal, J.; Kecová, H.; Dvoˇrák, M. Predisposition of dog breeds to rupture of the cranial cruciate ligament. Acta Vet. Brno 2000, 69, 305–310. [CrossRef]
57. Vasseur, P.B. Stifle Joint. In Textbook of Small Animal Surgery, 3rd ed.; Slatter, D., Ed.; Elsevier Science Saunders: Philadelphia, PA, USA, 2003; Volume 2, pp. 2090–2116.
58. Taylor-Brown, F.E.; Meeson, R.L.; Brodbelt, D.C.; Church, D.B.; McGreevy, P.D.; Thomson, P.C.; O’Neill, D.G. Epidemiology of cranial cruciate ligament disease, diagnosis in dogs attending primary-care veterinary practices in England. Vet. Surg. 2015, 44, 777–783. [CrossRef]
59. De Camp,C.E.; Johnston, S.A.; Déjardin, L.M.; Schaefer, S.L. (Eds.) The stifle joint. In Brinker, Piermattei & Flo’s Handbook of Small Animal Orthopaedics and Fracture Repair, 5th ed.; Elsevier: St. Louis, MO, USA, 2016; pp. 616–643.
60. Kaeding, C.C.; Léger-St-Jean, B.; Magnussen, R.A. Epidemiology and diagnosis of anterior cruciate ligament injuries. Clin. Sports Med. 2016, 36, 1–8. [CrossRef] [PubMed]
61. Sanders, T.L.; Kremers, H.M.; Bryan, A.J.; Larson, D.R.; Dahm, D.L.; Levy, B.A.; Michael, J.S.; Aaron, J.K. Incidence of anterior cruciate ligament tears and reconstruction. A 21 year population based study. Am. J. Sports Med. 2016, 44, 1502–1507. [CrossRef] [PubMed]
62. Pfeifer, C.E.; Beattie, P.F.; Sacko, R.S.; Hand, A. Risk factor associated with non-contact anterior cruciate ligament injury: A systematic review. Int. J. Sports Phys. Ther. 2018, 13, 575–587. [CrossRef]
63. Witsberger, T.H.; Villamil, J.A.; Schultz, L.G.; Hahn, A.W.; Cook, J.L. Prevalence of and risk factors for hip dysplasia and cranial cruciate ligament deficiency in dogs. J. Am. Vet. Med. Assoc. 2008, 232, 1818–1824. [CrossRef]
64. Mall, N.A.; Chalmers, P.N.; Moric, M.; Tanaka, M.J.; Cole, B.J.; Bach, B.R.; Paletta, G.A. Incidence and trends of anterior cruciate ligament reconstruction in the United States. Am. J. Sports Med. 2014, 42, 2363–2370. [CrossRef]
65. Wilke, V.L.; Robinson, D.A.; Evans, R.B.; Rothschild, M.F.; Conzemius, M.G. Estimate of the annual economic impact of treatment of cranial cruciate ligament injury in dogs in the United States. J. Am. Vet. Med. Assoc. 2005, 227, 1604–1607. [CrossRef]
66. Mather, R.C.; Koenig, L.; Kocher, M.S.; Dall, T.M.; Gallo, P.; Scott, J.D.; Bach, B.R.; Spindler, K.P.; Moon Knee Group. Societal and economic impact of anterior cruciate ligament tears. J. Bone Joint Surg. Am. 2013, 95, 1751–1759. [CrossRef]
67. Toth, S.A.; Siegel, M.I. Canine cruciate ligament ruptures: Implications for financial costs and human health. Anat. Rec. 2021, 304, 222–230. [CrossRef]
68. Heidorn, S.N.; Canapp, S.O.; Zink, C.; Leasure, C.S.; Jean Carr, B. Rate of return to agility competition for dogs with cranial cruciate ligament tears treated with tibial plateau leveling osteotomy. J. Am. Vet. Med. Assoc. 2018, 253, 1439–1444. [CrossRef]
69. Hornof WJ, Wind AP, Wallack ST, Schulz KS. Canine elbow dysplasia. The early radiographic detection of fragmentation of the coronoid process Vet Clin North Am Small Anim Pract. 2000; 30(2): 257-266.
70. Alves-Pimenta S, Ginja MM, Colaço B. Role of Elbow Incongruity in Canine Elbow Dysplasia: Advances in Diagnostics and Biomechanics. Vet Comp Orthop Traumatol. 2019; 32(2): 87-96. https://doi.org/10.1055/s-0038-1677513
71. Anderson KL, O’Neill DG, Brodbelt DC, et al. Prevalence, duration and risk factors for appendicular osteoarthritis in a UK dog population under primary veterinary care. Sci Rep. 2018; 8(1): 5641. https://doi.org/10.1038/s41598-018-23940-z
72. Wu CL, Harasymowicz NS, Klimak MA, Collins KH, Guilak F. The role of macrophages in osteoarthritis and cartilage repair. Osteoarthritis Cartilage. 2020; 28(5): 544-554. https://doi.org/10.1016/j.joca.2019.12.007
73. Frye CW, Shmalberg JW, Wakshlag JJ. Obesity, Exercise and Orthopedic Disease. Vet Clin North Am Small Anim Pract. 2016; 46(5): 831-841. https://doi.org/10.1016/j.cvsm.2016.04.00
74. Dempsey LM, Maddox TW, Comerford EJ, Pettitt RA, Tomlinson AW. A Comparison of Owner-Assessed Long-Term Outcome of Arthroscopic Intervention versus Conservative Managemento f Dogs with Medial Coronoid Process Disease. Vet Comp Orthop Traumatol 2019; 32(1): 1-9. https://doi.org/10.1055/s-0038-1676293
75. De Sousa RJ, Parsons KJ, Owen MR, et al. Radiographic, Surgeon and Owner Assessment of the BioMedtrix TATE (®) Elbow Arthroplasty. Vet Surg. 2016; 45(6): 726-735. https://doi.org/10.1111/vsu.12508. Epub 2016 Jul 6
76. ascelles BD, McFarland JM, Swann H. Guidelines for safe and effective use of NSAIDs in dogs. Vet Ther. 2005; 6(3): 237-251.
77. McAlindon TE, LaValley MP, Harvey WF, et al. Effect of Intra-articular Triamcinolone vs Saline on Knee Cartilage Volume and Pain in Patients With Knee Osteoarthritis: A Randomized Clinical Trial. JAMA 2017; 317(19): 1967-1975. https://doi.org/10.1001/jama.2017.5283 79 PMCID:
78. Vandeweerd JM, Zhao Y, Nisolle JF, et al. Effect of corticosteroids on articular cartilage: have animal studies said everything? Fundam Clin Pharmacol. 2015; 29(5): 427-438. https://doi.org/10.1111/fcp.12137. Epub 2015 Aug 19
79. Vandeweerd JM, Coisnon C, Clegg P, et al. Systematic review of efficacy of nutraceuticals to alleviate clinical signs of osteoarthritis J Vet Intern Med. 2012; 26(3): 448-456. https://doi.org/10.1111/j.1939-1676.2012.00901.x. Epub 2012 Mar 9
80. Fries C.L., Remedios A.M. The pathogenesis and diagnosis of canine hip dysplasia: A review. Can. Vet. J. 1995; 36:494–502. [ PMC free article] [ PubMed] [ Google Scholar][
7 ANEXOS


1, 2, 3Medicina Veterinária
