REGISTRO DOI: 10.5281/zenodo.11316422
João Matheus Pereira Falcão Nunes1; Bruno Miranda Dos Santos Oliveira2; Fernanda Paloma Duarte Trierweiler3; Letícia Santana De Jesus3; Brunna Pamella Dos Anjos Nascimento3; Rafael De Carvalho Sacramento3; Gabriel Victor Cerqueira Dos Santos3; Samuel Everson Alves Moraes3; Reinaldo Oliveira Matos Junior4
RESUMO:
A pele é o maior órgão do corpo humano em termos de área superficial e peso, composta pelas camadas epiderme, derme e hipoderme. Este tecido cutâneo desempenha diversas funções vitais, como proteção das estruturas internas do corpo, defesa imunológica, regulação da temperatura corporal, sensibilidade tátil, proteção contra os raios ultravioleta (UV) e barreira contra a entrada de microrganismos. Entre as diversas condições que afetam a pele, o vitiligo é uma leucopatia adquirida que impacta significativamente um número considerável de pessoas, reduzindo a qualidade de vida dos afetados. Portanto, o objetivo deste trabalho é apresentar os possíveis mecanismos de tratamento com Propionato de Clobetasol, um composto químico que vem sendo considerado como um potente imunomodulador sistêmico. Para abordar essa temática, realizamos uma pesquisa bibliográfica em diversas bases de dados sobre o tema em questão, buscando compreender as variáveis envolvidas na patologia. Foi constatado que o vitiligo apresenta uma fisiopatologia complexa, sendo sugerido que seja causado pela destruição dos melanócitos na camada basal da pele.
PALAVRAS-CHAVE: Vitiligo; propionato de clobetasol; mecanismos.
ABSTRACT:
The skin is the largest organ of the human body in terms of surface area and weight, composed of the epidermis, dermis and hypodermis layers. This skin tissue performs several vital functions, such as protection of the body’s internal structures, immune defense, regulation of body temperature, tactile sensitivity, protection against ultraviolet rays and barrier against the entry of microorganisms. Among the various conditions that affect the skin, vitiligo is an acquired leukopathy that significantly impacts a considerable number of people, reducing the quality of life of those affected. Therefore, the aim of this work is to present the possible pathophysiology of the disease and the mechanisms of treatment with Clobetasol Propionate, which has been shown to be a potent systemic immunomodulator. To address this issue, we carried out a literature search in various databases on the subject in question, seeking to understand the variables involved in this disease. It was found that vitiligo has a complex pathophysiology, and it is suggested that it is caused by the destruction of melanocytes in the basal layer of the skin. Diagnosis is achieved through the application of Wood’s light, the relevance of which is fundamental in highlighting the lesions, allowing a more precise assessment of the extent of the condition. In addition, laboratory tests and skin biopsy play a crucial role in the differential diagnosis with other diseases that present similar symptoms of hypochromia.
KEYWORDS: Vitiligo; Clobetasol Propionate; Mechanisms.
INTRODUÇÃO:
O vitiligo é uma doença cutânea crônica, adquirida e não contagiosa, característica de uma condição dermatológica que envolve a despigmentação da pele, sendo familiar e progressiva. Conforme Bergqvist et al., 2020 a doença é Caracterizada pela perda gradual de pigmentação, tanto na pele quanto nos cabelos, com ausência completa de melanócitos quando observada ao microscópio (BAPUR, 2016). Há duas categorias principais de vitiligo: o tipo generalizado, que é a forma comum e simétrica, e o tipo segmentar, que afeta apenas um lado do corpo. Com a interrupção da produção de melanina devido à morte dos melanócitos, a pele perde sua pigmentação natural, adquirindo uma tonalidade branca (PARVEEN et al., 2022).
A patologia pode causar uma transformação significativa no aspecto estético e visual, ocasionalmente, gerando desconforto ao paciente. Diversas pesquisas têm examinado a qualidade de vida de pessoas com vitiligo, constatando baixa autoestima e uma imagem corporal prejudicada, além da manifestação de distúrbios psiquiátricos relevantes, com taxas de até 25% em alguns estudos (LINTHORST et al., 2009). Diante disso, esta condição pode ter um impacto significativo na qualidade de vida do paciente, sendo considerada uma doença de pele de grande importância, não apenas relacionada às complicações clínicas mas também aos problemas sociais e psicológicos (YAGHOOBI et al., 2011). A incidência dessa condição afeta apenas cerca de 1% da população, sendo que entre 23% e 26% das crianças diagnosticadas têm menos de 12 anos de idade.
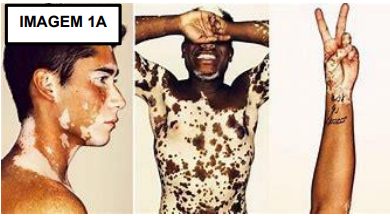
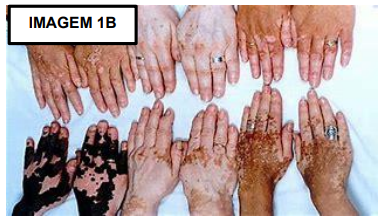
Inicialmente, o vitiligo se manifesta por manchas hipocrômicas que, posteriormente, tornam-se acrômicas e marfínicas, com limites bem definidos, frequentemente acompanhadas por bordas hiperpigmentadas. Essas manchas geralmente não causam coceira e têm uma tendência a se distribuir simetricamente, com preferência por áreas como tornozelos, pulsos, face, ântero lateral das pernas, dorso das mãos, dedos, axilas, pescoço e genitália. De acordo com Temel et al, 2024 no couro cabeludo, pode ocorrer poliose (perda da pigmentação dos cabelos). É incomum nas palmas das mãos e plantas dos pés, mas comumente encontrado nas regiões perioral e periorbital (Imagem 1A), podendo afetar até os olhos. Em cerca de 7% dos casos, a patologia pode estar associada à uveíte subclínica e, eventualmente, lesões na mácula. A incidência de vitiligo em pacientes com doenças oculares, como uveíte e irite, é significativamente maior do que na população em geral. Enquanto a perda de pigmentação pode passar despercebida em pessoas de pele clara, pode ser estigmatizante em indivíduos de pele mais escura (Imagem 1B) (HABIF, 2012).
Regiões do vitiligo comumente
Celebrando a Diversidade da Pele através das Mãos
De acordo com MARCHIORO (2022) a causa do vitiligo ainda não foi completamente esclarecida, porém há evidências de um componente genético envolvido, uma vez que entre 20% a 30% dos pacientes com vitiligo têm histórico familiar positivo para a doença. Atualmente, acredita-se que o vitiligo tenha uma origem autoimune, resultante de uma produção inadequada de anticorpos e linfócitos T direcionados contra os melanócitos. Além disso, em alguns casos, o vitiligo pode surgir após traumas ou queimaduras solares. Existem três teorias propostas para explicar a destruição dos melanócitos: imunológica, citotóxica e neural. É possível também que a doença tenha uma origem multifatorial.
Alguns estudos sugerem que a causa do vitiligo pode ter uma natureza poligênica, com a presença de dispositivos genéticos envolvidos. Em aproximadamente 30% dos casos, há uma história familiar positiva da doença. Essas descobertas foram corroboradas por pesquisas anteriores (CRAIGLOW, 2016).
No vitiligo, os melanócitos sofrem destruição por parte das células T específicas do antígeno, resultando em uma despigmentação irregular. Embora seja evidente que a imunidade adaptativa desempenha um papel significativo na progressão da doença, os fatores que iniciam esse processo ainda são em grande parte desconhecidos. De acordo com Chang et al, 2023 as vias de estresse celular estão desreguladas nos melanócitos de pacientes com vitiligo, sugerindo que defeitos intrínsecos nesses melanócitos contribuem para a patogênese da condição. Pesquisas recentes mostram que o estresse nos melanócitos desencadeia padrões moleculares associados a danos, os quais ativam a imunidade inata, estabelecendo assim uma ligação entre o estresse e a inflamação específica do órgão (ELASSIUTY YE et al., 2011) (Figura 2A). Estudos genéticos sobre o vitiligo comprovam a influência do estresse, da imunidade inata e dos mecanismos adaptativos, discutindo os avanços nesse campo e enfatizando como o estresse celular, os sinais de perigo endógeno e a ativação da imunidade inata contribuem para o desenvolvimento da doença (RICHMOND, 2013).
Uma análise estrutural revelou um retículo endoplasmático dilatado, indicando um aumento nos níveis de estresse celular (CAVALCANTE et al., 2015). Além disso, os níveis elevados de H2O2 e subprodutos de oxidação sugerem a presença de estresse oxidativo. Estudos de Vanderwalle et al 2017, também identificaram a presença de monobenzeno e outros fenóis comuns em produtos comerciais, como bolsas de couro e borracha, que têm a capacidade de provocar uma resposta exacerbada no vitiligo. Em doses elevadas, esses produtos químicos levaram à morte in vitro dos melanócitos (ALGADRI et al., 2022) . No entanto, em doses mais baixas, não houve morte celular, mas observou-se um aumento na quantidade de Espécies Reativas de Oxigênio (EROs), o que desencadeou uma resposta celular para combater esse acúmulo de agentes oxidativos, conhecida como Unfolded Protein Response (UPR). Isso, por sua vez, levou à autofagia celular, uma vez que a autofagia desempenha um papel importante na defesa celular contra o estresse oxidativo.
As proteínas HSP70 são induzidas em resposta ao estresse provocado pelo fenol nos melanócitos e na pele de pacientes com vitiligo (REICHARDT et al., 2021). Em modelos animais, a HSP70 é necessária para a indução do vitiligo, acelerando o progresso da doença e ativando células dendríticas na pele. Assim, as EROs e as HSPs geradas pelos melanócitos em resposta ao estresse atuam como DAMPs (Padrões Moleculares Associados a Danos) no vitiligo, ativando os PRRs para iniciar a inflamação (CAETANO et al., 2022) . Além disso, os DAMPs podem ser liberados para o meio extracelular durante a morte celular ou devido aos danos sofridos.
Conforme Frisoli et al (2020), observou-se também a alteração de várias citocinas próinflamatórias e anti-inflamatórias, como IL-6 e IL-8, sendo a IL-6 um antagonista das respostas T reguladoras e a IL-8 responsável pelo recrutamento de células do sistema imunológico para o local específico. Houve também um aumento na quantidade de IFN-γ, que em doses elevadas é responsável pela apoptose dos melanócitos, quando há uma diminuição da IL-10, um potente regulador anti-inflamatório e considerado um fator redutor na produção de citocinas.
Mecanismo da patogênese do vitiligo
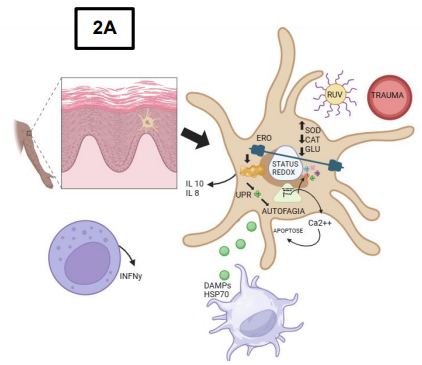
LEGENDA: A melanogênese e os polimorfismos genéticos associados ao vitiligo, podem desempenhar um papel no estresse intrínseco dos melanócitos. Além disso, vários fenóis ambientais interagem com enzimas melanogênicas, induzindo estresse e resultando na liberação de padrões moleculares associados a danos (DAMPs). Esses DAMPs estimulam as células imunes inatas próximas por meio de receptores de reconhecimento de padrões (PRRs). Os polimorfismos genéticos associados ao vitiligo, podem influenciar tanto o estresse dos melanócitos quanto a resposta imune inata.
O estresse emocional pode desempenhar um papel significativo no desenvolvimento e na progressão do vitiligo. A presença da despigmentação pode, por si só, ser um fator estressante para os pacientes (RICHMOND, 2013).
Geralmente, o início da doença ocorre entre a segunda e a terceira década de vida. Ambos os sexos, adultos e crianças, são igualmente afetados, embora alguns estudos sugiram uma leve predominância de casos entre o sexo feminino. Isso pode estar relacionado às consequências psicossociais mais significativas que essa condição dermatológica pode acarretar para as mulheres, porém esse dado ainda não é considerado estatisticamente significativo devido às taxas demonstrando incidência semelhante entre os gêneros. O vitiligo é a forma mais comum de hipomelanose adquirida. Portanto, essa é uma questão especialmente relevante em crianças e adolescentes, uma vez que estão em fase de formação e desenvolvimento de sua identidade (CAVALCANTE et al., 2015).
Frente a essa realidade, é crucial encontrar tratamentos que sejam de fato eficaz.
MÉTODO:
Realizamos uma revisão bibliográfica descritiva e qualitativa, fundamentada na literatura de publicações sobre o uso do Propionato de Clobetasol no tratamento do Vitiligo, utilizando as bases de dados eletrônicas disponíveis na Biblioteca Virtual em Saúde – BVS. A pesquisa foi conduzida nos bancos de dados da Scielo e PubMed.
Os critérios de inclusão abrangeram artigos publicados na íntegra entre 2000 e 2024, que discutiram o efeito farmacológico do Propionato de Clobetasol na patogênese do Vitiligo. Artigos não escritos em português ou inglês, fora do escopo temático ou inconclusivos, e com fator de impacto abaixo de um, foram excluídos.
A seleção e análise dos artigos foram realizadas com base nos critérios de inclusão e pertinência ao tema, visando compreender o estado atual do conhecimento sobre o Propionato de Clobetasol e o Vitiligo para fundamentar o escopo teórico do estudo.
RESULTADOS E DISCUSSÃO:
Estudos imunológicos revelaram que os linfócitos CD8+ são os mais prevalentes na pele de indivíduos com vitiligo. Houve um aumento observado no número de linfócitos citotóxicos CD8+ reativos ao MELAN/Mart1, um antígeno de melanoma reconhecido pelas células T, além da presença de anticorpos para antimelanócitos nos soros de pacientes com vitiligo (COHEN et al., 2015). Esses anticorpos, embora também presentes em indivíduos saudáveis, são mais frequentes em pacientes com vitiligo, especialmente durante a atividade da doença. A existência desses anticorpos pode ser um marcador da doença ativa e pode persistir mesmo após longos períodos de despigmentação (HARRIS et al., 2012). Diversos pigmentos antigênicos de células foram identificados como alvos para esses anticorpos associados ao vitiligo, incluindo a tirosinase, uma enzima envolvida na produção de melanina. No entanto, o papel preciso desses autoanticorpos no desenvolvimento da doença ainda não está totalmente esclarecido (CUI; ARITA; BYSTRYN, 1995; FARROKHI et al., 2005; ELEFTHERIADOU, 2013). Embora o mecanismo exato do vitiligo permaneça indefinido, várias teorias foram propostas para explicar a perda funcional dos melanócitos na epiderme. Essas teorias envolvem uma combinação de fatores genéticos, autoimunes, bioquímicos, oxidativos, neurais, virais e ambientais (HIROBE, 1995; STEINER et al., 2004; HALDER; CHAPPELL, 2009).
Assim, embora haja uma compreensão crescente dos aspectos imunológicos envolvidos no vitiligo, a complexidade da doença sugere que múltiplos fatores podem estar contribuindo para sua patogênese, exigindo uma abordagem integrada para sua compreensão e tratamento.
O estudo aprofundado desses mecanismos é fundamental para o desenvolvimento de estratégias terapêuticas mais eficazes e para melhorar a qualidade de vida dos pacientes afetados pelo vitiligo.
Conforme Caetano (2022), por quase seis décadas, os corticosteroides sistêmicos têm desempenhado um papel significativo na prática dermatológica, oferecendo vantagens terapêuticas para uma variedade de condições devido às suas propriedades anti-inflamatórias e imunossupressoras. No entanto, o uso desses medicamentos enfrenta o desafio de equilibrar seus efeitos benéficos com suas potenciais atividades farmacológicas adversas.
O cortisol (hidrocortisona) é o principal glicocorticoide produzido pelo organismo, sendo sintetizado no córtex adrenal a partir do colesterol (CAETANO et al., 2022). Em situações normais, apenas aproximadamente 5% do cortisol circula de forma livre, enquanto o restante permanece inativo, com 95% ligados à globulina ligadora de cortisol e 5% à albumina (LARSEN et al., 2003).
A quantidade diária de cortisol secretada varia entre 10 e 20mg, atingindo seu pico pela manhã, geralmente em torno das 8h. Com uma meia-vida de cerca de 90 minutos no plasma, o cortisol é metabolizado pelo fígado e excretado pelas vias renal e hepática. Seu processo de produção é regulado pelo eixo hipotalâmico-hipofisário-suprarenal, sendo também influenciado pelo ciclo circadiano, situações de estresse e pelo feedback negativo exercido nos receptores de glicocorticóides localizados no hipotálamo e na hipófise (LARSEN et al., 2003).
Embora os glicocorticóides tenham sido inicialmente associados ao metabolismo da glicose, atualmente são categorizados como esteróides, agindo por meio da ligação a receptores citosólicos específicos que mediam suas ações. Tais receptores são amplamente distribuídos em quase todos os tecidos, sendo responsáveis pela maioria dos efeitos desses esteróides. Mudanças na estrutura dos glicocorticóides resultaram no desenvolvimento de compostos sintéticos com maior atividade glicocorticóide, o que aumenta sua afinidade com os receptores específicos e prolonga sua permanência nos tecidos. Além disso, muitos desses glicocorticóides sintéticos possuem efeitos mineralocorticoides mínimos, evitando assim a retenção de sódio, hipertensão e hiperpotassemia (TASKER et al., 2006).
O mecanismo pelo qual o glicocorticóide alcança seu receptor parece envolver a difusão passiva através da membrana celular lipídica, sem a necessidade de transporte específico. Quando o glicocorticóide se liga ao receptor no citoplasma celular, ocorre a ativação do complexo receptor-glicocorticoide. Esse complexo, em seguida, migra para o núcleo e regula a expressão de genes relacionados às citocinas e à apoptose celular. Isso é realizado por meio da ligação a locais específicos no DNA, conhecidos como elementos reguladores dos glicocorticóides, bem como pela interação com outros fatores de transcrição, como o fator kB. Essas alterações na expressão gênica resultam em uma resposta aos glicocorticóides que pode ser inibitória ou estimulatória, dependendo do gene e do tecido afetado. Esses efeitos adversos na expressão genética contribuem para os efeitos anti-inflamatórios e imunossupressores dos glicocorticóides (LOSEL et al., 2003).
Apesar de os complexos receptor-glicocorticoide e a subsequente regulação da expressão gênica serem responsáveis pela maioria dos efeitos dos glicocorticóides, também parece haver um mecanismo não genômico envolvendo respostas hormonais. Vários efeitos foram relatados quase imediatamente após a exposição aos corticosteróides, possivelmente mediados por receptores ainda não identificados, presentes nas membranas plasmáticas (VANDEWALLE et al., 2017).
As condições dermatológicas mais frequentemente tratadas com corticosteróides sistêmicos em doses elevadas ou por períodos prolongados incluem doenças autoimunes bolhosas, distúrbios do tecido conjuntivo (como dermatomiosite, lúpus eritematoso sistêmico e doença mista do tecido conjuntivo), vasculites, dermatoses neutrofílicas (como pioderma gangrenoso e síndrome de Sweet), sarcoidose, reação do tipo I à hanseníase, hemangioma capilar, paniculites, urticária e angioedema (REICHARDT et al., 2021).
Algumas dermatoses requerem o uso de corticosteróides em doses elevadas por curtos períodos, por exemplo, eczema atópico, dermatite de contato, farmacodermia, reações de fotossensibilidade, entre outras (Robertson et al., 2017).
Diversos fatores devem ser considerados antes da prescrição de um corticosteróide, de modo que os benefícios da droga superem os efeitos indesejáveis.
O propionato de clobetasol tópico (CP) é um corticóide potente de escolha para o vitiligo, que suprime o sistema imunológico reduzindo a ação das imunoglobulinas e causa a restauração dos melanócitos, levando à repigmentação da pele (ESCOTER et al., 2019). Seus mecanismos estão intrinsecamente ligados à redução da inflamação inibindo a resposta inflamatória da pele. Ele penetra nas células da pele e se liga aos receptores de glicocorticóides intracelulares. Essa ligação ativa os receptores de glicocorticóides, que então inibem a expressão de genes pró-inflamatórios, como citocinas, quimiocinas e mediadores inflamatórios. Isso resulta em uma redução da inflamação, inchaço e vermelhidão associados a condições como dermatite (MUMTAZ et al., 2020).
Supressão da Resposta Imunológica reduzindo a inflamação, o CP também suprime a resposta imunológica da pele (SCHENKEL JS et al., 2017). Isso é particularmente útil em condições de pele de origem autoimune, como a psoríase, onde o sistema imunológico ataca erroneamente as células da pele. Conforme Kumari et al, 1984, suprimir a atividade do sistema imunológico local na pele, o clobetasol ajuda a reduzir a progressão da doença, bem como a inibição da proliferação celular em condições como psoríase, onde há uma proliferação excessiva e anormal das células da pele. O propionato de clobetasol também atua inibindo a proliferação celular (MUMTAZ et al., 2020). Isso ajuda a reduzir a espessura da pele afetada e a formação de escamas. Além de seus efeitos anti-inflamatórios e imunossupressores, o propionato de clobetasol também proporciona alívio dos sintomas associados a condições de pele inflamatórias, como coceira, dor e desconforto (BAPUR, 2016).
Conforme Alqadri et al (2022) os esteroides tópicos, como o propionato de clobetasol, pode estar associado a efeitos adversos sistêmicos, incluindo a supressão do eixo hipotálamo-hipófise-adrenal (HPA). Estudos indicam que a aplicação de mais de 50g por semana de creme de propionato de clobetasol pode resultar em insuficiência adrenal secundária (ELEFTHERIADOU et al., 2011).
Recentemente, foram descritos casos de quatro pacientes que utilizaram creme de propionato de clobetasol por um período prolongado. Destes, três pacientes utilizaram doses menores que 50g por semana (7,5g, 25g e 30g por semana), no entanto, todos desenvolveram insuficiência adrenal secundária até quatro meses após a interrupção da terapia (RAZAVI et al., 2014). Esses achados sugerem que a insuficiência adrenal pode ser mais comum do que se reconhecia anteriormente, mesmo em doses moderadas e em pacientes que utilizam o medicamento por um período prolongado. Diante desse cenário, recomenda-se a realização do teste de metirapona, que avalia todo o eixo HPA, em pacientes que fazem uso prolongado de creme tópico de propionato de clobetasol. Além disso, é importante considerar a suplementação de glicocorticóides durante episódios de estresse, como infecções e cirurgias, por até quatro meses após a interrupção da terapia com PC. Essas medidas visam prevenir complicações decorrentes da insuficiência adrenal secundária e garantir a segurança dos pacientes que fazem uso prolongado de esteróides tópicos potentes como o propionato de clobetasol (PELS et al., 2008).
CONCLUSÕES FINAIS:
O clobetasol tópico pode ser considerado uma opção terapêutica para o tratamento do vitiligo, especialmente em casos em que outras opções não estão disponíveis ou não são eficazes. É importante observar que não existe um protocolo clínico nacional específico para o tratamento do vitiligo, o que pode levar os médicos a considerar o uso de medicamentos como o clobetasol como parte do manejo da doença. O mesmo tem sido utilizado no tratamento do vitiligo devido às suas propriedades anti-inflamatórias e imunossupressoras, que podem ajudar a reduzir a inflamação e a despigmentação da pele. Embora seu uso para essa indicação não seja universalmente reconhecido ou padronizado, evidências anedóticas e estudos clínicos sugerem que pode ser eficaz em alguns casos. Além disso, o clobetasol está disponível no mercado há mais de 15 anos, com mais de 50 registros de diferentes produtores, marcas e apresentações, incluindo genéricos e similares. A disponibilidade no Sistema Único de Saúde (SUS) dentro do componente especializado, para indicação de psoríase pode contribuir para a competitividade de preços entre diferentes marcas, tornando o produto potencialmente acessível para pacientes com vitiligo. No entanto, é importante ressaltar que o uso de clobetasol tópico para o tratamento do vitiligo deve ser supervisionado por um médico dermatologista, pois o uso inadequado ou prolongado pode levar a efeitos colaterais adversos, como afinamento da pele, estrias e alterações na pigmentação e HPA. Além disso, o tratamento do vitiligo geralmente requer uma abordagem multifacetada, que pode incluir terapias combinadas e medidas de suporte psicossocial para obter os melhores resultados.
REFERÊNCIAS BIBLIOGRÁFICAS:
AlQadri NG, Aljomah N, Alotaibi HM. Insuficiência Adrenal Induzida por Corticosteróide Tópico: Um Relato de Caso. Caso Rep Dermatol. 21 de março de 2022; 14(1):39-42. DOI: 10.1159/000515734. PMID: 35496505; PMCID: PMC8995654.
ANDERSON, B. E. Sistema tegumentar volume 4. 2. ed. Rio de Janeiro: Elsevier, 2014.
APPLEGATE, E. J. Anatomia e fisiologia. 4. ed. Rio de Janeiro: Elsevier, 2012.
Bapur Erduran F, Adışen E. Comparação da eficácia da monoterapia com lâmpada excimer de 308 nm com terapias tópicas de combinação de tacrolimus ou clobetasol 17-propionato em vitiligo localizado. Fotoderma, Photoimmunol, Photomed. 2016; 32(5-6):247-253. DOI:10.1111/phpp.12266
Bergqvist C, Ezzedine K. Vitiligo: Uma revisão. Dermatologia. 2020; 236(6):571-592. DOI: 10.1159/000506103. EPub 2020 10 de março. PMID: 32155629.
Caetano CM, Malchoff CD. Dose Diária de Reposição de Glicocorticoides na Insuficiência Adrenal, Uma Mini Revisão. Frente Endocrinol (Lausanne). 2022 Jun 29;13:897211. DOI: 10.3389/fendo.2022.897211. PMID: 35846313; PMCID: PMC9276933.
CAVALCANTE, M. L. L. L.; PINTO, A. C. V. D.; BRITO, F. F. de; SILVA, G. V. da; ITIMURA, G.; MARTELLI, A. C. C. Perfil clínico e epidemiológico do vitiligo infantil: análise de 113 casos diagnosticados em um centro de referência em dermatologia de 2004 a 2014. Surgical and Cosmetic Dermatology, v. 7, n. 4, p. 298–301, 2015.
Chang WL, Ko CH. O Papel do Estresse Oxidativo no Vitiligo: Atualização em sua Patogênese e Implicações Terapêuticas. Células. 19 de março de 2023; 12(6):936. DOI: 10.3390/cells12060936. PMID: 36980277; PMCID: PMC10047323.
Cohen BE, Elbuluk N, Mu EW, Orlow SJ. Tratamentos Sistêmicos Alternativos para Vitiligo: Uma Revisão. Sou J Clin Dermatol. 2015; 16(6):463-474. DOI:10.1007/s40257-015-0153-5
CRAIGLOW, B. G.; KING, B. a. Tofacitinib Citrate for the Treatment of Vitiligo: A Pathogenesis-Directed Therapy. JAMA dermatology, v. 151, n. 10, p. 11–13, 2015. Disponível em: Acesso em: 23 fev. 2024
CUI, J.; ARITA, Y.; BYSTRYN, J. C. Characterization of vitiligo antigens. Pigment cell research / sponsored by the European Society for Pigment Cell Research and the International Pigment Cell Society, v. 8, n. 1, p. 53–59, 1995.
Elassiuty YE, Klarquist J, Speiser J, Yousef RM, El Refaee AA, Hunter NS, Shaker OG, Gundeti M, Nieuweboer-Krobotova L, Le Poole IC. A expressão da heme oxigenase-1 protege os melanócitos da morte celular induzida por estresse: implicações para o vitiligo. Exp Dermatol. Junho de 2011; 20(6):496-501. DOI: 10.1111/j.1600-0625.2010.01232.x. EPub 2011 22 de março. PMID: 21426408; PMCID: PMC3712900.
Eleftheriadou V, Whitton ME, Gawkrodger DJ, Batchelor J, Corne J, Cordeiro B, Ersser S, Ravenscroft J, Thomas KS; vitiligo priorizando a parceria. Pesquisas futuras sobre o tratamento do vitiligo: onde devem estar nossas prioridades? Resultados da parceria de definição de prioridades para o vitiligo. Br J Dermatol. Março de 2011; 164(3):530-6. DOI: 10.1111/j.13652133.2010.10160.x. EPub 2011 28 de janeiro. PMID: 21128908; PMCID: PMC3084501.
Escoter-Torres L, Caratti G, Mechtidou A, Tuckermann J, Uhlenhaut NH, Vettorazzi S. Combatendo o fogo: mecanismos de regulação gênica inflamatória pelo receptor de glicocorticoides. Imunol frontal. 2019;10:1859. Publicado em 7 de agosto de 2019. DOI:10.3389/fimmu.2019.01859
FARROKHI, S.; HOJJAT-FARSANGI, M.; NOOHPISHEH, M. K.; TAHMASBI, R.; REZAEI, N. Assessment of the immune system in 55 Iranian patients with vitiligo. Journal of the European Academy of Dermatology and Venereology, v. 19, n. 6, p. 706–711, 2005 HABIF, T. P. Dermatologia clínica: guia colorido para diagnóstico e tratamento. 5. ed. Rio de Janeiro: Elsevier, 2012.
Halder RM, Chappell JL. Atualização de vitiligo. Semin Cutan Med Surg. 2009; 28(2):86-92. DOI:10.1016/j.sder.2009.04.008
Harris JE, Harris TH, Weninger W, Wherry EJ, Hunter CA, Turka LA. Um modelo de vitiligo em camundongos com despigmentação epidérmica focalizada requer IFN-γ para o acúmulo de células T CD8⁺ autorreativas na pele. J Invest Dermatol. 2012; 132(7):1869-1876. DOI:10.1038/jid.2011.463
HIROBE, T. Structure and function of melanocytes: Microscopic morphology and cell biology of mouse melanocytes in the epidermis and hair follicle. Histology and Histopathology, v. 10, n. 1, p. 223–237, 1995.
Kumari J. Vitiligo tratado com propionato de clobetasol tópico. Arco Dermatol. Maio de 1984; 120(5):631-5. PMID: 6721525.
Larsen PR, Kronenberg HM, Melmed S, Polonsky KS. Williams Textbook of Endocrinology. 10th ed. Philadelphia: Saunders; 2003. p.3034.
Linthorst Homan MW, Spuls PI, de Korte J, Bos JD, Sprangers MA, van der Veen JP. A sobrecarga do vitiligo: características dos pacientes associadas à qualidade de vida. J Am Acad Dermatol. 2009; 61(3):411-420. DOI:10.1016/j.jaad.2009.03.022
Losel RM, Falkenstein E, Feuring M, et al. Ação esteroide não genômica: controvérsias, perguntas e respostas. Rev. Fisiol 2003; 83(3):965-1016. DOI:10.1152/physrev.00003.2003
Marchioro HZ, Silva de Castro CC, Fava VM, Sakiyama PH, Dellatorre G, Miot HA. Atualização sobre a patogênese do vitiligo. Um sutiã dermatol. 2022; 97(4):478-490. DOI:10.1016/j.abd.2021.09.008
Mumtaz H, Anis S, Akhtar A, Rubab M, Zafar A, Niazi N, Bahadur H, Talpur AS, Shafiq MA, Fatima T. Eficácia do Tacrolimus Versus Clobetasol no Tratamento do Vitiligo. Curativo. 8 dez 2020; 12(12):e11985. DOI: 10.7759/cureus.11985. PMID: 33437542; PMCID: PMC7793363.
Nogueira LS, Zancanaro PC, Azambuja RD. Um sutiã dermatol. 2009; 84(1):41-45. DOI:10.1590/s0365-05962009000100006
Parveen S, Awan NUH, Farooq FB, Fanja R, Anjum QUA. Índices topológicos de novas drogas utilizadas no tratamento de vitiligo de doenças autoimunes e sua modelagem QSPR. Biomed Res Int. 2022 15 de novembro de 2022:6045066. DOI: 10.1155/2022/6045066. PMID: 36425334; PMCID: PMC9681541.
Pels R, Sterry W, Lademann J. Propionato de clobetasol – onde, quando, por quê?. Drogas Hoje (Barc). 2008; 44(7):547-557. DOI:10.1358/dot.2008.44.7.1122221
Razavi Z, Sanginabadi M. Parada de crescimento linear sem ganho de peso devido ao uso excessivo de clobetasol tópico. Omã Med J. 2014 Nov; 29(6):454-7. DOI: 10.5001/omj.2014.118. PMID: 25584165; PMCID: PMC4289488.
Reichardt SD, Amouret A, Muzzi C, Vettorazzi S, Tuckermann JP, Lühder F, Reichardt HM. O Papel dos Glicocorticoides nas Doenças Inflamatórias. Células. 28 de outubro de 2021; 10(11):2921. DOI: 10.3390/cells10112921. PMID: 34831143; PMCID: PMC8616489.
Richmond JM, Frisoli ML, Harris JE. Mecanismos imunes inatos no vitiligo: perigo interno. Curr Opin Imunol. 2013 Dez; 25(6):676-82. DOI: 10.1016/j.coi.2013.10.010. EPub 2013 12 de novembro. PMID: 24238922; PMCID: PMC3935321.
Robertson S, Mergulhador LA, Alvarez-Madrazo S, et al. Regulação de Genes Corticosteroidogênicos por MicroRNAs. Int J Endocrinol. 2017;2017:2021903. DOI:10.1155/2017/2021903
Sain N, Hooda V, Singh A, Gupta S, Arava S, Sharma A. O fator inibitório de macrófagos altera a funcionalidade dos macrófagos e seu envolvimento na patogênese da doença de pacientes com vitiligo generalizado ativo. Citocinas. 2024;176:156516. DOI:10.1016/j.cyto.2024.156516
Schenkel JS, Lübbers HT, Rostetter C, Metzler P. Traitement médicamenteux du lichen plan buccal. Suíça Dent J. 2017; 127(6):538-539. Francês. PMID: 28639683.
Singh SK, Nasir F.; O efeito reservatório dos esteróides tópicos na pele vitiliginosa: um estudo transversal. Indiano J Dermatol Venereol Leprol. 2015; 81(4):370-375. DOI:10.4103/03786323.159933
STEINER, D.; VILLAS, R. T.; BEDIN, V.; STEINER, T.; MORAES, M. B. Vitiligo. Anais Brasileiros de Dermatologia, v. 79, n. 3, p. 335–351, 2004.
Taieb A, Alomar A, Böhm M, et al. Diretrizes para o manejo do vitiligo: consenso do Fórum Europeu de Dermatologia. Br J Dermatol. 2013; 168(1):5-19. DOI:10.1111/j.13652133.2012.11197.x
Tasker JG, Di S, Malcher-Lopes R. Mini Revisão: sinalização rápida de glicocorticóides via receptores associados à membrana. Endocrinologia. 2006 Dez; 147(12):5549-56. DOI: 10.1210/pt.2006-0981. EPub 2006 31 de agosto. PMID: 16946006; PMCID: PMC3280589.
Temel B, Orenay O, Karaosmanoglu N. An Evaluation of the Hematological Markers of Systemic Inflammation and Oxidative Stress in Vitiligo: A Case-Control Study. Cureus. 2024 Mar 12;16(3):e56034. doi: 10.7759/cureus.56034. PMID: 38606245; PMCID: PMC11008697.
TORTORA, G. J.; DERRICKSON, B. Corpo humano : fundamentos de anatomia e fisiologia. 8. ed. Porto Alegre: Artmed, 2012.
Vandewalle J, Luypaert A, De Bosscher K, Libert C. Mecanismos terapêuticos dos glicocorticóides. Tendências Endocrinol Metab. 2018; 29(1):42-54. DOI:10.1016/j.tem.2017.10.010
Yaghoobi R, Omidian M, Bagherani N. Vitiligo: uma revisão do trabalho publicado. J Dermatol. 2011; 38(5):419-431. DOI:10.1111/j.1346-8138.2010.01139.x
Frisoli ML, Essien K, Harris JE. Vitiligo: Mecanismos de patogênese e tratamento. Rev. Annu Imunol. 2020 Abr 26;38:621-648. DOI: 10.1146/annurev-immunol-100919-023531. EPub 2020 Fev 4. PMID: 32017656.
1Biomédico pelo Centro UNIME/BA e Mestre em Gestão e Administração em Saúde Pública pela Universidad Colúmbia del Paraguay.
2Biomédico pela Universidade de Salvador (UNIFACS). Mestrando em Imunologia (PPGIM-UFBA).
3Graduandos em Biomedicina na universidade UNIME/BA, Lauro de Freitas.
4Graduando em Farmácia na universidade UNIME/BA, Lauro de Freitas.
