REGISTRO DOI: 10.69849/revistaft/cl10202509191102
Nizolli, Natalia Neiva1
Scalzilli, Bruna2
Resumo
O aumento da longevidade de cães e gatos têm impulsionado o uso de terapias adjuvantes que priorizam a qualidade de vida. Os sarcomas de tecidos moles (STMs) são tumores infiltrativos e localmente agressivos, tradicionalmente tratados com margens cirúrgicas amplas. A eletroquimioterapia (EQT) apresenta baixa toxicidade e potencializa a ação de quimioterápicos pela eletroporação, contribuindo para o controle local e redução de recidivas. Este trabalho relata dois casos de STMs em pequenos animais tratados com cirurgia conservadora associada à EQT. Ambos os pacientes apresentaram boa evolução, preservação funcional e ausência de recidiva durante acompanhamento, sugerindo que a EQT é uma alternativa promissora como terapia multimodal na oncologia.
Palavras-chave: Neoplasias mesenquimais, Cão, Gato, Preservação funcional, Oncologia.
Abstract
The increased longevity of dogs and cats has driven the use of adjuvant therapies that prioritize quality of life. Soft tissue sarcomas (STS) are infiltrative and locally aggressive tumors, traditionally treated with wide surgical margins. Electrochemotherapy (ETC) has low toxicity and enhances the action of chemotherapy agents through electroporation, contributing to local control and reducing recurrences. This study reports two cases of STS in small animals treated with conservative surgery combined with ETC. Both patients presented good outcomes, functional preservation, and no recurrence during follow-up, suggesting that ETC is a promising alternative as a multimodal therapy in oncology.
Keywords: Mesenchymal neoplasms, Dog, Cat, Functional preservation, Oncology.
Introdução
As neoplasias representam causa importante de morbidade e mortalidade em pequenos animais, contudo, devem ser previamente diagnosticadas para melhor conduta terapêutica.23
Os sarcomas de tecidos moles (STMs) são neoplasias malignas de origem mesenquimal, caracterizadas por comportamento infiltrativo e baixo potencial metastático.3 Podem revelar-se como neoplasias de diversos tamanhos e consistências, com crescimento lento comum, tendo exceções de crescimento rápido, e sua localidade de maior frequência em troncos e membros. 4 Seu crescimento é localmente invasivo, podendo introduzir-se em planos profundos fasciais, sendo envoltos por uma pseudocápsula de tecido conjuntivo peritumoral, ao redor de toda massa, mas que constantemente a invadem, favorecendo assim, as recidivas.9 Visto que em pacientes com alto grau tumoral (grau III), podem evoluir para metástases em 40% das ocorrências, enquanto casos de STMs em grau baixo a intermediário, são capazes de progredir para quadros metastáticos em 15% dos eventos.8
A sintomatologia depende da localização anatômica tumoral.3 A principal é definida através da inspeção e exame físico minucioso, sendo palpável uma formação, frequentemente acompanhada de dor e perda de função motora, em que é frequente a presença de claudicação do membro afetado que pode começar em quadros agudos e se tornarem crônicos.6
Para exame de triagem, a citologia por agulha fina (CAAF), não é assertiva para STM, porém, pode ser usada para o diferencial de outros tumores cutâneos como também a classificação de massas que são ou não neoplásicas.4 A biópsia incisional é eleita o método assertivo para análise histopatológica pré-operatória e consequentemente determinante da graduação neoplásica. 9 Os exames de imagem são indispensáveis para estadiamento e planejamento do tratamento.14 A tomografia e ressonância magnética tem efetividade no que se refere a tumores envolvendo plexo e medula, pois têm aptidão para distinguir os feixes nervosos e profundidades da vascularização sanguínea.14
O procedimento cirúrgico deve ser a primeira escolha terapêutica para os STMs.8 Em sarcomas de graduação baixa, ela pode ser curativa, dispensando a necessidade de terapias adjuvantes.3,14 Contudo, a agressividade desse tipo tumoral os permite invadir tecidos adjacentes ocasionando maior chance de recidivas locais.8,14
Quando os sarcomas de tecidos moles acometem os membros, a ressecção radical, frequentemente representada pela amputação, é uma das opções terapêuticas consideradas para garantir o controle local da doença.18 Apesar de possibilitar margens amplas e bom controle tumoral, essa conduta tem sido alvo de debate, uma vez que pode comprometer a qualidade de vida dos pacientes, especialmente em indivíduos com comorbidades adicionais, como doenças osteoarticulares, obesidade ou idade avançada.18 Nessas situações, a amputação pode se configurar como uma solução drástica e nem sempre a melhor alternativa.18 Em contrapartida, a associação de terapias multimodais à cirurgia conservadora tem se mostrado uma abordagem promissora. Essa estratégia permite o controle local da neoplasia, reduz o risco de recidivas e, ao mesmo tempo, preserva a função e a estética do membro acometido, proporcionando melhor qualidade de vida ao paciente.18
Embora a intervenção cirúrgica seja a principal forma de tratamento dos STMs, é fato, que a associação das terapias adjuvantes pode aumentar o controle local e reduzir as reincidências.18
A quimioterapia sistêmica, isoladamente, apresenta eficácia limitada nesta tipologia tumoral, pois a maioria dos agentes apresentam dificuldades de penetração intracelular, o que reduz sua efetividade citotóxica.19,20 Neste contexto, a eletroquimioterapia (EQT) surge como estratégia. 22 Trata-se de uma modalidade que associa quimioterápicos a pulsos elétricos de alta intensidade, induzindo assim, a eletroporação reversível da membrana celular e aumentando a entrada do fármaco no tecido neoplásico com maior citotoxicidade e apoptose celular.10,15
Entre os agentes utilizados, destacam-se a Cisplatina e a Bleomicina. Embora eficaz em cães, a Cisplatina pode provocar efeitos adversos importantes e é contraindicada em felinos devido à sintomatologia de toxicidade pulmonar.12,20, 21 Já a bleomicina, é considerada o fármaco de escolha na prática clínica, por sua segurança e pelo marcante aumento de eficácia quando associada à eletroporação.9,1 Assim, a EQT têm sido consolidada como uma alternativa segura e eficaz para o tratamento de STMs em pequenos animais, principalmente quando associada à cirurgia conservadora.10,15
O objetivo deste trabalho é relatar dois casos de sarcoma de tecidos moles em cão e gato, tratados por cirurgia conservadora associada à eletroquimioterapia, discutindo a abordagem diagnóstica, terapêutica e a importância da preservação funcional no manejo desses tumores.
Relato de caso – 1° caso
Um cão, macho, de 12 anos, sem raça definida, castrado, foi encaminhado para atendimento mediante a queixa principal de aparecimento de um nódulo com crescimento acentuado em membro torácico direito, em região rádio-ulnar. Seu aspecto era circular, macio, aderido e não ulcerado, medindo 3,0cm x 1,53cm, sem sintomatologia associada (Figura 1).
Em conduta clínica inicial, foi solicitado exame de Citologia Aspirativa por Agulha Fina (CAAF), sugestiva de sarcoma de tecidos moles. Diante do quadro, o paciente foi encaminhado para planejamento cirúrgico, visando obtenção de dose cirúrgica adequada e estadiamento clínico ao sistema TNM1, associado à realização de exames complementares. Solicitados exames de imagem, incluindo radiografia torácica para pesquisa de metástases em campos pulmonares e do membro acometido, que confirmou presença de área nodular em terço médio/distal da diáfise da ulna. A ultrassonografia abdominal, não evidenciou alterações metastáticas ou outras formações oncológicas aparentes. Para triagem anestésica, realizaram-se ecodopplercardiograma e eletrocardiograma a fim de avaliar atividade e morfologia cardíaca. O paciente foi classificado como ASA II2, sem comprometimento cardiológico ou atividade arrítmica.
O paciente foi submetido a cirurgia conservadora para a exérese tumoral associada à eletroquimioterapia transoperatória visando preservar a função do membro. Foi realizado jejum alimentar e hídrico prévio, para pré-operatório, já com todos os exames avaliados pela equipe cirúrgica. Na sala de preparo, após pesagem e identificação, foi estabelecido acesso venoso periférico, garantido via adequada para fluidoterapia, administração de fármacos e infusões anestésicas e analgésicas para manutenção em período perioperatório. Como medicação pré-anestésica utilizou-se com Acepromazina na concentração de 0,2%, na dose 0,05 ml/Kg, associado à Metadona 10 mg/ml na dose de 0,3 mg/Kg, por via intramuscular. Procedeu-se a tricotomia ampla do membro torácico direito, permitindo adequada exposição do campo cirúrgico e correta assepsia cutânea.
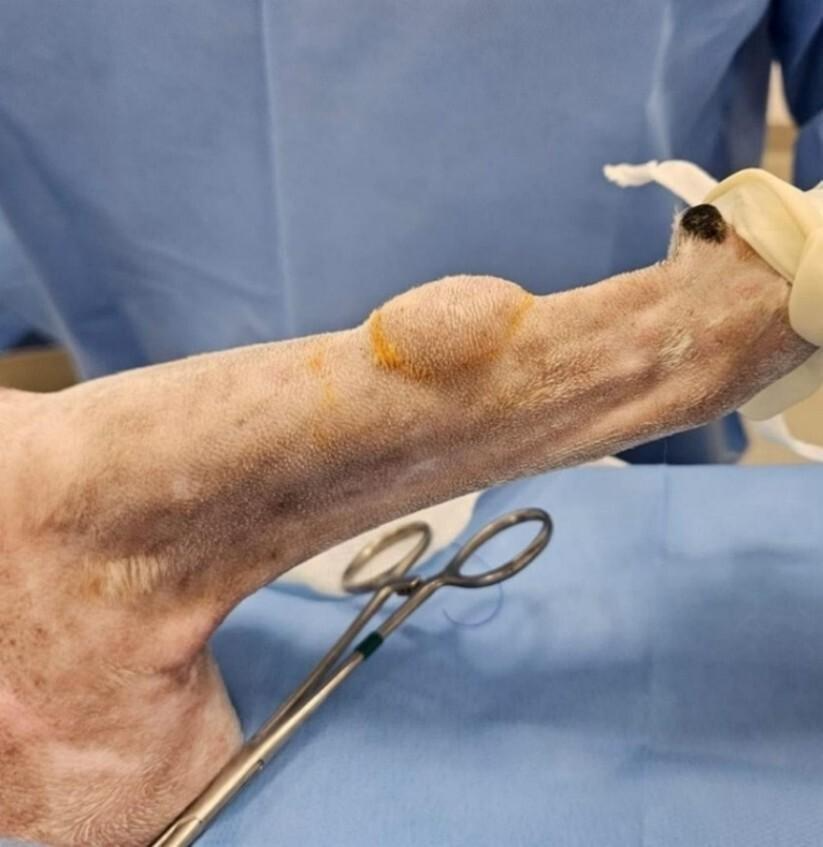
Figura 1: Sarcoma de Tecidos Moles localizado em região de terço distal da diáfise ulnar em cão medindo 3,0 cm x 1,53 cm, já com as delimitações cirúrgicas e pano de campo. Fonte: Arquivo pessoal, 2025.
No centro cirúrgico, a indução anestésica foi realizada com Propofol 10mg/ml, na dose de 5mg/kg por via intravenosa associada a infusão de solução com ringer com lactato em taxa de manutenção 5ml/kg/h durante transoperatório. Procedeu-se a intubação endotraqueal com sonda nº 8 sob auxílio de um laringoscópio, e manutenção anestésica volátil com gás Isoflurano. Durante toda a intervenção, foram monitorados FC/FR3, saturação de oxigênio, PAS e PAM4, temperatura e glicemia, visando prevenir hipotermia, hipotensão e hipoglicemia.
Após preparo asséptico, realizou-se a exérese tumoral com margens seguras (Figura 2), após a retirada do linfonodo regional axilar direito. Realizou-se a administração de Bleomicina frasco ampola de 15 UI, por via endovenosa, na dose de 10 UI/m², aguardado 7 minutos e realizado procedimento de EQT5 em leito aberto. Em seguida, trocou-se todo material cirúrgico para a rafia da ferida feita pela ressecção. Procedeu-se a síntese a partir da confecção de um retalho de padrão subdérmico de rotação a partir da base distal da ferida, realizando-se uma incisão em formato de meia lua, transpondo a pele para cobertura da ferida. Foram utilizados pontos simples separados com fio polidioxanona 3-0 para aproximação de tecido subcutâneo, seguida de sutura com ponto sultan com fio nylon 4-0 para rafia cutânea. Não houve intercorrências.
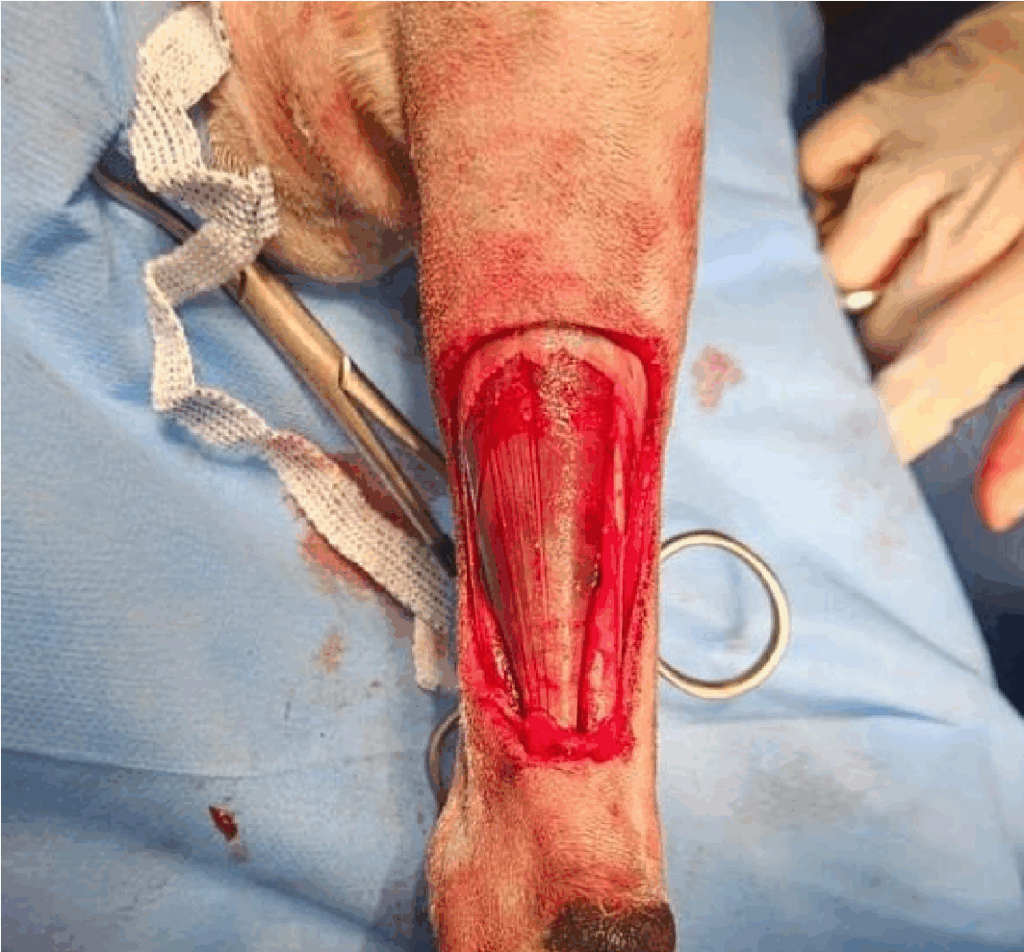
Figura 2: Membro torácico direito após a ressecção tumoral de sarcoma de tecidos moles em diáfise ulnar em região distal/ventral – membro em campo cirúrgico. Fonte: Arquivo pessoal, 2025.
O exame histopatológico confirmou sarcoma de tecidos moles grau I, com margens cirúrgicas livres e linfonodo axilar sem alterações. A análise microscópica dos fragmentos enviados foi realizada em cortes histológicos corados em hematoxilina e eosina (Figura 3).
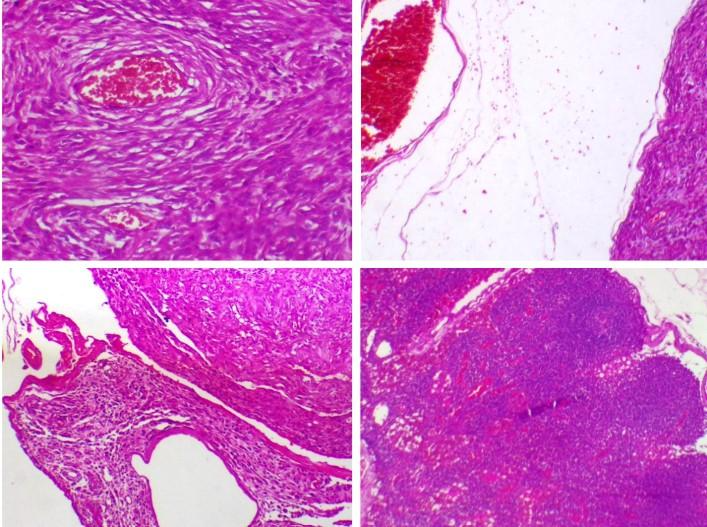
Figura 3: Análise Histopatológica das amostras enviadas – *Comentário: o padrão característico de redemoinho observado assemelha-se muito ao tecido conjuntivo maduro que envolve nervos e vasos sanguíneos, sugerindo fenótipo de célula perivascular ou perineural. Fonte: Imagem cedida por M.V. Msc Bruna Scalzilli Luzes – Feita pelo Laboratório de Análises Clínicas IOVET – Instituto de Oncologia Veterinária de São Paulo – Pompéia – SP
No pós-operatório imediato, o paciente recebeu analgesia multimodal, anti-inflamatório e antibioticoterapia por via subcutânea (metadona 0,2 mg/kg, dipirona 25mg/kg, meloxicam 0,2mg/kg e amoxicilina 22 mg/kg), além de cuidados locais. Para administração domiciliar, foram prescritos: cloridrato de tramadol (2 mg/kg por via oral a cada 8 horas, durante 4 dias), dipirona (25 mg/kg por via oral a cada 8 horas, durante 5 dias), e meloxicam (0,1mg/kg por via oral a cada 24 horas, durante três dias). Orientou-se ainda a limpeza da ferida cirúrgica apenas com solução fisiológica e uso da roupa cirúrgica específica para proteção dos membros dianteiros. O paciente evoluiu com cicatrização completa em 20 dias, e manteve-se sem sinais de recidiva no acompanhamento de 6 meses (Figura 4).
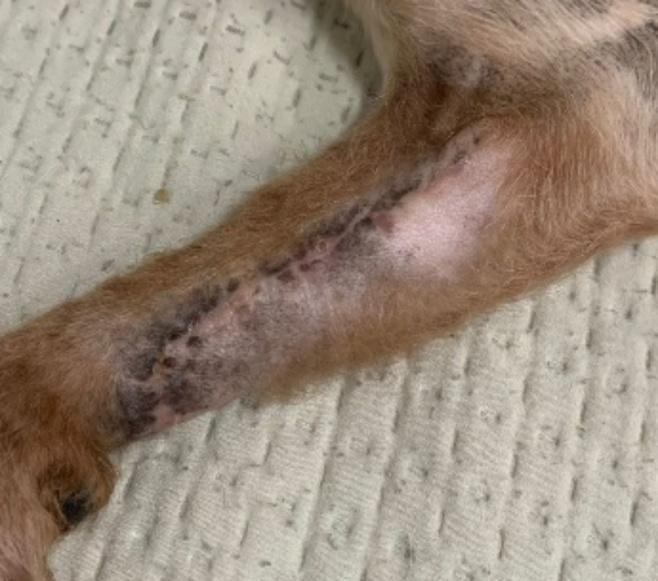
Figura 4: Ferida cirúrgica de paciente após 30 dias de pós-operatório, em completa cicatrização. Fonte: Arquivo pessoal, 2025.
Relato de caso – 2° caso
Um felino, macho, 7 anos, sem raça definida, castrado, foi encaminhado para atendimento mediante a queixa principal do aparecimento de uma neoformação com crescimento rápido no membro pélvico esquerdo, em região de calcâneo, que causava incômodo ao andar, sem outros sinais clínicos associados. Seu aspecto era circular, macio, liso, aderido e não ulcerado, medindo 2,5 x 2,0 x 1,8 cm. (Figura 5).
Como conduta clínica inicial, foi realizada Citologia Aspirativa por Agulha Fina (CAAF), que revelou celularidade composta por células fusiformes compatíveis com o diagnóstico tumoral de Sarcoma de Tecidos Moles sem definição de grau histológico.
Diante do diagnóstico prévio, foram realizados exames complementares para estadiamento clínico. A radiografia torácica não evidenciou metástases pulmonares e a radiografia do membro revelou massa em partes moles, sem sinais de invasão óssea. Exames laboratoriais e sorologia para FIV (Imunodeficiência Felina) e FELV (Leucemia Felina) apresentaram resultados dentro da normalidade. A ultrassonografia abdominal não demonstrou alterações relevantes. E a avaliação cardiológica classificou o paciente como ASA I, sem alterações significativas. Com o diagnóstico sugestivo de STM6, optou-se por exérese tumoral associada à eletroquimioterapia transoperatória, além da remoção do linfonodo poplíteo regional. O paciente foi submetido a jejum alimentar e hídrico, para pré-operatório, já com todos os exames avaliados pela equipe cirúrgica.
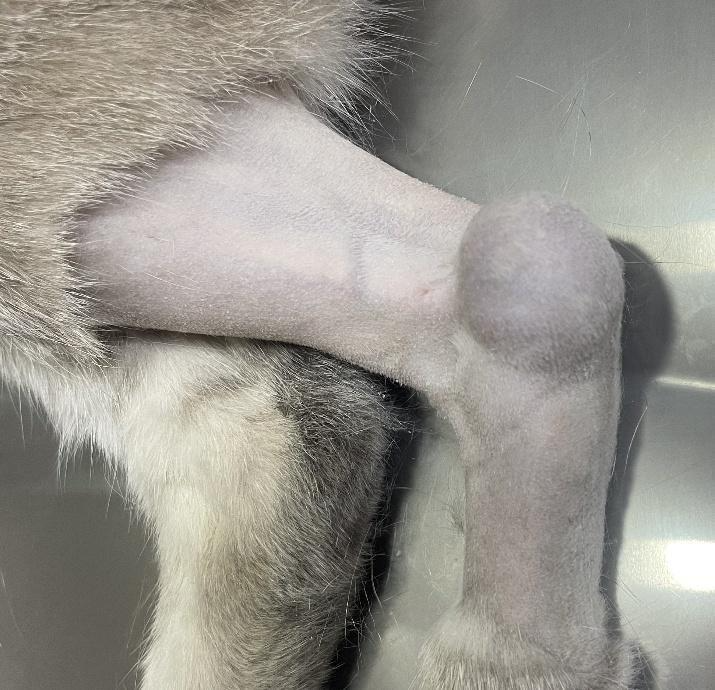
Figura 5: Sarcoma de Tecidos Moles localizado em região de calcâneo, em eixo de epífise distal da fíbula esquerda medindo 2,5 x 2,0 x 1,8 cm, com realização de tricotomia ampla, sem delimitações. Fonte: Arquivo pessoal, 2025.
A medicação pré-anestésica foi realizada com Dexmedetomidina 500 ug/mL na dose 0,01 mg/m², associado à Metadona ampola de 10 mg/ml, na dose de 0,2 mg/Kg, por via intramuscular. Procedeu-se a tricotomia ampla do membro pélvico esquerdo, permitindo adequada exposição do campo cirúrgico.
Já no centro cirúrgico, foi realizada a indução anestésica com Propofol 10mg/ml, na dose de 5mg/kg por via intravenosa e solução de RL7 na dose de manutenção 5ml/kg/h durante o transoperatório. Iniciou-se a indução anestésica volátil, com a intubação endotraqueal com sonda nº 4 e manutenção anestésica com Isoflurano, durante todo o transcirúrgico.
Após preparo asséptico, foi realizada a exérese tumoral com margens seguras (Figura 6), juntamente com a remoção do linfonodo regional poplíteo esquerdo. Após ressecção, realizou-se a EQT em leito cirúrgico aberto, com a administração endovenosa de Bleomicina (frasco ampola de 15 UI, na dose de 10 UI/m²), associada à eletroporação com eletrodo de agulhas. Posteriormente procede-se a troca de todo material cirúrgico para a rafia da ferida resultante da ressecção. Foram utilizados pontos simples separados com fio polidioxanona 3-0 para aproximação de tecido subcutâneo, seguida de sutura com pontos simples separados com fio nylon 4-0 para refia cutânea.
O procedimento transcorreu sem intercorrências.
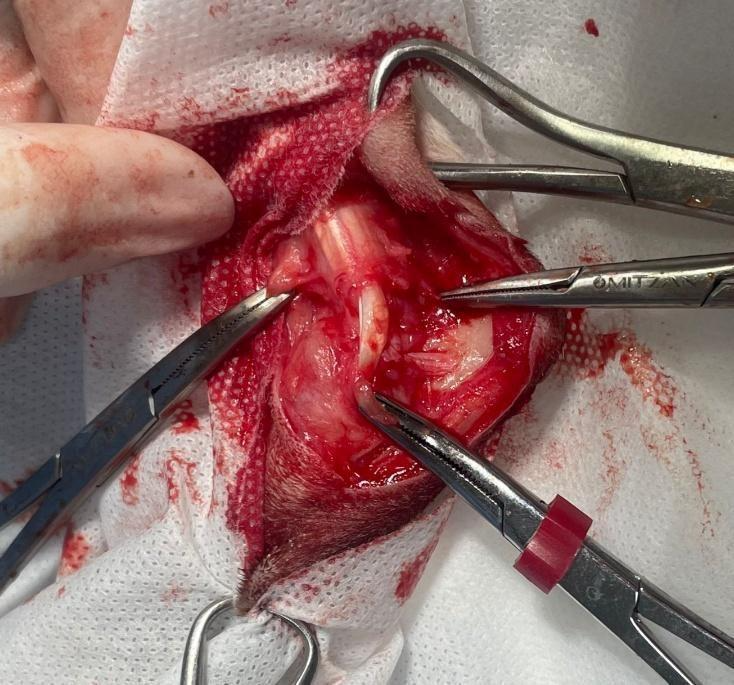
Figura 6: Membro pélvico esquerdo de paciente felino após a ressecção tumoral de sarcoma de tecidos moles em calcâneo – membro em campo cirúrgico, com pinças hemostáticas. Fonte: Arquivo pessoal, 2025.
A análise histopatológica confirmou sarcoma de tecidos moles grau II, com margens profundas comprometidas, sem evidência de metástases no linfonodo poplíteo. No pós-operatório imediato, o paciente recebeu analgesia multimodal, anti-inflamatório e antibioticoterapia por via subcutânea (metadona 0,15 mg/kg, dipirona 12,5 mg/kg, meloxicam 0,1mg/kg e amoxicilina com clavulanato 22 mg/kg). Os pontos foram removidos em sua totalidade após 28 dias do procedimento, com completa cicatrização, sem complicações pós operatórias (Figura 7).
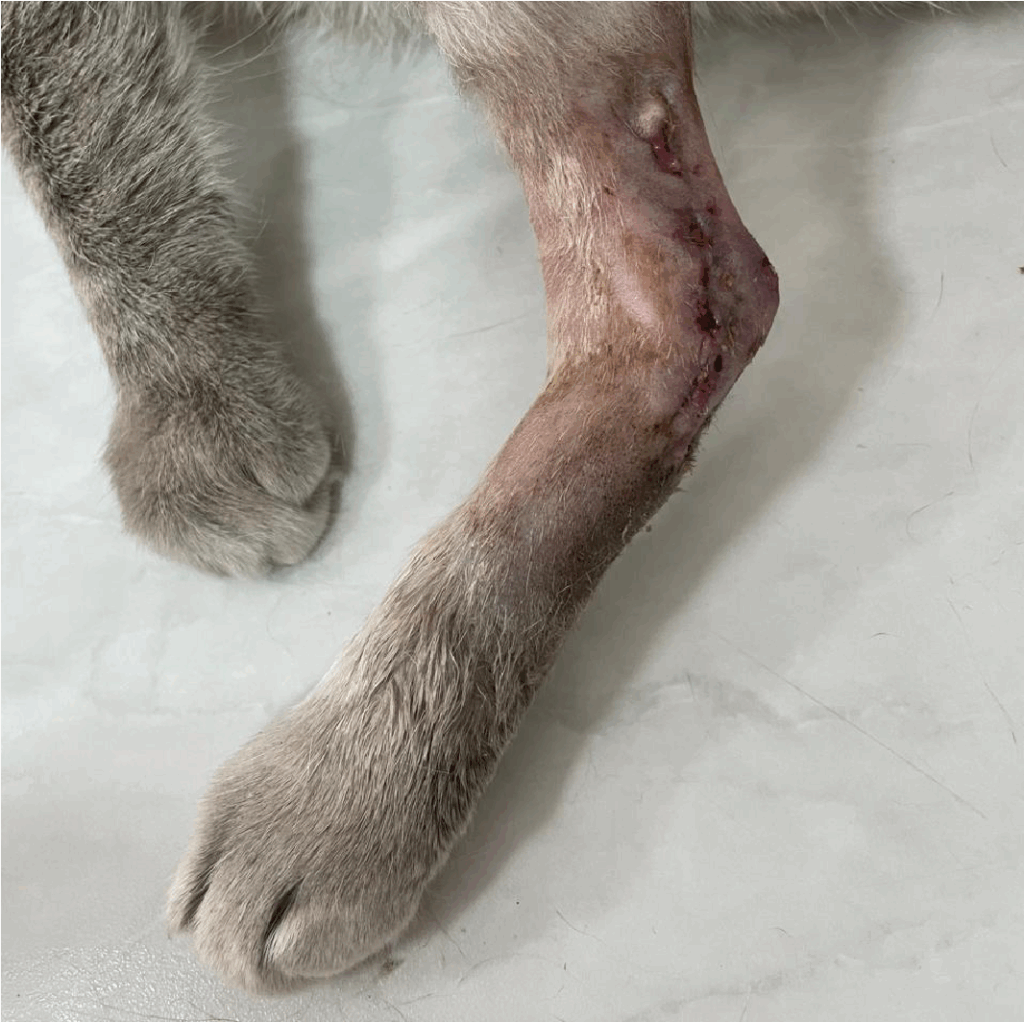
Figura 7: Membro pélvico esquerdo de paciente felino após remoção dos pontos e completa cicatrização. Fonte: Arquivo pessoal, 2025.
Foi instituído protocolo de quimioterapia metronômica com ciclofosfamida (10 mg/m² a cada 48 horas, durante 30 dias) e piroxicam (0,3 mg/kg, a cada 48 horas, durante 30 dias para reajuste de dose), em um período de 6 meses. O acompanhamento clínico ao longo de 12 meses demonstrou boa evolução, sem nenhum sinal de recidiva tumoral.
Discussão
Os sarcomas de tecidos moles (STMs) representam de 8 a 15% das neoplasias cutâneas e subcutâneas em cães e gatos, sendo mais prevalentes em cães de meia-idade a idosos de porte médio a grande, sem predisposição racial definida.³,⁹ No presente trabalho, foram relatados dois casos em animais sem raça definida, um cão de 12 anos e um felino de 7 anos, corroborando a literatura quanto à idade de ocorrência, mas sem evidências de predisposição racial.
O estadiamento TNM é ferramenta essencial para o planejamento terapêutico, pois avalia a extensão tumoral, comprometimento linfonodal e presença de metástases.² Em ambos os casos relatados, não foram identificadas metástases regionais ou à distância, achado semelhante ao descrito em tumores de grau baixo a intermediário, nos quais a taxa metastática é inferior a 20%.⁷
A análise histopatológica evidenciou STM grau I no cão, com margens livres, e STM grau II no felino, com margens comprometidas. A literatura aponta maior risco de recidiva em tumores de graus mais elevados, especialmente quando há comprometimento de margens.⁴,⁹ Ainda assim, ambos os pacientes evoluíram sem recidiva, resultado atribuído à associação da cirurgia conservadora à eletroquimioterapia.
A eletroquimioterapia (EQT) têm sido descrita como modalidade adjuvante eficaz no controle local dos STMs, pois potencializa a ação de quimioterápicos como cisplatina e bleomicina por meio da eletroporação celular.10,15
A cisplatina é um quimioterápico eficaz contra STMs, atuando por meio da ligação ao DNA tumoral e da indução de necrose e apoptose. Apesar da eficácia em cães, seu uso pode estar associado a efeitos adversos significativos, incluindo nefrotoxicidade, ototoxicidade e distúrbios gastrointestinais. Em felinos, a droga é contraindicada devido à toxicidade pulmonar. 12, 20, 21
A bleomicina, por sua vez, apresenta ação citotóxica pela lise do DNA e é considerada o fármaco de escolha na EQT, principalmente por sua segurança em gatos. Sua eficácia aumenta exponencialmente quando associada à eletroporação, podendo alcançar até 700 vezes mais a atividade citotóxica 19,21.
Protocolos recomendam sua administração intravenosa cerca de 20 minutos antes da eletroporação, prática adotada nos casos relatados e em conformidade com as diretrizes do ESOPE (European Standard Operating Procedures on Electrochemotherapy). 1,5,13
Assim como realizado nos presentes casos, a utilização da bleomicina associada à EQT promoveu controle local satisfatório. O seguimento clínico demonstrou ausência de recidiva em ambos os pacientes (6 meses no cão e 12 meses no gato), reforçando a efetividade da abordagem multimodal. Esses resultados corroboram estudos retrospectivos que descrevem taxas elevadas de controle local e baixo índice de efeitos adversos em pacientes submetidos à EQT. ¹⁷,²²
A técnica apresenta como vantagens a seletividade tumoral e a baixa incidência de efeitos colaterais, embora sua eficácia seja limitada em lesões metastáticas à distância e em casos que exigem eletrodos específicos para alcançar determinadas regiões .
Para facilitar a comparação entre os dois relatos, elaborou-se o Quadro 1 (Figura 8), que resume as principais características clínicas, histopatológicas, terapêuticas e evolutivas dos casos. A análise comparativa evidencia tanto as diferenças de grau histológico e margens cirúrgicas quanto às semelhanças nos resultados obtidos com a associação da cirurgia conservadora à eletroquimioterapia.
| Quadro 1: Comparativo dos casos de Sarcoma de Tecidos Moles tratados com Eletroquimioterapia | ||
| CARACTERÍSTICA | CASO 1 | CASO 2 |
| Espécie | Cão, Sem raça definida | Felino, Sem raça definida |
| Idade | 12 Anos | 7 anos |
| Sexo (Inteiro/Castrado) | Macho, Castrado | Macho, Castrado |
| Localização | Membro torácico direito (rádio-ulnar) | Membro Pélvico Esquerdo (Região Calcâneo) |
| Tamanho do tumor | 3,0 x 1,5 cm | 2,5 x 2,0 x 1,8 cm |
| Graduação histológica | Grau I | Grau II |
| Margens cirúrgicas | Livres | Comprometidas |
| Linfonodo Regional | Sem metástase | Sem metástases |
| Tratamento adjuvante | EQT transoperatória | EQT transoperatória + quimioterapia metronômica |
| Evolução Clínica | Seguimento de 6 meses sem recidivas. | Seguimento de 12 meses sem recidivas. |
Figura 8: Quadro 1. Comparativo entre dois casos relatados de sarcoma de tecidos moles em pequenos animais, tratados com eletroquimioterapia, destacando aspectos clínicos, histopatológicos, margens, tratamento e evolução clínica.
Observa-se que, apesar do felino apresentar sarcoma de tecidos moles grau II e margens comprometidas, a associação da EQT e quimioterapia metronômica proporcionou controle local semelhante ao obtido no cão com tumor de grau I e margens livres. Esses achados reforçam o papel da EQT como terapia adjuvante, conforme descrito em estudos que relatam sua eficácia na redução de recidivas e na preservação funcional.³,⁷,¹⁵,²²
Considerações finais
Conclui-se que a eletroquimioterapia (EQT), associada à cirurgia conservadora, mostrou-se ser uma abordagem segura e eficaz no controle local dos sarcomas de tecidos moles (STMs) em pequenos animais, permitindo preservação funcional e evitando procedimentos radicais, como a amputação. Nos dois casos relatados, a utilização da EQT com bleomicina resultou em evolução clínica satisfatória e ausência de recidiva durante o período de acompanhamento. Contudo, estudos com maior casuística e seguimento prolongado, são necessários para consolidar protocolos e ampliar a aplicação dessa modalidade terapêutica na oncologia veterinária.
1Sistema para classificação de tumores malignos e estadiamento clínico tumoral, T (Tipo Tumoral), N (Linfonodo) e M (Metástase) – OMS (Organização Mundial de Saúde – 1980 – São Paulo, SP).
2American Society of Anesthesiologists – Sistema de avaliação perioperatório para procedimento anestésico. – ASA II – corresponde ao paciente com doença sistêmica leve – Sociedade Americana de Anestesiologista – 1963.
3FC: Frequência Cardíaca | FR: Frequência Respiratória.
4PAS: Pressão arterial sistólica | PAM: Pressão arterial média.
5Abreviação de Eletroquimioterapia.
6Abreviação para Sarcoma de Tecidos Moles.
7Abreviação para Ringer Lactato.
Referências
- ABREU, R. S. Neoplasias em novos animais de companhia. Lisboa: Universidade de Lisboa, 2019. DOI: 10.24873/j.rpemd.2019.09.455. Disponível em: https://doi.org/10.24873/j.rpemd.2019.09.455. Acesso em: 16 ago.2025
- AGNOLI, A. et al. Consensus statement on the diagnosis and treatment of canine mammary tumors. Veterinary Sciences, v. 8, n. 2, p. 32, 2021. Disponível em: <https://doi.org/10.3390/vetsci8020032.> Acesso em: 03 ago. 2025.
- AVALLONE, G.; STEFANELLO, D.; FERRARI, R.; ROCCABIANCA, P. The controversial histologic classification of canine subcutaneous whorling tumours: The path to perivascular wall tumours. Veterinary and Comparative Oncology, v. 18, n. 1, p. 3–8, mar. 2020. DOI: 10.1111/vco.12559. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/31778274/>. Acesso em: 04 jul. 2025.
- BRAY, J. P. Soft tissue sarcoma in the dog – Part 2: surgical margins, controversies and a comparative review. Journal of Small Animal Practice, v. 58, n. 2, p. 63–72, 2017. DOI: 10.1111/jsap.12629. Disponível em: https://pubmed.ncbi.nlm.nih.gov/28160303/. Acesso em: 06 jul. 2025.
- BRUNNER, C. H. N. Eletroquimioterapia. In: DALECK, C. R.; DE NARDI, A. B. (Ed.). Oncologia em cães e gatos. São Paulo: Editora Roca, 2016.
- COSTA, R. C. Neoplasias intracranianas, espinais e de nervos periféricos. In: DALECK, C. R.; NARDI, A. B. (Org.). Oncologia em cães e gatos. São Paulo: Grupo Gen-Editora Roca Ltda., 2016. p. 892–901.
- CRIVELLENTI, L. Z.; BORIN-CRIVELLENTI, S. Casos de rotina em medicina veterinária de pequenos animais. 3. ed. São Paulo: MedVet, 2023.
- DALECK, C. R.; DE NARDI, A. B. Oncologia em Cães e Gatos. 2. ed. Rio de Janeiro: Roca, 2016. p. 758.
- DENNIS, M. M.; MCSPORRAN, K. D.; BACON, N. J.; SCHULMAN, F. Y.; FOSTER, R. A.; POWERS, B. E. Prognostic factors for cutaneous and subcutaneous soft tissue sarcomas in dogs. Veterinary Pathology, v. 48, n. 1, p. 73–84, jan. 2011. DOI: 10.1177/0300985810388820. Disponível em: https://pubmed.ncbi.nlm.nih.gov/21139143/. Acesso em: 14 ago. 2025.
- DOS ANJOS, D. S.; BRUNNER, C. H. M.; CALAZANS, S. G. Eletroquimioterapia – uma nova modalidade para o tratamento de neoplasias em cães e gatos. Revista de Investigação Veterinária, v. 15, n. 1, p. 1–6, 2016.
- HENRIQUES, Maria Beatriz Duarte. Análise retrospetiva dos efeitos adversos induzidos pela quimioterapia metronómica com ciclofosfamida em canídeos e felídeos [dissertação de mestrado]. Lisboa: Faculdade de Medicina Veterinária, Universidade de Lisboa, 2024. Disponível em: <http://hdl.handle.net/10400.5/96826>. Acesso em: 09 ago. 2025.
- KILARI, D.; GUANCIAL, E.; KIM, E. S. Role of copper transporters in platinum resistance. World Journal of Clinical Oncology, v. 7, n. 1, p. 106–113, 2016. Disponível em: https://doi.org/10.5306/wjco.v7.i1.106. Acesso em: 16 de ago. 2025.
- MALI, B.; MIKLAVCIC, D.; CAMPANA, L. G.; CEMAZAR, M.; SERSA, G.; SNOJ, M.; JARM, T. Tumor size and effectiveness of electrochemotherapy. Radiology and Oncology, 47(1), p. 32–41, 2013. Disponível em: DOI: 10.2478/raon-2013-0002. Acesso em: 21 de ago. 2025.
- MCSPORRAN, K. D. Histologic grade predicts recurrence for marginally excised canine subcutaneous soft tissue sarcomas. Veterinary Pathology, v. 46, p. 928–933, 2009. Disponível em: https://pubmed.ncbi.nlm.nih.gov/21139143/. Acesso em: 21 ago. 2025.
- MEDEIROS, R. C.; SAMPAIO, R. M. A.; SOUSA, J. M.; SANTOS, E. F.; ALMEIDA, H. G. B. Aspectos do emprego da eletroquimioterapia em cães e gatos: revisão. Pubvet, v. 17, n. 6, e1398, 2023. DOI: 10.31533/pubvet. v17n6e1398. Disponível em: <https://ojs.pubvet.com.br>. Acesso em: 09 ago. 2025.
- SPUGNINI, E. P.; FAIS, S.; AZZARITO, T.; BALDI, A. Novel instruments for the implementation of electrochemotherapy protocols: from bench side to veterinary clinic. Journal of Cellular Physiology, v. 232, n. 3, p. 490–495, mar. 2017. DOI: 10.1002/jcp.25505. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/27464761/>. Acesso em: 09 jul. 2025.
- SPUGNINI, E. P.; BALDI, A. Electrochemotherapy in Veterinary Oncology: State-of-the-Art and Perspectives. Vet Clin North Am Small Anim Pract, v. 49, n. 5, p. 967–979, set. 2019. DOI: 10.1016/j.cvsm.2019.04.006. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/31176458/>. Acesso em: 30 de jul. 2025.
- SPUGNINI, E. P.; AZZARITO, T.; FAIS, S.; et al. Electrochemotherapy as first line cancer treatment: experiences from veterinary medicine in developing novel protocols. Current Cancer Drug Targets, v. 16, n. 1, p. 43–52, 2016. DOI: 10.2174/156800961601151218155340. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/26712353/>. Acesso em: 25 ago. 2025.
- SPUGNINI, E. P.; FANCIULLI, M.; CITRO, G.; et al. Preclinical models in electrochemotherapy: the role of veterinary patients. Future Oncology, v. 8, n. 7, p. 829–837, 2012. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/22830403/>. Acesso em: 25 ago. 2025.
- SPUGNINI, E. P.; PIZZUTO, M.; FILIPPONI, M.; et al. Electroporation enhances bleomycin efficacy in cats with periocular carcinoma and advanced squamous cell carcinoma of the head. Journal of Veterinary Internal Medicine, v. 29, n. 5, p. 1368–1375, set. -out. 2015. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/26192904/>. Acesso em: 25 ago. 2025.
- TOZON, N. Operating procedures of the electrochemotherapy for treatment of tumor in dogs and cats. Journal of Visualized Experiments, n. 116, p. 1–7, 2016. DOI: 10.3791/54760. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/27805594/>. Acesso em: 25 jul. 2025.
- TORRIGIANI, F.; PIERINI, A.; LOWE, R.; SIMČIČ, P.; LUBAS, G. Soft tissue sarcoma in dogs: A treatment review and a novel approach using electrochemotherapy in a case series. Veterinary and Comparative Oncology, v. 17, n. 3, p. 234–241, 2019. DOI: 10.1111/vco.12462. Disponível em: <https://pubmed.ncbi.nlm.nih.gov/30688021/>. Acesso em: 07 ago. 2025.
- WITHROW, J. P.; MACEWEN, S. J. Small Animal Clinical Oncology. 5. ed. Philadelphia: Elsevier Saunders, 2013. p. 768.
1Médica Veterinária Autônoma São Paulo – SP, Brazil
2Instituto de Oncologia Veterinária – IOVET, São Paulo-SP, Brazil *scalzillib@gmail.com
