ANORECTAL MELANOMA: CASE REPORT
REGISTRO DOI: 10.5281/zenodo.11194464
Ana Carolina Vitor Vieira Silva; Igor Loures Rossinol de Souza Mendes; Youri Barbosa Andrikopoulo
Resumo
O melanoma é um tumor maligno proveniente dos melanócitos, que tem por sitio mais comum a pele, contudo, 1% podem ocorrer em região de mucosas. O melanoma anorretal ocorre na mucosa anal e tem difícil diagnostico por simular outras doenças anorretais. Geralmente, apresenta-se como lesões polipoides no canal anal com sintomatologia inespecífica. Os autores descrevem 1 relato de caso de melanoma anorretal, abrangendo os mais atualizados dados da literatura, focando no diagnostico, tratamento, evolução e prognóstico. O melanoma anorretal apresenta um baixo índice de cura e um elevado índice de mortalidade a curto prazo.
Palavras-chave: Melanoma. Melanoma Anorretal. Neoplasia Anorretal. Neoplasia Anal. Tratamento.
Abstract
Melanoma is a malignant tumor arising from melanocytes, with the skin being its most common site, although 1% may occur in mucosal areas. Anorectal melanoma occurs in the anal mucosa and poses a diagnostic challenge due to its resemblance to other anorectal diseases. Typically, it presents as polypoid lesions in the anal canal with nonspecific symptoms. The authors describe a case report of anorectal melanoma, encompassing the most updated data from the literature, focusing on diagnosis, treatment, progression, and prognosis. Anorectal melanoma presents a low cure rate and a high short-term mortality rate.
Keywords: Melanoma. Anorectal Melanoma. Anorectal Neoplasia. Anal Neoplasia. Treatment.
1. INTRODUÇÃO
O melanoma é um tumor maligno, originado dos melanócitos, que tem como sítio mais comum a pele, sendo que essa topografia corresponde a aproximadamente 90% de todos os melanomas diagnosticados. Contudo, cerca de 1%2,4, pode aparecer em região de mucosa, assim como o melanoma anorretal, objeto deste estudo. Esse trata-se do terceiro sítio mais comum de surgimento, atrás da pele e da retina, correspondendo a 1,6%2,6 de todos os melanomas diagnosticados. Em relação a região anorretal, tal doença corresponde a aproximadamente 0,05% de todas as neoplasias colorretais e cerca de 1% das anorretais2,14.
Sua incidência é maior em pacientes entre a sexta e a oitava décadas de vida, tendo uma predileção discreta pelo sexo feminino3,11,12. Usualmente, apresentam-se como lesões polipóides em canal anal, por vezes pigmentadas, podendo ser ulceradas, com sintomatologia inespecífica3. No início da doença, seu comportamento costuma ser assintomático2 evoluindo para sangramento anal, tenesmo, dor abdominal e alteração de hábito intestinal,3-5,8,14,15,18,20. Tal comportamento leva a confusão com outras doenças orificiais e de canal anal e, portanto, gerando atraso e equívoco no diagnóstico.
O comportamento do melanoma anorretal é agressivo, com disseminação sistêmica precoce e, associado a dificuldade diagnóstica, seu prognóstico é altamente reservado, mesmo após abordagem cirúrgica. A taxa de sobrevida varia entre 5 e 19 meses2, a depender do estadio da doença no momento do diagnóstico. Em cerca de 60% dos casos, a neoplasia é diagnosticada com a presença de metástases a distância1,3,6,22,23, o que é fator determinante para o pior prognóstico.
Dada a sua raridade e, portanto, dificuldade de realização de estudos clínicos prospectivos sobre o tema, não existem condutas padronizadas para tratamento cirúrgico ou quimioterápico, sendo esse individualizado a depender a sua apresentação no momento do diagnóstico, estadio, invasão linfonodal, sintomatologia e comorbidades associadas1,6,19,24. Hoje, a ressecção cirúrgica pode ser realizada através de duas técnicas principais, a excisão local ampla ou a amputação abdominoperineal do reto, não apresentando diferenças significativas nas taxas de recidiva3,6,8,11,23, sendo sua escolha baseada nos fatores citados acima.
2. OBJETIVO
Relatar o caso de paciente com diagnóstico pós operatório de melanoma anorretal.
3. METODOLOGIA
Relato de caso único, descritivo, analítico e retrospectivo, com discussão do mesmo e revisão bibliográfica associada. A paciente alvo foi atendida por médico coloproctologista e sua equipe, em ambulatório de Cirurgia Geral, vinculado a serviço hospitalar secundário, ambos na Zona Sul da Cidade de São Paulo, sendo a intervenção cirúrgica realizada nesse serviço.
A coleta de dados foi baseada na análise do prontuário da paciente, após autorização familiar, documentada através de termo de consentimento livre e esclarecido, submissão do projeto e aprovação pelo comitê de ética do Hospital Geral do Grajaú – CAEE 59830822.8.0000.5447, nº do parecer 5.510.070. Ainda, a família forneceu para a equipe todas as imagens realizadas em serviços externos, autorizando também sua utilização no presente estudo.
O levantamento bibliográfico baseou-se em livros de referência em coloproctologia e periódicos nacionais e internacionais, contidos nas bases de dados UpToDate, SCIELO, PubMed e Google Scholar, utilizando os seguintes termos para pesquisa: melanoma, melanoma anorretal, melanoma anal, neoplasia anorretal e neoplasia anal. Foram selecionados apenas periódicos escritos em língua portuguesa e inglesa.
4. RELATO DE CASO
Paciente feminina, 79 anos, compareceu ao ambulatório de coloproctologia com relato de hematoquezia há 01 mês, associada a abaulamento anal e disquezia. Ainda, apresentava constipação, com hábito intestinal de 01 evacuação por semana, fezes ressecadas, esforço evacuatório e sensação de evacuação incompleta. Negava episódios semelhantes previamente. Dentre seus antecedentes pessoais relevantes, constavam hipertensão arterial sistêmica, Doença de Parkinson avançada, em uso de Prolopa e Gabapentina, e histórico familiar de câncer colorretal não especificado em irmã.
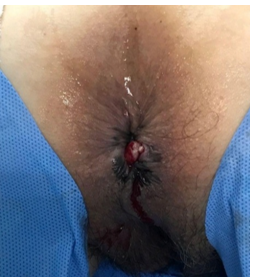
Ao exame proctológico, realizado em posição de Sims, foram evidenciadas, durante a inspeção, máculas hipercrômicas anteriores descontínuas e lesão escarificada e prolapsada anterolateral esquerda. Ao toque retal e anuscopia, lesão ulcero-vegetante anterolateral esquerda, iniciando-se em borda anal, com extensão de 3cm, cavalgável a 4cm, endurecida e friável. Assim, levantada a hipótese de melanoma anorretal e, portanto, solicitados exames complementares e posterior biópsia da lesão. (Imagem 01 )
Imagem 01: máculas hipercrômicas e lesão escarificada prolapsada
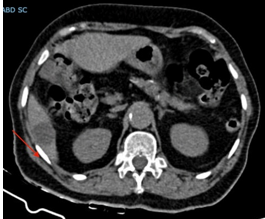
Solicitada TC de abdome, pelve e tórax, cuja única alteração relevante era um cisto hepático em seguimento VI, medindo 30mm, podendo sugerir presença de metástase hepática, mas realizada sem contraste, o que dificultou a confirmação (Imagem 02). Exames bioquímicos não evidenciaram quaisquer alterações e, por indisponibilidade do serviço, não foi solicitado USG endorretal.
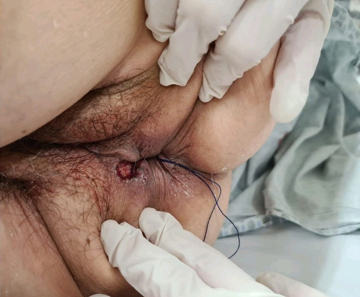
Após a realização de exames pré-operatórios e avaliação pré-anestésica, foi realizado exame proctológico sob narcose e, durante o intraoperatório, ressecção transanal da lesão (após elevação da mesma do plano muscular) com avanço de retalho mucoso de espessura parcial (ausência de lesões macroscópicas em plano esfincteriano) e excisão de máculas hipercrômicas. (Imagens 03/04)
Imagem 03: Anuscopia realizada com paciente em posição Jack-Knife, evidenciando lesão -úlcerovegetante, acometendo borda e canal anal.
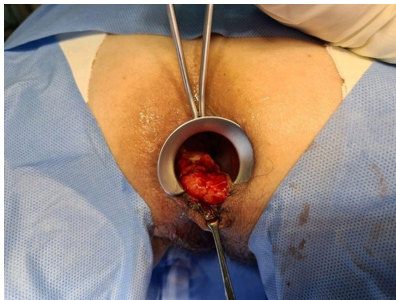
Imagem 04: Pós operatório imediato de ressecção transanal da lesão com raquete de drenagem externa.
Enviado material cirúrgico para análise anatomopatológica. Procedimento ocorreu sem intercorrências, paciente apresentou boa evolução e teve alta hospitalar no 2º dia de pós operatório, com previsão de seguimento ambulatorial.
Avaliada, 21 dias após o procedimento cirúrgico, com presença de ferida operatória sem sinais de complicação.
O estudo anatomopatológico da peça cirúrgica resultou em melanoma maligno de borda anal, com infiltração transmural da parede retal, espessura aproximada da neoplasia de 4mm. Ainda, presença de ulceração em mucosa retal e pele perianal e melanoma “in situ” em epiderme adjacente. Margem cutânea livre de neoplasia, dista 15mm do componente “in situ”, margem em extensão retal e profunda (retal e anal) comprometidas. Procedeu-se estudo histoquímico para definição histogenética e melhor classificação da neoplasia. A análise imuno-histoquímica era consistente com melanoma invasivo de canal anal com alto índice de proliferação celular, com os seguintes marcadores positivos: HMB-45, Ki-67 e Melan-A.
Após explicar o diagnóstico e suas implicações a paciente e seu familiar, a mesma foi encaminhada para seguimento oncológico clínico em serviço de referência e solicitada PET-CT, para avaliação de possíveis disseminações e continuidade do tratamento.
Imagens 5, 6: TC de Tórax – corte axial, janela pulmonar – evidenciando nódulos pulmonares bilaterais em lobos inferiores.
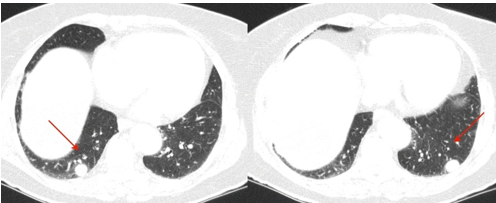
Imagem 07: ausência de nódulos em lobos médios.
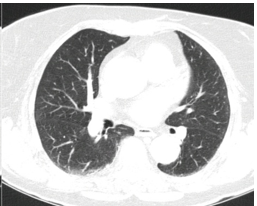
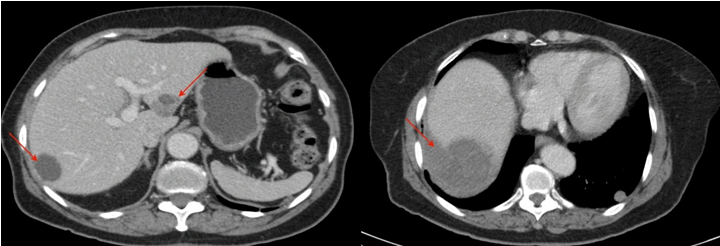
Em seguimento pós operatório, realizou exames laboratoriais, com resultados apresentando discreta elevação de marcadores hepáticos (gama glutamil transferase: 105U/L; fosfatase alcalina: 145U/L; TGO: 143U/ L; TGP 173U/L;), sem outras alterações. Realizados também exames de imagem, com endoscopia digestiva alta e RM de crânio sem alterações significativas. E TC de abdome e pelve, apresentando nódulos pulmonares bilaterais em lobos inferiores, medindo 1,4 cm à direita e 1,6 cm à esquerda, sugestivos de envolvimento neoplásico secundário, (Imagens 05/06/07), assim como, nódulos hepáticos no lobo esquerdo e no segmento VIII, medindo 0,5 cm e 2,5 cm. (Imagens 08/09)
Imagens 8,9: TC de Abdome – corte axial, – evidenciando nódulos hepáticos no lobo esquerdo e segmento VIII.
Após 7 meses da abordagem cirúrgica, a paciente evoluiu com quadro de enterorragia e suspeita de obstrução intestinal, com necessidade de internação hospitalar prolongada. Durante essa internação, realizou exames complementares que mostraram progressão considerável da doença, com novas imagens de TC de tórax, abdome e pelve evidenciando aumento dos nódulos pulmonares bilaterais, medindo até 4,2cm (Imagem 10), assim como novo.nódulo em lobo médio a direita, medindo até 2,1 cm. (Imagem 11).
Imagens 12,13,14,15: TC de Abdome – corte axial- evidenciando lesão expansiva, volumosa, hipovascularizada, multiloculada e heterogênea, ocupando lobo hepático esquerdo em quase sua totalidade, com extensão extracapsular acometendo parte do espaço hepatogástrico e comprimindo corpo do pâncreas e antropiloro;
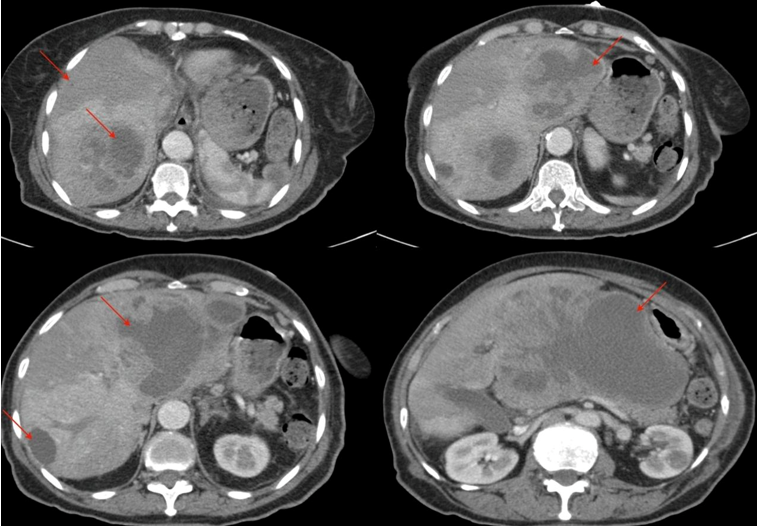
Importante aumento de dimensões da volumosa lesão expansiva hipovascularizada, heterogênea e multiloculada ocupando quase todo o lobo hepático esquerdo, com extensão extracapsular acometendo parte do espaço hepatogástrico, comprimindo o corpo do pâncreas e o antropiloro, apresentando extenso componente liquefeito, medindo cerca de 15×10 cm no plano axial e 20 cm no sagital. (Imagens 12/13/14/15)
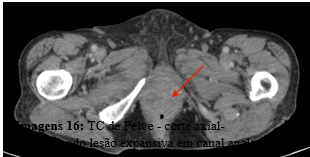
Surgiu, ainda, lesão subcapsular esplênica medindo 2,7 cm, e tornou-se evidente lesão expansiva no canal anal com cerca de 3,5 cm de extensão (Imagem 16). A paciente evoluiu a óbito nesta internação, 12 meses após a suspeita diagnóstica e 8 meses após sua confirmação.
5. DISCUSSÃO
O melanoma é um tumor maligno agressivo, originado nos melanócitos, células produtoras da melanina, substância responsável pela pigmentação dos tecidos, e proteção contra os raios UV na pele e nos olhos1-3. Ainda, esses estão presentes em outras regiões do corpo que não necessitam dessa proteção, como as mucosas3. O sítio mais comum dessa neoplasia é a pele, correspondendo a aproximadamente 90% dos casos, mas podem também surgir em região de mucosa, em aproximadamente 1-2% dos casos2,4,10. Dentre esses, os principais sítios descritos são cabeça e pescoço em 55,4% dos casos, principalmente no nariz e seios paranasais, seguido da região anorretal, objeto deste relato, em 23,8%, trato genital feminino em 18% e trato urinário em 2,9%2,5,10. Ao se considerar os melanomas do trato gastrointestinal, a região anorretal é o principal sítio, com 31,4% dos casos em canal anal e 22,2% no reto3.
Em um contexto geral, a região anorretal mostra-se como um sítio frequente de melanomas malignos, sendo o terceiro local mais comum de aparecimento do mesmo, atrás do melanoma cutâneo e ocular, com incidência aproximada de 0,4-1,6% de todos os casos2,6,14, surgindo, habitualmente, na linha pectínea do canal anal (52-92% dos casos10,11), com tendência a se espalhar pela submucosa7, ou na região retal, mais raramente (2-5% dos casos10). A incidência anual estimada é de 0.3-1.0 por milhão de pessoas11. Tendo sido descrito pela primeira vez em 1857, por Moore9, com aproximadamente 260010 casos relatados desde então.
Há uma discreta predominância pelo sexo feminino1-3,10-12,15, que pode ser explicada pela maior frequência com que as mulheres são submetidas a exames periódicos de períneo13. A maior prevalência aparece em pacientes entre a sexta e a oitava década de vida1-3,10,12,14. Epidemiologia que concorda com o caso relatado, uma vez que se tratava de paciente feminina, com diagnóstico aos 79 anos.
Os fatores de risco para melanomas de mucosa ainda não são conhecidos2,14,15,23 e, considerando o fato de que eles surgem em áreas não comumente expostas ao sol, diferente dos melanomas cutâneos, que tem a exposição solar como principal fator de risco, não se pode considerar essa exposição como relevante3. Os estudos mais recentes não sugerem qualquer relação com os fatores de risco dos melanomas cutâneos10,15,16.
Tal patologia corresponde a aproximadamente 0,05% das neoplasias malignas colorretais10, e 0,5-4,6% dos cânceres anorretais2,10,14, manifestando-se com sintomatologia frusta14, sendo o sangramento retal apontado como o principal sintoma e, também, dor abdominal inespecífica, alteração de hábito intestinal, evacuação mucossanguinolenta, tenesmo e sensação de evacuação incompleta, apresentando-se como hemorroidas atípicas, pólipos, mácula pigmentada ou não pigmentada de contorno irregular, pápula, mancha ou nódulo com ou sem ulceração1-5,10,14,17-22,18.
A apresentação evidencia a dificuldade do diagnóstico precoce, tanto por sua inespecificidade3,15, quanto pelo fato de que a maioria dos pacientes são assintomáticos no início da doença2,17. Ainda, corroborando com isso, as lesões, quando notadas, como citado, comumente se apresentam como lesões polipoides pigmentadas no canal anal ou na margem anal, levando a uma fácil confusão com doenças benignas, como hemorroidas com ou sem complicações8, como a trombose hemorroidaria16, apesar de serem frequentemente friáveis e ulceradas2,3,20,22. Isso leva ao retardo pela procura do serviço médico especializado pelo paciente, como também ao equívoco diagnóstico, se não bem investigado, o que resulta em aproximadamente 2/3 dos pacientes com erro diagnóstico antes da cirurgia2,10, comumente diagnosticados como hemorroida, adenocarcinoma, pólipo ou câncer retal3. Ainda, cerca de 30% dessas apresentam-se com características amelanóticas3,10,18.
Aventada a suspeita diagnóstica, a investigação se faz necessária, sendo considerados como principais diagnósticos diferenciais doença hemorroidária complicada, linfoma não-Hodgkin, adenocarcinoma e sarcoma14,15. O diagnóstico definitivo é definido através de biópsia, por vezes realizado incidentalmente após abordagem cirúrgica para tratamento de doença hemorroidária, contudo, essa pode não ser conclusiva, sendo a análise imuno-histoquímica essencial para o diagnóstico correto10,14. Os marcadores imuno-histoquímicas para o diagnóstico1,2,5,14,15 são HMB-45 (human melanoma black-45), especificidade 56-100% e sensibilidade 69-93%, S-100 (solube 100%), o mais sensível – sensibilidade > 89% e especificidade 75-87%, e melan-A (melanoma-associated protein A), sensibilidade 75-92% e especificidade 95-100%. Tais marcadores apresentam-se intensamente positivos em 78-100% dos melanomas anorretais3,14,17.
Trata-se de uma neoplasia com comportamento agressivo, que apresenta início insidioso, porém disseminação rápida, resultando em invasão linfonodal, principalmente para das cadeias linfonodais inguinal e mesentérica, seguida da para-aórtica17,22,23, e doença metastática, mais comum em topografia hepática, seguida de pulmonar, cerebral, óssea e mamária10,17,19,23, essa estando presente em aproximadamente 60% dos casos no momento do diagnóstico1,3,6,22,23.
Após a confirmação diagnóstica, são necessários exames complementares para avaliação da existência de metástases a distância, informação essencial para que seja realizado o estadio. Essa avaliação pode ser feita por meio de tomografia computadorizada de tórax, abdome e pelve ou PET-CT. E para avaliação de acometimento de sistema nervoso central, ressonância magnética de crânio20. Além disso, considerando-se o fato de que os principais sítios para surgimento de melanoma são a pele e o olho, também fazem-se necessários exames dermatológico e oftalmológico minuciosos para excluir a presença de tumores primários desses locais1,3.
Com isso, as seguintes informações sobre a lesão e sua investigação devem constar nos registros e são necessárias para a correta documentação da patologia: tamanho macroscópico e profundidade vertical do tumor, presença/ausência de ulceração e invasão linfática e perineural, subtipo citomorfológico, envolvimento de estruturas adjacentes, confirmação do diagnóstico de melanoma através de imuno-histoquímica e marcadores melanócitos e, se houver intervenção cirúrgica, envolvimento ou não das margens da lesão ressecada, para definição de melanoma in situ ou invasivo. Pode-se também incluir informações adicionais como presença/ausência de pigmentação, necrose e componente inflamatório associado4.
Tabela 1
a: T1 ≤ 2cm; T2 > 2 cm but ≤ 5cm; T3 > 5cm; T4: tumor of any size invading adjacent organ(s);
b: N1: metastasis in inguinal, mesorectal, internal iliac or external iliac nodes; N1a: metastasis. In inguinal, mesolectal or internal iliac lymph nodes; N1b: metastasis in external iliac lymph nodes; N1c: metastasis in external iliac with any N1a nodes;
c: M1: distant metastases;
d: T1 – invades submucosa (through the muscularis mucosa but not into the muscularis própria);T2 invades muscularis propria; T3 invades through the muscularis própria into pericolorectal tissues; T4: T4a – invades the visceral peritoneum (including gross perforation of the bowel trough tumor and continuous invasion of tumor trough areas of inflammation to the surface of the visceral peritoneum); T4b – directly invades or adheres to adjacent organ or structure;
e: N1 – one to three regional lymph nodes are positive (tumor in lymph nodes measuring ≥ 0.2mm) or any number of tumor deposits are present and all identifiable lymph nodes are negative; N1a: one regional lymph node is positive; N1b: two or three regional lymph nodes are positive; N1c: no regional lymph nodes are positive, but there are tumor deposits in the: subserosa; mesentery; or nonperitonealizes pericolic ou precirectal/mesorectal tissues; N2: four or more regional nodes are positive; N2a: four to six regional lymph nodes are positive; N2b: seven or more regional lymph nodes are positive;
f: M1 – metastases to one or more distant sites or organs or peritoneal metastasis is identified; M1a: metastasis to one site or organ is identified without peritoneal metastasis; M1b: metastasis to two or more sites or organs are identified without peritoneal metastasis; M1c: metastasis to the peritoneal surface is identified alone or with other site or organ metastases;
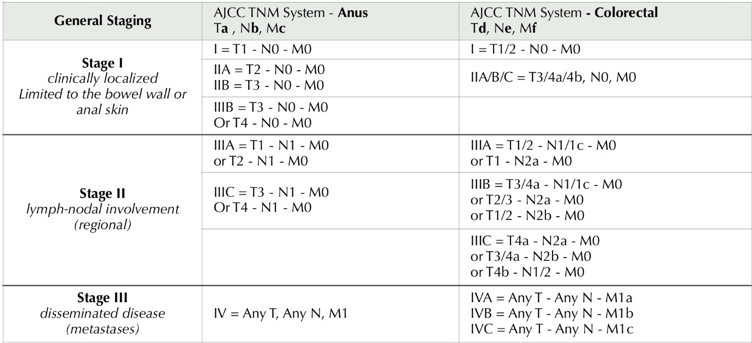
Dada a raridade dessa patologia, não existem sistemas de classificação específicos para a mesma, tampouco inclusão no sistema de estadiamento TNM (Tumor Node Metastasis)3,10,11,20 para cânceres colorretais e de canal anal, de acordo com a última edição do AJCC11,20. Então, os melanomas anorretais, quando diagnosticados, são classificados de acordo com a disseminação da lesão nesse momento, a partir da sua correlação com as classificações do AJCC/TNM21 para tumores colorretais e de canal anal, considerando o sítio anatômico da lesão, assim como é feito com os carcinomas4,17,22,23. (tabela 1)
A atual classificação proposta pela AJCC para cânceres colorretais e anais é semelhante, apresentando diferenças pontuais na avaliação do tamanho da lesão e no status de envolvimento dos linfonodos21,23, apresentadas na tabela 1, associadas com a classificação por disseminação baseada em 3 estágios, descrita pela primeira vez em 1970 por Ballantyne e sendo a mais utilizada atualmente10,11,17,20.
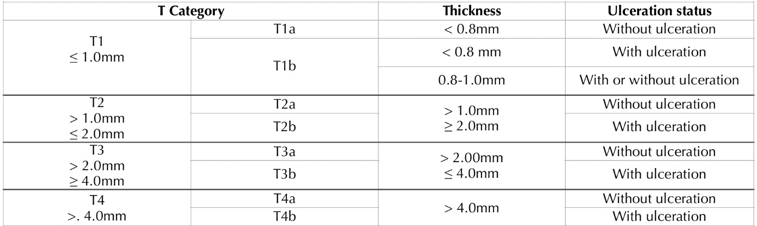
Também pode ser utilizada, para classificação T, o índice de Breslow, utilizado principalmente nos melanomas cutâneos, que leva em consideração a espessura da lesão e a correlaciona com sua disseminação e prognóstico13,17,24 (Tabela 2).
Tabela 2: Breslow Index according to the American Joint Committee on Cancer
A raridade dessa patologia leva à impossibilidade da realização de estudos prospectivos e ensaios clínicos randomizados, portanto, não há um tratamento específico preconizado como padrão ouro para o melanoma anorretal. As principais questões que devem ser respondidas para determinar o manejo ideal da doença potencialmente curativa são se uma abordagem radical inicial melhora a sobrevida nesses pacientes e, caso contrário, como a doença locorregional pode ser melhor controlada, maximizando a qualidade de vida de um paciente11. Assim, entende-se que o mesmo deve ser individualizado, considerando o tamanho e estadio do tumor, a idade do paciente, a presença de outras comorbidades concomitantes e a presença ou ausência de lesões metastáticas, focando, principalmente, no controle local da doença e na qualidade de vida do paciente, uma vez que o prognóstico é reservado e a expectativa de vida é baixa6,11 independentemente da abordagem1,6,11,19,24.
Atualmente, são utilizadas duas técnicas para o tratamento cirúrgico da lesão, a excisão local ampla(wide local excision – WLE), procedimento sem ressecção linfonodal e com preservação do reto, e a ressecção extensa, comumente feita através da amputação abdominoperineal do reto (abdominalperineal ressection – APR), associada a excisão total do mesorreto. Não são descritas diferenças significativas na sobrevida global dos pacientes, independentemente da técnica cirúrgica utilizada2,3,6,8,11,12,23.
Smith et. al descreveu, após revisão sistemática e meta-análise comparando as duas técnicas, que não foram identificadas diferenças significativas entre ambas, tanto no controle local da doença e taxas de sobrevida global, como também na sobrevida livre de doença (2.5 a 23.2 meses após APR e 5-16 meses após WLE) e recorrência local; tampouco foram identificados estudos que comparassem a morbidade e a qualidade de vida dos pacientes após ambos os procedimentos11. A ausência de diferença nessas taxas, quando se compara as técnicas empregadas, pode ser justificada pela presença de macro e micrometástases15,25, o que implica em uma recidiva que costuma apresentar-se de maneira sistêmica6,17,23, reforçando essa hipótese.
A abordagem costuma ser padronizada em algumas regiões, nos países asiáticos, por exemplo, a grande maioria dos pacientes são submetidos a APR6, já nos Estados Unidos e Europa há uma predileção pela realização da WLE6,8. No Brasil, não foram encontrados dados estatísticos que confirmem uma escolha técnica superior a outra, o que sugere que a abordagem é individualizada de acordo com cada caso.
Nesse sentido, uma vez que o prognóstico é altamente reservado, a escolha técnica deve levar em consideração a qualidade de vida do paciente após a abordagem cirúrgica. A WLE, por ser menos invasiva, promove uma recuperação mais rápida do paciente no pós operatório6, ausência da necessidade de ostomia2,12 e, prioritariamente, preservação do esfíncter, contudo, esse pode ser acometido, gerando um comprometimento inaceitável da função anorretal11, além de manter as cadeias linfonodais, que podem estar comprometidas8,25,26. Ao passo que a APR promove um melhor controle local da doença e esvaziamento linfonodal, porém a implica na necessidade de ostomia e, por vezes, resulta em disfunção geniturinária e sexual3,6,8, impactando significativamente na qualidade de vida6, devendo ser considerada nos pacientes em que a excisão local gere o comprometimento da função anorretal, quando há evidência de invasão esfincteriana ou envolvimento linfonodal do mesorreto, em tumores maiores e com maior invasão tecidual, nos casos de recorrência após WLE, ou quando essa apresentar margens comprometidas, sem a possibilidade de extensão da excisão sem gerar tais comprometimentos6,8,11,25,26.
Ainda, alguns estudos sugerem que pode-se guiar a escolha considerando a espessura da lesão de acordo com o índice de Breslow. Em lesões menores de 1mm, realizar excisão local com preservação do esfíncter; lesões entre 1-4mm, excisão local com preservação do esfíncter e margem de segurança de 2cm; lesões maiores do que 4mm ou invasão esfincteriana, APR. No pós operatório, caso o estudo anatomopatológico demonstre margens menores do que 1mm (R1), pode-se repetir a WLE, se viável, ou optar pela APR, a fim de obter uma ressecção com margens livres (R0)17,23.
Não existem evidências do benefício de terapia adjuvante para o melanoma anorretal, seja ela realizada através de quimio ou radioterapia2,11. Os estudos não sugerem impacto na sobrevida desses pacientes, quando realizadas1. Contudo, é citado que a radioterapia neoadjuvante após WLE pode promover um melhor controle local da doença, sugerindo sua realização em tumores maiores do que 4mm, quando viável20, porém sem evidências conclusivas, uma vez que a radioterapia não demonstra efeito terapêutico em si, mas pode ser considerada como tratamento paliativo para tumores irressecáveis2. Portanto, a estratégia pós operatória que tem sido adotada após o procedimento cirúrgico é a vigilância rigorosa e avaliação periódica do paciente, através de proctoscopia, ressonância de pelve e tomografia computadorizada11.
Por conseguinte, associando-se o diagnóstico tardio ao comportamento agressivo dos melanomas anorretais e seu prognóstico ainda muito reservado, com taxa de recorrência local estimada em 37% e 34% para pacientes submetidos a WLE e APR, respectivamente6, a média de sobrevivência dos pacientes varia entre 5-19 meses2, após o diagnóstico e a taxa de sobrevida em 5 anos entre 6-22%, a depender da extensão da lesão no momento do diagnóstico, sendo estimada em 32%, 17% e 0% para doença local, doença com invasão linfonodal e a com presença de metástase1, respectivamente, independentemente da abordagem terapêutica empregada.
5. CONSIDERAÇÕES FINAIS
Relatamos caso de uma paciente de 79 anos, portadora doença de Parkinson avançada, que apresentou-se em ambulatório de coloproctologia com sintomatologia inespecífica e lesão importante de canal anal associada a presença de máculas hipercrômicas, sendo suspeitado o diagnóstico de melanoma anorretal. Após considerar o quadro da paciente e suas condições clínicas, optado pela realização de excisão da lesão para biópsia, sendo confirmado o diagnóstico por análise anatomopatológica e imuno-histoquímica. Em seguimento, constatadas lesões metastáticas avançadas em fígado e pulmão, sem proposta curativa, com progressão rápida e agressiva, tendo a mesma evoluído a óbito após 7 meses da confirmação diagnóstica. Tal apresentação e evolução vai de encontro com os achados bibliográficos.
O melanoma anorretal é uma neoplasia agressiva, de evolução rápida e prognóstico muito reservado, com taxas de recidiva da doença, quando abordada, elevadas e, também, taxas de sobrevivência e sobrevida livre da doença baixas. Sua sintomatologia é inespecífica e o diagnóstico, muitas vezes, realizado de maneira incidental, com o paciente em vigência de doença metastática em mais de metade dos casos.
Dada a sua raridade, não existem estudos prospectivos sobre o tema, tampouco ensaios clínicos, o que inviabiliza, por ora, a definição de uma conduta terapêutica padrão ouro, seja no que tange à intervenção cirúrgica ou tratamento sistêmico neoadjuvante, adjuvante ou paliativo. Com isso, a escolha da técnica cirúrgica a ser utilizada é, usualmente, individual para cada paciente, avaliando o contexto clínico e as vantagens e desvantagens de cada técnica, considerando-se que não existem diferenças estatísticas que tornem uma superior a outra quando se avalia as taxas de recidiva e sobrevida, fato que se justifica pela característica de disseminação sistêmica da neoplasia.
Ainda, também não é proposta classificação específica para estadiamento, sendo esse realizado através de classificações existentes para outras neoplasias de mesmos sítios anatômicos (AJCC/TNM para câncer colorretal e de canal anal) e para mesma neoplasia em sítio diferente (Índice de Breslow para melanoma cutâneo).
O tratamento é individualizado e realizado, comumente, através da WLE ou da APR, sem evidências de superioridade de uma técnica em relação a outra, considerando-se tanto a apresentação clínica do paciente, quanto suas comorbidades associadas, grau da lesão e priorização da sua qualidade de vida no pós operatório. Tendo em vista o fato de que a neoplasia apresenta-se com recidiva sistêmica na maior parte dos casos, o que se traduz em um prognóstico ainda reservado com taxas de sobrevida muito baixas. Não são preconizadas terapias adjuvantes, assim, o seguimento é programado para avaliação constante do paciente e a detecção precoce de recidiva.
Assim, evidencia-se a necessidade de mais relatos e discussões sobre esse tema, quando ele se apresenta na rotina dos médicos coloproctologistas, oncologistas clínicos e cirúrgicos e, também, outros especialistas que realizem o diagnóstico, ainda que incidental, para que seja possível estabelecer uma classificação padronizada e, por conseguinte, uma padronização no tratamento e seguimento dessa neoplasia, afim de otimizar seu prognóstico e, consequentemente, a qualidade de vida dos pacientes diagnosticados com essa patologia.
6. CONCLUSÃO
O melanoma anorretal é uma doença rara, de sintomatologia inespecífica e comportamento agressivo, cujo diagnóstico é realizado, muitas vezes, de maneira incidental e com o paciente em vigência de doença metastática em mais da metade dos casos. O prognóstico ainda é reservado, com taxa de sobrevida variando entre 5 e 19 meses, a depender do grau de disseminação da lesão ao diagnóstico. Não há tratamento específico para esse tumor, sendo esse baseado no controle local da doença e qualidade de vida do paciente, seja por excisão local ampla ou APR, tendo em vista que a disseminação a distância corre independentemente da técnica cirúrgica empregada.
REFERÊNCIAS
1. Husain M, Rashid T, Ahmad MM, Hassan MJ. Anorectal malignant amelanotic melanoma: Report of a rare aggressive primary tumor. J Cancer Res Ther. 2022 Jan-Mar;18(1):249-252.
2. Van Pham B, Kang JH, Phan HH, Cho MS, Kim NK. Malignant melanoma of anorectum: Two case reports. Ann Coloproctol. 2021;37(1):65–70.
3. Mihajlovic M, Vlajkovic S, Jovanovic P, Stefanovic V. Primary mucosal melanomas: a comprehensive review. Int J Clin Exp Pathol. 2012;5(8):739-753.
4. Smith, H. G., Bagwan, I., Board, R. E., Capper, S., Coupland, S. E., Glen, J., … Smith, M. J. F. (2020). Ano- uro-genital mucosal melanoma UK national guidelines. European Journal of Cancer, 135, 22–30. doi:10.1016/j.ejca.2020.04.030
5. Carcoforo P, Raiji MT, Palini GM, Pedriali M, Maestroni U, Soliani G, et al. Primary anorectal melanoma: An update. J Cancer. 2012;3(1):449–53.
6. Jutten E, Kruijff S, Francken AB, Lutke Holzik MF, van Leeuwen BL, van Westreenen HL, et al. Surgical treatment of anorectal melanoma: a systematic review and meta-analysis. BJS open. 2021;5(6).
7. Cavalcanti NF, Marques AG, Regadas SMM, Mont’Alverne RED, Varela LBMM, Silva RR da, et al. Melanoma anal: relato de caso raro e revisão de literatura. Vol. 60, Revista de Medicina da UFC. 2020. p. 39–44.
8. Bleicher J, Cohan JN, Huang LC, Peche W, Pickron TB, Scaife CL, et al. Trends in the management of anorectal melanoma: A multi-institutional retrospective study and review of the world literature. World J Gastroenterol. 2021;27(3):267–80.
9. Moore WD. Recurrent melanosis of the rectum after previous removal from the verge of the anus in a man aged sixty-ive. Lancet 1857;1:290-4.
10. Falch C, Stojadinovic A, Hann-Von-Weyhern C, Protic M, Nissan A, Faries MB, et al. Anorectal malignant melanoma: Extensive 45-year review and proposal for a novel staging classification. J Am Coll Surg. 2013;217(2):324–35.
11. Smith, H. G., Glen, J., Turnbull, N., Peach, H., Board, R., Payne, M., … Smith, M. J. F. (2020). Less is more: A systematic review and meta-analysis of the outcomes of radical versus conservative primary resection in anorectal melanoma. European Journal of Cancer, 135, 113–120. doi:10.1016/j.ejca.2020.04.04
12. Kahl AR, Gao X, Chioreso C, Goffredo P, Hassan I, Charlton ME, et al. Presentation, Management, and Prognosis of Primary Gastrointestinal Melanoma: A Population-based Study. J Surg Res. 2021;260(June 2018):46–55.
13. Gama LRM, Clara RC, da Gama PLAN, Zambom ACS, Ribeiro FLM, Loureiro GJZ, et al. Melanoma of the Anal Canal Simulating Hemorrhoidal Disease. Case Report. Rev Bras Coloproctol. 2010;30(3):360–4. 1.
14. Apostu RC, Stefanescu E, Scurtu RR, Kacso G, Drasovean R. Difficulties in diagnosing anorectal melanoma: A case report and review of the literature. World J Clin Cases. 2021;9(36):11369–81.
15. Kolosov A, Leskauskaitė J, Dulskas A. Primary melanoma of the anorectal region: clinical and histopathological review of 17 cases. A retrospective cohort study. Color Dis. 2021;23(10):2706–13.
16. Bohan S, Ramli Hamid MT, Poh KS, Chow TK, Chan WY. Primary anorectal malignant melanoma: A clinical, radiology and pathology correlation. Malays J Pathol. 2020;42(3):461–7.
17. Fillmann LS, Fillmann ÉEP, Fillmann HS, de Oliveira JK, Parizotto JFB, Scolaro BL, et al. Anorectal melanoma: Review of diagnosis and treatment based on a case report. J Coloproctology. 2012;32(1):84–8.
18. Alsharif NM, Omeish H, Abdulelah M, Abu-Rumaileh MA, Bader H. Anorectal Melanoma: An Uncommon Cause of Lower Gastrointestinal Bleeding. Cureus. 2021;45(8):13–6.
19. Xu X, Ge T, Wang G. Primary anorectal malignant melanoma: A case report. Medicine (Baltimore). 2020;99(5):e19028.
20. Carvajal ARD, Hamid O, Ariyan C. Locoregional mucosal melanoma : Epidemiology , clinical diagnosis , and treatment. 2022; In S. Lee (Ed.), UpToDate. Acessado em maio 16, 2022, disponível em <https:// www.uptodate.com/contents/locoregional-mucosal-melanoma-epidemiology-clinical-diagnosis-and- treatment>.
21. Amin MB, Edge S, Greene F, Byrd DR, Brookland RK, Washington MK, Gershenwald JE, Compton CC, Hess KR, et al. (Eds.). AJCC Cancer Staging Manual (8th edition). Springer International Pulishing: American Joint Commission on Cancer; 2017.
22. Noncutaneos Melanoma. Jeffrey E. Scott and Meg R. Gerstenblith (Editors). Codon Publications, Brisbane, Australia. ISBN: 978-0-9944381-5-7;
23. Ottaviano M, Giunta EF, Marandino L, Tortora M, Attademo L, Bosso D, et al. Anorectal and Genital Mucosal Melanoma: Diagnostic Challenges, Current Knowledge and Therapeutic Opportunities of Rare Melanomas. Biomedicines. 2022;10(1):1–21.
24. Nusrath S, Thammineedi SR, Patnaik SC, Raju KVVN, Pawar S, Goel V, et al. Anorectal Malignant Melanoma—Defining the Optimal Surgical Treatment and Prognostic Factors. Indian J Surg Oncol. 2018;9(4):519–23.
25. Wang M, Zhang Z, Zhu J, Sheng W, Lian P, Liu F, et al. Tumour diameter is a predictor of mesorectal and mesenteric lymph node metastases in anorectal melanoma. Color Dis. 2013;15(9):1086–92.
26. Yeung H-M, Gupta B, Kamat B. A Rare Case of Primary Anorectal Melanoma and a Review of the Current Landscape of Therapy. J Community Hosp Intern Med Perspect. 2020;10(4):371–6.
27. Parra RS, de Almeida ALNR, Badiale GB, da Moraes MMFS, Rocha JJR, Féres O. Melanoma of the anal canal. Clinics. 2010;65(10):1063–5.
28. Hossne RS, Prado RG, Bakonyi Neto A, Denardi Junior E, Ferrari A. Melanoma anorretal: relato de 2 casos e revisão da literatura. Rev Bras Coloproctol. 2007;27(3):317–21.
29. Charifa A, Zhang X. Morphologic and Immunohistochemical Characteristics of Anorectal Melanoma. Vol. 26, International Journal of Surgical Pathology. 2018. p. 725-9.
