REGISTRO DOI: 10.69849/revistaft/ar10202410271013
Gustavo Kutscher Ulguim¹, Raimundo Marcel Gomes Praciano²; Murilo Gabriel Consolim³, Fabio Yuji Shibuya⁴, Flávia Constância de Los Santos de Camargo⁵, Marjane Maciel Correa⁶, Ana Caroline Freitas Caetano de Sousa⁷, Daniel Curvello de Mendonça⁸, Paulo Dilkin⁹, Helton Fernandes dos Santos¹⁰.
Resumo
As deformidades angulares em aves podem ter diversas origens, desde agravos nutricionais, genéticos ou patológicos. Como exemplo, a perose é uma patologia observada nos tendões do músculo gastrocnêmio em aves e sua ocorrência geralmente é relacionada à nutrição durante os primeiros meses de vida. Além disso, interações genéticas entre parentes, ou endogamia, já são relatadas como essencialmente importantes para manifestação de genes deletérios e produção de anomalias morfofisiológicas. Foi acompanhada uma propriedade no município de Santa Maria (RS) onde diferentes gerações de cisne-negro (Cygnus atratus) apresentaram graus variados de deformidades angulares em membros pélvicos durante o período de um ano. Diferentes metodologias, procedimentos clínicos e cirúrgicos foram empregados no tratamento dos pacientes. Esse busca relatar possíveis fatores que possam ter influenciado na ocorrência da patologia durante o período acompanhado, trazendo as alterações necessárias recomendadas para a propriedade a fim de evitar a incidência de novos casos e comparado às metodologias utilizadas para terapêutica e seus resultados.
Palavras-chave: Perose.Cygnus atratus.Fisioterapia.Cirurgia.
INTRODUÇÃO
O cisne-negro (Cygnus atratus, Latham,1790) é uma ave anseriforme da família Anatidae, originário da Austrália (Mullarney et al., 2003). Em estado natural, possuem uma alimentação estritamente vegetariana composta de plantas aquáticas e pastagem, este especialmente quando alagado (Kouzov et al., 2024) utilizando o aparelho filtrador do bico e língua (Cubas et al., 2014). Possuem hábitos migratórios e não possuem um período do ano específico para reprodução, desde que as condições sejam favoráveis para tal (Coleman, 2014). Um diferencial dessa espécie de cisne é o hábito social, produzindo colônias na maioria das vezes, contudo, podem torna-se muito territorialistas caso não haja espaço suficiente para cuidar das crias (Kim et al., 2023). A espécie encontra-se na IUCN Red List, desde 2018 (IUCN, 2018).
A domesticação do cisne negro começou na Nova Zelândia por volta de 1860, originalmente para o controle de plantas aquáticas, posteriormente sendo criado para uso esportivo e ornamental em várias regiões do mundo (Bimler, 1983). Atualmente no Brasil o cisne negro é o único cisne listado na lista de fauna considerada doméstica pela legislação ambiental brasileira (IBAMA, 1998).
Pela dificuldade de encontrar rações comerciais de ampla produção específicas para as aves aquáticas, comumente os proprietários usam rações projetadas para aves de corte para anseriformes, no entanto essas aves criadas em cativeiro possuem demandas nutricionais muito específicas, e as rações de aves industriais possuem em sua composição altos níveis energéticos e proteicos (Bellaver, 2003; Schmidt & Silva, 2018), que são desconforme à espécie, podendo levar a enfermidades como a perose (Cubas et al., 2014).
Com isso, o presente trabalho tem como objetivo relatar casos de desvios angulares em Cisnes-negros (C. atratus), criados no sul do Brasil, relatando o conjunto de ações clínicas, relatórios de imagem e medidas posteriores para identificação e controle do agravo.
RELATO DE CASO
Caso Clínico:
Foram encaminhados ao Laboratório Central de Diagnóstico de Doenças Aviárias (LCDPA) da Universidade Federal de Santa Maria (UFSM) em outubro de 2021 um espécime de Cisne-negro (Cygnus atratus) de três meses de idade e pesava cerca de 0,860kg e dois meses após, uma fêmea com quatro meses de idade e 2,44kg.
Na anamnese os animais apresentavam claudicação nos membros posteriores, inflamação nas articulações tíbio-társicas, com aumento de temperatura e rubor. Os exames físicos não indicavam demais alterações dos padrões fisiológicos. Na anamnese do primeiro paciente foi informado que a alimentação oferecida consistia de gramíneas à pasto, ração inicial para frangos de corte, milho e couve picada.
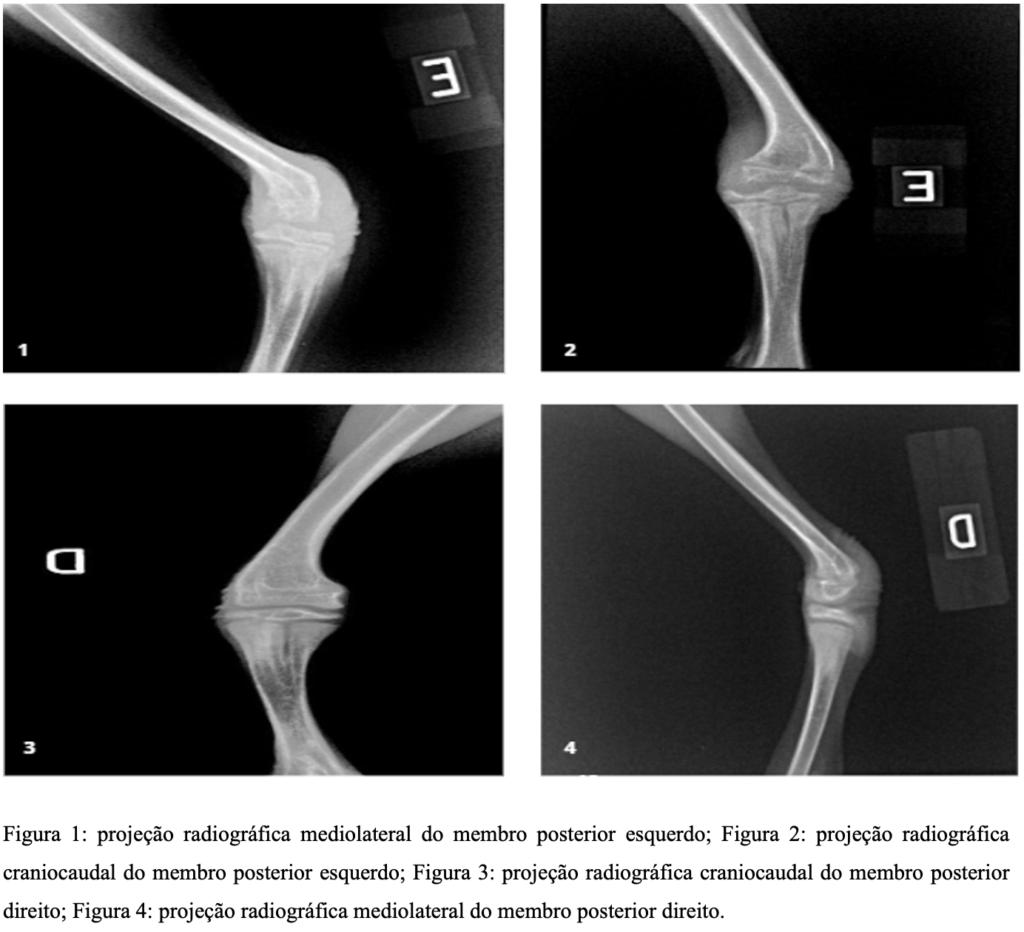
O primeiro cisne (C1) foi encaminhado para o Setor de Diagnóstico por Imagem do Hospital Veterinário Universitário da UFSM, onde foi realizado estudo radiográfico, que evidenciou doença articular degenerativa em membros posteriores. Foram obtidas projeções mediolateral e craniocaudal do membro esquerdo sendo observado aumento de radiopacidade dos espaços articulares e irregularidade da cortical óssea com desvio medial da porção distal do fêmur. Os tecidos moles adjacentes apresentaram aumento de volume severo e também da radiopacidade.
O animal não conseguia movimentar adequadamente os membros devido ao desconforto causado pela artrose, onde a impressão diagnóstica da região tibiotársica esquerda, afirma insuficiência ligamentar e deficiência nutricional, não podendo descartar artrite erosiva. Ainda foi possível notar a presença de linhas fisárias compatíveis com paciente jovem e demais estruturas ósseas dentro da normalidade. As projeções das figuras 1, 2, 3 e 4, indicam as alterações do C1.
Durante a internação dos animais o protocolo terapêutico consistiu na administração de meloxicam (0,2%) na dose de 0,5mg/kg durante sete dias, sulfato de condroitina na dose de 250mg/dia e enrofloxacino (10%) na dose de 15mg/kg por 7 dias. As aves receberam tratamento fisioterapêutico durante a internação. Devido ao menor tamanho do cisne (C1), foi possível suspendê-lo em tecidos para evitar o sobrepeso nos membros e auxiliar na recuperação, conforme mostrado na figura 5. Foi optado por manter o cisne (C2) em decúbito esternal, conforme demonstrado na figura 6. Os pacientes C1 e C2 receberam alta no 15º dia e 7º dia, respectivamente, após o tratamento clínico e medicamentoso.


Caso cirúrgico
Em fevereiro de 2023 um novo cisne (C3) do mesmo plantel com sete meses de idade, macho e 2.650 kg foi trazido ao LCDPA. Foi relatado a incapacidade de locomoção, sendo encaminhado ao Setor de Diagnóstico por Imagem da UFSM. O laudo dos exames indicou na articulação esquerda, diminuição da densidade óssea, incongruência da articulação tíbio-társica com aumento de radiopacidade dos espaços articulares e irregularidade da cortical óssea com discreto desvio medial da porção distal da tíbia.
Desta vez ocorreu o encaminhamento para correção cirúrgica no Hospital Veterinário Universitário da UFSM. No exame de triagem pré-anestésico, a ave apresentava caquexia e sarcopenia de moderada a severa em diversos grupamentos musculares. Seus parâmetros vitais foram: frequência cardíaca de 204 bpm, frequência respiratória de 19 mpm e temperatura cloacal de 40,1°C. Após o exame físico, foi realizada coleta de sangue e enviada ao Laboratório de Patologia Clínica Veterinária (LaCVet) da UFSM para realização de exame bioquímico e hemograma. Os resultados demonstraram valores condizentes aos de referência para animais hígidos dessa espécie.
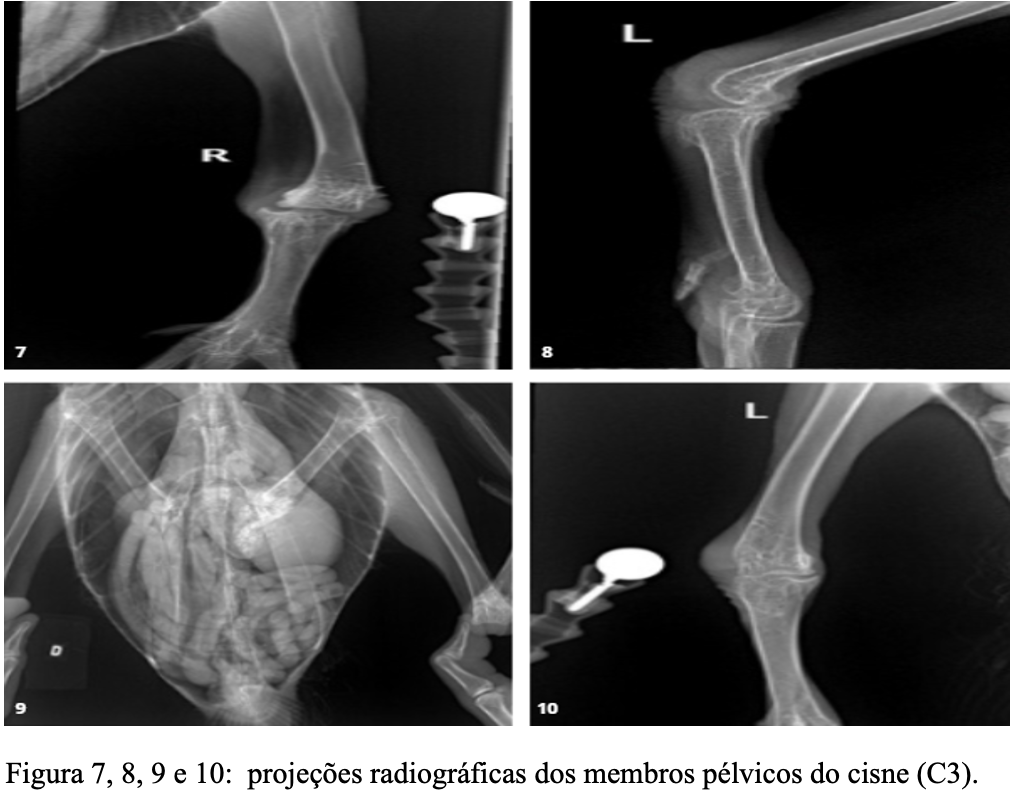
O paciente foi encaminhado para realização de estudo radiográfico pré cirúrgico, onde foram registradas as imagens dos membros posteriores. Houve discreto deslocamento cranial do tarso em relação a tíbia e diminuição do espaço articular. Os tecidos moles adjacentes estavam com aumento de volume e aumento de radiopacidade. A articulação direita apresentou diminuição da densidade óssea, incongruência e aumento do espaço da articulação tíbio-társica, com aumento de radiopacidade e discreto desvio medial da porção distal da tíbia. Os tecidos moles adjacentes estavam com aumento de volume e aumento de radiopacidade, conforme figura 7,8, 9 e 10.
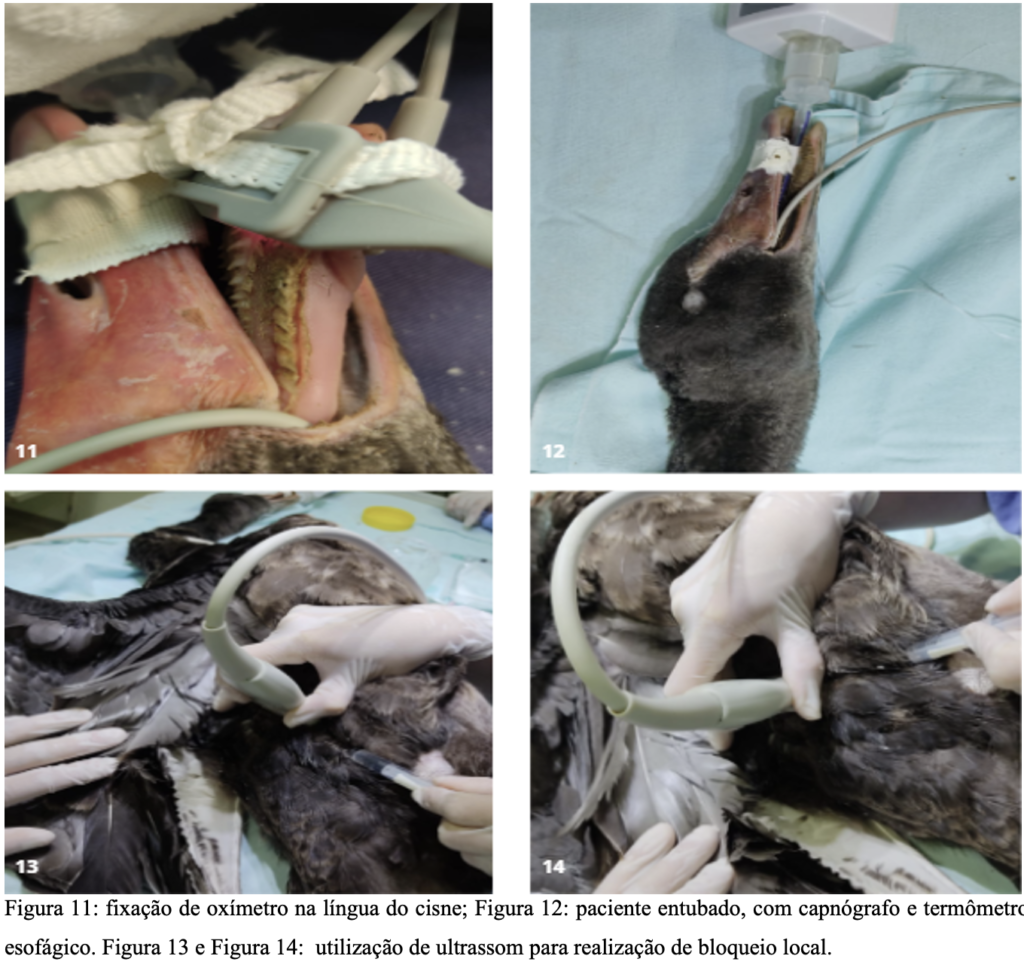
O animal foi submetido a jejum pré-cirúrgico. A medicação pré-anestésica foi administrada via intramuscular no músculo peitoral, consistindo em butorfanol (1 mg/kg), midazolam (2 mg/kg) e cetamina (25 mg/kg). Após 10 minutos, observou-se os efeitos da pré-medicação, incluindo letargia, redução do nível de consciência e diminuição dos movimentos das asas. O animal foi então pré-oxigenado por 5 minutos através de máscara facial com oxigênio 100% antes de iniciar a indução com isoflurano (3,5%) também via máscara facial, até que os reflexos palpebrais fossem reduzidos e ocorresse relaxamento total, permitindo a abertura do bico. A intubação foi realizada com uma sonda endotraqueal de tamanho 2,5 sem cuff (figura 11 e figura 12). Para insensibilização do membro, foi realizada a técnica de bloqueio guiado por ultrassom nos plexos femoral e isquiático utilizando lidocaína, na dose de 2mg/kg (figura 13 e figura 14).
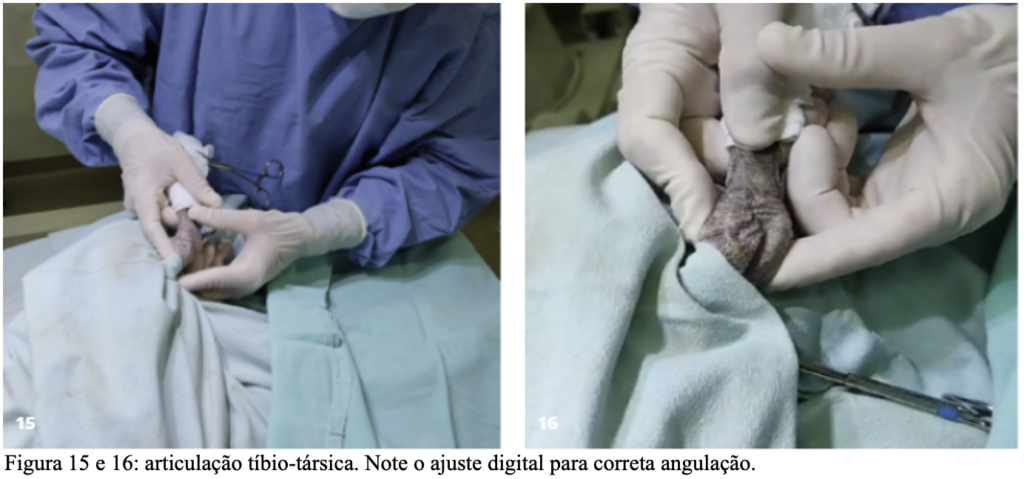
Após a manobra de antissepsia sobre a articulação tíbio-társica (figura 15) e a incisão sob a tróclea tibial lateral (figura 16), foi feita a aplicação de um parafuso ortopédico cortical de 2mm, tamanho 14. Foi feita a passagem de fio de propileno 1 à 20mm no sentido látero-medial da tróclea tibial pelo tendão gastrocnêmio, retornando de médio para lateral, englobando o tendão. Feita a passagem do fio pelo parafuso, formou-se dispositivo de sutura “parafuso-tendão”, fazendo o retorno do tendão ao centro da tróclea tibial. Após a oclusão do fio de sutura foi realizado o teste de estabilidade (luxação-negativo) e realizada a sutura do tecido subcutâneo com fio PDX 3-0 padrão “zig-zag” e sutura de pele com o mesmo fio no padrão colchoeiro em cruz. Em seguida foi realizado o mesmo procedimento no membro contralateral. Como complicações transoperatórias foram encontrados foco hemorrágico nas incisões, controlados através de ligaduras e suturas hemostáticas.
Visita a propriedade após os tratamentos
Quatro meses após o processo cirúrgico foi realizada uma visita à propriedade com intuito de avaliar a condição atual dos cisnes após as mudanças realizadas no manejo, principalmente em relação à alimentação. Ao todo foram avaliados nove animais, de quatro gerações diferentes. Foi informado à equipe veterinária que o casal original, Cm1 e Cf1, veio de um mesmo criador, podendo haver grau endogâmico entre eles. Foram avaliados dois animais que formaram casal, sendo o macho (Cm2) e fêmea (Cf2), estes atualmente com três anos e meio de vida. Estes são irmãos de ninhadas diferentes dos primeiros cisnes a serem atendidos e relatados, C1 e C2.Também foram observados um casal de dois anos e meio (Cm3 e Cf3), que ainda não reproduziram, um macho com uma no de idade (C4), uma fêmea com um ano e meio de idade (C5) e três filhotes com três meses de idade.
O casal formado pelas aves Cm1 e Cm2 são a base genealógica de todos os outros animais. No esquema ilustrativo a seguir é possível observar as conexões geracionais.
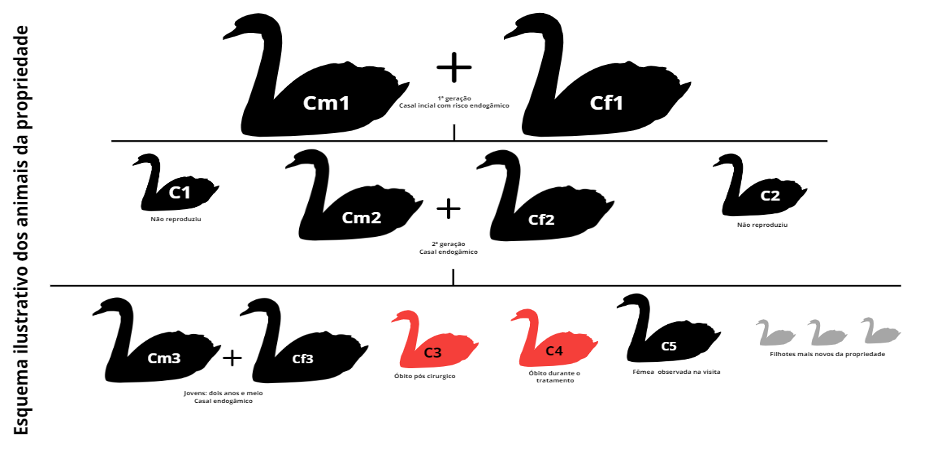
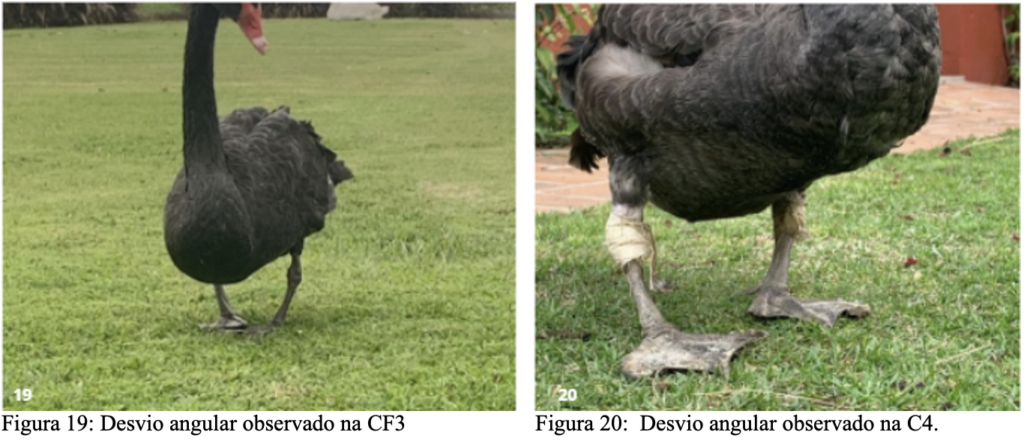
A Cf3 apresentou desvio angular no membro esquerdo devido a articulação tíbio-társica que apresentava aumento da mobilidade articular, sendo recomendado um manejo nutricional mais cuidadoso nesse indivíduo para evitar ganho de peso e consequente agravação do quadro. O C4 apresentou alto grau de claudicação, desvio angular em ambos os membros pélvicos, com inflamação nas articulações tíbio-társicas, sendo que o membro esquerdo estava com maior desenvolvimento da inflamação, esta que se apresentava com elevação de temperatura acentuada. Além das alterações articulares o espécime apresentava pododermatite nos pés.
O tratamento recomendado para esse animal (C4) foi de administração de meloxicam (0,2%) na dose de 0,5mg/kg por cinco dias, cloridrato de condroitina 0,3mg/g, vitamina B12 por quatorze dias enrofloxacino (10%) na dose de 15mg/kg por 10 dias . Associado, foi recomendado um protocolo fisioterápico similar ao realizado no primeiro cisne (C1). Após cinco dias, o animal perdeu a capacidade de se apoiar usando o membro pélvico esquerdo e foi encaminhado para o HVU, onde foi internado. Para evitar sobrecarga nos membros, o indivíduo foi suspenso e iniciou a fisioterapia recomendada, incluindo exercícios uma esteira aquática. A cirurgia para correção dos distúrbios foi agendada, mas o animal veio a óbito antes de poder realizar o procedimento.
Segunda visita à propriedade
Após o óbito do C4, foi realizada uma nova visita à propriedade com intuito de informar o prognóstico dos animais. Foi relatado que um dos filhotes do plantel já começava a apresentar problemas articulares nos membros pélvicos, sendo orientado a administração de condroitina e vitamina B12 nesse período, junto com a utilização de técnicas fisioterápicas para evitar o aprofundamento do quadro clínico.
DISCUSSÃO
Fatores ligados à nutrição e genética
Desde o primeiro paciente foi recomendada adequação alimentar, evitando o desenvolvimento de problemas articulares futuros. Entretanto, mesmo com as alterações feitas na dieta, a incidência de animais afetados não reduziu, sendo assim levantada a possibilidade de fatores genéticos não isolados, sendo importantes também os critérios como peso e atividades, conforme sugerido Bradshaw et al., (2002) para aves industriais.
Por mais que os fatores de distúrbios angulares ainda não estejam totalmente elucidados, inúmeros trabalhos com frangos de corte demonstram forte relação nutricional e genética, correlacionando o agravo à condições de fornecimento em excesso ou em déficit ( Tang et al., 2020). Dietas com teor protéico acima de 17%, apresentam risco para criações de cisnes, assim como dietas ricas em cálcio, e pobres em colina, manganês, ácido fólico, niacina, piridoxina e pantotênico (Olsen 1994; Cubas et al., 2014). Para as aves relatadas nesse trabalho, a dieta fornecida possuía, em média, acima de 20% de proteína.
Por sua vez, a suplementação excessiva de cálcio provoca a ineficiência da absorção de manganês, gerando alterações nos ossos e tecidos conjuntivos adjacentes, visto que esse mineral é essencial na formação óssea e na manutenção de tecidos conjuntivos (Olgun, 2017). Como exemplo, a perose decorrente da carência de manganês costuma ocorrer antes das duas semanas de vida do filhote (Wallach & Boever, 1983).
A perose é um distúrbio multifatorial caracterizado por alterações nos membros pélvicos das aves causado por afecção do tendão do músculo gastrocnêmio, podendo causar deslocamento de tendão, alongamento do jarrete, deformidades dos ossos társicos e luxação medial do tendão calcâneo (Olsen, 1994), muitas vezes associado com deficiências e desbalanço de minerais como o manganês (Macari et al., 2002; Cupertino et al., 2005 ; Sakomura et al., 2014).
Waldenstedt (2006) elucida que dietas inadequadas para aves jovens pode provocar problemas de rápido crescimento como discondroplasias, deformidades angulares, além de desvios em articulação tibio-társica, tanto pela carência quanto pelo excesso. Trabalhos que versem sobre questões articulares em anatídeos relatam torções articulares, como o exemplo da “asa de anjo”, uma torção na articulação carpal provocada pelo crescimento rápido das penas por dietas inadequadas (Zhu et al., 2021), provocando alterações em anatídeos de várias espécies, incluindo cisnes-negros (Arican et al., 2019).
Foi optado pela administração de condroitina e vitamina B12 como metodologia profilática para os filhotes da propriedade, mas outras metodologias como uso direto de manganês (Sakara et al., 2021), selênio (Wiesner et al., 1979) e biotina (Whitehead, 1977; Steele, Edgar e Doncon, 1984) com diferentes graus de resultados.
Diferentes doenças ósseas com ligações hereditárias são relatadas no reino animal, como osteogênese imperfeita e raquitismo. Essas alterações são monogênicas, ou seja, causadas por alterações em um único gene (Marini et al., 2017; Haffner et al., 2019; Ralston & Gaston 2020). A maioria dos casos de osteogênese imperfeita é resultante de alterações nos genes COL1A1 e COL1A2, responsáveis pela codificação do colágeno tipo 1, sendo essa alteração resultado de uma herança autossômica dominante, mas outros casos de osteogênese imperfeita podem ser resultados de alterações causadas em outros genes (Marini et al., 2017; Ralston & Gaston, 2020). O raquitismo pode ser influenciado por alterações nas vias metabólicas da vitamina D, no receptor de vitamina D e na concentração de fosfato no sangue (Rupee, 2017; Haffner et al., 2019).
O segundo paciente apresentou redução de claudicação ao caminhar após o tratamento terapêutico. O animal recuperou a capacidade de apoiar o membro e se locomover. Cubas et al., (2014) relata que há maiores chances na recuperação de desvio angulares em animais jovens, quando optado por métodos não cirúrgicos. Mesmo com aproximadamente 4 meses de vida, foi possível reduzir os agravos da condição.
Tratamento cirúrgico e exames complementares
O cisne (C3) que foi levado à cirurgia teve prognóstico pós cirúrgico reservado. Após o tutor retornar o animal à propriedade, relatou dificuldade do mesmo para se alimentar, demonstrando fraqueza ao tentar se levantar e consequentemente acabou vindo a óbito cerca de duas semanas após a cirurgia. Incapacidade de correção cirurgica em alguns casos é citado na literatura (Ritchie, Harrison e Harrison., 1994) e a eutanasia pode ser uma opção avaliada (Pryianka et al., 2018).
As deformidades angulares apresentadas pelos cisnes (C8 e c8) são relatadas acometendo uni ou bilateralmente e conhecidas como valgus, quando a inclinação é lateral ou varus, quando é medial (Tang et al., 2020), afetando um grande número de aves de rápido crescimento por questões nutricionais ou anomalias genéticas, relatadas em aves de produção (Gonzales & Mendonças JR, 2006) e causando anomalias articulares em anatídeos (Zsivanovits et al., 2006; Pitman et al., 2012).
A citologia aspirativa por agulha fina (CAAF) do primeiro cisne indicou aumento de células inflamatórias no local, de acordo com o relatado por Li et al., (2022), que não somente descreveu o processo inflamatório em condições de valgus-varius, como demonstrou a degeneração em frangos. O animal suspenso recebeu protocolo medicamentoso além de fisioterapia Scott (2020), auxiliada por dessensibilização neurossensorial (Klos,2020) compressão das articulações com gelo (Jericó et al. 2015), estímulo ao nado e estímulo à caminhada e passeio, auxiliando na recuperação da ave (Prydie & Hewitt, 2015).
Avaliação do plantel in locu
Durante a visita à propriedade foi informado que além da mudança alimentar realizada anteriormente a quantidade de comida oferecida havia sido reduzida, principalmente para filhotes, com intuito de evitar o crescimento excessivo e consequente lesão das articulações. (Guo et al., 2019), além da avaliação geral dos cisnes do plantel. O casal original foi comprado de um mesmo produtor, assim havendo possibilidade de relação familiar entre eles. O casal 1 (Cm2 e Cf2) é composto por animais irmãos, assim o casal 2 (Cm3 e Cf3), que além de serem irmãos são a segunda linhagem vinda de cruzamentos consanguíneos.
Foi aconselhado aos proprietários que não deixassem eles gerarem filhotes, visto que a chance de produzir animais com doenças genéticas aumenta em cada geração de cruzamentos consanguíneos (Charlesworth & Willis 2009 ; Kardos et al., 2023). Foi recomendado que para futuras gerações sejam introduzidos novos animais vindos de outro produtor, para aumentar a variabilidade genética no bando, sendo essencialmente importante para a saúde geral do plantel, principalmente em criações cativas (Speak et al., 2024).
O casal 1 (Cm2 e Cf2) não possuía alteração morfisiológica perceptível ao exame visual e palpação. O macho do casal 2 (Cm3) possuía leve desvio angular no membro pélvico, mas a claudicação era sútil quando andando em curvas, e não perceptível andando em linha reta. Os três filhotes de dois meses avaliados foram os primeiros a receber a nova dieta para evitar ganho de peso excessivo, não apresentando alterações nos membros pélvicos perceptíveis ao exame visual e palpação durante a primeira visita, sendo o controle alimentar resolutivo nesse caso.
O animal registrado como C4, após 5 dias de medicação e a primeira sessão de fisioterapia, não resistiu e veio óbito antes de poder concluir o tratamento e realizar a cirurgia marcada para correção do desvio angular e pododermatite, apresentando um avanço de gravidade do quadro mais rápido quando comparado aos cisnes tratados anteriormente.
CONSIDERAÇÕES FINAIS
Inicialmente os pacientes foram diagnosticados com base nas lesões e no histórico alimentar que indicavam quadros já descritos na literatura de perose, conforme mais pacientes afetados foram surgindo mesmo com a melhora da nutrição oferecida, novos fatores foram avaliados na persistência do quadro clínico, sendo o cruzamento consanguíneo um dos possíveis causadores desse agravo. Ninhadas de pais com históricos de problemas ósseos apresentaram maior incidência quando comparado com as ninhadas iniciais da propriedade.
Caso um alelo genético seja responsável pela predisposição à doença óssea, a possibilidade de um animal desenvolver a doença é amplificada sendo oriundo de cruzamento consanguíneo. Caso o alelo seja recessivo, a ocorrência de homozigose se torna mais recorrente visto que ambos os pais são portadores do gene a probabilidade de gerar uma prole doente se torna 25% (Neto et al., 2020). Sendo um alelo dominante a chance aumenta para 75%.
A pouca variabilidade genética é fator limitante, entretanto, cruzamentos endogâmicos de primeiro grau são contraindicados. Fatores nutricionais são essenciais para as criações e novos estudos com relação aos requerimentos nutricionais dessa espécie devem ser publicados. Quanto mais rápido diagnosticar e intervir, melhor o prognóstico do paciente em relação ao agravo da deformação e desenvolvimento de pododermatite (Azmantis, Wernick e Hatt., 2014) Além dos problemas nas pernas, consanguinidade predispõe outras alterações fisiológicas e anatômicas reduzindo a qualidade de vida dos animais resultantes dos cruzamentos.
REFERÊNCIAS
KOUZOV, S.A, et al. Ecological and phylogenetic aspects of the spring diet of three palaearctic species of swans.BMC Ecol Evo, 24, 17 (2024). Disponível em: https://doi.org/10.1186/s12862-024-02204-7. Acesso em 10 de agosto de 2024.
CUBAS, Z.S., SILVA, J.C.R., CATÃO DIAS, J.L. Tratado de animais selvagens: medicina veterinária. São Paulo: Roca. 2014. 5054 p. v. 2.
COLEMAN, J. Breeding biology of the Black Swan Cygnus atratus in southeast Queensland, Australia. Wildfowl, [S.l.], p. 217–230, Nov. 2014. ISSN 2052-6458. Available at: <https://wildfowl.wwt.org.uk/index.php/wildfowl/article/view/2593/1712>. Date accessed: 15 Oct. 2024.
KIM, J.-H. et al. Winter breeding of black swan Cygnus atratus in a solar greenhouse with a water pond. Animal Reproduction Science, p. 107199, fev. 2023. Available at: <https://doi.org/10.1016/j.anireprosci.2023.107199>. Date accessed: 05 Oct. 2024.
BirdLife International. 2018. Cygnus atratus. The IUCN Red List of Threatened Species 2018: e.T22679843A131907524. Available at: <https://dx.doi.org/10.2305/IUCN.UK.2018-2.RLTS.T22679843A131907524.en.>. Date accessed: 05 Oct. 2024.
BIMLER, A. M. The behavioural ecology of the population of black swan (Cygnus atratus Latham) on a Manawatu dune lake. Doctor of Philosophy in Zoology at Massey University. Disponível em: <http://hdl.handle.net/10179/3547>. Acesso em: 11 jun. 2024.
BRASIL. IBAMA – Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis (IBAMA). Portaria IBAMA nº 93, de 7 de julho de 1998. Diário Oficial da União, Brasília, 7 jul. 1998. Disponível em: <https://www.ibama.gov.br/sophia/cnia/legislacao/IBAMA/PT0093-070798.PDF.>. Acesso em: 15 out. 2024.
BELLAVER, C. Sistemas de produção de frangos de corte – nutrição e alimentação. Janeiro, 2003. Disponível em: <http://sistemasdeproducao.cnptia.embrapa.br>. Acesso em: 02 de Outubro de 2024.
SCHMIDT, N. S.; SILVA, C. L. DA. Pesquisa e Desenvolvimento na Cadeia Produtiva de Frangos de Corte no Brasil. Revista de Economia e Sociologia Rural, v. 56, p. 467–482, 2018. Disponível em: < https://doi.org/10.1590/1234-56781806-94790560307>. Acesso em: 02 de Outubro de 2024.
BRADSHAW, R.H., KIRKDEN, R.D. AND BROOM, D.M. A review of the aetiology and pathology of leg weakness in broilers in relation to their welfare. Avian and Poultry Biology Reviews, 13, 45-103. Available at: <Doi:10.3184/147020602783698421>. Date accessed: 05 Oct. 2024.
Tang, H., et al. Integrative Analysis of Long Non-Coding RNA and mRNA in Broilers with Valgus-Varus Deformity. Plos One. Available at: <doi:10.1371/journal.pone.0239450>. Date accessed: 05 Oct. 2024.
OLSEN, J.H., 1994. Anseriformes, In:, BRANSON, W. R. , HARRISON, G. J. ,HARRISON L. R. (eds), Avian Medicine: Principles and Applications, (Wingers Publishing: Florida), p.1257–1258.
OLGUN, O. Manganese in poultry nutrition and its effect on performance and eggshell quality. World’s Poultry Science Journal, v.73, p.45-56, 2017. Available at: <DOI:10.1017/S0043933916000891>. Date accessed: 02 Oct. 2024.
WALLACH, Joel D.; BOEVER, William J. Diseases of exotic animals. Medical and surgical management. 1983.
MACARI, M., R. L. FURLAN, and E. GONZALES. 2002. “Fisiologia aviária aplicada a frangos de corte”. 2 ed. Jaboticabal: FUNEP/UNESP.
CUPERTINO, E.S. et al. Exigências de manganês para frangos de corte nas fases de crescimento e terminação. Revista Brasileira de Zootecnia, v.34, p.2308-2315, 2005. Disponível em: <https://doi.org/10.1590/S1516-35982005000700017 >. Acesso em: 01. Out. 2024.
SAKOMURA, N.K. et al. Nutrição de não ruminantes. 1. ed. Jaboticabal: Funep, 2014.
WALDENSTEDT, Lotta. Nutritional factors of importance for optimal leg health in broilers: A review. Animal feed science and technology, v. 126, n. 3-4, p. 291-307, 2006. Available at: <https://doi.org/10.1016/j.anifeedsci.2005.08.008>. Date accessed: 02 Oct. 2024.
ZHU, X. et al. Incidence rate of angel wing and its effect on wing bone development and serum biochemical parameters in geese. Poultry Science, v. 100, n. 11, p. 101450, nov. 2021.
Available at: <https://doi.org/10.1016/j.psj.2021.101450>. Date accessed: 04 Oct. 2024.
ARICAN,M. et al. Angel Wings Syndrom in Swans (Cygnus cygnus and Cygnus atratus). Kafkas Üniversitesi Veteriner Fakültesi Dergisi , vol. 25, no.6, pp.873-877, 2019. Available at: < DOI : 10.9775/kvfd.2019.21995>. Date accessed: 04 Oct. 2024.
MARINI JC, et al. Osteogenesis imperfecta. Natural Reviews Disease Primers. 2017 Aug 18. Available at: <doi: 10.1038/nrdp.2017.52. PMID: 28820180>. Date accessed: 10 Oct. 2024.
HAFFNER, D. et al. Clinical practice recommendations for the diagnosis and management of X-linked hypophosphataemia. Nature Reviwes Nephrology. 15, 435–455 (2019). Available at: <DOI: 10.1038/s41581-019-0152-5>. Date accessed: 05 Oct. 2024.
RALSTON SH ; GASTON MS. Management of Osteogenesis Imperfecta. Frontiers Endocrinology. 2020, Feb 11;10:924. Availabe at:<doi: 10.3389/fendo.2019.00924>. Date acessed: 04 oct.2024.
RUPPE MD.et al. X-Linked Hypophosphatemia. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2021. Availabe at: <https://www.chop.edu/conditions-diseases/x-linked-hypophosphatemia-xlh>. Date accessed: 04 oct.2024.
GONZALES E; MENDOÇA JR. CX. Problemas locomotores em frangos de corte. VII Simpósio Brasil Sul de Avicultura. Chapecó, SC – Brasil. Anais. 79-94, 2006.
ZSIVANOVITS et al. Bilateral valgus deformity of the distal wings (Angel Wing) in a Northern Goshawk (Accipiter gentilis). Journal Avian Medicine and Surgery., 20 (2006), pp. 21-26. Availabe at: < https://www.jstor.org/stable/40236516>. Date accessed: 05 Oct. 2024.
PITMAN et al. Bost Incidence of wing deformities (‘Angel Wing’) among Masked Boobies at Clipperton island: life history consequences and insight into etiology. The Wilson Journal of Ornithology. 124 (2012), pp. 597-602. Availabe at:<https://www.chop.edu/conditions-diseases/x-linked-hypophosphatemia-xlh>. Date accessed: 04 oct.2024.
LI, J. et al. Valgus-varus deformity induced abnormal tissue metabolism, inflammatory damage and apoptosis in broilers. British Poultry Science, v. 64, n. 1, p. 26–35, 14 set. 2022. Available at: <DOI: 10.1080/00071668.2022.2121640>. Date accessed: 04 oct.2024.
SCOTT, D. E. Raptor medicine, surgery, and rehabilitation. 3ed. Wallingford, Boston: CAB International, 2020, 360 p.
KLOS, T.B. Fisioterapia e reabilitação animal na medicina veterinária. Pubvet, v. 14, p. 148, 2020. Disponível em :<DOI: https://doi.org/10.31533/pubvet.v14n10a669.1-17>. Acesso em: 04 oct.2024.
JERICÓ, M. et al. Tratado de medicina interna de cães e gatos. São Paulo: Grupo Gen – Guanabara Koogan, 2015, p. 82–88.
PRYDIE, D.; HEWITT, I. Practical physiotherapy for small animal practice. Chichester, Iowa: John Wiley & Sons Inc, 2015, 320 p.
GUO, Y. et al. Clinical assessment of growth performance, bone morphometry, bone quality, and serum indicators in broilers affected by valgus-varus deformity. Poultry Science, v. 98, n. 10, p. 4433–4440, 8 maio 2019. Available at: <doi: 10.3382/ps/pez269>. Date access: 01 Oct.2024.
CHARLESWORTH, D.; WILLIS, J. H. The Genetics of Inbreeding Depression. Nature Reviews Genetics, v. 10, n. 11, p. 783–796, nov. 2009. Available at: <DOI: 10.1038/nrg2664>. Date access: 02 Oct. 2024.
KARDOS M et al. Inbreeding depression explains killer whale population dynamics. Natury Ecology & Evolution. 2023 May;7(5):675-686. Available at: <doi: 10.1038/s41559-023-01995-0>. Date access: 01 Oct.2024.
SPEAK, S. A. et al. Genomics‐informed captive breeding can reduce inbreeding depression and the genetic load in zoo populations. Molecular Ecology Resources, 10 maio 2024. Available at: <DOI: 10.1111/1755-0998.13967>. Date access: 01 Oct.2024.
¹Gustavo_ulguim@hotmail.com
111.986.419-40
https://orcid.org/0000-0001-9130-0380
Médico Veterinário graduado pela Universidade Federal de Santa Maria, Santa Maria – RS.
²pracianovet@hotmail.com
050.393.573.54
https://orcid.org/0000-0002-4920-9636
Médico Veterinário graduado pela Universidade Federal Rural do Semi-Árido, Residente em Patologia Aviária, UFSM, Santa Maria – RS.
³muriloconsolim@gmail.com
065.218.039-64
https://orcid.org/0000-0002-1725-0351
Médico Veterinário graduado pela Universidade do Estado de Santa Catarina, Especialista em Anestesiologia Veterinária – UFSM, Santa Maria – RS.
⁴fabioshibuya@hotmail.com
384.296.078-62
https://orcid.org/0000-0001-6769-9715
Médico Veterinário, Graduado pela Universidade de São Paulo, Mestre em Medicina Veterinária Preventiva – UFSM, Santa Maria – RS.
⁵flaviadelossantos04@gmail.com
037.926.420-00
https://orcid.org/0000-0003-4446-0079
Médica Veterinária graduada pela Universidade Federal de Santa Maria, Msc. em Zootecnia e Especialista em Patologia Aviária – UFSM, Santa Maria – RS.
⁶marjanecorrea@gmail.com
051.935.829-58
https://orcid.org/0000-0001-6730-279X
Médica Veterinária formada pela Universidade do Sul de Santa Catarina, Mestranda em Clínica e Cirurgia de Pequenos Animais – UFSM, Santa Maria – RS.
⁷Carolfreitas04@outlook.com
061.166.543-39
https://orcid.org/0000-0001-5883-9704
Médica Veterinária formada pela Universidade Federal Rural do Semi-Árido, Residente em Clínica Médica e Cirúrgica de Animais Silvestres – UFERSA, Mossoró – RN.
⁸mullerdcm@gmail.com.br
086.808.897-84
https://orcid.org/0000-0002-7225-6027
Professor Adjunto da Universidade Federal de Santa Maria – UFSM, Departamento da Clínica de Pequenos Animais – UFSM, Santa Maria – RS.
⁹dilkinvet@gmail.com
https://orcid.org/0000-0003-1299-8114
Professor Adjunto da Universidade Federal de Santa Maria – UFSM, Departamento de Medicina Veterinária Preventiva – UFSM, Santa Maria – RS.
¹⁰Helton.santos@ufsm.br
https://orcid.org/0000-0002-8690-3993
Professor Adjunto da Universidade Federal de Santa Maria – UFSM, Departamento de Medicina Veterinária Preventiva – UFSM, Santa Maria – RS.
