REGISTRO DOI: 10.5281/zenodo.10892665
Jennifer Hummel1
Franciane Bobinski1
RESUMO
Objetivo: Avaliar os mecanismos de ação e as parametrizações dos Campos Eletromagnéticos Pulsados (CEMP) utilizados no tratamento da dor em animais.
Métodos: Foi realizada uma revisão integrativa de artigos sobre a aplicação e mecanismos de ação do CEMP como opção de tratamento da dor em animais. A busca foi realizada na base de dados da MEDLINE (PubMed) no período de 2003 a 2023.
Resultados: Dos 33 artigos localizados, 7 estudos foram incluídos na revisão integrativa, e outros 3 artigos foram incluídos manualmente. Os resultados apontam que o uso de CEMP tem se mostrado eficaz no tratamento da dor em animais, sendo uma possibilidade terapêutica não invasiva, podendo ser relevante sua inclusão no tratamento de animais com dor por distintas etiologias. Os estudos analisados obtiveram resultados significativamente positivos quanto a redução da dor com o uso do CEMP.
Conclusão: A revisão integrativa apresentada neste estudo sugere que os Campos Eletromagnéticos Pulsados podem ser uma opção terapêutica promissora para o tratamento da dor em animais, mas são necessários mais estudos para avaliar sua eficácia e segurança em diferentes espécies animais.
Palavras-chave: Campos Eletromagnéticos, Dor, Animal, Terapia Multimodal.
ABSTRACT
Objective: To evaluate the mechanisms of action and parameterizations of Pulsed Electromagnetic Fields (CEMP) used in the treatment of pain in animals.
Methods: An integrative review of articles on the application and mechanisms of action of CEMP as an option for pain treatment in animals was conducted. The search was conducted in the MEDLINE database (PubMed) from 2003 to 2023.
Results: Of the 33 articles found, 7 studies were included in the integrative review, and another 3 articles were manually included. The results indicate that the use of CEMP has been shown to be effective in the treatment of pain in animals, being a non-invasive therapeutic possibility, and its inclusion in the treatment of animals with pain due to different etiologies may be relevant. The studies analyzed obtained significantly positive results regarding pain reduction with the use of CEMP.
Conclusion: The integrative review presented in this study suggests that Pulsed Electromagnetic Fields may be a promising therapeutic option for the treatment of pain in animals, but more studies are needed to evaluate their efficacy and safety in different animal species.
Keywords: Electromagnetic Fields, Pain, Animal, Multimodal Therapy.
INTRODUÇÃO
Segundo a Associação Internacional do Estudo da Dor (IASP) em sua classificação mais recente define a dor como “uma experiência sensorial e emocional desagradável associada ou semelhante àquela associada a um dano tecidual real ou potencial”. Adicional a esse conceito destaca alguns pontos chave principais, sendo um deles: “a impossibilidade de descrever verbalmente a dor não impede que um indivíduo humano ou não humano experencie a dor”(1). Apesar do conceito estar direcionado para a dor em humanos, é um conceito translacionável para a medicina veterinária, uma vez que animais possuem os mecanismos neurofisiológicos da dor preservados ao longo da evolução(2). Apesar de serem incapazes de verbalizar o que sentem, possuem características comportamentais e expressões faciais que descrevem o grau de envolvimento doloroso que está sendo vivenciado(3), permitindo a avaliação adequada e eficácia de determinado tratamento analgésico.
Ingressam diariamente aos hospitais veterinários diversos pacientes apresentando patologias que cursam com dor. Dependendo da intensidade, localização e duração da dor, que pode ser identificada através de um exame físico detalhado e de uso de escalas de dor apropriadas para cada espécie(3), ocorrem alterações comportamentais que podem afetar não apenas a qualidade de vida do paciente, como também a integridade física do tutor, como por exemplo, presença de agressividade em cães e gatos frente a um quadro doloroso intenso.
Os Campos Eletromagnéticos Pulsados (CEMP) vem sendo utilizados nos últimos anos como tratamento de doenças osteoarticulares e doenças neurológicas(4–6), bem como no tratamento da dor(7) e inflamação(8,9). No entanto, ainda há lacunas a serem estudadas, uma vez que ainda há controvérsia quanto a eficácia, uma vez que o tipo de onda, frequência de pulso, intensidade do campo magnético, podem influenciar na resposta celular, desencadeando estímulos favoráveis ou deteriorantes(10).
A corrente bioelétrica gerada pelos campos eletromagnéticos desencadeia efeitos biológicos nas células. Apesar dessas interações não estarem bem elucidadas, alguns estudos demonstraram que o CEMP pode alterar a atividade celular através da ativação de receptores de membrana e vias de transdução intracelular(11,12), bem como indução de íons livres através da membrana(13), tendo importante efeito sobre a cascata inflamatória(14,15). O mecanismo de ação na célula está relacionado com as características da onda magnética fornecida pelos dispositivos(16). Embora sejam encontrados dispositivos com diferentes formatos de onda, amplitudes, frequência de pulsos e intensidade do fluxo magnético, se aplicam usualmente nos tratamentos clínicos os de baixa frequência e intensidade, que oscilam entre 6 e 500Hz, e 0.1mT e 30mT, respectivamente(17).
O objetivo da presente revisão integrativa é avaliar a eficácia do uso dos CEMP de baixa frequência e intensidade, os mecanismos de ação celular, bem como as parametrizações que vem sendo utilizadas nos estudos em animais para o tratamento da dor, possibilitando a adição desta terapia na abordagem terapêutica multimodal na medicina veterinária.
MATERIAIS E MÉTODOS
Foi realizada uma revisão integrativa de artigos sobre a aplicação e mecanismos de ação do CEMP como opção de tratamento da dor em animais.
Nessa revisão se realizou a busca por artigos científicos publicados no período de 2003 a 2023 na base de dados MEDLINE (PubMed). Os termos de busca foram: ((“Electromagnetic Field” OR “Pulsed Electromagnetic Field”, AND (“Acute Pain” OR “Chronic Pain” OR “Nociceptive Pain” OR “Neuropathic Pain” OR “Pain” OR “Musculoskeletal Pain” OR “Visceral Pain” OR “Nociplastic pain”)).
Os critérios para inclusão dos artigos foram estudos realizados nos últimos 10 anos com animais, que utilizaram CEMP abaixo de 500Hz de frequência e intensidade inferior a 30mT no tratamento da dor, que continham mensuração e avaliação da dor nos animais, e publicados em inglês, espanhol ou português.
RESULTADOS
Dos 33 artigos localizados sob esses critérios de busca, 7 artigos estavam de acordo com os critérios de inclusão (Figura 1) e 26 foram excluídos sob os seguintes critérios: 8 eram artigos de revisão, 1 estudo foi realizado in vitro apenas, 1 estava em idioma ucraniano, 3 estudos remetiam a campos eletromagnéticos emitidos de antenas e wireless, 1 continha apenas mensuração bioquímica sem avaliação da dor dos animais, e 10 estudos foram realizados em humanos e/ou com campos eletromagnéticos de alta ou altíssima frequência. Ao final da seleção, 3 artigos foram adicionados manualmente após a busca devido a relevância e por estarem de acordo com os critérios de inclusão.
Figura I – Fluxograma de elegibilidade dos artigos segundo critérios de busca.
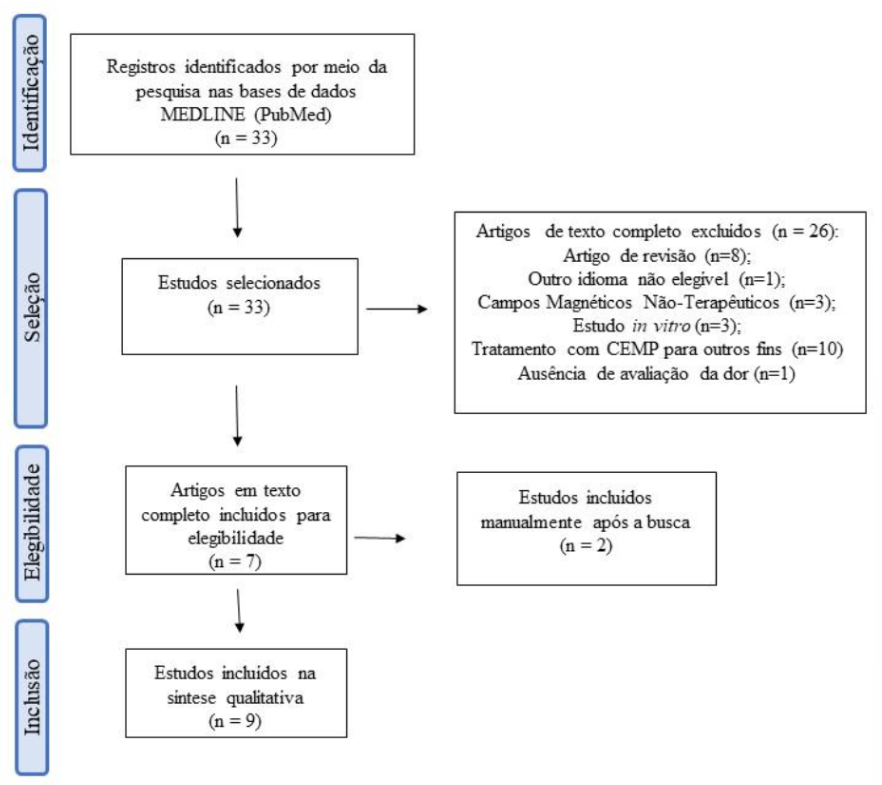
Dos 9 artigos analisados, 2 foram conduzidos na Turquia, 1 na Itália, 1 na Rússia, 2 na China e 3 nos Estados Unidos. Desses artigos, três (33%) foram estudos clínicos controlados, os outros seis artigos (67%) foram estudos experimentais com modelos animais, sendo dois (33%) com camundongos e quatro (67%) com ratos.
Com relação ao efeito analgésico, oito estudos (89%) demonstraram diferença estatística significativa nos grupos tratados com campos eletromagnéticos pulsados comparado ao grupo controle(18–25), e apenas um estudo (11%) não obteve diferença estatística na redução da sensibilidade dolorosa (26).
No Quadro I está sintetizado os principais achados e parâmetros utilizados nos artigos selecionados para esta revisão.
Quadro 1 – Síntese dos artigos selecionados. CEMP = campos eletromagnéticos pulsados; P = pulso; ms = milissegundos; µs = microssegundos; F = frequência de pulso; Hz = Hertz; kHz = quilohertz; I = intensidade de pico do fluxo magnético; µT = microtesla; T = tempo total de aplicação; min = minutos; h = horas; ELF- = extrema baixa frequencia, NO = óxido nítrico; sGC = guanilato ciclase solúvel; 5-HT = 5-hidroxitriptamina (serotonina); HCl = cloridrato de serotonina; HCN1/HCN2 = canais iônicos de cátion ativados por nucleotídeos cíclicos de hiperpolarização; DIV = disco intervertebral; DC = ciclo de trabalho; OA = osteoartrite.
Autores/ano publicação Objetivo do Estudo Parâmetros e Protocolo CEMP Resultados Alvarez, L.X. et al., 2019 Avaliar a eficácia da terapia com CEMP na cicatrização de feridas e na redução da dor pós-hemilaminectomia em cães P= 2ms,
F= 2Hz,
I = 4µT;
T = 15 minMelhora significativa na cicatrização de feridas. Redução na necessidade de medicação para dor. Ausência de efeitos adversos significativos. Del Seppia, C. et al, 2003 Avaliar os efeitos de diferentes campos magnéticos no comportamento e sensibilidade nociceptiva em camundongos. CEMP1
F = 0.026Hz e 0.043Hz;
I = entre 20µT e 70 µT; CEMP2
F = 37Hz;
I = 80 µT;
T = 90 min + 30 minExposição a campos magnéticos aumentou sensibilidade nociceptiva, sem diferenças significativas entre os tipos de campos. Efeitos mais marcantes a 37 Hz. Demirkazik, A. et al, 2019. Investigar o efeito dos ELF-CEMP na via do NO para dor térmica em ratos. P = 5µs;
F = 15Hz;
I = 1mT, 5mT e 10mT,
T = 30 min .ELF-CEMP aumentou produção de NO, ativou via NO/sGC, inibindo significativamente a dor e modulando percepção. Ozdemir, E. et al, 2019 Investigar efeitos dos agonistas dos receptores 5-HT em analgesia por campo eletromagnético em ratos e explorar mecanismos subjacentes. P = 5µs
F = 15Hz;
I = 1mT, 5mT e 10mT,
T = 30min HCI de serotonina aumentou eficácia analgésica significativa em ratos expostos a CEMP, enquanto WAY 100635 reduziu essa atividade. Das, S. et al, 2012 Avaliar efeitos da exposição a campo magnético de baixa frequência e intensidade após hemissecção da medula espinhal em ratos. F = 50Hz;
I = 17.96mT;
T = 2 h Melhora significativa nas funções locomotoras e sensoriomotoras dos ratos. Liu, H. et al, 2016. Avaliar o efeito da terapia CEMP na expressão de HCN1/HCN2 mRNA pós lesão nervosa para tratar dor neuropática. F = 8Hz;
I = 3.8mT;
T = 30min. Não houve diferença significativa na redução da sensibilidade dolorosa. Yang, X. et al, 2021. Investigar os efeitos do CEMP na OA através da inibição das vias do TNF-α e IL-6 e proteção contra apoptose e autofagia. P = 6.67ms;
F = 75Hz;
I = 3.8mT;
T = 1 h.Redução significativa da dor e inflamação da OA. Redução significativa na expressão de TNF-α e IL-6. Melhora significativa na microarquitetura óssea. Zidan, N. et al, 2018. Avaliar o efeito do CEMP na dor pós-operatória e recuperação locomotora em cães com extrusão do DIV toracolombar. P = 2mseg;
F = 2Hz;
I = 5µT;
T = 15min.Melhora significativa na dor pós-operatória e recuperação locomotora Shafford, H. et al, 2002. Avaliar a eficácia da terapia de CEMP na redução da dor pós-operatória em cães. P = 0.05Hz;
T = 20minRedução significativa da dor pós-operatória em cães submetidos a ovariohisterectomia.
DISCUSSÃO
Os campos eletromagnéticos pulsados são fornecidos aos tecidos biológicos através de dispositivos que entregam a energia por meio de bobinas indutivas de cobre. A passagem da corrente elétrica por essas bobinas gera um campo eletromagnético que é capaz de interagir com as estruturas celulares de acordo com suas propriedades magnéticas(16). Embora o organismo tenha uma pobre interação com campos eletromagnéticos externos, microscopicamente, algumas estruturas celulares possuem características ferromagnéticas ou paramagnéticas, que permitem uma maior interação. (16). A partir dessas interações são observados os efeitos do CEMP na modulação da atividade celular e molecular, incluindo a regulação da expressão gênica, a produção de citocinas e a liberação de neurotransmissores(27).
Os dispositivos de emissão de CEMP disponíveis no mercado possuem propriedades físicas muito distintas, o que pode gerar confusão no uso do equipamento(17). O formato da onda eletromagnética pode ser assimétrico, sinusoidal, quase-quadrangular, trapezoidal ou bifásico, gerando um campo eletromagnético atérmico e não-ionizante(17). A frequência de pulsos, a intensidade do campo gerado e o tempo de tratamento também são muito variáveis, o que dificulta a parametrização no uso do CEMP(16). No entanto, se observa de forma geral a aplicação clínica terapêutica dos campos eletromagnéticos pulsados de baixa frequência com pulsos menor que 100Hz e densidade do fluxo magnético entre 0.1 mT e 30 mT(17). Na medicina veterinária, o uso do CEMP tem se mostrado uma possibilidade terapêutica não invasiva e de poucos efeitos colaterais relatados, podendo ser relevante sua inclusão no tratamento de animais com dor e inflamação por distintas etiologias(27).
Entre as indicações clínicas, tem se estudado a aplicação do CEMP no tratamento da dor pós-operatória, edema e inflamação, bem como no estímulo do crescimento ósseo e tratamento de outras condições musculoesqueléticas. Há evidências clínicas crescentes que apoiam o uso do CEMP em várias condições, incluindo dor crônica, osteoartrite (OA) e lesões esportivas(27). Na medicina veterinária, a OA é uma condição ortopédica com alta prevalência na rotina clínica, sendo responsável pela causa da dor em 20% em cães com mais de um ano de idade, 80% em cães com oito anos ou mais(28), e 92% em gatos com 9 anos ou mais(29,30). O uso do CEMP na OA tem comprovados efeitos no controle da dor, inflamação e preservação da morfologia articular(15,31,32).
Os receptores adenosina presente nos condrócitos são responsáveis pela regulação da produção de citocinas inflamatórias e degradação da matriz cartilaginosa. No estudo de Vincenzi et al. [2013], o uso do CEMP ativou os receptores adenosina A2A e A3 em linhagens celulares de condrócitos e osteoblastos humanos tendo por consequência a inibição da produção das citocinas pró-inflamatórias IL-1β e TNF-α e aumento a produção de citocinas anti-inflamatórias IL-10. As células expostas ao CEMP também responderam com a inibição da atividade das enzimas degradadoras de matriz extracelular, como a metaloproteinase da matriz (MMP-13) e aumento da produção de inibidores de MMPs(15).
Nessa mesma linha de pesquisa, Ciombor et al. [2003] avaliaram o efeito do CEMP na matriz cartilaginosa in vivo no modelo animal de OA induzida, e obtiveram como resultado uma diferença significativa na preservação da morfologia da cartilagem articular e atraso no desenvolvimento da OA nas cobaias. Nesse experimento, o tratamento com CEMP reduziu significativamente o número de células imunorreativas aos anticorpos para colagenase matrix metalloproteinase-13 (MMP-13) e estromelisina matrix metalloproteinase-3 (MMP-3) na cartilagem dos platôs tibiais tratados, comparado ao controle, preservando dessa forma a morfologia articular(31).
Em outro estudo in vivo, Fini et al. [2005] demonstraram a redução significativa na progressão da lesão osteoartrítica em cobaias idosas, sendo identificada uma diminuição significativa na perda de proteoglicanos e menor índice de erosão na superfície articular do grupo tratado com CEMP comparado ao controle(32).
Mais recentemente, Yang et al. [2021] obteve como resultado o alívio da dor e redução da degeneração cartilaginosa em modelos animas de OA, através da inibição significativa de citocinas pró-inflamatórias, como TNF-α e IL-6. Além de, a microarquitetura do osso subcondral e inflamação sinovial também terem sido reduzidas nos camundongos expostos ao CEMP(23).
Levando em consideração a alta prevalência da OA em cães e gatos, o estudo de Sullivan et al. [2011] se mostra promissor no uso da CEMP como tratamento da dor articular na medicina veterinária. Os autores avaliaram a amplitude de movimento articular bem como a escala de dor em cães com osteoartrite que utilizaram o CEMP como tratamento, e obtiveram como resultado a redução significativa na gravidade e interferência da dor. No entanto, não encontraram diferença estatística quanto a mobilidade articular(33).
Além da OA, a dor crônica nos animais de companhia pode ocorrer por outras diversas etiologias. Um estudo transversal com 317 cães e 112 gatos reportou 56% dos cães e 54% dos gatos admitidos em emergências veterinárias sofriam de dor somática e/ou visceral(30). Essa prevalência é mais baixa para animais admitidos na rotina clínica em consultório veternário, representando 20% de dor em cães e 14% em gatos. As doenças mais prevalentes são a doença dental, câncer e dor espinal(34), sendo a doença do disco intervertebral (DDIV) o quadro neurológico mais comum em cães, ocasionando quadros de dor discogênica e inflamação da medula espinal quando associada à extrusão discal(35).
Alguns estudos foram realizados com o objetivo de avaliar a dor visceral e espinal e/ou discogênica com a aplicação do CEMP, e tem se mostrado efetivos no controle da dor em animais. Shafford et al. [2002] avaliaram a eficácia do CEMP na redução da dor pós-operatória em cães submetidos a ovariohisterectomia. Os resultados mostraram que os cães tratados com CEMP apresentaram uma redução significativa na dor pós-operatória em comparação com o grupo controle. Além disso, o grupo que recebeu CEMP e morfina apresentou uma redução ainda maior na dor em comparação com os grupos que receberam apenas um dos tratamentos(25).
Zidan et al. [2018] investigaram o efeito dos CEMP na dor pós-operatória e na recuperação locomotora em cães com extrusão de disco intervertebral toracolombar aguda e grave. Os resultados mostraram que o grupo de cães tratados com CEMP apresentou uma melhora significativa na dor pós-operatória e na recuperação locomotora em comparação com o grupo controle(24). Complementa bem esse estudo, a pesquisa realizada por Das et al. [2012], onde os autores sugerem que a presença do CEMP de baixa frequência aumenta a excitabilidade dos motoneurônios alfa, modulando os geradores de padrão central (CPGs), melhorando de forma significativa a atividade motora em lesões da medula espinal. Os autores sugerem que essa resposta ocorra através da diminuição da eficácia do receptor 5-HT1 pela exposição aos campos eletromagnéticos, aumentando a captação de serotonina na sinapse(22).
Em um estudo experimental, também relacionado às afecções neurológicas espinais, Chan et al. [2019] induziram a degeneração do disco intervertebral (DIV) em ratos com a finalidade de avaliar o efeito do CEMP sobre a dor discogênica e o padrão degenerativo do DIV. Como resultado desse estudo, o CEMP reduziu significativamente a inflamação dos DIVs e reduziu significativamente as lesões degenerativas histopatológicas dos DIVs(36).
Os efeitos analgésicos que podem ser encontrados com o uso do CEMP têm relação com a movimentação de íons livres interna e externamente à célula, que são forçados através da corrente eletromagnética a permear os canais eletro-sensíveis presentes na membrana plasmática, gerando o equilíbrio e retorno da função eletroquímica celular(37). A modulação da atividade dos canais dependentes de voltagem, como sódio e cálcio, nos neurônios sensoriais, resulta na redução da percepção dolorosa(23). Não apenas a movimentação dos íons e a modulação dos canais iônicos resultam no efeito analgésico no animal, senão também outros mecanismos parecem estar envolvidos com o controle da dor.
Liu et al. [2017] avaliaram o efeito do CEMP no controle de dor em ratos com dor neuropática induzida através do modelo de constrição crônica do nervo isquiático. O resultado do estudo apresentou uma redução significativa na expressão do RNAm de canais iônicos HCN1 e HCN2 em animais tratados com CEMP comparado ao controle, sugerindo a analgesia através da redução na expressão do RNAm HCN1/HCN2, uma vez que esses canais permitem a entrada de sódio e potássio na célula nervosa sendo um importante mecanismo na geração de potenciais de ação dos neurônios nociceptivos, transmitindo sinais de dor ao cérebro(26).
Outro mecanismo de ação celular envolvendo vias da dor é a ativação de receptores serotoninérgicos. Essa interação do CEMP desencadeia um efeito antinociceptivo, através da liberação de neurotransmissores que inibem os sinais de dor no sistema nervoso central. No estudo de Ozdemir et al. [2019], foi comparado o efeito do CEMP na nocicepção térmica em ratos injetados com agonista e antagonista da serotonina, e obtiveram como resultado uma atividade analgésica significativamente superior nos grupos tratados com CEMP comparado ao controle. Além disso, o grupo tratado com o agonista do receptor 5-HT1 apresentou um aumento significativo na eficácia analgésica nos ratos expostos ao CEMP comparado ao controle. (21).
A via do óxido nítrico (NO) também parece estar envolvida no processo de analgesia e controle da inflamação. Produzido pela enzima óxido nítrico sintase (NOS), o NO atua como um neurotransmissor e neuromodulador inibindo a liberação de neurotransmissores pró-inflamatórios, reduzindo a atividade de células inflamatórias e modulando a atividade neuronal. Além disso, o NO pode estimular a produção de GMPc que é um importante segundo mensageiro envolvido na regulação da dor e inflamação(20). Demirkazik et al. (2019) demonstraram em seu estudo que o CEMP é capaz de inibir a transmissão de dor e modular a percepção da dor através do aumento significativo na produção de NO pela ativação da guanilato ciclase solúvel (sGC), aumentando dessa forma a disponibilidade do GMPc(20).
Outra via que parece estar envolvida no efeito analgésico é o sistema opioide endógeno. Del Seppia et al. (2002) propõem que o efeito do CEMP na sensibilidade nociceptiva é provavelmente mediado por esse sistema, uma vez que os campos eletromagnéticos alteram o funcionamento do cálcio e fluxo de íons de cálcio, bem como ocorrem alterações nos mecanismos de transdução associados à proteína quinase C e ao NO e NOS(19).
CONCLUSÃO
Os Campos Eletromagnéticos Pulsados (CEMP) são uma técnica promissora para o tratamento da dor em animais, com potencial para ser incorporada em abordagens terapêuticas multimodais na medicina veterinária. A revisão integrativa realizada neste estudo mostrou que há evidências científicas que suportam o uso de CEMP em modelos animais, com resultados positivos na redução da dor.
No entanto, é importante ressaltar que a maioria dos estudos analisados foram experimentais com modelos animais, e apenas 33% dos estudos conduzidos foram clínicos controlados. Portanto, são necessários mais estudos clínicos para avaliar a eficácia e segurança do uso de CEMP em animais.
Além disso, é importante que os profissionais da área veterinária estejam cientes das parametrizações adequadas para o uso de CEMP em animais, a fim de evitar possíveis efeitos colaterais ou danos à saúde dos animais. Em resumo, a revisão integrativa apresentada neste estudo sugere que os Campos Eletromagnéticos Pulsados podem ser uma opção terapêutica promissora para o tratamento da dor e inflamação em animais, mas são necessários mais estudos clínicos para avaliar sua eficácia e segurança em diferentes espécies animais.
REFERÊNCIAS
1. Raja SN, Carr DB, Cohen M, Finnerup NB, Flor H, Gibson S, et al. The revised International Association for the Study of Pain definition of pain: concepts, challenges, and compromises. Pain. 2020 Sep 1;161(9):1976–82.
2. Williams AC de C. Persistence of pain in humans and other mammals. Philos Trans R Soc Lond B Biol Sci. 2019 Nov 11;374(1785):20190276.
3. Mogil JS, Pang DSJ, Silva Dutra GG, Chambers CT. The development and use of facial grimace scales for pain measurement in animals. Neurosci Biobehav Rev. 2020 Sep;116:480–93.
4. Weintraub MI, Cole SP. Pulsed magnetic field therapy in refractory neuropathic pain secondary to peripheral neuropathy: electrodiagnostic parameters–pilot study. Neurorehabil Neural Repair. 2004 Mar;18(1):42–6.
5. Musaev AV, Guseinova SG, Imamverdieva SS. The use of pulsed electromagnetic fields with complex modulation in the treatment of patients with diabetic polyneuropathy. Neurosci Behav Physiol. 2003 Oct;33(8):745–52.
6. Afshari D, Moradian N, Khalili M, Razazian N, Bostani A, Hoseini J, et al. Evaluation of pulsing magnetic field effects on paresthesia in multiple sclerosis patients, a randomized, double-blind, parallel-group clinical trial. Clin Neurol Neurosurg. 2016 Oct;149:171–4.
7. Sorrell RG, Muhlenfeld J, Moffett J, Stevens G, Kesten S. Evaluation of pulsed electromagnetic field therapy for the treatment of chronic postoperative pain following lumbar surgery: a pilot, double-blind, randomized, sham-controlled clinical trial. J Pain Res. 2018 Jun 22;11:1209–22.
8. Xu Y, Wang Q, Wang X-X, Xiang X-N, Peng J-L, He C-Q, et al. The Effect of Different Frequencies of Pulsed Electromagnetic Fields on Cartilage Repair of Adipose Mesenchymal Stem Cell-Derived Exosomes in Osteoarthritis. Cartilage. 2022 Dec;13(4):200–12.
9. Liu J, Huang X, Zhou J, Li L, Xiao H, Qu M, et al. Pulsed electromagnetic field alleviates synovitis and inhibits the NLRP3/Caspase-1/GSDMD signaling pathway in osteoarthritis rats. Electromagn Biol Med. 2022 Jan 2;41(1):101–7.
10. Maziarz A, Kocan B, Bester M, Budzik S, Cholewa M, Ochiya T, et al. How electromagnetic fields can influence adult stem cells: positive and negative impacts. Stem Cell Res Ther. 2016 Apr 18;7(1):54.
11. Xu H, Zhang J, Lei Y, Han Z, Rong D, Yu Q, et al. Low frequency pulsed electromagnetic field promotes C2C12 myoblasts proliferation via activation of MAPK/ERK pathway. Biochem Biophys Res Commun. 2016 Oct 7;479(1):97–102.
12. Bertagna F, Lewis R, Silva SRP, McFadden J, Jeevaratnam K. Effects of electromagnetic fields on neuronal ion channels: a systematic review. Ann N Y Acad Sci. 2021 Sep;1499(1):82–103.
13. Mansourian M, Shanei A. Evaluation of Pulsed Electromagnetic Field Effects: A Systematic Review and Meta-Analysis on Highlights of Two Decades of Research In Vitro Studies. Biomed Res Int. 2021 Jul 29;2021:6647497.
14. Stone TW, Ceruti S, Abbracchio MP. Adenosine receptors and neurological disease: neuroprotection and neurodegeneration. Handb Exp Pharmacol. 2009;(193):535–87.
15. Vincenzi F, Targa M, Corciulo C, Gessi S, Merighi S, Setti S, et al. Pulsed electromagnetic fields increased the anti-inflammatory effect of A₂A and A₃ adenosine receptors in human T/C-28a2 chondrocytes and hFOB 1.19 osteoblasts. PLoS ONE. 2013 May 31;8(5):e65561.
16. Flatscher J, Pavez Loriè E, Mittermayr R, Meznik P, Slezak P, Redl H, et al. Pulsed Electromagnetic Fields (PEMF)-Physiological Response and Its Potential in Trauma Treatment. Int J Mol Sci. 2023 Jul 8;24(14).
17. Hu H, Yang W, Zeng Q, Chen W, Zhu Y, Liu W, et al. Promising application of Pulsed Electromagnetic Fields (PEMFs) in musculoskeletal disorders. Biomed Pharmacother. 2020 Nov;131:110767.
18. Alvarez LX, McCue J, Lam NK, Askin G, Fox PR. Effect of Targeted Pulsed Electromagnetic Field Therapy on Canine Postoperative Hemilaminectomy: A Double-Blind, Randomized, Placebo-Controlled Clinical Trial. J Am Anim Hosp Assoc. 2019 Jan 17;55(2):83–91.
19. Del Seppia C, Mezzasalma L, Choleris E, Luschi P, Ghione S. Effects of magnetic field exposure on open field behaviour and nociceptive responses in mice. Behav Brain Res. 2003 Sep 15;144(1–2):1–9.
20. Demirkazik A, Ozdemir E, Arslan G, Taskiran AS, Pelit A. The effects of extremely low-frequency pulsed electromagnetic fields on analgesia in the nitric oxide pathway. Nitric Oxide. 2019 Nov 1;92:49–54.
21. Ozdemir E, Demirkazik A, Taskıran AS, Arslan G. Effects of 5-HT1 and 5-HT 2 Receptor Agonists on Electromagnetic Field-Induced Analgesia in Rats. Bioelectromagnetics. 2019 Jul;40(5):319–30.
22. Das S, Kumar S, Jain S, Avelev VD, Mathur R. Exposure to ELF- magnetic field promotes restoration of sensori-motor functions in adult rats with hemisection of thoracic spinal cord. Electromagn Biol Med. 2012 Sep;31(3):180–94.
23. Yang X, Guo H, Ye W, Yang L, He C. Pulsed Electromagnetic Field Attenuates Osteoarthritis Progression in a Murine Destabilization-Induced Model through Inhibition of TNF-α and IL-6 Signaling. Cartilage. 2021 Dec;13(2_suppl):1665S-1675S.
24. Zidan N, Fenn J, Griffith E, Early PJ, Mariani CL, Muñana KR, et al. The Effect of Electromagnetic Fields on Post-Operative Pain and Locomotor Recovery in Dogs with Acute, Severe Thoracolumbar Intervertebral Disc Extrusion: A Randomized Placebo-Controlled, Prospective Clinical Trial. J Neurotrauma. 2018 Aug 1;35(15):1726–36.
25. Shafford HL, Hellyer PW, Crump KT, Wagner AE, Mama KR, Gaynor JS. Use of a pulsed electromagnetic field for treatment of post-operative pain in dogs: a pilot study. Vet Anaesth Analg. 2002 Jan;29(1):43–8.
26. Liu H, Zhou J, Gu L, Zuo Y. The change of HCN1/HCN2 mRNA expression in peripheral nerve after chronic constriction injury induced neuropathy followed by pulsed electromagnetic field therapy. Oncotarget. 2017 Jan 3;8(1):1110–6.
27. Gaynor JS, Hagberg S, Gurfein BT. Veterinary applications of pulsed electromagnetic field therapy. Res Vet Sci. 2018 Aug;119:1–8.
28. Wright A, Amodie DM, Cernicchiaro N, Lascelles BDX, Pavlock AM, Roberts C, et al. Identification of canine osteoarthritis using an owner-reported questionnaire and treatment monitoring using functional mobility tests. J Small Anim Pract. 2022 Aug;63(8):609–18.
29. Slingerland LI, Hazewinkel HAW, Meij BP, Picavet P, Voorhout G. Cross-sectional study of the prevalence and clinical features of osteoarthritis in 100 cats. Vet J. 2011 Mar;187(3):304–9.
30. Della Rocca G, Gamba D. Chronic Pain in Dogs and Cats: Is There Place for Dietary Intervention with Micro-Palmitoylethanolamide? Animals (Basel). 2021 Mar 29;11(4).
31. Ciombor DM, Aaron RK, Wang S, Simon B. Modification of osteoarthritis by pulsed electromagnetic field–a morphological study. Osteoarthr Cartil. 2003 Jun;11(6):455–62.
32. Fini M, Giavaresi G, Torricelli P, Cavani F, Setti S, Canè V, et al. Pulsed electromagnetic fields reduce knee osteoarthritic lesion progression in the aged Dunkin Hartley guinea pig. J Orthop Res. 2005 Jul;23(4):899–908.
33. Sullivan MO, Gordon-Evans WJ, Knap KE, Evans RB. Randomized, controlled clinical trial evaluating the efficacy of pulsed signal therapy in dogs with osteoarthritis. Vet Surg. 2013 Apr;42(3):250–4.
34. Gruen ME, Lascelles BDX, Colleran E, Gottlieb A, Johnson J, Lotsikas P, et al. 2022 AAHA pain management guidelines for dogs and cats. J Am Anim Hosp Assoc. 2022 Mar 1;58(2):55–76.
35. Moore SA, Tipold A, Olby NJ, Stein V, Granger N, Canine Spinal Cord Injury Consortium (CANSORT SCI). Current approaches to the management of acute thoracolumbar disc extrusion in dogs. Front Vet Sci. 2020 Sep 3;7:610.
36. Chan AK, Tang X, Mummaneni NV, Coughlin D, Liebenberg E, Ouyang A, et al. Pulsed electromagnetic fields reduce acute inflammation in the injured rat-tail intervertebral disc. JOR Spine. 2019 Dec 2;2(4):e1069.
37. Panagopoulos DJ, Karabarbounis A, Margaritis LH. Mechanism for action of electromagnetic fields on cells. Biochem Biophys Res Commun. 2002 Oct 18;298(1):95–102.
1Experimental Neuroscience Laboratory (LaNEx), Graduate Program in Health Sciences, University of Southern Santa Catarina (UNISUL)
*Correspondence to: Jennifer Hummel Vicente, E-mail: jenniferhvicente@gmail.com
