USE OF NANOTECHNOLOGY IN THE PHARMACEUTICAL INDUSTRY: A LITERATURE REVIEW
REGISTRO DOI: 10.69849/revistaft/ni10202509301507
Renan Matheus de Souza Caputo1
Claudio Augusto Kelly/orientador2
Resumo
A nanotecnologia tem se consolidado como uma das principais ferramentas de inovação na indústria farmacêutica, possibilitando o desenvolvimento de novos fármacos, sistemas de liberação controlada e terapias mais eficazes. Este estudo apresenta uma revisão da sistemática da literatura sobre as principais aplicações da nanotecnologia no setor farmacêutico, abordando nanomedicamentos já aprovados, formulações em desenvolvimento e tendências emergentes, como nanocarregadores para terapias direcionadas e plataformas para diagnóstico avançado. Foram analisados artigos científicos publicados em bases de dados reconhecidas, destacando-se as vantagens, limitações e desafios regulatórios relacionados à utilização dessas tecnologias. Os resultados evidenciam que a nanotecnologia contribui para melhorar a biodisponibilidade, reduzir efeitos adversos e potencializar a eficácia terapêutica, embora ainda existam barreiras quanto à escalabilidade de produção e segurança a longo prazo. Conclui-se que a nanotecnologia representa um campo promissor para o avanço da indústria farmacêutica, mas exige contínua investigação e regulamentação para garantir seu uso seguro e efetivo.
Palavras-chave: Nanotecnologia, Indústria Farmacêutica, Nanomedicamentos, Sistemas de Liberação de Farmácos, Nanocarragadores.
Abstract
Nanotechnology has established itself as one of the main innovation tools in the pharmaceutical industry, enabling the development of new drugs, controlled-release systems, and more effective therapies. This study presents a systematic review of the literature on the main applications of nanotechnology in the pharmaceutical sector, addressing already approved nanomedicines, formulations under development, and emerging trends, such as nanocarriers for targeted therapies and platforms for advanced diagnostics. Scientific articles published in recognized databases were analyzed, highlighting the advantages, limitations, and regulatory challenges related to the use of these technologies. The results demonstrate that nanotechnology contributes to improving bioavailability, reducing adverse effects, and enhancing therapeutic efficacy, although barriers remain regarding production scalability and long-term safety. It is concluded that nanotechnology represents a promising field for the advancement of the pharmaceutical industry, but requires continuous research and regulation to ensure its safe and effective use.
Keywords: Nanotechnology, Pharmaceutical Industry, Nanomedicines, Drug Delivery Systems, Nanocarriers.
1. INTRODUÇÃO
A indústria farmacêutica enfrenta desafios persistentes, como a baixa biodisponibilidade de muitos fármacos, o aumento da resistência microbiana e a elevada incidência de efeitos adversos associados às terapias convencionais. Esses obstáculos comprometem a eficácia clínica de diversos tratamentos e têm impulsionado o desenvolvimento de estratégias inovadoras voltadas para a otimização da segurança e do desempenho terapêutico. (SHUKLA et al., 2025; BHALANI et al., 2022, ROCHA et al., 2023, GUPTA; KESARLA e OMRI, 2013, COURTEMANCHE et al., 2021, WANG et al., 2024).
Nesse cenário, a nanotecnologia desponta como uma ferramenta estratégica, possibilitando o desenvolvimento de formulações mais precisas, direcionadas e ambientalmente sustentáveis. (PATRA et al., 2018, JAHANGIRIAN et al., 2017).
Os nanocarreadores vêm se consolidando como plataformas terapêuticas promissoras, capazes de transpor barreiras fisiológicas, prolongar a meia-vida plasmática dos fármacos e promover sua entrega direcionada a tecidos ou células-alvo. Esses avanços resultam em maior biodisponibilidade, otimização do perfil farmacocinético e redução da toxicidade sistêmica. Exemplos já incorporados à prática clínica, como Doxil® (doxorrubicina lipossomal), Abraxane® (paclitaxel ligado à albumina) e as vacinas contra a COVID-19 baseadas em RNA mensageiro, evidenciam o impacto dos nanossistemas no manejo de doenças oncológicas, infecciosas e respiratórias, consolidando seu papel como eixo central da medicina translacional contemporânea. (FARJADIAN et al., 2019; TENCHOV et al., 2021).
Não obstante os avanços alcançados, a consolidação da nanotecnologia farmacêutica enfrenta desafios significativos, incluindo questões relacionadas à toxicidade dos nanomateriais, à reprodutibilidade e escalabilidade dos processos industriais, aos elevados custos de produção e às lacunas nos marcos regulatórios internacionais. Ademais, abordagens emergentes, como a nanotecnologia verde e a integração de métodos baseados em inteligência artificial para otimização de formulações e previsão de efeitos biológicos, introduzem novas oportunidades de inovação, ao mesmo tempo em que impõem desafios adicionais de padronização, validação e regulamentação. (JIMÉNEZ-MARTÍNEZ; VÁZQUEZ-LIRA, 2025; ZHANG; LI e MA, 2024).
Diante desse panorama, revela-se essencial a sistematização crítica dos avanços obtidos, bem como a identificação das limitações metodológicas persistentes e das tendências emergentes no campo da nanotecnologia aplicada à indústria farmacêutica, de modo a orientar futuras investigações e subsidiar o desenvolvimento de estratégias terapêuticas mais eficazes e seguras.
2. REFERENCIAL TEÓRICO
2.1 Conceitos e bases da nanotecnologia farmacêutica
A nanotecnologia, entendida como a manipulação e o controle de materiais em escala nanométrica (aproximadamente 1–100 nm), tem se consolidado como um dos campos mais promissores para a inovação na indústria farmacêutica. Trata-se de uma disciplina intrinsecamente multidisciplinar, que integra princípios da química, física, biologia e engenharia de materiais para o desenvolvimento de nanossistemas avançados, capazes de modular propriedades físico-químicas, aumentar a estabilidade das formulações e promover a entrega seletiva de fármacos. Entre os principais sistemas estudados destacam-se os lipossomas, as nanopartículas poliméricas, as micelas autoagregadas, as nanopartículas metálicas e os dendrímeros, cada qual oferecendo vantagens específicas em termos de biocompatibilidade, capacidade de encapsulação, perfil de liberação controlada e direcionamento a tecidos-alvo. Tais abordagens têm se mostrado eficazes na superação de limitações intrínsecas às terapias convencionais, como baixa biodisponibilidade, toxicidade sistêmica e susceptibilidade à degradação enzimática. (PATRA et al., 2018; JAHANGIRIAN et al., 2017).
Desde a década de 1980, observa-se um crescimento substancial no número de formulações nanoestruturadas aprovadas por agências regulatórias internacionais, refletindo avanços significativos na nanotecnologia farmacêutica. Um marco inicial foi a aprovação, em 1995, do Doxil® (doxorrubicina lipossomal peguilada) pela FDA, o primeiro medicamento antineoplásico baseado em nanotecnologia, indicado para o tratamento de sarcoma de Kaposi relacionado à AIDS (JAYARAJA; JIANGB e MUDALIGE, FDA 2023). Posteriormente, em 2005, a FDA aprovou o Abraxane® (paclitaxel ligado à albumina), uma formulação nanoparticulada que dispensou o uso de solventes orgânicos, melhorando a segurança e eficácia no tratamento de câncer de mama metastático. (U.S. FOOD DRUG, 2025)
Esses exemplos ilustram a aplicação bem-sucedida de nanossistemas em oncologia, com implicações terapêuticas também em doenças infecciosas, cardiovasculares, respiratórias e neurológicas. (FARJADIAN et al., 2019).
2.2 Nanossistemas consolidados na indústria farmacêutica
Entre os nanossistemas farmacêuticos já consolidados, destacam-se lipossomas, nanopartículas poliméricas, nanocristais e nanotubos de carbono. (MODY et al., 2014, DRISTANT et al., 2023; DAS; MAITY e ANURADHA, 2003, TENCHOV, R. et al., 2025; ORTEGA-GALINDO et al., 2023).
Os lipossomas constituem uma das plataformas mais estabelecidas, com diversas formulações aprovadas por agências regulatórias, incluindo Doxil® (doxorrubicina lipossomal peguilada), AmBisome® (anfotericina B lipossomal) e Vyxeos® (combinação lipossomal de daunorrubicina e citarabina), empregadas no tratamento de neoplasias e infecções fúngicas sistêmicas. (KRAUSS et al., 2019, U.S. FOOD DRUG ADMINISTRATION, 2017, LANCET et al., 2020)
As nanopartículas poliméricas, compostas por polímeros biodegradáveis como PLGA (poliláctico-co-glicólico), permitem a encapsulação controlada de fármacos, promovendo liberação sustentada, aumento da estabilidade e direcionamento seletivo a tecidos-alvo, com exemplos clínicos como as formulações de paclitaxel polimérico. (SAKHI et al., 2022; ALOBAIDY et al., 2023, MA; MUMPER, 2013, ZHOU et al., 2025, SEYAM et al., 2025, GOMES; FREITAS e DINIZ, 2013)
Os nanocristais, caracterizados por fármacos cristalinos em escala nanométrica, são utilizados para melhorar a solubilidade e biodisponibilidade de compostos pouco solúveis em água, favorecendo terapias orais e intravenosas. (PARDHI et al., 2018, CHARY et al., 2024; ROSSIER et al., 2024)
Já os nanotubos de carbono, estruturas cilíndricas de alta relação superfície/volume, têm sido investigados como plataformas para entrega de fármacos, agentes de contraste e terapias fototérmicas, devido à sua capacidade de funcionalização química e interação eficiente com células e tecidos. Coletivamente, esses nanossistemas ilustram o potencial da nanotecnologia farmacêutica em otimizar perfis farmacocinéticos e farmacodinâmicos, reduzir toxicidade sistêmica e ampliar a eficácia terapêutica em diversas áreas clínicas. (FERRARI; ARAUJO e PIANARO, 2017, LA ZERDA et al., 2008, DINGet al., 2016, GU et al., 2018, LIU et al., 2009, AL-ZHARANI et al., 2024, PRENCIPE et al., 2009, 2008; DING et al., 2016)
2.3 Aplicações terapêuticas emergentes
A oncologia representa o campo terapêutico que mais se beneficia dos avanços nanotecnológicos. Estruturas baseadas em DNA, incluindo bio-nanorrobôs programáveis, têm sido objeto de investigação para diagnóstico precoce, entrega dirigida de agentes terapêuticos e terapias combinadas (ABDOLLAHZADEH; PEEPLES e SHAHCHERAGHI, 2025; ESMAEILPOUR et al., 2025a; ESMAEILPOUR et al, 2025b). Por exemplo, nanorrobôs baseados em DNA origami foram projetados para acumular-se seletivamente nos vasos sanguíneos que irrigam tumores sólidos e liberar a protease trombina, induzindo trombose local e provocando necrose tumoral, com redução significativa do crescimento tumoral e aumento da sobrevida em modelos murinos de melanoma, câncer de mama, ovário e pulmão, sem induzir coagulação sistêmica ou efeitos adversos macroscopicamente detectáveis (LI et al., 2018).
Recentemente, pesquisadores suecos desenvolveram um interruptor robótico de DNA cuja carga citotóxica em nano-padrões peptídicos hexagonais é revelada apenas no microambiente ácido do tumor (pH ≈ 6,5), poupando células normais; em modelo murino de câncer de mama observou-se redução de ~70 % no volume tumoral comparado ao controle (WANG et al., 2024).
Outro estudo in vitro demonstrou que nanorrobôs com estrutura de Tetra-DNA funcionalizado com aptâmero anti-HER2 (HApt-tFNA) promovem degradação lisossomal de proteínas em células de câncer de mama com superexpressão de HER2, reduzindo a viabilidade celular de linhas SK-BR-3, enquanto preservam células normais (MCF-10A), indicando seletividade terapêutica (ZHANG et al., 2019).”
Terapias fototérmicas, fotodinâmicas e imunoterapias baseadas em nanopartículas têm expandido o leque de abordagens personalizadas no tratamento do câncer, ao potencializar a ação antitumoral e mitigar os efeitos adversos em tecidos saudáveis (LI et al., 2023). Uma demonstração clínica relevante é o uso de nanoshells ouro-sílica ativados por laser para ablação fototérmica focal de tumores de próstata de risco baixo a intermediário, em estudo piloto com 16 pacientes, no qual 94 % dos casos apresentaram ablação efetiva sem comprometimento significativo das funções geniturinárias ou urinárias (WINDRED et al., 2019).
No âmbito das doenças respiratórias, destaca-se o ensaio de fase II com amicacina lipossomal para inalação (Liposomal Amikacin for Inhalation – LAI) em pacientes com doença pulmonar por micobactérias não tuberculosas, que demonstrou conversão de cultura do escarro e melhora na distância percorrida em seis minutos, com toxicidade sistêmica limitada (GARCIA, 2014, OLSON et al., 2017). Também merece destaque a formulação lipossomal de ciclosporina A para inalação (L-CsA-i), avaliada em estudo multicêntrico, duplo-cego e controlado por placebo na prevenção de síndrome de bronquiolite obliterante em receptores de transplante pulmonar, que apresentou boa tolerabilidade e tendência a benefício em transplantes pulmonares simples (MEISNER et al., 2023).
No campo do trato gastrointestinal, micelas estabilizadas contendo peptídeo vasoativo intestinal (VIP) têm mostrado resultados promissores em modelos animais, com redução da secreção de TNF-α e atenuação de marcadores inflamatórios, indicando potencial para formulações orais inovadoras direcionadas ao tratamento de doenças inflamatórias intestinais (JAYAWARDENA et al., 2020a, JAYAWARDENA et al., 2020b).”
2.4 Nanotecnologia verde e sustentabilidade
Nos últimos anos, a nanotecnologia verde tem se consolidado como uma área de destaque ao propor métodos de síntese mais sustentáveis e ecologicamente seguros. Essa abordagem fundamenta-se na utilização de extratos vegetais, microrganismos e biopolímeros como agentes redutores e estabilizadores, permitindo a substituição de solventes tóxicos e de rotas químicas convencionais, em conformidade com os princípios da química verde e da minimização de impactos ambientais (JAHANGIRIAN et al., 2017). Além disso, a nanotecnologia verde apresenta significativo potencial para aplicações biomédicas e farmacêuticas, incluindo a síntese de nanopartículas com propriedades antimicrobianas, anticancerígenas e antioxidantes, bem como o desenvolvimento de sistemas de liberação controlada de fármacos mais biocompatíveis e menos citotóxicos, promovendo, dessa forma, estratégias terapêuticas mais seguras e ambientalmente responsáveis.
Estudos recentes com nanopartículas de ouro sintetizadas por métodos verdes demonstram elevada biocompatibilidade, reduzida citotoxicidade e potencial promissor em aplicações biomédicas, incluindo diagnóstico molecular de alta sensibilidade e terapias direcionadas, como a entrega controlada de fármacos e terapias fototérmicas para células tumorais (JIMÉNEZ-MARTÍNEZ; VÁZQUEZ-LIRA, 2025). A funcionalização dessas nanopartículas com biomoléculas permite interação seletiva com alvos celulares específicos, ampliando a eficácia terapêutica e minimizando efeitos adversos sistêmicos. Nesse contexto, a integração da nanotecnologia com os princípios da química verde evidencia o compromisso da indústria farmacêutica com práticas sustentáveis, conciliando inovação tecnológica, segurança biológica e responsabilidade ambiental, ao mesmo tempo em que reduz a geração de resíduos tóxicos e os impactos ecológicos associados à síntese de nanomateriais convencionais.
2.5 Aspectos regulatórios e toxicológicos
Apesar dos avanços significativos, a nanotecnologia farmacêutica ainda se depara com desafios críticos relacionados à segurança, escalabilidade e regulamentação. A toxicidade associada a nanopartículas metálicas e lipídicas permanece um ponto central de preocupação, exigindo o desenvolvimento de protocolos de avaliação mais robustos e padronizados, capazes de considerar parâmetros fundamentais, tais como a dose efetivamente administrada, a biocompatibilidade a longo prazo e os efeitos imunológicos potenciais (PAL et al., 2015; GERMAIN et al., 2020).
A ausência de padronização internacional constitui um desafio substancial para a aprovação de novas entidades farmacêuticas baseadas em nanossistemas, uma vez que organismos regulatórios, como a Food and Drug Administration (FDA) e a European Medicines Agency (EMA), aplicam diretrizes análogas às adotadas para fármacos convencionais, sem contemplar adequadamente as particularidades físico-químicas, farmacocinéticas e toxicológicas inerentes aos nanomateriais (SANT’ANNA; FERREIRA e ALENCAR, 2013). Em resposta a essas lacunas, iniciativas internacionais, como o European Nanomedicine Characterization Laboratory (EUNCL) e o TranslationHub, objetivam a harmonização de protocolos de caracterização e avaliação de nanomedicamentos, promovendo a padronização de parâmetros críticos—incluindo tamanho e morfologia nanoparticulada, estabilidade coloidal, liberação controlada de fármacos e perfil imunológico—além de acelerar a translação clínica dessas tecnologias emergentes (GERMAIN et al., 2020).
2.6 Tendências futuras e integração tecnológica
As perspectivas da nanotecnologia no âmbito da indústria farmacêutica apontam para uma medicina progressivamente personalizada e inteligente. A convergência com plataformas de inteligência artificial e algoritmos avançados de aprendizado de máquina viabiliza a concepção de sistemas terapêuticos adaptativos, capazes de modular dinamicamente a liberação de fármacos com base em parâmetros farmacocinéticos e biomarcadores individuais, otimizando a eficácia terapêutica e minimizando efeitos adversos (ZHANG; LI; MA, 2024). Paralelamente, o desenvolvimento de nanovacinas de próxima geração, microrrobôs cirúrgicos com precisão celular e nanossensores para monitoramento biomolecular contínuo evidencia a expansão da nanotecnologia para além das modalidades terapêuticas tradicionais, ampliando significativamente seu impacto em diagnósticos rápidos e precisos, medicina regenerativa, terapias combinadas e estratégias de medicina de precisão (YANG et al., 2024).
Nesse contexto, a nanotecnologia constitui-se como um vetor estratégico de inovação tecnológica, desempenhando um papel central na modernização dos processos produtivos e na promoção da sustentabilidade na indústria farmacêutica, ao possibilitar a otimização da entrega de fármacos, a redução de impactos ambientais e o desenvolvimento de plataformas terapêuticas mais eficientes.
3. METODOLOGIA
O presente estudo caracteriza-se como uma revisão da literatura, cujo objetivo foi identificar, analisar e sintetizar informações científicas sobre a aplicação da nanotecnologia na indústria farmacêutica. Para tanto, foi realizada uma busca sistemática em bases de dados científicas reconhecidas, incluindoPubMed, Scopus, Web of Science, ScienceDirect e Google Scholar, utilizando combinações de palavras-chave em português e inglês, tais como: “nanotecnologia”, “nanotechnology”, “indústria farmacêutica”, “pharmaceutical industry”, “sistemas de liberação de fármacos”, “drug delivery systems” e “nanomedicina”, nanomedicines, aplicando operadores booleanos para refinar a pesquisa.
Foram incluídos artigos originais, revisões e meta-análises publicados nos últimos 10 anos, disponíveis em português ou inglês, que abordassem diretamente o uso da nanotecnologia na formulação, liberação ou desenvolvimento de fármacos. Foram excluídos estudos que não tratassem de aplicações farmacêuticas, bem como artigos de opinião, notícias ou resumos de conferências sem apresentação de dados científicos completos.
O processo de seleção ocorreu em duas etapas: inicialmente, foram avaliados títulos e resumos quanto à relevância para o tema; em seguida, realizou-se a leitura integral dos artigos selecionados. Para cada estudo, foram extraídas informações sobre autoria, ano de publicação, tipo de nanomaterial, aplicação farmacêutica, resultados e conclusões, sendo posteriormente organizadas em tabelas e quadros comparativospara facilitar a análise.
A síntese dos dados foi realizada de forma qualitativa, agrupando os estudos de acordo com o tipo de aplicação da nanotecnologia, como sistemas de liberação de fármacos, nanopartículas lipídicas e poliméricas, nanocristais e nanotubos, bem como seus benefícios, desafios e perspectivas futuras. Por se tratar de revisão de literatura, o estudo não envolveu seres humanos ou animais, não sendo necessária aprovação por comitê de ética.
4. RESULTADOS
Foram selecionados para análise 9 artigos de acordo com os critérios de inclusão e exclusão, os quais foram categorizados segundo autor, ano de publicação, tipo de nanotecnologia, aplicações / achados principais e observações / limitações, conforme Quadro1.
Quadro 1 – Principais aplicações e características da nanotecnologia na indústria farmacêutica.
| Autor/Ano | Tipo de Nanotecnologia | Aplicações / Achados Principais | Observações / Limitações |
| ORTEGA- GALINDO et al., 2023 | Lipossomos | Transporte de fármacos com liberação controlada; redução de toxicidade; uso clínico crescente | Custo de produção elevado; estabilidade dependente da composição lipídica. |
| GOMES et al., 2013 | Nanocristais | Aumento da solubilidade e biodisponibilidade de fármacos pouco solúveis (ex.: norfloxacina) | Necessidade de surfactantes; potencial instabilidade física. |
| FERRARI et al., 2017 | Nanotubos de argila (halloysite) / Nanocompósitos poliméricos | Liberação controlada de fármacos; modificações | Possível citotoxicidade dependendo do polímero. |
| ESMAEILPOUR et al., 2025 | Nanotecnologia de DNA | Detecção e terapia de câncer; construção de nanodispositivos precisos para liberação de fármacos. | Alto custo e complexidade de fabricação; desafios na estabilidade in vivo. |
| GARCIA, 2014 | Nanomedicina respiratória | Terapias pulmonares direcionadas; aumento da eficiência de drogas respiratórias. | Necessidade de técnicas de entrega específicas; possíveis reações imunológicas. |
| JAYAWARDENA et al., 2020 | Nanopartículas para entrega colônica | Alívio de colite; potencial para cápsulas orais de fármacos peptídicos. | Estudos ainda pré-clínicos; biodisponibilidade limitada. |
| JIMÉNEZMARTÍNEZ & VÁZQUEZ-LIRA, 2025 | Nanopartículas metálicas (nanopartículas áuricas) | Nanotecnologia verde; aplicações terapêuticas e diagnósticas. | Toxicidade e acúmulo em tecidos a longo prazo. |
| PAL et al., 2015 | Avaliação toxicológica de nanomateriais | Classificação de nanomateriais quanto à toxicidade; importância da dosimetria in vitro. | Resultados dependem do modelo experimental; extrapolação para humanos limitada. |
| ZHANG et al., 2024 | Análise estratégica de nanomedicina | SWOT: inovação em entrega de fármacos; aumento da eficiência terapêutica; oportunidades de mercado. | Desafios regulatórios; necessidade de padronização de ensaios clínicos. |
Os lipossomos foram as primeiras nanomedicinais a obter aprovação clínica, atualmente, existem pelo menos 20 tecnologias lipossomais em uso clínico, com cerca de 18 em fases de avaliação. A maioria dessas formulações é utilizada no tratamento de diversos tipos de câncer, embora algumas também mostrem eficácia em outras condições. Algumas vantagens dos lipossomas são biocompatibilidade e capacidade de encapsular tanto substâncias hidrofílicas quanto lipofílicas. (ORTEGA-GALINDO et al., 2023)
O artigo de Ortega-Galindo et al. (2023) sobre lipossomas em nanomedicina destaca diversos desafios associados a essas nanopartículas, apesar de seu uso clínico consolidado, especialmente em terapias contra o câncer. Os principais obstáculos incluem: Instabilidade físico-química: Os lipossomas podem sofrer processos de oxidação e hidrólise, comprometendo sua eficácia e segurança. Além disso, sua instabilidade coloidal em meios fisiológicos pode afetar a liberação controlada do fármaco. Interações com proteínas plasmáticas e a formação da “coroa proteica” também podem interferir na entrega terapêutica; Reconhecimento pelo sistema imune: O sistema reticulo endotelial (RES) pode identificar e eliminar rapidamente os lipossomas, reduzindo seu tempo de circulação e eficácia terapêutica. Modificações na superfície, como o uso de polietilenoglicol (PEG), têm sido empregadas para “camuflar” os lipossomas e prolongar sua permanência na corrente sanguínea e Complexidade na fabricação e controle de qualidade: A produção de lipossomas requer processos rigorosos para garantir uniformidade no tamanho, carga e encapsulação do fármaco. A falta de métodos analíticos estandarizados dificulta a avaliação consistente de sua qualidade e eficácia.
Apesar desses desafios, os lipossomas continuam a ser uma plataforma promissora em nanomedicina, com avanços em tecnologias de liberação controlada e terapias combinadas. Pesquisas contínuas visam superar essas limitações e expandir suas aplicações clínicas, com destaque para as seguintes abordagens inovadoras: lipossomas multifuncionais e terapias combinadas, lipossomas sensíveis estímulos externos, modificações superficiais para melhorar a estabilidade e especificidade e avanço na produção e controle de qualidade.
A moagem assistida por surfactante (SAG) é um método eficaz na síntese de nanocristais de norfloxacina, os quais melhoram a solubilidade e a biodisponibilidade do fármaco. (GOMES; FREITAS; DINIZ, 2013)
De acordo com Gomes; Freitas e Diniz, 2013 o SAG apresenta algumas vantagens, incluindo a simplicidade do processo e a possibilidade de produção em larga escala. No entanto, também destacam a necessidade de otimização dos parâmetros de moagem para garantir a qualidade e a estabilidade dos nanocristais produzidos.
Nos estudos desenvolvidos por FERRARI; ARAUJO e PIANARO (2017) sobre nanotubos de haloista (HNTs) combinados com polímeros para liberação controlada de fármacos permitiram a obtenção de nanocompósitos com boa biocompatibilidade e capacidade de liberação sustentada.
Os autores destacam que os halloysite nanotubes (HNTs)possuem uma estrutura tubular única, com cavidade interna oca e paredes de alumino-silicato, o que os torna adequados para a encapsulação e liberação controlada de fármacos. É enfatizada a facilidade de modificação superficial dessas nanopartículas, permitindo a funcionalização com polímeros, ligantes e biomoléculas para aumentar a biocompatibilidade e promover o direcionamento seletivo a tecidos-alvo.
Na discussão, os autores reconhecem os desafios relacionados à produção em larga escala, incluindo a necessidade de padronização de tamanho, pureza e reprodutibilidade das propriedades físico-químicas. Apesar disso, argumentam que os HNTs apresentam um grande potencial terapêutico, sendo explorados para aplicações em liberação prolongada de medicamentos, nanocarregadores para terapias gênicas e plataformas para engenharia tecidual. O artigo também ressalta a necessidade de estudos toxicológicos e clínicos mais abrangentes para validar sua segurança e eficácia.
Os avanços recentes na nanotecnologia de DNA para detecção e terapia de câncer tem sido abordado por ESMAEILPOUR et al. (2025) mostrando que as estruturas de DNA têm mostrado alta especificidade e sensibilidade, além de sistemas de entrega direcionada que aumentam a eficácia das terapias.
Os principais progressos na engenharia de nanostruturas de DNA encontrados pelos autores foram: design e auto-montagem mais sofisticados, estabilidade e “camuflagem” em ambiente biológico, alvo e entrega direcionada (theranostics), sensores e detecção ultrasensível, plataformas multimodais (imagem + terapia), novas abordagens imunoterápicas e vacinais e rumo à escalabilidade e padronização.
No entanto, os autores também mencionam os desafios e limitações relacionados à estabilidade e à produção em larga escala dessas estruturas, tais como, degradação e imunogenicidade in vivo, entrega eficiente a tumores sólidos e tradução clínica.
O uso de nanomedicina no tratamento de doenças pulmonares tem sido estudado por GARCIA (2014). Os resultados encontrados pelo autor sugerem que as nanoterapias podem melhorar a entrega de fármacos ao pulmão, aumentando a eficácia dos tratamentos.
Garcia ressalta que os nanocarreadores (lipossomas, micelas, nanoemulsões, nanopartículas poliméricas) têm propriedades extremamente úteis do ponto de vista farmacoterápico para aplicação pulmonar.
Ele destaca que, embora ainda em fase inicial de pesquisa, os estudos sugerem que esses sistemas de liberação de fármacos podem ser promissores tanto para tratamento local quanto sistêmico de doenças pulmonares.
No entanto, dentre as principais vantagens das nanoterapias frequentemente (na terapia pulmonar e em geral) abordadas por Garcia e outros autores estão, melhor entrega dirigida / “targeting”, aumento da biodisponibilidade, liberação controlada / sustentada, menor toxicidade / menos efeitos colaterais, capacidade de atravessar barreiras biológicas, versatilidade de formulação e tratamento local e sistêmico.
Os desafios abordados por Garcia em seus estudos foram: fase inicial de pesquisa / poucas evidências clínicas – o autor observou que o uso de nanopartículas para aplicação pulmonar ainda está em fase inicial de investigação, com poucos estudos clínicos consolidados; toxicidade a longo prazo e segurança – embora as nanopartículas utilizadas pela via pulmonar pareçam apresentar “baixo potencial toxicológico”, Garcia enfatiza a necessidade de estudos contínuos para avaliar possíveis efeitos adversos com uso repetido e em longo prazo, ou seja, a segurança crônica é uma lacuna; deposição, eliminação e dinâmica in vivo desconhecidas – um desafio conceitual citado é o estudo dos processos dinâmicos in vivo — como as nanopartículas interagem com o organismo (distribuição, deposição, depuração) ainda não está bem elucidado e por fim o desenvolvimento e otimização de formulações, em que o autor menciona que são necessárias pesquisas sobre: modificação de superfície para melhorar a capacidade de “targeting” (seletividade aos alvos); otimização do preparo das nanopartículas para aumentar sua eficácia no transporte de fármacos e a viabilidade industrial / escalabilidade das formulações.
O estudo desenvolvido por JAYAWARDENA et al. (2020) investigou a entrega colônica de peptídeo intestinal vasoativo (VIP) utilizando nanomedicina. Os resultados mostram que a formulação proposta alivia a colite em modelos animais e tem potencial para uso como cápsula oral.
Os autores discutem os benefícios da entrega colônica de VIP, incluindo a redução de efeitos colaterais e a eficácia terapêutica. Eles também destacam os desafios na formulação e na necessidade de mais estudos clínicos.
Entre os desafios na formulação abordados pelos autores podemos citar: estabilidade do peptídeo / integridade durante o processamento; dissolução seletiva / responsiva ao pH colônico; reformulação das micelas ativas após a liberação; perfil de liberação reproduzível / controle de cinética; estabilidade do sistema durante armazenamento; escalabilidade / viabilidade de produção e barreiras fisiológicas do trato gastrointestinal.
Dentre os estudos clínicos sugeridos pelos autores podemos citar: estudos pré-clínicos limitados (modelo animal, dose única, via local); fórmula “humana equivalente” testada apenas in vitro; segurança sistêmica / efeitos adversos; eficácia comparativa em humanos e em casos clínicos variados; variabilidade interindividual / fatores fisiológicos humanos; desafios regulatórios / padronização e trânsito gastrointestinal / biodistribuição / destino das nanopartículas.
Os autores JIMÉNEZ-MARTÍNEZ e VÁZQUEZ-LIRA (2025) revisaram o uso de nanopartículas de ouro (AuNPs) na nanotecnologia verde. Os resultados indicam que as AuNPs têm aplicações terapêuticas e diagnósticas promissoras, com métodos de síntese sustentáveis.
Os autores discutem as vantagens das AuNPs, como sua biocompatibilidade e facilidade de modificação. Eles também abordam as preocupações relacionadas à toxicidade e à necessidade de métodos de síntese mais ecológicos.
O estudo da dosimetria in vitro na classificação toxicológica de nanomateriais de baixo aspecto tem sido abordado por PAL et al. (2015). Os principais resultados encontrados pelos autores foram: importância da dosimetria in vitro – os autores mostram que considerar apenas a concentração nominal (mg/mL) pode levar a interpretações erradas de toxicidade e que diferentes nanomateriais sedimentam, se difundem e interagem com as células de maneiras distintas, o que altera a dose efetivamente entregue às células; efeito dos protocolos de dispersão – o método de dispersão (tempo de sonicação, uso de dispersantes, agitação) influencia o tamanho dos aglomerados e a estabilidade da suspensão e suspensões mais bem dispersas resultaram em uma exposição mais uniforme e previsível das células, levando a classificações de toxicidade diferentes; ranking de toxicidade dependente do protocolo – o ranking relativo de toxicidade entre os diferentes nanomateriais mudou quando a dosimetria real (dose depositada na superfície celular) foi considerada em vez da concentração nominal. Isso significa que, sem normalização para dose efetiva, um material pode parecer mais ou menos tóxico do que realmente aparenta ser e a modelagem da dose entregue – o estudo utilizou modelos como o ISDD (In vitro Sedimentation, Diffusion and Dosimetry) para estimar a fração de dose que efetivamente atinge as células. Essa abordagem melhorou a consistência dos dados e a comparação entre materiais.
No entanto, os autores encontraram as seguintes implicações em seus estudos, necessidade de padronização; importância da dosimetria baseada na dose entregue; melhoria na avaliação de risco e redução de resultados falso-positivos ou falso-negativos.
Uma análise de SWOT da inovação na entrega de fármacos por meio da nanomedicina foi desenvolvido por ZHANG; LI e MA (2024). Os resultados destacam as oportunidades de mercado e os avanços terapêuticos, bem como os desafios regulatórios e técnicos.
Os autores discutem as forças, fraquezas, oportunidades e ameaças associadas à nanomedicina, enfatizando a necessidade de colaboração entre pesquisa, indústria e órgãos reguladores para superar os obstáculos
Na Tabela 1 é mostrado a análise de SWOT da Nanomedicina em entrega de fármacos baseado no estudo de ZHANG; LI e MA (2024).
Tabela 1 – Análise SWOT da Nanomedicina em Entrega de Fármacos
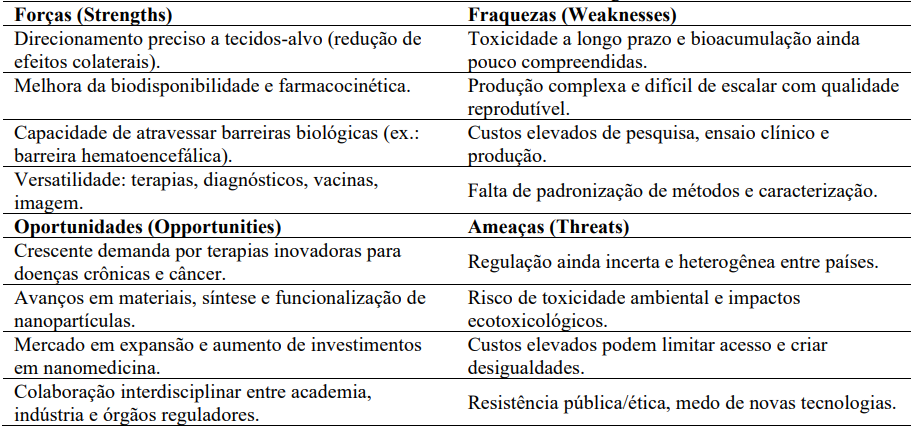
Analisando a Tabela 1 pode-se sugerir as seguintes estratégias: Aproveitar Forças + Oportunidades, investindo em pesquisas colaborativas e consórcios público-privados para acelerar inovação e reduzir custos; Mitigar Fraquezas desenvolvendo protocolos padronizados de caracterização, segurança e escalabilidade industrial e por fim Reduzir Ameaças promovendo regulamentação clara, estudos de impacto ambiental e campanhas de educação pública para melhorar a aceitação social.
5. CONCLUSÃO
A nanotecnologia consolidou-se como um pilar estratégico no avanço da indústria farmacêutica, com aplicações já bem estabelecidas em oncologia, bem como no tratamento de doenças respiratórias e gastrointestinais. Esta revisão corroborou a eficácia de sistemas consagrados, como lipossomas e nanopartículas, ao mesmo tempo em que evidenciou o potencial de abordagens inovadoras, incluindo nanotubos de haloisita e bio-nanorrobôs. Persistem, contudo, desafios relevantes relacionados à biocompatibilidade, à toxicidade, à escalabilidade dos processos produtivos e às exigências regulatórias. Ainda assim, as perspectivas futuras apontam para terapias mais eficazes, personalizadas e ambientalmente sustentáveis, reforçando o papel transformador da nanotecnologia na farmacoterapia contemporânea.
REFERÊNCIAS
ABDOLLAHZADEH, H.; PEEPLES, T. L.; SHAHCHERAGHI, M. DNA nanotechnology in oligonucleotide drug delivery systems: prospects for bio-nanorobots in cancer treatment. Advanced Drug Delivery Reviews, v. 180, p. 114016, 2025. doi: 10.1016/j.addr.2025.115673.
AL-OBAIDY, R.; HAIDER, A. J.; AL-MUSAWI, S.; ARSAD, N. Targeted delivery of paclitaxel drug using polymer-coated magnetic nanoparticles for fibrosarcoma therapy: in vitro and in vivo studies. Scientific Reports, v. 13, n. 3180, 2023.
AL-ZHARANI, M.; SAQUIB HASNAIN, M. D.; AL-EISSA, M. S.; ALQAHTANI, R. A. Novel drug delivery to the brain for neurodegenerative disorder treatment using carbon nanotubes. Journal of King Saud University – Science, v. 36, n. 11, 2024.
ARAÚJO, M. V.; ROCHA, J. V. R.; BAKUZIS, A. F. Nanopartículas magnéticas à base de óxido de ferro: propriedades magnéticas e aplicações na medicina. Revista Brasileira de Ensino de Física, v. 46, supl. 1, p. e0187, 2024. doi.org/10.1590/1806-9126-RBEF-2024-0187.
ASCO: AMERICAN SOCIETY OF CLINICAL ONCOLOGY. Asco: American Society of Clinical Oncology, 2025. Disponível em: https://www.asco.org/abstractspresentations/ABSTRACT313427.
BHALANI, D. V.; NUTAN, B.; KUMAR, A.; SINGH CHANDEL, A. K. Bioavailability Enhancement Techniques for Poorly Aqueous Soluble Drugs and Therapeutics. Biomedicines, v. 10, n. 9, 2022. Disponível em: https://doi.org/10.3390/biomedicines10092055.
CHARY, P. S.; SHAIKH, S.; BHAVANA, V.; RAJANA, N.; VASAVE, R.; MEHRA, N. K. Emerging role of nanocrystals in pharmaceutical applications: A review of regulatory aspects and drug development process. Applied Materials Today, v. 40, n. 102334, 2024.
COURTEMANCHE, G.; WADANAMBY, R.; KIRAN, A.; TORO-ALZATE, L. F.; DIGGLE, M.; CHAKRABORTY, D.; BLOCKER, A.; VAN DONGEN. Looking for Solutions to the Pitfalls of Developing Novel Antibacterials in an Economically Challenging System. Microbiology Research, v. 12, n. 1, pp. 173-185, 2021. https://doi.org/10.3390/microbiolres12010013.
DAS, D.; MAITY, N.; H. V.; ANURADHA. Nanotechnology: a revolution in targeted drug delivery. International Journal of Basic & Clinical Pharmacology, v. 6, n. 12, pp. 2766-2773.
DING, W.; LOU, C.; QIU, J.; ZHAO, Z.; ZHOU, Q.; LIANG, M.; JI, Z.; YANG, S.; XING, D. Targeted Fe-filled carbon nanotube as a multifunctional contrast agent for thermoacoustic and magnetic resonance imaging of tumor in living mice. Nanomedicine: Nanotechnology, Biology, and Medicine, v. 12, n. 1, pp. 235–244, 2016. https://doi.org/10.1016/j.nano.2015.08.008.
DRISTANT, U.; MUKHERJEE, K.; SAHA, S.; MAITY, D. An Overview of Polymeric Nanoparticles-Based Drug Delivery System in Cancer Treatment. Technology in Cancer Research & Treatment, v. 22, n. 15330338231152083, 2023. https://doi.org/10.1177/15330338231152083.
ESMAEILPOUR, D.; GHOMI, M.; NAZARZADEH ZARE, E.; SILLANPÄÄ, M. Recent advances in DNA nanotechnology for cancer detection and therapy. Advanced Drug Delivery Reviews, v. 180, p. 114017, 2025a. doi.org/10.1016/j.ijbiomac.2025.142136.
ESMAEILPOUR, M. et al. Emerging DNA nanostructures for cancer theranostics: from design to clinical translation. Advanced Drug Delivery Reviews, v. 210, p. 115276, 2025b.
FARJADIAN, F. et al. Nanopharmaceuticals and nanomedicines currently on the market: challenges and opportunities. Nanomedicine (London), v. 14, n. 1, p. 93-126, 2019. doi:10.2217/nnm-2018-0120.
FERRARI, P. C.; ARAUJO, F. F.; PIANARO, S. A. Halloysite nanotubes-polymeric nanocomposites: characteristics, modifications and controlled drug delivery approaches. Cerâmica, v. 63, n. 367, p. 423-431, 2017. doi.org/10.1590/0366-69132017633682167.
GARCIA, F. M. Nanomedicine and therapy of lung diseases. Einstein (São Paulo), v. 12, n. 4, p. 531-533, 2014. doi:10.1590/S1679-45082014MD3113.
GERMAIN, M. et al. Delivering the power of nanomedicine to patients today. Journal of Controlled Release, v. 326, p. 164-171, 2020. doi:10.1016/j.jconrel.2020.07.007.
GOMES, L. B. S.; FREITAS, R. A.; DINIZ, F. B. Surfactant-assisted mechanosynthesis of norfloxacin nanocrystals. Materials Research, v. 16, n. 2, p. 407-412, 2013. https://doi.org/10.1590/1980–5373–MR–2024–0195.
GUPTA, S.; KESARLA, R.; OMRI, A. Formulation strategies to improve the bioavailability of poorly absorbed drugs with special emphasis on self-emulsifying systems. ISRN Pharmaceutics, v. 2013, n. 848043, 2013. https://doi.org/10.1155/2013/848043.
JAHANGIRIAN, H. et al. A review of drug delivery systems based on nanotechnology and green chemistry: green nanomedicine. International Journal of Nanomedicine, v. 12, p. 29572978, 2017. doi:10.2147/IJN.S127683.
JAYARAJA, S.; JIANGB, W.; MUDALIGE, T. Doxorubicin HCl Release from Liposomal Doxorubicin Formulations Autonomous Capillary Electrophoretic (CE) In Vitro Release Test (IVRT) Method. Fórum Científico: U.S. Food and Drug Administration (FDA), 2023. Disponível em: https://www.fda.gov/science–research/fda–science–forum/doxorubicin–hclrelease–liposomal–doxorubicin–formulations–autonomous–capillary–electrophoretic–ce.
JAYAWARDENA, D. et al. Colonic delivery of vasoactive intestinal peptide nanomedicine alleviates colitis and shows promise as an oral capsule. Science Translational Medicine, v. 12, n. 564, p. eaay0525, 2020a. doi:10.2217/nnm-2020-0280.
JAYAWARDENA, D. et al. Peptide amphiphile micelles as a platform for targeted therapeutic delivery: application to inflammatory bowel disease. Nanomedicine: Nanotechnology, Biology and Medicine, v. 28, p. 102218, 2020b.
JIMÉNEZ-MARTÍNEZ, W. D. J.; VÁZQUEZ-LIRA, J. C. Nanotecnología verde: una revisión de nanopartículas áuricas. Mundo Nano, v. 18, n. 35, p. e69858, 2025. doi:10.22201/ceiich.24485691e.2025.35.69858.
KADAM, R. N.; SHENDGE, R. S.; PANDE, V. V. Nanoplex: a novel nanoparticle. Brazilian Journal of Pharmaceutical Sciences, v. 51, n. 2, p. 255-265, 2015. doi.org/10.1590/S198482502015000200002.
KRAUSS, A. C. et al. Approval Summary: (Daunorubicin and Cytarabine) Liposome for Injection for the Treatment of Adults with High-Risk Acute Myeloid Leukemia. Clinical Cancer Research, v. 25, n. 9, pp. 2685–2690, 2019. https://doi.org/10.1158/1078-0432.CCR18-2990.
LA ZERDA, A.; ZAVALETA, C.; KEREN, S.; VAITHILINGAM, S.; BODAPATI, S.; LIU, Z.; LEVI, J.; SMITH, B. R.; MA, T.-J.; ORALKAN, O.; CHENG, Z.; CHEN, X.; DAI, H.; KHURI-YAKUB, B. T.; GAMBHIR, S. S. Carbon nanotubes as photoacoustic molecular imaging agents in living mice. Nature Nanotechnology, v. 3, pp. 557-562, 2008.
LANCET, J. E. et al. Five-year final results of a phase III study of CPX-351 versus 7+3 in older adults with newly diagnosed high-risk/secondary AML. In: 2020 ASCO Virtual Scientific Program. Disponível em: https://www.asco.org/abstracts–presentations/ABSTRACT313427.
LI, H. et al. Stimuli-activatable nanomedicine meets cancer theranostics. Theranostics, v. 13, n. 15, p. 5386-5417, 2023. doi:10.7150/thno.87854.
LI, S. et al. A DNA nanorobot functions as a cancer therapeutic in response to a molecular trigger in vivo. Nature Biotechnology, v. 36, n. 3, p. 258-264, 2018.
LÓPEZ GONZÁLEZ, E. J. et al. Aproximación a las mediciones a nivel nano, con énfasis en la biomedicina. Medisur, v. 21, n. 4, p. 865-878, 2023. Disponível em: http://scielo.sld.cu/pdf/ms/v21n4/1727–897X–ms–21–04–865.pdf. Acesso em: 17 ago. 2025.
LIU, Z.; TABAKMAN, S.; WELSHER, K.; DAI, H. Carbon Nanotubes in Biology and Medicine: in vitro and in vivo Detection, Imaging and Drug Delivery. Materials Science, v. 1, 2009.
MA, P.; MUMPER, R. J. Paclitaxel Nano-Delivery Systems: A Comprehensive Review. Journal of Nanomedicine & Nanotechnology, v. 4, n. 2, 2013. https://doi.org/10.4172/21577439.1000164.
MEISNER, R. et al. A phase 3 multicenter, randomized, double-blind, placebo-controlled study of inhaled liposomal cyclosporine (L-CsA-i) for prevention of bronchiolitis obliterans syndrome after lung transplantation. American Journal of Transplantation, v. 23, n. 4, p. 531543, 2023.
MODY, N.; TEKADE, R. K.; MEHRA, N. K.; CHOPDEY, P.; JAIN, N. K. Dendrimer, liposomes, carbon nanotubes and PLGA nanoparticles: one platform assessment of drug delivery potential. AAPS PharmSciTech, v. 15, n. 2, pp. 388–399, 2014. https://doi.org/10.1208/s12249–014–0073–3.
OLSON, D. et al. Amikacin liposome inhalation suspension for treatment-refractory lung disease caused by Mycobacterium avium complex (CONVERT). American Journal of Respiratory and Critical Care Medicine, v. 195, n. 6, p. 814-823, 2017.
ORTEGA-GALINDO, A. S. et al. Los liposomas en nanomedicina: del concepto a sus aplicaciones clínicas y tendencias actuales en investigación. Mundo Nano, v. 16, n. 31, p. e69795, 2023. doi:10.22201/ceiich.24485691e.2023.31.69795.
PAL, A. K. et al. Implications of in vitro dosimetry on toxicological ranking of low aspect ratio engineered nanomaterials. Nanotoxicology, v. 9, n. 7, p. 871-885, 2015. doi:10.3109/17435390.2014.986670.
PARDHI, V. P.; VERMA, T.; FLORA, S. J. S.; CHANDASANA, H.; SHUKLA, R. Nanocrystals: An Overview of Fabrication, Characterization and Therapeutic Applications in Drug Delivery. Current Pharmaceutical Design, v. 24, n. 43, pp. 5129–5146, 2018. https://doi.org/10.2174/1381612825666190215121148.
PATRA, J. K. et al. Nano based drug delivery systems: recent developments and future prospects. Journal of Nanobiotechnology, v. 16, n. 71, p. 1-33, 2018. doi:10.1186/s12951-0180392-8.
PETROVIC, S.; BITA, B.; BARBINTA-PATRASCU, M. E. Nanoformulations in pharmaceutical and biomedical applications: green perspectives. International Journal of Molecular Sciences, v. 25, n. 11, p. 5842, 2024. doi:10.3390/ijms25115842.
PRENCIPE, G.; TABAKMAN, S. M.; WELSHER, K.; LIU, Z.; GOODWIN, A. P.; ZHANG, L.; HENRY, J.; DAI, H. PEG Branched Polymer for Functionalization of Nanomaterials with Ultralong Blood Circulation. Materials Science, v. 1, 2009.
ROCHA, B.; de MORAIS, L. A.; VIANA, M. C.; CARNEIRO, G. Promising strategies for improving oral bioavailability of poor water-soluble drugs. Expert Opinion on Drug Discovery, v. 18, n. 6, pp. 615–627, 2023. https://doi.org/10.1080/17460441.2023.2211801.
ROSSIER, B.; JORDAN, O.; ALLÉMANN, E.; RODRÍGUEZ-NOGALES, C. Nanocrystals and nanosuspensions: an exploration from classic formulations to advanced drug delivery systems. Drug Delivery and Translational Research, v. 14, n. 12, pp. 3438–3451, 2024. https://doi.org/10.1007/s13346–024–01559–0.
SAKHI, M.; KHAN, A.; IQBAL, Z.; KHAN, I.; RAZA, A.; ULLAH, A.; NASIR, F.; KHAN, S. A. Design and Characterization of Paclitaxel-Loaded Polymeric Nanoparticles Decorated With Trastuzumab for the Effective Treatment of Breast Cancer. Frontiers in Pharmacology, v. 13, n. 855294, 2022. https://doi.org/10.3389/fphar.2022.855294.
SANT’ANNA, L. S.; FERREIRA, A. P.; ALENCAR, M. S. M. Patents, drug delivery and public health protection: health risk management for nanopharmaceuticals. Journal of Technology Management & Innovation, v. 8, n. 2, p. 107-118, 2013. doi:10.4067/S071827242013000200009.
SELZLER, M. et al. Uso de nanopartículas em modelos animais para o tratamento do câncer de próstata: uma revisão sistemática. Acta Cirúrgica Brasileira, v. 38, p. e385923, 2023. doi:10.1590/acb385923.
SEYAM, S.; ALALLAM, B.; FADZILAH, N. H.; KADIR, E. A. Advances in paclitaxel nanoformulations: A systematic review of in vivo therapeutic efficacy and safety enhancements. Journal of Controlled Release, v. 385, n. 10, 2025.
SHUKLA, S.; M, S.; K, S.; G, S.; N, V.; V, V.; M, S. Improving Bioavailability and Solubility of Poorly Soluble Drugs- A systematic review. Journal of Neonatal Surgery, Lahore, Pakistan, v. 14, n. 32S, p. 2678–2684, 2025. Disponível em: https://jneonatalsurg.com/index.php/jns/article/view/7802. Acesso em: 28 set. 2025.
TENCHOV, R.; BIRD, R.; CURTZE, A. E.; ZHOU, Q. Lipid nanoparticles—From liposomes to mRNA vaccine delivery, a landscape of research diversity and advancement. ACS Nano, v. 15, n. 11, p. 16982-17015, 2021. doi:10.1021/acsnano.1c04996.
TENCHOV, R.; HUGHES, K.; GANESAN, M.; IYER, K. A.; RALHAN, K.; DIAZ, L. M. L.; BIRD, R. E.; IVANOV, J. M.; ZHOU, Q. A. Transforming Medicine: Cutting-Edge Applications of Nanoscale Materials in Drug Delivery. ACS Nano, v. 19, n. 4, 2025.
VIEIRA, D. B.; GAMARRA, L. F. Advances in the use of nanocarriers for cancer diagnosis and treatment. Einstein (São Paulo), v. 14, n. 1, 2016. doi.org/10.1590/S167945082016RB3475.
VILELA, A. P. et al. Preparation, characterization and stability study of eugenol-loaded Eudragit RS100 nanocapsules for dental sensitivity reduction. Brazilian Archives of Biology and Technology, v. 66, spe, p. e23230300, 2023. doi:10.1590/1678-4324-ssbfar-2023230300.
WANG, K.; ZHU, Y.; LIU, K.; ZHU, H.; OUYANG, M. Adverse events of biologic or small molecule therapies in clinical trials for inflammatory bowel disease: A systematic review and meta-analysis. Heliyon, v. 10, n. 4, p. e25357, 2024. https://doi.org/10.1016/j.heliyon.2024.e25357.
WANG, X. et al. Tumor microenvironment-activated DNA nanorobots for selective cytotoxicity and tumor growth inhibition. ACS Nano, v. 18, n. 2, p. 1501-1513, 2024.
WINDRED, C. et al. Focal laser ablation of prostate cancer with gold–silica nanoshells: Phase I pilot trial. Proceedings of the National Academy of Sciences, v. 116, n. 37, p. 18590-18596, 2019.
WU, W.; PU, Y.; SHI, J. Nanomedicine-enabled chemotherapy-based synergistic cancer treatments. Journal of Nanobiotechnology, v. 20, n. 1, p. 4, 2022. doi:10.1186/s12951-02101181-z.
YANG, S. et al. Nanomedicine therapies for pediatric diseases. Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology, v. 16, n. 5, p. e1996, 2024. doi:10.1002/wnan.1996.
YASIR, M.; SARA, U. V. S.; SOM, I. Development of a new HPLC method for in vitro and in vivo studies of haloperidol in solid lipid nanoparticles. Brazilian Journal of Pharmaceutical Sciences, v. 53, n. 2, p. e16047, 2017. doi.org/10.1590/s2175-97902017000216047.
ZHANG, H.; LI, S.; MA, X. Transforming healthcare with nanomedicine: a SWOT analysis of drug delivery innovation. Drug Design, Development and Therapy, v. 18, p. 3499-3521, 2024. doi:10.2147/DDDT.S470210.
ZHANG, T. et al. HApt-tFNA nanorobots selectively target HER2-positive breast cancer cells and induce lysosomal degradation. Biomaterials, v. 225, p. 119512, 2019.
ZHANG, Z.; ZHANG, J.; TIAN, J.; LI, H. A polydopamine nanomedicine used in photothermal therapy for liver cancer knocks down the anti-cancer target NEDD8-E3 ligase ROC1 (RBX1). Journal of Nanobiotechnology, v. 19, p. 323, 2021. doi:10.1186/s12951-021-01063-4.
ZHOU, H. et al. Polymeric Nanoparticles Simultaneously Delivering Paclitaxel Prodrug and Combretastatin A4 with Exceptionally High Drug Loading for Cancer Combination Therapy. Nano Letters, v. 25, n. 9, 2025.
U.S. FOOD & DRUG ADMINISTRATION. U.S Food & Drug Administration, 2017. U.S. Departament of Health & Human Services. FDA approves liposome-encapsulated combination of daunorubicin-cytarabine for adults with some types of poor prognosis AML. Disponível em: https://www.accessdata.fda.gov/.
U.S. FOOD & DRUG ADMINISTRATION. U.S Food & Drug Administration, 2025. U.S. Departament of Health & Human Services. Disponível em: https://www.accessdata.fda.gov/.
1Discente do Curso Superior de Farmácia do Centro Universitário Funvic – UniFUNVIC. e-mail: renan.01011348.pinda@unifunvic.edu.br
2Docente do Curso Superior de Farmácia do Centro Universitário Funvic – UniFUNVIC. e-mail: prof.claudiokelly.pinda@unifunvic.edu.br
