REGISTRO DOI:10.5281/zenodo.11194502
Joanisse Nascimento Siqueira Da Silva
José Vinicius Ferreira Dos Santos
Jéssica Pereira Dos Santos
Orientador: Prof.ª Dra. Mônica Batista De Almeida
RESUMO
A leucemia linfóide aguda é uma neoplasia maligna de células hematopoiéticas de linhagem linfóide. A doença se dá por acúmulos de linfoblastos B ou T anormais que podem estar localizados na medula óssea, no sangue periférico, e demais locais medulares. O tratamento imunoterápico da leucemia linfoblástica aguda por células T-CAR (receptor de antígeno quimérico da célula T) surge como um método revolucionário, que tem como principal alvo não apenas o tumor em si, mas sim, a potencialização do sistema imunológico. A terapia com células T-CAR consiste em modificar geneticamente os linfócitos T para potencializar sua ação em combate às células cancerosas. Trata-se de uma revisão integrativa da literatura sobre a leucemia linfoblástica do tipo B e o seu tratamento por meio de células T quiméricas que teve como ponto de partida o seguinte questionamento: como a adição de receptores de antígenos CAR em linfócitos T traz efeitos eficazes ao tratamento de pacientes com leucemia linfóide aguda do tipo B? Para responder ao questionamento, buscando garantir a veracidade dos conteúdos pesquisados, a busca e seleção dos artigos de estudos foram feitas em línguas inglesa, espanhola e portuguesa através das bases de dados: National Library of Medicine (PUBMED), Biblioteca Virtual em Saúde (BVS), Google Acadêmico, Scientific Electronic Library Online (SCIELO). Observou-se que, mesmo diante de alguns efeitos adversos, o tratamento com células T do receptor de antígeno se mostra mais benéfico quando comparado aos tratamentos mais agressivos, como a quimioterapia e a radioterapia. Palavras chave: leucemia linfoblástica aguda de células B, células T-CAR, imunoterapia.
ABSTRACT
Acute lymphoblastic leukemia is a malignant neoplasm of hematopoietic cells of lymphoid lineage. The disease is caused by accumulation of abnormal B or T lymphoblasts that may be located in the bone marrow, peripheral blood, and other medullary sites. The immunotherapeutic treatment of acute lymphoblastic leukemia by T-CAR (chimeric T cell antigen receptor) cells emerges as a revolutionary method, whose main target is not the tumor itself, but the potentiation of the immune system. Therapy with T-CAR cells consists of genetically modifying T lymphocytes to potentiate their action against cancer cells. This is an integrative review of the
literature on type B lymphoblastic leukemia and its treatment using chimeric T cells, whose starting point was the following question: how does the addition of CAR antigen receptors to T lymphocytes bring about effective effects? to the treatment of patients with type B acute lymphoblastic leukemia?. To answer the question, seeking to guarantee the veracity of the researched content, the search and selection of study articles were carried out in English, Spanish and Portuguese through the following databases: National Library of Medicine (PUBMED), Virtual Health library (VHL), Google Scholar, Scientific Electronic Library Online ( SCIELO). It was observed that, even in the face of some adverse effects, treatment with antigen receptor T cells is more beneficial when compared to more aggressive treatments, such as chemotherapy and radiotherapy.
Keywords: B-cell acute lymphoblastic leukemia, T-CAR cells, Immunotherapy.
1. INTRODUÇÃO
A leucemia linfoblástica aguda do tipo B (LLA-B) é uma neoplasia que atinge as células da linhagem linfóide. A produção dos linfoblastos de forma anormal e excessiva na medula óssea dificulta a produção e a liberação das outras células do sistema hemático. A estimativa do Instituto Brasileiro de Câncer (INCA) para o número de casos de leucemias diagnosticadas no Brasil no ano de 2020 foi de 5,55 novos casos a cada 100 mil homens e de 3,95 a cada 100 mil mulheres (ALMEIDA et al., 2021).
A LLA é um tipo de neoplasia comum em crianças de dois a sete anos, mas também, é uma patologia que acomete em menor número, adultos idosos > 70 anos, sendo uma doença mais grave e de difícil prognóstico nessa faixa etária (INABA e MULLIGHAN, 2020).
Os sintomas são generalizados por conta da pancitopenia (diminuição das linhagens celulares), sendo os mais comuns a febre, hemorragias, hepatoesplenomegalia e linfadenopatia. O diagnóstico é feito a partir de mielograma, sendo confirmada a LLA quando verificado um acúmulo > 25% de blastos leucêmicos na medula óssea. A diferenciação e classificação das leucemias é feita a partir de imunofenotipagem em citometria de fluxo para determinar o padrão antigênico da linhagem de células B (KATO e MANABE, 2017).
A principal forma de tratamento é à base de quimioterapia tendo como objetivo principal, a diminuição de células leucêmicas através da inibição da síntese de DNA. As desvantagens do tratamento são os danos causados aos tecidos normais do indivíduo, induzindo a diversos efeitos adversos (ABREU; SOUZA; GOMES, 2021).
O transplante de células tronco hematopoiéticas é outro método usado, no entanto é uma técnica muito invasiva ao paciente podendo ocasionar diversas complicações. Na última década, agentes moleculares direcionados a imunoterapias foram desenvolvidos e se tornaram peças-chave para novas estratégias terapêuticas (MARTHOM; DEGASPERI; TARSIANO, 2017).
Em busca de um método menos agressivo que possa ter maior eficácia e proporcionar ao paciente maior qualidade de vida, a imunoterapia surge como um novo método revolucionário no combate às células cancerígenas, o tratamento tem como alvo principal não o tumor em si, mas sim, a potencialização do sistema imunológico, partindo do conhecimento que o próprio organismo é capaz de combater as células cancerígenas através do mesmo, contudo, tem sua capacidade reduzida mediante às ações evasivas dos tumores (SILVA, 2021).
Com o advento da imunoterapia, surge uma nova modalidade terapêutica com o desenvolvimento de células T modificada geneticamente para expressar na sua superfície um receptor de antígeno quimérico (CAR), o qual permite direcionar a atividade antitumoral endógena da célula T para um determinado antígeno, resultando na destruição de um alvo específico (CRUZ; MATEUS; BORGES, 2019).
Desta forma, o objetivo desse estudo foi realizar uma revisão de literatura sobre a leucemia linfoblástica aguda de linhagem B, descrevendo os aspectos técnicos da imunoterapia com células T-CAR, além de discutir resultados de ensaios clínicos que utilizaram essa técnica imunoterápica, a fim de compreender a aplicabilidade e o seu prognóstico terapêutico.
2. METODOLOGIA
O trabalho se caracteriza como uma revisão integrativa da literatura com ênfase aos estudos com até cinco anos desde a sua data de publicação, porém, sem deixar de citar artigos com até doze anos, os quais foram importantes para o embasamento teórico sobre a leucemia linfoblástica aguda do tipo B e o seu
tratamento por meio de células T quiméricas. A presente revisão teve como ponto de partida o seguinte questionamento: como a adição de receptores de antígenos CAR em linfócitos T traz efeitos eficazes ao tratamento de pacientes com leucemia linfóide aguda do tipo B?
Para responder ao questionamento, buscando garantir a veracidade dos conteúdos pesquisados, a busca e seleção dos artigos de estudos foram feitas em língua inglesa, espanhola e portuguesa através das bases de dados: National Library of Medicine (PUBMED), Google Acadêmico, Biblioteca Virtual em Saúde (BVS) e Scientific Electronic Library Online (SCIELO).
Para buscas nas bases de dados foram utilizadas palavras-chave como: leucemia linfoblástica aguda de células B, células CAR-T e Imunoterapia. Em inglês estas palavras foram encontradas da seguinte forma: B-cell acute lymphoblastic leukemia, T-CAR cells and Immunotherapy.
A partir da busca pelas palavras-chave, foi feita a seleção de estudos clínicos que abordassem a terapia com células CAR-T. Estes ensaios foram incluídos em uma tabela, onde é mostrada a estratégia utilizada por cada autor e seus respectivos resultados. Os critérios de inclusão estabelecidos foram: artigos escritos na língua inglesa, espanhola ou portuguesa, ensaios clínicos que abordassem apenas leucemia linfoblástica aguda do tipo B, células CAR-T e Imunoterapia.
Para o restante da revisão, foram feitas buscas utilizando os mesmos critérios, desta vez, abrangendo para a seleção de estudos de revisão da literatura. O foco da pesquisa foi descrever sobre a produção e o impacto das células CAR-T voltadas para o tratamento de pacientes com LLA-B. Os critérios de exclusão compreenderam publicações que não estivessem na língua inglesa, espanhola ou portuguesa, teses e dissertações, livros e matérias de sites, além daqueles que não abordassem o tema escolhido.
Mediante os critérios de busca, foram realizadas leituras do resumo de 300 artigos, e destes, foram selecionados 80 para uma leitura completa, onde foram selecionados para o trabalho 30 artigos que faziam abordagem sobre a imunoterapia da LLA-B por células T-CAR. Dos 30 artigos selecionados, oito ensaios clínicos foram usados para a montagem da tabela. A figura 1 mostra o fluxograma que resume a estratégia adotada para a identificação e a inclusão dos estudos.
Figura 1 – Fluxograma da metodologia empregada na revisão da literatur
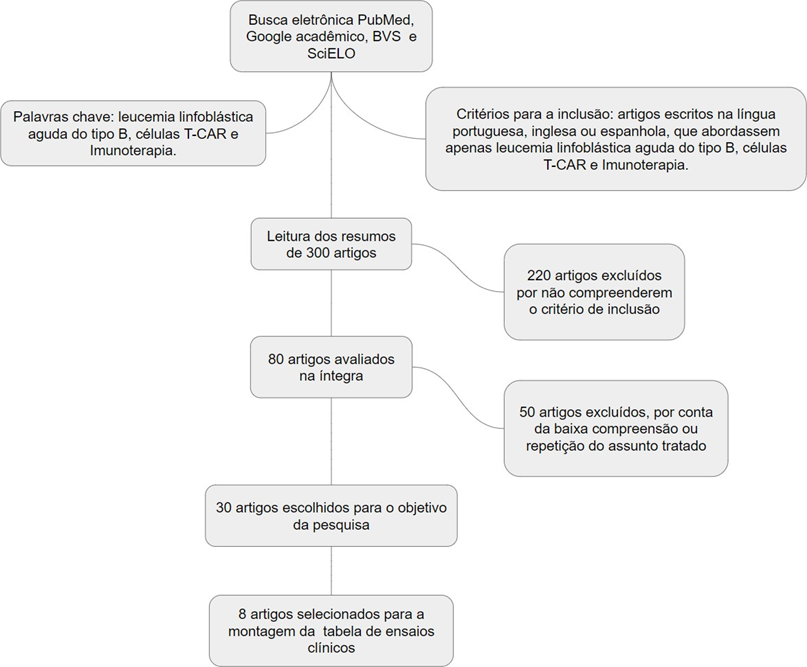
3. RESULTADOS
- LEUCEMIA LINFÓIDE AGUDA TIPO B (LLA-B)
A leucemia linfóide aguda é uma neoplasia maligna de células hematopoiéticas de linhagem linfóide. A doença se dá por acúmulos de linfoblastos B ou T anormais que podem estar localizados na medula óssea, no sangue periférico e demais locais medulares.
A LLA-B é o subtipo mais comum entre as crianças, os blastos de linhagem B no decorrer do seu desenvolvimento expressam antígenos na sua superfície membranar, citoplasma e no núcleo celular, assim os marcadores CD79a, CD10, CD19 e CD22 da linhagem B são pesquisados para identificar o subtipo da leucemia B (MOREIRA et al., 2021).
Os subtipos da linhagem B estão separados em quatro, sendo que cada um deles está ligado ao estágio de maturação dos progenitores, são eles: pró-B,
comum, pré-B e B-maduro. As células do tipo pró-B expõem: HLA-DR, Terminal Desoxinucleotidil Transferase (TdT), CD34, CD19 e CD22. A do tipo comum também denominada Calla, expressa CD10, que tem grande influência positiva no prognóstico, CD22, CD19 e CD20. A LLA do tipo pré-B apresenta cadeia μ citoplasmática, com a inclusão de CD19, CD20 e CD10. A tipo B-maduro caracteriza-se pela expressão de cadeias de imunoglobulina na membrana em sua superfície (CAVALCANTE et al., 2017).
As manifestações clínicas são variadas conforme a proliferação dos blastos, que substituem as células normais, impedindo assim que desencadeiam suas funções. Os sintomas são heterogêneos, alterando-se conforme o comprometimento medular e extramedular, os mais relatados são: frequentes astenia, palidez, petéquias, taquicardia, equimoses, manifestações hemorrágicas, febre devido à neutropenia com favorecimento bacteriana, dispnéia causada pela massa mediastinal, cefaléia causada pelo envolvimento com o sistema nervoso central, adenomegalia, hepatomegalia e dor óssea na criança (BRUTUS, et al. 2019).
O diagnóstico é obtido através da realização do mielograma, porém, é necessário a complementação com outros métodos como as análises bioquímicas, citogenética, citoquímica e de imunofenotipagem. No mielograma é realizada a análise do conteúdo da medula óssea, através da punção aspirada, geralmente no osso esterno ou ilíaco, sendo avaliado na leitura a quantidade de blastos presentes no tecido. O diagnóstico da leucemia é feito quando presente mais de 25% da concentração total de blastos. Para a classificação morfológica, é atualmente utilizado o método French-American-British (FAB), sendo classificada em três categorias: LLA-L1, LLA-L2 e LLA-L3 (PINHEIRO et al., 2019).
Os exames citogenéticos e moleculares verificam a constatação de modificações cromossômicas e genéticas das células afetadas, ligando-as com o reconhecimento, identificação, tipificação de diversas etapas, verificação da intermissão e parecer destas patologias (CAVALCANTE et al., 2017).
Já os métodos citoquímicos têm a finalidade de diferenciar as leucemias mieloides das leucemias linfóides agudas, para tal diferenciação são utilizados os corantes químicos nas células sanguíneas e medula óssea (MOREIRA et al., 2021).
Por fim, temos a imunofenotipagem, sendo fundamental para a determinação da linhagem (B ou T) e estágio de maturação dos linfoblastos, auxiliando também na
classificação, prognóstico, tratamento e investigação da doença residual mínima (BRUTUS et al., 2019).
O tratamento da LLA-B é realizado atualmente através de técnicas como imunoterapias e transplantes de células-tronco hematopoiéticas. Porém, novos métodos menos agressivos que possam ter maior eficácia estão sendo adotados. As principais estratégias são: aumentar a resistência celular, estimular sistemas de reparo ou regeneração, ou ainda, recompor características funcionais específicas de determinados sistemas orgânicos, mediante modulação de genes. Novos tratamentos vêm trazendo resultados positivos como a modificação genética da célula T do próprio paciente para incluir um novo gene que codifica um receptor de antígeno quimérico (CAR) (CAVALCANTE et al., 2017).
Os linfócitos T geneticamente modificados para potencialização da atividade antitumoral se destacam como uma das vertentes imunoterápicas promissoras para o tratamento da leucemia linfóide aguda tipo B (SILVA et al., 2021).
3.2. ENGENHARIA DAS CÉLULAS T-CAR PARA O TRATAMENTO DA LLA-B
Os linfócitos T fazem parte do sistema imunológico adaptativo, se subdividindo em T CD4+ e T CD8+, os quais são capazes de reconhecer agentes infectantes e células cancerígenas e as eliminar. O reconhecimento do antígeno se dá por meio do receptor de células T (TCR) que se liga aos peptídeos apresentados pelo complexo principal de histocompatibilidade (MHC), essa ligação envolverá o antígeno para que o complexo CD3 transporte os sinais de ativação para o citoplasma das células T (DAVILA e SADELAIN, 2017).
A célula T-CAR é uma célula T com o seu TCR substituído por receptores de antígenos quiméricos (CAR). Uma célula CAR-T reconhece e elimina células cancerígenas específicas, independente dos seus MHCs. O domínio intracelular, constituído pelas cadeias de CD3, integrantes do TCR natural, é alterado para uma única cadeia de CD3ζ (CD3 zeta), a qual irá transportar os sinais de ativação celular. Já o domínio extracelular é substituído por uma cadeia simples do fragmento variável (scFv) de anticorpos monoclonais específicos, que funciona no reconhecimento do antígeno-alvo. No tratamento da LLA-B o antígeno mais comumente utilizado é o anti-CD19 (ALMEIDA et al., 2021).
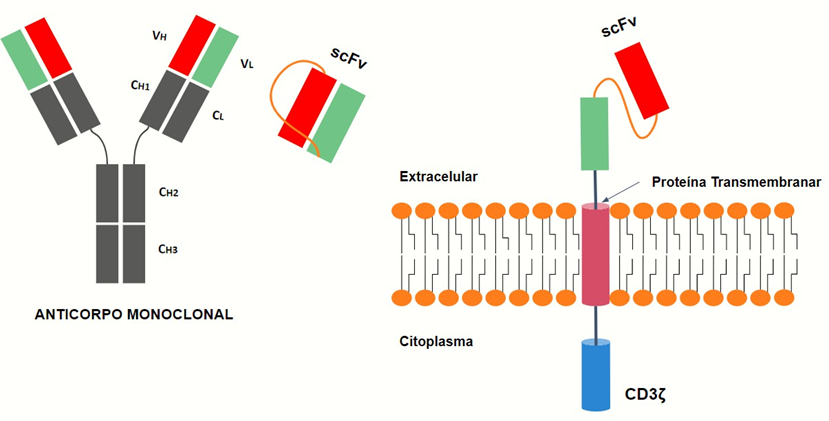
Figura 2. Representação do CAR de primeira geração, onde a região de ligação antigênica é constituída pela cadeia simples do fragmento variável de um anticorpo monoclonal (scFv), seguida de um espaçador transmembranar, o qual se liga a uma cadeia CD3 zeta, responsável pela passagem do sinal de ativação celular.
Fonte: Adaptado de STOCK; SCHMITT; SELLNER, 2019.
Por mais que os CARs de cadeia única, classificados como de primeira geração, sejam capazes de iniciar uma resposta antitumoral citotóxica, eles não são competentes em manter a ação efetiva de maneira prolongada. A fim de aumentar sua capacidade antitumoral, as células CAR-T evoluíram no decorrer do tempo. Foram adicionadas coestimuladores ao domínio intracelular, como o CD28, CD137 (4-1BB), ICOS, CD134 (OX40), CD27 ou CD244 (ATACA e ARSLAN, 2015).
Nos CARs de segunda geração, as proteínas coestimuladoras mais utilizadas são as CD28 e 4-1BB ligada à cadeia CD3ζ. A junção dos domínios resulta na proliferação sustentada de linfócitos enxertados, aumento dos níveis de IL-2, IFN-γ e secreção do fator estimulador de colônias de granulócitos e macrófagos (CARTELLIERI et al., 2010).
DAI et al., 2020, GARDNER et al., 2017, PARK et al., 2019, PAN et al., 2019,
MAUDE et al., 2018, e LIU et al., 2021; utilizaram CARs de segunda geração em sua terapia. Os grupos de DAI et al., 2020, GARDNER et al., 2017, LIU et al., 2021, PAN et al., 2019, e MAUDE et al., 2018; usaram a molécula coestimuladora 4-1BB, já o grupo de PARK et al., 2019, utilizou o coestimulador CD28 ligado à cadeia zeta na realização do seu estudo.
A terceira geração de CARs possui três domínios de sinalização na cadeia citoplasmática. Ligadas à cadeia CD3ζ-CD28, podem estar DAP10, CD134 (OX40) e
CD137 (4-1BB). No entanto, por mais que a variedade na combinação de sinalizadores foi aumentada, a liberação de citocinas e a proliferação das células enxertadas foi inferior, se comparado às células com sinalizadores CD28-CD3ζ (ENBLAD et al., 2018; CARTELLIERI et al., 2010).
O estudo de FRY et al., 2018, e CHEN et al., 2020, utilizaram a terceira geração de CAR em suas estratégias terapêuticas. Ambos utilizaram 4-1BB ligados à cadeia zeta
A quarta geração de células CAR-T preserva a cadeia 4-1BB/CD28-CD3ζ, porém envolve a edição genética da célula T para induzir a produção e liberação de citocinas pró-inflamatórias no local do tumor. A liberação das citocinas será mediada pela sinalização de ligantes coestimuladores adicionais, como 4-1BB-L e CD40-L. As citocinas que são produzidas podem ser IL-15, IL-7 e IL-21 constituindo uma citotoxicidade antitumoral superior em relação às outras gerações de CARs (STOCK; SCHMITT; SELLNER, 2019).
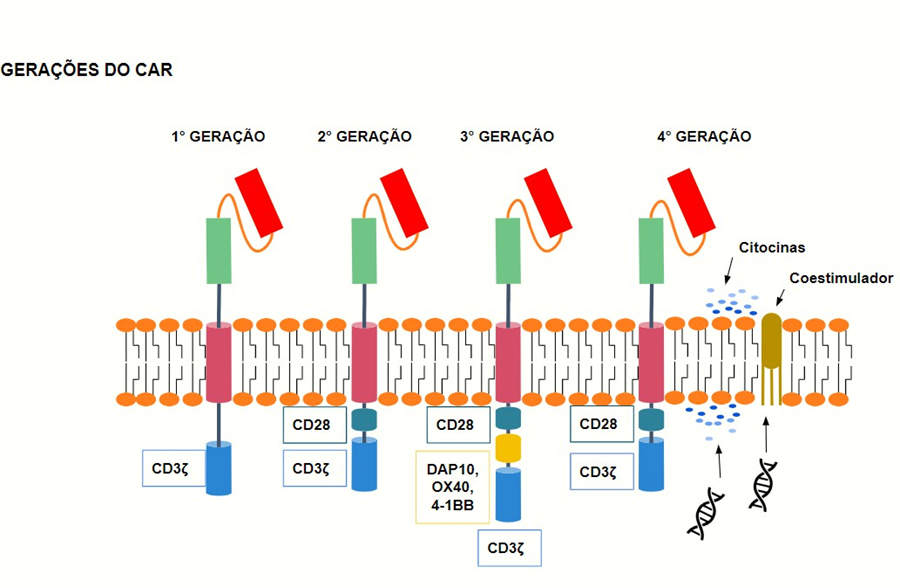
Figura 3. Gerações de receptores de antígenos quiméricos. As células CAR-T de primeira geração induzem a ativação das células T apenas pelo sinal primário através do domínio de sinalização CD3ζ. As células CAR-T de segunda geração foram desenvolvidas com a integração de um domínio coestimulador. As células CAR-T de terceira geração consistem em dois domínios coestimuladores. Já as células CAR-T de quarta geração combinam o domínio coestimulador dos CARs de segunda geração com enzimas, citocinas e ligantes coestimuladores.
Fonte: Adaptado de CARTELLIERI et al., 2010.
3.3. PROCESSO DE PRODUÇÃO DA CÉLULA CAR-T
A produção da célula CAR-T consiste no isolamento e enriquecimento das células T do próprio paciente que será tratado. As células mononucleares são obtidas do sangue periférico e os linfócitos são divididos de modo que porções de T CD4+ e T CD8+ sejam semelhantes. Os instrumentos para o isolamento dos linfócitos T varia entre grupos de produção, porém, basicamente são usadas centrífugas de gradiente de densidade para a remoção de granulócitos, eritrócitos e plaquetas (STOCK; SCHMITT; SELLNER, 2019), (IYER et al., 2018).
Com os linfócitos T isolados vem o processo de ativação, que consiste na expansão dessas células. Existem várias tecnologias para a ativação de células T, incluindo ativação baseada em células, ativação baseada em grânulos e ativação baseada em anticorpos. Células Apresentadoras de Antígenos (CAA), como macrófagos e células dendríticas, produzem melhores resultados na ativação de células ex vivo, uma vez que elas fornecem uma resposta mais in vivo como estimulantes de células imunes, porém é um método mais custoso, visto que dependem de compatibilidade entre o doador e as células ativadas, pois as células isoladas estão pobres em CAA (IYER et al., 2018).
O método de ativação mais comum é usando anticorpos monoclonais anti-CD3/CD28 revestindo esferas magnéticas, resultando em uma partícula apresentadora de antígeno. Essas esferas permitem uma estimulação mais contínua e podem ser removidas por um forte eletroímã (STOCK; SCHMITT; SELLNER, 2019).
Com as células ativadas é feita a escolha de como será feita a edição gênica, que não se limita em apenas modificar a recepção de antígenos, mas também pode ser usada para inserir novos genes que melhoram a eficácia das células T. Esses genes incluem aqueles que codificam moléculas coestimuladoras, moléculas anti-apoptosis, proteínas remodeladoras do microambiente tumoral, além de moléculas que promovem a homeostasia (BARRETT et al., 2014).
A principal técnica de inserção do material genético às células é por meio de mecanismos virais, porém ainda existem a técnica transposon/transposase, que utiliza a eletroporação para facilitar a entrada do plasmídio junto à enzima transposase. As células transduzidas são agora expandidas e cultivadas até
atingirem uma quantidade ideal para serem infundidas no paciente. Existem várias técnicas de cultura de células com fatores de crescimento específicos, cada um com suas vantagens e desvantagens inerentes (IYER et al., 2018).
3.4. COMPLICAÇÕES DO TRATAMENTO
- EFEITOS ADVERSOS
As células T do receptor de antígeno quimérico tem mostrado excelentes resultados no tratamento do LLA-B, contudo, essa terapia está associada a alguns efeitos adversos em razão de serem constituída por elementos sintéticos, não naturais ao corpo, e por desencadear forte resposta imune, estimulando desta forma a ocorrência de efeitos adversos diretamente associado a estadiamento da malignidade e o estado imunológico do indivíduo previamente ao tratamento (HAN; KWON, 2018).
Os efeitos adversos mais comuns são: síndrome de liberação de citocinas (CRS), aplasia de células B e síndrome de neurotoxicidade associada a células efetoras imunes. Mesmo diante desses efeitos, o tratamento com células T do receptor de antígeno se mostra mais benéficos quando comparados com os tratamentos mais agressivos, como a quimioterapia e a radioterapia (SOUZA et al., 2020).
3.4.2. SÍNDROME DE LIBERAÇÃO DE CITOCINAS – CRS
Sendo o efeito adverso mais comum, a CRS ocorre nos primeiros dias após a infusão de células T. A reação se deve a liberação exacerbada de citocinas pró-inflamatórias como interferon gama, IL-6 e IL-2 devido a ativação e a proliferação dos linfócitos CAR-T. As manifestações clínicas são amplas, desde síndrome febril, hipotensão, taquicardia, coagulopatias, hipóxia até disfunção de múltiplos órgãos (CUENCA et al., 2021).
Os sintomas podem ser controlados com corticoide e tocilizumabe, anticorpo monoclonal que bloqueia o receptor de IL-6. O siltuximab, que também atua na via da IL-6, é outra opção que pode ser utilizada (BRITO et al., 2022).
Segundo o estudo de acompanhamento a longo prazo realizado por PARK et al., 2019; utilizando a terapia anti-CD19 CAR T na leucemia linfoblástica aguda em
53 pacientes adultos, onde após a infusão da célula CAR-T, a CRS de qualquer grau ocorreu em 45 dos 53 pacientes. Os sintomas relatados entre os pacientes foram: febre, taquicardia, hipotensão, desconforto respiratório ou hipoxemia. O tratamento foi diversificado sendo que em um total de 22 pacientes recebeu apenas cuidados de suporte, seis receberam o anticorpo monoclonal anti-receptor da interleucina-6 tocilizumab, 13 receberam tocilizumab mais um glicocorticoide e quatro receberam apenas glicocorticoide. Um paciente morreu de CRS grave e falência de múltiplos órgãos no quinto dia de tratamento.
3.4.3. APLASIA DE CÉLULAS B
A diminuição do número de células B circulante é um dos sintomas decorrente da imunoterapia com células CAR-T. Isso se dá devido ao ataque destas células contra essa linhagem que possui expresso o antígeno CD19 ou CD22 em sua membrana (WEI et al., 2017).
A perda prolongada ou transitória de células B não patológicas geralmente é bem tolerada, normalizando seus níveis na maioria dos pacientes quando as células CAR-T diminuem ao longo do tratamento. No entanto, a aplasia e sua consequente diminuição das imunoglobulinas predispõem aos pacientes desenvolverem infecções oportunistas. Portanto, o manejo é feito com infusões mensais de imunoglobulinas (SOUZA et al., 2020).
Em estudo realizado por Maude et al., 2018, com 75 pacientes que receberam uma infusão de tisagenlecleucel e puderam ser avaliados quanto à eficácia. Neste estudo foi observado que todos os pacientes com resposta ao tratamento apresentaram aplasia de células B, e a maioria dos pacientes do estudo recebeu reposição de imunoglobulina de acordo com a prática local. A probabilidade de manutenção da aplasia de células B em 6 meses após a infusão foi de 83% (IC 95%, 69 a 91).
3.4.4. SÍNDROME DE NEUROTOXICIDADE ASSOCIADA ÀS CÉLULAS EFETORAS IMUNES (ICANS)
Essa síndrome está associada ao dano no sistema nervoso central ou periférico, podendo alterar a atividade ou causar morte ao nervo (SILVA et al., 2021).
Os principais mecanismos propostos que levam à neurotoxicidade das células CAR T são a ativação endotelial e a ruptura da integridade da barreira hematoencefálica (BRITO et al., 2022).
Os fatores de risco que contribuem para tal desenvolvimento são: a alta carga tumoral ou alta dose de CAR-T, preexistência de sintomas neurológicos e CRS devido à relação concomitante entre estes fatores (CUENCA et al., 2021).
Os sintomas podem ser variados, podendo evoluir em horas a alguns dias para formas mais graves como, afasia global, convulsões, fraqueza motora, edema cerebral difuso e coma. A afasia é o sintoma mais específico dessa síndrome, podendo ser diferenciada de outros tipos de encefalopatia tóxico-metabólica. Os sintomas são completamente reversíveis na maioria dos pacientes, porém é incerto se pode causar sequelas neurológicas subclínicas a longo prazo. O tratamento é realizado com cuidados de suporte para toxicidades de baixo grau e corticosteróides para casos mais graves (BRITO et al., 2022).
Segundo dados da pesquisa realizada por Pan et al., 2019, na terapia com células CAR-T CD22 em 34 pacientes pediátricos e adultos B-ALL recidivantes ou refratários (r/r), que falharam em terapia anterior com células CAR-T CD19. Neste estudo, a síndrome de neurotoxicidade associada a células efetoras imunes ocorreu após a infusão de células CAR-T, sendo que em cinco dos 34 pacientes apresentaram neurotoxicidade de grau 1 manifestada por cefaleias e alterações do estado mental. Um paciente desenvolveu neurotoxicidade de grau 2 no sétimo dia após infusão, manifestada por breve convulsão generalizada, sendo tratado com manitol e furosemida para reduzir a pressão intracraniana e dexametasona para aliviar a inflamação, que foi completamente resolvido no décimo dia.
3.5. TRATAMENTO COM CÉLULAS CAR-T NO BRASIL
No Brasil o Kymriah® (tisagenlecleucel), da empresa Novartis Biociências S.A, é o primeiro medicamento com registro sanitário para produto de terapia gênica baseada em células T de receptores de antígenos quiméricos (CAR), contudo, há duas formas de CAR-T Cell hoje no país: o CAR-T farmacêutico e o acadêmico (ANVISA, 2022).
Apesar da anvisa já ter liberado, o CAR-T farmacêutico, o mesmo ainda não passou por toda regulamentação da Agência Nacional de Saúde Suplementar
(ANS); já o acadêmico possui um programa de terapia com células CAR-T realizado pelo governo do estado de São Paulo, fruto de uma parceria entre o Instituto Butantan, Faculdade de Medicina da Universidade de São Paulo (FMUSP), Faculdade de Medicina de Ribeirão Preto (FMRP-USP) e Hemocentro de Ribeirão Preto (BUTANTAN, 2022).
Autores/Ano Amostra Estratégia de tratamento Resultado Dai et al., 2020 Seis adultos com LLA-B r/r CAR-T anti-CD19 e CD22. Dose: 1,7 – 3 x 10⁶ cels/kg Todos os seis pacientes alcançaram a RC entre os dois primeiros meses. Três pacientes recidivaram, um em dez, outro em cinco e o outro em três meses Fry et al., 2018 21 adultos com CAR-T anti-CD22 em três níveis de dose em cels/kg. primeiro nível: 3 x 10⁵ segundo nível: 1 x 10⁶ terceiro nível: 3 x 10⁶ 57% dos pacientes LLA-B r/r com alcançaram a RC; nove histórico de pelo pacientes foram DRM menos um TCTH negativos. 1 de 6 pacientes atingiu a RC no primeiro nível de dose. Gardner et al., 2017 45 pacientes ≥ 12 meses e < 27 anos com LLA-B r/r CAR-T anti-CD19. Doses: 0.5 – 10.0 x 10⁶ cels/kg A taxa de RC foi de 93%. 89% dos pacientes tiveram DRM negativos.Os pacientes que associaram ao tratamento fludarabina e ciclofosfamida atingiram 100% de RC. Park et al., 2019 53 paciente adultos com LLA-B r/r CAR-T anti-CD19 (CD28 – CD3-zeta). Doses: 1.0 – 3.0 x 10⁶ cels/kg 83% dos pacientes atingiram a RC. 67% dos pacientes alcançaram DRM negativa. Chen et al., 2020 Sete paciente menores de 18 anos com LLA-B recidivante testicular isolada CAR-T anti-CD19 em uma única dose de 5.0 x 10⁶ cels/kg Todos os setes pacientes alcançaram a RC. A probabilidade de sobrevida livre de eventos para todos os pacientes em 12 meses de monitoramento foi de 83,3%. Liu et al., 2021 27 pacientes adultos e pediátricos com Na primeira infusão receberam CAR-T Após 30 dias, 85% dos pacientes alcançaram RC, LLA-B recidivante anti-CD19 na mediana de destes, 95% negativaram 1.0 x 10⁵ cels/kg. Na para DRM. 11% tiveram segunda infusão 21 remissão parcial. Um pacientes receberam paciente morreu por SRC. uma dose de CAR-T Após 30 dias da segunda anti-CD22 na mediana de infusão, os pacientes que 2.0 x 10⁵ cels/kg recidivaram, atingiram a RC.
Quadro 1. Resumo dos dados de eficácia e sobrevida de ensaios clínicos selecionados que usaram células CAR-T em LLA-B.
Maude et al., 2018 75 pacientes pediátricos e adultos jovens com LLA de células B recidivante ou refratária CD19+ Única infusão de tisagelecleucel (CAR-T anti-CD19) Média de 3,1 × 10⁶ cels/kg Em três meses RC de 81%. As taxas de SLE e SG foram de 73%, em seis meses e 50% em 12 meses. A persistência das células foi observada por até 20 meses. Pan et al., 2019 34 pacientes adultos e pediátricos com LLA-B r/r, foram inscritos. Os pacientes não transplantados receberam uma dose média de 7,5 × 10⁵ cels/kg. Já os transplantados, a dose média foi de 1.0 x 10⁵ cels/kg Os pacientes não transplantados receberam células CAR-T anti-CD22 em uma dose média de 7,5 × 10⁵ cels/kg. Já os transplantados, a dose média foi de 1.0 x 10⁵ cels/kg Um paciente morreu. Dos 30 pacientes que sobreviveram aos 30 dias 80% alcançaram a RC/RCi. 18 negativaram para DRM. Cinco pacientes DRM positivos, tornaram-se DRM negativos após o tratamento. Dos quatro DEM exclusivos, dois alcançaram a RC e um teve redução de 50% do volume de massa.
Abreviações: RC: remissão completa; r/r: recidivante/refratária; RCi: recuperação de contagem incompleta; TCTH: transplante de células-tronco hematopoiéticas; DRM: doença residual mínima; SRC: síndrome de liberação de citocinas; DEM: doenças extramedulares; PBMC: células mononucleares do sangue periférico; SLE: Sobrevida Livre de Eventos; SG: Sobrevida Global.
Fonte: Autoria própria.
4. DISCUSSÃO
Nesta revisão de literatura, buscamos elucidar o que é uma molécula CAR, como ela é formada, suas diversas maneiras de combinações e os efeitos adversos ao tratamento da leucemia linfoblástica do tipo B. Além disso, levantamos um compilado de estudos clínicos com características de resultados variados, demonstrando a eficácia e os riscos inerentes à terapia com células CAR-T.
Mostramos que o conjunto de proteínas que formam o complexo CAR possuem diversas maneiras de configurações e fatores que podem fazer parte da estrutura ou não. De acordo com HUANG et al., 2020, cada decisão de unir uma proteína coestimuladora à cadeia CAR, ou até uma proteína estrutural, produzem efeitos que impactam diretamente no desempenho antitumoral da célula CAR-T.
Uma parte fundamental da molécula CAR, a qual impulsiona a ação citotóxica em células T, é a proteína responsável pela coestimulação do sinal. O domínio co-estimulatório 4-1BB é uma molécula de grande interesse entre os pesquisadores, uma vez que ela realiza um efeito maior que o domínio CD28 e por mais tempo. Ela produz níveis baixos de marcadores de exaustão enquanto produz níveis mais elevados de citocinas em relação à CD28, que também é uma proteína bastante
usada. Segundo LONG et al., 2015, as duas juntas em CARs de terceira geração mostraram resultados satisfatórios em pacientes com LLA-B.
Os estudos que trouxeram pacientes que foram tratados com CARs de segunda geração, utilizando a proteína 4-1BB como a coestimuladora, obtiveram resultados promissores. No estudo GARDNER et al., 2017, onde foi usado a proteína 4-1BB junta à cadeia zeta, todos os pacientes que usaram o tratamento de linfodepleção alcançaram a remissão completa e doença residual mínima negativa, além do enxerto permanecer ativo por todo o período de análise (18 meses).
DAVILA e SADELAIN, 2016, propuseram que a técnica escolhida para a transferência do gene modificado às células têm relevância importante na expressão do CAR, sendo o uso da técnica viral de transdução, o método mais utilizado e eficiente. Os mesmos demonstraram que existem outros métodos de transferência de genes, como a eletroporação para uma melhor entrega do plasmídeo por meio da enzima transposase, porém, esta técnica não é tão efetiva quando se espera maior expressão de células CAR em relação às que foram traduzidas por vetores retrovirais.
Os estudos de DAI et al., 2020; FRY et al., 2018; CHEN et al., 2020; LIU et al.,
2021; MAUDE et al., 2018; PAN et al., 2019 e GARDNER et al., 2017; utilizaram vetores lentivirais na transdução do material genético para as células T. Já a pesquisa de PARK et al., 2019, utilizou vetores gama-retrovirais para a transferência genética, porém, em todos os ensaios as células tiveram uma boa expressão do mecanismo de citotoxicidade antitumoral do CAR, corroborando com IYER et al., 2018, o qual, afirmam que o manejo de vetores virais é uma técnica eficientes para a transdução do material genético em linfócitos T.
PARK, C. H., 2021, assegura que o tempo de expansão de células em cultura ex vivo é um fator a ser considerado, pois, influencia diretamente na atividade dos linfócitos T CAR. As células mais antigas, além de terem menor tempo de vida ativa, produzem menos citocinas. Alguns estudos evidenciam que uma cultura de curto prazo melhora os efeitos antitumorais.
O tempo reduzido em oito dias na expansão e cultura celular no ensaio clínico de LIU e colaboradores, 2021, além de permitir ao grupo transfundir uma menor quantidade de células em seus pacientes (CAR-T anti-CD19 1,0 x 10⁵ células/kg), a taxa de sobrevida global, em uma corte com 21 pacientes, foi de 88,5% em 12 meses e a taxa de sobrevida livre de eventos foi de 67,5% em 18 meses, além da
taxa de remissão completa ter sido de 81-91% nos primeiros 6 meses após a primeira infusão.
Em comparação com a pesquisa de Gardner e colaboradores, 2017, onde foi usado um tempo médio de 15 dias de cultivo após a mudança genética, a sobrevida global foi de 65,9% em 12 meses e a sobrevida livre de eventos foi de 50,3% nos mesmos 12 meses. No entanto, os efeitos adversos verificados neste estudo foram consideravelmente inferiores (taxa de CRS grave 23%) .
Em relação ao ensaio de Liu e colaboradores, 2021, em que, mesmo tendo usado uma baixa dose de células, obteve-se uma taxa de síndrome de liberação de citocinas grave de 30%, destes, um paciente (3,7%) morreu por conta da gravidade da CRS.
5. CONCLUSÃO
A terapia do receptor de antígeno quimérico significa um grande avanço da medicina, trazendo grandes resultados na oncohematologia em especial para a leucemia linfoide aguda B, possibilitando ao portador da doença uma nova esperança de tratamento com grande perspectiva de cura, contudo, apesar do grande sucesso, o procedimento apresenta efeitos adversos, tais como: neurotoxicidade, aplasia de célula B e síndrome de liberação de citocinas; mesmo diante de tais efeitos, a terapia se mostra promissora tendo em vista que são reversíveis.
A redução dos altos custos do processo de fabricação aliado à mitigação dos efeitos adversos ao tratamento, é um desafio que norteia o futuro das pesquisas em imunoterapia CAR. O foco das pesquisas está em diminuir o uso de vetores virais e o tempo entre a leucaférese e a re-infusão ao paciente.
O uso de edição genética em novas gerações de CARs poderá ser capaz de incorporar genes suicidas para fornecer melhor controle sobre a síndrome de liberação de citocinas (CRS), além de fazer com que a célula produza cargas úteis de drogas ou proteínas terapêuticas, minimizando os danos ao indivíduo.
Os resultados dos ensaios clínicos abordados no decorrer da revisão, demonstram a eficácia desta terapia, com altas taxas de remissão completa de blastos leucêmicos, assim como, elevado tempo de sobrevida que, apesar das
pesquisas apresentarem resultados relevantes, é necessário verificar a durabilidade dos impactos relacionados ao tratamento em estudos de longo prazo.
6. REFERÊNCIAS
ALMEIDA, S. A.; MELO, A. L. M.; CARVALHO, L. S.; CONSTANTE, M. M.;
ASSUNÇÃO, M. A. A. Imunoterapia com células CAR-T como nova perspectiva de tratamento da leucemia linfoblástica aguda recidivada/refratária. Revista Médica de Minas Gerais. Brasil, v. 31, e-31209. set. 2021.
ATACA, P.; ARSLAN, O. Chimeric Antigen Receptor T Cell Therapy in Hematology.
Turk J Haematol. Turquia, v. 32, n. 4, p. 285-294, dez. 2015.
BARRETT, D. M.; SINGH, N.; PORTER, D. L.; GRUPP, S. A.; JUNE, C. H. Chimeric
Antigen Receptor Therapy for Cancer. Annual Review of Medicine. v. 65, p. 333-347, nov. 2013.
BRITO, M. H. Neurologic adverse events of cancer immunotherapy. Arquivos de Neuro-Psiquiatria, [S. L.], v. 80, n. 5, p. 270-280, may. 2022.
BUTANTAN. Portal do Butantan: Terapia celular CAR-T contra o câncer no SUS deverá custar 5% do que se pratica no exterior. São Paulo, 2022.
CARTELLIERI, M. et al. Chimeric Antigen Receptor-Engineered T Cells for Immunotherapy of Cancer. Journal of Biomedicine and Biotechnology. Alemanha,
v. 2010: 956304. mai. 2010.
CAVALCANTE, M. S.; ROSA, I. S. S.; TORRES, F. Leucemia linfoide aguda e seus principais conceitos. Revista Científica da Faculdade de Educação e Meio Ambiente, [S. L.], v. 8, n. 2, p. 151–164, jul-dez. 2017.
CHEN, X. et al. Treatment of Testicular Relapse of B-cell Acute Lymphoblastic Leukemia With CD19-specific Chimeric Antigen Receptor T Cells. Clinical Lymphoma, Myeloma & Leukemia. China, v. 20, n. 6, p. 366-370, jun. 2020.
CRUZ, M. T.; MATEUS, D. M.; BORGES, O. Células T com Recetor de Antigénio Quimérico (CAR): Uma Nova Estratégia Imunoterapêutica. Revista Portuguesa de Farmacoterapia, Portugal, v. 11, n. 2-3, p. 39-48, abr-jul. 2019.
CUENCA, John A. et al. Terapia de células T con receptores de antígenos quiméricos: revisión de la literatura. Mexican journal of oncology, México, v. 21, n. 1, 17-25, mar. 2022.
DAI, H. et al. Bispecific CAR-T cells targeting both CD19 and CD22 for therapy of adults with relapsed or refractory B cell acute lymphoblastic leukemia. Journal of Hematology & Oncology. China, v. 13, n. 30. abr. 2020.
DAVILA, M. L.; SADELAIN, M. Biology and clinical application of CAR T cells for B cell malignancies. International Journal of Hematology. [S. L.], v. 104, n. 1, p. 6-17, jun. 2016.
ENBLAD, G. et al. A Phase I/IIa Trial Using CD19-Targeted Third-Generation CAR T Cells for Lymphoma and Leukemia. American Association for Cancer Research. Suécia, v. 24, n. 24, p. 6185-6194, dez. 2018.
FRY, T. J. et al. CD22-targeted CAR T cells induce remission in B-ALL that is naive or resistant to CD19-targeted CAR immunotherapy. Nature Medicine. USA, v. 24, n. 1,
p. 20-28, jan. 2018.
GARDNER, R. A. et al. Intent-to-treat leukemia remission by CD19 CAR T cells of defined formulation and dose in children and young adults. Blood. v. 129, n. 25, p. 3322-3331, jun. 2017.
GOV.BR – Ministério da saúde. Agência nacional de Vigilância Sanitária (ANVISA): Anvisa aprova produto de terapia avançada para tratamento de câncer. Brasilia, 2022
HUANG, R. et al. Recent advances in CAR-T cell engineering. Journal of Hematology & Oncology. v. 13, n. 86. mar. 2020.
INCA – Instituto Nacional de Câncer. Estimativa 2020: leucemias (taxas brutas). Rio de Janeiro: INCA, 2021.
INABA, Hiroto e MULLIGHAN, Charles G. Pediatric acute lymphoblastic leukemia.
Haematologica, Itália, v. 105, n. 11, p. 2524-2539, nov. 2020.
IYER, R. K.; BOWLES, P. A.; KIM, H.; TULLOCH, A. D. Industrializing Autologous Adoptive Immunotherapies: Manufacturing Advances and Challenges. Frontiers in Medicine. v. 5, n. 150, p. 1-18, mai. 2018.
KATO, Motohiro; MANABE, Atsushi. Treatment and biology of pediatric acute lymphoblastic leukemia. Pediatrics International, Japão, v. 60, n. 1, p. 4-12, jan. 2017.
LIU, S. et al. Combination of CD19 and CD22 CAR-T cell therapy in relapsed B-cell acute lymphoblastic leukemia after allogeneic transplantation. American Journal of Hematology. China, v. 96, n. 6, p. 671-679, mar. 2021.
LONG, A. H. et al. 4-1BB costimulation ameliorates T cell exhaustion induced by tonic signaling of chimeric antigen receptors. USA, Nature Medicine. v. 21, n. 6, jun. 2015.
MARTHO, L. J.; DEGASPERI, G. R.; TARSIANO, C. A. B. Imunoterapia com células T-CAR: bioengenharia contra a leucemia linfoblástica aguda. CuidArte, Enfermagem, Brasil, v. 11, n. 2, p. 168-173, jul-dez. 2017.
MAUDE, S. L. et al. Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. The New England Journal of Medicine. USA, v. 378, n. 5, p. 439-448, fev. 2018.
MOREIRA, F. L. et al. Avaliação dos aspectos citológicos e laboratoriais da leucemia linfóide aguda. Revista Eletrônica Acervo Saúde, [S. L.], v. 13, n. 5, p. 1-8, mai. 2021.
PAN, J. et al. CD22 CAR T-cell therapy in refractory or relapsed B acute lymphoblastic leukemia. Leukemia. China, v. 33, n. 12, p. 2854-2866.
PARK, C. H. Making Potent CAR T Cells Using Genetic Engineering and Synergistic Agents. Cancers. Korea, v. 13, n. 13. jun. 2021.
PARK, J. P. et al. Long-Term Follow-up of CD19 CAR Therapy in Acute Lymphoblastic Leukemia. The New England Journal of Medicine. New York, v. 378, n. 5, p. 449-459, fev. 2018.
SILVA, I. C. C.; FERNANDES, A. P. Terapia do receptor de antígeno quimérico de células T: funcionamento, progressos e perspectivas. Revista Científica Multidisciplinar Núcleo do Conhecimento, [S. L.], v. 1, n. 2, p. 59-87, jul. 2021.
SOUZA, K. S.T-CAR cell-directed immunotherapy for the treatment of acute lymphoid leukemia. Research, Society and Development, [S. l.], v. 9, n. 11, p. 1-15, dez. 2020.
WEI, G.; DING, L.; WANG, J.; HU, Y.; HUANG, H. (2017). Advances of
CD19-directed chimeric antigen receptor-modified T cells in refractory/relapsed acute lymphoblastic leukemia. Experimental Hematology & Oncology, China, v. 6, n. 10, p. 1-7, abr. 2017.
