REGISTRO DOI: 10.69849/revistaft/th102411181805
Tatiana Marangon Pereira1
Evaldo Wust Neto2
Jéssica Voltolini3
Ariadne Scaratti Campiolo4
Manuella Kolinski Vielmo5
Patrick Lennon Antonelli Lanzarini6
Lirane Elize Defante Ferreto7
Paulo Cezar Nunes Fortes8
RESUMO
A SHR é uma síndrome caracterizada por uma injúria renal aguda (IRA) em pacientes com cirrose hepática e a ascite. A fisiopatologia da SHR-IRA está relacionada a hipovolemia, a qual causa vasoconstrição renal, levando à IRA. Apesar dos avanços científicos, a SHR-IRA continua sendo uma complicação hepática grave, com elevada mortalidade. Assim, o estudo da fisiopatologia se torna importante para novas formas de diagnósticos e tratamento. Neste contexto, este artigo de revisão bibliográfica pretende demonstrar estudos dos últimos 2 anos relacionados a fisiopatologia, o diagnóstico e os tratamentos para a SHR-IRA em pacientes adultos. As recomendações do PRISMA foram utilizadas como protocolo do estudo, associada ao modelo PICO, para delinear a consulta e a estratégia de busca, bem como os critérios de seleção do estudo. Aplicando-se os critérios de inclusão e exclusão, foram identificados 807 artigos, sendo selecionados 15 artigos para o estudo. Não foram encontrados estudos de pesquisa relacionados à novos mecanismos envolvidos na fisiopatologia da SHR-IRA, no entanto, a disfunção circulatória é considerada o principal mecanismo envolvido. Diversos fatores têm sido relacionados ao diagnóstico da SHR-IRA, dentre eles estão, marcadores hemostáticos (‘NGAL’, zonulina, LPS, LBP, COX, APTT, TT, INR, D-dímero e Fib), nível de creatina sérica, resposta à retirada de diuréticos, hipovolemia e hipervolemia, cirrose com ascite, uso de nefrotóxicos, proteinúria, exames de imagem (USVCI), esforço fracionado de sódio, lesão tubular e escala proposta pela CFS. A partir do diagnóstico, diversas formas de tratamento têm sido propostas, sendo a utilização do vasoconstritor terlipressina-albumina (TA), a forma mais utilizada e efetiva. A resposta ao tratamento é considerada um preditor para a mortalidade de pacientes com SHR-IRA. Entretanto, o tratamento com TA apresenta algunas efeitos adversos em pacientes com insuficiência hepática aguda ou crônica grau 3; e isquemia coronária, periférica e mesentérica. Neste sentido, novos estudos fisiopatológicos e de biomarcadores devem ser realizados, interferindo na eficácia do tratamento para a SHR-IRA.
Palavras–chave: Cirrose hepática. Ascite. Vasodilatação esplâncnica. Terlipressina. Insuficiência renal.
ABSTRACT
HRS is a syndrome characterized by acute kidney injury (AKI) in patients with liver cirrhosis and ascites. The pathophysiology of HRS-AKI is related to hypovolemia, which causes renal vasoconstriction, leading to AKI. Despite scientific advances, HRS-AKI remains a serious hepatic complication with high mortality. Thus, the study of pathophysiology becomes important for new forms of diagnosis and treatment. In this context, this literature review article aims to demonstrate studies from the last 2 years related to the pathophysiology, diagnosis and treatments for HRS-AKI in adult patients. The PRISMA recommendations were used as the study protocol, associated with the PICO model, to outline the search and search strategy, as well as the study selection criteria. Applying the inclusion and exclusion criteria, 807 articles were identified, of which 15 articles were selected for the study. No research studies related to new mechanisms involved in the pathophysiology of HRS-AKI were found; however, circulatory dysfunction is considered the main mechanism involved. Several factors have been related to the diagnosis of HRS-AKI, including hemostatic markers (‘NGAL’, zonulin, LPS, LBP, COX, APTT, TT, INR, D-dimer and Fib), serum creatine level, response to diuretic withdrawal, hypovolemia and hypervolemia, cirrhosis with ascites, use of nephrotoxics, proteinuria, imaging tests (USVCI), fractional sodium exertion, tubular injury and scale proposed by CFS. From the diagnosis, several forms of treatment have been proposed, with the use of the vasoconstrictor terlipressin-albumin (TA) being the most used and effective form. Response to treatment is considered a predictor of mortality in patients with HRS-AKI. However, treatment with TA has some adverse effects in patients with acute or chronic liver failure grade 3; and coronary, peripheral and mesenteric ischemia. In this sense, new pathophysiological and biomarker studies should be carried out, interfering in the efficacy of treatment for HRS-AKI.
Keywords: Liver cirrhosis. Ascites. Splanchnic vasodilation. Terlipressin. Renal failure.
1. INTRODUÇÃO
A síndrome hepatorrenal (SHR) é caracterizada como uma disfunção renal aguda (ou injúria renal aguda – IRA) grave, comumente observada em pacientes com doença hepática aguda ou crônica, se destacando a cirrose hepática e a ascite (Duong et al., 2023). Dados da literatura mostram que mais de 50% dos pacientes com cirrose hepática tendem a desenvolver a SHR-IRA. Desta forma, a SHR-IRA é considerada a maior gravidade em casos de insuficiência renal e lesão hepática, com taxas de mortalidade chegando a 90% dos casos (Hasan et al., 2021; Ning et al., 2022). Desta forma, a SHR-IRA pode ser considerada uma síndrome desafiadora, especialmente quanto ao diagnóstico precoce e ao tratamento efetivo.
A SHR-IRA está associada a uma série de desregulações hemodinâmicas, inflamatórias e hormonais, porém, com ausência de anormalidades significativas na histologia renal (Hasan et al., 2021). Basicamente, a fisiopatologia da SHR-IRA é caracterizada pela vasodilatação esplâncnica, ocasionando redução do volume arterial, também conhecida como hipovolemia. Em consequência da hipovolemia, ocorre a ativação neuro-hormonal dos sistemas renina-angiotensina-aldosterona (SRAA) e nervosos simpático (SNS), causando vasoconstrição renal, o que reduz o fluxo sanguíneo para os rins (hipoperfusão renal), levando à insuficiência renal ou IRA (Kaptein et al., 2023a). A análise da fisiopatologia é importante para obter um diagnóstico preciso e um tratamento efetivo.
O diagnóstico da SHR-IRA pode ser realizado a partir de diversos fatores, como: análise de biomarcadores (funcionais, de lesão tubular e de parada do ciclo celular); aumento dos níveis de creatinina sérica, definidos pelo Kidney Disease: Improving Global Outcomes (KDIGO); e exclusão de obstrução ou doença renal parenquimatosa, observadas a partir de exames de imagem, como ecografia renal e microscopia da urina (Badura et al., 2023). Apesar do transplante hepático continuar sendo a única forma de cura para a SHR, o diagnóstico precoce é essencial para a tomada de decisão terapêutica e estabelecer o prognóstico, mantendo a estabilidade do quadro clínico aos pacientes que aguardam o transplante (Duong et al., 2023).
O manejo terapêutico para a SHR-IRA está principalmente relacionado à reversão da vasodilatação sistêmica (vasodilatação esplâncnica) e na restauração do fluxo sanguíneo renal (perfusão renal). Assim, a administração de vasoconstritores, como a terlipressina combinada com outras substâncias, tem sido amplamente utilizada em pacientes com SHR-IRA. No entanto, a utilização destes vasoconstritores pode ocasionar alguns efeitos adversos, principalmente em pacientes com outras enfermidades, como isquemia cardiovascular e mesentérica (Duong et al., 2023). Neste sentido, novas formas de tratamento vêm sendo estudadas, visando aumentar a eficiência do tratamento e isentar o paciente de complicações.
Atualmente, apesar dos avanços na área biomédica, a SHR-IRA continua sendo uma complicação grave de insuficiência hepática, além de desafiadora, com elevada mortalidade e complexidade no manejo clínico (Wilde et al., 2023). No entanto, os mecanismos fisiopatológicos da SHR-IRA têm evoluído, e o entendimento destes mecanismos permite uma avaliação mais precisa da função renal, impulsionando diagnósticos mais precisos e novas formas de tratamento.
Neste contexto, a revisão bibliográfica tem como objetivo explorar estudos recentes (de 2022 a 2024) publicados em revistas cientificamente renomadas, relacionados a fisiopatologia, diagnóstico e tratamento da SHR-IRA em pacientes adultos. Assim, este estudo visa contribuir com profissionais da saúde, auxiliando no entendimento de novas formas de diagnósticos e tratamentos para a SHR-IRA.
2. METODOLOGIA
Protocolo do estudo
As recomendações do PRISMA (do inglês, Preferred Reporting Items for Systematic Reviews and Meta-analysis Statement) (PAGE[1], et al., 2020), foi utilizada como protocolo do estudo e associada ao modelo PICO (acrônimo para P: população/pacientes/problema; I: intervenção; C: comparação/controle; O: desfecho/ do inglês, Outcome), o qual foi utilizado para delinear a consulta e a estratégia de busca, bem como os critérios de seleção do estudo (HIGGINS[2] et al., 2023).
A questão norteadora da pesquisa foi fundamentada no diagnóstico e tratamento de pacientes com hepatopatia que evoluem para injúria renal aguda, os principais pontos da pesquisa pelo modelo PICO foram:
P: Pacientes adultos com hepatopatia que evoluem para injúria renal aguda.
I: Diagnóstico e tratamento da síndrome hepatorrenal associada à injúria renal aguda, incluindo as atualizações mais recentes.
C: Práticas diagnósticas e terapêuticas.
O: Eficácia no diagnóstico precoce e tratamento.
2.2 Estratégia de busca
Foram consultadas três bases de dados bibliográficas: PubMed, Biblioteca Cochrane e Literatura Latino-Americana e do Caribe em Ciências da Saúde (LILACS). A estratégia de busca utilizou os descritores DeCS/MeSH em diferentes idiomas (inglês, português e espanhol) presentes nos títulos e resumos, combinados com o operador booleano AND e OR:
Português:
1. Síndrome hepatorrenal OR SHR
AND
2. Injúria renal aguda OR insuficiencia renal aguda OR IRA
AND
3. Diagnóstico OR tratamento OR terapia OR prognostico
Inglês:
1. Hepatorenal syndrome OR HRS
AND
2. Acute kidney injury OR acute renal failures OR AKI
AND
3. Diagnosis OR treatment OR management OR therapy OR prognosis
Espanhol:
1. Síndrome hepatorrenal OR SHR
AND
2. Lesión renal aguda OR insuficiencia renal aguda OR LRA
AND
4. Diagnóstico OR tratamiento OR terapia OR pronóstico
2.1 Critérios de elegibilidade
Os critérios de inclusão foram: artigos originais, relatos de casos, estudos clínicos e estudos controlados randomizados, com filtros linguísticos (português, inglês ou espanhol). Priorizou-se a seleção de artigos disponíveis em acesso aberto, contudo, também foram incluídos trabalhos disponíveis para acesso em instituições de ensino. O período considerado para as publicações foi entre 2014 e 2024 (filtros temporários), cuja busca foi atualizada até 27 de agosto de 2024.
Foram incluídos artigos de revisão que relatavam a fisiopatologia, diagnóstico e tratamento mais eficaz para a SHR-IRA em pacientes adultos, considerando as atualizações mais recentes. Foram excluídos os estudos duplicados, resumos em anais e aqueles que não apresentavam pelo menos dois dos descritores no resumo ou no título. Após a leitura crítica, também foram excluídos artigos irrelevantes para a objetivo da pesquisa.
3. DISCUSSÃO
Aplicando-se os critérios de inclusão e exclusão, foram identificados no total 807 artigos (Figura 1), sendo selecionados 47 estudos para leitura completa. Após análise crítica dos artigos relevantes, foram incluídos no estudo 15 artigos.
Figura 1 – Fluxograma do processo de seleção dos estudos.
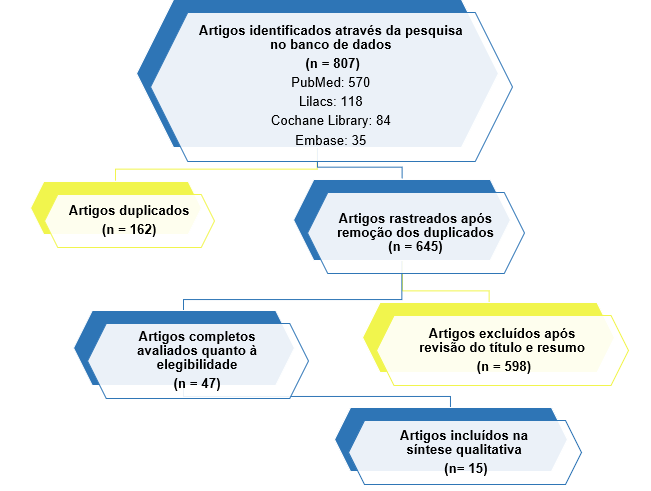
Fonte: o autor.
Os artigos incluídos na síntese qualitativa (Figura 1) foram avaliados e estão apresentados na Tabela 1.
Tabela 1 – Descrição dos estudos incluídos na síntese qualitativa.
Título Objetivo Resultados Referência Delhi Model: A New Tool for Predicting Response to Terlipressin in Hepatorenal Syndrome – Acute Kidney Injury Identificar fatores independentes que preveem a resposta ao tratamento com terlipressina em pacientes com SHR-IRA Cerca de 61% dos pacientes responderam ao tratamento com terlipressina. A creatinina basal, a pontuação Child Turcotte Pugh (CTP) e o DCD4 foram preditores independentes para a resposta ao tratamento. Cerca de 50% dos pacientes necessitaram de readmissão em 3 meses, e a sobrevida neste mesmo período para grupos de resposta foi de 68,5%. O modelo Delphi desenvolvido apresentou excelente capacidade preditiva para previsão de resposta ao tratamento com terlipressina em pacientes com SHR-IRA. (Agrawal et al., 2024) Early Versus Standard Initiation of Terlipressin for Acute Kidney Injury in ACLF: A Randomized Controlled Trial (eTerli Study) Investigar se a administração precoce da terlipressina pode melhorar as taxas de resposta à progressão da SHR-IRA em estágio II e III Para o sétimo dia de tratamento, cerca de 69% dos pacientes administrados com terlipressina precoce a 2 mg/24 h mais albumina em 12 h (ET) demonstraram resposta ao tratamento. Já para a terapia padrão em 48 h (ST), apenas 31% dos pacientes responderam ao tratamento em 7 dias. Pacientes ET mostraram melhores respostas no grau de IRA, pressão arterial e débito urinário no terceiro dia, necessitando de menor administração de albumina em 7 dias, quando comparado à pacientes ST. Além disso, pacientes ET mostraram taxa de mortalidade menor em 28 dias. (Jindal et al., 2024) Prospective validation of the EASL management algorithm for acute kidney injury in cirrhosis Estudar e validar o coorte prospectivo do algoritmo de gerenciamento da SHR em pacientes hospitalizados com cirrose e IRA A resposta geral ao tratamento com infusão de albumina de 2 dias foi de 80% e com terlipressina foi de 61% em pacientes com SHR-IRA, enquanto a substituição renal foi necessária em apenas 8%. Cerca de 74% dos pacientes não diagnosticados com SHR-IRA e cirrose, mas com necrose tubular aguda, não responderam ao tratamento com albumina. O tempo médio do diagnóstico de cirrose ao início do tratamento com terlipressina foi de 2,5 dias. (Ma et al., 2024) Novel predictors of response to therapy with terlipressin and albumin in hepatorenal syndrome–acute kidney injury Avaliar as taxas de resposta à terlipressina-albumina com base na nova definição de SHR-IRA e identificar novos fatores preditivos de melhora da função renal e da sobrevivência A resposta completa à terapia terlipressina-albumina foi observada em 54% dos pacientes com SHR-IRA. Os fatores associados à resposta completa foram: presença da síndrome de resposta inflamatória sistêmica e creatinina sérica basal, aumento na pressão arterial e diminuição do índice de resistência renal, ambos no dia 3 de tratamento. Pacientes que responderam ao tratamento apresentaram sobrevida média de 6 meses em relação aos que não responderam. A resposta ao tratamento foi um preditor de mortalidade, assim como o modelo para doença hepática terminal sódio > 23. (Narayanan, 2023) Early treatment with terlipressin in patients with hepatorenal syndrome yields improved clinical outcomes in North American studies Avaliar o efeito ao tratamento precoce com terlipressina em pacientes com SHR-IRA (SHR-1) e a relação com o nível de creatinina sérica basal A creatinina sérica basal (CSB) foi significativamente associada à reversão da SHR-IRA. A incidência de reversão foi inversamente correlacionada com o subgrupo de CSB (< 3mg/dL, 49,2%; ≥ 3 a < 5mg/dL, 28,0%; ≥ 5mg/dL, 9,1%). Durante 30 dias de acompanhamento, a sobrevida livre de terapia de substituição renal foi maior para pacientes com CSB mais baixa (< 5mg/dL). Pacientes tratados com terlipressina e com níveis mais baixos de CSB apresentaram maior sobrevida global e livre de transplante no dia 90. (Curry et al., 2023) Diagnostic and prognostic performance of urinary neutrophil gelatinase-associated lipocalin in patients with cirrhosis and acute kidney injury Investigar o uso do biomarcador de lesão renal: lipocalina associada à gelatinase de neutrófilos urinários (NGAL) para (1) diagnóstico de IRA em pacientes com cirrose, (2) prever a resposta ao tratamento com terlipressina e (3) prever a mortalidade O NGAL foi um biomarcador eficiente para o diagnóstico de SHR-IRA em pacientes com cirrose, além de prever a resposta ao tratamento com terlipressina e albumina, sendo um preditor independente de mortalidade hospitalar. Cerca de 22% dos pacientes tinham IRA pré-natal, 40% SHR-IRA, 17% IRA com necrose tubular aguda (IRA-NTA) e 22% apresentavam forma mista de IRA. Os valores de NGAL foram significativamente maiores para IRA-NTA em comparação com outros tipos de IRA (1162 ng/mL). O limite de melhor desempenho foi 220 ng/mL (sensibilidade, 89%; especificidade, 78%), foi independentemente associado a um maior risco de não resposta. (Gambino et al., 2023) Terlipressin vs Midodrine Plus Octreotide for Hepatorenal Syndrome-Acute Kidney Injury: A Propensity Score–Matched Comparison Comparar o tratamento de terlipressina mais albumina (TA) com midodrina e octreotida mais albumina (MOA) em pacientes com SHR-IRA Cerca de 52% dos pacientes tratados com TA mostraram reversão de SHR-IRA, enquanto apenas 20% dos pacientes tratados com MOA apresentaram a reversão. O tratamento com TA aumentou a sobrevida global dos pacientes. (Gonzalez et al., 2023) Hepatorenal syndrome misdiagnosis may be reduced using inferior vena cava ultrasound to assess intravascular volume and guide management Avaliar o volume intravascular de pacientes com SHR-IRA, após administração de albumina e retirada de diurético pelo uso do ultrassom da veia cava inferior (USVCI) O emprego do USVCI foi capaz de definir com maior precisão a SHR-IRA, sendo hipovolêmica ou hipervolêmica, e de orientar o gerenciamento de volume intravascular. Cerca de 75% dos pacientes foram diagnosticados com hipovolemia e hipervolemia intravascular por USVCI. Cerca de 40% dos pacientes apresentaram melhora em 4-5 dias de acompanhamento por USVCI, indicando diagnósticos errôneos quanto a SHR-IRA. (Kaptein et al., 2023b) Prediction models combining zonulin, LPS, and LBP predict acute kidney injury and hepatorenal syndrome–acute kidney injury in cirrhotic patients Avaliação de marcadores para prever IRA e SHR-IRA em pacientes com cirrose Ao longo de 6 meses, 19% dos pacientes cirróticos desenvolveram IRA e 12% apresentaram SHR-IRA, dados obtidos a partir dos marcadores zonulina, lipopolissacarídeos (LPS) e proteína de ligação a lipopolissacarídeos (LBP) em células intestinais (Caco‑2) e tubulares renais (HK‑2). (Lin et al., 2023) Urine neutrophil gelatinase-associated lipocalin as a biomarker of acute kidney injury and prognosis in decompensated chronic liver disease: A prospective study Avaliar o prognóstico da lipocalina associada à gelatinase de neutrófilos na urina (NGAL) na doença hepática crônica descompensada (DCLD) e a capacidade de subtificar IRA NGAL foi capaz de identificar subtipos de IRA e correlacionar com resultados clínicos, incluindo mortalidade. NGAL foi mais elevada para a necrose tubular aguda (NTA), baixa na azotemia pré-renal (APR) e intermediária na síndrome hepatorrenal (SHR-IRA). A NGAL foi superior à creatina sérica e inferior à excreção fracionada de sódio (FENa) na estratificação da IRA. Um ponto de corte de 203,9 ng/mL discriminou SHR-IRA da APR, com sensibilidade de 78% e especificidade de 69%. A NGAL correlacionou-se com a necessidade de internação na UTI, mortalidade em 3 e 6 meses. Pacientes com NGAL > 205 ng/mL apresentaram sobrevida menor em 2 anos. (Yewale et al., 2023) Urinary Neutrophil Gelatinase-associated Lipocalin as a Diagnostic and Prognostic Marker for Acute Kidney Injury in Hospitalized Cirrhotic Patients: A Study from North Indian Population Examinar a NGAL (lipocalina associada à gelatinase urinária de neutrófilos) como um possível marcador diagnóstico e prognóstico de IRA em pacientes com cirrose A NGAL foi um marcador efetivo para distinguir os tipos de IRA em pacientes cirróticos. Cerca de 33% dos pacientes não desenvolveram IRA e 67% desenvolveram IRA. Os níveis urinários de NGAL foram 6 vezes maiores em pacientes com necrose tubular aguda (259 ng/mL) e 3 vezes maiores na SHR-IRA (125 ng/mL) em comparação com funções renais normais (40 ng/mL). Mortes foram relacionadas com NGAL maiores (~ 172 ng/mL) em relação aos que sobreviveram (~ 134 ng/mL). Para um valor de corte > 115 ng/mL, a NGAL representou uma sensibilidade de 87% e especificidade de 100% para o diagnóstico de IRA em pacientes com cirrose hepática. (Shyam et al., 2023) Incidence and outcomes of acute kidney injury including hepatorenal syndrome in hospitalized patients with cirrhosis in the US Analisar o diagnóstico de SHR-IRA e fornecer um guia clínico para o uso da terlipressina no tratamento desta síndrome O diagnóstico de SHR-IRA pode ser feito a partir de vários critérios, como: aumento de 0,3 mg/dL na creatina sérica em 48 horas ou aumento de 50% em relação à linha base (7 dias anteriores); nenhuma resposta à retirada de diuréticos e expansão de volume de 2 dias com albumina (1 g/kg por dia); cirrose com ascite; ausência de choque; nenhum uso recente de nefrotóxicos; ausência de proteinúria (< 500 mg por dia); US renal normal; esforço fracionado de sódio < 0,1%; e lesão tubular, analisada pela ausência de cilindros granulares ou epiteliais. A terlipressina é uma intervenção essencial para a reversão da SHR-IRA, porém, deve ser evitada em pacientes com insuficiência hepática aguda ou crônica grau 3; hipóxia; isquemia coronária, periférica e mesentérica, e creatina sérica > 5 mg/dL. (Patidar et al., 2023) Elevated D-Dimer levels correlate with the development of hepatorenalsyndrome and a poor outcome in patients with cirrhosis Investigar a relação entre marcadores hemostáticos e os diferentes tipos de IRA em pacientes com cirrose Os marcadores hemostáticos COX, APTT, TT, INR, D-dímero e Fib foram associados aos diversos tipos de IRA, SHR e necrose tubular aguda. Apenas o marcador D-dímero foi um fator de risco independente para SHR, sendo fator para o diagnóstico, com sensibilidade de 87% e especificidade de 73%, no ponto de corte de 3,7 mg/L. Taxas de sobrevivencia foram diferentes conforme o nível de D-dímero. (Chen et al., 2022) Safety and efficacy of terlipressin in acute-on-chronic liver failure with hepatorenal syndrome-acute kidney injury (HRS-AKI): a prospective cohort study Analisar a eficácia e a segurança da administração de terlipressina e do curso da IRA em pacientes com insuficiência hepática aguda crônica A não resposta à terlipressina pode prever a mortalidade de pacientes com SHR-IRA e com insuficiência hepática aguda crônica. Cerca de 21% dos pacientes desenvolveram efeitos adversos ao tratamento, estando vivos apenas 1/3 dos pacientes no dia 90. Cerca de 65% dos pacientes responderam ao tratamento com terlipressina. Recorrência de SHR foi identificado em 22% e progressão para doença renal crônica por SHR em 5% dos pacientes. A sobrevivência sem transplante foi de 70% no dia 30, e 58% no dia 90. A não resposta ao tratamento com terlipressina previu a mortalidade no dia 90. (Kulkarni et al., 2022) Frailty as Tested by the Clinical Frailty Scale Is a Risk Factor for Hepatorenal Syndrome in Patients With Liver Cirrhosis Avaliar o risco da IRA e SHR-IRA em pacientes não eletivamente hospitalizados com cirrose hepática A fragilidade em pacientes com cirrose hepática foi associada à IRA e SHR-IRA. A escala proposta pela Clinical Frailty Scale (CFS) pode ser considerada uma ferramenta confiável para identificar pacientes com alto risco para IRA e SHR-IRA. Durante a internação hospitalar, 56% e 49% dos pacientes desenvolveram IRA e SHR-IRA, respectivamente. Um valor de CFS maior foi observado para pacientes com IRA e SHR-IRA em comparação com pacientes com lesão renal. Houve forte associação e correlação entre a fragilidade do paciente e a SHR-IRA. (Schleicher et al., 2022)
3.1 Fisiopatologia
A SHR-IRA é caracterizada como uma deterioração progressiva da função renal em pacientes com cirrose avançada, necessitando do transplante de fígado e podendo levar à morte antes do transplante (Jung & Chang, 2023). Entre os fatores fisiopatológicos relacionados à SHR-IRA, a disfunção circulatória é considerada o principal mecanismo envolvido nesta doença (Adebayo & Wong, 2023). Assim, por muitos anos, acreditou-se que pacientes com cirrose avançada desenvolviam SHR-IRA a partir da vasodilatação arterial esplâncnica, desencadeando baixo volume arterial efetivo (hipovolemia) e ativação de sistemas vasoconstritores endógenos, como o sistema renina-angiotensina-aldosterona (RAAS) e o sistema nervoso simpático (SNS) (Jung & Chang, 2023).
A intensa ativação destes sistemas induz à disfunção circulatória sistêmica, causando a SHR-IRA. Entretanto, estudos têm mostrado que a utilização de vasoconstritores esplâncnicos e expansores de volume podem restaurar a disfunção circulatória associada a SHR-IRA em apenas 35% dos pacientes (Bera & Wong, 2022). Desta forma, nos últimos anos, ficou evidente que outros mecanismos de importância fisiológica podem estar envolvidos no desenvolvimento da SHR-IRA.
Como estabelecido em nossa pesquisa, para os últimos dois anos (2022–2024), não foram encontrados estudos direcionados à novos mecanismos fisiopatológicos no desenvolvimento da SHR-IRA. No entanto, estudos recentes de revisão (Adebayo & Wong, 2023; Velez et al., 2024) têm enfatizado que outros mecanismos fisiopatológicos podem estar associados à SHR-IRA, como a inflamação sistêmica, as alterações estruturais e distorção arquitetônica do fígado, a cardiomiopatia cirrótica (CC) e a síndrome compartimental abdominal (SCA).
A vasodilatação arterial esplâncnica pode ser exacerbada pela inflamação sistêmica, causada pela translocação bacteriana do trato gastrointestinal e do fígado lesionado. Desta forma, a translocação bacteriana ocasiona o aumento da produção de citocinas pró-inflamatórias, como interleucinas (IL-6 e IL-1β) e o fator de necrose tumoral-alfa (TNF-α). Estas citocinas podem danificar os túbulos renais, formando microtrombos, estresse oxidativo e dano tubular renal. Além disso, aumentam a vasodilatação arterial esplâncnica e a instabilidade hemodinâmica (Adebayo & Wong, 2023).
Alterações estruturais e distorção arquitetônica do fígado podem estar presentes em pacientes cirróticos, aumentando a resistência vascular intra-hepática e obstruindo o fluxo portal. Com a obstrução, vasodilatadores, como o óxido nítrico, são liberados, intensificando a vasodilatação esplâncnica. A CC, dada por uma disfunção cardíaca, é outro mecanismo fisiológico que pode levar a uma incompatibilidade entre a capacitância circulatória e o volume circulatório, diminuindo o subenchimento arterial efetivo, levando a hipoperfusão renal (nefropatia congestiva) e aumentando o risco de desenvolvimento de lesão renal aguda. Já a SCA na circulação renal é ocasionada pela presença de ascite tensa, dificultando a filtração glomerular e causando disfunção renal (Adebayo & Wong, 2023; Velez et al., 2024).
Segundo Adebayo & Wong (2023), estes mecanismos podem ocorrer independentemente um do outro, mas todos, induzem a vasoconstrição renal extrema, reduzindo o fluxo sanguíneo e levando à IRA. Desta forma, o estudo de novas vias metabólicas, que podem ocasionar a IRA, apresenta potencial na identificação de novos biomarcadores para o diagnóstico precoce e tratamentos estratégicos e precisos desta síndrome.
3.2 Diagnóstico
O diagnóstico precoce da SHR-IRA é essencial para definir as intervenções terapêuticas mais adequadas e eficientes ao paciente. Além disso, permite estabelecer um prognóstico, principalmente para pacientes que aguardam o transplante hepático (Duong et al., 2023). Diante disso, diversos fatores têm sido empregados para o diagnóstico precoce da SHR-IRA, como a análise de biomarcadores, níveis de creatinina sérica e exames de imagem, como demonstrado na Tabela 1.
Estudos recentes têm demonstrado que o biomarcador ‘NGAL’ (Lipocalina Associada à Gelatinase de Neutrófilos), liberado de células tubulares renais sob estresse logo após uma lesão aguda, é eficiente para o diagnóstico de SHR-IRA em pacientes com cirrose hepática. Estudos têm demonstrado que, além de ajudar no diagnóstico de SHR-IRA em cirróticos, o biomarcador ‘NGAL’ pode prever a resposta ao tratamento (Gambino et al., 2023), identificar subtipos de IRA e correlacionar com resultados clínicos, sendo um preditor independente de mortalidade hospitalar (Yewale et al., 2023; Shyam et al., 2023). Maiores níveis de ‘NGAL’ foram determinados para a necrose tubular aguda (> 259 ng/mL), seguidos de níveis intermediários para a SHR-IRA (125 ng/mL), em comparação com as funções renais normais (40 ng/mL) (Yewale et al., 2023; Shyam et al., 2023). Além disso, Yewale et al. (2023) mostraram que a ‘NGAL’ correlacionou-se com a necessidade de internação na UTI e mortalidade acima de 3 meses. Pacientes com ‘NGAL’ > 205 ng/mL apresentaram sobrevida menor em 2 anos. Já o estudo realizado por Shyam et al. (2023) mostrou que pacientes com ‘NGAL’ > 172 ng/mL apresentavam maior risco de morte.
Outros biomarcadores também têm sido estudados (Chen et al., 2022; Lin et al., 2023). Lin et al. (2023) mostraram que a análise dos biomarcadores zonulina, lipopolissacarídeos (LPS) e proteína de ligação a lipopolissacarídeos (LBP) em células intestinais (Caco‑2) e tubulares renais (HK‑2), por um período de 6 meses, foram eficientemente empregados para o diagnóstico de SHR-IRA em pacientes com cirrose. Enquanto que Chen et al. (2022) mostraram que os marcadores hemostáticos COX, APTT, TT, INR, D-dímero e Fib foram associados à diversos tipos de IRA, SHR e necrose tubular aguda. Porém, apenas o marcador D-dímero foi um fator de risco independente para SHR. Além disso, taxas de sobrevivência foram associadas ao nível de D-dímero.
A análise de diversos fatores/critérios também pode favorecer o diagnóstico da SHR-IRA, como demonstrado por Patidar et al. (2023). O estudo mostrou que critérios como: aumento de 0,3 mg/dL na creatina sérica em 48 horas; a não resposta à retirada de diuréticos e expansão volumétrica de 2 dias com albumina (1 g/kg por dia); presença de cirrose com ascite; ausência de choque; nenhum uso recente de nefrotóxicos; ausência de proteinúria (< 500 mg por dia); ultrassom renal normal; esforço fracionado de sódio < 0,1%; e lesão tubular, são efetivos indicativos para o desenvolvimento de SHR-IRA.
O emprego do ultrassom da veia cava inferior (USVCI) também é capaz de diagnosticar pacientes com SHR-IRA, através do gerenciamento do volume intravascular (hipovolemia e hipervolemia). No estudo realizado por Kaptein et al. (2023b), o USVCI diagnosticou hipovolemia e hipervolemia intravascular em 75% dos pacientes. Além disso, o acompanhamento por USVCI por 5 dias mostrou melhora de 40% dos pacientes quanto ao volume intravascular, indicando diagnósticos errôneos quanto a SHR-IRA. Desta forma, exames de imagem podem ajudar no diagnóstico efetivo e precoce da SHR-IRA.
Outra ferramenta considerada confiável para o diagnóstico e alto risco para IRA e SHR-IRA em pacientes com cirrose hepática é a escala proposta pela Clinical Frailty Scale (CFS). A partir desta escala, Schleicher et al. (2022) mostraram que durante a internação hospitalar, cerca de 50% dos pacientes desenvolveram IRA e SHR-IRA. Valores mais elevados de CFS foram determinados para pacientes com IRA e SHR-IRA em comparação à lesão renal. Além disso, uma forte associação e correlação entre a fragilidade do paciente e a SHR-IRA foi observada.
3.3 Tratamentos
O principal mecanismo envolvido no tratamento da SHR-IRA está relacionado à reversão da dilatação dos vasos sanguíneos na região esplâncnica, assim como, na restauração da perfusão renal (Duong et al., 2023). Neste sentido, vasoconstritores têm sido amplamente utilizados em pacientes com SHR-IRA. Estudos mostram que a terlipressina, um vasoconstritor efetivo no tratamento da SHR-IRA, combinada com albumina, apresenta melhora significativa na reversão da disfunção renal (Jindal et al., 2024; Narayanan, 2023).
A albumina auxilia na expansão do volume plasmático, estabelecendo o equilíbrio hemodinâmico e intensificando a ação da terlipressina (Duong et al., 2023). No estudo realizado por Ma et al. (2024), pacientes com SHR-IRA tratados por 2 dias com infusão de albumina (80%) demonstraram melhores respostas ao tratamento quando comparados à terlipressina (61%). Jindal et al. (2024) mostraram que, para um tratamento de 7 dias, 69% dos pacientes tratados com terlipressina (2 mg) por 24 h mais albumina em 12 h (TA) demonstraram resposta ao tratamento. Enquanto, para o tratamento convencional (apenas terlipressina) por 48 h, apenas 31% apresentaram resposta. Além disso, o tratamento com TA mostrou menor taxa de mortalidade e melhores respostas ao grau de IRA, quando comparado ao tratamento apenas com terlipressina. Narayanan (2023) também demonstraram respostas efetivas para o tratamento com terlipressina-albumina. Cerca de 54% dos pacientes com SHR-IRA demonstraram resposta ao tratamento com terlipressina-albumina, além de apresentarem sobrevida de 6 meses, comparados aos pacientes que não responderam ao tratamento. Assim, resposta ao tratamento foi um preditor para mortalidade e doença hepática terminal.
Pesquisas têm sido realizadas no sentido de estudar diferentes preditores para a resposta ao tratamento da SHR-IRA. Neste sentido, Agrawal et al. (2024) mostraram que preditores independentes para a resposta ao tratamento com terlipressina (sendo 61% dos pacientes com SHR-IRA), foram obtidos a partir da creatinina sérica basal, pontuação Child Turcotte Pugh (CTP) e DCD4. Os preditores foram analisados por meio de um modelo computacional Delphi, o qual demonstrou excelente capacidade preditiva para prever a resposta ao tratamento com terlipressina em pacientes com SHR-IRA. Curry et al. (2023) associou baixos níveis de creatina sérica basal (< 5mg/dL) com a resposta ao tratamento com terlipressina em pacientes com SHR-IRA, demonstrando maior sobrevida global e livre de transplante em 3 meses. Kulkarni et al. (2022) também demonstraram que a resposta ao tratamento com terlipressina foi útil para prever a insuficiência hepática aguda crônica e a mortalidade em pacientes com SHR-IRA em 3 meses.
No entanto, estudos têm demonstrado que a utilização destes vasoconstritores (terlipressina-albumina) pode ocasionar efeitos adversos (Duong et al., 2023), devendo ser evitada em pacientes com outras enfermidades, como insuficiência hepática aguda ou crônica grau 3; hipóxia; isquemia coronária, periférica e mesentérica, e creatina sérica > 5 mg/dL (Patidar et al., 2023). Neste sentido, novos tratamentos vêm sendo estudados, visando eliminar ou reduzir possíveis complicações. Porém, como demonstrado no estudo realizado por Gonzalez et al. (2023), o tratamento de terlipressin-albumina (TA) mostrou maior reversão da SHR-IRA e aumento da sobrevida global dos pacientes, quando comparado ao tratamento com midodrina e octreotida-albumina (MOA). Desta forma, mais estudos devem ser realizados a fim de encontrar formas alternativas e eficientes ao tratamento com terlipressina.
4 CONCLUSÃO
Nos últimos dois anos, de 2022 a 2024, não foram encontrados estudos de pesquisa relacionados à novos mecanismos envolvidos na fisiopatologia da SHR-IRA. No entanto, estudos de revisão têm demonstrado que o principal mecanismo envolvido na SHR-IRA é a disfunção circulatória. Os estudos abordados neste artigo de revisão mostraram que marcadores hemostáticos, como ‘NGAL’, zonulina, LPS, LBP, COX, APTT, TT, INR, D-dímero e Fib podem ser eficientemente empregados para o diagnóstico de SHR-IRA, além de indicarem taxas de sobrevida. Nível de creatina sérica, resposta à retirada de diuréticos, expansão volumétrica, cirrose com ascite, uso de nefrotóxicos, proteinúria, exames de imagem (USVCI), esforço fracionado de sódio, lesão tubular e escala proposta pela CFS, também podem ser considerados para o diagnóstico da SHR-IRA. Os estudos também mostraram que a terlipressina-albumina (TA) apresenta destaque no tratamento da SHR-IRA, além de ser um preditor para mortalidade e doença hepática terminal. Porém, a TA apresenta efeitos adversos, especialmente para pacientes com insuficiência hepática aguda ou crônica grau 3; e isquemia coronária, periférica e mesentérica. Neste sentido, pesquisas futuras devem focar no estudo de novas formas de tratamento para a SHR-IRA, com redução de complicações e oferecendo melhores prognósticos e qualidade de vida aos pacientes. Como demonstrado neste trabalho, é também necessário novos estudos fisiopatológicos e de biomarcadores, garantindo a eficácia do tratamento para a SHR-IRA.
REFERÊNCIAS
Adebayo, D., & Wong, F. (2023). Pathophysiology of Hepatorenal Syndrome – Acute Kidney Injury. Clinical Gastroenterology and Hepatology, 21(10), S1–S10. https://doi.org/10.1016/j.cgh.2023.04.034
Agrawal, J., Kumar, A., Sharma, P., Bansal, N., Singla, V., Sharma, S., & Arora, A. (2024). Delhi Model: A New Tool for Predicting Response to Terlipressin in Hepatorenal Syndrome—Acute Kidney Injury. Journal of Clinical and Experimental Hepatology, 14(1), 101266. https://doi.org/10.1016/j.jceh.2023.08.002
Badura, K., Frąk, W., Hajdys, J., Majchrowicz, G., Młynarska, E., Rysz, J., & Franczyk, B. (2023). Hepatorenal Syndrome—Novel Insights into Diagnostics and Treatment. International Journal of Molecular Sciences, 24(24), 17469. https://doi.org/10.3390/ijms242417469
Bera, C., & Wong, F. (2022). Management of hepatorenal syndrome in liver cirrhosis: A recent update. Therapeutic Advances in Gastroenterology, 15, 17562848221102679. https://doi.org/10.1177/17562848221102679
Chen, B., Liu, J., Li, Y., He, X., Zhou, C., Chen, Y., & Zheng, M. (2022). Elevated D-Dimer levels correlate with the development of hepatorenal syndrome and a poor outcome in patients with cirrhosis. Scandinavian Journal of Gastroenterology, 57(12), 1486–1493. https://doi.org/10.1080/00365521.2022.2098051
Curry, M. P., Vargas, H. E., Befeler, A. S., Pyrsopoulos, N. T., Patwardhan, V. R., & Jamil, K. (2023). Early treatment with terlipressin in patients with hepatorenal syndrome yields improved clinical outcomes in North American studies. Hepatology Communications, 7(1), e1307–e1307. https://doi.org/10.1097/01.HC9.0000897228.91307.0c
Duong, N., Kakadiya, P., & Bajaj, J. S. (2023). Current Pharmacologic Therapies for Hepatorenal Syndrome-Acute Kidney Injury. Clinical Gastroenterology and Hepatology, 21(10), S27–S34. https://doi.org/10.1016/j.cgh.2023.06.006
Gambino, C., Piano, S., Stenico, M., Tonon, M., Brocca, A., Calvino, V., Incicco, S., Zeni, N., Gagliardi, R., Cosma, C., Zaninotto, M., Burra, P., Cillo, U., Basso, D., & Angeli, P. (2022). Diagnostic and prognostic performance of urinary neutrophil gelatinase‐associated lipocalin in patients with cirrhosis and acute kidney injury. Hepatology, n/a-n/a. https://doi.org/10.1002/hep.32799
Gonzalez, S. A., Chirikov, V. V., Wang, W.-J., Huang, X., Jamil, K., & Simonetto, D. A. (2023). Terlipressin vs Midodrine Plus Octreotide for Hepatorenal Syndrome-Acute Kidney Injury: A Propensity Score–Matched Comparison. Clinical and Translational Gastroenterology, 14(12), e00627. https://doi.org/10.14309/ctg.0000000000000627
Hasan, I., Rashid, T., Chirila, R. M., Ghali, P., & Wadei, H. M. (2021). Hepatorenal syndrome: Pathophysiology and evidence-based management update. Romanian Journal of Internal Medicine, 59(3), 227–261. https://doi.org/10.2478/rjim-2021-0006
Jindal, A., Singh, H., Kumar, G., Arora, V., Sharma, M. K., Maiwall, R., Rajan, V., Tewathia, H. V., Vasishtha, C., & Sarin, S. K. (2024). Early Versus Standard Initiation of Terlipressin for Acute Kidney Injury in ACLF: A Randomized Controlled Trial (eTerli Study). Digestive Diseases and Sciences, 69(6), 2204–2214. https://doi.org/10.1007/s10620-024-08423-8
Jung, C.-Y., & Chang, J. W. (2023). Hepatorenal syndrome: Current concepts and future perspectives. Clinical and Molecular Hepatology, 29(4), 891–908. https://doi.org/10.3350/cmh.2023.0024
Kaptein, E. M., Oo, Z., & Kaptein, M. J. (2023a). Hepatorenal syndrome misdiagnosis may be reduced using inferior vena cava ultrasound to assess intravascular volume and guide management. Renal Failure, 45(1), 2185468. https://doi.org/10.1080/0886022X.2023.2185468
Kaptein, E. M., Oo, Z., & Kaptein, M. J. (2023b). Hepatorenal syndrome misdiagnosis may be reduced using inferior vena cava ultrasound to assess intravascular volume and guide management. Renal Failure, 45(1), 2185468. https://doi.org/10.1080/0886022X.2023.2185468
Kulkarni, A. V., Ravikumar, S. T., Tevethia, H., Premkumar, M., Kumar, K., Sharma, M., Gupta, R., Rao, P. N., & Reddy, D. N. (2022). Safety and efficacy of terlipressin in acute-on-chronic liver failure with hepatorenal syndrome-acute kidney injury (HRS-AKI): A prospective cohort study. Scientific Reports, 12(1), 5503. https://doi.org/10.1038/s41598-022-09505-1
Lin, Y.-H., Kuo, N.-R., Shen, H.-C., Chang, Y.-C., Lin, R., Liao, T.-L., Yeh, H.-Y., Yang, Y.-Y., Hou, M.-C., & Lin, H.-C. (2023). Prediction models combining zonulin, LPS, and LBP predict acute kidney injury and hepatorenal syndrome–acute kidney injury in cirrhotic patients. Scientific Reports, 13(1), 13048. https://doi.org/10.1038/s41598-023-40088-7
Ma, A. T., Solé, C., Juanola, A., Escudé, L., Napoleone, L., Avitabile, E., Pérez-Guasch, M., Carol, M., Pompili, E., Gratacós-Ginés, J., Soria, A., Rubio, A. B., Cervera, M., Moreta, M. J., Morales-Ruiz, M., Solà, E., Poch, E., Fabrellas, N., Graupera, I., … Ginès, P. (2024). Prospective validation of the EASL management algorithm for acute kidney injury in cirrhosis. Journal of Hepatology, 81(3), 441–450. https://doi.org/10.1016/j.jhep.2024.03.006
Narayanan, V. (2023). Novel predictors of response to therapy with terlipressin and albumin in hepatorenal syndrome–acute kidney injury. Annals of Gastroenterology. https://doi.org/10.20524/aog.2023.0853
Ning, Y., Zou, X., Xu, J., Wang, X., Ding, M., & Lu, H. (2022). Impact of acute kidney injury on the risk of mortality in patients with cirrhosis: A systematic review and meta-analysis. Renal Failure, 44(1), 1934–1947. https://doi.org/10.1080/0886022X.2022.2142137
Patidar, K. R., Piano, S., Cullaro, G., Belcher, J. M., & Allegretti, A. S. (2023). Recent Advances in the Management of Hepatorenal Syndrome: A US Perspective. Clinical Gastroenterology and Hepatology, 21(4), 897-901.e1. https://doi.org/10.1016/j.cgh.2022.12.034
Schleicher, E. M., Kremer, W. M., Kalampoka, V., Gairing, S. J., Kaps, L., Schattenberg, J. M., Galle, P. R., Wörns, M.-A., Nagel, M., Weinmann-Menke, J., & Labenz, C. (2022). Frailty as Tested by the Clinical Frailty Scale Is a Risk Factor for Hepatorenal Syndrome in Patients With Liver Cirrhosis. Clinical and Translational Gastroenterology, 13(7), e00512. https://doi.org/10.14309/ctg.0000000000000512
Shyam, R., Sachan, R., Ali, W., Patel, M. L., & Chaudhary, A. (2023). Urinary Neutrophil Gelatinase-associated Lipocalin as a Diagnostic and Prognostic Marker for Acute Kidney Injury in Hospitalized Cirrhotic Patients: A Study from North Indian Population. Indian Journal of Critical Care Medicine, 27(8), 545–551. https://doi.org/10.5005/jp-journals-10071-24497
Velez, J. C. Q., Latt, N., & Rodby, R. A. (2024). Pathophysiology of Hepatorenal Syndrome. Advances in Kidney Disease and Health, 31(2), 87–99. https://doi.org/10.1053/j.akdh.2024.01.002
Wilde, B., Canbay, A., & Katsounas, A. (2023). Clinical and pathophysiological understanding of the hepatorenal syndrome: Still wrong or still not exactly right? World Journal of Clinical Cases, 11(6), 1261–1266. https://doi.org/10.12998/wjcc.v11.i6.1261
Yewale, R. V., Ramakrishna, B. S., Venugopal, G., Doraiswami, B. V., & Rajini, K. (2023). Urine neutrophil gelatinase-associated lipocalin as a biomarker of acute kidney injury and prognosis in decompensated chronic liver disease: A prospective study. Indian Journal of Gastroenterology, 42(1), 106–117. https://doi.org/10.1007/s12664-022-01312-w
[1]Page MJ, McKenzie JE, Bossuyt PM, et al. Updating guidance for reporting systematic reviews: development of the PRISMA 2020 statement. J Clin Epidemiol 2021;134:S0895-4356(21)00040-8. doi: 10.1016/j.jclinepi.2021.02.003
[2]Higgins JPT, Thomas J, Chandler J, Cumpston M, Li T, Page MJ, Welch VA (editors). Cochrane Handbook for Systematic Reviews of Interventions version 6.4 (updated August 2023). Cochrane, 2023. Available from www.training.cochrane.org/handbook.
1 residente em Clínica Médica pela Universidade Estadual do Oeste do Paraná (UNIOESTE), Francisco Beltrão (PR), Brasil. ORCID 0000.0002.3484.9980. tatianamarangontati@gmail.com
2 residente em Clínica Médica pela Universidade Estadual do Oeste do Paraná (UNIOESTE), Francisco Beltrão (PR), Brasil. ORCID 0009-0002-7403-6308. wust_neto@hotmail.com
3 residente em Clínica Médica pela Universidade Estadual do Oeste do Paraná (UNIOESTE), Francisco Beltrão (PR), Brasil. ORCID 0009-0000-2424-9239. voltolini.jessica@gmail.com
4 residente em Clínica médica pela Universidade Estadual do Oeste do Paraná (UNIOESTE), Francisco Beltrão (PR), Brasil. ORCID 00009-0005-7984-1420. ariadnescampiolo@gmail.com
5 acadêmica do curso de medicina pela Universidade Cesumar (UNICESUMAR), Maringá (PR), Brasil. ORCID 0000-0002-7395-4783. manuvielmo@gmail.com
6 acadêmico do curso de medicina pela Universidade Estadual do Oeste do Paraná (UNIOESTE), Francisco Beltrão (PR), Brasil. ORCID 0000-0002-1772-7279.patrick.lanzarini@gmail.com
7 Laboratório Multiusuário de Biociências e Saúde (LABS). Universidade Estadual do Oeste do Paraná (UNIOESTE), Francisco Beltrão (PR), Brasil. ORCID 0000-0002-0757-3659.lferreto@gmail.com
8 Professor Adjunto da Universidade Estadual do Oeste do Paraná (UNIOESTE), Francisco Beltrão (PR), Brasil. ORCID 0000-0001-8331-2410. paulo.fortes@unioeste.br
