HYPERTHERMIC INTRAPERITONEAL CHEMOTHERAPY AS NA INNOVATION IN THE TREATMENT OF PERITONEAL CARCINOMATOSIS
REGISTRO DOI: 10.5281/zenodo.11214675
Jessica Teixeira Cavalcante de Souzaª; Lucas Ferreira Leonardoa; Tatiane Melissa Peres Nascimentoa; Orientadora: Amanda de Oliveira Baccinb.
RESUMO
O Câncer Colorretal é uma neoplasia de causa multifatorial decorrente de mutações em genes que perdem a capacidade do controle celular, com isso, ocorre o favorecendo da multiplicação celular desordenada diferenciando-se do crescimento celular normal, dessa maneira, o seu desenvolvimento acelerado e de difícil controle culmina no surgimento de metástases podendo se dissiparem por regiões do corpo e trazer um prognóstico ruim aos pacientes acometidos por está vertente da doença. A Carcinomatose Peritoneal, é um tipo de metástase que acomete o tecido peritoneal, sendo esta uma membrana vascularizada que reveste a cavidade abdominal e os órgãos abdominais, com a finalidade de promover proteção, suporte e funcionamento adequado aos órgãos. Importante trazer luz as dificuldades de diagnóstico da CP, principalmente, devido a patologia desenvolver-se de maneira assintomática e somente ser descoberta quando ocorrer danos maiores aos sistema do paciente, nesse sentido, pesquisas estão sendo desenvolvidas com o intuito de antecipar o diagnóstico para promover a terapêutica dentro de um intervalo de tempo menor, visando o aumento da sobrevida e as chances de cura. Os desafios terapêuticos desta doença são grandes, haja vista, a complexidade dos danos causados, dessa forma, as linhas de tratamento são vastas, pois, envolvem desde a tratamentos convencionais, por exemplo, as quimioterapias sistêmicas que possuem eficácia aceitável, porém, grandes efeitos colaterais como queda brusca de cabelos, náuseas, desconforto gastrointestinais e outros. Em contrapartida, terapias mais inovadoras estão se popularizando, por exemplo, a HIPEC que visa promover um tratamento mais eficaz, assertivo e com pouco afeito adverso, isso porque é uma terapia mais individualizada e baseada em score que definem o sucesso ou o insucesso da aplicação.
Embora, a aplicação da HIPEC seja clara e com resultados satisfatórios quando comparamos a métodos terapêuticos mais convencionais, ainda assim é possível vislumbrarmos que mais estudos sejam desenvolvidos e que a definição de protocolos possam ser patronizados possibilitando avaliar efetivamente os pontos favoráveis e desfavoráveis da técnica. Além, da busca por medicamentos que possam ser utilizados em soluções hipertérmicas e que tenham ação superior aos já utilizados atualmente.
Palavras-chave: câncer colorretal, carcinomatose peritoneal, mecanismo de ação, quimioterapia hipertérmica intraperitoneal.
ABSTRACT
Colorectal Cancer is a neoplasm with a multifactorial cause resulting from mutations in genes that lose the capacity for cellular control, thus favoring disordered cell multiplication, differentiating itself from normal cell growth, thus, its accelerated and difficult development. Control culminates in the emergence of metastases that can dissipate throughout regions of the body and bring a poor prognosis to patients affected by this aspect of the disease. Peritoneal Carcinomatosis is a type of metastasis that affects the peritoneal tissue, which is a vascularized membrane that covers the abdominal cavity and abdominal organs, with the purpose of promoting protection, support and adequate functioning of the organs. It is important to bring light to the difficulties in diagnosing PC, mainly due to the pathology developing asymptomatically and only being discovered when greater damage occurs to the patient’s system. In this sense, research is being developed with the aim of anticipating the diagnosis to promote therapy within a shorter period of time, aiming to increase survival and the chances of a cure. The therapeutic challenges of this disease are great, considering the complexity of the damage caused, therefore, the lines of treatment are vast, as they involve everything from conventional treatments, for example, systemic chemotherapy, which have acceptable efficacy, but great effects. side effects such as sudden hair loss, nausea, gastrointestinal discomfort and others. On the other hand, more innovative therapies are becoming popular, for example, HIPEC, which aims to promote a more effective, assertive treatment with little adverse effect, because it is a more individualized therapy and based on scores that define the success or failure of the application.
Although the application of HIPEC is clear and with satisfactory results when compared to more conventional therapeutic methods, it is still possible to envisage that more studies will be developed and that the definition of protocols can be standardized, making it possible to effectively evaluate the favorable and unfavorable points of the technique. In addition, the search for medicines that can be used in hyperthermic solutions and that have superior action to those currently used.
Keywords: colorectal cancer, peritoneal carcinomatosis, mechanism of action, intraperitoneal hyperthermic chemotherapy.
1. INTRODUÇÃO
A definição de câncer, segundo a Organização Pan-Americana de Saúde (OPAS), refere-se à proliferação desordenada de células que perderam a capacidade de regular seu crescimento, apresentando potencial invasivo em tecidos adjacentes e perturbando a homeostase do organismo. O câncer emergiu como uma preocupação global, notadamente para as entidades de saúde encarregadas da vigilância epidemiológica, considerando o aumento observado nos casos. A OPAS estima que até 2030 ocorrerão 2,3 milhões de óbitos nas Américas, destacando que aproximadamente um terço destes poderiam ser prevenidos mediante a abordagem dos principais fatores de risco (1).
Dentre esses fatores, o tabagismo desponta como responsável por 22% das mortes relacionadas ao câncer. Adicionalmente, as neoplasias originadas por infecções, como hepatite e papiloma vírus humano, contribuem com 22% das mortes em países de baixa e média renda. A modificação do estilo de vida figura como componente essencial nesse contexto. Portanto, a sensibilização e a implementação de estratégias de intervenção direcionadas à redução desses fatores de risco são imprescindíveis para atenuar o impacto do câncer na saúde global (2).
Anualmente o surgimento de novos casos tem gerado desconforto e inquietude às autoridades de saúde, pois observa-se que as neoplasias malignas estão cada vez mais afetando ambos os sexos em percentuais iguais ou parecidos, conforme dados já divulgados pelo Instituto Nacional do Câncer (INCA), no qual se destacam os cânceres primários oriundos do cólon e reto (3).
O carcinoma colorretal é uma patologia heterogênea que, predominantemente, se origina de mutações genéticas que ocorrem em lesões benignas, como pólipos colônicos. Dados epidemiológicos indicam que o carcinoma colorretal ocupa o terceiro lugar entre os tipos de câncer mais frequentes no Brasil. O INCA estima que, no período de 2023 a 2025, haverá um total de 45.630 novos casos desse câncer no Brasil, sendo 21.970 em indivíduos do sexo masculino e 23.660 em indivíduos do sexo feminino. Em 2020, foram registrados 20.245 óbitos decorrentes dessa neoplasia, sendo 9.889 em homens e 10.356 em mulheres, evidenciando os principais fatores de risco associados ao carcinoma colorretal, sendo eles o sedentarismo, a obesidade, consumo irregular de álcool, baixa ingestão de frutas e vegetais, bem como a predisposição genética e doenças inflamatórias crônicas (4).
O diagnóstico na maioria dos casos é prejudicado e não obtido de maneira precoce devido a pouca evidência sintomatológica, que apenas se intensifica nos estágios avançados da doença (5). Com isso, a investigação precisa ser minuciosa afim de evitar as possíveis complicações recorrentes da doença, como as obstruções instestinais malignas,que abrange 24% dos pacientes em fase avançada, a perfuração intestinal que é a segunda principal complicação causada pela CCR e que tem a incidência de 2.6% a 12% dos pacientes, a hemorragia colorretal que atinge cerca de 25% a 50% dos casos de metástases que são descobertas no momento do diagnóstico primário, entretanto, de 10% a 15% dos pacientes podem cursar para o desenvolvimento de metástases durante o processo de tratamento e acompanhamento, dentre as mais variadas podemos citar a carcinomatose peritoneal que possui alta incidência nos indivíduos que possuem diagnóstico de CCR tardio (6,7).
A carcinomatose peritoneal (CP) é reconhecida como uma forma grave de disseminação tumoral, e até pouco tempo atrás era considerada uma condição incurável e apenas passivel de tratamento paliativos, sendo a principal causa de morte entre pacientes com tumores intestinais, especialmente os colorretais (8).
A CP ocorre quando tumores malignos, em estágio avançado, invadem e se depositam no tecido peritoneal. Inicialmente assintomática, à medida que avança, a CP pode manifestar sintomas como náuseas, diarreia, dor abdominal e perda de peso. No entanto, o diagnóstico precoce continua sendo um desafio, pois, atualmente utiliza-se métodos de imagem, como tomografia computadorizada (TC), tomografia por emissão de pósitrons (PET) e ultrassonografia, mas a disseminação micronodular dos tumores pode escapar à detecção prévia; sendo importante considerar que muitas vezes é diagnosticada somente quando há produção de ascite ou obstrução intestinal, dificultando o tratamento. É comum em pacientes com tumores colorretais, sendo encontrada em até 7% após cirurgia primária e entre 4% e 19% após cirurgia com intenção curativa (9). Nesse sentido, e com o intuito de aprimoramento do diagnóstico da CP linhas de pesquisas visam identificar biomarcadores tumorais na corrente sanguínea que estejam associados com este processo de desenvolvimento neoplásico e que possam em um futuro breve reduzir o tempo e promover diagnóstico precoce. A intenção é favorecer a descoberta antecipada e agir de maneira efetiva para que o paciente tenha acesso a HIPEC, considerando até o uso profilático da técnica em casos de CCR avançado (estágio III) em que o indivíduo possa ter uma alta chance de desenvolver metástases devido a presença no soro de marcadores específicos, sendo esta uma grande exemplificação de como a técnica poderá ser aplicada (10).
A estimativa de sobrevida em pacientes com CP é geralmente curta, em torno de 5 meses, podendo ser prolongada até 12 meses com tratamentos paliativos. Entretanto, em pacientes bem selecionados e que são submetidos à cirurgia citorredutora (CRS) associada a HIPEC podem dar ao paciente a sobrevida de até 63 meses (11).
A quimioterapia intraperitoneal hipertérmica (HIPEC) emerge como uma modalidade terapêutica aplicável a neoplasias de origem apendicular e colorretal. Essa abordagem terapêutica envolve a administração de agentes quimioterápicos aquecidos diretamente na cavidade abdominal do paciente, concomitantemente à cirurgia citorredutora (CRS). Sendo, portanto, uma terapêutica amplamente empregada no tratamento de neoplasias peritoneais primárias e secundárias (metástases), como mesotelioma, câncer de ovário, estômago, pâncreas, pseudomixoma peritoneal e câncer colorretal (12,13).
Os resultados têm demonstrado superioridade em relação às opções terapêuticas convencionais, proporcionando elevação de até 50% na taxa de eficácia, em virtude da concentração otimizada dos agentes quimioterápicos agindo diretamente na área de interesse, associada a uma menor taxa de toxicidade. É importante destacar que sua eficácia pode ser variável, dependendo de fatores individuais do paciente, do perfil tumoral, da progressão da doença e da escolha dos agentes quimioterápicos a serem empregados, pois, em determinadas circunstâncias, essa terapêutica contribui para a redução do tamanho tumoral e para o prolongamento da sobrevida do paciente (14, 15).
Nesse contexto, o objetivo deste trabalho é conduzir uma análise do impacto da HIPEC na biologia molecular das carcinomatoses peritoneais derivadas de tumores colorretais. Isso envolverá a identificação e exploração dos mecanismos subjacentes que conferem eficácia a essa abordagem terapêutica quando associada à CRS. Além disso, pretende-se investigar de forma abrangente as limitações que restringem a aplicabilidade da HIPEC em pacientes diagnosticados com carcinomatose peritoneal decorrente de CCR, proporcionando uma compreensão mais sólida desse tratamento e suas implicações clínicas.
2. JUSTIFICATIVA
A avaliação da eficácia da HIPEC como uma abordagem inovadora no tratamento das carcinomatoses peritoniais, quando combinada à cirurgia citorredutora, revela resultados promissores, notadamente ao se considerar análises estatísticas e comparativas em relação à terapia quimioterápica convencional (16).
De acordo com os dados fornecidos pela Comissão Nacional de Incorporação de Tecnologias no Sistema Único de Saúde (CONITEC), um estudo controlado randomizado e compreendendo 104 pacientes com carcinomatose peritoneal generalizada, avaliou dois grupos de tratamento: um submetido à quimioterapia sistêmica associada à CCR e outro ao tratamento HIPEC. Após um período médio de acompanhamento de 21,6 meses, constatou-se que 20 pacientes do grupo de tratamento convencional permaneciam vivos, em contraposição a 30 pacientes do grupo HIPEC. A abordagem de citorredução seguida da HIPEC resultou em uma redução significativa do risco de mortalidade, com uma taxa de risco de 0,55 e um intervalo de confiança de 95% (0,32 a 0,95). A mediana da sobrevida dos pacientes submetidos à quimioterapia sistêmica foi de 12,6 meses, enquanto aqueles tratados com HIPEC apresentaram uma mediana de sobrevida de 22,4 meses (P = 0,032) (17).
Esses dados corroboram com a justificativa para a realização desse estudo, que visa apresentar as mais recentes abordagens terapêuticas no contexto oncológico, com o objetivo de otimizar o prognóstico e mitigar o desconforto experimentado pelos pacientes. É amplamente reconhecido que após o diagnóstico, a vida do paciente adquire novos significados, o que ressalta a importância de proporcionar tratamentos que minimizem o desconforto, otimizem a resposta prognóstica e reduzam o tempo de terapia, a fim de promover o bem-estar dos indivíduos afetados pela doença. Especificamente, os tratamentos quimioterápicos convencionais, embora ainda apresentem resultados satisfatórios, frequentemente se associam a efeitos adversos consideráveis, como náuseas, vômitos, diarréia, dor abdominal e perda capilar. Além disso, aumentam o risco de infecções quando os acessos permanentes para a administração de medicamentos não são manuseados adequadamente.
Por outro lado, a abordagem da HIPEC combinada com CRS reduz o tempo de internação hospitalar e otimiza a biodisponibilidade do agente quimioterápico nas células tumorais, resultando em uma potencialização da eficácia terapêutica. Ademais, a aplicação de solução hipertérmica na cavidade intraperitoneal reduz significativamente os efeitos colaterais pós-intervenção quimioterápica, por exemplo a queda dos cabelos, contribuindo para o conforto e bem-estar dos pacientes oncológicos.
3. METODOLOGIA DE ESTUDO
Consiste em uma revisão bibliográfica, que compreendeu dados publicados de 2012 até o presente momento, obtidos a partir de fontes de renome, incluindo os bancos de dados SciELO e PubMed, contemplando pesquisas tanto em âmbito nacional quanto internacional. Foi realizada uma busca sistemática, utilizando as palavras-chave “câncer colorretal”, “carcinomatose peritoneal”, “mecanismo de ação” e “quimioterapia hipertérmica intraperitoneal”.
O estudo teve como foco principal a análise da técnica de quimioterapia intraperitoneal hipertérmica combinada a cirurgia citorredutora no tratamento de carcinomatose peritonial decorrente de câncer colorretal. Foram estabelecidos critérios específicos para a seleção do material a ser incluído na revisão, sendo considerados elegíveis estudos que abordassem a HIPEC e CR como modalidades de tratamento para a condição estabelecida dentro do período cronológico estipulado e que estivessem na íntegra. Estudos que não atendessem a esses critérios foram excluídos.
4. CONSIDERAÇÕES GERAIS
4.1. Introdução a tumores colorretais e carcinomatose peritonial
Considerando que o diagnóstico de tumores colorretais precisa ser minucioso devido à sua tendência ao desenvolvimento assintomático ou à manifestação de sintomas que se assemelham a outras patologias que afetam o sistema gastrointestinal, é imprescindível a realização de pesquisas visando aprimorar a correlação sintomatomatológica em pacientes afetados pelas neoplasias de cólon e reto. Segundo dados apresentados pelo INCA em 2020, a estimativa mundial ultrapassou 1,9 milhões de novos casos de câncer colorretal, dos quais 10% classificaram-se como o terceiro câncer mais incidente em escala global. Ao analisar esses dados em escala internacional, 1,1 milhão de novos casos afetaram o sexo masculino, com uma taxa estimada de 23,40 casos a cada 100 mil homens. Entre as mulheres, observou-se uma estimativa de 865 mil novos casos, posicionando esse câncer como o segundo mais frequente no grupo feminino, com uma taxa de incidência de 16,20 casos a cada 100 mil mulheres. Esse estudo epidemiológico também enfatizou a segmentação da incidência por regiões, constatando as maiores taxas em homens nas regiões Central, Norte e Sul da Europa, enquanto as maiores taxas em mulheres foram registradas na Oceania e no Norte da Europa (18).
No contexto nacional, de acordo com dados também divulgados pelo INCA (2023), identificamos diferenciações significativas na incidência de novos casos de câncer colorretal por região, conforme ilustrado nas figuras 1 e 2 a seguir:
Figura 1 – Representação espacial das taxas ajustadas de incidência por 100 mil homens, estimadas para o ano de 2023, segundo Unidade de Federação (neoplasia maligna do cólon e reto).
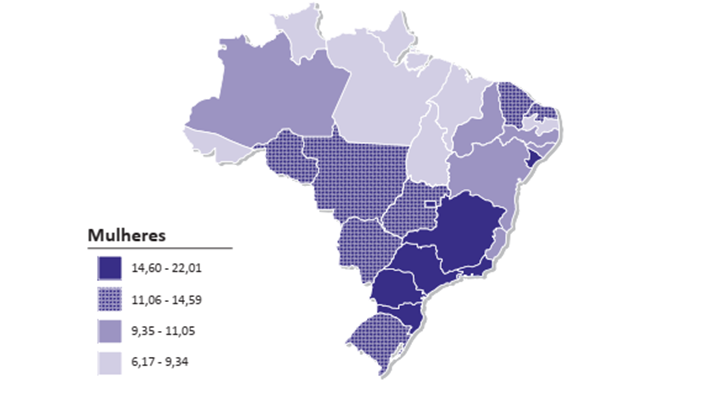
Figura 2 – Representação espacial das taxas ajustadas de incidência por 100 mil mulheres, estimadas para o ano de 2023, segundo Unidade de Federação (neoplasia maligna do cólon e reto).

Nesse sentido, podemos examinar a heterogeneidade na prevalência de neoplasias colorretais em diferentes regiões do Brasil. No que tange à incidência em indivíduos do sexo masculino, destacam-se as regiões Centro-Oeste, Sul e Sudeste. Já ao analisar a prevalência de novos casos em mulheres, notam-se números expressivos nas regiões Sul, Sudeste e parte da região Centro-Oeste, incluindo o Distrito Federal (19).
A explicação para a disparidade de incidência entre regiões, além de elementos de predisposição genética e hereditária, envolve a ingestão exacerbada e indiscriminada de alimentos ultraprocessados e industrializados, geralmente carentes ou destituídos de fibras. Adicionado ao consumo excessivo de carnes vermelhas, particularmente em áreas onde o churrasco é uma prática cultural em encontros familiares e sociais, contribui significativamente para tal diferença. Esse costume implica em riscos à saúde, uma vez que a combustão do carvão gera a liberação de substâncias carcinogênicas, especialmente os hidrocarbonetos policíclicos aromáticos (HPA), favoráveis a provocar patologias respiratórias e mutações (20).
Embora, a maior incidência de CCR esteja atrelado aos adenocarcinomas que lideram com 95% dos casos, ainda existem outros tipos de câncer colorretais que podem afetar a população ainda que incomuns. Os tumores neuroendócrinos ou carcinoides, são células neuroendócrinas localizadas no intestino grosso e que atuam produzindo hormônios, os tumores estromais gastrointestinais (GISTs), caracterizam-se como sendo um tipo de tumor oriundo das células especiais na parede do cólon que são chamadas de células intersticiais de Cajal, sendo essas importantes reguladoras dos processos corporais como a digestão dos alimentos e consideradas como integrantes do sistema nervoso autônomo (SNA), essas células podem estar presentes em qualquer parede do trato digestivo, mas são incomuns no cólon, outro tipo são os linfomas que iniciam seu desenvolvimento nos gânglios linfáticos, porém, poderão começar no cólon, reto ou em outros órgãos e os sarcomas podendo ter seu início nas camadas musculares ou em outros tecidos conjuntivos da porção cólon e reto do intestino grosso. Além da especificidade de cada tipo de câncer há de se considerar que o microambiente tumoral favorece o sucesso ou o insucesso para que as células cancerígenas sejam capazes de se desenvolverem e se dissiparem para outros órgãos, que no caso dos CCRs o ponto-alvo mais próximo é o peritônio, dando origem ao que chamamos de carcinomatose peritoneal (21).
A carcinomatose peritoneal (CP) caracteriza-se pela presença de células tumorais no peritônio, estas populações celulares podem ser de origem primária, como o Mesotelioma Peritoneal ou o Carcinoma Peritoneal Primário, e como secundária, essas células são oriundas do CCR, câncer de ovário, câncer gástrico e outros. A região peritoneal apresenta uma área considerável com vasta drenagem linfática, facilitando a invasão pelas células tumorais que é baseado na teoria de ‘’Aprisionamento de células tumorais”, que se fundamenta em 4 etapas, sendo elas: liberação de células tumorais, adesão de células tumorais-perinoteo, migração e sobrevivência. A primeira etapa ocorre o que chamamos de transformação mesenquimatosa das células tumorais, pois, devido ao aumento da pressão no fluído intersticial ocorre o favorecimento de alterações no citoesqueleto das células juntamente com a perda de glicoproteínas membranares como a E-canderinas, sendo esta uma glicoproteína considerada um importante elemento supressor da mobilidade celular. Após esta fase as células tumorais que se desprenderem do tumor primário, acabam sobrevivendo com o processo anoikis, que confere as essas unidades celulares resistência à morte celular por perda de adesão, tornando-se distintas das demais células do organismo. Na fase de adesão para assegurar o sucesso no processo de adesão celular, as células cancerígenas necessitam de um microambiente rico em vasos sanguíneos e com características favoráveis para que ocorra o processo de angiogênese de maneira constante. A ligação das integrinas aos componentes da matriz extracelular do peritônio, como o colágeno e as fribronectinas, é o que propicia a adesão das células tumorais. A fase de migração ocorre com sucesso quando as células alteradas atingem ao espaço submesotelial após aderirem-se às moléculas CD44, e para que todo este processo não seja em vão a quarta fase é onde as células cancerígenas sintetizam um conjunto de fatores para perturbar a barreira de sangue peritoneal, levando à neoangiogênese e o desenvolvimento de um microambiente imunossupressor, rico em células mesoteliais peritoneais, fibroblastos e macrófagos peritoneais (22).
4.2. Indicação e seleção de pacientes
Segundo a literatura, a HIPEC tem sido utilizada nos cânceres que acometem órgãos e tecidos envoltos pelo peritônio, sendo assim, é indicada no tratamento dos cânceres colorretais que possuem a capacidade de migrarem para o peritônio, por exemplo, o carcinoma peritoneal (CP), o adenocarcinoma colorretal mucinoso com metástase peritoneal e os sarcomas, além disso para as carcinomatoses peritoneais primárias e secundárias também há indicação. Outro motivo que encontra-se como respaldo para indicar este tratamento inovador seria adotá-lo como medida profilática na prevenção de metástase peritoneal em pacientes de alto risco metastático (23, 24).
No entanto, para que a CRS e a HIPEC tenham um resultado significativo, é necessário que a CRS seja bem realizada, removendo totalmente o tumor macroscopicamente ou o máximo possível, não deixando mais de 2,5mm para que os agentes quimioterápicos possam aderir da melhor forma ao tecido. Embora, os resultados com a aplicação da HIPEC sejam de 20 a 50 vezes mais efetivos em relação à quimioterapia sistêmica, é essencial que haja uma seleção minuciosa dos pacientes visando evitar complicações durante o procedimento e no pós-operatório, uma vez que durante o procedimento muitas alterações fisiológicas ocorrem e para minimizar isto, o estado fisiológico do paciente é fundamental na avaliação pré-cirúrgica, cabendo à equipe multidisciplinar a decisão de em quais pacientes será empregada a HIPEC (25).
Os fatores primordiais a serem observados para indicação ao procedimento são: a gravidade da doença, fatores nutricionais, avaliação cardiológica, hepática e renal, verificação dos níveis de eletrólitos, exames de imagem, obesidade visceral que possa limitar a visibilidade dos focos da doença abaixo de 2,5mm e o índice de carcinomatose peritoneal (PCI), sendo este um dos principais fatores de escolha. O PCI é utilizado para quantificar a extensão residual da doença na cavidade abdominal, com a seguinte classificação: índice de citorredução (IC) que varia de 0 a 3, onde IC-0 indica ausência de doença residual, IC-1 refere-se a doença residual com até 2,5mm, IC-2 aponta doença residual entre 0,25 e 2,5mm e IC-3 denota doença residual superior a 2,5mm. Quanto menor o PCI, maior a chance de remoção total dos focos tumorais, aumentando assim o sucesso da CRS e HIPEC (23). Portanto, a eficácia e o sucesso dos casos submetidos à HIPEC são avaliados de maneira personalizada, levando em consideração as características clínicas e diagnósticas individuais de cada paciente (26).
Segundo pesquisa realizada com 1.384 pacientes com CP, sendo 330 pacientes no Hospital Zhongnan da Universidade de Wuhan e 1.054 pacientes no Hospital Shijitan da Capital Universiy, a pontuação Karnofsky (KPS) que foi desenvolvida para acompanhar o declínio clínico dos pacientes oncológicos, conforme a figura 3, também deve ser considerada no pré-operatório com pontuação >80, para avaliar a capacidade curativa desse paciente ou capacidade de realizar suas atividades diárias e trabalhar sem muito esforço (27).
Figura 3 – Status de desempenho KPS.

Marcadores tumorais também são necessários, como por exemplo, o Ki67, associado à proliferação, onde o aumento de sua expressão demostra além da agressividade tumoral, pior sobrevida livre da doença e, neste caso, descarta a possibilidade da HIPEC (28).
Todos os pacientes selecionados passam por exames de imagem como tomografia e ressonância magnética do tórax, abdome e pelve a fim de avaliar metástases distantes, bem como tomografia por emissão de prótons para metástases nos pulmões, ósseas e nos linfonodos retroperitoneais, as quais são contraindicadas para a HIPEC, mas em caso de dúvidas, a laparoscopia é uma alternativa para melhor avaliação abdominal (29).
4.3. Cirurgia citorredutora e HIPEC
A técnica HIPEC representa uma abordagem distinta, atualmente direcionada a grupos de pacientes que enfrentam neoplasias peritoneais disseminadas, tais como o carcinoma mucinoso de apêndice com disseminação peritoneal, pseudomixoma peritoneal e mesotelioma peritoneal. A administração de quimioterápicos no peritônio é realizada após uma cirurgia citorredutora, uma vez que a citorredução, por si só, já reduz a presença de células neoplásicas na região peritoneal. A terapia hipertérmica, por outro lado, exibe potencial citotóxico, intensificando a permeabilidade dos agentes quimioterápicos nas células neoplásicas, incrementando, assim, a citotoxicidade em determinadas células. De acordo com os dados fornecidos pela CONITEC, observou-se uma redução significativa no risco de óbito no grupo de pacientes submetidos à citorredução seguida da HIPEC. Entretanto, vale ressaltar que ainda persistem numerosos estudos em fase de desenvolvimento e uma ampla gama de dados a serem analisados. A associação dessas duas técnicas se mostra promissora, sobretudo em contexto de neoplasias peritoneais, embora pesquisas relacionadas à eficácia da técnica em tumores de outras localizações permaneçam em estágios iniciais e demandem investigação adicional para consolidação de resultados (30).
A CRS representa uma intervenção eficaz no tratamento das metástases oriundas de diversas neoplasias. Sua finalidade primordial é a extirpação completa dos focos tumorais macroscópicos, mas também visa à ressecção de vísceras acometidas por estes. Frequentemente é associada à HIPEC, na qual a CRS realiza a remoção dos nódulos macroscópicos, enquanto a quimioterapia intraperitoneal é empregada para tratar lesões microscópicas (31).
O cerne do procedimento de CRS envolve a ressecção do peritônio, uma membrana que reveste a cavidade abdominal e o assoalho pélvico. O peritônio, órgão anatomicamente complexo, pode servir como um potencial local de disseminação metastática. Em raras circunstâncias, um tumor primário surge no peritônio, sendo mais comum que neoplasias originadas em outras localizações, como o câncer colorretal que se espalhem para o peritônio. O procedimento de CRS tem início com uma incisão na linha média que se estende desde o processo xifoide até o púbis. A introdução de um afastador, comumente denominado de afastador de Thompson, facilita a exposição da cavidade abdominal e permite o início da ressecção dos órgãos e regiões do peritônio afetados. A ressecção é realizada utilizando métodos eletrocirúrgicos, como eletrocautério, tesoura bipolar ou bisturi ultrassônico, possibilitando assim o controle de sangramento e a destruição do tecido tumoral (32).
Após a ressecção, é aplicado um sistema de avaliação denominado índice de redução (IC), que quantifica a eficácia da citorredução com base no tamanho dos nódulos remanescentes.CC-0 significa ausência de doença residual, CC-1 denota nódulos tumorais com diâmetro inferior a 2,5mm, considerados passíveis de penetração pela HIPEC, enquanto CC-2 e CC-3 representam citorreduções incompletas. A conclusão bem-sucedida da citorredução, avaliada pelo score CC como CC-1, dá-se início à HIPEC, que será realizada enquanto o paciente permanece sob anestesia geral e pode ser conduzida em abordagens aberta ou fechada, a critério do cirurgião. Ambas as modalidades permitem a administração direta da quimioterapia no local afetado, com o propósito de erradicar células tumorais livres e, consequentemente, prevenir a recidiva local (33).
Atualmente existem duas formas de realização da HIPEC, a técnica aberta (Figura 4) e a fechada. Para a técnica aberta, depois da CRS colocam-se dois cateteres de entrada e três de saída na parede abdominal para infusão do quimioterápico, o abdômen é coberto por um plástico específico para o procedimento para que a equipe cirúrgica não seja exposta ao quimioterápico por aerossóis (Figura 5). Normalmente os kits utilizados para a realização do procedimento são compostos por material polimérico e atóxico, resistente a pressão, ao impacto, às variações de temperatura e à ação de agentes químicos e biológicos. Realizado esse processo, o quimioterápico é aquecido para atingir de 41° a 43°C e a perfusão dura de 30 a 90 minutos dependendo do fármaco utilizado (34).
Figura 4 – Representação da técnica aberta na HIPEC.
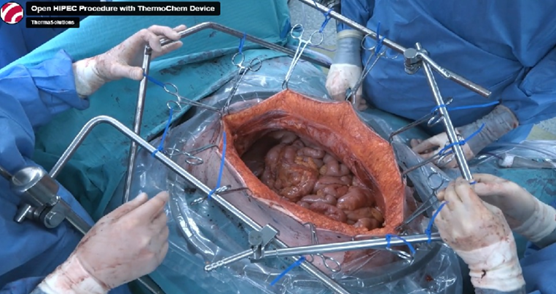
Figura 5 – Representação da técnica aberta na HIPEC.

Na técnica fechada (Figura 6), após a CRS, utiliza-se um a dois cateteres para entrada e um para saída na parede abdominal, o abdômen é fechado por uma sutura temporária e a quimioterapia passa em um fluxo de 1,5L/min por 30 a 90 mi.
Figura 6 – Representação da técnica fechada na HIPEC.
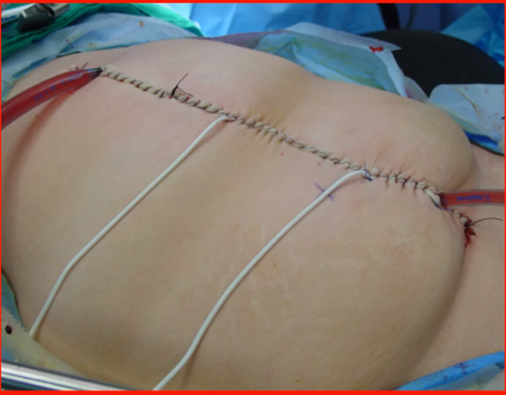
Para o uso da HIPEC é necessário que se tenha disponível um pertuso que realiza o aquecimento da solução quimioterápica e faz a circulação para dentro e fora da cavidade abdominal. O processo de aquecimento do quimioterápico produz efeito citotóxico em até 180% e aumenta sua permeabilidade, como o uso da quimioterapia é loco regional, possibilita o uso de alta concentração sem efeito tóxico sistêmico (35).
4.4. Mecanismos moleculares
O entendimento no desenvolvimento dos tumores é considerado complexo, pois, abrange inúmeros fatores pró-neoplásicos que no decorrer da vida tendem a favorecer o surgimento dessa doença e sua dissipação. (36).
A replicação celular é composta por etapas as quais acontecem eventos moleculares importantes que darão origem as células-filhas com igual quantidade de material genético, dessa forma, durante este processo fatores intrínsecos (fatores genéticos) e fatores extrínsecos (radiação, luz ionizante, aflatoxina, amianto, tabaco, arsênio e infecções por alguns tipos específicos de vírus e bactérias) poderão predispor a unidade funcional do organismo a algum erro e acarretar desordens futuras, inclusive, células neoplásicas. Com isso, chamamos de proto-oncogene (PO) os genes que possuem a capacidade de regular positivamente a divisão celular, entretanto, quando ocorrem mutações e essas os atingem, eles serão denominados como oncogêneses, pois, agora atuarão negativamente estimulando o crescimento desordenado das células e a divisão antes mesmo de se diferenciarem e alcançarem o seu tamanho normal (37).
Os genes supressores de tumor (ST) atuam restringindo a proliferação celular, ou seja, executando a função oposta dos proto-oncogenes; e com essa ação contrária ocorre uma contrabalança de maneira efetiva na hiperatividade dos PO’s. Considerado o ‘’guardião do genoma’’, o gene p53 possui função supressora e tem sua ação ativada como resposta ao dano celular provocado, sabe-se que o seu fator de transcrição possui a capacidade de interagir com pelo menos outros seis genes, por exemplo, ligar-se ao gene p21 com a finalidade de parar o ciclo celular na fase G1 antes que ocorra a duplicação do DNA na fase S do ciclo celular e, assim, permitir o reparo do DNA danificado antes de sua replicação. Outra finalidade que observamos é atuação da p53 ao estímulo da apoptose (morte celular programada) quando a célula sofre danos que não são reparados e em que a via pRb não esteja devidamente intacta, dessa forma, as células com danos no DNA não serão reparadas e poderão apresentar transformação anormal, podendo iniciar um clone maligno (38, 39).
É interessante mencionarmos que algumas substâncias carcinogêneas podem gerar mutações na p53. Como exemplo, a ingestão dietética da aflatoxina (microtoxina produzida por espécies de fungos do gênero Aspergillus), a exposição ao benzopireno que é potencialmente mutagênico e carcinogênico e é encontrado no cigarro e que produz mutações em três códons do gene, e com isso, relacionando-se ao surgimento do câncer de pulmão (40).
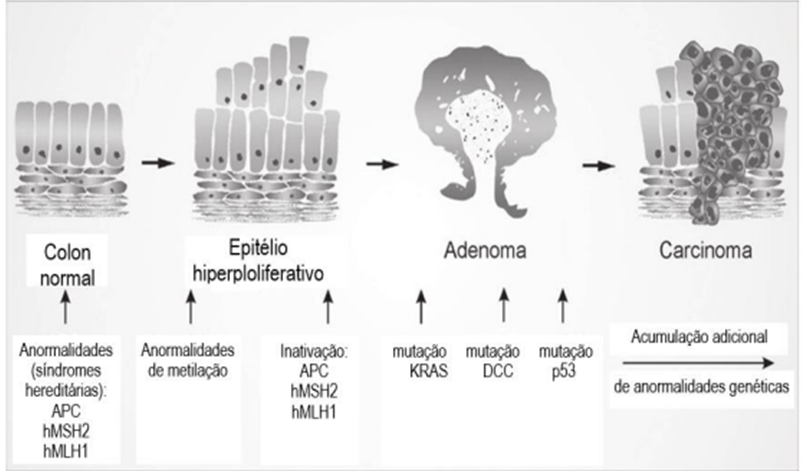
Embora, tenhamos direcionado luz as possíveis mutações na p53, outros genes poderão sofrer ação mutagênica e desencadear processos neoplásicos, como por exemplo, o proto-oncogene Hst1 que sintetiza o fator de crescimento do fibroblasto (FGF) e em que sua mutação está associada com câncer de estômago, o Erb2 e Erb3 que ambos sintetizam receptores para o fator de crescimento epidérmico e estão associados ao câncer de mama, o gene Abl que é transdutor de sinal e devido a um erro de translocação poderá originar a Leucemia Mieloide Crônica (LMC) ou a Leucemia Linfoblástica Aguda (LLA), a Ras/Kras direcionam para o desenvolvimento de câncer de origem colorretal (figura 7) que atualmente é o terceiro na prevalência mundial e apresentando pior prognóstico quanto mais precoce for o seu desenvolvimento (41).
Figura 7 – Sequência adenocarcinoma: Correlação no desenvolvimento do câncer colorretal (CCR) em suas áreas epiteliais e suas respectivas mutações relacionadas – APC, p53 e KRAS.
Durante o processo de carcinogênese ocorrem estágios que visam atingir o desenvolvimento tumoral, dessa forma, a proliferação de células segue de maneira lenta e gradual para atingir o seu propósito. As etapas ocorrem da seguinte maneira: o estágio de iniciação no qual as células sofrerem o efeito de algum agente carcinogênico que provoca alterações de seus genes, portanto, neste momento a célula já está alterada, mas não sendo possível detectar clinicamente o tumor por estar em fase inicial de seu desenvolvimento. No estágio de promoção, a célula mutada permanece sendo atingida pelo agente carcinogênico e segue acumulando alterações genéticas e transformando-se em célula maligna. O último, mas não menos importante é o estágio de progressão, nesta fase o câncer encontra-se instalado e multiplicando-se de maneira desenfreada e evoluindo até as primeiras manifestações clínicas. Por esta razão que as células tumorais possuem alto metabolismo e precisam de concentrações elevadas de Adenosina-Trifosfato (ATP) para continuarem se multiplicando e permanecerem a frente com um ganho proliferativo em relação às células normais, com isso, essas células apresentam grande dependência do metabolismo glicolítico, sendo esta, uma via de rápida obtenção energética de metabólitos que possuem a capacidade de suportar altas taxas de crescimento e proliferação apresentadas pelo tumor (42).
Há algumas décadas observou-se que os tumores apresentam uma vascularização robusta e funcional, no primeiro momento não se atrelou ao fato ds ser uma possível vantagem do tumor em relação aos tecidos não neoplásicos, entretanto, hoje com estudos bem definidos e projetos esquemáticos que explicam o estímulo tumoral à angiogênese, pode-se dizer que a vascularização nos tumores entrega a eles uma condição essencial para o seu desenvolvimento. Sendo assim, concluímos que a angiogênese tumoral (figura 8) é o resultado da liberação local de fatores pró-angiogênicos pelo tumor, sendo eles: o fator de crescimento fibroblástico báscio (bFGF), a ciclo-oxigenase-2 (COX-2) e o fator de crescimento endotelial vascular (VEGF).
Figura 8 – Represenção da angiogênese após estímulos tumorais.

No campo da malignidade, têm ocorrido fortes associações da angiogênese no processo de síntese e desenvolvimento de metástases. Estudos experimentais têm demonstrado que a formação de metástases oriundas de tumores primários tem baixa frequência quando ocorre antes do desenvolvimento da neovascularização, por outro lado, as metástases após a formação de novos vasos apresentam-se com maior frequência, tendo estes novos vasos como agentes facilitadores para a migração de células neoplásicas por meio da corrente sanguínea (43, 44).
A CP, conforme já descrita na introdução deste trabalho, é oriunda de um tumor primário e clinicamente é considerada um ponto intermediário entre a fase em que a doença se encontra ainda localizada e a sua disseminação total no organismo, o que justifica essa classificação é o fato da CP ser constituída por implantes peritoneais de células neoplásicas. A distribuição transparietal das células tumorais é definida como a redistribuição neoplásica, pois estas células partem do órgão de origem através do peritônio visceral e migram para a cavidade peritoneal, entretanto, não é considerado um processo de disseminação aleatório, mas sim, conduzido por fatores físicos, por exemplo, as características do tumor primário, do efeito da gravidade, do peristaltismo dos órgãos digestivos e da presença ou ausência da ascite maligna (figura 9) (45).
Figura 9 – Representação das rotas para a formação das metástases peritoneais.

A disseminação de células cancerígenas do tumor primário para a cavidade peritoneal poderá ocorrer de diferentes maneiras, conforme a figura 12. Em que (1) ocorre a disseminação direta do tumor inicial para o peritônio, (2) através do sistema linfático, (3) através do sistema hematogênico e (4) nova propagação de lesões PM existentes.
A capacidade de adesão das células cancerígenas ao peritônio é algo fundamental para a efetivação do processo metastático, uma vez que, para que ocorra esta adesão é imprescindível a presença de proteínas reguladoras. Os glicosaminoglicanos, como exemplo, o ácido hialurônico nas células mesoteliais, desempenha um papel necessário no processo de adesão, porque este se liga ao CD44 nas células tumorais favorecendo a sua adesão e migração (46). Além disso, as integrinas nas células tumorais ligam-se as moléculas de adesão mesotelial (ICAM1, VCAM1) e a outros fatores presente na matriz extracelular, incluindo, a fibronectina, laminina e colágenos, mas em especial as subunidades das integrinas β1 que são importantes na fixação peritoneal. É somente entendendo este mecanismo proliferativo e os componentes que executam um papel primordial, que será capaz definir terapias em que o foco seja atuação no processo de adesão a fim de delimitar esta progressão e minimizar a dispersão de células mutadas (47).
A hipertermia empregada na HIPEC potencializa a citotoxicidade dos quimioterápicos utilizados na técnica e, como resultado propiciam o aumento da morte celular de tumores microscópicos remanescentes após a citorredução (48). Em estudos recentes, foi mimetizado a HIPEC em ambiente in vitro a fim de analisar o comportamento molecular de oito diferentes linhagens de células de câncer colorretal em humanos, cada célula com a sua especificidade e potencial para tornar-se metastática em algum outro local, sendo assim, foram expostos aos seguintes medicamentos quimioterápicos: cisplatina, carboplatina, oxaliplatina, mitomicina-c (MMC) ou 5-fluorouracil (5-FU) e considerando temperaturas relevantes de 38º – 43º por 60 min. Esta exposição permitiu concluir que a ação hipertérmica em que a solução é infundida, favorece a captação de medicamentos a base de platina, essa absorção resultou na parada da fase G2 do ciclo celular, aumentos dos níveis apoptóticos e diminuição do crescimento celular, já o MMC, sendo este o medicamento predominantemente utilizado apresentaram dados iguais aos medicamentos a base de platina (figura 10), porém, neste caso observou que o MMC não é sinérgico com o calor nas células colorretais (CRC) (49, 50).
Figura 10 – Representação gráfica dos medicamentos a base de platina versus a mitomicina-c.

4.5. Limitações e complicações da quimioterapia convencional
A abordagem terapêutica atual possui variações, pois depende do estágio em que a doença se encontra, em especial, para as metástases peritoneais permanece sendo a ressecção cirúrgica (RC) dos focos neoplásicos e do câncer primário. A RC do câncer primário invasivo do cólon tem como objetivo a erradicação completa do tumor, incluindo a remoção dos principais pedículos vasculares e da bacia de drenagem linfática do segmento afetado com a finalidade de minimizar o potencial para a dissipação dessas células tumorais. Ademais, a quimioterapia é empregada como terapia adjuvante, dado que se observaram resultados significativos quando associada à RC (51).
O tratamento quimioterápico envolve condições importantes para ser iniciado, entre essas condições necessárias é considerado o tipo de tumor, qual o tipo celular que a compõe, se o tumor possui ou não receptores hormonais e as condições clínicas do paciente; isso tudo para que seja possível propor um tratamento efetivo e favorável ao indivíduo com esta doença, claro que com o passar dos anos novos estudos foram sendo realizados e novas associações foram sendo testadas. Por exemplo, a utilização do 5-fluorouracil (5-FU) foi empregado por mais de quatro décadas como terapia-padrão para o adenocarcinoma colorretal; e que inicialmente era o melhor dentro das possibilidades existentes, porém, os estudos foram avançando e associações de medicamentos quimioterápicos foram surgindo, a primeira originou-se no final dos anos 90 ocorrendo a associação do 5-FU com o Irinotecano, já neste primeiro momento foi possível observar uma melhora considerável na sobrevida (SV) dos pacientes (52).
A fim de melhorar a performance do quimioterápico a Indústria Farmacêutica uniu recursos e esforços juntamente com os avanços no entendimento da biologia celular e molecular, para desenvolverem o que chamamos de anticorpos monoclonais (AM), que são imunoproteínas capazes de reconhecer e ligar-se aos antígenos tumorais específicos (alvos) e proporcionarem uma resposta imunológica mais controlada, protegendo as células saudáveis e minimizando os efeitos tóxicos que a terapia convencional traz; como exemplo de AM’s temos o Cetuximabe, sendo um antagonista competitivo para o receptor do fator de crescimento epidérmico (EGFR), que por meio desta interação ocorre a regulação do crescimento e da proliferação celular, é considerado o segundo AM na linha de tratamento para o câncer colorretal metastático; outro AM empregado nesse caso é o Bevacizumabe (BV), que atua seletivamente no fator de crescimento endotelial vascular (VEGF) impedindo que se ligue ao receptor do fator de crescimento endotelial vascular (VEGFR) e que estimule a angiogênese tumoral, dessa forma, reduz a permeabilidade endotelial que é uma importante etapa para o crescimento, propagação e metástase do tumor; com isso o BV é considerado o primeiro na linha de tratamento do câncer colorretal metastático, além de apresentar uma melhora na SV quando comparado a outros diferentes protocolos utilizados na clínica (53, 54).
Embora os medicamentos quimioterápicos de uso sistêmico tenham indiscutivelmente sua eficácia reconhecida, eles também podem trazer com a sua efetividade uma maior taxa de toxicidade ao uso e efeitos adversos não muito agradáveis como náuseas, vômitos, diarreia precoce, dores abdominais, anorexia e mucosite oral. Dentre as limitações existentes desta terapia além dos efeitos adversos relatados, outro ponto a considerar é a barreira de inserção desses medicamentos antineoplásicos no Brasil, pois, comercialização e produção no país ficam limitadas uma vez que grandes indústrias detém a patente do produto, deixando-o com valores exorbitantes e dificultando a inserção no mercado nacional (55).
4.6. Limitações e complicações da HIPEC
A combinação da CRS e HIPEC tem conquistado crescente reconhecimento e interesse devido à sua eficácia clínica. No entanto, devido à natureza de grande porte desse procedimento, é fundamental reconhecer a ocorrência de grandes alterações fisiológicas cardiovasculares, renais, respiratórias e de coagulação no paciente durante a intervenção. Além disso, a possibilidade de insuficiência orgânica deve ser monitorada atentamente, exigindo uma abordagem proativa para resolução imediata. Os relatos clínicos têm documentado consideráveis perdas sanguíneas associadas à hipotermia durante essas cirurgias, muitas vezes requerendo transfusões sanguíneas para mitigar o risco de choque hipovolêmico e problemas de coagulação. Assim, a realização de exames laboratoriais no ambiente cirúrgico, transfusões e a manutenção de uma temperatura corporal adequada tornam-se medidas cruciais na gestão desses riscos (56).
É importante destacar que os quimioterápicos utilizados no procedimento podem causar danos e devem ser devidamente estudados e monitorados. A Cisplatina é uma droga antineoplásica que pode gerar uma lesão renal em até 20% dos pacientes e 66% caso sejam idosos devido a sua alta toxicidade, pois podem causar danos às células quiescentes do túbulo proximal renal. A Cisplatina é uma molécula neutra e tem baixo peso molecular onde é filtrada no glomérulo e excretada pela urina e neste caso a droga entra em altas concentrações nas células tubulares proximais do córtex renal e camada medular externa, especialmente no segmento S3 que é mais afetado. Ela entra nas células tubulares proximais por difusão passiva ou facilitada pelo transportador catiônico orgânico (OCT) na fase basolateral sendo o OCT2 o principal no que se refere ao acúmulo da droga no rim. Também diminui a absorção de cálcio na mitocôndria podendo levar as células tubulares renais a apoptose. Desta forma, ela causa uma toxicidade codependente limitando o aumento da dose a qual pode prejudicar o tratamento (57).
A Mitomicina C está associada à mielotoxicidade resultando em uma depressão medular, podendo ocorrer leucopenia, trombocitopenia, síndrome hemolítica urêmica, as quais podem acarretar desde septicemia até uma insuficiência renal irreversível. Portanto, não pode ser administrado caso o paciente apresente a taxa de creatinina sérica superior a 1,7 mg/dl (150 Ámol/l) ou quando o número de Plaquetas esteja inferior a 100.000/mm3 e o de Leucócitos for inferior a 4.000/mm3 segundo consta na bula desde fármaco (58).
O 5-fluorouracil (5FU) juntamente com a MMC e oxaliplatina (OHP) logo após CR e HIPEC em estudo in vitro se mostrou promissor em pacientes com alto risco de metástase peritoneal colorretal, embora este estudo em 2014 ainda estivesse na fase I, atualmente não foi encontrada na literatura sua conclusão em fase clínica (59).
A CR e a HIPEC, dada sua alta complexidade, podem resultar em íleo pós-operatório, uma ocorrência comum em procedimentos abdominais. Isso se deve ao estímulo nociceptivo desencadeado pela abertura da parede abdominal, que ativa o sistema simpático, desencadeando mecanismos neuroimunes, fatores farmacológicos e alterações eletrolíticas. O período pós-operatório é de extrema importância para a recuperação do paciente, portanto, a admissão do mesmo em uma unidade de terapia intensiva (UTI) é aconselhável, possibilitando monitoramento contínuo das alterações fisiológicas e a pronta intervenção em caso de complicações. No entanto, apesar da complexidade intrínseca a esse tratamento, é relevante destacar que a taxa de mortalidade resultante de complicações é relativamente baixa, em torno de 3% (60).
4.7. Resultados clínicos e eficácia da HIPEC
Na maioria dos estudos com pacientes CP de origem colorretal, estes pacientes já haviam passado por algum processo cirúrgico anterior e submetidos à Laparotomia ou Laparoscopia previamente.
No Hospital Felício Rocho em Belo Horizonte, foi realizado um estudo por mais de uma década se encerrando em 2020 com 56 pacientes. Tinha a idade média de 51,1 anos, duração média da cirurgia de 7,9 horas de 1 a 16 com oito dias de internação e todos com CP e já realizado cirurgia CC0 com CPI 15. A taxa de complicações foi acima de 60% e mortalidade 3,8%, verificando-se que quanto maior o tempo de cirurgia, maior eram suas complicações, tendo como principais: sepses, infecções urinárias, infecção das feridas operatórias, pneumotórax, síndrome de resposta inflamatória sistêmica (SIRS) e óbito. A SG desses pacientes foi de 77% em 12 meses, 72% em 24 meses e 57% no período de cinco anos. Também foi observado que as complicações maiores ocorreram nos pacientes que foi utilizado o quimioterápico MMC em comparação aos pacientes que utilizou o fármaco Oxaliplatina (61).
A taxa de sobrevida desses pacientes em 60 meses foi diferente de acordo com o tipo de droga utilizado (figura 11), onde os pacientes com câncer colorretal tratados com Oxaliplatina tiveram uma sobrevida maior (73%) em relação aos tratados com MMC (55%) (62).
Figura 11 – Sobrevida global dos pacientes de acordo com a droga implementada.
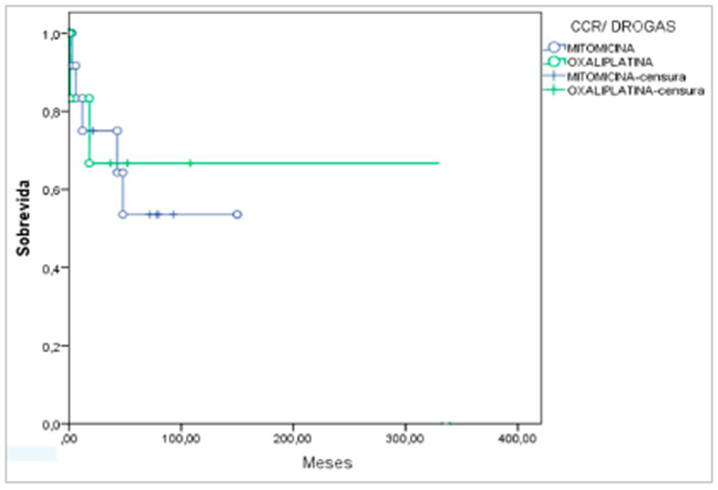
Estudos realizados na Dinamarca no departamento de cirurgia do hospital universitário de Aarhus mostraram que a HIPEC associada à cirurgia curativa do câncer colorretal melhora a sobrevida em pacientes de alto risco para recorrência de carcinomatose peritoneal secundária. Durante 94 meses dois estudos foram realizados, onde no primeiro, foi analisada a eficácia do tratamento em pacientes que receberam a HIPEC fechada mais IV com os pacientes que receberam apenas a CRS e o segundo estudo, um grupo de pacientes recebeu a HIPEC aberta e outro grupo de pacientes recebeu a IPEC (quimioterapia intraperitoneal não aquecida) (62).
O primeiro estudo mostrou que no grupo HIPEC houve um aumento em 59,5 meses de sobrevida contra 52,9 meses para o grupo CRS, onde posteriormente obteve-se uma recidiva de 4% nos pacientes do grupo HIPEC contra 28% no grupo CRS, e no segundo estudo, 100% dos pacientes submetidos à HIPEC tiveram uma sobrevida de três anos contra 69% dos pacientes submetidos a IPC, mostrando assim que o uso da HIPEC na cirurgia primária pode melhorar o prognóstico de pacientes com câncer colorretal avançado (63).
Outro estudo realizado entre 2008 a 2014, multicêntrico, aberto, randomizado de fase III, com 265 pacientes na França em 17 centros de Câncer em pacientes com CP colorretal fazendo um comparativo entre a CRS + HIPEC aberta ou fechada com Oxaliplatina aplicando 20 minutos antes IV uma combinação de quimioterapia sistêmica com fluorouracil 400mg/m² e ácido folínico 20mg/m² e CRS isolada, observou-se que em relação à SG, a CRS isolada e bem realizada é fundamental na intenção de cura da carcinomatose peritoneal (63).
Mais um estudo na China realizado entre 2012 e 2019 com 78 pacientes também concluiu que a HIPEC e CRS tem maior eficácia na SG e sobrevida livre de recidiva nos casos da carcinomatose peritoneal colorretal (64).
No entanto, um artigo demonstra que a realização de um tratamento com probióticos combinando Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus plantarum, Lactobacillus rhamnosus, Bifidobacterium lactis, Bifidobacterium bifidum, Bifidobacterium breve, Streptococcus thermophilus para a regulação da flora intestinal, o que ajudou na recuperação pós-operatória bem como a diminuir as complicações inclusive fatalidade. Isso ocorre devido toda a manipulação intensa na parte intestinal, prejudicando a relação hospedeiro-microbiano com a expressão de virulência das bactérias causando as infecções e prejudicando o tratamento podendo levar a óbito. Portanto, com a administração de probióticos modificando a microbiota intestinal e alterando sua flora, ocorre uma competição às membranas das mucosas, fortalecendo as barreiras do epitélio intestinal e modulando o sistema imune beneficiando o hospedeiro, pois, impacta positivamente os metabólitos da fermentação bacteriana, reduzi o pH encurtando o tempo de trânsito intestinal e melhorando sua motilidade (65).
5. CONSIDERAÇÕES FINAIS
O estudo possibilitou observarmos que para a execução da HIPEC podem ocorrer alguns variações quanto ao método a ser aplicado no paciente; podendo este ser aberto ou fechado, quanto ao medicamento quimioterápico, pois, este poderá ser uma monoquimioterapia ou uma quimioterapia combinada (associação de medicamentos quimioterápicos); além da temperatura a ser adotada e o tempo de ação que podem variar de acordo com o profissional que irá executar a técnica. Apesar das controvérsias em decorrência da inexistência de um protocolo padrão e da dificuldade de estabelecê-lo, a CRS + HIPEC continua sendo uma alternativa considerável e uma opção que favorece o aumento na sobrevida dos pacientes com CP.
Desse modo, mesmo considerando que os medicamentos mais utilizados são o MMC, 5FU e o L-OHP, e que eles sejam aplicadas de maneira individual ou combinada, foi possível concluirmos que não houve estatisticamente diferenças significativas na SG dos pacientes e ou cura destes para que pudéssemos relatar nesta revisão, sendo assim, a fim de contribuirmos cientificamente ressaltamos que é de extrema importância a condução de mais estudos clínicos para que possa estudar a padronização quanto a aplicação da técnica e a busca por mais quimioterápicos compreendendo sua ação terapêutica.
REFERÊNCIAS
(1) Câncer – OPAS/OMS | Organização Pan-Americana da Saúde [Internet]. www.paho.org. Available from: https://www.paho.org/pt/topicos/cancer#:~:text=Outros%20termos%20utilizados%20s%C3%A3o%20tumores.
(2) Câncer – OPAS/OMS | Organização Pan-Americana da Saúde [Internet]. www.paho.org. [cited 2023 Nov 20]. Available from: https://www.paho.org/pt/topicos/cancer#:~:text=Plummer%20M%2C%20de%20Martel%20C%2C%20Vignat%20J%2C%20Ferlay%20J%2C%20Bray%20F%2C%20Franceschi%20S.%20Global%20burden%20of%20cancers%20attributable%20to%20infections%20in%202012%3A%20a%20synthetic%20analysis.%20Lancet%20Glob%20Health.%202016%20Sep%3B4.
(3) Estatísticas de câncer [Internet]. Instituto Nacional de Câncer – INCA. 2022. Available from: https://www.gov.br/inca/pt-br/assuntos/cancer/numeros.
(4) INCA – Instituto Nacional de Câncer José Alencar Gomes da Silva. Câncer de Cólon e Reto [Internet]. 2023 [Citado 2023 jan 30]: Dsponivel em https://www.gov.br
(5) Câncer colônico – epidemiologia, diagnóstico, estadiamento e gradação tumoral de 490 pacientes [internet]. sbcp.org.br. [cited 2023 sep 23]. available from: https://sbcp.org.br/revista/nbr272/p139_153.htm.
(6) Câncer colorretal: principais complicações e a importância do diagnóstico precoce | Revista Eletrônica Acervo Saúde. acervomaiscombr [Internet]. 2021 Apr 11; Available from: https://acervomais.com.br/index.php/saude/article/view/6888/4402
(7) Mendoza-Moreno F, Diez-Alonso M, Belén Matías-García, Ovejero-Merino E, Gómez-Sanz R, Blázquez-Martín A, et al. Prognostic Factors of Survival in Patients with Peritoneal Metastasis from Colorectal Cancer. Journal of clinical medicine [Internet]. 2022 Aug 22 [cited 2024 May 5];11(16):4922–2. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9410473/
(8) Holtzman MP, Becker JM. Peritoneal Carcinomatosis. Current surgery. 2005 May 1;62(3):289–94.
(9) Peritoneal carcinomatosis of colorectal origin: incidence and current treatment strategies. Annals of Surgery [Internet]. 2006 Feb 1 [cited 2022 Feb 9];243(2):212–22. Available from: https://pubmed.ncbi.nlm.nih.gov/16432354/
(10) McMullen JRW, Selleck M, Wall NR, Senthil M. Peritoneal carcinomatosis: limits of diagnosis and the case for liquid biopsy. Oncotarget [Internet]. 2017 Mar 22;8(26):43481–90. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5522163/
(11) Aoyagi T. Current treatment options for colon cancer peritoneal carcinomatosis. World Journal of Gastroenterology. 2014;20(35):12493.
(12) Vaira M, Cioppa T, D’amico S, Marco GD, D’alessandro M, Fiorentini G, et al. Treatment of Peritoneal Carcinomatosis from Colonic Cancer by Cytoreduction, Peritonectomy and Hyperthermic Intraperitoneal Chemotherapy (HIPEC). Experience of Ten Years. In Vivo [Internet]. 2010 Jan 1 [cited 2024 Mar 30];24(1):79–84. Available from: https://iv.iiarjournals.org/content/24/1/79.long
(13) Ray MD, Dhall K. Hyperthermic Intraperitoneal Chemotherapy (HIPEC) in the management of peritoneal surface malignancies – An evidence-based review. Current Problems in Cancer. 2021 Dec;45(6):100737.
(14) Aoyagi T. Current treatment options for colon cancer peritoneal carcinomatosis. World Journal of Gastroenterology. 2014;20(35):12493.
(15) Manoğlu B, Yavuzşen T, Aktaş S, Altun Z, Yılmaz O, Gökbayrak ÖE, Erol A. Investigation of the effectiveness of hyperthermic intraperitoneal chemotherapy in experimental colorectal peritoneal metastasis model. Pleura Peritoneum. 2023 May 10;8(3):123-131.
(16) hipecbrasil.com.tratamento-hipec-no-brasil.[Internet]. 2018-2023. Disponível em https://hipecbrasil.com/.
(17) Cordeiro PJD, Muzi CD. Cirurgia Citorredutora com Quimioterapia Intraperitoneal Hipertérmica em Pacientes com Adenocarcinoma Mucinoso de Apêndice: Série de 43 Casos. Revista Brasileira de Cancerologia. 2022 Mar 24;68(1)
(18) https://www.gov.br/conitec/pt-br/midias/consultas/relatorios/2019/relatorio_hipec_pseudomixioma_cp_81_2019_.pdf
(19) Câncer de cólon e reto — Instituto Nacional de Câncer – INCA [Internet]. www.gov.br. Available from: https://www.gov.br/inca/pt-br/assuntos/cancer/numeros/estimativa/sintese-de-resultados-e comentarios/cancer-de-colon-e reto#:~:text=Entre%20os%20homens%2C%20ocorreram%20cerca.
(20) Ministério da Saúde Instituto Nacional de Câncer José Alencar Gomes da Silva Ministério da Saúde Instituto Nacional de Câncer [Internet]. Available from: https://www.inca.gov.br/sites/ufu.sti.inca.local/files/media/document/estimativa-2023.pdf.
(21) American Cancer Society. What Is Colorectal Cancer? | How Does Colorectal Cancer Start? [Internet]. www.cancer.org. 2020. Available from: https://www.cancer.org/cancer/types/colon-rectal-cancer/about/what-is-colorectal-cancer.html.
(22) Metástase: entenda por que um câncer se espalha [Internet]. Ministério da Saúde. Available from: https://www.gov.br/saude/pt-br/assuntos/noticias/2022/outubro/metastase-entenda-por-que-um-cancer-se-espalha.
(23) Mestrado Integrado em Medicina Área: Cirurgia Geral [Internet]. [cited 2024 Mar 30]. Available from: https://repositorio-aberto.up.pt/bitstream/10216/72423/2/29265.pdf
(24) S. Astudillo, F. Lopes, Filho A.L., Breno P., paiva R. A., et al. Avaliação da morbimortalidade e da sobrevida em pacientes portadores de carcinomatose peritoneal submetidos a cirurgia citorretorredutora e quimioterapia hipertérmica intraperitoneal (HIPEC). 2023 Jan 1;50.
(25) Ray MD, Dhall K. Hyperthermic Intraperitoneal Chemotherapy (HIPEC) in the management of peritoneal surface malignancies – An evidence-based review. Current Problems in Cancer. 2021 Dec;45(6):100737.
(26) HIPEC | Carcinomatose Peritoneal [Internet]. Carcinomatose. [cited 2023 Oct 12]. Available from: https://www.cancerdoperitonio.com.br/hipec.
(27) Informações para pacientes [Internet]. Hipec Brasil. [cited 2023 Oct 12]. Available from: https://hipecbrasil.com/informacoes-para-pacientes/
(28) Yu Y, Li XB, Lin YL, Ma R, Ji Z, Zhang YB, et al. [Efficacy of 1 384 cases of peritoneal carcinomatosis underwent cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy]. PubMed. 2021 Mar 25;
(29) Campos JAMF de, Cuenca RM, Schorn PW, Ibiapina AG, Japiassu GAB, Lima OAT, et al. Expressão citofotométrica dos marcadores tumorais Ki-67 e CD34 no adenocarcinoma de estômago. ABCD Arquivos Brasileiros de Cirurgia Digestiva (São Paulo) [Internet]. 2007 Sep 1 [cited 2024 Mar 30];20:179–83. Available from: https://www.scielo.br/j/abcd/a/ztgvzLxsv7BPGfNB6XVTGSB/#:~:text=O%20marcad
(30) Carcinomatose Peritoneal: A Quantidade De Doença Faz Diferença? Entenda O Que É O PCI? [Internet]. Dr. Artur Reis. 2020. Available from: https://drarturreis.com.br/carcinomatose-peritoneal-a-quantidade-de-doenca-faz-diferenca-entenda-o-que-e-o-pci/.
(31) https://www.gov.br/conitec/ptbr/midias/consultas/relatorios/2019/relatorio_hipec_pseudomixioma_cp_81_2019_.pdf
(32) A cirurgia citorredutora no tratamento da carcinomatose peritoneal [Internet]. Dr. Rodrigo Gomes. 2020 [cited 2024 Mar 30]. Available from: https://rodrigogomesonline.com.br/a-cirurgia-citorredutora-no-tratamento-da-carcinomatose-peritoneal/
(33) HIPEC no tratamento da carcinomatose peritoneal | Hospital da Luz [Internet]. www.hospitaldaluz.pt. Available from: https://www.hospitaldaluz.pt/pt/dicionario-de-saude/hipec-tratamento-carcinomatose-peritoneal.
(34) Mehta SS, Bhatt A, Glehen O. Cytoreductive Surgery and Peritonectomy Procedures. Indian Journal of Surgical Oncology. 2016 Feb 3;7(2):139–51.
(35) Kearsley D, Egan D, Mccaul C, Por E, Dra, Jackson A, et al. Available from: https://www.sbahq.org/wp-content/uploads/2018/07/379_portugues.pdf
(36) Câncer – OPAS/OMS | Organização Pan-Americana da Saúde [Internet]. www.paho.org. 2020. Available from: https://www.paho.org/pt/topicos/cancer.
(37) Lengauer C, Kinzler KW, Vogelstein B. Genetic instability in colorectal cancers. Nature. 1997 Apr;386(6625):623–7.
(38) Weinert T. DNA Damage and Checkpoint Pathways. Cell. 1998 Sep;94(5):555–8.
(39) Nakamura S, Gomyo Y, Roth JA, Mukhopadhyay T. C-terminus of p53 is required for G 2 arrest. Oncogene [Internet]. 2002 Mar 1 [cited 2021 May 8];21(13):2102–7. Available from: https://www.nature.com/articles/120525.
(40) Nussbaum. Thompson & Thompson Genetics In Medicine (7ª edição). 2007.
(41) Lopes A, Oliveira A, Prado C. REVISTA DE BIOLOGIA E CIÊNCIAS DA TERRA Principais genes que participam da formação de tumores [Internet]. Available from: https://www.biologia.bio.br/curso/2%C2%BA%20per%C3%ADodo%20Faciplac/Biologia%20Celular/Artigo%20Principais%20genes.
(42) Almeida VL de, Leitão A, Reina L del CB, Montanari CA, Donnici CL, Lopes MTP. Câncer e agentes antineoplásicos ciclo-celular específicos e ciclo-celular não específicos que interagem com o DNA: uma introdução. Química Nova [Internet]. 2005 Feb 1;28:118–29. Available from: https://www.scielo.br/j/qn/a/9wKB9z7fFmnVTZtGYbzhj5F/?lang=pt.
(43) Amorim MO, Vieira MM, Gonçalves IV, Rhana P, Rodrigues ALP. Breast Cancer: tumoral metabolism reprogramming. Revista Médica de Minas Gerais. 2018;28.
(44) ANGIOGINESE: O Gatilho Proliferativo [Internet]. sbcp.org.br. [cited 2023 Oct 21]. Available from: https://sbcp.org.br/revista/nbr254/P396_402.htm.
(45) Roviello F, Caruso S, Marrelli D, Pedrazzani C, Neri A, De Stefano A, et al. Treatment of peritoneal carcinomatosis with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy: State of the art and future developments. Surgical Oncology. 2011 Mar;20(1):e38–54.
(46) Harada N, Mizoi T, Kinouchi M, Hoshi K, Ishii S, Shiiba K, et al. Introduction of antisense CD44s cDNA down-regulates expression of overall CD44 isoforms and inhibits tumor growth and metastasis in highly metastatic colon carcinoma cells. International Journal of Cancer. 2000;91(1):67–75.
(47) Sluiter N, de Cuba E, Kwakman R, Kazemier G, Meijer G, te Velde EA. Adhesion mlecules in peritoneal dissemination: function, prognostic relevance and therapeutic options. Clinical & Experimental Metastasis. 2016 Apr 13;33(5):401–16.
(48) Cordeiro PJD, Muzi CD. Cirurgia Citorredutora com Quimioterapia Intraperitoneal Hipertérmica em Pacientes com Adenocarcinoma Mucinoso de Apêndice: Série de 43 Casos. Revista Brasileira de Cancerologia. 2022 Mar 24;68(1).
(49) Hildebrandt B, Wust P, Ahlers O, Dieing A, Sreenivasa G, Kerner T, et al. The cellular and molecular basis of hyperthermia. Critical Reviews in Oncology/Hematology [Internet]. 2002 Jul 1;43(1):33–56. Available from: https://www.ncbi.nlm.nih.gov/pubmed/12098606.
(50) Helderman RFCPA, Löke DR, Verhoeff J, Rodermond HM, van Bochove GGW, Boon M, et al. The Temperature-Dependent Effectiveness of Platinum-Based Drugs Mitomycin-C and 5-FU during Hyperthermic Intraperitoneal Chemotherapy (HIPEC) in Colorectal Cancer Cell Lines. Cells [Internet]. 2020 Aug 1 [cited 2023 Apr 15];9(8):1775. Available from: https://www.mdpi.com/2073-4409/9/8/1775.
(51) Vallejo jsa, queiroz fld, lacerda filho a, frança neto pr, costa bxmd, paiva ra, et al.. assessing morbidity, mortality, and survival in patients with peritoneal carcinomatosis undergoing cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. Rev Col Bras Cir. 2023;50:e20233421. Available from: https://doi.org/10.1590/0100-6991e-20233421-en
(52) Gerais M, Maria V, Colobó J, Cavaliere Batista M. Brazilian Journal of Development Estudo comparativo entre protocolos de ressecção e tratamento quimioterápico no câncer colorretal Comparative study between resection protocols and chemotherapy treatment in colorectal cancer Vinícius dos Santos Sá Rodrigues Graduado em Medicina pela Pontifícia Universidade Católica de Minas Gerais (PUC MG) Residente do 1° ano de Cirurgia Geral do Hospital da Polícia Militar de. Brazilian Journal of Development [Internet]. 2021 [cited 2023 Oct 13];(7):66265–84. Available from: https://ojs.brazilianjournals.com.br/ojs/index.php/BRJD/article/download/32399/pdf/82815.
(53) Vasconcelos E, São, Para Correspondência E, Lenita, Tonon M, Rua, et al. Câncer colorretal: uma revisão da abordagem terapêutica com bevacizumabe A review of bevacizumab and its use in colorectal cancer [Internet]. [cited 2023 Oct 22]. Available from: https://repositorio.usp.br/directbitstream/8895d80e-f475-4111-b471-cab80d3838fd/SECOLI%2C%20S%20R%20doc%20129e.pdf.
(54) Verwaal VJ, Bruin S, Boot H, van Slooten G, van Tinteren H. 8-Year Follow-up of Randomized Trial: Cytoreduction and Hyperthermic Intraperitoneal Chemotherapy Versus Systemic Chemotherapy in Patients with Peritoneal Carcinomatosis of Colorectal Cancer. Annals of Surgical Oncology. 2008 Jun 3;15(9):2426–32. – hipec vs qt convencional
(55) Vidal TJ, Figueiredo TA, Pepe VLE. O mercado brasileiro de anticorpos monoclonais utilizados para o tratamento de câncer. Cadernos de Saúde Pública [Internet]. 2018 Nov 29;34(12). Available from: https://www.scielo.br/pdf/csp/v34n12/1678-4464-csp-34-12-e00010918.pdf.
(56) Anestesia para cirurgia citorredutora (CRS) com quimioterapia intraperitoneal hipertérmica (HIPEC) [Internet]. WFSA Resource Library. [cited 2024 Mar 31]. Available from: https://resources.wfsahq.org/atotw/anestesia-para-cirurgia-citorredutora-crs-com-quimioterapia-intraperitoneal-hipertermica-hipec/
(57) Peres LAB, Cunha Júnior AD da. Acute nephrotoxicity of cisplatin: Molecular mechanisms. Jornal Brasileiro de Nefrologia. 2013;35(4):332–40.
(58) MITOCIN (Mitomicina C) | BulasMed [Internet]. www.bulas.med.br. [cited 2023 Nov 29]. Available from: https://www.bulas.med.br/p/bulas-de-medicamentos/bula/4357/mitocin.htm.
(59) Shimizu T, Sonoda H, Murata S, Takebayashi K, Ohta H, Miyake T, Mekata E, Shiomi H, Naka S, Tani T. Hyperthermic intraperitoneal chemotherapy using a combination of mitomycin C,5-fluorouracil, and oxaliplatin in patients at high risk of colorectal peritoneal metastasis: A Phase I clinical study. Eur J Surg Oncol. 2014 May;40(5):521-528. doi: 10.1016/j.ejso.2013.12.005. Epub 2013 Dec 18. PMID: 24388411.
(60) Correspondência A, Goulart, Goulart A, Martins S. ÍLEO PARALÍTICO PÓS-OPERATÓRIO: FISIOPATOLOGIA, PREVENÇÃO E TRATAMENTO Artigo de Revisão Review Article. Rev Port Coloproct [Internet]. 2010;7(2):60–7. Available from:https://comum.rcaap.pt/bitstream/10400.26/2028/1/ileo%20paral%C3%ADtico%20(Outubro%202010).pdf.
(61) ASTUDILLO S, Lopes F, ANTÔNIO LACERDA FILHO, PAULO, BRENO, RODRIGO ALMEIDA PAIVA, et al. Avaliação da morbimortalidade e da sobrevida em pacientes portadores de carcinomatose peritoneal submetidos a cirurgia citorretorredutora e quimioterapia hipertérmica intraperitoneal (HIPEC). 2023 Jan 1;50.
(62) Hyperterm intraperitoneal kemoterapi ved den primære operation for gastrointestinal cancer [Internet]. Ugeskriftet.dk. [cited 2023 Oct 14]. Available from: https://ugeskriftet.dk/videnskab/hyperterm-intraperitoneal-kemoterapi-ved-den-primaere-operation-gastrointestinal-cancer.
(63) François Quenet, Elias D, Roca L, Goéré D, Laurent Ghouti, Pocard M, et al. Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy versus cytoreductive surgery alone for colorectal peritoneal metastases (PRODIGE 7): a multicentre, randomised, open-label, phase 3 trial. 2021 Feb 1;22(2):256–66.
(64) Qin X, Siyad Mohamed M, Zhang Y, Chen Y, Wu Z, Luo R, et al. Hyperthermic intraperitoneal chemotherapy following up-front cytoreductive surgery versus cytoreductive surgery alone for isolated synchronous colorectal peritoneal metastases: A retrospective, observational study. Frontiers in Oncology [Internet]. 2022 [cited 2024 Apr 8];12:959514. Available from: https://pubmed.ncbi.nlm.nih.gov/36330501/
(65) Bajramagic S, Hodzic E, Mulabdic A, Holjan S, Smajlovic S, Rovcanin A. Usage of Probiotics and its Clinical Significance at Surgically Treated Patients Sufferig from Colorectal Carcinoma. Medical Archives. 2019;73(5):316.
aGraduandos em Biomedicina no Centro Universitário das Faculdades Metropolitanas Unidas – FMU.
bBiomédica, preceptora do curso de Biomedicina no Centro Universitário das Faculdades Metropolitanas Unidas – FMU.
