REGISTRO DOI: 10.5281/zenodo.8408597
Alex Aparecido De Carvalho
Breno Fonseca Vinhaes
Araceli Scalcon
Hugo Maurício Tiggemann
RESUMO
A piscicultura é uma atividade que vem crescendo rapidamente no Brasil. O cultivo da tilápia do Nilo (Oreochromis niloticus) representou 60,6% do cultivo de peixes em 2019, com o estado do Paraná se destacando como o maior produtor nacional. Como consequência da grande produção de tilápia, tem-se uma considerável geração de resíduos, que representam aproximadamente 50% do peso do animal. O reaproveitamento da pele de tilápia, descartado no seu beneficiamento, pode ser visto como uma possibilidade de agregar valor a este subproduto, além de diminuir impactos ambientais provenientes de um gerenciamento inadequado de resíduos. Para a obtenção de colágeno os peixes apresentam vantagens devido à sua disponibilidade, ausência de risco de transmissão de doenças, barreiras religiosas, alto rendimento e ausência de toxicidade. O colágeno devido às suas características e propriedades, possui uma aplicação versátil nas indústrias farmacêutica, estética, de alimentos, entre outras. Assim foi realizada a extração do colágeno seguindo uma metodologia de extração por meio de ácido acético com constante agitação em banho ultrassônico, onde foi verificado as diferenças de rendimento de proteínas entre os tempos e concentrações. Verificados em quais tempos e concentrações do ácido acético apresentaram influências nas variáveis estudadas por este artigo, onde obteve-se um aproveitamento da extração no rendimento e na quantidade de proteína em determinados casos superior à de outros autores, concluindo que a obtenção do colágeno através da pele da tilápia pode ser muito promissora e rentável.
PALAVRAS-CHAVE: Colágeno, Aproveitamento de Resíduos, Oreochromis niloticus
ABSTRACT
Fish farming is an activity that has been growing rapidly in Brazil. The cultivation of Nile tilapia (Oreochromis niloticus) accounted for 60.6% of fish farming in 2019, with the state of Paraná standing out as the largest national producer. As a consequence of the large tilapia production, there is a significant generation of waste, representing approximately 50% of the animal’s weight. The utilization of discarded tilapia skin, which occurs during processing, can be seen as an opportunity to add value to this byproduct and reduce environmental impacts resulting from improper waste management. Fish have advantages in obtaining collagen due to their availability, absence of disease transmission risks, lack of religious barriers, high yield, and absence of toxicity. Collagen, due to its characteristics and properties, has versatile applications in the pharmaceutical, cosmetic, food industries, among others. Thus, collagen extraction was performed using acetic acid with constant agitation in an ultrasonic bath, where differences in protein yield were observed among different times and concentrations. It was determined which times and concentrations of acetic acid had an influence on the variables studied in this article, resulting in extraction yield and protein quantity in certain cases that were superior to those of other authors. It was concluded that obtaining collagen from tilapia skin can be highly promising and profitable.
KEY WORDS: Collagen, Waste Processing, Oreochromis niloticus.
1. INTRODUÇÃO
A produção brasileira de peixes de cultivo tem aumentado nos últimos anos, e o mesmo ocorre com a produção de tilápia do Nilo (Oreochromis niloticus), que em 2021 foi de 534.005 toneladas. Esta atividade ocorre em praticamente todo o território brasileiro.
O Paraná é o principal produtor nacional de tilápias, com destaque para a região Oeste, cujas principais cidades produtoras são Toledo, Cascavel, Maripá, Nova Aurora, Assis Chateaubriand, Tupãssi e Marechal Cândido Rondon (PEIXE BR, 2021).
De acordo com Da Silva et al. (2015), a tilápia do Nilo, faz parte do grupo dos Teleósteos, Ordem Piciforme, pertencente à Família Cichlidae, Subfamília Pseudocrenilabrinae. Tem sua origem no rio Nilo, localizado no leste da África, e hoje também se encontra em quase todo o mundo, principalmente em regiões tropicais e subtropicais.
Suas principais características são desenvolvimento rápido, chegando na sua fase adulta medindo 60 cm e pesando entre 4,3 kg a 9,5 kg. Apresentam corpo achatado lateralmente, compostos por escamas de tipo ciclóides, de coloração acinzentada, focinho curto com boca anterior, com pequenos dentes quase imperceptíveis, olhos laterais e brânquias curtas e grossa (DA SILVA et al., 2015), como se observa Figura 1.
Figura 1- Tilápia-do-Nilo (Oreochromis niloticus)

Fonte: (https://aquaponia-urbana.com/tilapia-do-nilo/, 2022)
A tilápia do Nilo (Oreochromis niloticus), introduzida no Brasil na década de 1970, tem sido vastamente produzida em diversas regiões do mundo. Possuindo um dos melhores aspectos para seu cultivo, por se tratar de uma espécie de clima tropical, aceita vários alimentos, é bastante dócil, possui características rústicas, além de apresentar excelente rendimento de pesocarcaça (SCHULTER; VIEIRA FILHO, 2018).
Seu cultivo representa 60,6% do cultivo de peixes e apresentou um crescimento de 12,5% em relação ao ano de 2019, sendo a região sul responsável por 44% de toda a produção nacional (PEIXE BR, 2021).
A Tabela 1 apresenta os cinco maiores estados produtores de tilápia do Brasil no ano de 2020.
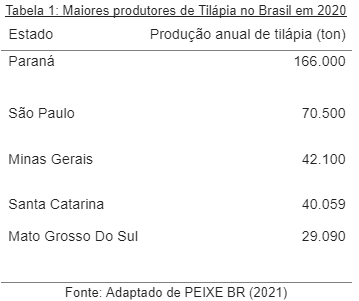
A produção de tilápia foi de 534.005 toneladas, representando 63,5% da produção de peixes, e teve um crescimento acima da média de 9,8% sobre o ano anterior (486.255t), comprovando sua viabilidade para as condições brasileiras (PEIXE BR, 2021).
O Sul do Brasil lidera a produção de tilápia. A espécie representa 86% de todos os peixes de cultivo na região. No total, são 231.900 toneladas nos três estados sulistas: cerca de 43,4% da produção nacional, e o Paraná ocupa a primeira posição, com uma produção de 182.000 toneladas (PEIXE BR, 2021).
Como consequência da grande produção de tilápia, a geração de resíduos que está presente em todas as etapas da cadeia produtiva, com cerca de 50% do volume processado diariamente nas indústrias sendo resíduo sólido que geralmente é descartado em lixões, córregos, rios e mares (DECKER et al., 2016; VAZ, et al., 2022).
Devido estes resíduos não apresentam um valor financeiro agregado e muitas vezes são descartados de forma irregular causando odor desagradável e atraindo insetos, além de conferir riscos à saúde pública do entorno (ALVES, 2016).
O colágeno é obtido a partir de resíduos da indústria pesqueira e vem alterando o cenário das indústrias devido suas diversas propriedades, dentro delas a de emulsificante, agentes espumantes, estabilizante, películas biodegradáveis e micro-encapsulante, sendo uma excelente forma de substituir materiais sintéticos (ALVES et al., 2019).
Segundo Vaz et. al (2022), estes resíduos podem ser reaproveitados para extração de biomoléculas, como colágeno, colagenases, pepsina, tripsina, quimotripsina, que possuem alto valor agregado para as indústrias farmacêuticas e alimentícias, além de agregar valores aos resíduos.
De acordo com Oliveira et.al (2017), o produto apresenta alto valor agregado, que vem sendo amplamente pesquisado para uso industrial devido à sua abundância em tecidos animais (bovinos, suínos, caprinos, ovinos, peixes, anfíbios, etc.).
Entre os diversos animais que são utilizados para obtenção do colágeno, destacam-se principalmente os peixes, devido à sua disponibilidade, ausência de risco de transmissão de doenças, barreiras religiosas, alto rendimento e ausência de toxicidade.
O colágeno é uma proteína fibrosa de origem animal encontrada nos tecidos conjuntivos, como ossos, tendões, cartilagens, dentes, veias, pele, músculos e na córnea dos olhos. Sua função é contribuir para a resistência e flexibilidade dos tecidos onde ela se encontra (SILVA; PENNA, 2012).
A hélice de colágeno pode se desdobrar e se tornar fácil de dissolver. Isso depende da temperatura de desnaturação e do conteúdo de prolina e hidroxiprolina no colágeno.
Atualmente, os pesquisadores identificaram pelo menos 29 tipos diferentes de colágeno de vários tecidos animais, cada um dos quais com sua própria sequência de aminoácidos e estrutura molecular, exemplo tipo I e tipo II com funções biológicas distintas (LIU et al., 2012).
A estrutura primária do colágeno é composta por um número específico de diferentes aminoácidos, que são organizados em sequência para formar uma cadeia polipeptídica de aproximadamente 1.050 aminoácidos por cadeia α (GONÇALVES, 2011).
O aminoácido glicina (Gly) tem o peso molecular mais abundante, com uma característica única da sequência de aminoácidos que existe em uma cadeia de 3 posições no tropocolágeno.
Em materiais de mamíferos, o aminoácido prolina (Pro) e hidroxiprolina (Hyp) correspondem por um quarto do peso (DJABOUROV; NISHINARI; ROSSMURPHY, 2013).
A estrutura secundária é formada por três cadeias α (duas idênticas, chamadas α1) e uma cadeia com uma estrutura primária diferente chamada α2.
Cada cadeia é organizada em um espiral à esquerda. Na estrutura terciária, três cadeias se agrupam para formar uma nova hélice do lado direito, formando uma hélice tripla (GONÇALVES, 2011).
Os resíduos Gly da sequência de repetição -Gly-X Y- estão localizados no núcleo da estrutura helicoidal tripla na qual as três cadeias estão dispostas em um eixo central comum, não deixando espaço para grupos laterais maiores no núcleo. (DJABOUROV; NISHINARI; ROSS-MURPHY, 2013).
O arranjo das hastes das fibrilas de colágeno é denominado estrutura quaternária. As fibras são reforçadas por ligações covalentes e tornando a molécula insolúvel. A Figura 2 apresenta uma ilustração da estrutura molecular do colágeno, tropocolágeno e a sequência de aminoácidos.
Figura 2: Formato estrutural do colágeno e a sequência de aminoácidos

Existem diferentes métodos de extração de colágeno, entre os quais, os mais utilizados são por meio de protocolos utilizando soluções ácidas/alcalinas e por meio de hidrólise enzimática.
Através delas são retiradas as cadeias polipeptídicas, assim tendo uma maior quantidade de colágeno solúvel. Mas se o processo de hidrólise ou extração for muito pujante, o colágeno pode ser degradado (REBOUÇAS et al., 2017).
Atualmente estão sendo realizadas diversas pesquisas na obtenção de colágeno a partir de resíduos pesqueiros, pelo fato de haver muitos subprodutos não aproveitados pela indústria. Outras características são a de não apresentar toxicidade, risco de transmissão de doenças baixo ou nulo e ter um alto rendimento no processo de extração (FONTOURA, 2019).
Além disso, a metodologia de extração e purificação do colágeno tem sido objeto de estudo recente de vários autores (ALVES, 2019; COSTA et al, 2019; MENEZES et al., 2020; GOMES, 2021; JUSTINO, 2021; SANTOS et al., 2019) com o objetivo de buscar métodos com o maior rendimento possível e que apresentem produto final com características adequadas à aplicação desejada.
2. Materiais e Métodos
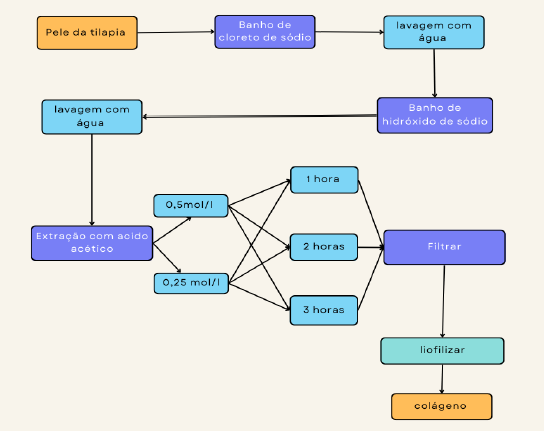
A pele da tilápia utilizada foi doada por produtor local e mantida em armazenamento sob a temperatura de -8ºC. As peles foram cortadas em quadrados de aproximadamente 4 cm² e mantidas sob congelamento até a utilização. A metodologia para a obtenção do colágeno foi adaptada de Gomes (2021) e pode ser visualizada na Figura 3.
A extração do colágeno foi realizada com um pré-tratamento onde foi colocado em um banho de cloreto de sódio 0,8 M com uma relação de 1:5 “pelesolução” por 40 minutos, em seguida foi realizada uma lavagem com água para retirar o excesso do reagente na amostra. Realizado um banho de hidróxido de sódio 0,1 M por 40 minutos com relação de 1:5 (pele/amostra) posteriormente.
Por fim, utilizada água destilada para lavagem e remoção do hidróxido de sódio, sendo seguida por extração com banho em ácido acético nas concentrações de 0,5 M e 0,25 M, pelos períodos de 1, 2 e 3 horas em agitação ultrassônica.
Figura 3: Fluxograma com metodologias para extração de colágeno
Fonte: Autoria própria (2023)
Como pode-se observar na Figura 3, a metodologia consiste em etapas subsequentes de lavagem em soluções ácidas e básicas para o pré-tratamento, descalcificação, desengorduramento e extração do colágeno. A metodologia também contempla etapas de separações físicas como liofilização e filtração.
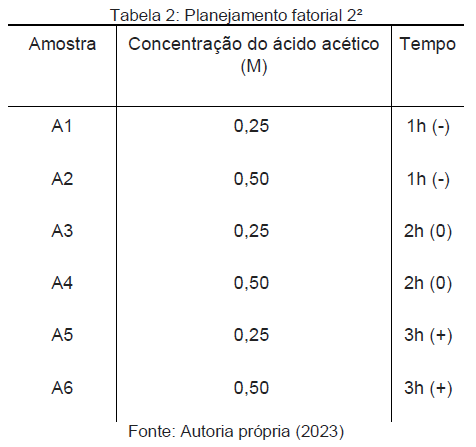
Utilizado planejamento fatorial 2², para a avaliação dos parâmetros que influenciam no processo de obtenção de colágeno. A Tabela 2 mostra o planejamento fatorial, a concentração de ácido acético e o tempo usado para as etapas:
Para a determinação de cinzas foi utilizada a metodologia do Instituto Adolfo Lutz (2008), onde a amostra foi carbonizada em bico de Bunsen e posteriormente aquecida em mufla a 550ºC durante 4 horas.
A análise de proteínas foi realizada a partir do método de Kjeldahl conforme relatado nos Métodos Físico-Químicos para Análise de Alimentos do Instituto Adolfo Lutz (2008). Neste método ocorre a digestão da amostra, onde o nitrogênio orgânico é transformado em amônia e os componentes orgânicos são convertidos em CO2 e H2O.
A segunda etapa da análise de proteínas, que é a destilação, consiste na captura do gás amônia liberado em solução receptora (ácido bórico). A última etapa, a titulação, realiza a determinação quantitativa da amônia contida na solução receptora.
Para determinação do pH (potencial hidrogeniônico) foi utilizada a metodologia do Instituto Adolfo Lutz (2008). As amostras foram dissolvidas em água destilada na proporção de 1:10 (1 grama de amostra para 10 ml de água) e com o auxílio do pHmetro mediu-se os valores de pH.
3. Resultados e Discussões
O método descrito por Gomes (2021) para a extração de colágeno da pele de tilápia foi utilizado como referencial teórico no desenvolvimento de novos métodos. Durante a adaptação, foram consideradas as condições necessárias para permitir um bom rendimento final para a obtenção de colágeno.
O processo totalizou 6 dias e ao fim o colágeno apresentou boa aparência e pouca diferença entre as amostras quanto à uniformidade e aspecto.
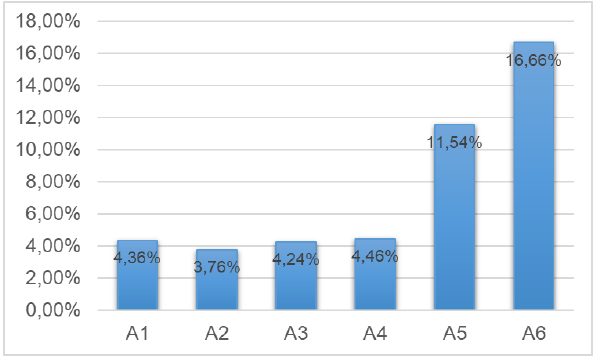
Os métodos utilizados seguiram protocolos detalhados e foram realizados em condições ideais de organização, limpeza e qualidade dos reagentes. O Gráfico 1 demonstra os rendimentos em porcentagem, baseadas nas pesagens anteriores e posteriores da extração do colágeno das amostras.
Houve uma grande diferença dos resultados de rendimento obtidos em A5 e A6 (11,54% e 16,66%) e o restante (A1 à A4, com valores bem próximos e média de 4,21%). Os resultados com maior elevação das duas últimas amostras podem ser um indicativo direto da relação entre tempo de sonicagem no ultrassom e rendimento. Mais estudos são necessários para a confirmação dessa evidência.
Gráfico 1: Rendimento da extração do colágeno
Fonte: Autoria própria (2023)
A análise de cinzas em colágeno fornece informações valiosas sobre a presença de resíduos inorgânicos na amostra. O teor de cinzas é um indicador importante da pureza do colágeno e pode influenciar sua qualidade e aplicabilidade em diversas áreas, como a indústria alimentícia e farmacêutica.
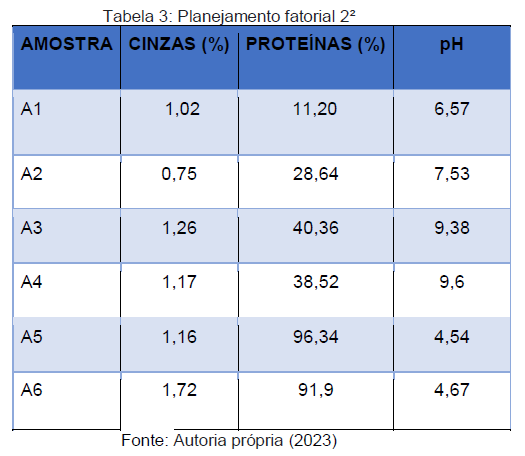
Para a análise de cinzas os valores obtidos variaram entre 0,75 a 1,72%, como pode-se observar na Tabela 3. Segundo Orkerman e Hansen (1994), resultados obtidos abaixo de 2,0% são considerados ideias.
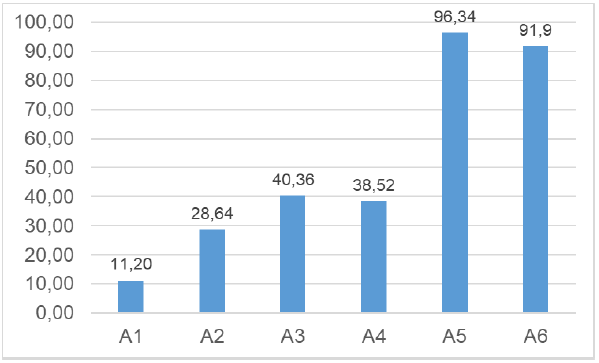
Gráfico 2: Teor de proteína das amostras
Fonte: Autoria própria (2023)
Houve grande diferença quanto ao teor de proteína em relação ao tempo (gráfico 2) de extração. É notável a relação direta entre tempo de extração e quantidade de teor. Quanto maior foi o tempo de extração, maior a quantidade de proteína na amostra.
As amostras A5 e A6 (3 horas no processo de extração) tiveram uma quantidade de proteína muito superior às outras amostras (tempo de 1 e 2 horas). Sugere-se então que a extração do colágeno da pele da tilápia torna-se viável a partir de 3 horas de extração.
Comparando os resultados com os obtidos por Olivio & Shimokomaki (2001), nenhum se enquadrou na faixa 76,27 a 81,41%. Valores esses também obtidos por Costa (2019). Ressaltando que o método utilizado no presente trabalho contém etapas diferentes e adaptadas.
Quanto à concentração do ácido acético, não houve impacto significativo no processo de extração, porém, as amostras que utilizaram 0,25 mol/L obtiveram um valor ligeiramente superior às com concentração de 0,5 mol/L.
Somente A1 obteve o menor rendimento para proteína.
Outra etapa realizada na análise de estabilidade do produto foi a medição do pH. As estimativas foram obtidas no dia após a retirada do liofilizador para verificar se o colágeno permaneceu na faixa de pH conforme descrito em literatura.
Os valores obtidos para o pH (Tabela 3) não seguiram um padrão e variaram bastante, alternando entre um valor mínimo de 4,54 e um máximo obtido de 9,6. Esses resultados são bem diferentes se comparados com os obtidos por Prestes et.al (2013), apresentados na faixa de 6,11 a 8,41, sendo apenas os resultados expressados em A1 e A2 (6,57 e 7,53) compatíveis com o do autor.
Outro fator que merece atenção foram os valores obtidos em A3 e A4 (9,38 e 9,6) e A5 A6 (4,54 e 4,67). De acordo com Gomes (2021) o colágeno atua também como agente tamponante e, caso haja a sua ausência, ocorrerá a grande variação de pH entre as amostras.
Não é possível ainda uma conclusão concreta pelo fato de atualmente termos ainda poucas informações em trabalhos acadêmicos utilizando um método onde haja a utilização de ultrassom. Porém, pode-se utilizar tais resultados como comparativos para estudos futuros.
4. Considerações Finais
A extração de colágeno da pele de tilápia tem se mostrado um campo promissor de pesquisa, com resultados significativos obtidos até o momento. Através de técnicas adequadas, foi possível obter um colágeno de boa qualidade e com potencial aplicação em diversos ramos da indústria, como a alimentícia, farmacêutica e cosmética.
Os estudos realizados demonstraram a viabilidade da extração de colágeno da pele de tilápia, ressaltando sua composição química, propriedades funcionais e características estruturais. Além disso, foram exploradas diferentes metodologias de extração, visando otimizar o rendimento e qualidade do colágeno obtido.
Os resultados obtidos até o momento sugerem que a pele de tilápia é uma fonte rica em colágeno, apresentando potencial econômico e sustentável. No entanto, é importante destacar a necessidade de estudos futuros para aprofundar o conhecimento nessa área.
Novas pesquisas podem explorar a influência de diferentes fatores, como a idade e nutrição dos peixes, nas propriedades e rendimento do colágeno extraído. Além disso, é importante investigar novas técnicas de extração e métodos de purificação que possam aprimorar ainda mais a qualidade do colágeno obtido.
Em conclusão, a extração de colágeno da pele de tilápia tem se mostrado uma abordagem promissora. Os resultados alcançados até o momento abrem perspectivas para a exploração comercial dessa fonte alternativa de colágeno.
Entretanto, é necessário continuar a investir em pesquisas e estudos adicionais para aprimorar os processos de extração, purificação e aplicação do colágeno da pele de tilápia, buscando assim ampliar e tornar cada vez mais eficiente seu potencial de utilização em diferentes setores industriais.
REFERÊNCIAS
ALVES, Admir Sendy Santos et al. Cola da pelelisada da pele (cromagem da Cola de caracterização hidrolisada e mistura no processo de recebimento, purificação e purificação). 2019.
ALVES. A. S. S., Extração de Colágeno como Forma de Aproveitamento de Resíduos Gerados pelo Beneficiamento da Tilápia. 2016. Monografia (Graduação em Engenharia de Biotecnologia e Bioprocesso) – Universidade Federal de Campina Grande, Sumé.
COSTA, Flávia Trivelato da. Extração de colágeno da pele de tilápia do Nilo com protocolo ácido. 2019. Trabalho de Conclusão de Curso. Universidade Tecnológica Federal do Paraná.
DA SILVA, Gisele Ferreira; MARCIEL, Lidiane Marcondes; DALMASS, Marcos Vinicios; GONÇALVES, Mariana Tiepo. TILÁPIA-DO-NILO: Criação e cultivo em viveiros no estado do Paraná. Curitiba: GIA, 2015. 290 p.
DECKER, A. T., RODRIGUES, E. A. DE ALMEIDA, J. C., QUADRO, M. S., LEANDRO, D., ANDREAZZA, R., BARCELOS, A. A. Impactos ambientais dos resíduos de pescado. Revista Brasileira de Engenharia e Sustentabilidade, v. 2, n. 1, p. 1-10, 2016.
DJABOUROV, M.; NISHINARI, K.; ROSS-MURPHY, S. B. Physical gels from biological and synthetic polymers. Cambridge University Press. New York, 2013.
FONTOURA. A. M. Colágeno de tilápia: uma alternativa para agregar valor aos subprodutos da indústria de pescado. Dissertação de Mestrado (Programa de Pós-Graduação em Ciência e Tecnologia dos Alimentos). Universidade Federal de Santa Maria, 2019.
GONÇALVES, A. A.; Tecnologia do pescado: ciência, tecnologia, inovação e legislação. 1ª ed. São Paulo: Editora Atheneu, 2011.
GOMES, Joyce de Pontes. Desenvolvimento das formulações de hidrogel à base de colágeno extraído da pele de tilápia (Oreochromis niloticus). 2021.
INSTITUTO ADOLFO LUTZ. Normas analíticas do Instituto Adolfo Lutz. 3. ed. São Paulo, 2008.
JUDGE, M.; ABERLE, A.; FORREST, J.; HEDRICK, H.; MERKEL, R. Principles of meat science. 2nd ed. Kendall/Hunt publishing company. 1989.
JUSTINO, Marco Antônio. Extração e caracterização de colágeno de pele de Tilápia (Oreochromis Niloticus): avaliação do seu potencial na formulação de hidrogéis para medicina regenerativa. 2021
LIU, Dasong et al. Extração e caracterização de colágeno solubilizado com pepsina de nadadeiras, escamas, peles, ossos e bexigas natatórias de carpa cabeçuda (Hypophthalmichthys nobilis). Food Chemistry, v. 133, n. 4, pág. 1441-1448, 2012.
MENEZES, Maria do L. Linhares Rodrigues et al. Otimização da extração de colágeno da pele de tilápia do Nilo (Oreochromis niloticus) e seu hidrogel com ácido hialurônico. Colóides e Superfícies B: Biointerfaces, v. 189, p. 110852, 2020.
OCKERMAN, H. W.; HANSEN, C. Industrialización de Sub-produtos de Origem Animal. Zaragoza, España: Acribia, 1994.
OLIVEIRA, V. M., DA CUNHA, M. N. C., NASCIMENTO, T. P., ASSIS, C. R. D., BEZARRA, R.
S., PORTO, A. L. F. Colágeno: função, classificação e produção de peptídeos bioativos a partir da pele de peixes. Acta of Fisheries and Aquatic Resources, v. 5, n. 2, p. 56-68, 2017.
OLIVO, R.; SOARES, A. L.; IDA, E.I.; SHIMOKOMAKI, M. Dietary vitamin E inihibits poultry PSE and improves meat functional properties. Journal of Food Biochemistry, v. 25, p. 271283, 2001.
PEIXE BR. Anuário Peixe BR da Piscicultura 2021. São Paulo: Associação Brasileira de Piscicultura, 2021, 138 p.
PRESTES, Rosa Cristina. Colágeno e seus derivados: características e aplicações em produtos cárneos. Journal of Health Sciences, v. 15, n. 1, 2013.
REBOUÇAS, L.O.S., FIGUEIREDO, A.C.N., SANTOS, J.J., ASSIS, A.P.P., CAMÊLO, M.C.S., SILVA, J.B.A., LIMA, P.O., 2017. Qualidade física e sensorial da tilápia. Boletim de Indústria Animal, vol. 74, pp. 116-121.
SANTOS, F. V. D., CORADINI, M. F., ALTIMARI JUNIOR, F. C., YAJIMA, E. M., PARISI, G., & SOUZA, M. L. R. D. (2019). PRODUÇÃO DE COLÁGENO EM PÓ A PARTIR DA PELE E DO ESPINHAÇO DE TILÁPIA DO NILO.
SCHULTER, E. P., & VIEIRA FILHO, J. E. R. (2018). DESENVOLVIMENTO E POTENCIAL DA TILAPICULTURA NO BRASIL. Revista De Economia E Agronegócio, 16(2), 177–201.
SILVA, Tatiane Ferreira da; PENNA, Ana Lúcia Barretto. Colágeno: Características químicas e propriedades funcionais. Revista do Instituto Adolfo Lutz, p. 530-539, 2012. VAZ, Lauren Cristine Souza, PINTO, Ellen Godinho, SOARES, Dayana Silva Batista, Fernandes, Ana Paula Stort auren et al. EXTRAÇÃO E CARACTERIZAÇÃO DO COLÁGENO A PARTIR DE PELE DE PEIXE DA ESPÉCIE TILÁPIA DO RIO E REPRESA. 2022.
