REGISTRO DOI: 10.5281/zenodo.11062688
Mariana Gouvêa Mendanha Silva1
RESUMO
A presença de micotoxinas é um desafio significativo na indústria avícola, especialmente na produção de frangos. Essas toxinas, metabólitos tóxicos produzidos por fungos, são comumente encontradas em commodities agrícolas, como cereais e produtos à base de cereais, que compõem a principal matéria-prima das rações para frangos. Esta revisão bibliográfica, baseada em uma minuciosa em diversas bases de dados, destaca as principais micotoxinas que contaminam alimentos para aves, incluindo aflatoxinas, deoxinivalenol, ocratoxina A (OTA), zearalenona, fumonisinas, toxina T-2. Essas toxinas podem induzir uma série de efeitos adversos nos frangos, incluindo problemas de saúde como hepatotoxicidade, imunotoxicidade e nefrotoxicidade, além de reduzir o desempenho e a produtividade das aves. Os prejuízos econômicos decorrentes da contaminação por micotoxinas incluem o descarte de rações contaminadas, custos com tratamento de doenças e perdas na produção. Estratégias de mitigação, como métodos físicos, químicos e biológicos, são fundamentais para minimizar esses impactos, embora as medidas de prevenção do desenvolvimento fúngico também sejam importantes. Portanto, a contaminação por micotoxinas representa uma séria preocupação para os produtores de frangos, exigindo investimentos em tecnologias e práticas eficazes para garantir a segurança alimentar e a saúde das aves destinadas ao consumo humano.
Palavras-chave: Avicultura de corte; Metabólito secundário; Dieta; Contaminação.
1. INTRODUÇÃO
A avicultura de corte é um dos setores mais importantes do agronegócio brasileiro. De acordo com a Associação Brasileira de Proteína Animal (ABPA), em 2022 a produção de frangos no Brasil alcançou a marca de 14,524 milhões de toneladas, sendo 66,8% destinada ao mercado interno e 33,20 % destinada à exportação, fazendo com que o país conquistasse o posto de maior exportador de carne de frango do mundo.
Com a produção avícola em constante expansão e uma demanda por alimentos de origem animal crescente, a eficiência e a lucratividade dessa indústria são constantemente desafiadas por vários fatores, dentre os quais se destacam a presença de micotoxinas, que são metabólitos secundários produzidos por fungos que podem contaminar diversas matérias-primas utilizadas na formulação de rações, incluindo grãos, farelos e subprodutos agrícolas. Essas toxinas são quimicamente estáveis, ou seja, além de resistirem ao longo de toda cadeia alimentar, desde a produção de ração até ao consumo humano, elas também são pertinentes no alimento após a retirada dos fungos seguindo os métodos convencionais de industrialização e embalagem, sendo um perigo não só para a saúde das aves, mas também para a segurança alimentar.
Existem três grandes grupos de fungos encontrados nas rações de aves de corte, são eles: Aspergillus (aflatoxinas e ocratoxina), Penicillium e Fusarium (desoxinivalenol, fumonisinas , tricoteceno e zearalenona). Cada uma dessas micotoxinas possui propriedades únicas e pode causar diversos efeitos nos frangos, incluindo a diminuição na taxa de crescimento, diminuição na conversão alimentar, má qualidade da carcaça, pododermatite, maior propensão a doenças, menor consumo de ração, aumento da mortalidade etc. Além disso, as micotoxinas geram um grande impacto econômico, já que será necessário a adoção de práticas agrícolas específicas para minimizar os efeitos das toxinas, podendo demandar o uso de fontes alternativas de alimentação para os animais, ou em casos mais graves será necessário descartar a matéria prima contaminada.
Neste contexto, o objetivo desta pesquisa é realizar uma revisão bibliográfica sobre os principais tipos de micotoxinas de interesse na avicultura de corte, estudar os efeitos adversos na saúde dos frangos, apresentar estratégias de prevenção e controle existentes.
2. OBJETIVOS
2.1 OBJETIVO GERAL
Realizar uma revisão bibliográfica abrangente e atualizada sobre a presença de micotoxinas na ração de frangos de corte, com o objetivo de analisar seus efeitos na saúde e desempenho das aves, além de avaliar as estratégias de prevenção e controle mais utilizadas, visando contribuir para a melhoria da segurança alimentar e produtividade na indústria avícola.
2.2 OBJETIVOS ESPECÍFICOS
Identificar as micotoxinas mais prevalentes nas rações de frangos de corte e seu impacto na saúde e desempenho das aves.
Investigar as medidas de controle adotadas na indústria avícola para reduzir a contaminação por micotoxinas na ração.
Propor recomendações práticas para a prevenção eficaz da contaminação por micotoxinas na produção, armazenamento e distribuição de rações destinadas a frangos de corte.
3. METODOLOGIA
A metodologia adotada para esta pesquisa de revisão bibliográfica envolverá a definição de critérios de seleção de fontes, seguida por buscas sistemáticas em bases de dados científicas utilizando palavras-chave relevantes. Os artigos selecionados serão triados com base nos critérios estabelecidos, seguidos de uma leitura crítica para extrair informações pertinentes sobre micotoxinas na ração de frangos de corte, incluindo tipos de micotoxinas, métodos de detecção, efeitos nas aves, medidas de controle, entre outros. Os resultados serão analisados e discutidos para identificar padrões e lacunas de conhecimento na literatura.
4. REVISÃO BIBLIOGRÁFICA
4.1 PANORAMA DA AVICULTURA DE CORTE NO BRASIL
A avicultura de corte se destaca como um dos ramos mais tecnológicos do agronegócio. Ao longo dos anos, o setor tem se empenhado em realizar avanços científicos na genética, nutrição, manejo, bem estar e sanidade animal. De acordo com a Associação Brasileira de Proteína Animal (ABPA, 2023), o alojamento de matrizes de corte, essencial para essa produção, apresentou uma tendência ascendente em um curto período, passando de 48 milhões em 2018 para 56 milhões em 2022 (Figura 1).
Figura 1 — Alojamento de Matrizes de Corte
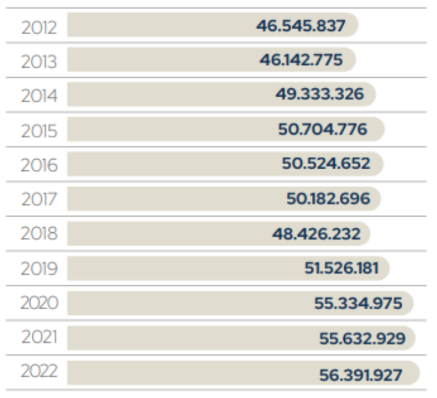
Fonte: ABPA (2023).
Essa evolução no alojamento de matrizes está intimamente relacionada com a produção de carne de frango, outro indicador chave do desempenho da avicultura de corte brasileira. Em 2022, por exemplo, a produção de carne de frango totalizou 14.524 milhões de toneladas, evidenciando um crescimento significativo em comparação aos anos anteriores (Figura 2).
Figura 2 — Produção de carne de frango
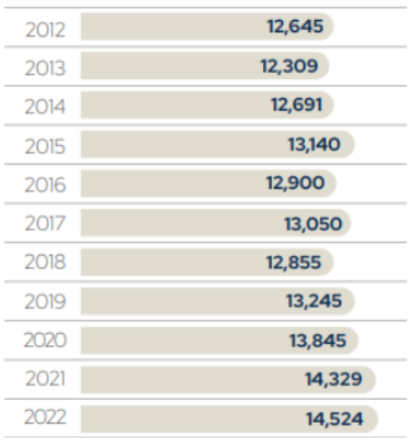
Fonte: ABPA (2023).
Quanto ao destino da carne de frango, observa-se que a 66,80% da produção é destinada ao mercado interno e 33,20% são destinados às exportações, consolidando a posição do Brasil como um dos principais exportadores mundiais de carne de frango.
4.2 RAÇÃO
A ração representa a quantidade total de alimento oferecido a um animal em um período de 24 horas. Ela ainda pode ser definida como uma quantidade específica de alimento que inclui todos os nutrientes necessários para atender aos requisitos fisiológicos específicos de cada espécie, categoria e fase animal (SALMAN; OSMARI; SANTOS, 2011).
Nos setores de produção animal, a nutrição representa entre 70% e 80% dos gastos totais (Cruz et al., 2017). Um dos principais ingredientes utilizados como fonte energética na formulação de ração é o milho, enquanto a soja e seus subprodutos são fundamentais como fontes de proteína (MAGNOLI; POLONI; CAVAGLIERI, 2019). Para cada quilo de carne de frango, são requeridos dois quilos de ração, com cerca de 70% de milho e 20% de farelo de soja (Embrapa Milho e Sorgo, 2014). Considerando que cereais e produtos derivados são as principais componentes das rações animais, eles também representam as principais fontes de contaminação por micotoxinas na alimentação animal (PALERMO-NETO, 2020).
A produção de ração destinada à criação de frangos no Brasil apresentou um crescimento consistente ao longo dos anos, conforme dados fornecidos pelo Sindicato Nacional da Indústria de Alimentação Animal (Sindirações, 2023). Entre janeiro e setembro de 2022, foram produzidas aproximadamente 31,8 milhões de toneladas de ração para aves, enquanto no mesmo período de 2023, esse número aumentou para 32,7 milhões de toneladas. Esse aumento na produção de ração acompanha o incremento na criação de frangos de corte e poedeiras. No período mencionado, a produção de ração destinada aos frangos de corte passou de 26,7 milhões de toneladas em 2022 para 27,5 milhões de toneladas em 2023, refletindo o contínuo crescimento do setor avícola no país.
As fábricas de ração emergiram para atender de maneira eficaz às necessidades nutricionais dos animais de produção, em resposta ao aumento da demanda do consumo de produtos de origem animal (LEITE et al., 2008). Segundo Burton et al (2016) as fábricas de ração utilizam mais de 20 ingredientes em suas dietas, sendo cada um deles escolhidos conforme o preço, disponibilidade, qualidade,etc.
A ração pode ser disponibilizada em diversas formas em relação ao formato do grão ao final do processo, como farelada, peletizada ou extrusada. De acordo com Bezerra (2009) independente da apresentação comercial da ração, a presença de fungos e micotoxinas compromete significativamente a saúde dos animais.
Com isso, o controle de qualidade na fabricação de ração se torna crucial para garantir a segurança e a eficácia dos produtos. A legislação, estabelecida pelo Ministério da Agricultura, Pecuária e Abastecimento (MAPA), faz exigências desde 2003 para que as fábricas adotem um processo rigoroso de controle de qualidade. Isso inclui a obrigação dos fabricantes de alimentação animal de possuírem o Manual de Boas Práticas de Fabricação (BPF) e os Procedimentos Operacionais Padrões (POP) (MAPA, 2007).
4.3 MICOTOXINAS
Segundo Coulombe (1991) as micotoxinas são definidas como metabólitos secundários produzidos por fungos que crescem de forma natural em produtos alimentícios, podendo causar diversos efeitos tóxicos para animais e seres humanos. O desenvolvimento dos microrganismos responsáveis pela produção dessas toxinas requer a interação de diversos fatores, incluindo aspectos físico químicos, o tipo de substrato, as condições de temperatura e umidade do ambiente de armazenamento, bem como a quantidade de água presente nos grãos e seu pH. (MAZIERO e BERSOT, 2010).
A contaminação por micotoxinas em alimentos e rações ocorre de forma indireta e direta. Na primeira situação, a contaminação se dá quando um dos ingredientes é inicialmente afetado, persistindo a presença das micotoxinas mesmo após a eliminação do fungo durante o processamento, já que essas substâncias são resistentes a altas temperaturas. Por outro lado, na forma direta, a contaminação acontece quando o alimento ou a ração pronta é contaminada por fungos toxigênicos, seguido pela produção subsequente de micotoxinas (FERREIRA et al., 2007).
A contaminação por micotoxinas em rações destinadas à alimentação de frangos de corte é um desafio complexo e preocupante na indústria avícola. Segundo dados da Pesquisa Mundial de Micotoxinas de DSM, conduzida no período de 2016 a 2020, mais de 8 mil amostras de rações finalizadas para aves foram analisadas, revelando uma realidade alarmante: a presença recorrente de micotoxinas. De acordo com a pesquisa 92% das amostras estavam contaminadas com múltiplas micotoxinas, e em muitos casos, 40 a 50 micotoxinas diferentes podiam ser detectadas em uma única amostra. O estudo ainda detectou a presença de micotoxinas e seu potencial de risco para frangos de corte foram representados abaixo (figura 3): as barras denotam a porcentagem de amostras positivas para cada micotoxina, enquanto a contaminação máxima é destacada dentro da figura (em ppb). As cores utilizadas indicam o nível de risco para as aves, sendo o roxo associado ao risco mais elevado e o amarelo indicando um risco moderado.
Figura 3 — Ocorrência de micotoxinas em rações para aves

Fonte: DSM (2023).
Os animais monogástricos são mais propensos a sofrer as reações causadas pelas micotoxinas em comparação com os animais ruminantes. Esta diferença reside na maior resistência dos ruminantes, atribuída à presença de microrganismos ruminais capazes de degradar e metabolizar algumas dessas substâncias provenientes do metabolismo dos fungos (Pozzo et al., 2016).
As micotoxinas quando ingeridas pelas aves podem provocar uma variedade de patologias dependendo da quantidade da substância consumida e do período de exposição. Shephard (2008) constatou que os animais podem apresentar sintomas agudos, que se manifestam rapidamente e podem levar a danos irreversíveis e até mesmo à morte, ou sintomas subagudos, que surgem de doses menores e resultam em distúrbios alimentares, redução da eficiência produtiva e supressão da imunidade
Detectar a intoxicação por micotoxinas é uma tarefa desafiadora, pois diversos fatores podem influenciar esse diagnóstico, como a amostragem inadequada do alimento contaminado ou baixas concentrações que dificultam sua identificação (Sávio, 2018). É importante destacar que além de prejudicarem o desempenho e a saúde dos animais de produção, as micotoxinas representam um risco para a saúde humana. Isso ocorre porque produtos de origem animal provenientes de animais alimentados com ração contaminada podem conter resíduos, como é o caso do leite, carne e ovos (Yiannikouris et al., 2002).
Os principais grupos de micotoxinas identificados na alimentação animal são gerados por três gêneros de fungos: Aspergillus (aflatoxinas (AFs) e ocratoxina A (OTA)), Penicillium (OTA) e Fusarium (tricotecenos, fumonisinas (FBs) e zearalenona (ZEA)) (MARIN et al., 2013; RODRIGUES; NAEHRER, 2012).
4.3.1 Aflatoxinas
As aflatoxinas são micotoxinas produzidas por fungos do gênero Aspergillus, especialmente pelas espécies A. flavus e A. parasiticus. Elas foram descobertas em 1960 após causarem um surto tóxico em perus na Inglaterra, conhecido como “Turkey-X-disease”. Durante esse surto, milhares de aves morreram após consumirem torta de amendoim na ração, a qual era proveniente do Brasil (Leeson et al., 1995).
São conhecidos 18 compostos semelhantes designados pelo termo aflatoxina, no entanto, os principais tipos de interesse médico-sanitário são identificados como B1, B2, G1 e G2 (Coulombe,1991). Essas aflatoxinas apresentam diferentes níveis de atividade biológica: a aflatoxina B1 (AFB1), além de ser a mais comumente encontrada em substratos vegetais, é a mais tóxica, seguida por G1, B2 e G2 (Leeson et al., 1995).
De acordo com Opas (1983) as aflatoxinas são cristalinas, termoestáveis, resistem a temperaturas superiores a 200ºC, não alteram sua composição quando submetidas ao frio, são solúveis em solventes polares, insolúveis em gorduras e óleos, são ligeiramente instáveis quando expostas à luz, especialmente à radiação ultravioleta, e são decompostas na de soluções fortemente alcalinas. Entretanto, temperaturas elevadas e baixa umidade propiciam o agrupamento de aflatoxinas nas plantas em crescimento, assim como, altas temperaturas e elevada umidade preliminar na colheita e no decorrer do armazenamento (Xu et al., 2022).
Segundo Santurio (2000) a existência de micotoxinas na ração de aves não significa que ela produzirá efeitos tóxicos, isso porque, a dose de risco está intimamente ligada à receptibilidade das aves com a micotoxina consumida, especificamente no que diz respeito as aflatoxinas, ao bem-estar das aves, em outras palavras, quanto menor o estresse das aves, mais resistentes elas se tornam as aflatoxinas.
As aflatoxinas são rapidamente absorvidas após a ingestão (Wyatt, 1991). Uma vez transportadas para o sangue, as aflatoxinas se ligam à albumina e outras proteínas, antes de se espalharem pelos tecidos. No fígado, essas aflatoxinas são então transformadas pelo sistema microssomal hepático em metabólitos altamente tóxicos, capazes de se ligarem a macromoléculas intracelulares, como o DNA e o RNA, alterando, assim, a transcrição genética e a síntese de proteínas (Zavieiro, 2005). De acordo com Sawnhey et al. (1973), no primeiro dia de intoxicação, a concentração de aflatoxinas é alta no fígado, órgãos reprodutores e rins, sugerindo um possível papel desses órgãos na excreção das toxinas. A presença das aflatoxinas nos excrementos só é detectada sete dias após a ingestão.
Uma da primeiras alterações observadas que pode contribuir para o diagnóstico clínico da intoxicação por aflatoxina (aflatoxicose) é o aumento do tamanho, mudanças na colaração e na textura de órgãos como fígado, baço e rins, ao mesmo tempo que a bursa e timo diminuem (Merkley et al.,1987). Em seus estudos Cruz et al (2012) após analisar amostras de fígado de frangos submetidos a ração com aflatoxinas (A), conforme demonstrado na figura 4, constatou um aumento de volume com lobos precisos, coloração pálido-amarelado e evidenciando focos hemorrágicos na superfície parietal. Isso contrasta com as amostras do grupo B, cujo os animais não receberam dieta contaminada, não apresentando alterações nítidas.
Figura 4 – Amostras de fígado de frangos tratados com ração contendo 2,8ppm de AFs totais durante 21 dias (A) e tratados com dieta isenta de micotoxinas (B)
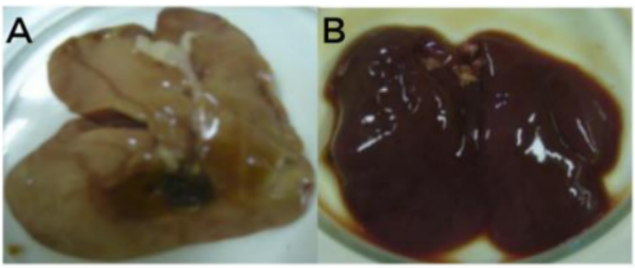
Fonte: Cruz et al (2012).
Os efeitos tóxicos da aflatoxina resultam em diversas lesões hepáticas, incluindo proliferação de dutos biliares no fígado. De acordo com Santurio (1999) a infiltração de gordura nesse órgão está sujeita a dose e ao tempo de intoxicação pela aflatoxina, podendo chegar a um aumento de até 68% em frangos de corte. Além disso, os níveis de albumina e proteínas plasmáticas diminuem, aumentando a fragilidade capilar, que pode resultar em micro-hemorragias (Hamilton & Garlich, 1971).
A aflatoxicose também é responsável pela má absorção da ração. É possível identificar partículas da ração que não foram totalmente digeridas, acompanhadas de esteatorreia, que é caracterizada pelo aumento da excreção de gordura (Osborne & Hamilton, 1981). Como o frango não consegue absorver gordura, a absorção das vitaminas e pigmentos lipossolúveis também são afetados, resultando em palidez das pernas e nas mucosas (MALLMANN, 2007), conforme mostra a figura 4. Além disso, uma absorção deficiente da dieta resulta em uma conversão alimentar ruim, aumentando os custos de produção (SANTURIO, 2000).
Figura 5 – Despigmentação de pernas de frango ocasionada pelo consumo de rações contaminadas por aflatoxinas

Fonte: Polinutri.
As micotoxinas não apenas afetam os órgãos, mas também podem influenciar outros aspectos físicos das aves, como as penas. No estudo conduzido por Giacomini et al. (2006), 240 pintos machos foram alimentados com ração contaminada com 3mg/kg de aflatoxinas, resultando em sinais de intoxicação, desuniformidade na estatura, redução no consumo de ração e ganho de peso, além de alterações nos órgãos e tecidos. O peso relativo do coração e do fígado aumentou significativamente, enquanto a massa de penas foi reduzida em 33,8%.
Os efeitos nocivos das aflatoxinas em frangos são mais perceptíveis na fase inicial de criação, até 21 dias de vida, contudo, o impacto negativo sobre o ganho de peso persiste até a fase final da produção (HUFF et al, 1986). Uma extensa análise compilou dados de 158 estudos publicados entre 1980 e 2016. Nessa metanálise, frangos de corte expostos a aflatoxinas, com uma concentração média de 630 ppb (variando de 0 a 5.000 ppb), apresentaram reduções de 9%, 15% e 6% no consumo de ração, ganho de peso e eficiência alimentar, respectivamente, em comparação com tratamentos livres de aflatoxina. Além disso, os efeitos prejudiciais da aflatoxicose foram mais significativos em aves mais jovens (KIPPER, 2020). Dessa forma, as aflatoxinas têm impactos adversos na performance avícola, afetando a cadeia de produção desde a diminuição das taxas de postura das matrizes até a redução do peso de abate dos frangos intoxicados (KICHOU & WALSER, 1993).
4.3.2 Fumonisinas
As fumonisinas são sintetizadas por fungos do gênero Fusarium, com destaque para o Fusarium moniliforme (Shephard et al., 1992), embora outras espécies como F. proliferatum (Ross et al., 1990) e também algumas do gênero Alternaria spp. (Chen et al., 1992), também atuam como produtores dessas toxinas. Dentre as fumonisinas identificadas até o momento, a FB1, FB2 e FB3 são as mais comumente isoladas em alimentos naturalmente contaminados. Dentre elas, a FB1 é a mais prevalente e também a mais tóxica, representando aproximadamente 70% da contaminação total de alimentos e rações (MALLMANN et al., 2001). As aves domésticas, de modo geral, são mais resistentes às fumonisinas quando comparadas a suínos e equídeos (LEESON et al., 1995). A presença de níveis de FB1 acima de 150mg/kg resulta em sintomas como diarreia, redução no consumo de alimentos e ganho de peso, além de aumento no peso do fígado e rins, juntamente com ocorrência de necrose hepática (Norred & Voss, 1994). De acordo com Tessari et al (2005) a intoxicação de frangos de corte com 50mg/ Kg de AFB1 e 200mg/Kg de FB1, em conjunto ou isoladas, é suficiente para o aumentar a concentração de aspartato aminotransferase e diminuir os níveis de proteínas após 20 dias de consumo da ração contaminada. Sintomas como diarreia, redução do consumo de alimentos, perca de peso corporal, aumento do fígado e dos rins, necrose hepática, também podem ser observados em frangos de corte (NORRED & VOSS, 1994).
A forma como as fumonisinas agem do organismo ainda não está elucidado, porém, vias bioquímicas têm sido propostas para explicar as doenças animais induzidas por essas micotoxinas. Uma dessas vias inclui a inibição da biossíntese dos esfingolipídeos (NORRED, 1993), os quais desempenham um papel crucial na integridade e na atividade fisiológica celular, sendo encontrados em altas concentrações no cérebro e no tecido nervoso de mamíferos e aves (SANTIN, 2000).
Sabe-se que as fumonisinas, especialmente as do tipo B1, pode ocasionar a diminuição do ganho de peso, aumento no tamanho do fígado, proventrículo, moela, atrofia cortical tímica, necro heepática multifocal e hiperblasia biliar (LEDOUX et al, 1992). Segundo Qureshi et al. (1992), a fumonisinas também são responsáveis por afetar o sistema imunológico das aves, deixando-as susceptíveis a doenças.
4.3.3 Ocratoxinas
O nome “ocratoxinas” deriva de Aspergillus ochraceus, o fungo do qual foi isolada pela primeira vez. Essas toxinas podem ser produzidas por algumas espécies de fungos dos gêneros Aspergillus e Penicillium (EFSA, 2006). A ocratoxina A (OTA) é a mais tóxica entre as ocratoxinas e não é eliminada por métodos simples de processamento de alimentos. São necessárias temperaturas superiores a 250ºC por vários minutos para conseguir diminuir a concentração dessa toxina (MARIN et al., 2013).
A ocratoxina A possui efeito nefrotóxico e existem provas de que várias espécies de animais apresentam sensibilidade a essa toxina ( SUTDER-KOHR et al., 1995). Segundo Cruz (1996), em aves domésticas a ocratoxina A é responsável por induzir à depressão da hematopoiese e exercer efeito imunossupressor no timo, bursa de fabricius, baço e linfonodo.
Um estudo realizado com pintos de corte mostrou que uma única exposição à ocratoxina A (OTA), na dose de 0,04mg/kg por via intraperitoneal, resulta em uma significativa redução no número total de leucócitos nas 3a e 6a hora após a intoxicação, além de alterações nos percentuais de diferentes tipos de células sanguíneas (Moura et al., 2005; Porfirio, 2002). Outro estudo com vísceras de frangos de corte detectou resíduos de ocratoxina A nos rins e fígados dos animais em diferentes tempos de inoculação da toxina (SALLES et al., 2000). De acordo com Kuiper-Goodman (1996) e Stander et al. (2000) um dos efeitos da intoxicação por OTA é a necrose de vários tipos de células e tecidos.
A ocratoxina A pode influenciar a enzima proteína quinase limitante, cuja redução nos níveis indica toxicidade sanguínea, levando a distúrbios na metabolização do glicogênio hepático. Além disso, essa micotoxina pode estar relacionada à capacidade mutagênica no RNA e DNA. (Thompson et al., 1990).
4.3.4 Zearalenona
Segundo Freire et al. (2007), a Zearalenona é um metabólito secundário produzido principalmente pelo Fusarium graminearum, mas outras espécies também contribuem para seu aparecimento em grãos usados na produção de rações animais. Ela é uma lactona macrocíclica proveniente do ácido resorcílico que é biotransformada em diferentes metabolitos quando consumida pelos animais (Malekinejad et al., 2006).
Essa micotoxina não sofre mudanças quando exposta a temperaturas até 150°C, sendo degradada apenas em temperaturas superiores ou em condições alcalinas (Ryu, Hanna, & Bullerman, 1999). De acordo com Perali et al (2016) a temperatura é um fator crucial para a contaminação de zearalenona, é estimado que valores entre 12 e 14 °C contribua para o crescimento de fungos, produção de toxinas e contaminação de produtos por micotoxinas, além das variações térmicas diurnas e noturnas.
Pesquisas realizadas por Allen et al., (1981); Lee et al., (1985); Mirocha & Christensen (1974) indicam que as concentrações de Zea (zearalenona) encontradas nas rações comerciais de aves domésticas, não são capazes de acarretar quadros de intoxicação nesses animais, entretanto Bock et al. (1986) e Meronuck et al. (1970) observaram alterações, como redução na conversão alimentar, leve alteração no peso dos órgãos, diminuição da fertilidade e mudanças no comportamento das aves, em seus estudos com rações com altas doses de zearalenona. Sintomas como diminuição no número de leucócitos, hipertrofia dos ovidutose redução do tamanho das cristas, também foram constatados por Allen et al. (1981) e Chi et al. (1980).
É importante frisar que apesar da tolerância de frangos de corte a zearalenona, altas concentrações dessa micotoxina pode contaminar as carcaças dessas aves, reduzir a conversão alimentar, diminuir o número de leucócitos e aumentar o peso da bursa de fabricius (BriyonesReyes et al., 2007; Liu et al., 1985).
4.3.5 Desoxinivalenol
O Desoxinivalenol (DON) é uma micotoxina tricoteceno produzida pelos fungos Fusarium graminearum. Os tricotecenos são um grupo de mais de cem micotoxinas com estrutura química tetracíclica. DON é classificado como tipo B, caracterizado por sua estrutura com dupla ligação nas posições C9, 10 e anel epóxi na posição 12,13, além de uma carbonila no C8 (BANDO et al., 2007).
De acordo com Freire et al (2007) o desoxinivalenol pode ser chamado de vomitoxina, visto que os animais intoxicados recusam a dieta. Além disso, o DON é uma micotoxina imunossupressora e imunotóxica que inibe a síntese de DNA, RNA e proteínas (NIEVINSKI, 2009). Os frangos e ruminantes apresentam maior tolerância ao desoxinivalenol do que os suínos (PESTKA, 2007). Entretanto, Antonissen et al (2018) constataram efeito sinérgico negativo entre uma dieta com disbiose e a presença adicional de DON (5 mg/kg) e FUM (20 mg/kg) no desempenho de frangos de corte. Os dados sugerem que a redução no desempenho é mais pronunciada na fase final da vida das aves, destacando o impacto das micotoxinas nos parâmetros de crescimento.
4.3.6 Toxina T-2
A toxina T-2, do tipo A dos tricotecenos, é produzida por fungos Fusarium, principalmente F. sporotrichoides (CHAUDHARI et al., 2009). Em frangos de corte, sua presença está associada à redução no ganho de peso e lesões na cavidade oral dos animais intoxicados (WEBER et al., 2010). Segundo Kosicki et al (2016) a T-2 é altamente inflamatória quando em contato com a pele. A toxina T-2, tem caráter lipofílico, pode ser prontamente absorvida após o consumo de alimento contaminado, ou mesmo pela respiração e pele. Sua meia-vida no plasma sanguíneo dos animais geralmente é curta, sendo eliminada em até 48 horas, dependendo da dose ingerida. (MACKEI et al., 2020). Entretanto, no caso de frangos de corte as feridas começam no palato duro e na borda da língua, são branco amareladas e caseosas, em seguida atingem as papilas e a raiz da língua, avançando para a parte inferior da língua e bico, dificultando o fechamento da boca das aves., em casos graves, as lesões além de afetarem o fígado, causando inchaço, causam erosões no estômago e intestinos, levando a hemorragias e morte e (CanoSancho et al., 2010; Kosicki et al., 2016).
De acordo com Doerr et al. (1981) a intoxicação pela T-2 pode causar transtornos metabólicos, imunossupressão afetando os macrófagos, alterações sanguíneas com hemorragias relacionadas à coagulação e neurotoxicidade. Um estudo realizado por Leal et al (1999) com frangos de corte expostos a toxina T-2, foi constatado um aumento hepático de MDA (malonildialdeído)e redução da concentração de glutationa em apenas 7 dias de ingestão, indicando sua ação sobre o sistema antioxidante do organismo (Leal et al., 1999).
Segundo Yang et al. (2016) as T-2 são capazes de elevar a atividade plasmática das enzimas ALT e AST em frangos submetidos a dieta com 4mg/Kg dessa micotoxina, além disso foi descoberto que dose de 2mg/Kg contribuem na diminuição dos níveis plasmáticos de proteínas totais dessas aves.
4.4 PREVENÇÃO DE MICOTOXINAS NA RAÇÃO
Existem três abordagens principais para lidar com a contaminação por micotoxinas em rações: prevenção, descontaminação e inibição da absorção no trato digestivo. Quando a prevenção não é viável, são empregadas estratégias para diminuir a contaminação, acompanhadas de métodos para bloquear a absorção de micotoxinas pelo organismo dos animais (XU et al., 2022). De acordo com Kabak et al (2006) os grãos podem ser contaminados por micotoxinas no campo, colheita e armazenamento, sendo necessário dividir as estratégias de prevenção em pré colheita, colheita e pós-colheita.
Para evitar a contaminação de matérias-primas da ração, é necessário seguir as Boas Práticas Agrícolas (BPA), que pode envolver diversas estratégias como implementação de programas de melhoramento genético para selecionar plantas mais resistentes aos fungos, uso de sementes de qualidade, rotação de culturas, manejo do solo, aplicação de fungicidas e inseticidas adequados (VAR, 2006).
A colheita desempenha um papel crucial na contaminação por micotoxinas nos cereais utilizados na produção de rações. Conforme apontado por Hoffmans et al. (2022), diversos fatores relacionados ao processo de colheita podem aumentar significativamente a presença dessas toxinas nos grãos. Por exemplo, a realização da colheita em épocas tardias, muitas vezes com o intuito de reduzir a umidade dos grãos, pode favorecer o aumento do ataque de insetos e, consequentemente, a proliferação de fungos produtores de micotoxinas. Além disso, a ocorrência de chuvas intensas antes da colheita pode resultar em níveis elevados de estresse nas plantações, uma vez que as culturas ficam expostas a um ambiente de alta umidade, o que pode promover o crescimento fúngico e a produção de micotoxinas. Adicionalmente, danos mecânicos durante o processo de colheita podem facilitar a entrada de fungos nos grãos, contribuindo para um aumento na contaminação por micotoxinas.
Em relação a pós-colheita manter baixa umidade e temperatura no ambiente de armazenamento, juntamente com a preservação da integridade dos grãos, desempenham um papel fundamental no controle dos níveis de fungos e micotoxinas presentes (XU et al., 2022).
4.5 MÉTODOS DE MITIGAÇÃO DE MICOTOXINAS
Para descontaminar grãos afetados por micotoxinas, é necessário remover ou inativar as toxinas sem comprometer as propriedades tecnológicas, valor nutricional ou palatabilidade dos produtos. Além disso, deve-se evitar a geração de resíduos tóxicos e ser economicamente viáveis em larga escala. (COLOVIĆ et al., 2019). Existem vários métodos de mitigar a contaminação por micotoxinas,são eles: físicos, químicos e biológicos.
4.5.1 MÉTODOS FÍSICOS
4.5.1.1 Limpeza dos grãos
Na produção de rações, a limpeza e separação de grãos não processados são procedimentos essenciais para garantir a qualidade do produto final. Os grãos recebidos a granel geralmente apresentam impurezas como poeira e partículas estranhas, enquanto os grãos quebrados e danificados tendem a conter uma maior concentração de micotoxinas. Portanto, através da remoção dessas impurezas e da separação dos grãos de baixa qualidade dos saudáveis, é possível minimizar o risco de contaminação e assegurar a segurança alimentar dos animais (XU et al., 2022).
Métodos manuais identificam contaminações visíveis, mas são limitados a pequenas operações. Já técnicas como peneiramento e separação fotoelétrica são empregadas em larga escala, aproveitando a menor gravidade específica dos grãos contaminados, que tendem a se concentrar em partes mofadas, quebradas, assegurando a produção de alimentos seguros e de alta qualidade (LIU et al 2022).
Estudos realizados por Fernandes e Guarienti (2016) e Salgado et al. (2011) destacam a eficácia da limpeza mecânica, incluindo métodos de separação por gravidade e aspiração, na redução da presença de Deoxinivalenol (DON) no trigo. Fernandes e Guarienti demonstraram que essas técnicas foram capazes de efetivamente diminuir a presença de DON em trigo, independentemente da cultivar analisada. Da mesma forma, Salgado et al. também observaram resultados positivos, confirmando que a aspiração e a separação por gravidade são métodos eficazes para reduzir a contaminação por DON no trigo. Essas descobertas destacam a importância da limpeza mecânica na mitigação de micotoxinas em produtos agrícolas, contribuindo para a segurança alimentar e a qualidade dos alimentos.
4.5.1.2 Diluição
A diluição é uma estratégia utilizada na redução dos níveis de micotoxinas em alimentos para animais. Essa técnica envolve a mistura de grãos contaminados com micotoxinas com grãos saudáveis, resultando em uma mistura de concentrações de micotoxinas abaixo dos níveis máximos tolerados pela legislação. Segundo Bryden (2012) essa técnica é reconhecida por sua eficácia e sua relativa economia, porém sua eficácia pode variar dependendo do grau de contaminação inicial e da disponibilidade de fontes de grãos sem contaminação
Apesar de seus benefícios, o método de diluição também apresenta desafios. Um deles é o risco de áreas ou pontos específicos com concentrações elevadas de micotoxinas. Isso ocorre devido à distribuição heterogênea das micotoxinas nos grãos contaminados, o que pode levar a uma concentração mais alta em determinadas regiões da mistura (Peng, Marchal & Van der Poel, 2018). Esses pontos representam uma preocupação significativa, pois podem comprometer a segurança alimentar dos animais que consomem esses alimentos contaminados.
Em países da União Europeia, a prática da diluição não é permitida devido à possibilidade de contaminação residual (European Commission, 2006). No entanto, no Brasil, até o momento, não existe regulamentação específica que proíba essa prática como forma de minimizar a contaminação de cereais e rações.
Portanto, enquanto a diluição continua sendo uma estratégia comum em muitas regiões para reduzir os níveis de micotoxinas, é essencial considerar cuidadosamente seus benefícios e desafios, bem como a legislação e regulamentações locais que podem influenciar sua aplicação.
4.5.1.3 Solvente
A escolha do solvente de extração para micotoxinas depende de diversos fatores, incluindo as propriedades físicas e químicas do analito, custo, segurança do solvente, solubilidade de interferentes e etapas subsequentes de processamento. O solvente ideal é aquele que consegue remover de forma eficaz a micotoxina da matriz, mas devido à complexidade das matrizes, muitas vezes são utilizadas misturas de solventes. Entre as misturas comuns estão metanol/água e acetonitrila/ água, além do uso ocasional de solventes como etanol, acetona, acetato de etila e clorofórmio (Zhang, 2018). O uso de solventes orgânicos apresenta desvantagens, como perda de nutrientes, custos elevados devido à evaporação, remoção de resíduos tóxicos nos cereais e descarte de extratos tóxicos, limitando sua aplicação (Liu et al., 2022).
4.5.1.4 Irradiação
A radiação é uma forma de energia que pode ser classificada em duas categorias principais: ionizante e não ionizante. A primeira inclui radiações como raios X, raios ultravioleta, raios gama e feixe de elétrons, enquanto a segunda abrange micro-ondas, infravermelho, ondas de rádio e raios visíveis. A diferença fundamental entre elas reside no comprimento de onda e na quantidade de energia que possuem. A radiação não ionizante possui comprimentos de onda longos, entretanto não possuem energia suficiente para ionizar átomos ou moléculas, enquanto a radiação ionizante é gerada a partir de átomos instáveis que buscam estabilidade, liberando energia e/ou massa durante esse processo. Esta última possui comprimentos de onda curtos e alta energia, capazes de ionizar átomos e moléculas. (PENG; MARCHAL; VAN DER POEL, 2018).
De acordo com Liu et al (2022) embora a irradiação seja vista como uma promissora técnica para descontaminar micotoxinas em alimentos para animais, preocupações surgem, como a segurança da irradiação ionizante, alterações nos valores nutricionais e custos adicionais de processamento de alimentos. Os efeitos da irradiação gama na redução de micotoxinas são variáveis, dependendo de fatores como a diversidade e espécies de fungos, composição dos alimentos, dose de radiação e umidade do ar (FUMAGALLI et al., 2021). Um estudo realizado por Aziz et al. (2007) investigou os efeitos da aplicação de doses de radiação gama na inativação da fumonisina B1 em diferentes cereais. Eles descobriram que uma dose de 5 kGy foi capaz de inativar a fumonisina B1 em 96,6% para trigo, 87,1% para milho e 100% para cevada. Além disso, observou-se que uma dose de 7 kGy foi suficiente para a destruição completa da fumonisina B1 em trigo e milho.
4.5.1.5 Tratamento térmico
Algumas micotoxinas apresentam alta estabilidade térmica, tornando-as desafiadoras de serem eliminadas por meio de tratamentos convencionais de calor (KABAK, 2009). Diversos métodos de processamento térmico são empregados na produção de alimentos e rações, podendo afetar a presença de micotoxinas. Entre eles, os processos de fragmentação, peletização e extrusão são os mais comuns na fabricação de ração, combinando cisalhamento em alta velocidade e vapor superaquecido. Apesar de reduzirem significativamente as concentrações de micotoxinas, esses métodos raramente resultam na eliminação completa das mesmas (COLOVIĆ et al., 2019). Um estudo realizado por Azzaniga et al. (2001) constatou que o cozimento por extrusão reduz eficazmente o teor de DON em farinha de milho contaminada, mas teve apenas sucesso parcial na descontaminação de AFB1. Comparativamente ao processamento térmico convencional, o uso de vapor superaquecido pode resultar em menores perdas por oxidação e maior eficiência energética durante a fabricação (ALFY et al., 2016).
4.5.1.6 Adsorventes
Uma das principais formas de combater as micotoxinas é a utilização de adsorventes. O mecanismo central de adsorção desses materiais envolve uma troca de cargas entre o adsorvente e a micotoxina. Contudo, devido às variações nas estruturas das micotoxinas, sua eficácia não é uniforme para todas elas (Brown et al., 1992). O ideal é que o adsorvente seja inerte e capaz de fixar as micotoxinas em sua superfície, sendo eliminado do organismo junto com as fezes. Essas medidas visam proteger a saúde animal e humana contra os efeitos nocivos das micotoxinas (Brown et al., 1992; Arellano & Rosas, 2008).
De acordo com Yiannikouris et al. (2004), a adsorção física, que engloba as interações de Var der Waals e hidrogênio, e química, que engloba ligação iônica ou covalente, são os principais mecanismos pelos quais os adsorventes se ligam às micotoxinas. No entanto, é crucial encontrar um equilíbrio nessa inclusão adsorvente, uma vez que níveis excessivos podem afetar as propriedades físicas da ração, comprometendo seu processamento e acessibilidade pelos animais.
Existem diferentes tipos de adsorventes utilizados para sequestrar micotoxinas, podendo ser classificados como inorgânicos e orgânicos. Os adsorventes inorgânicos são conhecidos por sua capacidade de adsorver micotoxinas específicas e são frequentemente escolhidos como suplementos alimentares devido ao seu custo relativamente baixo e à sua inércia em nível nutricional. No entanto, estudos mostram que esses adsorventes oferecem uma proteção limitada contra micotoxinas (Van Kessel & Hiang-Chek, 2001). Por outro lado, os adsorventes orgânicos de micotoxinas são compostos por polímeros à base de carbono. Exemplos incluem fontes vegetais de fibras, como casca de aveia, farelo de trigo, celulose, hemicelulose, pectina e extratos de parede celular de fermento. Estes materiais são biodegradáveis e apresentam a vantagem da baixa inclusão e grande área de superfície fornecida pela parede celular de fermentos (Dilkin & Mallmann, 2004). A escolha entre adsorventes inorgânicos e orgânicos depende das características específicas da produção animal e das necessidades de mitigação de micotoxinas em cada caso.
4.5.2 Métodos Químicos
Os métodos químicos são de certa forma eficientes para minimizar os efeitos das micotoxinas e possuem um custo acessível ao produtor. Entretanto o uso dessa técnica é alarmante não recomendada, visto que pode gerar metabólitos tóxicos, alterar o valor nutricional e palatabilidade da dieta, além da dificuldade de se trabalhar com esses produtos químicos s (PENG; MARCHAL; VAN DER POEL, 2018). É importante frisar que o uso de métodos químicos para combater micotoxinas não é autorizado na União Europeia (EUROPEAN COMISSION, 2006). Entretanto, não há informações claras no Brasil.
4.5.3 Métodos Biológicos
Os métodos biológicos para mitigação de micotoxinas são reconhecidos pela sua eficácia, especificidade, irreversibilidade e amigabilidade ambiental. Eles envolvem a triagem e isolamento de micro-organismos capazes de biotransformar micotoxinas específicas, assim como a utilização de materiais bioativos, como enzimas. De acordo com Liu et al. (2022), esses métodos são capazes de preservar as características nutritivas e sensoriais das substâncias tratadas.
A biodegradação das micotoxinas ocorre quando o grupo tóxico das moléculas é decomposto e destruído pelos metabólitos secundários produzidos por micro-organismos ou suas enzimas. Essa transformação biológica pode converter as micotoxinas em metabólitos menos ou não tóxicos, quando micro-organismos ou sistemas enzimáticos são aplicados em rações contaminadas (Liu et al., 2022).
A utilização de enzimas para degradar micotoxinas é uma alternativa promissora em relação aos microrganismos, devido à sua capacidade de catalisar reações químicas de forma altamente específica e eficiente. Essas enzimas oferecem vantagens em termos de segurança e facilidade de manuseio. No entanto, é importante notar que as enzimas são restritas a um substrato específico de micotoxina (Zhu et al., 2016).
Uma cepa de levedura foi identificada e nomeada Trichosporon mycotoxinivorans por sua capacidade de degradar as micotoxinas OTA e ZEA. Estudos demonstraram que a inclusão dietética dessa levedura bloqueia a supressão imune causada pela OTA em pintinhos de corte. Além disso, o T. mycotoxinivorans foi capaz de converter a ZEA em um metabólito não estrogênico, chamado ZOM-1, por meio da abertura do anel de ZEA. Este metabólito não apresentou atividade estrogênica in vivo e não interagiu com a proteína do receptor estrogênico in vitro (Politis et al., 2005; Vekiru et al., 2010).
5. CONCLUSÃO
A garantia de uma ração nutricionalmente adequada é essencial para o desenvolvimento e produção eficientes de aves de corte. No entanto, a presença de micotoxinas nessa ração representa um desafio significativo, capaz de desencadear efeitos adversos nas aves e gerar prejuízos para as indústrias de alimentação animal.
A contaminação por micotoxinas na ração não é um problema localizado, mas sim global, demandando esforços coordenados para sua mitigação. Além do impacto na saúde animal, a presença dessas toxinas representa também um risco para a saúde humana.
Embora estratégias de prevenção e métodos de limpeza e separação sejam amplamente utilizados e recomendados, sua eficácia é limitada diante da diversidade de micotoxinas e das condições práticas da indústria. Nesse contexto, os métodos de biotransformação, que empregam microrganismos ou enzimas, apresentam-se como alternativas promissoras. Esses métodos são ecologicamente viáveis e preservam as características nutricionais e sensoriais das matérias-primas tratadas.
No entanto, é crucial que sejam realizados estudos adicionais para aprimorar essas técnicas e identificar soluções eficientes para uma variedade mais ampla de micotoxinas. A busca por tecnologias mais ecológicas e inovadoras para o controle da contaminação por micotoxinas é fundamental para garantir a segurança alimentar e a proteção ambiental.
Em última análise, a adoção de medidas preventivas pelas indústrias de fabricação de rações é indispensável para reduzir a contaminação por micotoxinas. É essencial que essas empresas estejam atualizadas sobre os métodos de mitigação mais adequados para sua produção específica, contribuindo assim para a saúde e bem-estar tanto das aves quanto dos consumidores finais.
REFERÊNCIAS
ABPA. RELATÓRIO ANUAL. 2023. Disponível em: https://abpa-br.org/quem somos/abparelatorio-anual. Acesso em: 5 mar. 2024.
ALFY, Anto et al. Recent Developments in Superheated Steam Processing of Foods — A Review.. Critical Reviews in Food Science and Nutrition. [s. l.], v. 56, n. 13, p. 2191–2208, 2016..
ALLEN, NK et al. Aakhus-Allen S, Bates F. Effects of dietary zearelenone on finishing broiler chickens and young turkey poults. Poultry Science, p. 124-31, 1981.
ANTONISSEN, G et al. The impact of Fusarium mycotoxins on human and animal host susceptibility to infectious diseases. 2018, p. 430-452.
ARELLANO, J. L; ROSAS, I. G. Uso de Organoaluminosilicato para reducir el efecto tóxico de mezcla de Aflatoxinas y Zearalenona em la Producción de Huevo. ( In. SCUSSEL et. al. Atualidades em Micotoxinas e Armazenagem Qualitativa de Grãos II. Florianópolis: ABMAG, 2008. p.351- 355).
AZIZ, Nagy H. Control of Fusarium moulds and fumonisin B1 in seeds by gammairradiation. Food Contro, v. 18, n. 11, p. 1337-1342, 2007.
BANDO, E et al. Biomarcadores para avaliação da exposição humana às micotoxinas. J. Bras Patol Med Lab. v.43, p. 175-180, 2007.
BEZERRA,, V. S. As toxinas nos alimentos.. Embrapa,, 2007.
BOCK, RR et al. Death in broiler breeders due to salpingintis: Possible role of zearalenone. Avian Pathology, n. 15, p. : 495-502, 1986.
BRIYONES-REYES, et al. l. Zearalenone contamination in corn for human consumption in the state of Tlaxcala, Mexico. Food Chemistry. y, Tlaxcala, v. 100, n. 2, p. 693-698, 2007.
BROWN, T. P; ROTTINGHAUSGE, G. L; WILLIAMS, M. E. Fumonisin mycotoxicosis in broilers: Performance and patholog. Avian Dis. v.36, p.450-454, 1992.
BROWN, T. P; ROTTINGHAUSGE, G. L; WILLIAMS, M. E. Fumonisin mycotoxicosis in broilers: Performance and pathology. Avian Dis. v.36, p.450- 454, 1992 .
BRYDEN, Wayne L. Mycotoxin contamination of the feed supply chain: Implications for animal productivity and feed security. Animal Feed Science and Technology, v. 173, n. 1-2. 134–158 p, 2012.
BURTON, Emily et al. Sustainable Poultry Production in Europe. CABI, v. 3, 2016.
CANO-SANCHO, G. Biomonitoring of Fusarium spp. mycotoxins: perspectives for an individual exposure assessment tool. Food Science and Technology International, 2010. 16, 266-276.
CHAUDHARI, N et al. Receptores de sabor para umami: o caso de múltiplos receptores. Sou. J. Clin. NutR, 2009.
CHEN, J et al. .Production of the mycotoxin fumonisin B1 by Alternaria alternata f. sp. lycopersici. Appl. Environ. Microbiol, v. 58, p. 3928- 3931, 1992.
CHI, M. S et al. Effect of dietary zearalenone on growing broiler chicks. Poultry Science, v. 59, p. 531-536, 1980.
COLOVIC, Radmilo et al. . Decontamination of mycotoxin-contaminated feedstuffs and compound feed. 2019.
COULOMBE, R. A. Mycotoxins and phytoalexins.. Boca Raton: CRC Press, 1991, p. 103-143.
CRUZ, et al. . Investigação do gene p53 de frangos expostos às aflatoxinas [Investigation of p53 gene in poultries exposed to aflatoxins]Arq. Bras. Med. Vet. Zootec., v. [S. l.: s. n.], 2012.
CRUZ, F.G (Org.); RUFINO, J.P.F. Formulação e Fabricação de Rações (Aves, Suínos e Peixes). Manaus: Editora da Universidade Federal do Amazonas (EDUA), 2017. 92 p.
CRUZ, L. C. H. H. Micotoxinas: são importantes? Perspectiva latinoamericana. Rio de Janeiro: UFRRJ Editora, 1996. 261 p.
DILKIN, P; MALLMANN, C. A. Sinais clínicos e lesões causadas por micotoxinas. . In: 1 ANAIS DO XI ENCONTRO NACIONAL DE MICOTOXINAS, n. 2004. Anais […] Piracicapa-Sp.
DOERR, J. A et al. T-2 toxicosis and blood coagulation in young chickens. Toxicol and Appl Pharmacol. v.60, p.157-162, 1981.
DSM. Relevância das Micotoxinas na Produção de Frangos de Corte. Disponível em: https://www.dsm.com/anh/pt/challenges/improving-nutrition-and performance/mycotoxins.html. Acesso em: 2 mar. 2024.
EC, European Comission Regulation. DIRECTIVE 2002/32/EC. On undesirable substances in animal feed.. Official Journal of the European Communities, p. 01- 21, may. 2002.
EMBRAPA MILHO E SORGO. Diagnóstico dos Problemas e Potencialidades da Cadeia Produtiva do Milho no Brasil.. EMBRAPA, Sete Lagoas- MG, dez 2014.
FERREIRA, H. et al. Aflatoxinas: Um risco à saúde humana e animal.. Ambiência – Revista do Centro de Ciências Agrárias e Ambientais, v. 2, n. 1, p. 113-127, 2007.
FREIRE, F. C. O et al. Micotoxinas: importância na alimentação e na saúde humana e animal. 1ª ed. Embrapa Agroindustrial Tropical. 48 p, 2007.
FUMAGALLI, Francesca et al. toxins Integrated Mycotoxin Management System in the Feed Supply Chain: Innovative Approaches. 2021. Disponível em: https://doi.org/10.3390/toxins13080572. Acesso em: 10 abr. 2024.
GIACOMINI, L et al. desempenho e plumagem de frangos de corte intoxicados por aflatoxinas. Ciência Rural, Santa Maria, v. 36, n. 1, p. 234-239, 2006.
GIACOMINI, L et al. Desempenho e plumagem de frangos de corte intoxicados por aflatoxinas. Ciência Rural. https://doi.org/10.1590/S0103-84782006000100036.
HAMILTON, P. M; GARLICH, J. D. Aflatoxin as a possible cause of fatty liver syndrome in laying hens. . Poultry Science, v. 50, n. 3, p. 800-804, 1971.
HOFFMANS, Yvette et al. Factors during Production of Cereal-Derived Feed That Influence Mycotoxin Contents. 2022.
HUFF, F. J et al. progression of aflatoxicosis in broiler chickens. Poultry Science, v. 65, p. 1891- 1899, 1986.
KABAK, Bulent et al. Strategies to prevent mycotoxin contamination of food and animal feed: A review. . Critical Reviews in Food Science and Nutrition. , [s. l.], v. 46, n. 8, p. 593–619, 2006..
KABAK, Bulent. The fate of mycotoxins during thermal food processing. 2009.
KICHOU, F; WALSER, M. M. The natural occurrence of aflatoxin B1 in poultry feeds. Vet Hum Toxicol, v. 35, n. 2, p. .105-108, 1993.
KIPPER, M et al. Assessing the implications of mycotoxins on productive efficiency of broilers and growing pigs. Scientia Agricola, v. 77, 2020.
KOSICK, R et al. Multiannual mycotoxin survey in feed materials and feedingstuffs. Animal Feed Science and Technology, 2016.
KUIPER-GOODMAN. , T. Risk assemente of ochratoxin A: an update. Food additives and Contaminants, v. 13, 1996.
LEAL, M et al. . Effect of lycopene on lipid peroxidation and glutathione-dependent enzymes induced by T-2 toxin in vivo. Toxicology Letters. v. 109, p. 1-10, 1999.
LEDOUX, D. R et al. Effects of Fusarium moniliforme culture material containing known levels of fumonisin B1 on turkey poults. . Poultry Science, v. 71. 162 p, 1992.
LEE, YM et al. The effect of a perified water-soluble fraction of a Fusarium roseum “Graminearum” culture on reproduction of White Leghorn females. Poultry Science, p. ; 1077-1082, 1985.
LEESON, Steven; G., Gonzalo J. Diaz; SUMMERS, John D.. Poultry Metabolic Disorders and Mycotoxins. Guelph, Ont. : University Books, 1995. 352 p.
LEITE, J.L.B et al. Effect of pelleting and addition of enzymes and vitamins on the performance and advantage of energy and nutrients in broiler chickens from 1 to 21 days old. Revista Ciência Agrotécnica, v. 32, n. 4, p. 192-198.
LESSON, S; DIAZ, G. J; SUMMERS, J. D. Metabolic Disorders and Mycotoxins. University Books. Guelph, Ontario, Canada, 1995. 352 p.
LIU, M. T et al. Indirect Enzyme-Linked Immunosorbent Assay for the Mycotoxin Zearalenone. Applied and Environmental Microbiology, American Society for Microbiology, Washington, v. 50, n. 2, p. 332-336, 1985..
LIU, Meng et al. Invited review: Remediation strategies for mycotoxin control in feed. BioMed Central Ltd, 2022.
MACKEI, M et al. Cellular Effects of T-2 Toxin on Primary Hepatic Cell Culture Models of Chickens. Toxins,. v.12, n.1, p. 16, 2020.
MAGNOLI, Alejandra Paola; POLONI, Valeria Lorena; CAVAGLIERI, Lilia. Impact of mycotoxin contamination in the animal feed industry. Elsevier Ltd, 2019.
MALEKINEJAD, H et al. J. Species differences in the hepatic biotransformation of zearalenone. Veterinary Journal, v. 172, p. 96-102, 2006.
MALLMANN, C. A et al. Fumonisin b1 levels in cereals and feeds from southern brazil. Arq. Inst. Biol, v. 68, f. 1, 2001, p. 41-45.
MALLMANN, C. A et al. Micotoxinas em ingredientes para alimento balanceado de aves. In: : CONGRESO LATINOAMERICANO DE AVICULTURA, XX. 2007. Anais […] Porto Alegre, p. 191-204.
MAPA, Ministério da Agricultura Pecuária e Abastecimento. Instrução normativa nº 4, de 23 de fevereiro de 2017. Disponível em: www.gov.br/agricultura/pt br/assuntos/insumos-agropecuarios/insumos-pecuarios/alimentacao animal/arquivos-alimentacao-animal/InstruoNormativa04.2007.pdf.. Acesso em: 6 mar. 2024.
MARIN, et al. Mycotoxins: Occurrence, toxicology, and expoosure assessment. Food and Chemical Toxicology, v. 60, p. 218-37, 2013.
MARIN, S. et al. Mycotoxins: Occurrence, toxicology, and exposure assessment. S. l.: s. n., 2013.
MAZIERO, M. T; BERSOT, L dos S. Micotoxinas em alimentos produzidos no Brasil. Revista Brasileira de Produtos Agroindustriais, v. 12, p. 89-99, 2010.
MENORUCK, RA et al. Effects on turkey poults and chicks of rations containing corn invaded by Penicillium and Fusarium species. American Journal Veterinary Research, p. 551-555, 1970.
MERKLEY, J. W et al. Hepatic fatty acid profiles in aflatoxin-exposed broiler chickens. Poultry Science, v. 66, p. 59-64, 1987.
MIROCHA. Oestrogenic mycotoxins sinthe by, Fusarium: In: PUCHARSE, I.F.H. Mycotixins Amsterdam: Elsevier, 1974. 129 – 148. Elsevier.
MOURA, M. A et al. Effects of ochratoxin a in the leucocytes of broilers. Revista Brasileira de Ciência Avícola, v. 6, n. 6, p. 187- 190, 2005.
NIEVINSK, P. Trigo: do grão a farinha (uma revisão sobre deoxinivalenol).
2009 Trabalho de Conclusão de Curso – Universidade Federal do Rio Grande do Sul.
NORRED, W. P. . Fumonisins – mycotoxins produced by Fusariun moliniforme. J Toxicol Environ Health, v. 38, p. 309-328, 1993.
NORRED, W. P; VOSS, K. A. Toxicity and role of fumonisinsin animal diseases and human esophageal cancer. Journal of Food Protection,, v. 57, p. 522-527, 1994.
OSBORNE, D. J; HAMILTON, P. B. Decreased pancreatic digestive enzymes during aflatoxicosis. Poultry Science, v. 60, p. 1818-221, 1981.
PENG, W. X; MARCHAL, J. L.M; VAN DER POEL, A. F. B. Strategies to prevent and reduce mycotoxins for compound feed manufacturing. 2018.
PENG, W. X; MARCHAL, J. L.M; VAN DER POEL, A. F.B. Strategies to prevent and reduce mycotoxins for compound feed manufacturing. [S. l.]: Elsevier B.V., 2018. .
PERALI, C. Avaliação do desempenho da parede celular de leveduras como aditivo antimicotoxinas na intoxicação experimental por aflatoxina, zearalenona ou fumonisina. 2016. 65 p Tese – Universidade Federal Rural do Rio de Janeiro.
PESTKA, James J. Deoxynivalenol: Toxicity, mechanisms and animal health risks. Animal Feed Science and Technology, v. 137, n. 3-4. 283–298 p, 2007.
POLITIS, I et al. Uso de Trichosporon mycotoxinivorans para suprimir os efeitos da ocratoxicose no sistema imunológico de pintinhos de corte.. Britânico. Poult. Ciência. 2005; 46 :58–65.
PORFIRIO, L. C. Hematologia bioquímica e imunologia de aves experimentalmente intoxicadas com 0,04mg/Kg de Ochratoxina-A. 2002 Tese – Universidade Federal Rural do Rio de Janeiro.
POZZO, M. D et al. Impacto dos adsorventes de micotoxinas βeta-glucana ou montmorilonita sobre a fermentação ruminal de bovinos in vitro.. Acta Scientiae Veterinariae, v. 44, n. 1342, p. 1-6, 2016.
QURESHI, M. A; HAMILTON, T. B. Effect of fumonisin B1 on chicken macrophage functions in vitro . Poultry Science, v. 71, p. 104-102, 1992.
RELATÓRIO ANUAL. Sindicato Nacional da Indústria de Alimentação Animal, dezembro 2023. Disponível em: https://sindiracoes.org.br/wpcontent/uploads/2023/12/boletim_informativo_setor_dez23_vs_final_port_sindiracoe s.pdf.
ROSS, P. F et al. Production of fumonisins by Fusarium moniliforme and F.proliferatum isolates associated with equine leukoencephalomalacia and pulmonary edema syndrome in swine. Appl.Environ. Microbiol, v. 56. 1990, p. .3225-3226.
RYU, et al. Stability of Zearalenone during Extrusion of Corn Grits †Journal of Food Protection.. Journal of Food Protection, 1999.
SALGADO, Jorge David et al. . Grain harvesting strategies to minimize grain quality losses due to fusarium head blight in wheat. Plant Disease,. , [s. l.], v. 95, n. 11, p. 1448– 1457, 2011.
SALMAN, D. K .A; OSMARI, K. E; SANTOS, dos R. G. M. Manual prático para formulação de ração para vacas leiteiras. EMBRAPA, 2011.
SANTIN, et al. Micotoxinas do Fusarium spp. na avicultura comercia. Ciência Rural, Santa Maria, v. 31, n. 1, p. 185-190, 2000.
SANTURIO, J. M. In: III ENCONTRO TÉCNICO SOBRE AVICULTURA DE CORTE DA REGIÃO DE DESCALVADO. 1999. Anais […]. 1999, p. 28-45.
SANTURIO, J. M. Micotoxinas e micotoxicoses na avicultura. Revista Brasileira Ciência Avícola, v. 2, n. 1, p. 1-12, 2000.
SANTURIO, JM. Micotoxinas e Micotoxicoses na Avicultura. Revista Brasileira de Ciência Avícola, v. 2, n. 1, p. 01-12, 2000.
SAWHNEY, D. S; VADEHRA, D. V; BACKER, R. C. The metabolism of C aflatoxins in laying hens. Poultry Science, v. 52, p. 1302-1309, 1973.
SHEPARD, GS. Impacto das micotoxinas na saúde humana nos países em desenvolvimento.. Aditivos Alimentares e Contaminantes: Parte A , p. 146-151. ( https://doi.org/10.1080/02652030701567442).
SHEPHARD, G. S; THIEL, P. G; SYDENHAM, E. W. . Initial studies on the toxicokinetics of fumonisin B1 in rats. Food Chem. Toxicol, v. 30, p. 277-279, 1992.
SPINOSA, Helenice de Souza; GÓRNIAK, Silvana Lima; NETO, João Palermo. Toxicologia aplicada à medicina veterinária. 2a ed. São Paulo: Manoele, 2020.
STANDER, M. A et al. Screening of comercial hidrolases for degration of Ochratoxin A. Agric. Food. Chem, v. 48, p. 5736-5739, 2000.
STUDER-KOHR, I et al. The occurrence of Ochratoxin A in coffee. Food Chem. Toxicol, v. 33, n. 5, p. 341-355, 1995.
SÁVIO, P.O.L.O. Viabilidade do uso de adsorventes de micotoxinas na terminação de cordeiros texel em confinamento. Arapongas, 2018 Dissertação – Universidade Norte do Paraná.
TESSARI. . Efeitos da aflatoxina B1 e fumonisina B1 sobre os níveis séricos de aspartato amino-transferase e proteína total de frangos de corte. Arquivos do Instituto Biológico, São Paulo, v. 72, n. 2, p. 185-189, 2005.
THOMPSON, W. L et al. In vivo effects of T-2 mycotoxin on synthesis of proteins and DNA in rat tissues. Toxicol Appl Pharmacol, v. 105, n. 3, p. 483-491, 1990.
TIBOLA, Casiane Salete; FERNANDES, José Mauricio Cunha; GUARIENTI, Eliana Maria. Effect of cleaning, sorting and milling processes in wheat mycotoxin content. Food Control,. v. 60, p. 174–179, 2016. .
VAN KESSEL, T. F. M; HIANG-CHEK, N. Aflatoxin binders – how to get the best value for money.. International Poultry Production. Driffield, v.12, n.4, p.33-35. 2001.
VEKIRU, E et al. Clivagem de zearalenona por Trichosporon mycotoxinivorans em um novo metabólito não estrogênico.. Apl. Env. Microbiol. 2010; 76 :2353–2359.
WEBER, M et al. Effect of T-2 and HT-2 Toxin during the Growing Period on Body Weight,Lipid Peroxide and Glutathione Redox Status of Broiler Chickens. 2010. Disponível em: doi:10.2754/avb201079010027. Acesso em: 10 abr. 2024.
WYATT, R .D; SMITH, J. E; HENDENSON, R. S (eds). Mycotoxins and Animal Foods. Boca Raton: CRC Press, 1991, p. 553-605.
XU, , Ran et al. Nutritional impact of mycotoxins in food animal production and strategies for mitigation.. [S. l.]: BioMed Central Ltd, 2022.
YANG, L et al. Toxicity and oxidative stress induced by T-2 toxin and HT-2 toxin in broilers hepatocytes. Food and Chemical Toxicology, v. 87, p. 128-137, 2016.
YIANNIKOURIS, A; JOUANY, J-P. Mycotoxins in feeds and their fate in animals: a review. Animal Research, v. 51, p. 81-99, 2002.
YIANNIKOURIS, A; JOUANY, J. P. Mycotoxins in feeds and their fate in animals: a review. Animal Research. , Izatnagar, v.51, p.81-99, 2002..
ZAVIERO, D; CONTRERAS, m. Impacto de hongos y micotoxinas em las aves. Industria Avícola, Illinois,, v. 52, f. 7, 2005, p. 899-903.
ZHANG, k et al. Mycotoxins in infant/toddler foods breakfast cereals in the U.S retail market. Food additives and Contaminants: Part B, v. 11, p. 183-190, 2018.
ZHU, Yan et al. . Innovative technologies for the mitigation of mycotoxins in animal feed and ingredients-A review of recent patents. ( [S. l.]: Elsevier B.V., 2016. ). [OPAS], ORGANIZACIÓN PANAMERICANA DE LA SALUD. Micotoxinas. Washington, 1983. (Criterios de Salud Ambiental, 11)..
