INFLUENCE OF TEMPERATURE AND SALINITY ON LARVAL DEVELOPMENT OF CARDISOMA GUANHUM/LATREILLE, 1825 (DECAPODA, GECARCINIDAE) INLABORATORY
REGISTRO DOI: 10.5281/zenodo.12735156
Conholato Nicoli, F. A1
Loureiro Fernades, L. F.2
Nicoli, G. T.3
RESUMO: A influência dos efeitos da temperatura e da salinidade no desenvolvimento larval de Cardisoma guanhumi em condições de laboratório foi estudada. Fêmeas ovígeras foram coletadas nomanguezal da baía de Vitória (20023’59″S – 40 2 59·’), levadas ao laboratório e acondicionadasem aquários com água do mangue até a desova. Após a eclosão, 450 zoeas foram selecionadas eseparadas individualmente em recipientes contendo 50 ml de água do mar filtrada nas salinidades20, 25 e 30, sendo mantidos em temperaturas de 23°C. 25°C e 27°C, perfazendo um total de 50larvas por tratamento. O fotoperíodo foi de 12:12 hs (claro: e curo). A alimentação das larvas foifeita diariamente, utilizando náuplios de Artemia sp. recém-eclodidos. Houve uma variação deestágios larvais em todos os experimentos, onde foram encontrados de cinco a seis estágios de zoeae uma megalopa. as salinidades 25 e 30, o desenvolvimento até o estágio de zoea 5 foi melhorpara todas as variáveis analisadas (crescimento, sobrevivência e duração dos estágios). Nos estágiosfinais (zoea 6 e megalopa) as salinidades menores tiveram melhor efeito que nas demaissalinidades, principalmente no crescimento. Os resultados demonstram que, em condições delaboratório, as três salinidades utilizadas tiveram maior influência no desenvolvimento larval e noestágio de primeiro caranguejo de C. guanhumi do que as temperaturas, sendo a salinidade 25 e temperatura 25°C as melhores para o cultivo desta espécie.
PALAVRAS–CHAVE: Cultivo, Ecologia, Cardisoma guanhumi, Manguezal, desenvolvimento larval.
ABSTRACT: The influence of the effects of temperature and salinity on the larval development of Cardisoma guanhumi under laboratory conditions was studied. Ovigerous females were collected in the mangrove forest of Vitória Bay (20023’59″S – 40 2 59·’), taken to the laboratory and placed in aquariums with mangrove water until spawning. After hatching, 450 zoea were selected and separated individually in containers containing 50 ml of filtered seawater at salinities 20, 25 and 30, being kept at temperatures of 25°C and 27°C, totaling 50 larvae per treatment. 12 hours (clear: and cure). The larvae were fed daily, using newly hatched Artemia sp. nauplii. There was a variation of larval stages in all experiments, where five to six zoea stages were found. megalopa. At salinities 25 and 30, development up to zoea stage 5 was better for all variables analyzed (growth, survival and duration of stages). other salinities, especially during growth. The results demonstrate that, under laboratory conditions, the three salinities used had a greater influence on larval development and the first crab stage of C. guanhumi than temperatures, with salinity 25 and temperature 25°C being the best for the cultivation of this species.
KEYWORDS: Cultivation, Ecology, Cardisoma guanhumi, Mangrove, larval development.
1. INTRODUÇÃO
O desenvolvimento larval dos Brachyura apresenta dois tipos de larvas: zoea e megalopa, sendo a última o estágio anterior ao de primeiro caranguejo (pohIe et al 1999). O número de estágios larvais pode variar de uma única zoea (Goodbody, 1960) até em mais de dez zoeas (Brossi-Garcia & Rodrigues, 1993; Cuesta & Rodrigues, 1994), dependendo da espécie (pohle et al, 1999).
No primeiro estudo de desenvolvimento larval de C guanhumi em laboratório, realizado por
Costlow & Bookhout (1966), foram observados cinco estágios de zoea e um de megalopa. As zoeas têm apenas poucos milímetros de tamanho, porém com ótima capacidade natatória, usando ambos maxílipedes e o abdômen para proporcionar seus pulsos, já as megalopas nadam calmamente com o abdômen em posições verticais, usando apêndices abdominais para propulsão (Pohle et a1., 1999).
Esta capacidade de natação é um dos fatores que podem contribuir para o deslocamento das larvas para locais onde a temperatura e a salinidade sejam adequadas ao seu desenvolvimento, pois muitas espécies liberam suas larvas no interior do estuário as quais são transportadas para a região costeira, retomando na fase de megalopa ou pós-larva (Sandifer, 1975; Morgan, 1995).
Em caranguejos (braquiúros) estuarinos, sua distribuição e abundância são influenciadas pelo alimento disponível, adaptação às variações ambientais, a diversidade de habitats, entre outros fatores. A distribuição vertical das larvas e a existência de comportamentos de natação permitem utilizar diferencialmente as correntes de água (Spivak, 1997).
Durante seu ciclo de vida, os decápodos atravessam um período no qual os estágios larvais constituem uma parte significante do plâncton marinho (Negreiros-Fransozo et a1., 2002) e várias técnicas de cultivo foram aprimoradas, permitindo a criação de larvas de crustáceos decápodos sob condições controladas em laboratório, resultando em um aumento das descrições e comparações de fases larvais obtidas em laboratório recriando situações do ambiente natural (Costlow, 1965; Fransozo e Negreiros-Fransozo, 1986). O cultivo de larvas em laboratório tomou mais precisa a identificação de larvas coletadas no plâncton e através das descrições morfológicas é possível conhecer o número de estágios larvais e como fatores ambientais, dentre eles temperatura e salinidade podem afetar eu desenvolvimento no ambiente natural (Fransozo e Negreiros-Fransozo, 1986). Além disso as comparações feitas entre larvas obtidas em laboratório e as coletadas no plâncton frequentemente mostram variações nas características morfológicas ou no número de estágios larvais e algumas dessas variações são observadas em larvas de crustáceos, especialmente nas dos Brachyura (Costlow, 1965).
As larvas, durante o seu desenvolvimento, estão sujeitas às mais variáveis condições ambientais e estudos realizados em laboratório demonstram que fatore ambientais como salinidade (Fransozo & Negreiros-Fransozo, 1986; Negreiros-Fransozo & Franso o, 1990; Messerknecht et aI., 1991); temperatura (Anger, 1983; Gardner et al., 2004)· temperatura e salinidade (Costlow et al., 1962; Lárez et aI., 2000; Luppi et aI., 2003) e alimentação (Brick, 1974; Anger, 1984; Darwirs, 1984; Darwirs & Dietrich, 1986) afetam a duração do desenvolvimento e a sobrevivência das larvas de Brachyura.
Fotoperíodo e alimentação são alguns dos fatores importantes para o desenvolvimento de larvas meroplanctônicas, porém, a temperatura é considerada um fator chave controlando e direcionando a natação das mesmas e, também, é responsável pela duração das fases planctônicas (Anger, 1983). O efeito da temperatura não é suficiente para explicar alguns aspectos relacionados com a distribuição de algumas espécies e suas histórias de vida (Spivak, 1997). Em geral, larvas de Brachyura de águas estuarinas e costeiras, em áreas temperadas, tem sua maior abundância nos meses mais quentes do ano, devido principalmente à elevada temperatura e maior disponibilidade de alimento (Sandifer, 1973; Dittel & Epifanio, 1982; Lindley, 1998; Grabe, 2003). Os estágios de zoea se alimentam de uma larga variedade de organismos fito e zooplanctônicos e o tamanho é o fator determinante para a escolha do tipo de alimento (Pohle et aI, 1999).
Dentre os Brachyura, a família Gecarcinidae inclui vários dos chamados “caranguejos terrestres”, sendo que nesta família existem dez espécies pertencentes a quatro gêneros (Cabrera, 1966). Os Gecarcinidae têm ampla distribuição geográfica e caracterizam-se por apresentar maior predominância e número de espécies em regiões tropicais e subtropicais (Chubart et al., 2000) e tanto na fase larval como na fase adulta pode se estabelecer em habitats de diversas concentrações salinas em virtude de sua capacidade o osmorregulatória (Costlow e Bookhout, 1968; Kalber e Costlow, 1968). Em cultivos de larvas de crustáceos, esta capacidade osmorregulatória com o controle e manipulação da salinidade tem sido demonstrada em experimentos de tolerância a salinidades sendo este tipo de conhecimento durante o desenvolvimento das larvas é uma informação muito importante para tecnologia de cultivos (Kalber, 1970).
Dentre as espécies desta família, Cardisoma guanhumi Latreille. 1825 e destaca por sua ocorrência que vai da Flórida, passa pelas Bermudas, Golfo do México. América Central, Antilhas até a Costa Atlântica da América do Sul (Melo, 1996) e no Brasil. A área de ocorrência se estende entre os estados do Ceará até Santa Catarina (Branco, 1991). Esse caranguejo também se destaca por possuir uma alta porcentagem de carne, sendo utilizado na culinária em pratos típicos e de frutos do mar (Oshiro et al, 1999). O objetivo deste estudo foi verificar como os níveis de temperatura e da salinidade podem ser fatores influenciantes no desenvolvimento larval de Cardisoma guanhumi, avaliando seus efeitos no crescimento, sobrevivência e tempo de permanência nos estágios larvais.
2. MATERIAL E MÉTODOS
2. 1. Coleta das fêmeas
Fêmeas ovígeras de Cardisoma guanhumi foram obtidas no manguezal da Universidade Federal do Espírito Santo na baía de Vitória (20023’59″S – ~0~2’56 ‘W), Vitória – ES, levadas ao laboratório de cultivo de organismos marinhos e colocadas em aquário com água do mangue constantemente aerada. As fêmeas foram aliment1das diariamente com folhas de rizóforas, evitando que os ovos e larvas fossem predados. As larvas utilizadas em todos os experimentos foram todas obtidas da desova de urna única fêmea para reduzir a variabilidade genética.
2.2. Cultivos
Para o estudo do ciclo de desenvolvimento larval e da influência da temperatura e salinidade, foram selecionadas 150 zoeas recém eclodidas para cada experimento perfazendo um total de 450 larvas.
Os experimentos foram realizados nas temperaturas de 23ºC ± 1ºC, 25ºC ± 1ºC e 27ºC ±1ºC,
sendo as duas primeiras mantidas com auxílio de incubadoras refrigeradas e a última com ar
condicionado, onde foram feitos controle e ajuste diário da temperatura.
Para os testes de tolerância às diferentes salinidades (20, 25 e 30), a água utilizada foi obtida na praia de Itapoã em Vila Velha-ES, uma região considerada pouco impactada. A água foi filtrada utilizando-se filtro Millipore GF/F de 47 mm de diâmetro para reter a matéria orgânica em suspensão. As diferentes salinidades foram obtidas através da diluição da água do mar com água destilada ajustadas com auxílio de um refratômetro modelo Atago.
Com a finalidade de verificar as taxas de sobrevivência e/ou mortalidade de cada grupo, distribuídas entre as diferentes temperaturas, em cada recipiente foram colocados 50 ml de água do mar filtrada e urna larva, sendo 50 recipientes em salinidade 20, 50 recipientes em salinidade 25 e 50 recipientes em salinidade 30.
A água dos recipientes individuais foi trocada diariamente fazendo-se um acompanhamento das mudanças de estágio (Zoea 1 para Zoea 2 … etc) através das exúvias (mudas) deixadas pelas larvas nos recipientes. Após a confirmação da mudança de estágio cada exúvia foi levada ao microscópio óptico marca Studar para medição, utilizando uma escala micrométrica previamente calibrada. As medidas exúvias foram feitas a partir do início do abdômen até o final do telson, pois a região do cefalotórax dos organismos frequentemente se rompe durante a muda. O experimento foi mantido até a metamorfose do estágio de me galopa para o primeiro caranguejo.
Em todos os experimentos os recipientes foram mantidos em um fotoperíodo de 12:12 h (claro:escuro). Após a troca diária de água, as larvas foram alimentadas com náuplios de Artemia sp.recém-eclodidos, os quais foram colocados em abundância.
2.3. Tratamento dos dados
Foi utilizado o teste ANOVA para comparar os tamanhos médio das larvas segundo dois fatores de variação (salinidade e temperatura). A ANOVA faz comparações globais (todas as temperaturas juntas ou todas as salinidades juntas). Para medir diferenças de médias entre as temperaturas ou as salinidades, foi utilizado o teste de Duncan. Na análise de sobrevivência utilizou-se a curva de sobrevivência de Kaplan-Meyer para todos os dados obtidos nas diferentes salinidades e temperaturas.
Para comparar as curvas de sobrevivência nos três valores de temperatura e salinidade, foi calculado o teste de hipóteses Log-Rank. Todos os testes foram realizados no programa SPSS versão 8.0 para Windows e o nível de significância adotado foi de 5%.
3. RESULTADOS
3.1. Análise de sobrevivência
No total, 450 larvas foram utilizadas no cultivo, sendo que 326 larvas foram selecionadas para as análises estatísticas. A influência da temperatura e salinidade utilizadas tiveram efeito variado com relação aos diferentes estágios larvais sendo em geral, os maiores números de mortalidade na mudança de zoea 1 para zoea 2 e zoea 5 até megalopa (Tabela 1).
Após 163 das 326 larvas chegarem a zoea 5, ou seja, 50%, 124 larvas passaram por zoea 6 e 31 larvas não passaram pelo sexto estágio chegando direto a megalopa (Tabela 1). Das 124 larvas que chegaram a zoea 6, menos da metade (55 larvas) atingiram o estágio de megalopa e ao final do experimento, 86 larvas (26,38% das 326) permaneceram vivas até o estágio de caranguejo 1 (Tabela 1).
Foi calculada a curva de sobrevivência de Kaplan-Meyer considerando todos os dados obtidos ao final do experimento. Os dados censurados mostram as larvas que permaneceram vivas até o estágio de megalopa (Figura 1). O tempo médio de sobrevivência, ou seja, o tempo de permanência nos estágios foi de 25,96 dias (com intervalo de confiança de 95% entre 23,77 a 28,14 dias). O tempo mediano foi de 27 dias (com intervalo de confiança de 95% entre 24,02 e 29,98 dias), isto quer dizer que 50% das larvas sobreviveram até 27 dias. Em to.mo de trinta dias metade das larvas morreram. O experimento durou em tomo de 68 dias com todos os sobreviventes atingindo o estágio de megalopa, que estão mostrados através dos dados censurados (Figura 1).
3.1.1. Salinidade
Os resultados apresentados na figura 2 mostram a curva de sobrevivência de Kaplan-Meyer para cada salinidade sendo os dados censurados as larvas que permaneceram vivas até o estágio de megalopa. Através do teste de hipóteses Log Rank foi determinada diferenças estatisticamente significantes entre as curvas de sobrevivência e o resultado indicou diferença significativa entre as salinidades (LR = 22,35; p = 0000).
A sobrevivência na salinidade 20 foi menor que nas demais salinidades, independente do efeito da temperatura e salinidade e “O mantiveram- e próximas até o 25° dia, com uma taxa de sobrevivência maior que na salinidade 20. Em tomo do 41° dia a taxa de sobrevivência na
salinidade 25 foi menor em relação à salinidade 30 (Figura 2).
Com relação às combinações de temperaturas e salinidades, na salinidade 25 foi onde ocorreu a maior porcentagem de sobreviventes ao longo do experimento junto com a temperatura 23°C para todos os estágios. A única exceção ocorreu na temperatura 27°C, onde a maior porcentagem de sobreviventes foi na salinidade 30 (Figura 3).
Juntamente com as análises de sobrevivência, foi possível obter uma análise do tempo médio cumulativo de permanência das larvas para cada salinidade. Os resultados mostram que as larvas permaneceram uma maior média de tempo vivas na salinidade 25 e menor na salinidade 20. Os intervalos de confiança dos limites inferiores (LI) e limites superiores (LS), tanto das médias quanto das medianas, mostram a confiabilidade dos dados (Tabela 2).
3.1.2. Temperatura
As curvas de frequência relativa de sobrevivência de Kaplan-Meyer para as diferentes temperaturas estão mostradas na figura 4, onde foi realizado o teste de hipóteses Log Rank para determinar diferenças estatisticamente significantes entre as curvas de sobrevivência. Não houve diferença significativa entre as temperaturas (LR = 3,05; P = 0,2180) indicando que os resultados obtidos a partir das temperaturas utilizadas não são considerados estatisticamente diferentes.
A temperatura 25 apresentou uma taxa de sobrevivência maior até a metade do experimento, tendo uma considerável diminuição durante um período do experimento, permanecendo depois com uma taxa de sobrevivência equivalente as temperaturas 23°C e 27°C. Estas temperaturas tiveram uma taxa de sobrevivência similar até por volta do 10° dia, passando a temperatura 23°C ter uma taxa de sobrevivência maior e ao [mal do experimento todas as temperaturas se aproximaram (Figura 3).
Nas combinações das temperaturas com as salinidades, a temperatura que obteve a maior porcentagem de larvas vivas durante as mudanças de estágio foi 25°C (Figura 5). Este resultado corrobora com as análises do tempo médio cumulativo de permanência das larvas, onde a temperatura 25°C foi também onde ocorreu a maior média de tempo de permanência nos estágios, com os limites inferiores (LI) e superiores (L) mostrando uma confiabilidade considerável (Tabela 3). As demais temperaturas tiveram suas médias próximas.
3.2. Tempo de permanência nos estágios
A maior média foi de 68,2 dias na. temperatura 25°C e salinidade 20 nos casos em que ocorreram o sexto estágio, já as larvas que não passaram pelo sexto estágio tiveram em média 50,2 dias, e o menor tempo foi das zoeas que estavam na temperatura 23°C e salinidade 25 com 37,6 dias para chegarem a megalopa. A média total de dias entre as que tiveram seis estágios e as que não tiveram mostra que houve uma diferença de 6,3 dias, ou seja, quando as larvas passam por zoea 6 levam mais tempo até atingirem megalopa (Tabela 4).
O teste de Duncan mostrou que para cada estágio, tanto temperatura quanto salinidade, os
resultados indicam diferenças significantes. Houve uma variabilidade destas significâncias para cada zoea. As temperaturas foram significantes em todos os estágios, a salinidade apenas nas zoeas 3, 4, 5 e as combinações apresentaram diferenças significantes em megalopa (Apêndice 1).
3.3. Crescimento das larvas
3.3.1. Zoea 1
O primeiro estágio de zoea apresentou um tamanho maior, média de 1,20 mm, na temperatura de 27°C e a salinidade 25. Nesta mesma temperatura e na salinidade 20, observou-se o menor crescimento das larvas (0,93 mm). Nas outras salinidades e temperaturas as larvas tiveram um crescimento médio de 1,03 mm a 1,15 mm (Figura 6). A ANO~A mostrou significância (p < 0,05) entre as diferentes salinidades e temperaturas indicando que no estágio de zoea 1, esses dois fatores são fundamentais para o crescimento (Apêndice 2).
3.3.2. Zoea 2
O segundo estágio, a ANOVA mostrou que não houve diferença significativa entre as salinidades (p = 0,642), indicando que este fator teve pouca influência no crescimento, em contraposição, a temperatura foi um fator significante (p < 0,05) em todos os experimentos (23°C, 25°C e 27°C) (Apêndice 2). A temperatura de 25°C, resultou em uma média maior de crescimento (1,40 mm). O menor crescimento ocorreu nas temperaturas 23°C e 27°C e salinidade 30, com tamanhos de 1,18 mm e 1,16 mm, respectivamente (Figura 6). Os resultados mostram que a temperatura foi o fator determinante para o crescimento da zoea 2.
3.3.3. Zoea 3
Em zoea 3, com relação as diferentes temperaturas e salinidades, o teste estatístico ANOVA evidenciou que houve significância entre estas (p < 0,05) (Apêndice 2), sendo a temperatura 25°C e salinidade 25 as que favoreceram o maior crescimento, com uma média de 1,63 mm (Figura 6). Os comprimentos atingidos pelas zoeas 3 mostraram médias de crescimento. próximas, em tomo de 1,52 mm, sendo que nas salinidades 30 e temperatura 23°C o crescimento foi menor (Figura 6).
3.3.4. Zoea 4
No quarto estágio, as diferentes temperaturas foram os únicos fatores estatisticamente significantes para o crescimento da zoea (p < 0,05) (Apêndice 1). As temperaturas 25°C e 27°C, em conjunto com a salinidade 25, foram as que apresentaram maior influência no crescimento das larvas, as quais tiveram um crescimento médio de 1,88 mm (Figura 7). Os menores tamanhos ocorreram na salinidade 30, independente da temperatura. As variações de salinidade, segundo a ANOVA, não foram significantes (p = 0,120) indicando a pouca influência da salinidade para o crescimento das zoea 4 (Apêndice 2).
3.3.5. Zoea 5
O tamanho de zoea 5 ficou, em média, 2,08 mm (Figura 7). O teste estatístico ANOVA mostrou que não há variação significativa (p > 0,05) em todas as temperaturas e salinidades utilizadas separadamente ou juntas, indicando que do estágio de zoea 4 para o estágio de zoea 5, nenhum dos fatores analisados tiveram efeito significativo sobre o crescimento (Apêndice 2). O menor tamanho, que foi de 1,74mm, foi obtido na temperatura 23°C e salinidade 20. Em outras salinidades e temperaturas, os comprimentos registrados foram semelhantes (Figura 7).
3.3.6. Zoea 6
O maior crescimento da zoea 6 (2,38 mm) ocorreu na temperatura 27°C e salinidade 20, sendo o tamanho mínimo de 1,47 mm na temperatura 23°C e salinidade 25 (Figura 8). O teste estatístico ANOVA mostrou que houve significância dos dados em ambas variáveis separadamente (p < 0,05), pois juntas a temperatura e salinidade não mostraram significância (p = 0,10) (Apêndice 2).
3.1.7. Megalopa
Neste último estágio larval, a análise estatística ANOVA (p < 0,05) mostrou que somente as temperaturas, separadamente das salinidades, foram significantes para o crescimento (Apêndice 1). Porém, os dados mostram que foi na salinidade 20 e temperatura 23°C onde ocorreu o maior crescimento das megalopas, as quais atingiram o comprimento máximo de 2,12 mm. Nas salinidades e temperaturas mais altas, o comprimento máximo foi de 1,30 mm, sendo os valores médios dos tamanhos muito próximos (Figura 8). Os resultados obtidos mostram que as temperaturas e salinidades menores favorecem o crescimento das megalopas até atingirem o estágio do primeiro caranguejo.
4. DISCUSSÃO
No primeiro cultivo de C. guanhumi em laboratório, feito por Costlow & Bookhout (1966), foram encontrados cinco estágios de zoea e uma megalopa. o pre ente trabalho, dentre as larvas que completaram o desenvolvimento larval em laboratório, houve variação na quantidade de estágios, sendo registrados cinco a seis estágios de zoea e uma megalopa. O sexto estágio corrobora com os estudos de Schubart et al. (2000), sobre relações filogenéticas entre Gecarcinidae e Grapsidae da América continental, que baseados na seqüência do DNA, o desenvolvimento larval das espécies do gênero Cardisoma é planctônico-marinho e composto de seis estágios.
A diferença de estágios observada entre o primeiro cultivo desta espécie e o presente estudo pode ser atribuída em parte aos efeitos da temperatura e salinidade, como observado por Sandifer (1973) onde larvas de uma mesma espécie podem ter o número de estágio variado, devido às condições em que são expostas. Podendo ser considerado então este fator, a explicação para esta variabilidade de estágios encontrada em larvas de C. guanhumi, onde as mesmas foram expostas a diferentes temperaturas e salinidades.
Variações na quantidade de estágios tem sido observada por diversos autores. Em Armases rubripes, Diaz & Ewald (1968) no estuário de Maracaibo, Venezuela, observou quatro estágios de zoea e uma megalopa. De acordo com Montú et al. (1990) na região de Pontal do Sul, no Brasil, essa espécie passa por cinco estágios de zoea e uma megalopa, antes de atingirem a fase de caranguejo 1. Esses autores sugerem ainda, que o número de estágios de desenvolvimento depende principalmente de fatores genéticos. Diferenças no número de estágios larvais também foi observado por Costlow (1965) em 40% a 63% das larvas de Callinectes sapidus, criados em laboratório. Este autor observou também que diversas larvas atingiram a fase de megalopa após seis estágios de zoea e outras larvas atingiram o estágio de me galopa após oito estágios de zoea.
O tempo médio total das larvas que passaram por cinco estágios e as que passaram por seis estágios teve uma diferença de seis dias, sendo que as larvas que passaram por zoea 6 tiveram uma média maior (49,9 dias) do que as que passaram por cinco estágios. Isto não difere do que foi encontrado para Armases rubripes. onde as larvas desta espécie, que e desenvolveram mais lentamente, foram as que tenderam a passar por um estágio a mais do que o anteriormente relatado por Dias & Ewald (1968). No de desenvolvimento larval de C. guanhumi os resultados indicam que o crescimento demonstra ser compensado durante o período de mudança de fase se há uma alteração no número de estágios de zoea, sendo que larvas que passaram por zoea 6 tiveram megalopas maiores em relação as que tiveram cinco estágios, indicando uma diferença significativa nesta última fase larval.
A variação de estágio foi observada em todas as combinações de temperaturas e salinidades
utilizadas. Durante os cultivos foram observados que para cada estágio de desenvolvimento larval de C. guanhumi, as diferentes temperaturas e salinidades tiveram um efeito variado no crescimento, sobrevivência e tempo de permanência nos estágios larvais, para cada combinação de temperatura e salinidade a qual estavam sujeitas, sendo a salinidade separadamente da temperatura o único fator que foi estatisticamente significante para a sobrevivência. A salinidade pode ser considerada um fator muito importante, pois a menor salinidade pode inibir ou dificultar o desenvolvimento larval de muitas espécies de Brachyura (Femandes et al., 2002; González-Gordillo & Rodrigues, 2003), porém em geral, larvas de caranguejos braquiúros possuem adaptações osmorregulatórias decorrentes das mudanças de salinidade (Sastry, 1983), as quais podem variar durante o seu desenvolvimento (Kalber, 1970). Em Ucides cordatus, braquiúro típico de mangue, a salinidade é um fator importante no seu desenvolvimento pós-embrionário, influenciando tanto na mortalidade quanto na duração dos diferentes estágios larvais (Rodrigues, 1982).
Estudos ecológicos que enfatizam a influência de fatores ambientais e o desenvolvimento larval de crustáceos mostram que os efeitos de diferentes salinidades podem ser variáveis (Negreiros-Fransozo & Fransozo, 1990). A tolerância a salinidades variadas, como pode ser observado para vários caranguejos estuarinos, aumentaria o número de ambientes que caranguejos juvenis e adultos poderiam explorar, seja na busca por alimento ou para escapar de predadores (Costlow & Bookhout, 1968).
Nas larvas de C. guanhumi cultivadas na salinidade 20, verificou-se que a porcentagem de sobreviventes é menor, podendo indicar que após a desova, as larvas têm preferência por águas com salinidades maiores. No desenvolvimento larval completo de Mithrax caribbaeus, que é capaz de suportar altas salinidades, onde três temperaturas (22, 25 e 28°C) e três salinidades (32, 35 e 38) também foram utilizadas, a salinidade teve um maior efeito na porcentagem de sobrevivência de cada estágio larval e do desenvolvimento completo até o estágio do primeiro caranguejo (Lárez et al., 2000). Espécies cujos adultos estão limitados às águas oceânicas só completam sua metamorfose em faixas de salinidades altas, e em relação à duração do desenvolvimento, nestes mesmos animais, a salinidade geralmente não provoca qualquer alteração (Costlow e Bookhout 1962).
O crescimento das larvas de C. guanhumi foi analisado individualmente de acordo com a medição das exúvias de cada estágio. Os testes estatísticos mostraram que, em alguns estágios, a salinidade não teve influência, indicando que a temperatura pode ser um fator mais determinante do que a salinidade no desenvolvimento. Nas análises de sobrevivência, entre as diferentes salinidades usadas, a salinidade 30 e 25 tiveram um efeito maior na maioria dos estágios, indicando que as larvas permanecem mais tempo vivas em salinidades maiores. Quando avaliamos fatores como crescimento, relacionando-o com tempo de permanência nos estágios, nota-se que há uma variação de efeitos tanto para as temperaturas quanto para as salinidades. Para alguns estágios como zoea 1, maior tempo de permanência implicou em maior crescimento, já em zoea 2 o maior crescimento ocorreu quando as larvas permaneceram menos dias neste estágio. Para o estágio de megalopa, os testes estatísticos mostraram que a salinidade não influenciou significantemente no crescimento, porém, na salinidade 20 é claramente notado o melhor desenvolvimento deste estágio. Em geral, o crescimento de larvas meroplanctônicas é acompanhado por mudanças no desenvolvimento em níveis fisiológicos, bioquímicos, morfológicos, comportamentais e ecológicos, os quais são influenciados pelas variações físico-químicas do ambiente (Anger, 1998).
Todas as larvas que chegaram a megalopa atingiram o estágio de primeiro caranguejo onde, nas análises de sobrevivência, o percentual foi de 100,00%, indicando que as combinações de temperatura e salinidade utilizadas não foram fatores que influenciaram negativamente nesta metamorfose. Isto pode ser explicado pelo fato de que os efeitos da temperatura e da salinidade diminuem com o avanço do desenvolvimento e poderia ser considerada uma vantagem para as megalopas, porque elas trocam de organismos pelágicos para um estilo de vida bentônico, devendo ter a capacidade de suportar as constantes mudanças de temperatura e salinidade (Lárez et aI., 2000). De acordo com Sandifer (1973), o sucesso de uma espécie de Decapoda, quando exposta a diferentes ambientes, pode depender da habilidade da larva para sobreviver, até mesmo quando exposta frequentemente a altas temperaturas e diferentes condições de salinidades.
Luppi et al. (2003) estudando as larvas de Armases rubripes no estuário do Rio de La Plata, verificaram que a temperatura e, principalmente. a salinidade, são os fatores que influenciam a distribuição das larvas. agindo em muito caso como barreiras geográficas na sua distribuição. Em decorrência da procura de um ambiente adequado para o desenvolvimento larval ocorre o processo de dispersão. Esse processo foi observado em larvas de Ucide cordatus no estuário do rio Caeté, no norte do Brasil, onde as larvas no estágio de zoea foram exportadas para águas costeiras, permanecendo três a quatro semanas para completar seu desenvolvimento e reinvadindo as águas estuarinas no estágio de megalopa (Diele, 2000). E se processo de dispersão ainda não foi observado em larvas de C. guanhumi, porém, com base nos resultados obtidos em laboratório pode-se inferir como as larvas se comportam em seu ambiente natural.
Com os procedimentos usados neste estudo para verificar a influência da temperatura e salinidade no desenvolvimento larval de C. guanhumi pode ser concluído que, para cultivar esta espécie em laboratório, é recomendado utilizar a temperatura 25°C e salinidade 25. Em qualquer estudo, para que se possa analisar o número de estágios larval ou a freqüência de mudança de estágio, é uma grande vantagem poder manter larvas individualmente separadas. Em estudos experimentais, larvas distribuídas em compartimentos diferentes podem ser dadas substâncias químicas diferentes ou alimentações diferentes. e podem ser colocadas em diferentes temperaturas ou condições de iluminação (Rice & Williamson, 1970).
A ordem Decapoda é um grupo relevante de organismos marinhos não somente devido a sua importância econômica, mas também por seu papel em sistemas marinhos Negreiros-Fransozo et al., 2002). Conforme Ong & Costlow (1970); Fransozo & Negreiros-Fransozo (1986) o estudo do desenvolvimento larval, principalmente de espécies ameaçadas de desaparecer de seu ambiente natural, pode fornecer valiosos subsídios para futuras criações de espécies de interesse econômico, no sentido de estabelecer as melhores condições de laboratório para a larvicultura, com a finalidade de repovoamento da espécie, principalmente das espécies que vivem em regiões estuarinas.
5. Referências
Anger, K. 1983 Temperature and the larval development of Hyas araneus L. (Decapoda: Majidae); extrapolation of laboratory data to field conditions. Journal of Experimental Marine Biology and Ecology 66, 159-176.
Anger, K. 1984 Influence of starvation 00 mouth cyc1e and morphogenesis of Hyas araneus larvae (Decapoda: Majidae). Hegolânder Meeresuntersuchungen 38, 21-33.
Anger, K. 1998 Patterns of growth and chemical composition in decapod crustacean larvae. Invertebrate Reproduction and Development 33 (2-3), 159-176.
Branco, J. O. 1991 Aspectos ecológicos dos Brachyura (Crustacea: Decapoda) no manguezal do ltacorubi, SC – Brasil. Revista Brasileira de Zoologia. 7 (1-2): 165-179.
Brick, R. W. 1974 Effects of water quality, antibiotics, phytoplankton and food on survival and development oflarvae of Scylla serrata (Crustacea: Portunidae). Aquaculture 3, 231-244.
Brossi-Garcia, A. L. & Rodrigues, M. D. 1993 Zoeal morphology of Pachygrapsus gracilis (Sausurre, 1858) (Decapoda, Grapsidae) reared in the laboratory. Invertebrate Reproduction and Development 24, 197-204.
Cabrera, J. J. A. 1966 EI primer estadio zoea en Gecarcinus Lateralis (Freminville) (Brachyura
Gecarcinidae) Procedente de VeraCruz, México. An. Inst. Biol. Univ. Mex. 36: 173-187.
Costlow, J. D. Jr. 1965 Variability in larval stages of the blue crab, Callineetes sapidus. Biol. Bull, 128: 58-66.
Costlow, J. D. Jr. & Bookhout, C. G. 1962 The larval development of Hepatus epheliticus (L.) under laboratory conditions. J Elisha Mitchel Sei. Soe., 78: 113-125.
Costlow, J.D. Jr. & Bookhout, C.G., 1966 The complete larval development of the land-crab, Cardisoma Guanhumi Latreille in the laboratory (Brachyura, Gecarcinidae). National Scienee Foundation 2 9- 69.
Costlow, J. D. JI. & Bookhout, C. G. 1968 The effect of environmental factors on the development of the land crab Cardisoma guanhumi Latreille. Am. Zoologist., 8: 399-410.
Costlow, J. D. Jr., Bookhout, C. G. & Monroe, R. 1960 The effects of salinity and temperature on larval development of Sesarma cineriun (Bose) reared in the laboratory. BoI. Bull., 118(2): 183-202.
Costlow, J. D. JI., Bookhout, C. G. & Monroe, R. 1962 salinity and temperature effects on larval development ofthe crab Panopeus herbstii Milne-Edwards, reared in the laboratory. Physiological Zoology 35, 79-93.
Cuesta, J. A., Rodríguez A 1994 Early zoeal stages of Pachygrapsus marmoratus (Fabricius), P. transverses (Gibbes) and P. maurus (Lucas) (Decapoda, Brachyura, Grapsidae) reared in thelaboratory. Scentia Marina, 58\; 323-327.
Dawirs, R. R. 1984 Influence of starvation on larval development of Carcinus maenas L. (Decapoda: Portunidae). Journal of Experimental Marine Biology and Ecology 80, 47-66.
Dawirs, R. R. & Dietrich, A 1986 Temperature and laboratory feeding rates in Carcinus maenas L. (Decapoda: Portunidae) larvae from hatching through metamorphosis. Journal of Experimental Marine Biology and Ecology 99, 133-147.
Diaz, H. & Ewald, J. J. 1968 A comparison of the larval development of Metasersarma rubripes (Rathbun) and Sesarma ricordi H. Milne Edwards (Brachyura, Grapsidae) reared under similar laboratory condictions. Crustaceana (Suppl. 2). 225-248.
Diele, K. 2000 Life History and population structure of the exploited mangrove crab Ucides cordatus (L.) (Decapoda: Brachyura) in the Caeté estuary, North Brazil. Zentrum fur Marine Tropenôlologie 9, 103 pp.
Dittel, A L & Epifanio, C. E. 1982 Seasonal abundance and vertical distribution of crab larvae in Delaware Bay. Estuaries 5, 197-202.
Femandes, L. D. A, Bonecker, L. C. & Valentin, J. L. 2002 Dynamic of decapod crustacean larvae ou the entrance of Guanabara Bay. Brazilian Archives of Biology and Technology 45 (4), 491-498.
Fransozo, A. & egreiros-Fransozo, M. L. 1986 Influência da salinidade no desenvolvimento larval de Eriphia gonagra (Fabricius, 1781) e Sesarma (holometopus) rectum randall, 1840 (Crustácea, Decapoda), em Laboratório. Revista Brasileira de Zoologia, 46(2) : 439-446, Rio de Janeiro/RJ.
Gardner, C., Maguire, G. B. & Williams, H. 2004 Effects ofwater temperature and thermoclines on larval behavior and development in the giant crab Pseudocarcinus gigas (Lamarck). Journal of Plankton Research 26 (4), 393-402.
González-Gordillo, J. L & Rodriguez, A. 2003 Comparative seasonal and spatial distribution of decapod larvae assemblages in three coastal zones of the south-western Iberian Penisula. Acta Oecologica 24, S219-S233.
Goodbody, L 1960 Abreviated development in a Pinnotherid crab. Nature, 185: 704-705.
Grabe, S. A. 2003 Seasonal periodicity of decapod larvae and population dynarnics of selected taxa in New Hampshire (USA) coast waters. Journal ofPlankton Research 25 (4),417-428.
Kalber, F. A. 1970 Osmorregulation in decapod larvae as a consideration in culture techniques. Helgol. Wiss. Meeresunters, 20: 697-706.
Kalber, F. A. & Costlow, J. D. Jr. 1968 Osmorregulation in larvae of the land crab, Cardisoma guanhumi (Latreille). Am. Zoologist 8: 411-416 p.
Lárez, M. B., Palazón-Fernández, J. L. & Bolafios, C. J. 2000 The effect of salinity and temperature on the larval development of Mithrax caribbaeus Rathbun, 1920 (Brachyura: Majidae) reared in the laboratory. Journal of Plankton Research 22 (10), 1855-1869.
Lindley, J. A. 1998 Diversity, biomassa, and production of decapod crustacean larvae in a changing environment. Invertebrate Reproduction and Development 33 (2-3),209-219.
Luppi, T. A., Spivak, E. D. & Bas, C. C. 2003 The effects of temperature and salinity on larval development of Armases rubripes Rathbun, 1987 (Brachyura, Grapsoidea, Sesarmidae), and the southem limit of its geographical distribution. Estuarine Coastal and ShelfScience (58), 575-585.
Melo, G. M. S. 1996 Manual de Identificação dos Brachyura (Caranguejos e Siris) do Litoral Brasileiro. São Paulo: Plêiade/FAPESP, 604 pp.
Messerknecht, L, Montú, M. & Anger, K. 1991 Larval development and salinity tolerance of brazilian Eurytium limosum (Say, 1818) (Brachyura, Xanthidae) reared in the laboratory. Meeresforschung 33,275-296.
Montú, M., Anger, K., & Bakker, C. 1990 Variability in the larval development of Metasersarma rubripes (Decapoda, Grapsidae) reared in laboratory. Neritica. Pontal do Sul. P R S, 113-128.
Morgan, S. G. 1995 Life and death in the planlcton: larval mortality and adaptation. In: L. R.
McEdward (Ed.) Ecology of Marine Invertebrate Larvae. ew York: CRC Marine Science Series, p.279-321.
Negreiros-Fransozo, M. L. & Fransozo, A. 1990 The effect of salinity on the post – embryonic development of Panopeus americanus Sausurre, 1857 and Eurypanopeus abbreviatus (Stimpson, 1860) (Crustacea, Xanhidae). Atlântica 12 (2), 95-104.
Negreiros-Fransozo, M. L., González-Gordillo, J. L & Fransozo, A. 2002 First larval stage of Exhippolysmata oplophoroides (Holthius, 1948) (Decapoda, Caridea, Hippolytidae) obtained in laboratory. Nauplius 10 (1), 67-71.
Ong, K. S. & Costlow, J. D. Jr. 1970 The effect of salinity and temperature on the -larval development of the stone crab Menippe mercenaria (Say), reared in the laboratory. Chesapeak Sci., 11 (1): 16-29.
Oshiro, L. M. Y., Silva, R. da & Silveira, C. M. 1999 Rendimento de carne nos caranguejos guaiá, Menippe nodifrons Stimpson, 1859 e guaiamum, Cardisoma guanhumi Latreille, 1825 (Crustácea, Decapoda, Brachyura) da Baía de Sepetiba / RJ. Acta Biológica Leopoldinensia 21 (1): 83-88.
Pohle, G., Mantellato, F. L., egreiros-Fransozo, M. L. & Fransozo, A. 1999 Larval Decapoda (Brachyura). In: Boltovskoy, D. (ed.). South Atlantic Zooplankton. Leiden: Brackhuys Publishers. P. 1281-1351.
Tabela 1 – úmero de larvas de Cardisoma guanhumi que mudaram de estágio ao longo do experimento, para cada combinação de salinidade e temperatura.
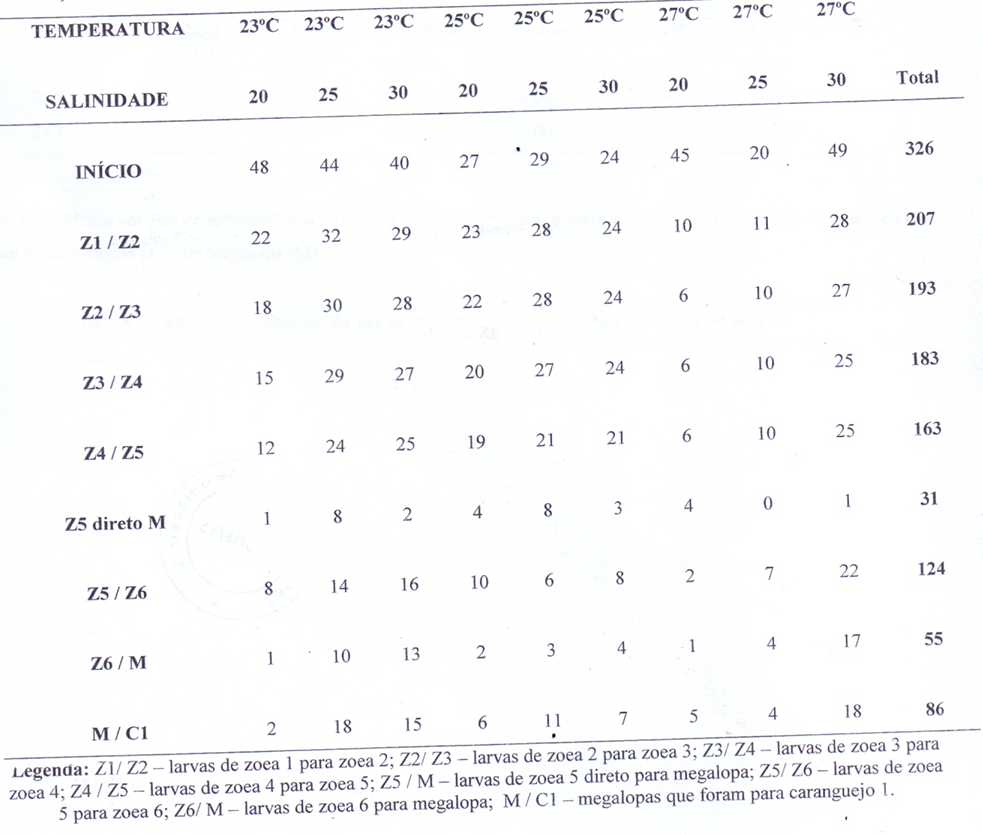
Tabela 2 _ Valores dos tempos médios e medianos para cada salinidade com os respectivos limites inferiores (LI) e superiores (LS) com 95% de confiança.
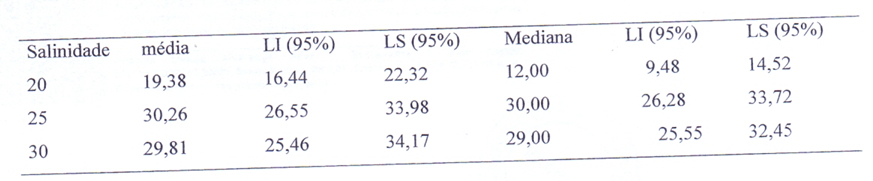
Tabela 3 – Valores dos tempos médios e medianos para cada temperatura com os respectivos limites inferiores (LI) e superiores (LS) com 95% de confiança.

Tabela 4 – Média em dias de sobrevivência das larvas que sobreviveram, a partir de zoea 1 (21) com seis estágios (26) e com cinco estágios (25) até megalopa (M).
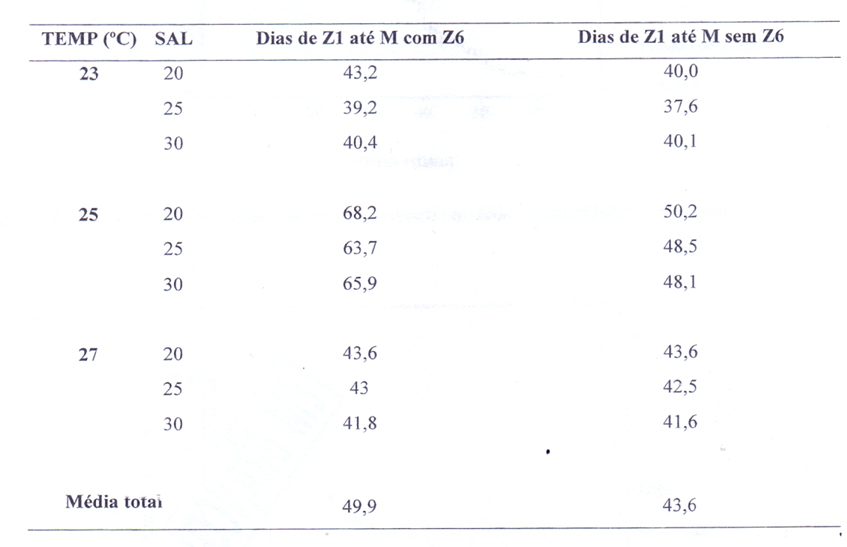
Figura 1 – Curva de Kaplan-Meyer do total de sobrevivência em todas as salinidades e temperaturas juntas.
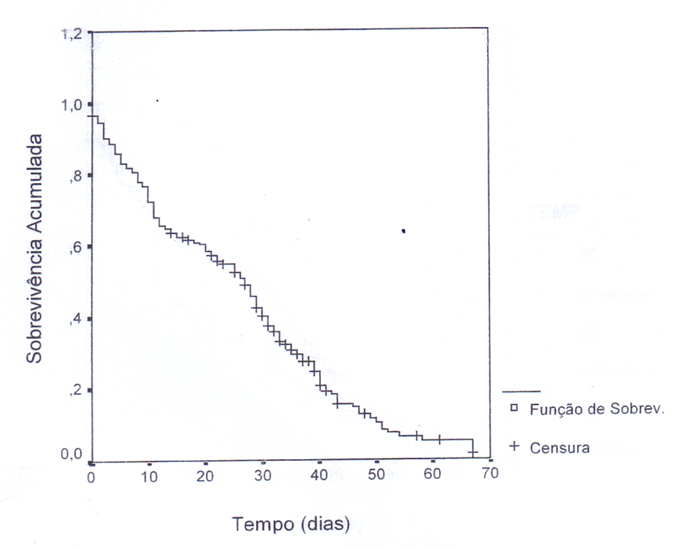
Figura 2 – Curvas de Kaplan-Meyer de sobrevivência de em cada salinidade (SAL)
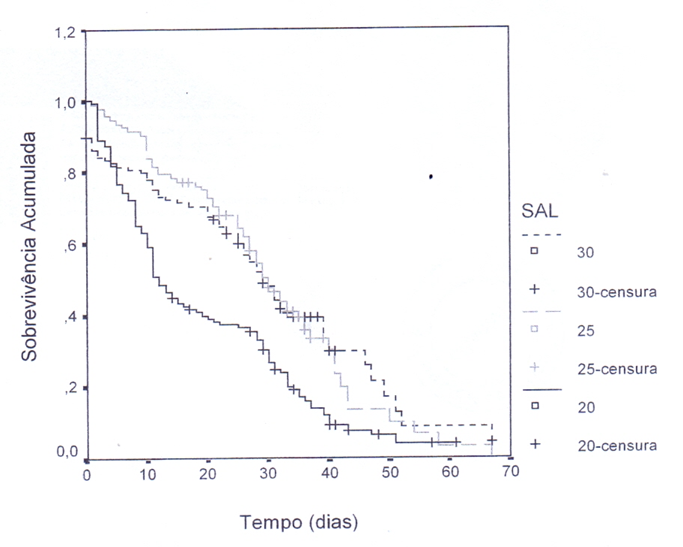
Figura 3 – Curvas de Kaplan-Meyer de sobrevivência em cada temperatura (TEMP).
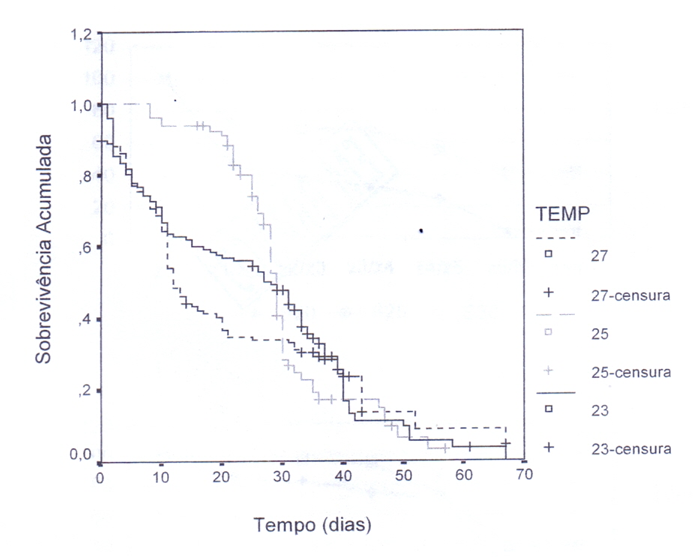
Figura 4 – Frequência relativa da sobrevivência dos estágios larvais de C. guanhumi submetidos a diferentes condições de salinidade.
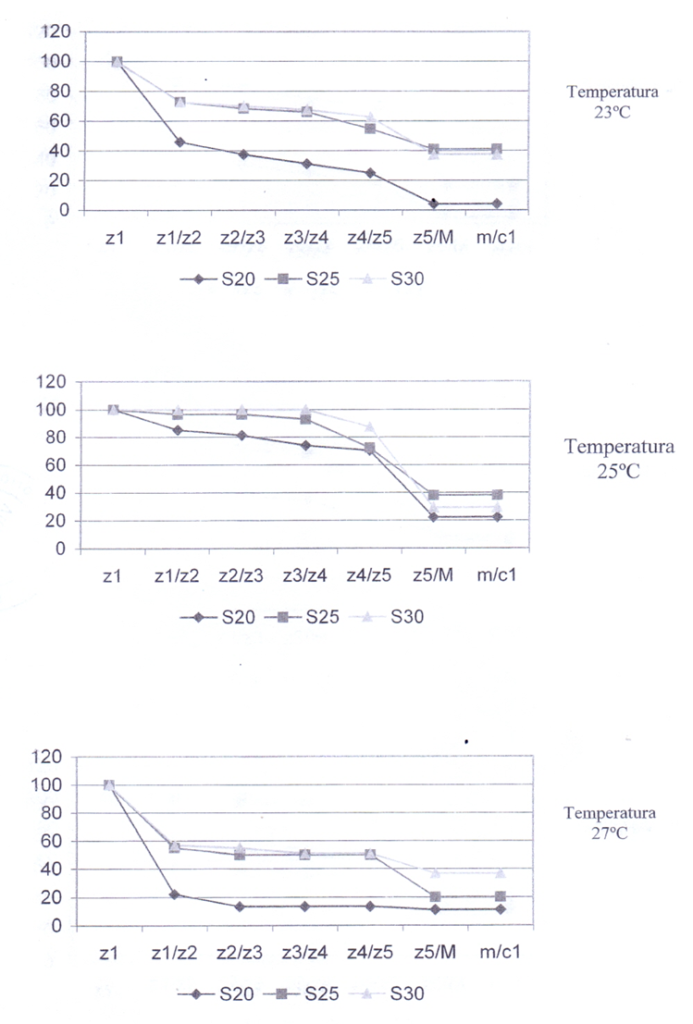
Figura 5 – Frequência relativa da sobrevivência dos estágios larvais de C. guanhumi submetidos a diferentes condições de temperatura.
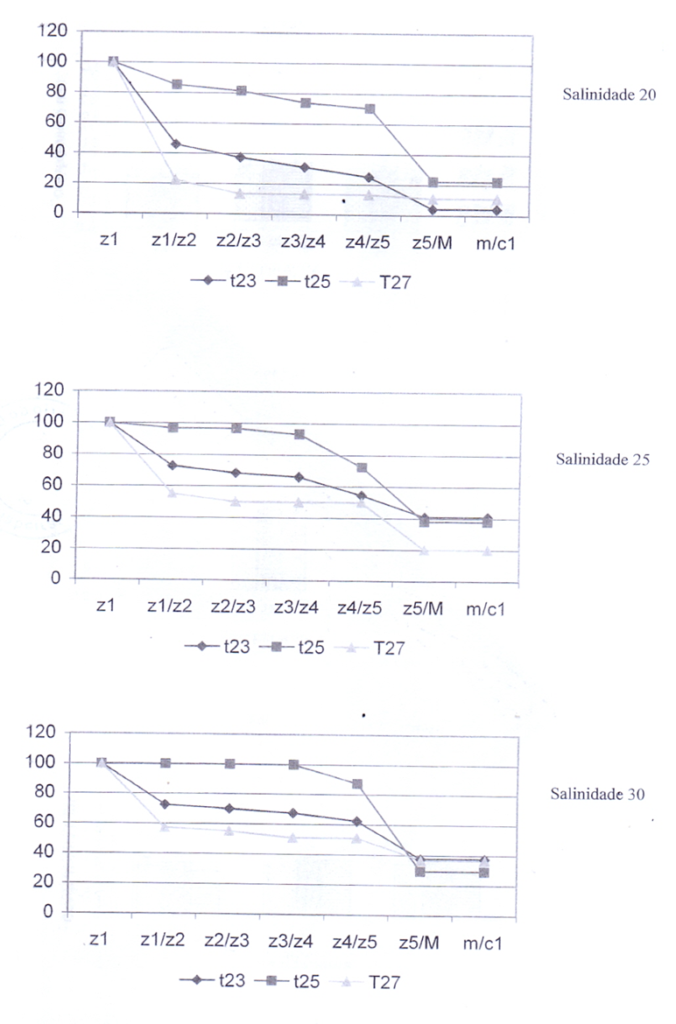
Figura 6 – Influência da temperatura e salinidade no crescimento dos estágios larvais de zoea 1, zoea 2 e zoea 3 de C. guanhumi em laboratório.
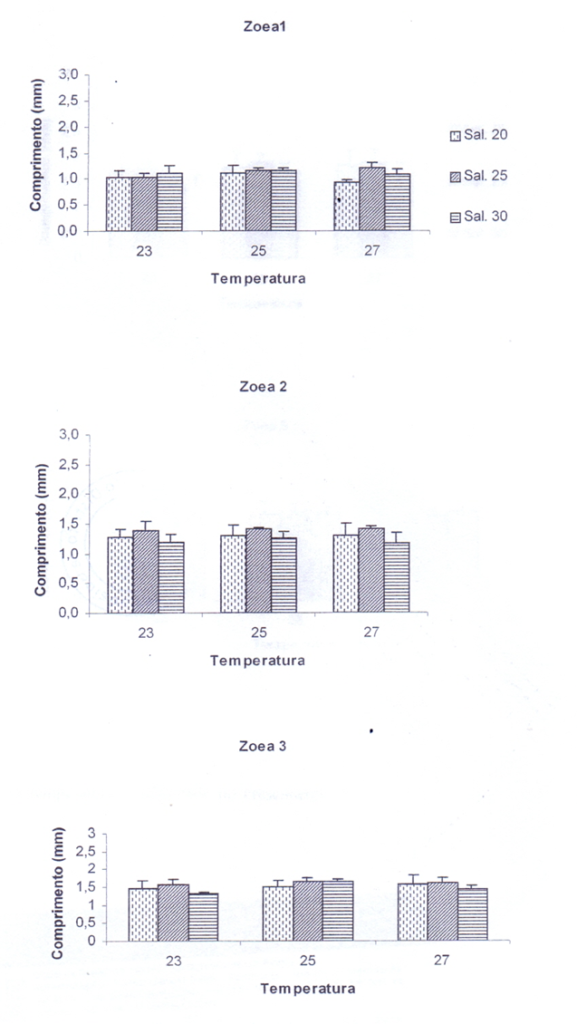
Figura 7 – Influência da temperatura e salinidade no crescimento dos estágios larvais de zoea 4 e zoea 5 de C. guanhumi em laboratório.
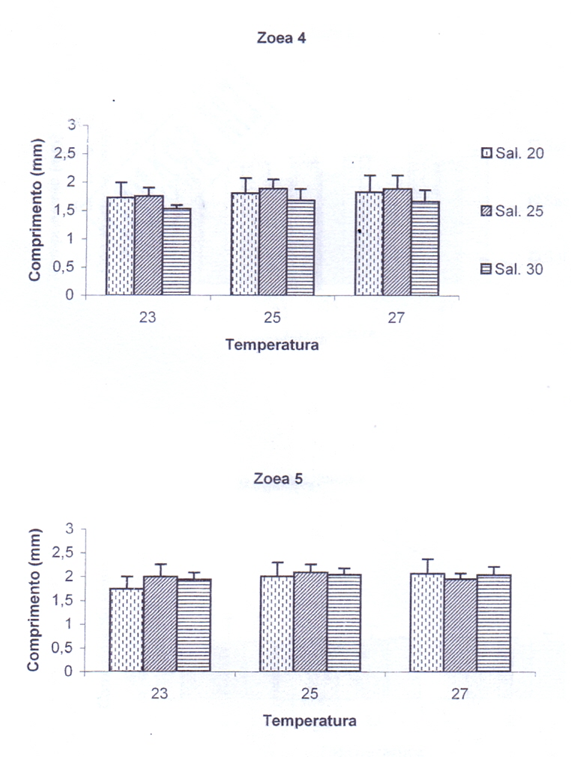
Figura 8 – Influência da temperatura e salinidade no crescimento dos estágios larvais de zoea 6 e megalopa de C. guanhumi em laboratório.
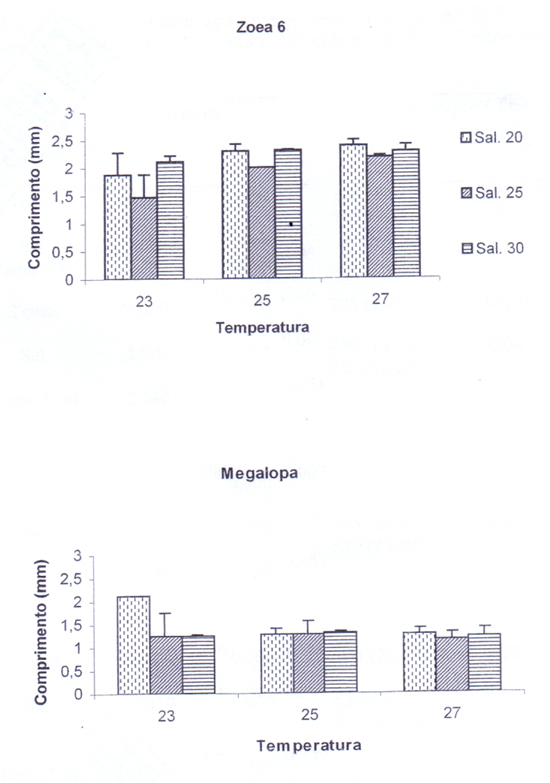
Apêndice 1 – Resultados da ANOVA e do teste de Duncan aplicados ao tempo de permanência dos estágios larvais de Cardisoma guanhumi em laboratório. Temperatura (T; Temp.); Salinidade (S; Sal); Temperatura e salinidade (Tem*sal.).
1 Docente e Coordenadora de Curso no Grupo Educacional FAVENI. Mestre em Ciências Biológicas pela Universidade Federal do Espírito Santo – UFES. e-mail: flaviane.nicoli@unifaveni.com.br
2 Docente na Universidade Federal do Espírito Santo – UFES. Departamento de Ecologia e Oceanografia. e-mail: luiz.ufes@gmail.com
3 Docente no Grupo Educacional FAVENI. Mestre em Física pela Universidade Federal do Espírito Santo – UFES. e-mail: gtnicoli@hotmail.com
