IMPORTANCE OF SPERM MORPHOLOGY EVALUATION IN ARTIFICIAL INSEMINATION (AI) IN CANINE SPECIES
REGISTRO DOI: 10.69849/revistaft/ni10202412202131
Júlia dos Santos Jasmim1; Carolina Resende Costa1; Izabelly Monteiro de Oliveira1; Laryssa Jardim da Silva Medeiros1; Luis Eduardo Ferreira de Almeida2; Eliene Porto Sad Pina3; Aline Vieira Pinheiro dos Santos3; Dala Kezen Vieira Hardman Leite3
RESUMO
O constante crescimento da área da reprodução em animais de companhia, instiga os criadores a buscarem por formas de avaliar o desempenho reprodutivo dos seus animais. O presente estudo foi aprovado pelo Comitê de Ética na utilização de animais da Universidade Iguaçu – UNIG, com o protocolo PEBIO/UNIG Nº 015/2023. A pesquisa foi realizada em um canil de Pastor de Shetland na cidade do Rio de Janeiro. No mês de julho de 2024, foram realizados três procedimentos de inseminação artificial (IA), com sêmen à fresco, em dias alternados em uma cadela. Anteriormente, a realização da inseminação artificial (IA), foram realizados exames ginecológicos, colpocitológicos e andrológicos para um acompanhamento reprodutivo. Trinta dias após a última inseminação artificial (IA), foi realizado um exame ultrassonográfico para confirmar a gestação, porém a cadela não apresentou prenhez. A IA foi realizada com base no exame andrológico e principalmente pelo fato que o macho já tinha histórico de bons resultados em inseminações artificiais anteriores. Contudo, após o resultado de não prenhez, 30 dias após o procedimento foi realizada a avaliação da morfologia espermática. Foram contadas 200 células, no microscópio óptico, com objetiva de 40x. A avaliação da morfologia espermática foi classificada em defeitos maiores e menores. Na análise da amostra do macho, a morfologia espermática revelou que 40,5% dos espermatozoides apresentavam-se normais. Quanto ao total de defeitos, foi observado 49,5% de espermatozoides com anormalidades, ultrapassando o limite máximo recomendado de 30,0%. A avaliação do exame ginecológico e colpocitológico é de extrema importância para a vida reprodutiva. A resolução de realizar a análise da morfologia espermática somente após a IA resultou na perda do cio da cadela e comprometeu as chances de sucesso reprodutivo. Esse fato ressalta a importância de avaliar a qualidade do sêmen previamente ao procedimento, garantindo melhores resultados e garantindo condições para o sucesso da inseminação artificial.
Palavras-chave: Citologia vaginal. Espermatozoide. Reprodução.
ABSTRACT
The constant growth in the field of reproduction in companion animals drives breeders to seek ways to evaluate the reproductive performance of their animals. This study was approved by the Ethics Committee on Animal Use of the Universidade Iguaçu – UNIG, under protocol PEBIO/UNIG No. 015/2023. The research was conducted at a Shetland Sheepdog kennel in the city of Rio de Janeiro. In July 2024, three artificial insemination (AI) procedures with fresh semen were performed on alternate days on a female dog. Prior to the artificial insemination (AI), gynecological and vaginal cytology exams were conducted for reproductive monitoring. Thirty days after the last artificial insemination (AI), an ultrasound examination was performed to confirm pregnancy; however, the female dog did not conceive. The AI was performed based on the andrological exam and, primarily, due to the male’s history of successful results in previous artificial inseminations. Nonetheless, after the negative pregnancy result, a sperm morphology evaluation was carried out 30 days after the procedure. A total of 200 cells were counted under an optical microscope with a 40x objective. The sperm morphology assessment was classified into major and minor defects. In the male’s sample, 40.5% of the spermatozoa were found to be normal. Regarding the total defects, 49.5% of the spermatozoa exhibited abnormalities, exceeding the maximum recommended limit of 30.0%. The evaluation of gynecological and vaginal cytology exams is of utmost importance for reproductive health. The decision to analyze sperm morphology only after the AI resulted in the loss of the female’s estrus cycle and compromised the chances of reproductive success. This highlights the importance of assessing semen quality prior to the procedure, ensuring better results and improving the likelihood of successful artificial insemination.
Keywords: Vaginal cytology. Spermatozoa. Reproduction.
INTRODUÇÃO
O mercado pet vem crescendo de forma exponencial no Brasil e no mundo, sustentado por uma crescente relação de afeto entre o homem e seu cão. Esse vínculo vem impulsionando a área de reprodução de animais de companhia, que traz um impacto significativo na criação e no melhoramento genético. O Pastor de Shetland é uma raça que atrai grande interesse entre criadores e entusiastas da cinofilia. O aprimoramento das características desejáveis dessa raça é um objetivo fundamental para criadores dedicados.
O exame ginecológico avalia o potencial reprodutivo da cadela, fornecendo informações valiosas para orientar futuras procriações e melhorar os índices reprodutivos. Nele é realizada a anamnese, exame físico com inspeção da cadeia mamária, vulva e vagina, e a citologia vaginal (Silva, Lima, 2018; Silva, Brito, 2023).
A citologia vaginal (colpocitógico) é um exame complementar que auxilia na avaliação da fase do ciclo estral em que a cadela se encontra, auxiliando o momento certo da cobertura ou inseminação artificial, bem como patologias, dias de previsão de parto e coberturas. Sendo um exame de fácil execução e baixo custo, que auxilia na estimativa da fase do ciclo estral. Este exame, se baseia na observação microscópica das células do epitélio vaginal, que sofrem alterações sob influência hormonal durante o ciclo estral, que é dividido em quatro fases: proestro, estro, diestro e anestro (Nogueira et al., 2019; Carvalho et al., 2020; Santos et al., 2022; Borges et al., 2024; Brito et al., 2024).
O exame andrológico é de grande valia para a seleção dos animais reprodutores, no diagnóstico de patologias e no prognóstico precoce de infertilidades. Portanto, o mesmo apresenta alta relevância pois, avalia a fertilidade do animal através do exame clínico geral, exame clínico do sistema reprodutor masculino e espermograma (CBRA, 2013; Monteiro et al., 2020; Souza et al., 2023; Paiva et al., 2024).
O espermograma é um recurso importante na avaliação da função do trato reprodutor masculino, podendo ser utilizado como diagnóstico até mesmo em animais que não fazem parte de um sistema de reprodução. Através deste, o sêmen é avaliado macroscópica e microscopicamente, considerando aspectos como volume, cor, densidade, pH, motilidade, vigor, concentração e morfologia espermática (CBRA, 2013; Santos et al., 2016; Foutouhi et al., 2023; Leite et al., 2023).
Para classificação das anormalidades espermáticas, pode-se utilizar o método preconizado por Blom, classificando-os em defeitos maiores quando a morfologia espermática causam prejuízo direto à fertilidade ou estão correlacionadas à alguma lesão de testículo e epidídimo (formas teratológicas, defeitos de acrossomo, piriforme, estreito na base, contorno anormal, cabeça isolada anormal, gota proximal, cauda fortemente dobrada) e defeitos menores quando a interferência é de menor relevância (delgado, gigante, curto, largo, pequeno normal, cabeça isolada normal, abaxial, retroaxial, oblíquo, cauda dobrada ou enrolada, gota distal) (Arruda et al., 2015; Oliveira et al., 2021). Após classificados, os defeitos maiores e menores devem ser contabilizados através de porcentagem como indicado no manual do CBRA (2013), também devem ser incluídas a presença de outras alterações como medusas, células epiteliais, leucócitos, eritrócitos, neutrófilos e bactérias (Arruda et al., 2015).
A Inseminação Artificial (IA) surge como uma alternativa segura à monta natural, permitindo o uso de sêmen fresco, refrigerado ou congelado, essencial para a preservação genética e o manejo reprodutivo eficiente. Como biotecnologia de reprodução, a inseminação artificial por via intravaginal (IAIV) com a utilização do sêmen à fresco depositado no trato genital da fêmea, é a técnica mais importante desenvolvida para o melhoramento genético dos animais, e a mais comum por ser de fácil manipulação e por oferecer bons resultados (Santana et al., 2017; Gonçalves et al., 2021).
O desenvolvimento da biotécnica, utilizando sêmen in natura, pode ser utilizado quando há impossibilidade da monta natural, por problemas anatômicos e comportamentais, resguardando também o estresse causado pela manipulação dos animais para a monta natural. Além disso, previne doenças transmitidas durante a cópula pois, preserva o material genético permitindo o uso do mesmo na fecundação de duas fêmeas de alto interesse zootécnico em um espaço indeterminado de tempo em suas melhores condições de armazenamento (Santana et al., 2017; Paiva et al., 2024).
A seleção de cães reprodutores é fundamental para obter êxito na inseminação artificial. Para isso será necessário avaliar ambos, o macho e a fêmea, através de uma anamnese, exame físico com a inspeção e palpação dos órgãos reprodutivos, e exames complementares no manejo reprodutivo: a colpocitologia e dosagem de progesterona e o exame andrológico (Rodrigues et al., 2019; Monteiro et al., 2020).
Além de oferecer uma solução para a reprodução, a inseminação artificial pode atenuar alguns riscos associados à reprodução canina, tal como reduzir a perda de material seminal, permitindo um controle mais preciso sobre a quantidade e a qualidade do sêmen utilizado. Além disso, pode reduzir os gastos econômicos associados ao processo de reprodução, ao otimizar o uso de recursos e evitar a necessidade de múltiplas tentativas de acasalamento natural (Rodrigues et al., 2019; Paiva et al., 2024).
RELATO DE CASO
O presente estudo foi aprovado pelo Comitê de Ética na utilização de animais da Universidade Iguaçu – UNIG, com o protocolo PEBIO/UNIG Nº 010/2022.
A pesquisa foi realizada em um canil de Pastor de Shetland na cidade do Rio de Janeiro. No mês de julho de 2024, foram realizados três procedimentos de inseminação artificial (IA), com sêmen à fresco, em dias alternados em uma cadela. Anteriormente, a realização da inseminação artificial (IA), foram realizados exames ginecológicos e colpocitológicos para um acompanhamento reprodutivo.
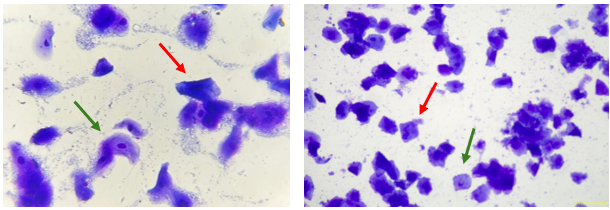
Uma cadela da raça Pastor de Shetland, com 7 anos de idade, apresentou exame físico sem alterações. A mucosa vaginal encontrava-se dilatada e hiperêmica, indicando fase de estro. A cadela demonstrava receptividade ao macho, e o exame ginecológico estava dentro da normalidade. A análise colpocitológica revelou 90,0% de células superficiais nucleadas e anucleadas, confirmando a fase de estro e corroborando o histórico de gestações prévias (Figura 1).
Figura 1. Presença de células superficiais anucleadas (seta vermelha), e nucleadas (seta verde), caracterizando fase do estro
No exame andrológico, o cão da raça Pastor de Shetland, com 6 anos de idade, apresentou histórico de inseminações artificiais anteriores com gestações confirmadas. No exame clínico realizado a bolsa escrotal não apresentou alterações. Os testículos estavam posicionados dentro da bolsa escrotal, apresentando simetria, mobilidade e consistência normais. Os epidídimos estavam presentes, com tamanho e consistência dentro da normalidade. Tanto o prepúcio quanto o pênis apresentaram-se sem anormalidades.
O sêmen foi coletado por meio do método de manipulação digital e apresentou um volume de 10 mL, sêmen denso e coloração esbranquiçada. Imediatamente após a coleta, o sêmen foi colocado em uma seringa e em uma pipeta específica para a inseminação artificial. Para avaliação da morfologia espermática, foi preparado um esfregaço do sêmen em lâminas histológicas, que foram preparadas através de um esfregaço do sêmen corados pelo método de Panótico Rápido (Diff Quick).
Trinta dias após a última inseminação artificial (IA), foi realizado um exame ultrassonográfico para confirmar a gestação, porém a cadela não apresentou prenhez.
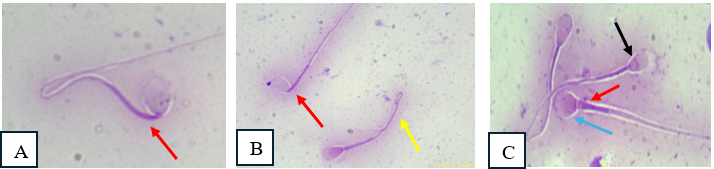
A IA foi realizada com base no exame andrológico e principalmente pelo fato que o macho já tinha histórico de bons resultados em inseminações artificiais anteriores. Contudo, após o resultado de não prenhez, 30 dias após o procedimento foi realizada a avaliação da morfologia espermática. Foram contadas 200 células, no microscópio óptico, com objetiva de 40x. A avaliação da morfologia espermática foi classificada em defeitos maiores e menores. Na análise da amostra do macho, a morfologia espermática revelou que 40,5% dos espermatozoides apresentavam-se normais. Quanto ao total de defeitos, foi observado 49,5% de espermatozoides com anormalidades, ultrapassando o limite máximo recomendado de 30,0%. Dos defeitos maiores foram encontrados 22,0% de defeitos de peça intermediária; 2,0% de cauda fortemente enrolada; 1,0%, de piriforme e quanto aos defeitos menores obtivemos 17,5 % de cauda enrolada e 7,0% de abaxial (Figura 2).
Figura 2. Fotomicrografia. Espermograma, espermatozoides corados com Panótico Rápido. Avaliação da morfologia espermática – defeitos maiores e menores. (A) Defeito na peça intermediária (seta vermelho); (B) Defeito de peça intermediária (seta vermelha) e cauda enrolada (seta amarela) (C) Espermatozóide normal (sem seta) defeito de cabeça (seta azul), defeito de peça intermediária (seta vermelho) e defeito de acrossomo (seta preta), objetiva 100x
DISCUSSÃO
No presente trabalho, o exame ginecológico realizado na cadela demonstrou parâmetros normais, indicando que a cadela estava apta para a reprodução. Como observado no caso, , a fêmea foi submetida ao exame colpocitológico para avaliação da fase do ciclo estral, antes da IA e corrobora com Santos, 2016; Nogueira et al. 2019, que mencionam a importância deste exame complementar para a avaliação das células e identificação do momento ideal da fase do estro. Conforme descrito também por Borges et al. (2024)que cita que a citologia vaginal é um exame simples, fácil e de baixo custo.
De acordo com Souza et al., 2023 e Mason (2018), o exame colpocitológico permite identificar as fase do ciclo estral, no qual caracteriza a fase do estro, quando há a presença de mais de 90,0% células superficiais anucleadas e nucleadas, de acordo com o encontrado neste trabalho. Nogueira et al., (2019) relatam que a identificação e classificação da predominância de células superficiais nucleadas e anucleadas indicam o momento ideal para a realização da inseminação artificial (IA), como observado na cadela avaliada.
Os achados corroboram ainda com o citado por Carvalho et al. (2020) e Silva e Lima (2018), no qual relatam que a citologia vaginal quando realizada regularmente permite acompanhar a evolução do ciclo estral das fêmeas.
No exame clínico, a bolsa escrotal não apresentou alterações. Ambos os testículos estavam presentes na bolsa escrotal, com forma, tamanho, mobilidade e consistência dentro da normalidade. As avaliações dos epidídimos, pênis e prepúcio também não revelaram anormalidades, atendendo aos parâmetros descritos no Manual do CBRA, 2013.
Porém, a análise do sêmen não foi realizada anteriormente ao procedimento da IA. Somente 30 dias após o procedimento, a análise da morfologia espermática indicou que o reprodutor não estava apto para a reprodução, apresentando baixa qualidade seminal. Como citado por Monteiro, et al. 2020, realizar a avaliação da qualidade do sêmen impedirá a utilização de sêmen de baixa qualidade, evitando frustações nos resultados e evitará desperdícios de ciclos reprodutivos. A falta da análise do sêmen não apenas compromete a verificação da fertilidade do animal, mas também confirma a falha na inseminação artificial realizada.
Paiva et al. (2024) destacaram que a qualidade do sêmen é um fator determinante para o sucesso do procedimento de inseminação artificial. No entanto, no caso do nosso animal, a avaliação seminal revelou um alto índice de patologias espermáticas, o que comprometeu a eficácia do procedimento.
Em relação as morfologias espermáticas encontramos que 40,5% dos espermatozoides apresentavam-se normais. Quanto ao total de defeitos, foi observado 49,5% de espermatozoides com anormalidades, estando de acordo com o manual do CBRA, 2013 que relata que o limite máximo recomendado de patologias espermáticas é de 30,0%. No presente trabalho foram encontrados 22,0% de defeitos de peça intermediária; 2,0% de cauda fortemente enrolada; 1,0%, de piriforme, classificados de defeitos maiores e quanto aos defeitos menores obtivemos 17,5 % de cauda enrolada e 7,0% de abaxial endossado pelos autores Monteiro, et al. 2020; Souza et al., 2023; Paiva et al., 2024.
De acordo com Souza et al. (2023) e Monteiro et al. (2020), a seleção minuciosa de reprodutores, tanto machos quanto fêmeas, é de extrema valia para o sucesso da inseminação artificial. Além disso, o diagnóstico de possíveis patologias reprodutivas ou infertilidades é indispensável para assegurar o sucesso reprodutivo. No caso citado, a fêmea estava apta para o procedimento, enquanto o macho apresentava problemas, com um alto índice de patologias espermáticas, o que comprometeu sua capacidade reprodutiva, conforme observado no nosso estudo.
CONSIDERAÇÕES FINAIS
A avaliação do exame ginecológico e colpocitológico é de extrema importância para a vida reprodutiva, identificando a fase do estro e o momento ideal para inseminação artificial. A resolução de realizar a análise da morfologia espermática somente após a IA resultou na perda do cio da cadela e comprometeu as chances de sucesso reprodutivo. Esse fato ressalta a importância de avaliar a qualidade do sêmen previamente ao procedimento, garantindo melhores resultados e garantindo condições para o sucesso da inseminação artificial.
REFERÊNCIAS
ARRUDA, R. P. de; CELEGHINI, E. C. C.; GARCIA, A. R.; SANTOS, G. de C. dos; LEITE, T. G.; OLIVEIRA, L. Z.; LANÇONI, R.; RODRIGUES, M. de P. Morfologia Espermática de Touros: Interpretação e Impacto na Fertilidade. Revista Brasileira de Reprodução Animal, Belo Horizonte, v.39, n.1, p.47-60, 2015.
BORGES, T. B.; SALA, P. L.; LEITZKE, A. V. S.; DISSENHA, A.; BELETTINI, S. T.; PAULA, D. S. de; SÁ, T. C. de; RIBEIRO, R. de C. L.; QUESSADA, A. M. Citologia Vaginal de Cadelas Submetidas à Aplicação de Anticoncepcionais Injetáveis. Brazilian Journal of Implantology and Health Sciences, [S. l.], v.6, n.9, p.1599–1615, 2024.
BRITO, E. F.; MEDEIROS, L. K. G.; SILVA, L. F. F. e; BRANDÃO, T. S. Estimativa Estral por Citologia Vaginal e Percepção dos Tutores Acerca de Problemas Reprodutivos de Cadelas no Município de Patos-PB. Brazilian Journal of Development, Curitiba, v.10, n.9, p.1-21, 2024
CARVALHO, A. M. H.; SANTOS, A. D. F.; SILVA, C. M. Indução do Estro e Métodos para Controle das Fases do Ciclo Estral em Cadelas. Ciência Animal, [S. l.], v.30, n.1, p.117-129, 2020.
CBRA – COLEGIO BRASILEIRO DE REPRODUÇÃO ANIMAL. Manual para exame andrológico e avaliação de sêmen animal. 3ed., Belo Horizonte: CBRA, 2013, 104 p.
FOUTOUHI, A.; HESSER, A.; FUENTE, A.; BULKELEY, E.; DINI, P.; MEYERS, S. Sperm parameters in the Great Dane: Influence of age on semen quality. Journal of Veterinary Behavior. v.197, p 267 – 274, 2023.
GONÇALVES PBD, FIGUEIREDO JR, GASPERIN BG. Biotécnicas Aplicadas à Reprodução Animal e à Humana. 3 th ed: Roca; 2021. 416p.
LEITE, D. K. V. H.; LUCENA, L. M. de; GONÇALVES, H. C. M.; DELFINO, K. S.; FERRER, D. M. V.; SOARES, P. F. C. Avaliação de Integridade de Membrana Espermática em Touros da Raça Nelore (Bos Taurus Indicus). Revista FT, Rio de Janeiro, v.27, n.121, 2023.
MONTEIRO, K.S.; BERGMANN, L.J.; FERREIRA, B.C.; LIRA, G.M.; MARQUES, T.F.R.; FONSECA, T.C.; BERALDO, E.; MURGAS, L.D.S. Inseminação Artificial e acompanhamento em uma cadela da raça Bull Terrier com histórico de agressividade: relato de caso. Caderno de Ciências Agrárias, v,12, 12: p.1-5, 2020.
NOGUEIRA CS, FERREIRA MH, SILVA WC, et al. Determinação da fase do ciclo estral através da anamnese e citologia vaginal associada a dosagens hormonais. Braz. J. Anim. Environ. Res., v.2, p.1037-1045, 2019.
OLIVEIRA, G. P.; SOUZA, H. F. F.; BATISTA, D. P.; SILVA, A.; SILVA, W. C. d; SILVA, L. K. X.; Emprego da Citologia Vaginal na Detecção da Fase do Ciclo Estral de Cadelas e Sua Relação Com a Idade e Escore de Condição Corporal, Belém, Pará. Research, Society and Development, 2021. v.10, n.9, 2021.
PAIVA, J. H. C.; DEBONI, A. C. N.; MARQUES, L. F.; SILVA, L. S. B.; CHAPEL, M.E. M.; PINA, SAD, E. P.; SANTOS, A. V. P.; ALMEIDA, L.E. F.; LEITE, D. K. V.H. Applicability of Pap smear and progesterone dosage in artificial insemination. Revista SEVEN, capítulo 81, p. 1121–1128, 2024.
RODRIGUES JL, BERRTOLINI M, FERREIRA BC, et al. Biotecnologias da Reprodução Animal: de Aristóteles à edição gênica. Anais do XXIII Congresso de Reprodução Animal, v.12,n.1, p.6, 2019.
SANTANA LR, BITTENCOURT RF, FELIX ND, NASCIMENTO AB. Perfil Espermático de reprodutores da raça Bulldogue Francês. Anais da 2ª Reunião da Associação Brasileira de Andrologia Animal (ABRAA). Campo Grande: EMBRAPA, v.1, p. 96-99, 2017.
SANTOS, J.F.P.; GOSMES, E.T.;, SIQUEIRA, A.K.M.; CARDOSO, R.C.S. Andrologia e criopreservação de sêmen em cães. R. Bras. Reprod. Animal, v. 40, n. 4, p.167-17, 2016.
SANTOS, N. R. A. dos; SOUZA; A. P. C. de; SANTOS; A. V. P. dos; LEITE; D. K. V. H. O Uso da Colpocitologia Associado à Anamnese na Determinação da Fase do Ciclo Estral em Cadelas (Canis familiaris). Revista de Ciência & Tecnologia, Rio de Janeiro, v.22, n.2, p.53-56, 2022.
SILVA, H. V. R.; BRITO, B. F. Atuação do Médico Veterinário Especialista em Reprodução no Manejo de Canis. Revista Brasileira de Reprodução Animal, Belo Horizonte, v.47, n.2, p.286-293, 2023.
SILVA, L. D. M.; LIMA, D. B. C. Aspectos da Fisiologia Reprodutiva da Cadela. Revista Brasileira de Reprodução Animal, Belo Horizonte, v.42, n.3-4, p.135-140, 2018.
SOUZA, A. P. C.; SANTOS, N. R. A.; ALMEIDA, L.E.F.; SANTOS, A. V. P.; LEITE, D.K.V.H. Uma cadela da raça Pastor de Shetland: relato de caso. Ciências Agrárias, Edição v.122, p.04-10, 2023.
1 Discente do curso de Medicina Veterinária – Universidade Iguaçu campus Nova Iguaçu, RJ, Brasil.
2 Médico Veterinário – autônomo,
3 Docente do curso de Medicina Veterinária – Universidade Iguaçu campus Nova Iguaçu, RJ, Brasil dkezen@gmail.com
