REGISTRO DOI:10.5281/zenodo.11224084
Andressa Beatriz da Silva da Santos
Raffaela Prado Reis
Orientador: Profa. Dra. Aline Francielle da Silva dos Santos
RESUMO
A trombofilia é uma condição na qual ocorre uma propensão aumentada para a formação de coágulos sanguíneos anormais. O fator V Leiden é uma mutação genética comum que torna o sangue mais propenso a coagular. Indivíduos com essa mutação têm um risco aumentado de desenvolver coágulos sanguíneos, o que pode levar a complicações como trombose venosa profunda (TVP) e embolia pulmonar.
É importante ressaltar que nem todas as pessoas com a mutação do fator V Leiden desenvolveram coágulos sanguíneos, e muitas pessoas podem ter a mutação e nunca apresentar sintomas. No entanto, é fundamental que indivíduos com história pessoal ou familiar de coágulos sanguíneos discutam com um médico a possibilidade de realizar testes genéticos e de coagulação para avaliar seu risco.
O tratamento para trombofilia de fator V Leiden geralmente envolve medidas de prevenção, como uso de anticoagulantes em determinadas situações de alto risco, como cirurgias, imobilidade prolongada ou durante a gravidez. O acompanhamento médico regular é fundamental para monitorar e gerenciar adequadamente a condição e prevenir complicações graves.
PALAVRAS-CHAVE: Trombofilia, TEV, Cascata de coagulação, Fator de Leiden, Anticoagulante
1. INTRODUÇÃO
A trombofilia é uma condição que pode ser hereditária ou adquirida, caracterizada por uma alteração na coagulação sanguínea que predispõe o indivíduo a desenvolver trombos vasculares. Essa predisposição é a principal causa de eventos como trombose arterial e venosa, embolias pulmonares, acidente vascular cerebral, e complicações obstétricas, incluindo dificuldade de engravidar, retardo no crescimento fetal, e, em casos mais graves, aborto. As principais causas de trombofilias hereditárias são Polimorfismos do fator V Leiden, Polimorfismos do gene da protrombina, Deficiência de proteína S (dPS), Deficiência de proteína C (dPC) e Deficiência de antitrombina (dAT).2 As trombofilias associadas ao gene da protrombina e à mutação do fator V de Leiden são as mais frequentes, responsáveis por 50-60% dos casos. (1-2)
Os pacientes com trombose sintomática frequentemente apresentam mais de um fator de risco, que podem exercer um efeito sinérgico no sentido de aumentar o risco de trombose. Exemplificando, as mulheres com fator V de Leiden que usam anticoncepcionais orais têm um risco de TEV 35 vezes maior do que o observado na população em geral, sendo que cada fator de risco está associado a um risco aproximado de 5 vezes.3
Em pacientes com risco trombótico aumentado, geralmente é necessária uma condição adicional com potencial trombótico para desencadear um evento, como neoplasias, cirurgias, imobilização, voos prolongados, uso de anticoncepcionais e gravidez. Pacientes com a trombofilia têm facilidade para desenvolver trombose mesmo em situações minimamente provocadoras ou sem nenhuma razão identificada.4-5
A trombose venosa profunda (TVP) dos membros inferiores é uma doença grave e potencialmente fatal. Aproximadamente 46% dos casos de TVP proximal, na região ilio-femoral, femoral e poplítea podem evoluir para uma embolia pulmonar (EP), por esse motivo o diagnóstico preciso se torna fundamental para iniciação o quanto antes da terapia medicamentosa que consiste em anticoagulantes, o objetivo do tratamento está em aliviar os sintomas, diminuir a extensão do trombo e a possível possibilidade de um EP.6-7
Dentro deste contexto, o presente artigo tem como propósito apresentar a relevância do tema em situações clínicas específicas e ressaltar a importância da localização do evento trombótico sobre o tratamento e o prognóstico, enfatizando a necessidade de uma abordagem individualizada no manejo e tratamento desses pacientes.
2. OBJETIVO
O estudo tem como objetivo avaliar a influência de fatores genéticos na predisposição à trombofilia, identificar os biomarcadores associados à essa doença, destacar a importância da investigação de trombofilia em eventos trombóticos espontâneos, episódios recorrentes, tromboflebites superficiais recorrentes e eventos trombóticos em locais não usuais, além de enfatizar a necessidade de considerar a localização do evento trombótico, uma vez que isso pode influenciar no tratamento e prognóstico em determinadas condições clínicas, reforçando a necessidade de uma abordagem individualizada no tratamento e manejo desses pacientes.
3. METODOLOGIA
Foi realizada uma busca de artigos científicos publicados no PubMed®/MEDLINE® entre janeiro de 2018 e janeiro de 2024, inserindo as palavras em inglês: (“thrombophilia”), (“thrombosis and pregnancy”), (“thrombophilia and screening”) e (“pré-hormone therapy”), palavras em português: (trombofilia), (doenças automimunes), (fator v de leiden), (TEV). Os artigos recuperados foram analisados quanto a relevância, escopo e desenho de estudo, gerando uma lista de estudos clínicos randomizados, os quais foram tomados como referências para a construção do presente estudo.
4. RESULTADOS E DISCUSSÃO
A hemostasia é um conjunto de fenômenos biológicos que ocorrem em sequência como resposta imediata a uma lesão, interrompendo o que poderia se tornar uma hemorragia. Esse processo inclui três etapas, que devem ocorrer em equilíbrio para que não haja sangramento em excesso, nem obstrução do fluxo sanguíneo assim o vaso sanguíneo lesado inicia o processo de tamponamento com a cascata de coagulação. A trombofilia é classificada como hereditária quando se demonstra a presença de uma anormalidade hereditária que predispõe à oclusão vascular, mas que requer a interação com outro componente, hereditário ou adquirido, para desencadear o episódio trombótico.
As trombofilias hereditárias são, na maior parte dos casos, decorrentes de alterações ligadas aos inibidores fisiológicos da coagulação (antitrombina, proteína C, proteína S e resistência à proteína C ativada) ou de mutações de fatores da coagulação (Fator V Leiden e mutação G20210A da protrombina).
A trombofilia é adquirida quando é decorrência de outra condição clínica, como neoplasia, síndrome antifosfolípide, imobilização, ou do uso de medicamentos, como terapia de reposição hormonal, anticoncepcionais orais e heparina. Níveis plasmáticos moderadamente elevados de homocisteína também podem ser responsáveis por episódios vaso-oclusivos.
Importante consideração a ser feita é o local que ocorre o evento trombótico vascular podendo ser venoso ou / e arterial, já que isto implica em mecanismos fisiopatológicos diversos, com investigação laboratorial e tratamento também diferentes.
Clinicamente, as trombofilias hereditárias geralmente manifestam-se como tromboembolismos venosos com algumas características próprias, sendo ocorrência em indivíduos jovens (< 45 anos), recorrência frequente e história familiar de eventos trombóticos, trombose migratória ou difusa ou em local pouco comum, episódio trombótico desproporcionalmente grave em relação ao estímulo desencadeante.
Os defeitos trombofílicos podem também causar várias complicações obstétricas, como dificuldade para engravidar, gestações complicadas, retardo do crescimento fetal, abortamentos e perdas fetais. A investigação laboratorial deve ser realizada em todas as situações mencionadas, porém se deveria considerar também a importância de agregar alguns exames rotineiros em consulta clínica de família antes do evento trombótico agudo, incluindo a quantificação funcional dos inibidores da coagulação, a quantificação da homocisteína plasmática, as pesquisas das mutações FV G1691A e G20210A da protrombina, e da presença dos anticorpos antifosfolípides (anticoagulante lúpico e anticardiolipina).
Como em algumas situações clínicas a investigação laboratorial pode não alterar a conduta terapêutica que será instituída, deve-se levar em conta a relação custo/benefício deste estudo.
Porém, duas observações merecem ser feitas que é a presença de associações de defeitos trombofílicos implica em maior potencial trombogênico e a demonstração da presença ou ausência de anticorpos anti fosfolípidos orienta quanto ao tempo e a intensidade da anticoagulação.
Por fim, deve-se ainda considerar que, por serem defeitos hereditários, a demonstração de um defeito trombofílico congênito determina qual será a investigação dos familiares e aqueles que forem portadores assintomáticos deverão receber orientação adequada em situações de risco, visando evitar a ocorrência de eventos trombóticos.
O fator V é uma proteína essencial na cascata de coagulação sanguínea, que desempenha um papel crucial na prevenção da formação de coágulos excessivos. A mutação genética conhecida como fator V Leiden resulta em uma forma alterada da proteína fator V, que torna o sangue mais propenso a coagular. Em condições normais, o fator V é inativado pela proteína C ativada, um regulador natural da coagulação. No entanto, na presença da mutação do fator V Leiden, a proteína C ativada não consegue inativar adequadamente o fator V alterado, levando a uma predisposição aumentada à formação de coágulos.
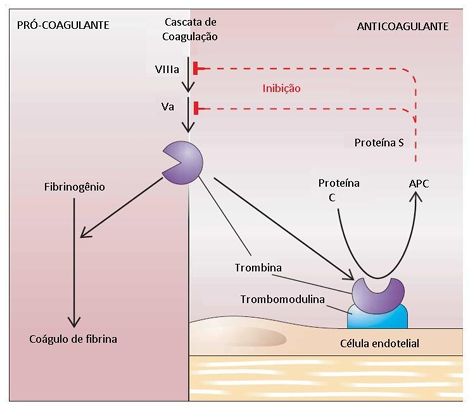
Figura 1 – A via da PC e PS é uma importante via reguladora da coagulação sanguínea. Quando a trombina se liga à trombomodulina, ocorre uma mudança conformacional na trombina, levando-a a adquirir a capacidade de ativar a PC no plasma. A PS atua como cofator para a proteína C ativada (APC). A APC, por sua vez, degrada os fatores V e VIII ativados, essenciais na cascata de coagulação, inibindo assim a formação de coágulos de fibrinogênio e a ativação de plaquetas. (Lawrence Leug, 2012).
Trombofilias são condições associadas a um aumento do risco de tromboembolismo venoso (TEV) e, ocasionalmente, trombose arterial quando ligada a um conjunto de fatores genéticos que predispõe a oclusão vascular caracterizada por alteração da cascata ocorrendo um aumento da função dos fatores e uma deficiência dos inibidores. Pacientes diagnosticados com trombofilia hereditária demonstram uma suscetibilidade aumentada a eventos trombóticos recorrentes, muitas vezes ocorrendo antes dos 45 anos de idade. Isso representa um desafio significativo para a saúde pública, visto que a morbimortalidade associada à trombose venosa e suas complicações é considerável. Nos Estados Unidos, por exemplo, estima-se que haja aproximadamente 50 mil óbitos anuais decorrentes de tromboembolismo pulmonar, além de 300 mil a 600 mil internações por trombose venosa profunda e tromboembolismo pulmonar. No Brasil, com base em dados de internações do Sistema Único de Saúde (SUS), estima-se que ocorram cerca de 28 mil hospitalizações anuais devido à embolia pulmonar, resultando em aproximadamente 4.247 mortes anuais. Ao contrário de doenças monogênicas, onde uma única mutação genética está associada à doença, a trombose venosa é considerada uma doença multigênica, onde diferentes mutações em genes diversos interagem para aumentar o risco de eventos trombóticos. Embora a predisposição à trombose venosa associada a uma única alteração genética seja relativamente baixa, a presença de mutações em vários genes aumenta substancialmente o risco de desenvolvimento da doença.
Os pacientes com trombose sintomática frequentemente apresentam mais de um fator de risco, que podem exercer um efeito sinérgico no sentido de aumentar o risco de trombose. Exemplificando, as mulheres com fator V de Leiden que usam anticoncepcionais orais têm um risco de TEV 35 vezes maior do que o observado na população em geral, sendo que cada fator de risco está associado a um risco aproximado de 5 vezes. Entre as principais trombofilias hereditárias a mutação do fator V de Leiden é uma mutação genética que aumenta o risco de desenvolvimento de coágulos sanguíneos.
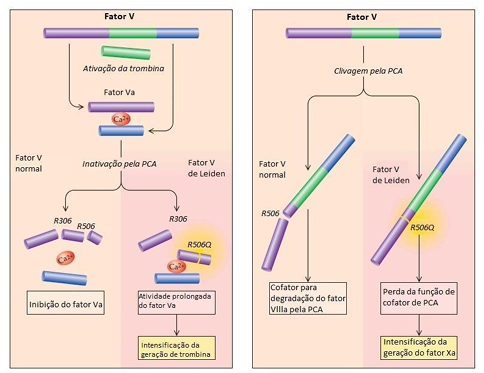
Figura 2 – A quebra do fator V de Leiden ativado pela trombina é notavelmente mais lenta em comparação com a quebra do fator V ativado normal (Va). Isso resulta em uma intensificação da produção de trombina (à esquerda). Estudos recentes indicam que o fator V normal, juntamente com a proteína S, atua como cofator da proteína C ativada (PCA) na inibição do fator VIIIa (à direita). Essa função de cofator da PCA desempenhada pelo fator V requer a clivagem do fator V pela PCA na posição da arginina 506. Portanto, a função de cofator apresentada pelo fator V de Leiden é comprometida. (Lawrence Leug; Seward Hung,2010).
Essa mutação afeta a proteína coagulante chamado fator V, tornando-a mais propensa a formar coágulo, esse gene é responsável pela produção da proteína chamada fator V, que desempenha um papel importante na coagulação do sangue.
A forma alterada do fator V é mais resistente à inativação pelo sistema anticoagulante natural do corpo aumentando o risco de formação de coágulos sanguíneos, especialmente nas veias das pernas, o que pode resultar em trombose venosa profunda ou embolia pulmonar.
A incidência de TEV é de cerca de dois a três por cada mil indivíduos, a ocorrência aumenta com a probabilidade de um segundo evento, dessa forma sugere-se tromboprofilaxia em caso de gravidez, se houver fatores de risco adicionais ou a existência de mais que uma mutação pró trombótica.
O marcador mais comum para detectar a mutação do Fator V de Leiden é um teste de DNA. Este teste identifica a presença da mutação no gene responsável pela produção do fator V. É importante ressaltar que esse teste é geralmente realizado em pessoas com histórico familiar de trombose venosa profunda ou embolia pulmonar, ou em indivíduos que tiveram essas condições em idade jovem e sem fatores de risco óbvios.
O diagnóstico da trombofilia de fator V Leiden é frequentemente realizado por meio de testes genéticos que identificam a presença da mutação no gene F5. O diagnóstico precoce é fundamental para a prevenção de complicações graves associadas à trombofilia de fator V Leiden.
Em mulher com mutação de risco trombótico tem mais chances de TEV em uma gravidez do que em uso de anticoncepcional, tendo em conta o elevado estudo laboratorial, o diagnóstico deve obedecer critérios como realizar em indivíduos que tiveram TEV antes dos 50 anos em locais atípicos como mesentérica, esplênica, hepática, renal ou cerebral e em mulheres com história obstétrica adversa, alguns autores defendem que só teria a importância do rastreio em familiar de primeiro grau ainda sim se tiver em situação determinada de risco.
Para pessoas com a mutação do Fator V de Leiden e que têm um alto risco de desenvolver coágulos sanguíneos, os médicos podem prescrever anticoagulantes, como a varfarina (Coumadin) ou anticoagulantes orais diretos (DOACs), como apixabana (Eliquis), dabigatrana (Pradaxa), rivaroxabana (Xarelto) ou edoxabana (Savaysa). Esses medicamentos ajudam a prevenir a formação de coágulos sanguíneos e reduzem o risco de complicações associadas à trombose venosa profunda ou embolia pulmonar. O tratamento específico depende do histórico médico individual e das condições de saúde. Sempre é essencial seguir as orientações do médico para o tratamento adequado.
Discutir com um médico quais medidas preventivas são mais apropriadas para cada indivíduo, considerando seu histórico médico e estilo de vida, é fundamental para um manejo eficaz da condição. O uso de anticoagulantes orais requer um cuidado cauteloso na vida do paciente pois em caso de corte ou dose aumentada do medicamento deve-se saber a melhor conduta para o paciente
Além do tratamento com anticoagulantes, algumas medidas podem contribuir para a prevenção de complicações em pessoas com Fator V de Leiden. Adotar um estilo de vida saudável, manter um peso corporal adequado, praticar exercícios regularmente, seguir uma dieta balanceada, manter-se ativo regularmente, evitando longos períodos de inatividade, como ficar sentado por muitas horas. Para pessoas que permanecem sentadas por longos períodos, como em viagens prolongadas de avião, é recomendável fazer pausas frequentes para caminhar e movimentar as pernas.
Consultas médicas regulares para realizar exames e seguir as orientações do médico sobre o uso adequado de medicamentos anticoagulantes são essenciais para prevenir complicações. É importante estar atento aos sintomas e sinais de coágulos sanguíneos, como inchaço, dor ou vermelhidão nas pernas, dificuldade respiratória, dor no peito ou tosse com sangue, e buscar assistência médica imediatamente se esses sintomas ocorrerem.
5. CONCLUSÃO
Considerando os avanços no entendimento da trombofilia hereditária e seu papel no contexto das doenças autoimunes, bem como as implicações clínicas e terapêuticas associadas a essa condição, é evidente a importância de uma abordagem multidisciplinar e individualizada no manejo desses pacientes. O estudo imunológico da trombofilia hereditária oferece conhecimentos valiosos sobre os mecanismos subjacentes à coagulação sanguínea e suas interações com o sistema imunológico, destacando a complexidade dessa condição. A identificação precoce de biomarcadores genéticos e a avaliação do risco trombótico são fundamentais para orientar a conduta clínica e prevenir complicações graves, como trombose venosa profunda e embolia pulmonar. Além disso, o tratamento individualizado, incluindo o uso de anticoagulantes e medidas preventivas, desempenha um papel crucial na redução do risco de eventos trombóticos recorrentes e na melhoria da qualidade de vida desses pacientes. No entanto, é importante reconhecer que ainda existem desafios significativos a serem superados, como a identificação de novos biomarcadores e o desenvolvimento de terapias mais eficazes. Portanto, são necessárias mais pesquisas e colaborações interdisciplinares para avançar no conhecimento e no manejo da trombofilia hereditária no contexto das doenças autoimunes.
6. REFERÊNCIAS BIBLIOGRÁFICAS
1. Disponível em: https://drauziovarella.uol.com.br/cardiovascular/trombofilia-causas-fatores-de-risco-etratamentos
2. Gabriela Melo de Oliveira TROMBOFILIAS HEREDITÁRIAS E ADQUIRIDAS E POSSÍVEIS COMPLICAÇÕES OBSTÉTRICAS.
3. LEUNG, Lawrence; HUNG, Seward. Thrombotic disorders. ACP Medicine. 2010; 1-21 (MedicinaNet.com). Canadá. Disponível em: https://www.medicinanet.com.br/conteudos/acp-medicine/5708/disturbios_trombotico s_%E2%80%93_lawrence_lk_leung.htm?_mobile=off acesso em 14/04/2024.
4. BRANDAO, Gustavo Muçouçah Sampaio et al. Anticoagulantes orais diretos para o tratamento da trombose venosa profunda: revisão de revisões sistemáticas. J. Vasc. Bras., Porto Alegre, v. 17, n. 4, p. 310- 317, Dec. 2018. Disponível em 🙁https://doi.org/10.1590/1677-5449.005518)
5. MARQUES, Marcos et. al. Pesquisa de marcadores, de trombifilia em eventos trombóticos e venosos: registro de 6 anos de investigação. CENTERVASC Rio de Janeiro, RJ. Vasc Bras. 2009. Disponível em https://research.ebsco.com/c/5eioxo/search/details/5uuvbtvaur?limiters=FT%3AY&q= marcadores%20de%20trombofilia%20 acesso em 08 abr. 2024.
6. ALONSO MARINO, Olga Lídia; ALONSO MARINO, Ana Luísa. Marcadores de trombofilia em pacientes com doença trombótica. Medicentro Electrónica, Santa Clara, v. 2, pág. 155-157, jun. 2018. Disponível em <http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1029-3043201800020 0008&lng=es&nrm=iso>. acesso em 08 abr. 2024.
7. Disponível em: https://blog.jaleko.com.br/cascata-da-coagulacao/
8. LIMA, Jorge; BORGES, Augusta. Rastreio de trombofilias. Boletim da SPHM, Lisboa, v. 27, n. 4, p.5-11, dez. Disponível em: (http://dx.doi.org/10.1590/S0104-42302003000100012.)
9. GODOY,José Maria. Trombose venosa profunda: prevalência da deficiência da proteína S e a interferência da coagulação oral. Revista Brasileira de Hematologia e Hemoterapia, São José do Rio Preto – SC, Abril de 2004. Disponível em (https://doi.org/10.1590/S1516-84842003000400007 ) acesso em 09/04/2024.
10. N.P.A.E.A. Manual Roca Técnicas de Laboratório – Sangue. Grupo GEN, 2011. Página 152. Acesso em 14/04/2024.
11. HERKENHOFF, Marcos. Análise da mutação G20210A no gene da protrombina (fator II) em pacientes com suspeita de trombofilia no sul do Brasil. Jornal Brasileiro de Patolohia e Medicina Laboratorial, Blumenau – SC, Maio de 2012. Disponível em (https://doi.org/10.1590/S1676-24442012000200003) acesso em 09/04/2024.
12. LEUNG, Lawrence. Hemostasis and its Regulation. ACP Medicine. 2012. (MedicinaNet.com). Canadá. Disponível em: <https://www.medicinanet.com.br/conteudos/acp-medicine/6390/hemostasia_e_sua_reg ulacao.htm> acesso em 14/04/2024.
13. GUIMARÃES, Sabrina P et al. Mutação predisponentes à trombofilia em indivíduos de Minas Gerais – Brasil com suspeita clínica de trombose. Revista Brasileira de Hematologia e Hemoterapia, Minas Gerais – MG, Fevereiro de 2009. Disponível em:< https://doi.org/10.1590/S1516-84842009005000004> acessado em 14/04/2024.
14. À Beira do Leito • Rev. Assoc. Med. Bras. 49 (1) • Jan 2003 Disponível em: https://doi.org/10.1590/S0104-42302003000100012
