EXPERIMENTAL STUDY OF THE APPLICATION OF LOW-INTENSITY LIGHT THERAPY IN THE HEALING PROCESS IN THE SKIN OF RATS WITH INDUCED CHEMICAL BURN
REGISTRO DOI: 10.69849/revistaft/th10249201348
Vilma Natividade1
Giuliana Petri3
Luiz Carlos de Abreu1.2
Resumo
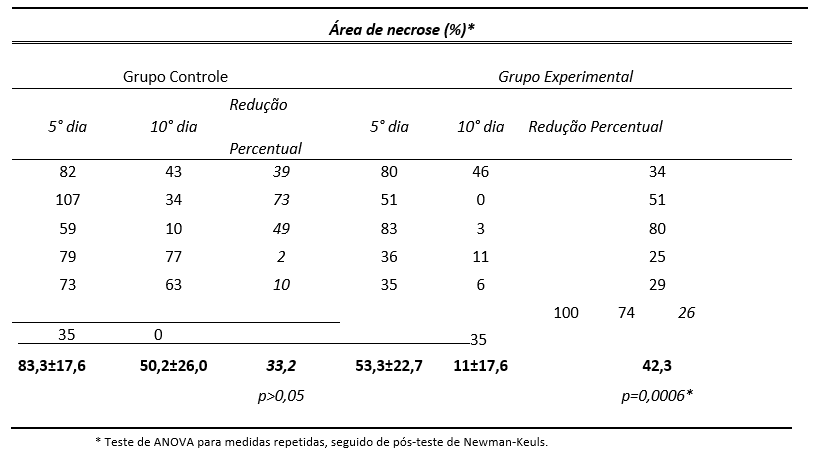
Uma das causas mais comuns de lesões nos humanos é a lesão por queimadura. Este tipo de lesão enfrenta o duplo desafio na reparação e regeneração a partir da periferia, juntamente com o apuramento de tecido necrótico de áreas mais centrais. A terapia com luz de baixa intensidade (TLBI) tem sido utilizada com o objetivo de promover efeitos biológicos de caráter anti-inflamatório e cicatrizante em tecido epitelial e conjuntivo. Objetivo: Avaliar os efeitos da TLBI sobre o tempo e a qualidade da reparação tecidual em pele de ratos pós-queimadura química. Método: Foram avaliados doze ratos adultos, machos e submetidos à queimadura química na região do dorso. Após as queimaduras os animais foram separados ao acaso em dois grupos: controle (G1) e experimental (G2) ambos com seis animais, sendo o G2 tratado pelo TLBI duas horas após a queimadura e nove dias subsequentes a lesão, totalizando 10 dias. E o G1 que recebeu apenas TLBI placebo. Os parâmetros da TLBI foram: luz visível (AlGaInP),660 nm, modo contínuo, potência de 100 mW, densidade de energia de 10j/cm² dosimetria de 2j/cm2, durante dez segundos a cada ponto no interior da queimadura. Para avaliação dos resultados foi utilizada análise histológica, histoquímica e avaliação macroscópica por meio do método de gabarito de papel no quinto e décimo dia após a lesão. Resultados: Na avaliação macroscópica o G2 apresentou área necrótica de 11% da área total e o G1 apresentou área de necrose 53%. Pode se observar no G2 ao décimo dia teve melhor reparação da epiderme e derme comparado ao G1. A análise histológica traduz que o G1 apresentou corte em solução de continuidade da epiderme, na derme observa-se infiltrado inflamatório misto e tecido conjuntivo não modelado, já no G2, nota-se reparação da epiderme, e derme papilar espessa e derme reticular com fibras de colágeno organizadas e distribuídas em várias direções. Nota se ainda tecido de granulação com escassez de vasos neoformados e celularidade aumentada composta de numerosos fibroblastos que se dispõe formando feixes de células empaliçadas, com semelhança de um tecido conjuntivo denso modelado. Na histoquímica na análise sob a luz polarizada, observam-se na derme a grande quantidade de fibras grossas de colágeno apresentando grande birrefringência em amarelo, o que mostra a intensa quantidade de fibras e no G1 foi evidente menor quantidade de fibras de colágeno. Conclusão: A terapia da luz de baixa intensidade favoreceu a reparação das feridas por queimadura química de segundo grau com menor tempo e melhor qualidade da pele por meio das análises realizadas em pele de rato.
Palavras–chave: Queimadura Química, Cicatrização, Terapia da Luz de Baixa Intensidade, Laser de Baixa Potencia, Reparação Tecidual.
ABSTRACT
Introduction: Low intensity light therapy has been used with the aim of promoting biological effects such as healing and anti-inflammatory processes. Objective: To assess the effects of low power laser therapy on time and quality of tissue repair in skin of rats with chemical burns. Method: There were assessed twelve adult rats, males and subjected to second-degree chemical burn, in the region of the back. After the burns the animals were randomly divided into two groups: G1 and G2. The G1 with six rats and 95% confidence interval received placebo Low intensity light therapy (turned off). The G2, also with six rats and 95% confidence interval 2 hours after the burn, undergone to visible laser (AlGaInP) in the range of 660 nm, continuous mode, 100 mW power, dose of 2 J/cm²,100mW of energy density and 10j/cm2 per point of application for ten seconds each point inside the burn. Histological and macroscopic evaluation analysis were made in the 5th and in the 10th day after the burn through the feedback method. Results: On macroscopic analysis, G2 presented 11% and the G1 presented 53% of necrotic areas (p < 0.05). In 10 days it was possible to notice the repair of the epidermis and papillary dermis in G2. Conclusion: Low intensity light therapy The favored the repair of injuries by second-degree chemical burn, decreased the time and showed better quality in the rat’s skin.
Keywords: Chemical Burn, Healing, Low-intensity Light Therapy, Low-Power Laser, Tissue Repair.
INTRODUÇÃO
O tratamento de queimaduras sempre foi um desafio, tanto pela sua gravidade, como pela multiplicidade de complicações que normalmente ocorrem. A cura da queimadura implica não somente em cirurgias de enxertia de pele precoces, mas também em controlar e orientar a regeneração cicatricial, que tende a ocorrer de forma anárquica e com potencial de sequelas e infecções (FERREIRA et al 2005).
Estima-se uma taxa de mortalidade de vítimas por queimadura entre 0,86% a 34,4%, sendo que a maior parte ocorre por infecção e o período de internação que é, em média, de um a 266 dias. Segundo Albuquerque et al (2010) o tempo necessário para a cura da queimadura é um dos principais determinantes para o desenvolvimento de complicações.
Os efeitos deletérios mais importantes do reparo da pele queimada ocorrem em estágios iniciais, levando à diminuição dos elementos celulares e alterações na síntese de colágeno (LEONARDI & YODA, 2013).
Diversos fatores locais e sistêmicos interferem e retardam a reparação e, por isso, a reparação tecidual associado à oxigenação local e o carregamento de substâncias celulares promovida pelo foto-estímulo, tem merecido atenção em vários estudos, em busca de métodos terapêuticos que possam solucionar ou minimizar as falhas no processo de cicatrização da queimadura (CARVALHO et al, 2003).
Atualmente, grande interesse tem sido apontado para o cuidado no processo de reparo tecidual com a utilização de terapia da luz de baixa intensidade (TLBI) como um importante método no processo de reparação.
A TLBI é realizada com o laser(Light Amplification by Stimulated Emission of Radiation), dispositivo constituído por substâncias de origem sólida, líquida ou gasosa, que produzem feixe de luz, caracterizado por ser monocromático, coerente e colimado(LINS et al, 2010).
A TLBI apresenta ação nas organelas celulares, especialmente nas mitocôndrias, nos lisossomos e membrana celular, gerando aumento de ATP (adenosina trifosfato) modificando o transporte iônico, através dos seus fotorreceptores sensíveis a determinados comprimentos de onda e absorvendo os fótons desencadeando em curto prazo, reações químicas que contribuem com a síntese de ATP, que em longo prazo acarreta a transcrição e replicação do DNA (ácido desoxirribonucleico) (ABREU et al, 2011).
O mecanismo fotobiológico primário promovido por este recurso foto físico corresponde à absorção de luz vermelha e infravermelha pelos cromóforos contidos nos componentes protéicos da cadeia respiratória localizados nas mitocôndrias, que, ao absorverem a energia, desencadeiam uma cascata de eventos bioquímicos, resultando no aumento da atividade enzimática, produção de ATP, síntese proteica, proliferação celular, deposição e organização do colágeno, formação do tecido de granulação, reepitelização e contração da ferida durante o processo de reparação de queimaduras (KALENDO et al, 2004).
A cura da queimadura implica não somente cirurgias precoces de enxertia de pele, mas também o controle e a orientação da reparação cicatricial, que tende a ocorrer de forma anárquica, promovendo sequelas e infecções (LEONARDI & YODA, 2013).
Assim o objetivo é avaliar os efeitos da Terapia da luz de baixa intensidade (TLBI) sobre o tempo e a qualidade da reparação tecidual em pele de ratos pósqueimadura química induzida.
MÉTODO
Foram utilizados 12 ratos adultos do sexo masculino (Rattus Norvegicus Albinus) da linhagem Wistar, com peso variando entre 310 e 350 gramas, provenientes do Biotério da Faculdade de Medicina ABC (FMABC).
Os animais foram mantidos em gaiolas individuais, sob luz controlada em foto, período de 12 horas claro/escuro e condições de temperatura, com alimentação e água à vontade. Foram preservados os princípios éticos, legais e de confidencialidade das informações, seguido os preceitos do Comitê de Ética em pesquisa com Animais da Faculdade de Medicina do ABC, com o número de aprovação 001-2012. Estando de acordo com as orientações do CONCEA (Conselho Nacional de Controle de Experimentação Animal), bem como os padrões do Conselho Internacional para o Laboratório de Ciência Animal.
Grupos Experimentais
Os animais foram distribuídos ao acaso nos dois grupos, com seis animais cada grupo: controle (G1) e Experimental (G2).
Os animais foram anestesiados com uma associação de Cetamina 50mg/Kg e Xilazina 10mg/Kg por via intraperitoneal previamente à realização da queimadura química. Para o procedimento realizou-se a tricotomia bidigital seguido da limpeza na pele com solução de iodo-povidon, para prosseguir com o delineamento da área padronizada que foi de 6cm x 3cm, sendo a área total de 18 cm2 na região dorsal do animal, definindo como ponto de referência 1 (um) cm abaixo da quarta vértebra torácica lateralmente à esquerda(figura 1)
A técnica de indução da queimadura química foi padronizada utilizando uma haste de madeira com algodão na ponta, medindo três cm de comprimento e 4 (quatro) mm de diâmetro embebido com ATA (ácido tricloroacético) na concentração de 50% com a técnica ininterrupta de três passagens sobre a área de 18cm2 em cada animal descrita por (SANTOS et al 2004).
No G1 após duas horas da queimadura química foi realizado o modo placebo da TLBI, e no G2, pelo mesmo período de duas horas foi realizada a aplicação TLBI por meio do aparelho Flash Laser III da marca DMC®, São Carlos, SP, com os seguintes parâmetros: luz visível (AlGaInP), 660 nm, modo contínuo, potência de 100 mW, densidade de energia de 10J/cm², técnica pontual transcutâneo no a qual a probe de 0,2 cm era posicionada com leve pressão em angulação de 90°.
Foi respeitada a distância de dois cm entre os pontos, totalizando três pontos no leito da queimadura por animal, e o TLBI foi aplicado durante dez dias consecutivos.
Após 24 horas da última terapia, os animais de ambos os grupos foram sacrificados por meio de uma câmara de gás carbônico (CO2), após serem anestesiados. No instante após o sacrifício, foi realizada a biópsia do tecido da pele a três cm da base do crânio para estudo histológico, incluindo a ferida em reparação.
MÉTODOS DE AVALIAÇÃO
Análise Macroscópica
Para calcular as porcentagens de área de necrose tomou-se como base o quinto e décimo dia de pós-queimadura, por meio do método Gabarito de Papel descrito por Sasaki e Pang (1980). O método consiste em desenhar o limite entre o tecido viável, como pele macia, rósea, quente e o necrosado, pele rígida, escurecida, fria, sem pêlos e com crosta nos animais (figura 2)
Após obter o molde da área queimada por meio do decalque, foi recortado em papel transparente vegetal, pesando em balança de precisão (erro de +/- 0,0001g) e, posteriormente, utilizou-se a seguinte fórmula:

ANÁLISE HISTOLÓGICA
Todas as amostras foram fixadas em formalina a 10% tamponada (pH: 7,4) e embebido em historresina. Após a realização dos cortes histológicos o material foi corado com Hematoxilina e Eosina (HE) e picrossirius para posterior análise do tecido, que foi realizada por um patologista experimente sem conhecimento prévio das amostras ou do método adotado na pesquisa.
Foi utilizado microscópio óptico com aumento de 100x Nikon® (Nikon, Tokyo, Japão). Todas as queimaduras foram classificadas como segundo grau e analisados o processo inflamatório, proliferação celular, a síntese de elementos que constituem a matriz extracelular (colágeno, elastina e fibras reticulares) e a existência de neovascularização.
ANÁLISE HISTOQUÍMICA
Os cortes foram corados em solução 0,1% de Sirius Red (Sirius Red F3B200, Mobay Chemical Co., Union, New Jersey,USA) dissolvido em ácido pícrico aquoso saturado por 1 (uma) hora. Em seguida, foram lavados em água corrente por cinco minutos e contra corados por hematoxilina de Erlich por dois minutos e também lavados em água corrente por cinco min. Em seguida foram desidratados em gradiente de etanol, diafanizados em xilol e montados em Entelan. Os cortes histológicos foram observados ao microscópio de luz polarizada e analisados pelo programa de análise de imagens Image ProPlus 44.1.0.1 (Media Cybernetics, Silver Spring, MD).
ANÁLISE ESTATÍSTICA
Para análise de dados foi usado o programa estatístico Graph Pad Prisma versão 5.0. Realizado o teste de ANOVA para medidas repetidas, e para a confirmação da normalidade foram usados dados não paramétricos. Diferença estatística entre os dados foi considerada significante com valor de p < 0,05.
RESULTADOS
ANALISE HISTOLÓGICA
Os resultados da análise histológica das lâminas grupo tratado com TLBI (G2), nota-se reparação da epiderme, e derme papilar espessa e derme reticular com fibras de colágeno organizadas e distribuídas em varias direções. Nota-se ainda tecido de granulação com escassez de vasos neoformados e celularidade aumentada composta de numerosos fibroblastos que se dispõe formando feixes de células empaliçadas, com semelhança de um tecido denso modelado. Nota–se ainda deposito de grande quantidade de colágeno entre as referidas células. Os anexos dérmicos representados por folículos pilosos mostram-se histologicamente preservados (Figura 4-A e B).
Já os resultados da análise histológica do grupo não tratado (G1) também corado com Hematoxilina Eosina (HE) apresentam corte em solução de continuidade da epiderme, mostrando uma epiderme em reorganização, na derme observa-se infiltrado inflamatório misto e tecido conjuntivo não modelado e preservação de anexos dérmicos, principalmente representados por folículos pilosos e glândula sebácea (Figura 4-C e D).
RESULTADOS DA ANALISE HISTOQUIMICA
Segundo a análise histoquímica, os animais tratados com TLBI (G2), podese observar alterações positivas na derme. Nota-se um tecido conjuntivo com grande quantidade de fibras grossas de colágeno organizadas e grande quantidade de feixes fibras de colágeno distribuído em várias direções (Figura 5-A).
Na análise do material sob a luz polarizada, observam-se na derme grande quantidade de fibras grossas de colágeno apresentando grande birrefringência em amarelo, o que mostra a intensa quantidade de fibras (Figura 5-B).
No G1 é evidente a menor quantidade de fibras de colágeno na derme. Evidencia-se que a quantidade de fibras de colágeno é inferior quanto comparado ao grupo tratado (Figura 5-C, D).
DISCUSSÃO
A reparação dos tecidos é um complexo processo de três fases que envolvem fase inflamatória, a formação de tecido de granulação, e a remodelação. A cura da queimadura implica não somente cirurgias precoces de enxertia de pele, mas também no controle e na orientação da reparação cicatricial, que tende a ocorrer de forma anárquica e com potencial de sequelas e infecções (LEONARDI &YODA, 2013).
A resposta inflamatória dura em média 3 dias, ocorrendo a migração sequencial das células, facilitada por mediadores bioquímicos que aumentam também a permeabilidade vascular (BALBINO et al 2005). Os mediadores bioquímicos são de ação curta e longa. A exemplo de ação curta tem-se a histamina e a serotonina, e as mais duradouras leucotaxina, bradicinina e prostaglandina, sendo esta última a mais importante nesta fase, pois estimula a mitose celular e a quimiotaxia de leucócitos. Os primeiros elementos celulares a alcançar o local da ferida são os neutrófilos e os monócitos (TAZIMA et al 2008).
BOLGIANI et al, (2010) descrevem que quando um tecido sofre agressão por queimadura, há um estímulo nociceptivo, e dependendo da sua intensidade, uma série de fenômenos bioquímicos tem início, alertando o organismo quanto ao risco, e ao mesmo tempo providenciando a sua reparação. Não só os terminais nervosos são estimulados por sua própria lesão, mas também os tecidos circunjacentes, incluindo o sangue, que libera uma grande quantidade de substâncias alogênicas, tais como: substância P e glutamato (terminais nervosos), bradicininas (cininogênio plasmático), calicrininas (células sanguíneas), prostaglandinas (ácido araquidônico-células lesionadas), íons K+ (isquemia – lesão celular), serotonina, fator de necrose tumoral (mastócitos) e ocitocinas (BOLGIANI et al, 2010).
A complexidade da reparação tecidual é descrita por diversos autores, no entanto há uma convergência entre os estudos no que diz respeito aos agentes envolvidos, sendo eles celulares, vasculares ou nervosos, e que o processo de reparo é dependente da gravidade, extensão e tempo de lesão. Por esta razão, recursos que possam de alguma forma potencializar ou mesmo acelerar o processo de reparo, minimizando possíveis complicações cicatriciais, objetivando um reparo mais rápido e de melhor qualidade, justifica-se a investigação dos efeitos da TLBI no reparo tecidual.
Nos últimos 40 anos a terapia por TLBI tem sido aplicada para estimular a cicatrização de feridas em animais e seres humanos, incluindo as queimaduras. O recurso tem mostrado melhores resultados nas fases iniciais do processo de cicatrização e quando utilizado com o comprimento de onda visível correspondente a 660nm (REZENDE & RIBEIRO, 2007), como foi aplicado nessa pesquisa. Os autores justificam que esta terapia aplicada na fase inicial, promove a presença de substâncias vasodilatadoras como: granulócitos, neutrófilos, citocromo C oxidase, sendo estes fotorreceptores (MEDEIROS et al,1992), corroborando com os nossos resultados.
Karu (1999) confirma que os efeitos da irradiação da TLBI dependem da conversão fotoquímica da energia absorvida por fotorreceptores específicos, que podem ser enzimas, membranas ou substâncias, como a melanina, a porfirina, a hemoglobina e o citocromo C oxidase. Ao absorverem a luz, tais elementos assumem estado eletrônico excitado que desencadeia quatro ações primárias: mudanças do estado redox e aceleração da transferência de elétrons, alterações estruturais e da atividade bioquímica pela excitação transitória dos cromóforos; aumento da produção de superóxido; geração de oxigênio molecular.
E assim partindo da hipótese nula de que os grupos seriam iguais, os achados dessa pesquisa apontam para uma diferença estatisticamente significativa entre os grupos com e sem TLBI.
Parizzoto (1998) ressalta ainda que, na sequência, reações secundárias são geradas como alterações dos parâmetros da homeostasia celular (pH, Ca2+, AMPc, ATP e outros), que acontecem horas e até dias após irradiação, como resposta da transdução do fotossinal e da amplificação ao núcleo das células irradiadas. Além da via de estimulação do citocromo C oxidase, considerado fotorreceptor primário, há receptores secundários que absorvem energia por intermédio do campo eletromagnético, havendo uma espécie de ressonância desses campos com as biomoléculas, alterando cargas específicas de membranas e proteínas. O principal representante dos fotorreceptores secundários piezoeletricidade e piroeletricidade que consistem na geração de cargas elétricas, quando submetidos á pressão e calor (PARIZZOTO, 1998 &SOUZA et al,2009), razões estas que podem explicar os possíveis efeitos da fototerapia do reparo tecidual. Efeitos bioquímicos como a liberação de substâncias pré-formadas como histamina, serotonina e bradicinina, bem como a interferência na produção de substâncias como prostaglandinas e endorfinas, também estão relacionados com à ação anti-inflamatória e analgésica do recurso, viabilizando sua aplicação também na prática clínica de pacientes queimados, com vistas a diminuição da dor, uma vez que os mesmos resultados sobre a liberação de substâncias vasoativas e endorfinas são confirmados por (FREITAS ET AL. (2013).
Não foram realizadas avaliações para quantificar a presença, bem como alterações destas substâncias nesta pesquisa, os achados presentes no grupo intervenção (G2) apontam para esta confirmação.
A replicação de resultados divulgados em pesquisa se torna em algumas situações um desafio, pois não há um consenso entre os estudos sobre quais os parâmetros mais adequados a serem aplicados, e nem mesmo as possíveis diferenças entre os resultados em humanos e animais. São encontrados diferentes parâmetros aplicados, que por sua vez, apresentam resultados semelhantes.
Bayat et al (2008) demonstraram que a dose de 1,2 J/cm2com a TLBI visível, aumenta o número total de mastócitos tipo1 e tipo 2 durante a fase inflamatória da cicatrização da queimadura, devido a sua superficialidade e baixa intensidade, tendo como alvo as mitocôndrias. Assim como outros autores (AMIR et al, 2002; VASHEGHANI et al, 2008; KARU, 1999) que também pesquisaram uso de TLBI, com aplicação de energia abaixo de 3 J/cm2 e (LAGAN et al 2001) afirmam que o TLBI acima de 4 J/cm2 provoca um efeito negativo, devido à hipótese de fadiga celular e as alterações na sinalização, ou nas vias metabólicas da célula, foi este, o ponto de partida para a escolha da dosimetria aqui aplicada, contribuindo e colaborando com os achados do grupo intervenção.
Carvalho et al (2003), em concordância com Lagan et al (2001) defendem a idéia de que doses maiores 16J/cm2 podem apresentar o efeito de inibição e que doses baixas como 2J/cm2 são estimulantes no processo de reparação. Baixas doses de luz podem intensificar a formação de um gradiente eletroquímico de prótons transmembrana mitocondrial, que é seguido por uma liberação de cálcio que estimula e desencadeia diversos processos biológicos, tais como a síntese de RNA e DNA, a mitose celular, a secreção de proteínas e proliferação celular.
Em doses mais elevadas, no entanto, demasiado cálcio é liberado, promovendo uma hiperatividade do cálcio-trifosfatase de adenosina (ATPase), bombas de cálcio que esgotam o pool de ATP da célula e gerando a inibição (ABRAHANSE & HAWKINS,2006).
Para RIBEIRO et al (2004)que utilizaram TLBI comprimento de onde de 660nm com doses de 1,8J/cm concordam que TLBI tem ação bioestimulador na cicatrização de feridas, resultando em rápida cura de queimaduras, aumento da síntese de colágeno e aceleração da contração da ferida, melhora da resistência da cicatriz à tração, devido ao aumento evidente na deposição do colágeno, reepitelização precoce com aumento da reação fibroblástica, considerável tecido de granulação e maior concentração de colágeno no tecido cicatricial diminuição importante de células inflamatórias e do edema, com maior proliferação de miofibroblastos.
Em nosso estudo a análise histológica e histoquímica, as lesões mostraram que o grupo tratado com TLBI reparou de forma mais organizada e mais rápida quando comparado ao grupo controle confirmando os efeitos encontrados realizados por (RIBEIRO et al 2004).
Kalendo et al (2004) em estudo com queimadura de terceiro grau em ratos apresentou dados semelhantes aos encontrados nessa pesquisa aqui relatada no que diz respeito ao aumento do influxo leucocitário e aceleração da angiogênese entre os grupos. Nota-se ainda depósito de grande quantidade de colágeno entre meio das células referidas. Os anexos dérmicos, representados por folículos pilosos e glândulas sebáceas mostram-se histologicamente preservados.
A razão da escolha da amostra de doze animais foi devido aos aspectos éticos em pesquisa em animais, segundo o Colégio Brasileiro de Experimentação Animal (COBEA), entidade filiada ao International Council for Laboratory Animal Science (ICLAS),no artigo IV, deve-se em pesquisa utilizar o mínimo necessário de animais para obtenção de resultados (SCHNAIDER &SOUZA, 2003). A quantidade de animais é citada em diversos estudos como em Araújo et al (2012) que utilizaram em sua amostra grupos de quatro animais André et al (2006), Tacon et al (2011),Gonçalves et al (2010) e Conti et al (2007) com seis animais por grupo.
Como citado, neste trabalho a periodicidade de tratamento foi de dez dias consecutivos, sendo que, no primeiro dia, foi realizada duas horas após a queimadura devido a fase inflamatória. Acredita-se que os efeitos benéficos do TLBI tenham ocorrido pela absorção da luz através dos fotorreceptores primários que e secundários por conta da precocidade da irradiação como descrito por LINS et al (2010).
A frequência de tratamento aqui aplicada se diferencia por acelerar o tempo de reparo dos demais trabalhos com reparação tecidual utilizando a terapia a laser. O tempo de cicatrização desse tipo de queimaduras é, em média, de quatro a cinco semanas. Por muitas vezes, levando à necessidade da enxertia (PINFILDI et al, 2006).
Al-Watban et al (2009) observaram que os efeitos do laser eram dependentes das doses e da frequência do tratamento, sendo que em mais de cinco dias por semana, obtinha-se efeito negativo sobre a cicatrização. Contrapondo esses resultados, em nossa análise observa-se melhora da reparação no período de dez dias consecutivos, ressaltando-se que a partir do quinto dia houve melhora significativa.
Como afirma Campos (2004) o laser terapêutico tem efeito antioxidante, por meio da estimulação da enzima Superóxido Dismutase (SOD) principal componente antioxidante do sistema endógeno. Corroborando com Kalendo et al (2004) que relatam possíveis mecanismos de ação do laser de baixa potência sugere o aumento do radical superóxido (O2) e peróxido de hidrogênio (H2O2) que conduzem a regulação do metabolismo celular, em equilíbrio com muitas enzimas antioxidantes.
Ao final do décimo dia, todas as queimaduras já se encontravam reparadas no grupo que recebeu o TLBI e notou-se diferença histológica das fibras colágenas G1 apresentava fibras colágenas finas e tecido conjuntivo não modelado e o G2 que recebeu a TLBI apresentava epiderme regenerada e espessamento da derme papila e tecido conjuntivo modelado.
Assim comprovamos os benefícios TLBI por laser 660nm no tratamento de queimaduras químicas induzidas, com aplicação precoce em baixas doses de 2j/cm2 ou densidade de energia de 10j/cm2, apresenta-se como ferramenta de extrema importância e relevância no tratamento dessas lesões por queimadura.
Ressalta-se a necessidade da continuação dos estudos para tornar esta prática cada vez mais difundida e embasada cientificamente, sugerindo diferentes formas de análises e comparação dos elementos envolvidos no complexo sistema de reparo. Além disso, a divulgação de relatos de casos e experiências clínicas devem ser enfatizadas para diminuir a lacuna determinada pelas diferenças na estrutura cutânea entre animais de laboratório e os humanos.
CONCLUSÃO
A terapia da luz de baixa intensidade por laser 660nm promoveu a reparação das lesões por queimadura química de segundo grau, em menor tempo e com tecido conjuntivo modelado apresentando melhor qualidade tecidual no grupo tratado com TLBI.
REFERENCIAS
Abreu, Eliane Souto de.; Marques, Mariângela E. De Alencar. Histologia da Pele Normal. In: JORGE, Silvia Angélica.; DANTAS, Sonia Regina. Abordagem multiprofissional para o tratamento de feridas. São Paulo: Atheneu, 2003. p.17-29.
Andrade de, Alexsandra G; Lima de, Claudia F; Albuquerque de, Ana Karla B. Efeitos do laser terapêutico no processo de cicatrização das queimaduras. Rev. Bras. Queimaduras, v.9, n.1, mar 2010. p.21-30.
Barros, F.C Laser de baixa intensidade na cicatrização periodontal R. Ci. Méd. biol., Salvador, v.7, n.1, , jan. /abr 2008. p. 85-89.
Balbino, C.A et al Mecanismos envolvidos da cicatrização: Revisão. Revista Brasileira de Ciencias Farmaceuticas Brasilian Journal of Pharmaceutical Sciences vol 41,n.1, jan/mar.,2005.
Bayat, M.; Vasheghani, M.M.; Razavie, N. & Jalili, M.R., Effectsof low-level laser therapy on mast cell number and degranulationin third-degree burns of rats. Journal of Rehabilitation Research & Development, 45(6):, São Paulo 2008. 931–938.
Bolgiani, A. N; Serra, M. C. V. F. Atualização no tratamento local das queimaduras. Rev. Bras. Queimaduras, v.9 n.2, 2010. P. 38-44.
Carvalho, P.T.C.; Mazzer ; Siqueira, j.f.r.; Ferreira, J.V.L.; Silva, I.S. Análise de fibras colágenas através da morfometria computadorizada em feridas cutâneas de ratos submetidos a irradiação do laser HeNe. Fisiot. Bras. v.4, jul-ago 2003. p. 253258.
Chagas-Oliveira, P.; Meireles, G.C.S.; Santos, N.R.; Carvalho, C.M.; Souza, A.P.C.; Santos, J.N. & Pinheiro, A.L.B., The use of light photobiomodulation on the treatment of second-degree burns: a histological study of a rodent model. Photomedicine and Laser Surgery, 26(4):, 2008. 289–299.
Freitas, Abreu R.P et al Low-level laser therapy and micro current in burn wound healing in rats. Associated or isolated therapy Fisioter Pesq. 2013;20(1):24-30.
Gonçalves R.V., et al. Effect of gallium-arsenide laser, gallium-aluminum-arsenide laser and healing ointment on cutaneous wound healing in Wistar rats. Brazilian Journal of Medical and Biological Research, v. 43, n. 4, p. 350-355, 2010.
Lagan, K.M., et al. Low Intensity Laser Therapy (830nm) in the Management of Minor Postsurgical Wounds: A Controlled Clinical Study. Laser Surg. Med., 28: 2732, 2001.
Leonardi et al.;Queimadura pediátrica: fatores associados a seqüelas físicas em crianças queimadas atendidas no Hospital Infantil Joana de Gusmão Vol. 12 nº 2 Revista Brasileira de Queimaduras GO.2013.
Light, Timothy, D. et al. Morphological parameters for assessment of burn severity in an acute burn injury rat model.International Journal of Experimental Pathology, v. 90, n. 1, p. 26-33, 2012.
LINS, Ruthinéia Diógenes Alves Uchôa et al. Efeitos bioestimulantes do laser de baixa potência no processo de reparo. Anais Brasileiros de Dermatologia. Rio de Janeiro, v. 85, n. 6, p. 849-855, dez. 2010.
Mello, P.B.; Sanpedro, R.M.F. & Piccinni, A.M., Efeitos do laser HeNe e do modo de aplicação no processo de cicatrizaçãode queimaduras em ratos. Fisioterapia e Pesquisa, 14(2):6–13, 2007.
Karu TI, Pyatibrat LV, Kalendo GS. Photobiological modulation of cell attachment via cytochrome c oxidase. Photochem. Photobiol Sci.2004:3(2);211-6.
Kalendo, Galina S.; KARU, Tina I.; PYATIBRAT, Ludmila V. Photobiological modulation of cell attachment via cytochrome c oxidase. Photochemical & Photobiological Sciences, v. 3, n. 2, p. 211-216, 2004.
Kubota, J. Effects of diode laser therapy on blood flow in axial pattern flaps in the rat model. Lasers in medical Science, v. 17, n. 3, p. 146-153, 2002.
Kumar, P.; Maiya, G.A.; Rao, L. Effect of low intensity helium-neon (He-Ne) laser irradiation on diabetic wound healing dynamics. Photomed Laser Surg, v. 23, n. 2, p. 187-190, 2005.
Parizzoto, N.A. et al. Adaptation of LDH enzyme in rats undergoing aerobic treadmill training and low intensity laser therapy. Revista Brasileira de Fisioterapia, v. 10, n. 2, p. 205-211, 2006.
Pinfildi, Carlos E. et al. Helium–neon laser in viability of random skin flap in rats. Lasers in surgery and Medicine, v. 37, n. 1, p. 74-77, 2005.
Santos VNS, Ferreira LM, Horibe EK, Duarte IS. Electric Microcurrent in the restoration of the skin undergone a trichloroacetic acid peeling in rats. Acta Cir Bras. 2004;19(5):466-70.
Sasaki GH, Pang CY. Pathophysiology and skin flaps raised on expanded pig skin. Plast Reconstr Surg 1984; 4:59-69.06. Neter, J. Applied linear statistical models. 4.ed. Chicago.
Souza A.P.C et al Laser Photobiomodulation of wound healing: a review of experimental studies in mouse and rat animal models. Hotomed Laser Surg. 2012;29.3
Vasheghani, M.M.; Bayat, M.; Dadpay, M.; Habibie, M. & Rezaei, F., Low-level laser therapy using 80-Hz pulsed infrared diode laser accelerates third-degree burn healing in rat. Photomedicine and Laser Surgery, 27(6):959–964, 2009.
Tacon, Kelly Cristina Borges et al. Healing activity of laser InGaAlP (660nm) in rats. ActaCirúrgica Brasileira, v. 26, n. 5, p. 373-378, 2011.
Tazina.M.F et al Biologia da ferida e cicatrização revista Medicina de Ribeirão R.Preto 2008 41(3) 259-64.
ANEXOS Análise Macroscópica
Figura1: Lesão de Queimadura apresentando área esbranquiçada “ Frosting”
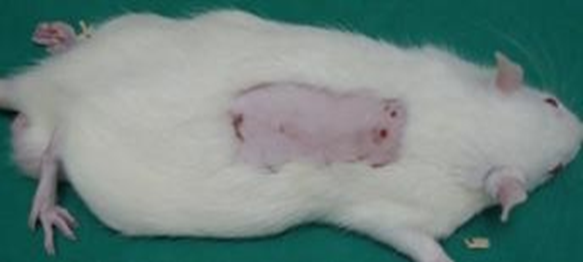
Figura 2: Método Gabarito de Papel “Decalque da Área Necrosada”
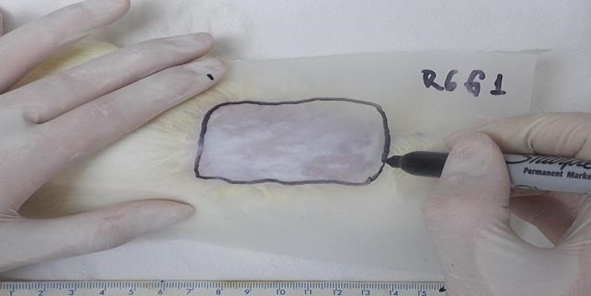
Tabela 1 – Diferença entre o G1 (grupo controle) e G2 (grupo experimental) sobre o tamanho da área de necrose no 5° e 10° dia pós a queimadura
AVALIAÇÃO MACROSCÓPICA DA LESÃO PÓS-QUEIMADURA QUÍMICA INDUZIDA
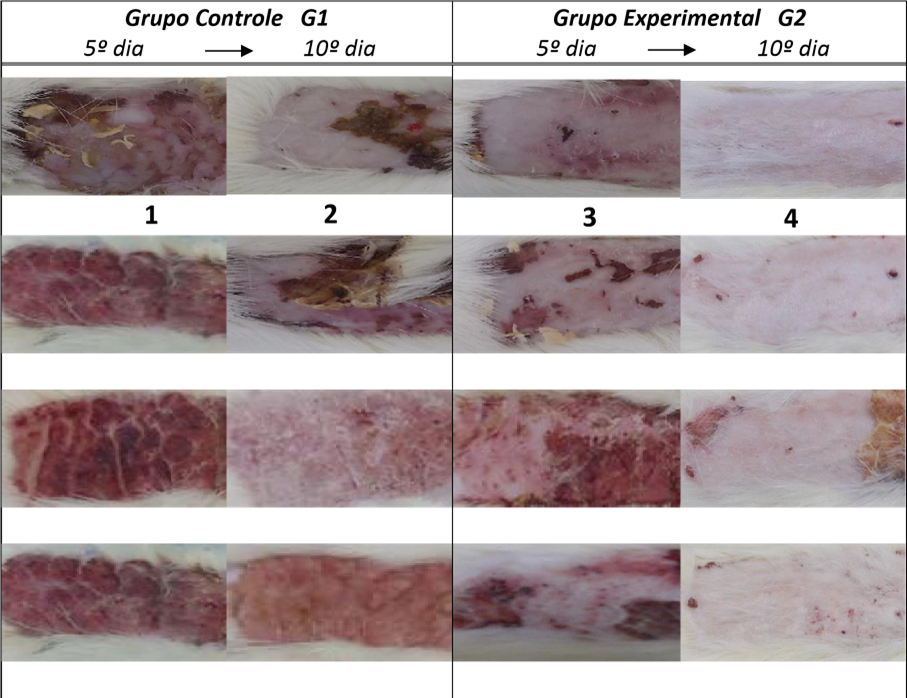
Figura 3 – Aspecto do tecido de reparação por cicatrização após 5 e 10 dias da lesão inicial. (G1- Grupo Controle e G2- Grupo Experimental). G1 (1) Notase no 5dia presença de crosta e áreas com edema e eritema ao redor das crostas no 10 (2) as crostas já estavam sendo eliminadas espontaneamente com presença de eritema e leve edema e algumas lesões com crostas ainda bem aderidas.G2 (3) nota-se pouca presença de crosta leve eritema sem edema (4) nota-se epiderme epitelizada sem presença de crosta, sem eritema e sem edema.
RESULTADO DA ANALISE HISTOLOGICA
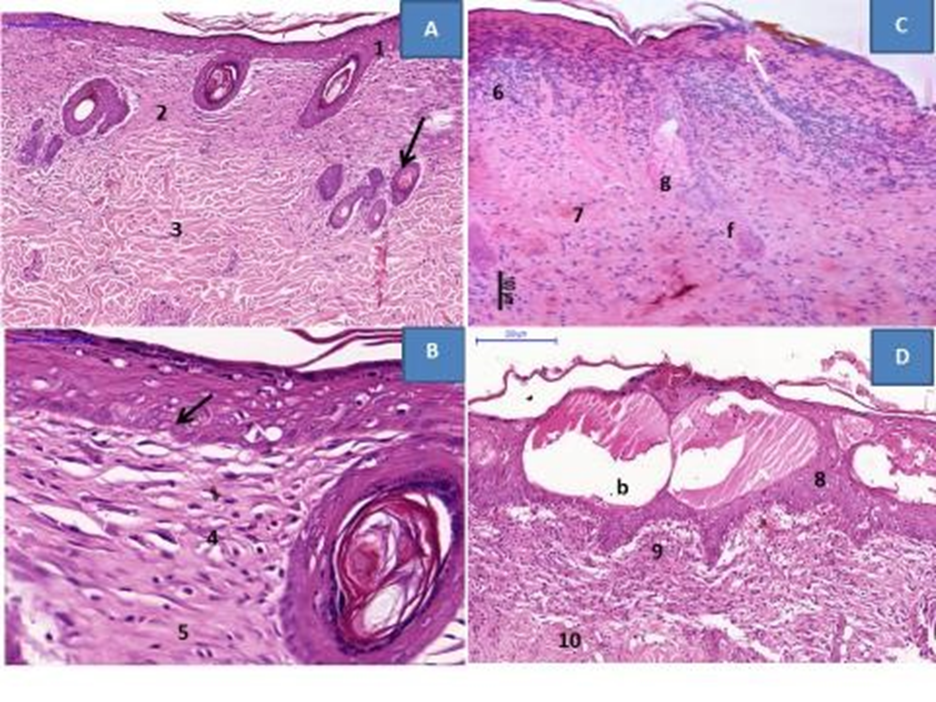
Figura 04: -Fotomicrografia de corte histológico de pele de rato, submetido a queimadura por ATA, corada pela hematoxilina-eosina. A: Observa-se regeneração epitelial homogêneo com espessamento da epiderme (1) derme papilar espessa (2) e derme reticular com tecido conjuntivo denso modelado (3). Observa-se ainda os anexos dérmicos preservados representados por folículos pilosos (seta). B: observa-se epiderme espessada com figura de mitose (seta), presença de grande quantidade de fibroblastos (4) e tecido denso modelado (5). C: observa-se solução de continuidade da epiderme (seta), intenso infiltrado inflamatório (6), colágeno hialinizado (7), preservação de anexos dérmicos representado por folículo piloso (f) e glândula sebácea (g). D: Observa–se a epiderme (8), a derme papilar (9) e a derme reticular (10). Nota se na epiderme a presença formações bolhosas intraepidérmicas (b). Na derme papilar a presença de inúmeras células conjuntivas e na derme reticular, tecido conjuntivo denso não modelado.
RESULTADO ANALISE HISTOQUIMICA
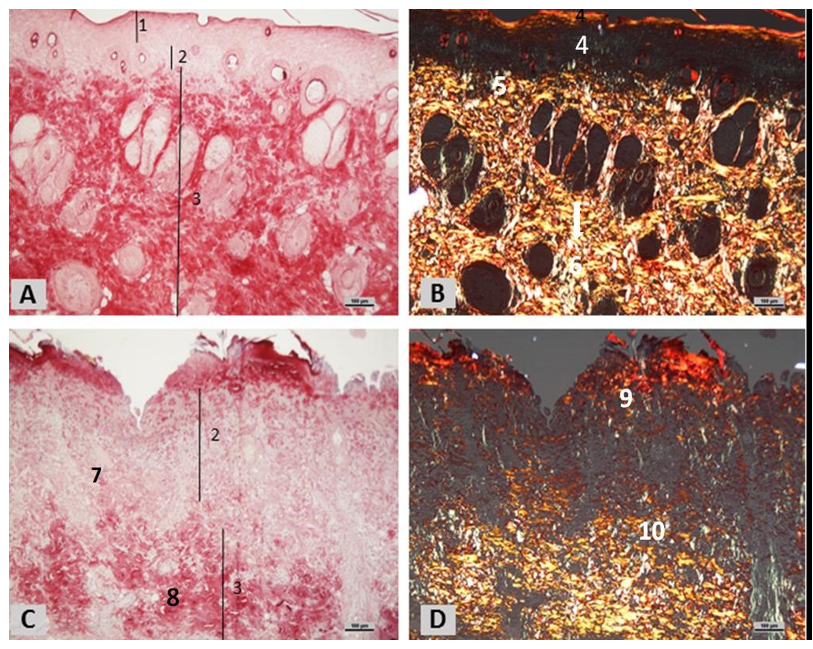
Figura 5: Fotomicrografia da pele de Rato Wistar submetidos a queimadura de segundo grau coradas com picrossírius. Em A, (1) epiderme, queimadura tratada com TLBI (2) derme papilar (2) fibras finas de colágeno em grande quantidade, em (3) derme reticular (4) feixes de fibras grossas de colágeno em varias direções. Em B, queimadura tratada com TLBI coradas com picrossírius sob a luz polarizada derme papilar (5), fibras mais finas de colágeno (6) evidencia-se a grande quantidade de fibras grossas de colágeno apresentando grande birrefringência, o que mostra a intensa quantidade de fibras (7). Em C, queimadura sem tratamento (controle) corada com picrossírius (8) pouca quantidade de fibras colágenas em derme papilar e reticular (9). Em D, queimadura não tratada coradas sob a luz polarizada, (10) (11) não observando birrefrigencia, ou seja, poucas fibras de colágeno na derme.
Aumento: 100X.
1 Laboratório de Delineamento de Estudos e Escrita Científica. Departamento de Saúde da Coletividade. Disciplina de Metodologia Científica. Faculdade de Medicina do ABC. Santo André, SP, Brasil.
2 Departamento de Saúde Materno Infantil, Faculdade de Saúde Pública, Universidade de São Paulo.
3 Coordenadora do Biotério da Faculdade de Medicina do ABC
