EFFECTS OF POLYUNSATURATED OMEGA-3 FATTY ACID SUPPLEMENTATION ON MITOCHONDRIAL DYSFUNCTION MARKERS IN OVERWEIGHT PATIENTS: A SYSTEMATIC REVIEW
REGISTRO DOI: 10.69849/revistaft/pa10202508171128
Wellington Henrique Justo Neto1; Mário Flávio Cardoso de Lima2; Marina Guedes Fraga Lopes3; Sheila Cristina Potente Dutra Luquetti4; Cláudio Teodoro de Souza5
RESUMO
Introdução: Alguns impactos da obesidade ainda não estão totalmente esclarecidos, como a disfunção mitocondrial. É notória a importância das mitocôndrias na regulação de processos como o balanço oxidativo, sinalização da insulina, resposta inflamatória e controle da apoptose. Restaurar a função mitocondrial é crucial para tratar a obesidade e suas complicações. Um alvo terapêutico é a irisina, hormônio conhecido por regular a função mitocondrial e potencialmente estimulado pelo consumo de ácidos graxos ômega-3. Esta revisão objetivou avaliar os efeitos da suplementação de ômega-3 sobre a disfunção mitocondrial em indivíduos com excesso de peso. Metodologia: Revisão sistemática com artigos encontrados nas bases Medline, Cochrane, Emabse, BVS e Opengrey. Para a definição dos critérios de elegibilidade foi adotada a estratégia PICO. Resultados: Um total de 4 estudos atendeu aos critérios de elegibilidade e foram explorados para compor a revisão. Discussão: As alterações provocadas pelo consumo de ômega-3 interferem em importantes eventos regulados pelas mitocôndrias e se refletem em menor dano oxidativo e inflamatório, melhor controle de vias apoptóticas e melhor metabolização de substratos como gorduras e carboidratos, envolvendo ajustes na sinalização da insulina. Conclusão: A suplementação de ômega-3 produz efeitos benéficos na disfunção mitocondrial em pacientes com excesso de peso, impactando em respostas como a inflamação crônica, balanço oxidativo, sensibilidade à insulina e apoptose.
Palavras-chave: Ácidos Graxos Ômega-3; Disfunção Mitocondrial; Obesidade; Diabetes Mellitus Tipo 2; Síndrome Metabólica.
ABSTRACT
Introduction and Objective: Some impacts of obesity are still not fully understood, such as mitochondrial dysfunction. The significance of mitochondria in regulating processes like oxidative balance, insulin signaling, inflammatory response, and apoptosis is well recognized. Restoring mitochondrial function is pivotal in treating obesity and its complications. A therapeutic target is irisin, a hormone known to regulate mitochondrial function and potentially influenced by omega-3 fatty acid consumption. This review aimed to assess the effects of omega-3 supplementation on mitochondrial dysfunction in overweight individuals. Materials and Methods: A systematic review was conducted using articles sourced from databases including Medline, Cochrane, Embase, BVS, and Opengrey. The PICO strategy was adopted to establish eligibility criteria. Results: A total of 4 studies met the eligibility criteria and were explored to form the review. Discussion: Alterations induced by omega-3 consumption impact crucial events regulated by mitochondria, resulting in reduced oxidative and inflammatory damage, improved control of apoptotic pathways, and enhanced metabolism of substrates such as fats and carbohydrates, involving adjustments in insulin signaling. Conclusion: Omega-3 supplementation yields beneficial effects on mitochondrial dysfunction in overweight patients, influencing responses like chronic inflammation, oxidative balance, insulin sensitivity, and apoptosis.
Key words: Fatty Acids, Omega-3. Mitochondrial Diseases. Obesity. Diabetes Mellitus, Type 2. Metabolic Syndrome.
INTRODUÇÃO
A obesidade é uma das maiores preocupações da saúde pública mundial e sua prevalência deve crescer 40% até o fim dessa década 1. É uma doença multifatorial em que os aspectos ambientais e comportamentais são determinantes, e está associada a várias complicações, destacando a resistência à insulina (RI) e o diabetes mellitus tipo 2 (DM2) 2, 3.
Alguns impactos da obesidade ainda não estão totalmente elucidados, como a disfunção mitocondrial. Acredita-se que as mitocôndrias tenham sua função afetada pela oferta nutricional demasiada, o que impõe um quadro de hiperatividade sobre essa organela, já potencialmente comprometida pela inatividade física, resultando em uma crítica associação deletéria 4. A disfunção mitocondrial contribui grandemente para a manutenção e agravamento da obesidade e de suas comorbidades por regular processos primordiais ao metabolismo 5.
Com a função mitocondrial aplacada, respostas importantes são afetadas como o balanço oxidativo, o controle da apoptose, a sensibilidade à insulina e a resposta inflamatória 6. Essas alterações produzem respostas como o estresse oxidativo (EO) e prejuízos no metabolismo da glicose, podendo culminar em DM2. Além disso, a deterioração das mitocôndrias prejudica eventos clínicos importantes como a perda de peso, já que a oxidação de gorduras ocorre justamente nessas organelas.
Abordagens capazes de reaver a função mitocondrial são de grande valia para a saúde pública e convenientes para o gerenciamento da obesidade e das comorbidades associadas. Um potencial alvo terapêutico é a irisina, um hormônio descrito originalmente em 2012 e conhecido por atuar no escurecimento do tecido adiposo (TA) branco e potencializar a oxidação de substratos pelo aumento na expressão de proteínas desacopladoras (UCPs) 7.
Em modelos in vitro, a irisina foi capaz, simultaneamente, de reaver a produção normal de ATP reajustando a fosforilação oxidativa, e reduzir a geração de espécies reativas de oxigênio (EROs), mesmo na presença de um quadro inflamatório 8. Em modelos experimentais, animais knockout para irisina apresentaram uma grave disfunção mitocondrial caracterizada pela menor produção de ATP e pela redução na atividade dos complexos respiratórios I, III e V, e essas desordens eram corrigidas pela administração do hormônio. Ainda foi descrito que a irisina participava diretamente do ciclo de vida celular por regular a apoptose 9. E veremos posteriormente, nos resultados deste estudo, que esses desfechos fisiológicos são impactados pelo consumo de ômega-3 também em humanos.
Alguns estudos vêm sugerindo que o consumo de ômega-3 estimula a produção da irisina 10. Nesse contexto, a suplementação com ácidos graxos poli-insaturados ômega-3 de cadeia longa (n-3 PUFAs), como os ácidos graxos docosahexanóico (DHA), eicosapentanóico (EPA) e alfa-linolênico (ALA), pode configurar uma estratégia promissora. No que tange à dosagem, concentrações de 1,2g de ômgea-3 já parecem ser suficientes para aumentar os níveis séricos de irisina em pacientes com excesso de peso, podendo produzir efeitos positivos sobre a maquinaria mitocondrial 11.
Embora o ômega-3 tenha sido amplamente estudado pelo seu efeito anti-inflamatório, não é consensual a participação desse bioativo na disfunção mitocondrial, particularmente na obesidade e nas alterações metabólicas associadas a essa doença. A estimulação da irisina induzida pelo consumo de ômega-3 permite hipotetizar que essa intervenção produza efeitos sobre a dinâmica mitocondrial. Portanto, a partir de uma estrutura de revisão sistemática (RS), este estudo objetivou investigar os efeitos da suplementação de ômega-3 sobre a disfunção mitocondrial, em indivíduos fisicamente inativos e com excesso de peso, bem como elucidar o impacto dessas eventuais alterações em respostas fisiológicas associadas a essa condição.
MÉTODOS
Questão norteadora, protocolo e registro
Essa RS foi guiada pelas seguintes questões: Qual o impacto da suplementação de ômega-3 sobre parâmetros de disfunção mitocondrial em indivíduos fisicamente inativos e com excesso de peso? E ainda, qual o impacto dessas eventuais alterações em respostas fisiológicas associadas a essa condição?
Os parâmetros considerados ao inferir a (dis)função mitocondrial foram: apoptose, balanço oxidativo, sensibilidade à insulina e inflamação. Para o desenvolvimento desta RS foram seguidas as diretrizes propostas pelo PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analysis) 12. O presente estudo foi protocolado na plataforma PROSPERO (International prospective register of systematic reviews) sob o registro CRD42022346138.
Estratégia de busca
A busca bibliográfica foi realizada nas bases de dados eletrônicas Medline, Embase, Cochrane e Biblioteca Virtual em Saúde (BVS), além do Opengrey que foi consultado para verificação da literatura cinzenta. Os termos Mesh foram devidamente consultados para embasar a construção da estratégia de busca empregada. Assim, nas bases Medline, Cochrane e Embase, a busca foi realizada, inicialmente, utilizando os termos Mesh “Mitochondria” e “Omega-3 fatty acids” conectados pelo operador lógico booleano “and”. Como não existiam termos Mesh específicos para caracterizar a disfunção mitocondrial (objeto de estudo deste trabalho), indicando tratar-se de um tema ainda pouco explorado, e devido ao pequeno número de trabalhos encontrados, foi performada, adicionalmente, uma pesquisa simples. Nesse momento foram adotados os termos “mitochondrial dysfunction and omega-3 fatty acids”, “mitochondrial function and omega-3 fatty acids” e “mitochondrial dynamics and omega-3 fatty acids”.
Para as buscas efetuadas na base Biblioteca Virtual em Saúde (BVS) foram consultados os termos do dicionário DeCS (descritores em ciências da saúde) e foi realizada uma pesquisa com os termos “mitocôndrias” e “ácidos graxos ômega-3” associados pelo operador “and”. A exemplo do que foi feito nas outras bases de dados, também foi desenvolvida uma busca complementar na BVS. Aqui foram adotados os vocábulos “disfunção mitocondrial e ácidos graxos ômega-3”, “função mitocondrial e ácidos graxos ômega-3” e “dinâmica mitocondrial e ácidos graxos ômega-3”. Essas pesquisas foram triplamente executadas adotando os filtros de “título, resumo e assunto”; “descritor de assunto”; e “assunto principal”.
A literatura cinzenta também foi consultada. Essa pesquisa foi realizada por meio da base OpenGrey, que foi explorada por uma pesquisa simples a partir das expressões “mitochondria and ômega-3 fatty acids”, “mitochondrial dysfunction and omega-3 fatty acids”, “mitochondrial function and omega-3 fatty acids” e “mitochondrial dynamics and omega-3 fatty acids”. Foram selecionados apenas trabalhos sob o formato de artigo.
As estratégias de busca não foram restringidas por idioma ou data, sendo filtradas apenas quanto à espécie estudada (humanos). As buscas foram realizadas entre os meses de abril e junho do ano de 2022, limitando-se a ensaios clínicos randomizados e controlados. A lista de referências bibliografias dos artigos elegíveis selecionados pelas bases de dados, foram verificadas manualmente para encontrar possíveis publicações de interesse.
Seleção dos estudos
Três revisores conduziram a pesquisa bibliográfica e fizeram a seleção dos artigos de forma independente. As divergências eram discutidas com o quarto e com o quinto pesquisadores para que um consenso fosse alcançado. Os artigos foram selecionados por título, resumo e leitura integral, nessa ordem. Sendo excluídos, manualmente, os estudos duplicados e estudos secundários (Figura 1).
Foi adotada a estratégia PICO (do inglês: Participants, Intervention, Comparations, Outcomes) para a definição prévia dos critérios de elegibilidade e exclusão, e foram incluídos apenas os estudos que atenderam todos os critérios descritos a seguir. A população considerada foi composta por adultos e idosos de ambos os sexos, fisicamente inativos e classificados com excesso de peso corporal (IMC ≥ 25 kg/m2). A intervenção foi a suplementação com ômega-3 que deveria conter, ao menos, os ácidos graxos eicosapentaenoico (EPA) e docosahexaenoico (DHA), sem delimitar dosagem e proporção desses ácidos graxos. Estratégias de enriquecimento dietético com alimentos fontes de ômega-3 não foram consideradas pela impossibilidade de um controle preciso das quantidades consumidas do bioativo. O comparador deveria ser constituído de placebo ou controle (não intervenção). E os desfechos observados foram – além, evidentemente, da produção energética – respostas comumente relatadas na literatura ao inferir o status de funcionalidade das mitocôndrias: apoptose, balanço oxidativo, inflamação e sensibilidade à insulina. Vale lembrar que não existem desfechos padronizados para função ou disfunção mitocondrial, nem mesmo em plataformas especializadas como a COMET initiative.
Extração e síntese dos dados
Após a seleção dos ensaios clínicos, foram extraídas, por meio de tabela estruturada, as seguintes informações: Nome dos autores, ano da publicação, características da amostra, duração da intervenção, dosagem da suplementação, principais resultados e desfechos avaliados para inferir a disfunção mitocondrial. Os pesquisadores compararam os dados extraídos para garantir integridade e confiabilidade.
Risco de Viés
O risco de viés foi avaliado com auxílio da ferramenta de risco de viés para Ensaios Randomizados da Cochrane (em inglês, Cochrane risk-of-bias tool for randomized trials 2.0 [RoB 2]). O risco de viés foi mensurado com a avaliação dos seguintes domínios: o processo de randomização (D1); desvios das intervenções pretendidas (D2); falta de dados dos resultados (D3); medição do resultado (D4) e seleção do resultado relatado (D5). Os estudos foram então classificados como “baixo risco de viés” (low risk), “algumas preocupações” (some concerns) ou “alto risco de viés” (high risk), conforme a avaliação
RESULTADOS
Seleção dos estudos
O fluxograma com o número de artigos selecionados e excluídos em cada etapa foi construído de acordo com as diretrizes do PRISMA e é mostrado na Figura 1. A estratégia de busca utilizada encontrou inicialmente 35 artigos das bases de dados pesquisadas, sendo excluídos 8 estudos que estavam duplicados. Ao revisar os títulos e resumos, foram excluídos 3 artigos por não serem pertinentes a temática da revisão. Dessa forma, 24 artigos foram selecionados para leitura completa do texto. Destes, 20 artigos foram excluídos devido aos seguintes fatores: não se tratar de estudo clínico randomizado controlado (9), não investigar a população de interesse (1) e inacessibilidade ao conteúdo integral do artigo (10). Foi realizada a busca de citações para identificar outros estudos relevantes, porém, nenhuma pesquisa atendeu aos critérios de elegibilidade. Finalmente, 4 artigos foram incluídos nesta revisão.
Descrição dos estudos incluídos
A Tabela 1 apresenta uma síntese das informações extraídas dos estudos revisados. Nos quatro trabalhos incluídos foram estudados 129 indivíduos, de ambos os sexos, com idades variando de 18 até 85 anos. O tempo médio de intervenção foi de aproximadamente 4 meses e meio, variando entre 2 semanas e 6 meses de suplementação. Todos os pacientes tinham obesidade ou sobrepeso, e alguns ainda eram acometidos por outras condições metabólicas patológicas como resistência à insulina, doença hepática gordurosa não alcoólica e alterações na glicemia de jejum e colesterol HDL. Além disso, todos eram fisicamente inativos.
Suplementação com ômega-3
A dosagem da suplementação variou de 0,945g a 3,9g de ômega-3 ao dia, sendo sempre fracionada em 3 ou 4 cápsulas diárias. Apenas um estudo utilizou doses substanciais de ALA, enquanto nos outros três trabalhos, a suplementação era basicamente composta por EPA e DHA, em diferentes proporções, indicando diferentes fontes de extração do óleo. Três dos estudos empregaram algum tipo de placebo como controle da intervenção aplicada, sendo que o estudo de Okada et al. (2018) utilizou óleo mineral, Lalia et al. (2015) fez uso de etil oleato e Yoshino et al. (2016) adotou o óleo de milho, enquanto Anderson et al. (2014) não dispôs de grupo placebo em seu ensaio, sendo o controle feito pela ausência de intervenção.
Tecidos e análises relativas à função e disfunção mitocondrial
O ensaio clínico conduzido por Anderson et al. (2014) incluiu pacientes com sobrepeso ou obesidade e alguns ainda eram afetados por outras doenças metabólicas como DM2 e hipertensão que viriam a passar por uma cirurgia cardíaca. Durante a intervenção cirúrgica, uma amostra de tecido cardíaco era obtida a partir do átrio direito. Esse tecido foi alvo de análises do consumo de oxigênio por oxígrafo de alta resolução (Oroboros), de produção de ATP pela hidrólise desse nucleotídeo a NADPH, espectrofluorometria para mensurar a emissão de H2O2, e análises de imunoblot para a expressão do gene codificador da Cox4, uma proteína encontrada na membrana interna das mitocôndrias, e do receptor PPAR-γ. Dessa forma foi possível observar desfechos como o balanço oxidativo e a biogênese mitocondrial.
A pesquisa conduzida por Lalia et al. (2015) contou com uso do DEXA para determinar massa corporal e massa gorda total. A função mitocondrial foi mensurada a partir da capacidade oxidativa, que foi dosada pela taxa de recuperação do conteúdo de fosfocreatina pós esforço no músculo tibial anterior. Para a biópsia foi coletada amostra do vasto lateral e a taxa de respiração foi obtida pelo fluxo de elétrons nos complexos da cadeia respiratória, o que era balizado pela quantidade de cópias de DNA mitocondrial, permitindo inferir alterações quanto à função dessas organelas e à biogênese.
Yoshino et al. (2016) e colaboradores também utilizaram tecido muscular para realizar suas análises. Foi coletado tecido muscular do quadríceps femoral, o qual foi objeto de análises gênicas, via PCR em tempo real, referentes à várias moléculas envolvidas na cadeia transportadora de elétrons e fosforilação oxidativa.
No trabalho de Okada et al. (2018) foram coletadas amostras de tecido hepático e plasma oriundo do sangue periférico. As biópsias hepáticas foram analisadas, de forma independente, por dois patologistas experientes e cegados. Foram feitas análises proteonômicas de moléculas envolvidas no metabolismo lipídico, estresse do retículo endoplasmático, respiração celular e matriz celular para inferir o status de funcionalidade das mitocôndrias, compreendendo processos como o balanço oxidativo e a produção energética. O tratamento com ômega-3 promoveu aumento nas concentrações plasmáticas de ALA, EPA e DHA.
Efeitos do ômega-3 em parâmetros da função e disfunção mitocondrial
Excetuando o estudo de Lalia et al. (2015), os demais trabalhos encontraram diferenças significativas em resposta à suplementação de ômega-3. A pesquisa de Okada et al. (2018) evidenciou uma maior mobilização dos lipídeos no meio intracelular, resultando em aumento no transporte e na oxidação desses substratos, além de constatar ampliação do sistema de defesa antioxidante materializada pelo aumento na atividade das enzimas superóxido dismutase (SOD) e catalase (CAT). Anderson e colaboradores (2014) também verificaram melhora do sistema de defesa antioxidante, caracterizado pelo aumento na atividade das glutationa peroxidases 1 e 4, e da NADPH-quinona oxidoredutase-1 (NQO-1). Além disso, nesse estudo, o consumo de ômega-3 foi capaz de aumentar a expressão de PPAR-γ. Na investigação conduzida por Yoshino et al. (2016), foi observado um aumento na expressão da subunidade 1 da ubiquinol- citocromo c redutase (UQCRC1), uma proteína responsável por mediar importantes respostas produzidas pelas mitocôndrias, como a regulação da apoptose via inibição das caspases. Outro achado interessante desse estudo foi o aumento na expressão da proteína desacopladora 3 (UCP- 3). Ainda nesse trabalho, a suplementação com ômega-3 gerou efeitos secundários como a melhora da capacidade funcional dos pacientes aumentando a força muscular medida por testes de 1RM e por handgrip, e ainda promoveu, simultaneamente, aumento do volume muscular e redução do conteúdo de gordura intramuscular.
Risco de viés
Para avaliar o risco de viés dos trabalhos incluídos nesta RS, foi utilizada a ferramenta RoB 2 (Figura 2). Todos os estudos foram bem avaliados quanto ao processo de randomização, não havendo qualquer ressalva. Alguns desvios foram notados nas intervenções pretendidas, na mensuração do resultado ou ainda na seleção do resultado relatado, mas sem afetar o risco de viés do trabalho como um todo.
DISCUSSÃO
Esta RS investigou os efeitos da suplementação de ômega-3 sobre parâmetros de disfunção mitocondrial em pacientes com excesso de peso, afetados ou não por outros fatores de risco metabólico. A maioria dos estudos incluídos aponta efeitos positivos dessa intervenção, que além de mitigar a disfunção mitocondrial, ainda repercutiu em respostas adicionais como o fortalecimento do sistema de defesa antioxidante. Essas respostas podem ser observadas já a partir de duas semanas de suplementação, indicando que essa terapia pode contribuir para o tratamento da obesidade e demais doenças associadas.
Nossa RS mostra que um dos efeitos produzidos pelo consumo do ômega-3 foi o aumento na atividade da SOD. Na mitocôndria, os ácidos graxos ômega-3, especialmente o DHA, atuam em vias importantes para o balanço oxidativo. Entre essas ações destacam-se a redução na atividade da citocromo c oxidase, o aumento na atividade da SOD e a inibição do processo de peroxidação da membrana 17, 18. Em adição, o consumo de ômega-3 parece se relacionar inversamente com os níveis de keap1 (proteína tipo kelch associada a ECH – 1), uma proteína que regula negativamente o fator nuclear Nrf2 (fator nuclear eritroide 2 relacionado ao fator 2), que, por sua vez, participa de uma das principais vias de aumento da defesa antioxidante 19. Cabe ressaltar que pesquisas básicas evidenciam o envolvimento da irisina no fortalecimento do sistema de defesa antioxidante, destacando aumentos na atividade da SOD e da GPx 8.
Existem divergências sobre os mecanismos envolvidos na relação entre ômega-3 e EO, e alguns autores defendem que essas respostas sejam baseadas na imunomodulação promovida por esses ácidos graxos. Nesse cenário ocorre uma redução na ativação de células imunes e uma consequente contenção na produção de citocinas inflamatórias como IL-6 e TNF-a, que são bem conhecidas por fomentar a produção de ROS nas mitocôndrias 20, 21. Considerando que a geração de ROS impacta negativamente no estado inflamatório, ficamos diante de um ciclo vicioso que pode ser combatido com o consumo de ômega-3.
Em estudos experimentais já foi possível observar que a atividade da CAT é prejudicada pela obesidade induzida por dieta, e que a suplementação com ômega-3 pode reaver esse dano e reestabelecer a condição de normalidade 22. Cabe destacar que alguns estudos relataram que aumentos na expressão da CAT melhoram a função mitocondrial, o que, aparentemente, ocasionou uma significante redução da RI e da apoptose induzida por ROS 23, 24. Portanto, o envolvimento da CAT na preservação da função mitocondrial deve ser considerado. Outras enzimas antioxidantes impactadas positivamente pela ingestão de ômega-3 são a GPx1 e a GPx4. Essas proteínas atuam na remoção do H2O2 utilizando-o como substrato para a oxidação da GSH 25.
A NQO-1 também foi estimulada pelo consumo de ômega-3 e apresentou uma expressão acentuada em resposta à suplementação. Essa enzima usa a proteína flavina para reduzir quinonas a fenóis, e, além de suas propriedades antioxidantes já bem relatadas, exerce funções metabólicas significativas, conferindo proteção contra obesidade, hipertensão, estenose arterial, lesão renal e distúrbios neurodegenerativos 26. Estudos mecanicistas já demonstraram o envolvimento dessa enzima na mediação dos efeitos benéficos da restrição calórica na obesidade e ainda apontam para uma correlação negativa entre os níveis de NQO-1 e a inflamação subclínica 27, 28. Em estudos in vitro e em modelos experimentais de dieta hiperlipídica, o aumento, tanto em expressão quanto em atividade, da NQO-1 potencializou a atividade mitocondrial e inibiu a produção de ROS por regular a relação NAD+/NADH, suscitando a atividade da sirtuína 1 (SIRT-1), enzima conhecida por aumentar a sensibilidade à insulina, estimular o PGC-1a e combater a obesidade e a síndrome metabólica (SM) 29, 30.
No estudo de Anderson et al. (2014), foi observado um aumento considerável na atividade do PPAR-γ em resposta ao consumo de ômega-3, o que é descrito pelos autores como a provável explicação molecular para os efeitos benéficos do ômega-3 sobre o tecido muscular cardíaco. Os receptores PPAR podem ser estimulados tanto por EPA quanto por DHA, e, além dos efeitos sobre a maquinaria mitocondrial e a metabolização de lipídeos, apresentam efeito anti-inflamatório por inibir a via do NF-kB, contribuindo no combate à inflamação subclínica 31.
Nesta revisão foi evidenciado que a intervenção com ômega-3 pode aumentar a expressão do gene UQCRC1, tendo como produto gênico a subunidade 1 de uma proteína da cadeia respiratória, a ubiquinol-citocromo c redutase. Esse achado converge com os resultados de Dave et al. (2022) que mostraram aumento na expressão gênica do UQCRC1 (Figura 3), culminando em aumento na atividade do complexo III mitocondrial em células nervosas com prejuízos na função mitocondrial tratadas com DHA. Em pesquisa acerca da funcionalidade dessa proteína, foi indicado que deficiências na UQCRC1 estão relacionadas com o aumento do citocromo c no citoplasma, estimulando a via das caspases e apresentando o importante papel dessa proteína na mediação da apoptose regulada pelas mitocôndrias (Figura 5). Esse trabalho ainda reforça que uma menor expressão de UQCRC1 implica em menores taxas de produção de ATP e, mutuamente, em uma geração exacerbada de ROS, desestabilizando a estrutura do complexo III e comprometendo a integridade da membrana mitocondrial, causando extravasamento do citocromo C ao citosol 33.
Em pesquisa anterior, conduzida por Yi et al. (2020), já havia sido mostrado o envolvimento da UQCRC1 na mediação do processo de apoptose. Na referida pesquisa, os autores sinalizaram que o aumento dessa proteína potencializa a expressão da proteína antiapoptótica Bcl-2 e diminui a expressão da proteína pró-apoptótica Bax, e da caspase 3. Interessantemente, esses efeitos foram completamente anulados pela inibição da PI3K. Além disso, a superexpressão de UQCRC1 aumentou drasticamente a fosforilação de moléculas
jusante à PI3K, como a AKT, que, entre tantas funções, atua na cascata de sinalização da insulina regulando o metabolismo da glicose 34. Esses achados são, potencialmente, novas evidências da relação entre disfunção mitocondrial e sensibilidade à insulina, materializados aqui pela ativação das proteínas UQCRC1, PI3K e AKT, indicando que a dinâmica mitocondrial influencia e é influenciada pela sinalização desse hormônio. E, em modelos experimentais, foi observado que a irisina regula positivamente marcadores pró-sobrevivência como Bcl-2 e survivina, e negativamente parâmetros pró-apoptóticos como Bax e caspase 9 9, 35. Esses dados podem sugerir a participação massiva desse hormônio na dinâmica mitocondrial ao ser estimulado pelo ômega-3.
A UCP3 foi outra proteína cuja expressão foi alterada pela terapia com o ômega-3. A UCP3 dissipa o gradiente eletroquímico de prótons (H+) em forma de calor, reduzindo a eficiência energética e provocando um aumento na oxidação dos substratos, motivo pelo qual, alguns pesquisadores compreendem essa via como um ciclo fútil 36. A maior expressão de UCP3 encontrada nessa revisão vai ao encontro dos achados evidenciados por Martins et al. (2018) em análises mecanicistas com modelos experimentais. Nesse estudo, foi induzida obesidade e RI em camundongos com uma dieta hiperlipídica e constataram que a suplementação com óleo de peixe era capaz de atenuar os efeitos deletérios produzidos pelo excesso de adiposidade 37. Apesar dos estudos em humanos serem incipientes, o aumento de UCP3 é um mecanismo amplamente debatido e bem aceito ao explicar alguns efeitos provocados pelo consumo de ômega-3, como os citados acima, e outros como o aumento da capacidade oxidativa no músculo, e o aumento da taxa metabólica de repouso 38, 39. Outro efeito promovido pelo consumo de PUFAs encontrado nessa revisão foi o aumento na mobilização intracelular de lipídeos, que pode inclusive ser, ainda que parcialmente, atribuído ao aumento na expressão da UCP3 que atua no transporte dos ácidos graxos até a matriz mitocondrial, fomentando a oxidação 40, 41.
Entre os trabalhos incluídos nessa revisão, o único que não apresentou algum efeito benéfico do ômega-3 sobre a dinâmica mitocondrial foi a pesquisa de 14. Esse ensaio clínico duplo-cego foi randomizado e controlado por placebo, e adotou uma metodologia robusta envolvendo medidas padrão-ouro como biópsia e cultura ex vivo, porém, não foi avaliada a absorção do ômega-3 pelo tecido-alvo. A absorção do ômega-3 foi inferida a partir das alterações nos níveis plasmáticos de EPA e DHA, o que não necessariamente representa a incorporação tecidual desses AGs 42. A inalterada função mitocondrial também pode ser explicada pelo elevado IMC dos pacientes, ficando em torno de 35 kg/m2, e pelos altos índices de gordura corporal e abdominal, podendo sugerir que, em situação de severo estresse mitocondrial, o ômega-3 não tem ação efetiva, pelo menos não com o tempo de uso e dosagem propostos, e sem associação com outras modificações no estilo de vida e/ou tratamento farmacológico.
Limitações
Embora esta RS tenha exibido respostas positivas do consumo de ômega-3 sobre a disfunção mitocondrial, alguns pontos não puderam ser totalmente esclarecidos. A escassez de estudos sobre o tema é um ponto importante, o qual tentamos solucionar traçando rigorosos critérios metodológicos para a elegibilidade dos trabalhos, explicando o baixo número de artigos incluídos. Ainda assim, algumas diferenças consideráveis podem ser notadas quanto à dose de PUFAs consumido e ao tempo de intervenção. A falta de padronização sobre os desfechos adotados na definição de disfunção mitocondrial, mesmo em plataformas especializadas como a COMET initiative, foi outro fator limitante, gerando certa heterogeneidade nas análises. Além disso, a falta de descritores controlados pode ter impossibilitado a identificação de trabalhos pertinentes à construção dessa revisão por divergências nos termos de indexação.
Alguns estudos utilizados nessa revisão realizaram análise de cromatografia gasosa ao avaliar os suplementos utilizados em suas intervenções e placebos, mas sem investigar a eventual presença agentes antioxidantes conhecidos que poderiam configurar um confundidor.
CONCLUSÃO
Esta RS aponta evidências de um potencial efeito benéfico da suplementação de ômega- 3 na disfunção mitocondrial em pacientes com excesso de peso, e ainda, sinaliza como essas alterações impactam em respostas fisiológicas notadamente desajustadas nessa condição clínica, como a inflamação crônica, produção de ROS, sensibilidade à insulina, apoptose e metabolização dos substratos energéticos. No presente estudo pôde ser observado que doses inferiores a 1g de suplementação, e tratamentos de duas a três semanas de duração já podem promover resultados promissores na maquinaria mitocondrial.
Os efeitos antioxidante e antiapoptótico do ômega-3 evidenciados nesta revisão podem estar refletindo os achados encontrados em estudos experimentais e in vitro com irisina, e indicando o envolvimento desse hormônio como mediador dos efeitos do ômega-3 na maquinaria mitocondrial. Assim, essa relação deve ser considerada em pesquisas futuras.
CONFLITOS DE INTERESSE
Os autores declaram não possuírem quaisquer conflitos de interesse para realização desde estudo.
REFERÊNCIAS
1. Kovesdy CP, Furth SL, Zoccali C. Obesity and kidney disease: hidden consequences of the epidemic. J Bras Nefrol. 2017;39(1). https://doi.org/10.5935/0101-2800.20170001
2. Freshwater M, Christensen S, Oshman L, et al. Behavior, motivational interviewing, eating disorders, and obesity management technologies: An Obesity Medicine Association (OMA) Clinical Practice Statement (CPS) 2022. Obesity Pillars. 2022;2:1-13. https://doi.org/10.1016%2Fj.obpill.2022.100014
3. Kumar R, Mal K, Razaq MK, et al. Association of Leptin With Obesity and Insulin Resistance. Curēus. 2020;12(12):1-4. https://doi.org/10.7759/cureus.12178
4. Mthembu SXH, Mazibuko-Mbeje SE, Ziqubu K, et al. Impact of physical exercise and caloric restriction in patients with type 2 diabetes: Skeletal muscle insulin resistance and mitochondrial dysfunction as ideal therapeutic targets. Life Sci. 2022;297. https://doi.org/10.1016/j.lfs.2022.120467
5. Das M, Sauceda C, Webster NJG. Mitochondrial Dysfunction in Obesity and Reproduction. Endocrinology. 2021;162(1):1-13. https://doi.org/10.1210/endocr/bqaa158
6. Mello AH, Costa AB, Engel JDG, et al. Mitochondrial dysfunction in obesity. Life Sci. 2018;192:26-32. https://doi.org/10.1016/j.lfs.2017.11.019
7. Boström P, Wu J, Jedrychowski MP, et al. A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis. Nature. 2012;481(7382):463-8. https://doi.org/10.1038/nature10777
8. Jiang X, Cai S, Jin Y, et al. Irisin Attenuates Oxidative Stress, Mitochondrial Dysfunction, and Apoptosis in the H9C2 Cellular Model of Septic Cardiomyopathy through Augmenting Fundc1-Dependent Mitophagy. Oxid Med Cell Longev. 2021;2021:1-9. https://doi.org/10.1155/2021/2989974
9. Xin C, Zhang Z, Gao G, et al. Irisin Attenuates Myocardial Ischemia/Reperfusion Injury and Improves Mitochondrial Function Through AMPK Pathway in Diabetic Mice. Front Pharmacol. 2020;11:1-12. https://doi.org/10.3389%2Ffphar.2020.565160
10. Ansari S, Djalali M, Honarvar NM, et al. The Effect of n-3 Polyunsaturated Fatty Acids Supplementation on Serum Irisin in Patients with Type 2 Diabetes: A Randomized, Double- Blind, Placebo-Controlled Trial. Int J Endocrinol Metab. 2017;15(1):1-6. https://doi.org/10.5812/ijem.40614
11. Agh F, Honarvar NM, Djalali M, et al. Omega-3 Fatty Acid Could Increase One of Myokines in Male Patients with Coronary Artery Disease: A Randomized, Double-Blind, Placebo-Controlled Trial. Arch Iran Med. 2017;20(1):28-33. https://pubmed.ncbi.nlm.nih.gov/28112528/
12. Page MJ, McKenzie JE, Bossuyt PM, et al. The PRISMA 2020 statement: an updated guideline for reporting systematic reviews. BMJ. 2021;372(71):1-9.
13. Okada LSRR, Oliveira CP, Stefano JT, et al. Omega-3 PUFA modulate lipogenesis, ER stress, and mitochondrial dysfunction markers in NASH – Proteomic and lipidomic insight. Clin Nutr. 2018;37(5):1474-84. https://doi.org/10.1016/j.clnu.2017.08.031
14. Lalia AZ, Johnson ML, Jensen MD, et al. Effects of Dietary n-3 Fatty Acids on Hepatic and Peripheral Insulin Sensitivity in Insulin-Resistant Humans. Diabetes Care. 2015;38(7):1228-37. https://doi.org/10.2337/dc14-3101
15. Yoshino J, Smith GI, Kelly SC, et al. Effect of dietary n-3 PUFA supplementation on the muscle transcriptome in older adults. Physiol Rep. 2016;4(11):1-11. https://doi.org/10.14814/phy2.12785
16. Anderson EJ, Thayne KA, Harris M, et al. Do fish oil omega-3 fatty acids enhance antioxidant capacity and mitochondrial fatty acid oxidation in human atrial myocardium via PPARγ activation? Antioxid Redox Signal. 2014;21(8):1156-63. https://doi.org/10.1089/ars.2014.5888
17. Sakai C, Ishida M, Ohba H, et al. Fish oil omega-3 polyunsaturated fatty acids attenuate oxidative stress-induced DNA damage in vascular endothelial cells. PLoS One. 2017;12(11):1-13. https://doi.org/10.1371/journal.pone.0187934
18. Oliveira MR, Nabavi SF, Nabavi SM, et al. Omega-3 polyunsaturated fatty acids and mitochondria, back to the future. Trends Food Sci. 2017;67:76-92. https://doi.org/10.1016/j.tifs.2017.06.019
19. Li R, Jia Z, Zhu H. Regulation of Nrf2 Signaling. React Oxyg Species (Apex). 2019;8(24):312-22. https://pubmed.ncbi.nlm.nih.gov/31692987/
20. Ferguson JF, Roberts-Lee K, Borcea C, et al. Omega-3 polyunsaturated fatty acids attenuate inflammatory activation and alter differentiation in human adipocytes. J Nutr Biochem. 2019;64:45-9. https://doi.org/10.1016/j.jnutbio.2018.09.027
21. Yang D, Elner SG, Bian Z-M, et al. Pro-inflammatory cytokines increase reactive oxygen species through mitochondria and NADPH oxidase in cultured RPE cells. Exp Eye Res. 2007;85(4):462-72. https://doi.org/10.1016/j.exer.2007.06.013
22. Hunsche C, Hernandez O, Gheorghe A, et al. Immune dysfunction and increased oxidative stress state in diet-induced obese mice are reverted by nutritional supplementation with monounsaturated and n-3 polyunsaturated fatty acids. Eur J Nutr. 2018;57(3):1123-35. https://doi.org/10.1007/s00394-017-1395-1
23. Shin S-K, Cho H-W, Song S-E, et al. Ablation of catalase promotes non-alcoholic fatty liver via oxidative stress and mitochondrial dysfunction in diet-induced obese mice. Pflugers Arch. 2019;471(6):829-43. https://doi.org/10.1007/s00424-018-02250-3
24. Lee H-Y, Choi CS, Birkenfeld AL, et al. Targeted expression of catalase to mitochondria prevents age-associated reductions in mitochondrial function and insulin resistance. Cell Metab. 2010;12(6):668-74. https://doi.org/10.1016/j.cmet.2010.11.004
25. Lubos E, Loscalzo J, Handy DE. Glutathione Peroxidase-1 in Health and Disease: From Molecular Mechanisms to Therapeutic Opportunities. Antioxid Redox Signal. 2011;15(7):1957-97. https://doi.org/10.1089%2Fars.2010.3586
26. Ross D, Siegel D. Functions of NQO1 in Cellular Protection and CoQ10 Metabolism and its Potential Role as a Redox Sensitive Molecular Switch. Front Physiol. 2017;8(595):1-10. https://doi.org/10.3389/fphys.2017.00595
27. Chhetri J, King AE, Gueven N. Alzheimer’s Disease and NQO1: Is there a Link? Curr Alzheimer Res. 2018;15(1):56-66. https://doi.org/10.2174/1567205014666170203095802
28 Diaz-Ruiz A, Lanasa M, Garcia J, et al. Overexpression of CYB5R3 and NQO1, two NAD+ -producing enzymes, mimics aspects of caloric restriction. Aging Cell. 2018;17(4):1-13. https://doi.org/10.1111/acel.12767
29. Wu P-Y, Lai S-Y, Su Y-T, et al. β-Lapachone, an NQO1 activator, alleviates diabetic cardiomyopathy by regulating antioxidant ability and mitochondrial function. Phytomedicine. 2022;104:1-19. https://doi.org/10.1016/j.phymed.2022.154255
30. Ross D, Siegel D. The diverse functionality of NQO1 and its roles in redox control. Redox Biol. 2021;41:1-14. https://doi.org/10.1016%2Fj.redox.2021.101950
31. Nuccio CD, Bernardo A, Troiano C, et al. NRF2 and PPAR-γ Pathways in Oligodendrocyte Progenitors: Focus on ROS Protection, Mitochondrial Biogenesis and Promotion of Cell Differentiation. Int J Mol Sci. 2020;21(19):1-21. https://doi.org/10.3390%2Fijms21197216
32. Dave A, Pillai PP. Docosahexaenoic acid increased MeCP2 mediated mitochondrial respiratory complexes II and III enzyme activities in cortical astrocytes. J Biochem Mol Toxicol. 2022;36(4):1-8. https://doi.org/10.1002/jbt.23002
33. Hung Y-C, Huang K-L, Chen P-L, et al. UQCRC1 engages cytochrome c for neuronal apoptotic cell death. Cell Rep. 2021;36(12):1-14. https://doi.org/10.1016/j.celrep.2021.109729
34. Yi T, Wu X, Li H. Ubiquinol-cytochrome c reductase core protein 1 overexpression protects H9c2 cardiac cells against mimic ischemia/reperfusion injury through PI3K/Akt/GSK- 3β pathway. Biochem Biophys Res Commun. 2020;529(4):904-9. https://doi.org/10.1016/j.bbrc.2020.06.089
35. Fan J, Zhu Q, Wu Z, et al. Protective effects of irisin on hypoxia-reoxygenation injury in hyperglycemia-treated cardiomyocytes: Role of AMPK pathway and mitochondrial protection. J Cell Physiol. 2020;235(5):1165-74. https://doi.org/10.1002/jcp.29030
36. Li H, Wang C, Li L, et al. Skeletal muscle non-shivering thermogenesis as an attractive strategy to combat obesity. Life Sci. 2021;269:1-8. https://doi.org/10.1016/j.lfs.2021.119024
37. Martins AR, Crisma AR, Masi LN, et al. Attenuation of obesity and insulin resistance by fish oil supplementation is associated with improved skeletal muscle mitochondrial function in mice fed a high-fat diet. J Nutr Biochem. 2018;55:76-88. https://doi.org/10.1016/j.jnutbio.2017.11.012
38. Albracht-Schulte K, Kalupahana NS, Ramalingam L, et al. Omega-3 fatty acids in obesity and metabolic syndrome: a mechanistic update. J Nutr Biochem. 2018;58:1-16. https://doi.org/10.1016/j.jnutbio.2018.02.012
39. Yarizadeh H, Hassani B, Nosratabadi S, et al. The Effects of Omega-3 Supplementation on Resting Metabolic Rate: A Systematic Review and Meta-Analysis of Clinical Trials. Evid Based Complement Alternat Med. 2021;2021:1-9. https://doi.org/10.1155%2F2021%2F6213035
40. Jabůrek M, Varecha M, Gimeno RE, et al. Transport function and regulation of mitochondrial uncoupling proteins 2 and 3. J Biol Chem. 1999;274(37):26003-7. https://doi.org/10.1074/jbc.274.37.26003
41. Žuna K, Jovanović O, Khailova LS, et al. Mitochondrial Uncoupling Proteins (UCP1- UCP3) and Adenine Nucleotide Translocase (ANT1) Enhance the Protonophoric Action of 2,4- Dinitrophenol in Mitochondria and Planar Bilayer Membranes. Biomolecules. 2021;11(8):1-14. https://doi.org/10.3390/biom11081178
42. Dias BV, Gomes SV, Castro MLC, et al. EPA/DHA and linseed oil have different effects on liver and adipose tissue in rats fed with a high-fat diet. Prostaglandins Other Lipid Mediat. 2022;159. https://doi.org/10.1016/j.prostaglandins.2022.106622
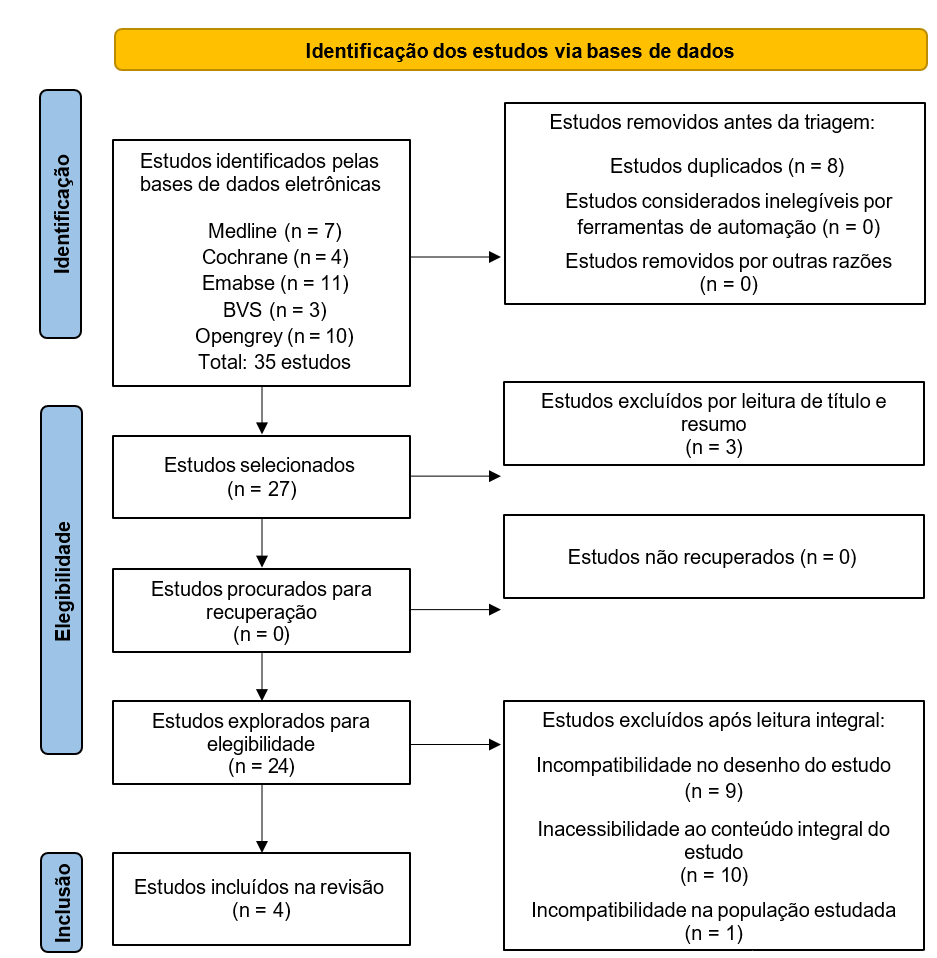
Figura 1 – Fluxograma do processo de seleção dos estudos incluídos
Tabela 1 – Síntese dos estudos incluídos nessa revisão sistemática
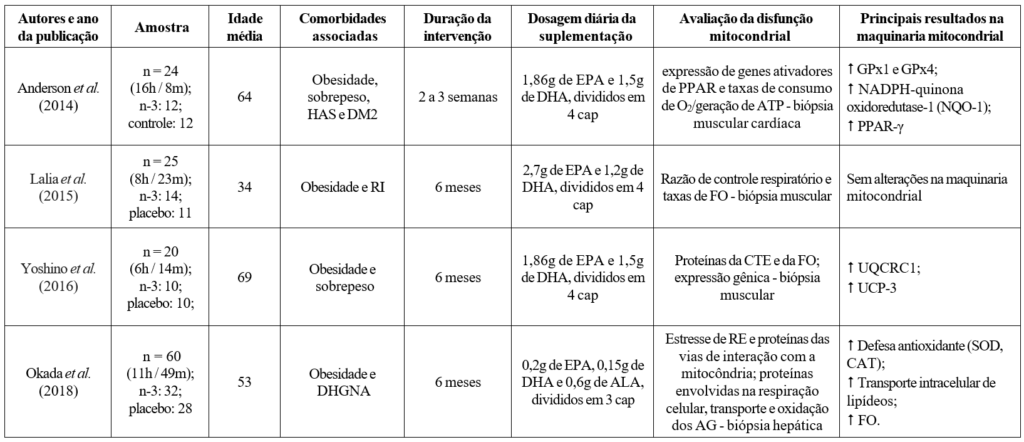
n: número de indivíduos da amostra; h: homens; m: mulheres; n-3: ômega-3; HAS: hipertensão arterial sistêmica; DM2: diabetes mellitus tipo 2; RI: resistência à insulina; DHGNA: doença hepática gordurosa não alcoólica EPA: ácido eicosapentaenóico; DHA: ácido docosahexaenóico; ALA: ácido alfa-linolênico; cap: cápsula GPx: glutationa peroxidase; PPAR-γ: receptor ativado por proliferadores de peroxissoma tipo gamma; UQCRC: ubiquinol- citocromo c redutase; UCP: proteína desacopladora; SOD: superóxido dismutase; CAT: catalase; ATP: adenosina trifosfato; CTE: cadeia transportadora de elétrons; FO: fosforilação oxidativa AG: ácidos graxos; ⭡: aumento nos níveis do biomarcador indicado

Figura 2 – Risco de viés dos estudos incluídos nesta revisão sistemática. D1: processo de randomização. D2: desvios das intervenções pretendidas. D3: falta de dados dos resultados.
D4: medição do resultado. D5: seleção do resultado relatado
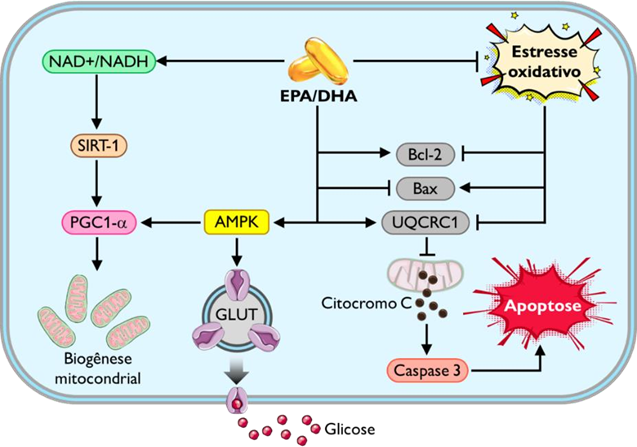
Figura 3 – Efeitos produzidos pelo ômega-3 encontrados nessa revisão
1Nutricionista, Mestre em Saúde pela Universidade Federal de Juiz de Fora (UFJF).
Programa de Pós-graduação em Saúde da Universidade Federal de Juiz de Fora, nível Doutorado, Juiz de Fora, Minas Gerais, Brasil.
E-mail: henriquejusto6@gmail.com ORCID: https://orcid.org/0000-0002-3496-409X
2Nutricionista, Doutor em Saúde pela Universidade Federal de Juiz de Fora (UFJF).
Empresa Brasileira de Serviços Hospitalares/Hospital Universitário da Universidade Federal de Juiz de Fora, Juiz de Fora, Minas Gerais, Brasil.
E-mail: marioflaviolima@gmail.com ORCID: https://orcid.org/0000-0002-5735-4411
3Nutricionista, Doutora em Saúde pela Universidade Federal de Juiz de Fora (UFJF). Hospital Unimed Dr. Hugo Borges, Juiz de Fora, Minas Gerais, Brasil.
E-mail: mguedes.nut@gmail.com ORCID: https://orcid.org/0000-0003-4035-8448
4Professora Associada, Doutora em Fisiopatologia Clínica e Experimental pela Universidade do Estado do Rio de Janeiro (UERJ).
Departamento de Nutrição. Instituto de Ciências Biológicas, Universidade Federal de Juiz de Fora, Juiz de Fora, Minas Gerais, Brasil.
E-mail: sheila.dutra@ufjf.br ORCID: https://orcid.org/0000-0002-2257-5337
5Professor Titular, Doutor em Clínica Médica pela Universidade Estadual de Campinas (UNICAMP).
Núcleo de Pesquisa em Nutrição e Exercício Físico Aplicados à Síndrome Metabólica – NEFASM, Departamento de Clínica Médica. Faculdade de Medicina. Universidade Federal de Juiz de Fora, Juiz de Fora, Minas Gerais, Brasil.
E-mail: claudio.t.desouza@gmail.com ORCID: https://orcid.org/0000-0003-4904-5675
