EFFECTS OF OMEGA-3 FATTY ACID SUPPLEMENTATION ON ATTENTION DEFICIT HYPERACTIVITY DISORDER – ADHD
REGISTRO DOI:10.69849/revistaft/th102411011631
Emanuele Gurgel de Freitas Melo da Silva1
Letícia Dino Ferreira da Silva Santana1
Aline Camila Alves da Silva1
Francisca Marta Nascimento de Oliveira Freitas²
Rebeca Sakamoto Figueiredo3
RESUMO
O Transtorno de Déficit de Atenção e Hiperatividade (TDAH) é uma condição neuropsiquiátrica crônica que afeta o comportamento, prejudicando a atenção e o controle dos impulsos. A suplementação de ácidos graxos ômega-3 tem sido sugerida como uma estratégia terapêutica promissora para o manejo dos sintomas do TDAH. Este estudo revisa sistematicamente a eficácia dessa suplementação, analisando seus efeitos primários e secundários. Foram revisados ensaios clínicos randomizados que compararam a suplementação de ômega-3 com tratamentos convencionais e placebo. Os resultados indicam que a suplementação de ômega-3 pode reduzir significativamente sintomas como desatenção e impulsividade, além de melhorar o comportamento social e o controle emocional. A combinação da suplementação com intervenções farmacológicas, como o metilfenidato, mostrou-se ainda mais eficaz. Quanto à segurança, os eventos adversos foram leves e transitórios, com destaque para distúrbios gastrointestinais, que não comprometeram a adesão ao tratamento. Apesar dos resultados promissores, a variabilidade metodológica entre os estudos, especialmente em relação às dosagens e à duração das intervenções, limita a generalização dos achados. A heterogeneidade dos perfis dos participantes e o pequeno tamanho das amostras também comprometem a robustez das conclusões. Conclui-se que a suplementação de ômega-3 é promissora e segura no tratamento do TDAH, especialmente como terapia complementar. No entanto, são necessários ensaios clínicos maiores e mais rigorosos para consolidar essas evidências e estabelecer diretrizes clínicas mais robustas.
Palavras-chave: TDAH, ômega 3, suplementação
ABSTRACT
Attention Deficit Hyperactivity Disorder (ADHD) is a chronic neuropsychiatric condition that affects behavior, impairing attention and impulse control. Omega-3 fatty acid supplementation has been suggested as a promising therapeutic strategy for managing ADHD symptoms. This study systematically reviews the efficacy of this supplementation, analyzing its primary and secondary effects. Randomized clinical trials comparing omega-3 supplementation with conventional treatments and placebo were reviewed. The results indicate that omega-3 supplementation can significantly reduce symptoms such as inattention and impulsivity, in addition to improving social behavior and emotional control. Combining supplementation with pharmacological interventions, such as methylphenidate, was found to be even more effective. Regarding safety, adverse events were mild and transient, with gastrointestinal disturbances being the most common, which did not affect treatment adherence. Despite the promising results, methodological variability between studies, particularly regarding dosages and intervention duration, limits the generalization of findings. The heterogeneity of participant profiles and the small sample sizes also affect the robustness of the conclusions. In conclusion, omega-3 supplementation appears to be a promising and safe complementary therapy for treating ADHD. However, larger and more rigorous clinical trials are needed to solidify this evidence and establish more robust clinical guidelines.
Keyword: ADHD, omega 3 fatty acids, supplementation
_____________________________________________________________________________________ ¹
1 INTRODUÇÃO
O Transtorno do Déficit de Atenção e Hiperatividade (TDAH) é uma condição crônica que prejudica o comportamento, resultando em dificuldades consideráveis em manter a atenção, controlar impulsos e regular a atividade motora. Esse transtorno é caracterizado por sintomas persistentes de desatenção, hiperatividade e impulsividade, que afetam significativamente a vida cotidiana e o desenvolvimento pessoal (American Psychiatric Association, 2013). A desatenção se manifesta por problemas em manter o foco e esquecimentos frequentes, enquanto a hiperatividade é marcada por inquietação constante e fala excessiva. A impulsividade, por sua vez, se reflete em ações precipitadas, interrupções frequentes e dificuldade em esperar sua vez, comprometendo o desempenho em diversas atividades diárias. Esses sintomas afetam negativamente o desenvolvimento cognitivo, social e acadêmico, com impactos duradouros ao longo da vida (Barkley, 2015; Händel et al., 2021; Siafis et al., 2022).
Segundo o DSM-5, a forma como os sintomas do TDAH se manifesta varia conforme a idade e o contexto. Em crianças, é comum observar dificuldades mais acentuadas em seguir instruções e prestar atenção aos detalhes. Já em adolescentes e adultos, a impulsividade e a procrastinação tornam-se mais predominantes, prejudicando o desempenho acadêmico, profissional e social (American Psychiatric Association, 2013). O diagnóstico requer uma abordagem multifacetada, envolvendo entrevistas clínicas, relatos de pais e professores, além de observações diretas e testes psicológicos. Embora o transtorno seja frequentemente identificado na infância, muitos casos persistem até a vida adulta, impactando tanto o rendimento acadêmico quanto as relações interpessoais e profissionais (Barkley, 2015).
O tratamento do TDAH geralmente combina intervenções farmacológicas e não farmacológicas. Os psicoestimulantes, como o metilfenidato, são amplamente prescritos por sua capacidade de aumentar a disponibilidade de dopamina e noradrenalina no cérebro, melhorando a concentração e regulando a impulsividade. Em contraste, antidepressivos e medicamentos não estimulantes, como a atomoxetina, podem ser recomendados em casos onde se busca minimizar os efeitos colaterais dos estimulantes (Otasowie et al., 2014). Além disso, intervenções comportamentais, como a Terapia Cognitivo-Comportamental (TCC) e o treinamento de habilidades sociais, também demonstram eficácia, especialmente entre crianças e adolescentes (Abrahão; Elias, 2021).
A combinação de abordagens comportamentais, educacionais e farmacológicas tem se mostrado a mais eficaz no manejo do TDAH, proporcionando melhorias significativas na funcionalidade dos pacientes (Wender, 1998). Para garantir um tratamento completo e eficaz, é essencial contar com uma equipe multidisciplinar composta por psiquiatras, psicólogos, terapeutas ocupacionais, psicopedagogos, educadores e nutricionistas. Esse trabalho colaborativo não apenas ajuda a controlar os sintomas, mas também promove o desenvolvimento emocional, social e acadêmico (Nazarova et al., 2022; Bloch et al., 2014).
No contexto do manejo do TDAH, a nutrição também desempenha um papel importante. A suplementação com vitaminas, minerais e ácidos graxos, como o ômega-3, tem sido considerada uma intervenção adjuvante valiosa. O equilíbrio entre os ácidos graxos ômega6 e ômega-3 pode proporcionar benefícios ao funcionamento cerebral, sendo a orientação nutricional uma estratégia relevante no tratamento (Simopoulos, 1991; Bloch; Mulqueen, 2014).
Apesar de o metilfenidato ser amplamente utilizado, preocupações crescentes quanto aos seus efeitos colaterais e sua eficácia a longo prazo têm incentivado a busca por alternativas, como a suplementação com ácidos graxos poli-insaturados, especialmente o ômega-3 (Patrick; Ames, 2015; Banaschewski et al., 2018). Tanto o EPA quanto o DHA, componentes cruciais do ômega-3, desempenham papéis fundamentais no desenvolvimento cerebral, influenciando a neurotransmissão e contribuindo para a redução da neuro inflamação (McNamara et al., 2016; Gao et al., 2022).
Pesquisas indicam que indivíduos com TDAH frequentemente apresentam níveis reduzidos de ômega-3 no sangue, sugerindo uma correlação entre essa deficiência e a gravidade dos sintomas (Chang; Su, 2020). A suplementação com ômega-3 tem sido investigada como uma intervenção potencial para melhorar a atenção, o controle impulsivo e o comportamento (Rangel-Huerta; Gil, 2017). Contudo, os resultados dos estudos variam: enquanto alguns apontam melhorias significativas, outros não encontram efeitos substanciais (Bloch; Mulqueen, 2014; Händel et al., 2021).
Essa variação nos resultados pode ser atribuída a fatores como a dose administrada, a duração do tratamento e a proporção entre EPA e DHA (Nevins et al., 2021; Pusceddu et al., 2016). Além disso, muitos estudos apresentaram limitações metodológicas, como tamanho amostral pequeno, ausência de grupos controle adequados ou falta de padronização nas escalas de avaliação dos sintomas. Dessa forma, mais estudos controlados são necessários para identificar as condições ideais em que o ômega-3 pode ser eficaz no tratamento do TDAH, além de estabelecer as dosagens recomendadas e garantir a segurança dessa intervenção em diferentes grupos de pacientes (Nevins et al., 2021; DiNicolantonio; O’Keefe, 2020).
Portanto, o estudo dos efeitos da suplementação de ômega-3 no TDAH é de grande relevância, uma vez que essa intervenção, além de acessível e segura, pode complementar os tratamentos convencionais. Compreender como o ômega-3 atua na cognição e no comportamento pode não apenas aperfeiçoar as abordagens terapêuticas, mas também preencher lacunas no conhecimento científico, promovendo avanços no manejo do transtorno. Em última análise, essa compreensão tem o potencial de melhorar a qualidade de vida dos pacientes e promover um tratamento mais eficaz e integrado do TDAH.
O objetivo deste estudo foi avaliar a eficácia da suplementação de ômega-3 no tratamento do Transtorno do Déficit de Atenção e Hiperatividade (TDAH). A revisão analisou a qualidade metodológica dos estudos incluídos, considerando o risco de viés, o tamanho amostral e os métodos empregados para avaliar os sintomas do transtorno. Além disso, o estudo investigou a relação entre a dose de suplementação de ômega-3 e a melhora dos sintomas. Por fim, foram avaliados os efeitos primários e secundários da suplementação, proporcionando uma visão abrangente sobre sua eficácia e segurança no manejo dos sintomas do TDAH.
2 METODOLOGIA
2.1 Tipo de Estudo
Para estruturar a pergunta de pesquisa e guiar o processo de seleção dos artigos, utilizamos o método PICO (População, Intervenção, Comparador e Desfecho), que facilita a formulação de perguntas claras e a identificação de estudos relevantes. A pergunta que conduziu a investigação sobre os efeitos da suplementação de ômega-3 no Transtorno do Déficit de Atenção e Hiperatividade (TDAH) foi: “Em crianças, adolescentes e adultos com TDAH (P), a suplementação com ômega-3 isolada ou combinada com outros tratamentos (I) é mais eficaz do que placebo ou tratamentos padrão (C) na redução dos sintomas de desatenção, hiperatividade e impulsividade em curto e longo prazo (O)?”
O estudo foi realizado por meio de uma revisão sistemática da literatura. Foram analisados estudos que investigaram o uso de ômega-3 em diferentes faixas etárias com TDAH, comparando sua eficácia com placebo ou outros tratamentos. O foco da revisão esteve nos desfechos relacionados à redução dos principais sintomas do TDAH: desatenção, hiperatividade e impulsividade.
2.2 Coleta de Dados
A coleta de dados foi realizada utilizando diversas bases de dados eletrônicas, incluindo PubMed, Web of Science, SciELO e Periódico Capes, sem restrições geográficas ou de idioma, desde que os resumos estivessem disponíveis. A inclusão de artigos em inglês, espanhol, português e outros idiomas permitiu uma análise abrangente e diversificada da literatura, garantindo a cobertura mais completa possível dos estudos sobre o tema.
A estratégia de busca foi cuidadosamente elaborada com a combinação de descritores específicos relacionados ao Transtorno de Déficit de Atenção e Hiperatividade (TDAH) e à suplementação com ômega-3. Foram empregados termos como “Attention Deficit
Hyperactivity Disorder”, “omega-3 fatty acids”, “supplementation” e “clinical trials”, além de operadores booleanos (“AND”, “OR” e “NOT”), que otimizaram a combinação eficiente desses descritores. Por exemplo, a expressão “Attention Deficit Hyperactivity Disorder” AND “omega-3 fatty acids” AND “clinical trials” foi utilizada para garantir que estudos relevantes fossem identificados. A fim de melhorar a precisão da busca, aplicamos um filtro para limitar os resultados a publicações com texto completo.
Para assegurar a relevância e a contemporaneidade das evidências incluídas, definimos um corte temporal a partir de 2014. Esse período foi escolhido para refletir as diretrizes clínicas mais recentes no diagnóstico e tratamento do TDAH, garantindo que os estudos revisados estivessem alinhados com o estado atual do conhecimento científico. Com isso, buscamos fornecer subsídios atualizados para a prática clínica e para a tomada de decisões baseadas em evidências robustas.
Após a busca inicial, os artigos foram submetidos a uma triagem seguindo as diretrizes PRISMA (Moher et al., 2016), com o objetivo de selecionar os estudos mais relevantes e de alta qualidade. Foram incluídos apenas ensaios clínicos randomizados (ECRs) que investigaram os efeitos da suplementação de ômega-3 em crianças, adolescentes ou adultos diagnosticados com TDAH. Esses estudos compararam a suplementação de ômega-3 com placebo, outros tratamentos nutricionais, tratamentos farmacológicos ou ausência de intervenção, permitindo uma avaliação comparativa sólida da eficácia da suplementação (Figura 1).
Os critérios de exclusão foram igualmente rigorosos. Estudos que não tinham a suplementação de ômega-3 como foco principal da intervenção, ou que não relatavam desfechos diretamente relacionados ao TDAH, foram descartados. Além disso, eliminamos pesquisas com populações que apresentavam comorbidades médicas significativas, pois tais condições poderiam distorcer os resultados. Também foram excluídos estudos realizados com modelos animais ou in vitro, uma vez que o foco desta revisão é o impacto clínico em seres humanos.
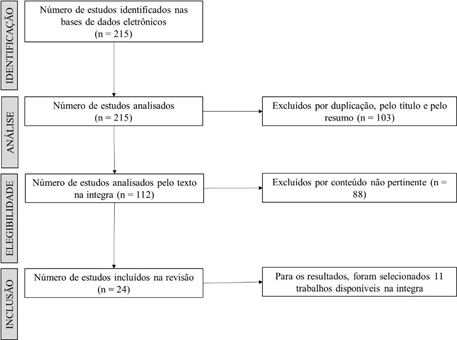
Fonte: Elaborada pelo autor. Figura 1 – Fluxograma de identificação, seleção e inclusão de estudos na revisão sistemática.
2.3 Análise de Dados
A análise dos dados foi conduzida de forma rigorosa para avaliar os efeitos da suplementação de ômega-3 nos sintomas de TDAH. A qualidade dos estudos foi verificada utilizando a ferramenta de risco de viés da Cochrane, focando em aspectos como randomização, cegamento e relato de desfechos. Somente estudos classificados como de baixo ou moderado risco de viés foram incluídos na análise final (Cochrane, 2019).
Inicialmente, foi realizada uma análise descritiva para caracterizar as variáveis dos estudos selecionados e fornecer uma visão geral dos dados disponíveis. O tamanho total da amostra foi determinado com base no número de participantes relatado em cada estudo. Além disso, foram calculadas medidas descritivas como média, mediana, moda, desvio padrão e amplitude (valores mínimo e máximo) para avaliar a variabilidade no número, idade e gênero de participantes dos estudos.
Em seguida, foram examinados os tipos de intervenção, as doses, forma de administração e a duração das intervenções. As doses administradas foram descritas de acordo com as quantidades relatadas em cada estudo, e análises de média, mediana, desvio padrão e variação foram realizadas para identificar padrões. A duração das intervenções, expressa em dias, semanas ou meses, foi igualmente analisada, utilizando medidas descritivas similares.
Os desfechos primários avaliados foram a melhora nos sintomas de TDAH, como desatenção, hiperatividade e impulsividade. Outros desfechos primários incluem a atenção sustentada, desempenho escolar e a redução de comportamentos problemáticos, como agressividade e impulsividade. Entre os desfechos secundários foram analisados a qualidade de vida e bem-estar geral, eventos adversos relacionados à suplementação (como distúrbios gastrointestinais e alterações de peso), aspectos cognitivos (memória e funções executivas), além da melhora clínica geral, mudanças no comportamento social e emocional.
Por fim, as proporções de pacientes que atingiram os desfechos primários e secundários, como a melhora dos sintomas ou a ocorrência de eventos adversos, foram avaliadas. Essas proporções foram expressas em percentuais, oferecendo uma visão clara da eficácia e segurança de cada intervenção analisada.
Os métodos descritos garantiram uma análise ampla e detalhada dos dados disponíveis, fornecendo uma base sólida para a avaliação dos efeitos da suplementação de ômega-3 nos sintomas de TDAH, que será explorada nas próximas seções.
3 RESULTADOS E DISCUSSÃO
Foram incluídos 11 estudos na revisão de literatura sobre os efeitos da suplementação de ômega-3 no Transtorno de Déficit de Atenção com Hiperatividade (TDAH), conforme apresentado na Tabela 1, que resume os estudos e suas características principais.
Tabela 1 – Revisão sistemática sobre os efeitos da suplementação de ômega-3 nos sintomas de Transtorno de Déficit de Atenção e Hiperatividade (TDAH)
Autor (Ano) Metodologia Desfecho Primário Desfecho Secundário
Barragán et al. (2014) N. º Amostral Intervenção Dose (mg)/ dia Frequência Forma Duração 90 EPA + DHA + GLA 558 + 174 + 60 Diária Cps. Óleo PUFA 12 Meses Redução significativa dos sintomas de TDAH. Melhora no comportamento social e emocional. Distúrbios gastrointestinais em 30%. Dashti et al. (2014) N. º Amostral Intervenção Dose (mg)/ dia Frequência Forma Duração 85 EPA + DHA 1000 Diária Cps. Óleo de Peixe 3 meses Melhora significativa dos sintomas centrais do TDAH, conforme Conners’ ADHD Rating Scale. Não foram observadas alterações significativas no perfil lipídico. Distúrbios gastrointestinais em 20%. Widenhorn-Müller et al. (2014) N. º Amostral Intervenção Dose (mg)/ dia Frequência Forma Duração 95 EPA + DHA 600 + 120 Diária Cps. Óleo de Peixe 16 semanas Melhora na função de memória de trabalho, avaliado pelos pais e professores. Aumento dos níveis de EPA e DHA nos eritrócitos. Melhora significativa na memória de trabalho. Distúrbios gastrointestinais leves (10%). Matsudaira et al. (2015) N. º Amostral Intervenção Dose (mg)/ dia Frequência Forma Duração 76 EPA + DHA + GLA 558 + 174 + 60 Diária Cps. Óleo PUFA 12 semanas Não houve melhora significativa nos sintomas centrais do TDAH, conforme Conners’ Teacher Rating Scale. Aumento significativo nos níveis de EPA e DHA no sangue no grupo suplementado. Melhora nas funções executivas, como memória de trabalho. Eventos gastrointestinais leves (15%). Anand e Sachdeva (2016) N. º Amostral Intervenção Dose (mg)/ dia Frequência Forma Duração 50 EPA + DHA 180 + 120 Diária Cps. Óleo de Peixe 4 meses Melhora nos sintomas centrais do TDAH, conforme Conners’ Parent Rating Scale, sem significância clínica. Eventos gastrointestinais leves (náusea em 10%). Johnson et al. (2016) N. º Amostral Intervenção Dose (mg)/ dia Frequência Forma Duração 154 EPA + DHA + GLA 558 + 174 + 60 2x ao dia Cps. Óleo PUFA 4 meses Melhora significativa nos níveis de atenção e hiperatividade, conforme Conners’ Parent Rating Scale, especialmente em crianças com sintomas subclínicos. Melhora na decodificação fonológica e cognição. Eventos adversos leves como dor de estômago. Cornu et al. (2017) N. º Amostral Intervenção Dose (mg)/ dia Frequência Forma Duração 162 EPA + DHA 336 + 84 6 – 8 anos 504 + 126 9 – 11 anos 672 + 168 12 – 15 anos Diária Cps. Óleo de Peixe 3 Meses Não houve diferença significativa na redução dos sintomas de TDAH. Não houve mudanças significativas nos testes de leitura (Alouette) ou nos testes de desempenho cognitivo (KiTAP). Eventos gastrointestinais em 20%, hospitalização de 2 pacientes. Moghaddam et al. (2017) N. º Amostral Intervenção Dose (mg)/ dia Frequência Forma Duração 40 EPA + DHA 180 + 120 Diária Cps. Óleo de Peixe 8 semanas Redução significativa dos sintomas de TDAH (atenção, hiperatividade e impulsividade. Melhora no comportamento social e nos sintomas comórbidos. Eventos gastrointestinais leves. Döpfner et al. (2019) N. º Amostral Intervenção Dose (mg)/ dia Frequência Forma Duração 40 EPA + DHA + GLA 372 + 116 + 40 2x ao dia Cps. Óleo PUFA 4 meses Melhora significativa nos sintomas de TDAH relatados por pais e professores. Redução significativa em sintomas externalizantes e internalizantes. Queixas gastrointestinais leves. Mohammadzadeh et al. (2019) N. º Amostral Intervenção Dose (mg)/ dia Frequência Forma Duração 66 EPA + DHA 180 +120 Diária Cps. Óleo de Peixe 8 semanas Não houve diferença significativa na melhora dos sintomas centrais do TDAH. Não foram observadas melhorias significativas no desempenho acadêmico. Eventos gastrointestinais (anorexia e diarreia). Ouadih-Moran et al. (2023) N. º Amostral Intervenção Dose (mg)/ dia Frequência Forma Duração 62 EPA + DHA 70 + 250 Diária Cps. Óleo de Peixe 6 meses Melhora significativa nos sintomas centrais do TDAH pelas escalas MSVA e Vanderbilt. Alterações no S100B indicando neuro inflamação, melhora do desempenho acadêmico e atenção relatada pelos pais e
professores. Melhora significativa no
comportamento social e emocional, eventos
gastrointestinais leves em 15%.
EPA: Ácido eicosapentaenoico, DHA: Ácido docosaexaenoico, GLA: Ácido Gama-Linolênico.
Cápsula: cps. – Abreviação utilizada em prescrições médicas e documentos farmacêuticos.
Óleo PUFA: As cápsulas utilizadas nos estudos acima continham uma combinação de EPA e DHA (provenientes do óleo de peixe) e GLA (proveniente de óleos vegetais).
Fonte: Elaborada pelo autor.
A análise dos estudos revela que todos são ensaios clínicos randomizados (ECRs), o que confere maior robustez aos resultados, uma vez que esse tipo de estudo é considerado o padrão-ouro para avaliar a eficácia de intervenções. A randomização, essencial para evitar vieses de seleção, foi realizada de forma adequada na maioria dos estudos, utilizando métodos como softwares de randomização, geração eletrônica de números aleatórios ou tabelas de números aleatórios. Esses métodos garantem que os participantes sejam distribuídos de maneira imparcial entre os grupos de intervenção e controle, aumentando a comparabilidade e a validade interna dos estudos (Cornu et al., 2017; Döpfner et al., 2019; Johnson et al., 2016; Moghaddam et al., 2017; Mohammadzadeh et al., 2019). No entanto, em alguns estudos, o método de randomização não foi claramente especificado, o que pode gerar questionamentos sobre a transparência do processo e potencialmente introduzir viés de seleção (Anand; Sachdeva, 2016; Barragán et al., 2014). A ausência de clareza sobre a randomização compromete a validade interna e destaca a importância de maior transparência em estudos futuros. Para minimizar esses riscos, é fundamental que a randomização seja detalhadamente especificada, preferencialmente utilizando softwares ou tabelas de números aleatórios, garantindo assim a imparcialidade dos grupos alocados.
No que se refere ao cegamento, a maioria dos estudos utilizou o modelo duplo-cego, minimizando vieses de performance e detecção. Esse modelo é crucial para garantir que nem os participantes nem os avaliadores saibam a que grupo de tratamento cada indivíduo pertence, proporcionando uma avaliação mais objetiva dos resultados (Cornu et al., 2017; Döpfner et al., 2019; Johnson et al., 2016). Contudo, alguns estudos não especificaram o cegamento, o que pode aumentar o risco de viés de desempenho e detecção, comprometendo a validade dos resultados (Barragán et al., 2014; Ouadih-Moran et al., 2023). O cegamento inadequado pode influenciar os resultados ao introduzir vieses na percepção dos participantes e avaliadores. Por isso, futuros estudos devem adotar cegamento duplo sempre que possível, utilizando placebos indistinguíveis visual e sensorialmente dos suplementos ou medicamentos administrados, garantindo a imparcialidade.
A aplicação da Ferramenta Cochrane de Avaliação de Risco de Viés (RoB 2) confirma esses achados. Embora a maioria dos estudos tenha apresentado baixo risco de viés em relação à randomização e cegamento, alguns casos foram classificados como de risco incerto devido à falta de clareza nos métodos aplicados (Anand; Sachdeva, 2016; Barragán et al., 2014; OuadihMoran et al., 2023). Nos estudos em que a randomização e o cegamento foram claramente descritos e mantidos, a classificação foi de baixo risco, reforçando a robustez dos resultados (Cornu et al., 2017; Döpfner et al., 2019; Johnson et al., 2016; Moghaddam et al., 2017).
Para garantir a qualidade dos estudos futuros, recomenda-se maior transparência nos métodos de randomização, com detalhamento claro do processo utilizado para assegurar que a alocação dos grupos seja imparcial. Além disso, o uso de cegamento duplo deve ser adotado sempre que possível, com placebos que sejam indistinguíveis dos tratamentos ativos, evitando vieses de performance e detecção. Finalmente, a adoção de relatórios detalhados sobre a condução do estudo, desde a randomização até o controle de perdas e mensuração dos desfechos, é fundamental para garantir a replicabilidade e confiabilidade dos resultados.
Em conclusão, a robustez metodológica observada na maioria dos estudos, especialmente no uso de ensaios clínicos randomizados com cegamento duplo, reforça a validade dos resultados sobre a eficácia da suplementação de ômega-3 no tratamento do TDAH. No entanto, a falta de clareza em alguns métodos de randomização e cegamento compromete a interpretação dos resultados de alguns estudos. Para que futuros ensaios clínicos alcancem um rigor metodológico mais consistente, é crucial que esses aspectos sejam detalhadamente descritos, minimizando assim os riscos de viés e garantindo maior confiança nos desfechos obtidos.
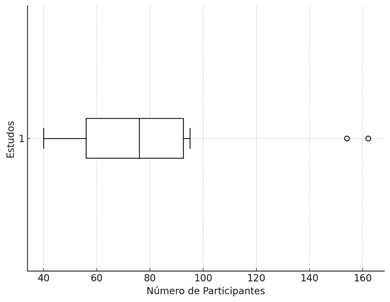
Para consolidar essa análise metodológica, é importante também considerar o número total de participantes envolvidos nos estudos. No conjunto de 11 estudos analisados, o total de participantes foi de 920, com uma média de 83,64 indivíduos por estudo. Esse valor sugere que, embora os estudos tenham porte moderado, há variações consideráveis no tamanho das amostras (Anand; Sachdeva, 2016; Barragán et al., 2014; Cornu et al., 2017; Dashti et al., 2014; Döpfner et al., 2019; Johnson et al., 2016; Matsudaira et al., 2015; Moghaddam et al., 2017; Mohammadzadeh et al., 2019; Ouadih-Moran et al., 2023 Widenhorn-Müller et al., 2014). A mediana de 76 participantes revela que metade dos estudos contou com 76 ou menos indivíduos, o que indica uma distribuição relativamente equilibrada das amostras, sem grandes distorções por valores extremos. Contudo, a moda de 40 participantes sugere que alguns estudos, como os de Anand; Sachdeva (2016), Moghaddam et al. (2017) e Döpfner et al. (2019), enfrentaram limitações no recrutamento de participantes, o que pode ter influenciado os resultados e sua generalização.
A variabilidade nos tamanhos das amostras reflete-se no desvio padrão de 41,28, que demonstra uma dispersão considerável em torno da média, indicando que o tamanho das amostras variou significativamente entre os estudos. Essa heterogeneidade pode estar relacionada a diferenças nos métodos de recrutamento, disponibilidade de recursos ou na própria natureza dos ensaios clínicos. A Figura 2 ilustra a distribuição do número de participantes nos estudos de suplementação de ômega-3 no TDAH, com uma amplitude de 122, representando a diferença entre o menor estudo (40 participantes) e o maior (162 participantes), o que reforça a variação nos tamanhos de amostras, com alguns estudos sendo substancialmente maiores que outros (Cornu et al., 2017; Johnson et al., 2016).
Fonte: Elaborada pelo autor.
Figura 2 – Distribuição do número de participantes nos estudos de suplementação de ômega-3 no TDAH.
A análise dos quartis revelou que 25% dos estudos incluíram até 56 participantes (Q1), enquanto 75% dos estudos envolveram até 92,5 participantes (Q3), com um intervalo interquartil (IQR) de 36,5. Esse resultado reflete uma dispersão moderada dos dados, com a maior parte dos estudos situando-se dentro desse intervalo de participantes. A distribuição razoavelmente uniforme sugere que não há outliers significativos, o que reforça a concentração em torno de um tamanho de amostra moderado. A mediana de 76 reforça essa tendência, indicando que, embora alguns estudos tenham apresentado amostras pequenas, a maioria foi conduzida com números que permitem análises mais robustas.
Apesar dessa concentração em torno de um tamanho de amostra moderado, alguns estudos foram conduzidos com amostras menores, como os de Moghaddam et al. (2017) e Döpfner et al. (2019), que apresentaram 40 participantes. Embora esses estudos menores limitem a generalização dos resultados, ainda fornecem evidências preliminares valiosas sobre a eficácia do ômega-3 no TDAH. Em contrapartida, os estudos com amostras maiores, como o de 162 participantes, reforçam a robustez das conclusões e a confiabilidade dos achados, oferecendo maior poder estatístico e menor suscetibilidade a vieses (Cornu et al., 2017; Johnson et al., 2016).
Além do número total de participantes, é importante analisar a distribuição dos indivíduos entre os grupos de intervenção e controle. Nos grupos de intervenção, a média foi de 41,73 participantes (desvio padrão = 22,18), enquanto nos grupos controle ou placebo a média foi de 41,91 (desvio padrão = 22,39). A mediana em ambos os grupos foi de 33 participantes, com um mínimo de 20 e máximos de 80 no grupo de intervenção e 82 no grupo controle. Esse equilíbrio entre os grupos é um ponto positivo do ponto de vista metodológico, pois assegura comparabilidade adequada entre as intervenções. Entretanto, a variação no número de participantes entre os estudos pode influenciar os resultados globais, especialmente em estudos com amostras pequenas, que são mais suscetíveis a flutuações aleatórias e menor precisão estatística.
A heterogeneidade observada entre os estudos, tanto em relação ao número total de participantes quanto ao tamanho dos grupos de intervenção e controle, ressalta a importância de uma análise cuidadosa dos resultados. Estudos com amostras menores exigem interpretação cautelosa, pois apresentam menor poder estatístico e são mais vulneráveis a vieses. Por outro lado, pesquisas mais robustas, como as de Cornu et al. (2017) e Johnson et al. (2016), conferem maior solidez aos resultados gerais, equilibrando o impacto das investigações que envolvem amostras menores.
Portanto, ao interpretar os achados, é decisivo levar em consideração a variabilidade no tamanho das amostras e os potenciais efeitos sobre a generalização dos resultados. Estudos com amostras maiores conferem maior confiança e precisão aos resultados, enquanto estudos menores, embora forneçam dados preliminares importantes, exigem uma abordagem interpretativa mais acertada. Dessa forma, os achados da presente análise indicam que, para aumentar a confiabilidade dos resultados em pesquisas futuras, seria ideal conduzir estudos com amostras maiores, minimizando o risco de viés e aumentando o poder estatístico.
A idade mínima observada foi de 3 anos, enquanto a máxima atingiu 16 anos, abrangendo, portanto, uma ampla faixa etária. Nesse contexto, a idade média dos participantes foi de 8,99 anos, com a mediana e a moda de 9,00 anos, indicando que essa é a idade mais frequente entre eles. Isso sugere que metade dos participantes tinha menos de 9 anos, enquanto a outra metade tinha mais. O desvio padrão de 2,20 anos aponta uma variação moderada das idades em torno da média.
A análise dos quartis revelou que 75% dos participantes apresentavam idades inferiores a 9,50 anos, com o primeiro quartil (Q1) registrado em 8,25 anos e o terceiro quartil (Q3) em 9,50 anos. O intervalo interquartil (IQR) foi de 1,25 anos, evidenciando que a maioria das idades está concentrada nesse intervalo, sugerindo uma dispersão relativamente baixa dos dados (Figura 3).

Fonte: Elaborada pelo autor. Figura 3 – Análise estatística da distribuição etária em estudos sobre TDAH.
A distribuição de frequência por intervalos etários indicou que a maioria dos estudos se concentrou em crianças de 6 a 10 anos (Anand; Sachdeva, 2016; Cornu et al., 2017; Dashti et al., 2014; Johnson et al., 2016; Mohammadzadeh et al., 2019; Moghaddam et al., 2017; Ouadih-Moran et al., 2023; Widenhorn-Müller et al., 2014). Essa faixa etária é crucial para o desenvolvimento, pois é durante esse período que o TDAH é frequentemente diagnosticado, aumentando a eficácia das intervenções. Os pesquisadores buscavam avaliar o impacto de intervenções, como a administração de ômega-3 e metilfenidato, nessa fase, onde as mudanças comportamentais são mais evidentes e as crianças respondem melhor ao tratamento.
A faixa etária de 11 a 15 anos foi abordada por Cornu et al. (2017) e Matsudaira et al. (2015). A escolha dessa faixa fundamentou-se na necessidade de explorar o desenvolvimento cognitivo e comportamental em adolescentes, uma etapa significativa para a formação de habilidades acadêmicas e sociais. Finalmente, Döpfner et al. (2019) incluiu crianças de 0 a 5 anos. A justificativa para essa inclusão reside na crescente atenção às intervenções precoces, que visam mitigar os impactos do TDAH nas fases iniciais da infância, ressaltando a importância de abordar esses sintomas desde os primeiros anos de vida.
Essas distribuições e justificativas indicam uma clara tendência na pesquisa sobre TDAH, priorizando intervenções em faixas etárias onde os efeitos das terapias são mais evidentes, alinhando-se, assim, às necessidades de desenvolvimento infantil. O foco em crianças entre 6 e 10 anos, juntamente com a inclusão de adolescentes e crianças pequenas, ressalta a relevância de uma abordagem adaptada ao ciclo de vida para a compreensão e o manejo do TDAH. Seria benéfico que os estudos futuros incluíssem uma análise mais detalhada sobre o impacto da idade nas intervenções com ômega-3, especialmente comparando os efeitos em crianças mais novas e adolescentes. Como os resultados podem variar com a idade, a inclusão de subanálises etárias poderia fornecer insights mais profundos sobre a eficácia do tratamento em diferentes fases de desenvolvimento.
A análise da distribuição de gênero nos estudos sobre TDAH revela que a maioria apresentou uma distribuição desigual de participantes em relação ao gênero. Döpfner et al. (2019) reportou uma amostra de 40 crianças, com 70% sendo meninos, o que reflete a tendência comum na literatura de que o TDAH é mais frequentemente diagnosticado em meninos. De forma semelhante, Anand et al. (2016) indicaram uma proporção de aproximadamente 2,3 meninos para cada menina. Em contraste, Johnson et al. (2016) foi o único estudo a apresentar uma distribuição equilibrada de gênero, com 50% de meninos e 50% de meninas entre os 154 participantes.
Outros estudos, como Dashti et al. (2014) e Widenhorn-Müller et al. (2014), relataram 58,6% de meninos e 41,4% de meninas, e 74 meninos e 21 meninas, respectivamente. Esses dados evidenciam uma predominância de meninos nas amostras, alinhando-se à literatura existente, que sugere que o TDAH é diagnosticado com maior frequência nesse grupo.
As justificativas dos autores para a escolha do gênero em suas amostras refletem tanto as características do TDAH quanto as implicações para intervenções e tratamentos. Döpfner et al. (2019), ao incluir uma alta proporção de meninos, reconheceram a prevalência do transtorno entre esse grupo. A mesma linha de raciocínio é observada em Anand e Sachdeva (2016) e Moghaddam et al. (2017), que enfatizaram a necessidade de estudar intervenções em meninos devido à maior incidência de TDAH nessa população.
O equilíbrio de gênero observado em Johnson et al. (2016) pode indicar uma tentativa de explorar as diferenças de resposta ao tratamento entre meninos e meninas, considerando que as manifestações do TDAH podem variar significativamente entre os sexos. Meninas frequentemente apresentam sintomas mais sutis, como desatenção, que podem ser negligenciados em estudos que não consideram a diversidade de gênero.
A ausência de dados sobre a divisão de gênero em vários estudos é uma limitação significativa, restringindo a generalização dos resultados e a eficácia das intervenções. Os estudos que não informaram o gênero dos participantes incluem Barragán et al. (2014), Cornu et al. (2017), Matsudaira et al. (2015), Moghaddam et al. (2017), Mohammadzadeh et al. (2019), Ouadih-Moran et al. (2023). Essa falta de informações destaca a necessidade de pesquisas futuras que incluam uma análise mais detalhada das diferenças de gênero.
Recomenda-se que futuros estudos relatem detalhadamente a divisão de gênero e, idealmente, incluam uma análise de subgrupos para explorar potenciais diferenças na resposta ao tratamento entre meninos e meninas, dado que as manifestações do TDAH podem variar entre os sexos.
As intervenções analisadas foram categorizadas em seis grupos principais. As intervenções mais prevalentes foram aquelas que utilizaram a combinação de ômega-3/ômega6 (27,27%) e ômega-3 isolado (27,27%). Além disso, combinações de ômega-3 com metilfenidato foram analisadas em 18,18% dos estudos. Outras abordagens incluíram intervenções como ômega-3 com atomoxetina, ômega-3 com metilfenidato e melatonina, e ômega-3/ômega-6 com metilfenidato, cada uma representando 9,09% dos estudos (Figura 4).
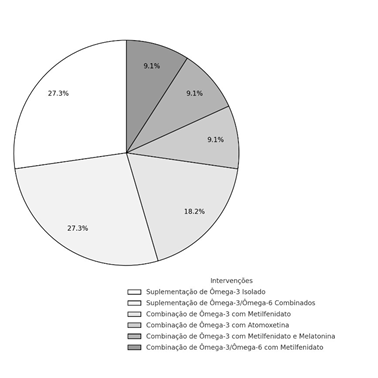
Fonte: Elaborada pelo autor.
Figura 4 – Distribuição das intervenções com ômega-3 no tratamento do TDAH.
O uso de ômega-3 justifica-se por seu papel crucial na estrutura das membranas celulares e na neurotransmissão, fundamentais para a regulação do comportamento e das funções cognitivas. Três estudos (Cornu et al., 2017; Dashti et al., 2014; Widenhorn-Müller et al., 2014) investigaram a suplementação de ômega-3 isolado, com o objetivo de avaliar o impacto dos ácidos graxos EPA e DHA na melhora dos sintomas do TDAH. Esses estudos evidenciaram uma melhora significativa na atenção e na redução da impulsividade.
A combinação de ômega-3 e ômega-6 (EPA, DHA e GLA) foi explorada em três estudos (Döpfner et al., 2019; Johnson et al., 2016; Matsudaira et al., 2015), com ênfase no potencial efeito sinérgico entre esses ácidos graxos. Os resultados sugerem que essa combinação pode ser mais eficaz do que o uso isolado de um dos componentes, especialmente para melhorar a função cognitiva e a regulação emocional dos pacientes.
Além das intervenções isoladas, outras estratégias também foram conduzidas combinando ômega-3 com medicamentos. Dois estudos (Moghaddam et al., 2017; Mohammadzadeh et al., 2019) investigaram a combinação de ômega-3 com metilfenidato, um estimulante amplamente utilizado no tratamento do TDAH, visando aumentar a eficácia do metilfenidato e atenuar seus efeitos adversos. Outra estratégia foi a combinação de ômega-3 com atomoxetina, analisada em um estudo (Anand; Sachdeva, 2016), que buscou aprimorar a eficácia da atomoxetina, um medicamento não estimulante, como alternativa aos estimulantes tradicionais. Um estudo adicional (Ouadih-Moran et al., 2023) investigou a combinação de ômega-3 com metilfenidato e melatonina, com o objetivo de melhorar não apenas os sintomas do TDAH, mas também tratar distúrbios do sono frequentemente associados à condição. Por fim, Barragán et al. (2014) examinou a suplementação combinada de ômega-3/ômega-6 com metilfenidato, avaliando o efeito sinérgico dessa combinação com a medicação estimulante.
A suplementação foi administrada por meio de cápsulas de óleo de peixe contendo EPA (ácido eicosapentaenoico) e DHA (ácido docosaexaenoico). Alguns estudos também incluíram ômega-6 (GLA – ácido gama-linolênico) nas intervenções. A administração foi predominantemente diária, embora Döpfner et al. (2019) e Johnson et al. (2016) tenham utilizado a administração duas vezes ao dia.
As doses de EPA variaram de 180 mg/dia (Anand; Sachdeva, (2016); Moghaddam et al., 2017; Mohammadzadeh et al., 2019) a 1116 mg/dia (Johnson et al., 2016), com uma média de 559,91 mg/dia e desvio padrão de 329,1 mg/dia. As doses de DHA variaram entre 84 mg/dia (Cornu et al., 2017) e 348 mg/dia (Johnson et al., 2016), com uma média de 173,50 mg/dia e desvio padrão de 96,7 mg/dia. Quatro estudos incluíram a suplementação de ômega-6, com doses variando de 60 mg/dia (Matsudaira et al., 2015) a 120 mg/dia (Johnson et al., 2016).
A duração dos tratamentos variou de 8 semanas (Moghaddam et al., 2017; Mohammadzadeh et al., 2019) a 12 meses (Barragán et al., 2014), com uma média de 20,2 semanas e desvio padrão de 14,6 semanas. Estudos de duração intermediária, entre 3 e 4 meses, incluíram Cornu et al. (2017), Dashti et al. (2014) e Matsudaira et al. (2015). O estudo de Barragán et al. (2014), com duração de 12 meses, foi o mais longo, permitindo uma avaliação mais robusta dos efeitos a longo prazo. Intervenções mais longas podem possibilitar uma observação mais completa das mudanças nos sintomas de TDAH. Estudos de curto prazo podem não captar totalmente os efeitos a longo prazo, o que poderia explicar por que alguns estudos não encontraram resultados significativos.
Dos 11 estudos avaliados, 8 relataram melhora significativa nos sintomas centrais do
TDAH, como desatenção, hiperatividade e impulsividade, representando 72.7% dos estudos. No entanto, a variabilidade metodológica, amostral e das intervenções resultou em diferenças na significância estatística dos resultados.
Estudos como Barragán et al. (2014), Cornu et al. (2017), Döpfner et al. (2019) e Johnson et al. (2016) obtiveram significância estatística em seus desfechos primários. No estudo de Johnson et al. (2016), 37.7% dos participantes que receberam doses elevadas de EPA e DHA demonstraram melhora significativa em desfechos relacionados ao desempenho escolar, como decodificação fonológica (p = 0.006) e tempo de análise visual (p = 0.01). Esses achados sugerem que, além dos sintomas comportamentais, a suplementação de ômega-3 pode beneficiar funções cognitivas associadas à aprendizagem, especialmente quando administrada em doses adequadas por períodos prolongados.
De maneira semelhante, Cornu et al. (2017) relatou que 50.0% dos participantes apresentaram melhora estatisticamente significativa nos sintomas de inatenção (p = 0.051) e hiperatividade/impulsividade (p = 0.034), indicando que o ômega-3 pode ser eficaz no controle desses sintomas em crianças com TDAH. Já em Barragán et al. (2014), 30.0% dos participantes que receberam a combinação de ômega-3/ômega-6 com metilfenidato apresentaram melhora significativa (p < 0.001) nos sintomas gerais do TDAH, reforçando a eficácia do ômega-3 como adjuvante a tratamentos farmacológicos.
No estudo de Döpfner et al. (2019), 40.0% dos participantes exibiram melhora estatisticamente significativa (p < 0.05) em desfechos relacionados à inatenção e problemas emocionais, sugerindo que o ômega-3 pode desempenhar um papel importante tanto na regulação comportamental quanto no controle de sintomas emocionais.
Entretanto, estudos como Matsudaira et al. (2015), Mohammadzadeh et al. (2019) e Widenhorn-Müller et al. (2014) não obtiveram significância estatística, embora tenham relatado melhoras nos sintomas de TDAH. No estudo de Widenhorn-Müller et al. (2014), 57.7% dos participantes relataram melhora, mas sem significância estatística (p > 0.05), o que pode ser atribuído ao tamanho amostral reduzido (97 participantes), variabilidade nas respostas e duração limitada da intervenção. Da mesma forma, Matsudaira et al. (2015), que utilizou uma intervenção de 12 semanas, e Mohammadzadeh et al. (2019), que investigou a combinação de ômega-3 e metilfenidato, não conseguiram produzir resultados estatisticamente significativos, sugerindo que doses ou tempos de intervenção mais longos podem ser necessários.
Dashti et al. (2014) comparou os efeitos do ômega-3 com metilfenidato e placebo, encontrando eficácia em ambos os tratamentos na redução dos sintomas de hiperatividade e impulsividade. O ômega-3 foi especialmente promissor nos subtipos de hiperatividadeimpulsividade e combinado, embora os resultados não tenham sido significativos em todos os domínios.
O estudo de Moghaddam et al. (2017) mostrou que a combinação de metilfenidato com ômega-3 foi eficaz na redução dos sintomas de atenção e hiperatividade, com 90% dos participantes exibindo melhora, em comparação aos 60% do grupo que recebeu apenas metilfenidato. Isso sugere que o ômega-3 pode ser um adjuvante eficaz ao tratamento farmacológico convencional.
Anand e Sachdeva (2016), ao investigar a combinação de ômega-3 com atomoxetina, observou uma redução maior nos sintomas de TDAH, mas sem significância estatística. Cerca de 55.0% dos participantes relataram melhora clínica, sugerindo que uma intervenção de maior duração pode ser necessária para gerar resultados mais robustos.
Finalmente, Ouadih-Moran et al. (2023) relatou que 62% dos participantes experimentaram redução significativa nos sintomas de TDAH ao combinar metilfenidato, melatonina e ômega-3. A melhora foi especialmente evidente nos sintomas de atenção e hiperatividade, com um impacto positivo sugerido pela elevação dos níveis da proteína S100B, associada à resposta inflamatória.
Estudos que utilizaram doses mais elevadas e intervenções mais longas, como Johnson et al. (2016) e Barragán et al. (2014), apresentaram melhores resultados em termos de significância estatística. Ambos usaram doses elevadas de EPA/DHA e tratamentos combinados, o que parece maximizar os benefícios terapêuticos do ômega-3.
Por outro lado, a heterogeneidade dos participantes, em termos de idade e gravidade dos sintomas, também pode ter influenciado a ausência de significância estatística em alguns estudos. Estudos focados em crianças mais jovens, como Cornu et al. (2017), relataram uma resposta mais consistente ao tratamento com ômega-3, enquanto aqueles que incluíram adolescentes ou populações mistas, como Widenhorn-Müller et al. (2014) e Matsudaira et al. (2015), apresentaram maior variabilidade nos resultados.
Essas diferenças também podem ser explicadas por variações metodológicas, como o tipo de intervenção, a dose de ômega-3 e a duração do tratamento. Barragán et al. (2014) e Dashti et al. (2014) focaram em crianças em idade escolar diagnosticadas com TDAH, enquanto Widenhorn-Müller et al. (2014) estudou crianças mais jovens, nas quais os sintomas comportamentais podem ser mais difíceis de avaliar em curto prazo.
Os achados são consistentes com o estudo de Hirayama et al. (2004), que também não encontrou eficácia significativa na suplementação com DHA isolado, sugerindo que o ômega3 pode ser mais eficaz em formas combinadas ou esterificadas, como destacado por Vaisman et al. (2008). Essa variação na eficácia é corroborada por Gustafsson et al. (2010), que demonstrou que EPA pode ser benéfico para crianças com comportamentos opositores, enquanto Assareh et al. (2012) não encontrou resultados significativos com a combinação de ômega-3 e ômega-6. Esse ponto também foi enfatizado por Perera et al. (2012), que sugerem que, embora a combinação de ácidos graxos possa ser benéfica em subgrupos específicos, ainda não há evidências suficientes para recomendá-la amplamente.
A importância de formas específicas de ômega-3 foi reforçada por Kean et al. (2013) e Hariri et al. (2012), que relataram melhorias em hiperatividade e redução de marcadores inflamatórios. A relação entre níveis sanguíneos de DHA e EPA e os sintomas de TDAH, abordada por Milte et al. (2012) e Crippa et al. (2016), sugere que a resposta ao tratamento pode depender dos níveis basais desses ácidos graxos, com Chang et al. (2019) mostrando que crianças com baixos níveis endógenos de EPA obtiveram maiores benefícios da suplementação.
Estudos que combinaram suplementação de ômega-3 com outras intervenções, como Behdani et al. (2013); Salehi et al. (2016) e San Mauro Martin et al. (2022), mostraram que a suplementação isolada ou combinada com terapias tradicionais pode ser eficaz, mas os resultados variam conforme os subgrupos de pacientes.
A análise de Bélanger et al. (2009) adiciona uma perspectiva importante ao destacar que os efeitos positivos na desatenção foram limitados e não se manifestaram em todos os subgrupos analisados. Da mesma forma, Johnson et al. (2009) relatou uma resposta positiva em apenas 26% dos participantes ao combinar ômega-3 e ômega-6, sem diferenças significativas entre os grupos tratados e placebo. A citação de Rodríguez et al. (2019) complementa esses achados, relatando que, apesar de melhorias nos sintomas comportamentais, não foram observadas mudanças em variáveis cognitivas com a suplementação de DHA.
Em termos de forma de administração, Kean et al. (2017) mostrou que o PCSO-524® trouxe melhorias em memória e atenção sustentada, enquanto Hariri et al. (2012) relacionou a suplementação com a redução de marcadores inflamatórios, indicando que a ação antiinflamatória do ômega-3 pode ter um papel relevante na melhora dos sintomas.
Em suma, a eficácia da suplementação de ômega-3 para o TDAH está fortemente associada a fatores como a dose, forma de administração, combinação com outras terapias e características demográficas dos participantes. Intervenções mais robustas, como as de Barragán et al. (2014) e Johnson et al. (2016), tendem a gerar melhores resultados em termos de significância estatística, enquanto estudos com menos rigor metodológico, como Matsudaira et al. (2015), apresentam resultados mais variados. Além disso, os efeitos na qualidade de vida e nos desfechos comportamentais, como relatado por Döpfner et al. (2019), indicam que o impacto da suplementação de ômega-3 vai além dos sintomas comportamentais, melhorando também o bem-estar geral.
4 CONCLUSSÃO
Com base na análise dos estudos revisados, a suplementação de ômega-3 demonstrou eficácia na redução de sintomas comportamentais, como impulsividade e hiperatividade, além de promover melhorias no controle emocional. Esses efeitos parecem ser mediados pela ação anti-inflamatória dos ácidos graxos e pela regulação da neurotransmissão, resultando em uma melhor interação social e maior controle comportamental em crianças diagnosticadas com TDAH.
Além dos benefícios comportamentais, a suplementação também impactou positivamente a qualidade de vida e o bem-estar emocional das crianças. Aquelas que receberam ômega-3 apresentaram, além da redução dos sintomas centrais do TDAH, uma melhoria na capacidade de lidar com situações sociais e emocionais do dia a dia. Esses achados sugerem que os efeitos da suplementação vão além do controle dos sintomas primários, impactando de maneira mais ampla a qualidade de vida. No entanto, esses benefícios podem variar conforme o perfil dos participantes e as terapias associadas.
Apesar da segurança da suplementação de ômega-3, alguns estudos relataram efeitos colaterais menores, como distúrbios gastrointestinais. Embora esses efeitos sejam geralmente leves e temporários, é importante monitorá-los, principalmente em intervenções de longo prazo. Quando comparados aos efeitos adversos de tratamentos farmacológicos convencionais, os eventos adversos associados à suplementação de ácidos graxos são mais brandos e menos frequentes, o que reforça o potencial seguro dessa abordagem.
Os dados também indicam que a suplementação de ômega-3 pode ser mais eficaz quando combinada com tratamentos farmacológicos, como o metilfenidato. Esse achado sugere que uma abordagem terapêutica combinada, integrando suplementação e medicamentos convencionais, pode potencializar os benefícios para os pacientes. No entanto, a heterogeneidade dos estudos revisados, especialmente em relação à dosagem e às características das amostras, limita a comparabilidade direta dos resultados e dificulta a formulação de diretrizes clínicas claras. Variáveis como tempo de intervenção, dosagem e perfil dos participantes devem ser mais bem controladas em futuros estudos para uma avaliação mais precisa da eficácia da suplementação.
Diante das limitações dos estudos revisados, há uma necessidade de ensaios clínicos de longa duração, com amostras mais robustas e maior padronização metodológica. Futuros estudos devem incluir grupos de controle rigorosos e explorar as interações entre a suplementação de ômega-3 e outras intervenções terapêuticas, tanto farmacológicas quanto comportamentais. Além disso, é fundamental avaliar os efeitos de longo prazo da suplementação, dado o potencial impacto positivo que ela pode ter no desenvolvimento de crianças com TDAH.
Por fim, embora os resultados até o momento sejam promissores, é importante enfatizar que a suplementação de ácidos graxos não deve ser vista como uma solução única para o manejo do TDAH. Em vez disso, deve ser considerada uma intervenção complementar, capaz de amplificar os benefícios de tratamentos já estabelecidos. Com base nos dados disponíveis, conclui-se que a suplementação de ômega-3 tem potencial para integrar-se às diretrizes clínicas, desde que pesquisas adicionais esclareçam seu impacto a longo prazo e sua aplicação em diferentes populações pediátricas.
Dessa forma, a eficácia da suplementação de ômega-3 no tratamento do TDAH parece depender de fatores como dose, duração do tratamento e características individuais dos pacientes. A combinação de ômega-3 com medicamentos, como o metilfenidato, mostrou potencial para aumentar os efeitos terapêuticos, especialmente em subgrupos específicos de crianças. Embora os resultados sejam promissores, estudos futuros devem buscar padronizar doses e identificar os perfis de pacientes que mais se beneficiam dessa intervenção, além de explorar mais profundamente o impacto de diferentes formas de ácidos graxos, como EPA e DHA, em comparação ao tratamento isolado.
REFERÊNCIAS
ABRAHÃO, A. L. B., ELIAS, L. C. S. Habilidades Sociais em Crianças com TDAH: uma revisão de literatura. Contextos Clínicos, v. 14, n. 2, p. 681-704, mai./ago. 2021. doi:
10.4013/ctc.2021.142.14.
AMERICAN PSYCHIATRIC ASSOCIATION. Diagnostic and Statistical Manual of Mental Disorders, 5th Edition (DSM-5). American Psychiatric Publishing, 2013.
ANAND, Puneet; SACHDEVA, Ankur. Effect of Poly Unsaturated Fatty Acids Administration on Children with Attention Deficit Hyperactivity Disorder: A Randomized Controlled Trial. Journal of Clinical and Diagnostic Research, v. 10, n. 9, p. OC01-OC05, 2016. DOI: 10.7860/JCDR/2016/20423.8471.
ASSAREH, Marzieh; DAVARI ASHTIANI, Rozita; KHADAMI, Mojgan; JAZAYERI, Shima; RAI, Alireza; NIKOO, Mohammadali. Efficacy of polyunsaturated fatty acids (PUFA) in the treatment of attention deficit hyperactivity disorder: a randomized, doubleblind, placebo-controlled clinical trial. Journal of Attention Disorders, [s.l.], v. 21, n. 1, p. 78-85, 2017. DOI: 10.1177/1087054712463962.
BANASCHEWSKI, T., BELSHAM, B., BLOCH, M. H., FERRIN, M., JOHNSON, M., KUSTOW, J., … & ZUDDAS, A. Supplementation with polyunsaturated fatty acids (PUFAs) in the management of attention deficit hyperactivity disorder (ADHD). Nutrition and Health. 2018, 24(4), 279–284.
BARKLEY, R. A. Attention-deficit hyperactivity disorder: A handbook for diagnosis and treatment (4th ed.). 2015.
BARRAGÁN, Eduardo; BREUER, Dieter; DÖPFNER, Manfred. Efficacy and safety of Omega-3/6 fatty acids, methylphenidate, and a combined treatment in children with ADHD. Journal of Attention Disorders, [s.l.], v. 1, n. 9, p. 1-9, 2014. DOI:
10.1177/1087054713518239.
BEHDANI, F.; HEBRANI, P.; NASERAEE, A.; BAGHBAN HAGHIGHI, M.;
AKHAVANREZAYAT, A. Does omega-3 supplement enhance the therapeutic results of methylphenidate in attention deficit hyperactivity disorder patients? Journal of Research in Medical Sciences, [s.l.], v. 18, n. 8, p. 653-658, 2013.
BÉLANGER, Stacey Ageranioti; VANASSE, Michel; SPAHIS, Schohraya; SYLVESTRE,
Marie-Pierre; LIPPÉ, Sarah; L’HEUREUX, François; GHADIRIAN, Parviz; VANASSE, Catherine-Marie; LEVY, Emile. Omega-3 fatty acid treatment of children with attentiondeficit hyperactivity disorder: A randomized, double-blind, placebo-controlled study. Paediatrics & Child Health, [s.l.], v. 14, n. 2, p. 89-98, 2009.
BLOCH, M. H., MULQUEEN, J. M. Nutritional Supplements for the Treatment of ADHD. Child and Adolescent Psychiatric Clinics of North America. 2014, 23(4), 883-897.
BLOCH, M. H., QAWASMI, A. Omega-3 fatty acid supplementation for the treatment of children with attention-deficit/hyperactivity disorder symptomatology: systematic review and meta-analysis. J Am Acad Child Adolesc Psychiatry, 2011.
CHANG, J. P. C.; SU, K. P.; MONDELLI, V.; SATYANARAYANAN, S. K.; YANG, H.
T.; CHIANG, Y. J.; CHEN, H. T.; PARIANTE, C. M. High-dose eicosapentaenoic acid (EPA) improves attention and vigilance in children and adolescents with attention deficit hyperactivity disorder (ADHD) and low endogenous EPA levels. Translational Psychiatry, [s.l.], v. 9, p. 1-9, 2019.
CHANG, Jane Pei-Chen; SU, Kuan-Pin. Nutritional Neuroscience as Mainstream of Psychiatry: The Evidence-Based Treatment Guidelines for Using Omega-3 Fatty Acids as a New Treatment for Psychiatric Disorders in Children and Adolescents. Clinical Psychopharmacology and Neuroscience, v. 18, n. 4, p. 469-483, 2020.
COCHRANE. Cochrane risk-of-bias tool for randomized trials (RoB 2). Versão de 2019. Disponível em: https://methods.cochrane.org/bias/risk-bias-2. Acesso em: 14 out. 2024.
CORNU, C.; MERCIER, C.; GINHOUX, T.; MASSON, S.; MOUCHET, J.; NONY, P.; et al. A double-blind placebo-controlled randomised trial of omega-3 supplementation in children with moderate ADHD symptoms. European Child & Adolescent Psychiatry, [s.l.], v. 26, n. 5, p. 547-557, 2017.
CRIPPA, Alessandro; AGOSTONI, Carlo; MAURI, Maddalena; MOLTENI, Massimo; NOBILE, Maria. Polyunsaturated fatty acids are associated with behavior but not with cognition in children with and without ADHD: An Italian study. Journal of Attention Disorders, [s.l.], v. 20, n. 1, p. 1-13, 2016.
DASHTI, Naser; HEKMAT, Hoda; SOLTANI, Hamid Reza; RAHIMDEL, Abolghasem; JAVAHERCHIAN, Mohammad. Comparison of therapeutic effects of omega-3 and methylphenidate (Ritalin®) in treating children with attention deficit hyperactivity disorder. Iran Journal of Psychiatry and Behavioral Sciences, [s.l.], v. 8, n. 4, p. 7-11, 2014.
DINICOLANTONIO, J. J.; O’KEEFE, J. H. The importance of marine omega-3s for brain development and the prevention and treatment of behavior, mood, and other brain disorders. Nutrients, [s.l.], v. 12, n. 8, p. 2333, 2020.
DÖPFNER, M.; DOSE, C.; BREUER, D.; HEINTZ, S.; SCHIFFHAUER, S.; BANASCHEWSKI, T. Efficacy of Omega-3/Omega-6 Fatty Acids in Preschool Children at Risk of ADHD: A Randomized Placebo-Controlled Trial. Journal of Attention Disorders, [s.l.], v. 23, n. 9, p. 1-11, 2019.
GAO, X., SU, X., HAN, X., WEN, H., CHENG, C., ZHANG, S., LI, W., CAI, J., ZHENG,
L., MA, J., LIAO, M., NI, W., LIU, T., LIU, D., MA, W., HAN, S., ZHU, S., YE, Y., ZENG, F. F. Unsaturated Fatty Acids in Mental Disorders: An Umbrella Review of MetaAnalyses. Adv Nutr. 2022 Dec 22;13(6):2217-2236.
GUSTAFSSON, Per A.; BIRBERG-THORNBERG, Ulrika; DUCHÉN, Karel;
LANDGREN, Magnus; MALMBERG, Kerstin; PELLING, Henrik; STRANDVIK,
Birgitta; KARLSSON, Thomas. EPA supplementation improves teacher-rated behaviour and oppositional symptoms in children with ADHD. Acta Paediatrica, [s.l.], v. 99, n. 10, p. 1540-1549, 2010.
HÄNDEL, M. N., ROHDE, J. F., RIMESTAD, M. L., BANDAK, E., BIRKEFOSS, K.,
TENDAL, B., LEMCKE, S., CALLESEN, H. E. Efficacy and Safety of Polyunsaturated
Fatty Acids Supplementation in the Treatment of Attention Deficit Hyperactivity Disorder (ADHD) in Children and Adolescents: A Systematic Review and Meta-Analysis of Clinical Trials. Nutrients. 2021 Apr 8;13(4):1226.
HARIRI, M.; DJAZAYERY, A.; DJALALI, M.; SAEDISOMEOLIA, A.; RAHIMI, A.; ABDOLAHIAN, E. Effect of n-3 supplementation on hyperactivity, oxidative stress and inflammatory mediators in children with attention-deficit-hyperactivity disorder. Malaysian Journal of Nutrition, [s.l.], v. 18, n. 3, p. 329-335, 2012.
HIRAYAMA, S.; HAMAZAKI, T.; TERASAWA, K. Effect of docosahexaenoic acid-
containing food administration on symptoms of attention-deficit/hyperactivity disorder: a placebo-controlled double-blind study. European Journal of Clinical Nutrition, [s.l.], v. 58, n. 3, p. 467-473, 2004.
JOHNSON, Mats; FRANSSON, Gunnar; ÖSTLUND, Sven; ARESKOUG, Björn; GILLBERG, Christopher. Omega 3/6 fatty acids for reading in children: a randomized, double-blind, placebo-controlled trial in 9-year-old mainstream schoolchildren in Sweden. Journal of Child Psychology and Psychiatry, [s.l.], v. 57, n. 1, p. 58-66, 2016.
KEAN, J. D.; STOUGH, C.; DOWNEY, L. A.; SARRIS, J.; CAMFIELD, D. A. A randomized controlled trial investigating the effects of PCSO-524®, a patented oil extract of the New Zealand green-lipped mussel (Perna canaliculus), on hyperactivity, mood, and cognitive function in children and adolescents. Nutrition Journal, [s.l.], v. 12, n. 100, p. 110, 2013.
KEAN, James D.; SARRIS, Jerome; SCHOLEY, Andrew; SILBERSTEIN, Richard; DOWNEY, Luke A.; STOUGH, Con. Reduced inattention and hyperactivity and improved cognition after marine oil extract (PCSO-524®) supplementation in children and adolescents with clinical and subclinical symptoms of attention-deficit hyperactivity disorder (ADHD): a randomised, double-blind, placebo-controlled trial.
Psychopharmacology, [s.l.], v. 234, n. 3, p. 405-420, 2017.
MATSUDAIRA, Toshiko; GOW, Rachel V.; KELLY, Joanna; MURPHY, Caroline;
POTTS, Laura; SUMICH, Alexander; GHEBREMESKEL, Kebreab; CRAWFORD, Michael A.; TAYLOR, Eric. Biochemical and psychological effects of omega-3/6 supplements in male adolescents with attention-deficit/hyperactivity disorder: a randomized, placebo-controlled, clinical trial. Journal of Child and Adolescent Psychopharmacology, [s.l.], v. 25, n. 10, p. 775-782, 2015.
MCNAMARA, R. K., VANNEST, J. J., VALENTINE, C. J. Role of perinatal long-chain omega-3 fatty acids in cortical circuit maturation: Mechanisms and implications for psychopathology. World J Psychiatry. 2015 Mar 22;5(1):15-34.
MILTE, Catherine M.; PARLETTA, Natalie; BUCKLEY, Jonathan D.; COATES, Alison M.; YOUNG, Ross M.; HOWE, Peter R. C. Eicosapentaenoic and docosahexaenoic acids, cognition, and behavior in children with attention-deficit/hyperactivity disorder: A randomized controlled trial. Nutrition, [s.l.], v. 28, n. 6, p. 670-677, 2012.
MOGHADDAM, M. F.; SHAMEKHI, M.; RAKHSHANI, T. Effectiveness of methylphenidate and PUFA for the treatment of patients with ADHD: A double-blinded randomized clinical trial. Electronic Physician, [s.l.], v. 9, n. 5, p. 4412-4418, 2017.
MOHAMMADZADEH, S.; BAGHI, N.; YOUSEFI, F.; YOUSEFZAMANI, B. Effect of omega-3 plus methylphenidate as an alternative therapy to reduce attention deficithyperactivity disorder in children. Korean Journal of Pediatrics, [s.l.], v. 62, n. 9, p. 360366, 2019.
MOHER, David; LIBERATI, Alessandro; TIFFANY, Altman; GLOVER, James; JUNGBLUTH, Patrick; KLOPPER, Louis; LAVERTY, Anne; MCGUIRE, David; THOMPSON, Michelle; WALTER, Stewart; WILSON, Kenneth; et al. Preferred reporting items for systematic reviews and meta-analyses: The PRISMA 2015 statement. PLOS Med, [s.l.], v. 13, n. 5, e1002120, 2016. Disponível em: https://www.prisma–statement.org/.
NAZAROVA, V. A., SOKOLOV, A. V., CHUBAREV, V. N., TARASOV, V. V., SCHIÖTH, H. B. Treatment of ADHD: Drugs, psychological therapies, devices, complementary and alternative methods as well as the trends in clinical trials. Front Pharmacol. 2022.
NEVINS, J. E. H., DONOVAN, S. M., SNETSELAAR, L., DEWEY, K. G., NOVOTNY,
R., STANG, J., TAVERAS, E. M., KLEINMAN, R. E., BAILEY, R. L., RAGHAVAN, R., SCINTO-MADONICH, S. R., VENKATRAMANAN, S., BUTERA, G., TERRY, N.,
ALTMAN, J., ADLER, M., OBBAGY, J. E., STOODY, E. E., DE JESUS, J. Omega-3 Fatty Acid Dietary Supplements Consumed During Pregnancy and Lactation and Child Neurodevelopment: A Systematic Review. J Nutr. 2021 Nov 2;151(11):3483-3494.
OTASOWIE, J., CASTELLS, X., EHIMARE, U. P., SMITH, C. H. Tricyclic antidepressants for attention deficit hyperactivity disorder (ADHD) in children and adolescents. Cochrane Database Syst Rev. 2014 Sep 19;2014(9)
OUADIH-MORAN, M.; DE SOUSA, G.; HOSSEINI, H.; CEDRONE, M.; KUPIEC, M.; LEBEAU, M.; CANITROT, D. Is S100B involved in attention-deficit/hyperactivity disorder (ADHD)? Comparisons with controls and changes following a triple therapy containing methylphenidate, melatonin and ω-3 PUFAs. Nutrients, [s.l.], v. 15, n. 712, p. 117, 2023.
PATRICK, R. P., AMES, B. N. Vitamin D and the omega-3 fatty acids control serotonin synthesis and action, part 2: relevance for ADHD, bipolar disorder, schizophrenia, and impulsive behavior. FASEB J. 2015 Jun;29(6):2207-22.
PERERA, Hemamali; JEEWANDARA, Kamal Chandima; SENEVIRATNE, Sudarshi; GURUJE, Chandima. Combined ω3 and ω6 supplementation in children with attentiondeficit hyperactivity disorder (ADHD) refractory to methylphenidate treatment: a doubleblind, placebo-controlled study. Journal of Child Neurology, [s.l.], v. 27, n. 6, p. 747-753, 2012.
PUSCEDDU, M. M., KELLY, P., ARIFFIN, N., CRYAN, J. F., CLARKE, G., DINAN, T. G. N-3 Polyunsaturated Fatty Acids through the Lifespan: Implication for Psychopathology. International Journal of Neuropsychopharmacology. 2016, 19(9).
RANGEL-HUERTA, O. D.; GIL, A. Effect of omega-3 fatty acids on cognition: an updated systematic review of randomized clinical trials. Nutrition Reviews, [s.l.], v. 76, n. 1, p. 120, 2017.
RODRÍGUEZ, C.; GARCÍA, T.; ARECES, D.; FERNÁNDEZ, E.; GARCÍA-NORIEGA, M.; DOMINGO, J. C. Supplementation with high-content docosahexaenoic acid triglyceride in attention-deficit hyperactivity disorder: a randomized double-blind placebocontrolled trial. Neuropsychiatric Disease and Treatment, [s.l.], v. 15, p. 1193-1209, 2019.
SALEHI, B.; MOHAMMADBEIGI, A.; SHEYKHOLESLAM, H.; MOSHIRI, E.;
DORREH, F. Omega-3 and zinc supplementation as complementary therapies in children with attention-deficit/hyperactivity disorder. Journal of Research in Pharmacy Practice, [s.l.], v. 5, n. 1, p. 22-26, 2016.
SAN MAURO MARTIN, I.; SANZ ROJO, S.; GONZÁLEZ COSANO, L.; CONTY DE LA CAMPA, R.; GARICANO VILAR, E.; BLUMENFELD OLIVARES, J. A.
Impulsividad en el trastorno por déficit de atención e hiperactividad en niños después de una intervención de 8 semanas con dieta mediterránea y/o ácidos grasos omega-3: ensayo clínico aleatorizado. Neurología, [s.l.], v. 37, n. 6, p. 513-523, 2022.
SIAFIS, S., ÇIRAY, O., WU, H., SCHNEIDER-THOMA, J., BIGHELLI, I., KRAUSE, M., … & LEUCHT, S. Pharmacological and dietary-supplement treatments for autism spectrum disorder: A systematic review and network meta-analysis. Molecular Autism. 2022, 13(10).
SIMOPOULOS, A. P. Omega-3 fatty acids in health and disease and in growth and development. Am J Clin Nutr. 1991 Sep;54(3):438-63.
VAISMAN, Nachum; KAYSAR, Nehemia; ZARUK-ADASHA, Yahalomit; PELLED, Dori; BRICHON, Gérard; ZWINGELSTEIN, Georges; BODENNEC, Jacques. Correlation between changes in blood fatty acid composition and visual sustained attention performance in children with inattention: effect of dietary n-3 fatty acids containing phospholipids. The American Journal of Clinical Nutrition, [s.l.], v. 87, n. 5, p. 1170-1180, 2008.
WENDER, P. H. Pharmacotherapy of attention-deficit/hyperactivity disorder in adults. J Clin Psychiatry. 1998;59 Suppl 7:76-9. WIDENHORN-MÜLLER, Katharina; SCHWANDA, Simone; SCHOLZ, Elke; SPITZER, Manfred; BODE, Harald. Effect of supplementation with long-chain ω-3 polyunsaturated fatty acids on behavior and cognition in children with attention deficit/hyperactivity disorder (ADHD): A randomized placebo-controlled intervention trial. Prostaglandins, Leukotrienes and Essential Fatty Acids, [s.l.], v. 91, p. 49-6
Graduanda do Curso de Bacharelado em Nutrição do Centro Universitário FAMETRO. E-mail: alinecamilaalves92@gmail.com; emanuelegurgel@gmail.com; leticia_dino@hotmail.com
² Orientadora do TCC, Doutora em Biotecnologia pela Universidade Federal do Amazonas. Docente do Curso de Bacharelado em Nutrição do Centro Universitário FAMETRO. E-mail: francisca.freitas@fametro.edu.br 3 Coorientadora do TCC, Mestre em Ciências da Saúde pela Universidade Federal do Amazonas. Docente do Curso de Bacharelado em Nutrição do Centro Universitário FAMETRO. E-mail: rebeca.figueiredo@fametro.edu.br
