NON-INFECTIOUS INTESTINAL AND SECONDARY DISORDERS IN DOGS AND CATS: LITERATURE REVIEW
REGISTRO DOI: 10.5281/zenodo.10699379
Maria Eduarda de França1; José Mykael da Silva Santos2; Amanda Luisa Teixeira Leite2; Jéssica Dantas de Farias2; Lucas Assis Lourenço2; João Paulo da Silva2; Micaelly Felix Lacerda2; João Victor Soares dos Santos2; Almir Pereira de Souza3
Resumo
Distúrbios intestinais não infecciosos são afecções enteropáticas, que promovem desordem intestinal em cães e gatos, levando a manifestações clínicas do trato gastrointestinal, além de afetar outros sistemas podendo manifestar até alterações cutâneas. Assim, objetivou-se com este trabalho revisar a literatura sobre os principais distúrbios intestinais primários e secundários não infecciosos em cães e gatos. A fase crônica de uma inflamação intestinal, associado a fatores genéticos, predisposição racial e idade pode causar o surgimento de doenças intestinais, visto que outros fatores determinantes como antígenos na dieta também podem provocar tal inflamação, podendo ser de origem imunomediada ou não. Os distúrbios intestinais não infecciosos podem ser de origem primária local, como os quadros obstrutivos, ou secundários a outras patologias como por exemplo as alterações metabólicas que incluem hepatopatias e insuficiência pancreática exócrina, distúrbios alimentares, como a hipersensibilidade alimentar; distúrbios por doenças idiopáticas, imunológicas, congênita ou adquiridas, que cursam com a doença inflamatória intestinal, linfangiectasia intestinal e constipação intestinal. As principais neoplasias são os adenocarcinomas intestinais, linfoma gastrointestinal, tumor estromal gastrointestinal e leiomiossarcoma intestinal que também podem cursar com este distúrbio. Logo, os conhecimentos dos mecanismos fisiopatológicos são cruciais e determinantes para obtenção do diagnóstico e tratamento eletivo. Exames de triagem como hemograma, bioquímicas e eletrólitos devem ser solicitados, principalmente quando há obstrução intestinal, pois a hipopotassemia e a hipocloremia podem estar presentes. Para obtenção do diagnóstico de forma geral, pode-se requerer exames de imagens como raio-x e ultrassonografia, porém os exames colonoscópicos são mais precisos, principalmente para identificação de corpos estranhos o qual viabiliza a sua remoção na maioria das vezes. Em casos de neoplasias, o exame histopatológico é considerado o definitivo. O tratamento é prescrito conforme a doença de base, que constitui na terapêutica do trato gastrointestinal, que incluem terapias de suporte, sintomática, específica e dietética. Nos casos de intussuscepção, o tratamento requer procedimento cirúrgico. Os distúrbios intestinais de origem idiopática, por serem de causa desconhecida devem ser investigados, sendo necessário a exclusão de outras enfermidades para alcançar diagnóstico definitivo. Contudo para obtenção de um sucesso terapêutico deve-se buscar a causa de base, visto que a maioria dos distúrbios intestinais são secundárias a outras patologias.
Palavras-chaves: Inflamação. Intestino. Obstrução intestinal. Imunomediada. Idiopático.
INTRODUÇÃO
Distúrbios intestinais são afecções que ocorrem frequentemente na Clínica Médica de Pequenos Animais, tendo em vista que, as doenças intestinais de origens primordialmente não infecciosas acometem de forma significativa, ambas espécies caninas e felinas. Sabe-se que os seres humanos estão cada vez mais antropomórficos, o qual designa como o ato de atribuir características humanas a não humanas, tornando-os como um membro familiar e muitas das vezes, acabam fornecendo um manejo adaptado à sua realidade, que porventura podem propiciar surgimentos de doenças e agravos aos seus pets, incluindo os distúrbios intestinais. Estudos e pesquisas relatam que as doenças gastrointestinais estão cada vez mais recorrentes na rotina clínica, e estes animais estão mais predispostos a desencadear processos crônicos inflamatórios, através do fornecimento de diversas variedades de rações, alimentos caseiros e hábitos de convivência. Com a modernidade, os tutores estão com mais acessibilidade a uma grande variedade de raças caninas e felinas, que podem propiciar a uma maior incidência de doenças inflamatórias intestinais.
Além do mais, com o acesso à informação por meios tecnológicos de pesquisas e de mídia, são geralmente estes os recursos que os tutores tendem a consultar em primeira instância, antes mesmo de encaminhar o seu animal ao atendimento Médico Veterinário. Tal conduta é preocupante tendo em vista que algumas doenças intestinais não infecciosas podem ser fatais, se não diagnosticadas precocemente. Outro fator importante é o comportamento felino ser totalmente distinto dos caninos, o que poderá dificultar a observação das manifestações dos sinais clínicos. Dessa maneira, as probabilidades do felino evoluir para um quadro crônico são maiores.
Os distúrbios intestinais não infecciosos podem ser de origem primária local como os quadros obstrutivos, ou secundários a outras patologias como por exemplo as alterações metabólicas, distúrbios alimentares, distúrbios de origem idiopática, imunológica, congênita ou adquiridas e neoplasias. Estes são exemplos de afecções importantes que podem desencadear um quadro de inflamação intestinal em cães e gatos.
Uma inflamação normalmente é um mecanismo protetor cujo objetivo fisiológico é eliminar a causa da lesão. No entanto, em alguns casos uma resposta inflamatória excessiva e/ou prolongada pode se tornar prejudicial e até mesmo mais danosa do que as alterações provocadas por agentes infecciosos. O que possibilita a busca do diagnóstico e tratamento eficaz se tornarem os meios mais relevantes para estabilização clínica.
Desta forma, objetivou-se com esta revisão de literatura, relatar os principais distúrbios intestinais primários e secundários não infecciosos que acometem cães e gatos, com ênfase em descrever a epidemiologia, diagnóstico e tratamentos de tais afecções.
ANATOMOFISIOLOGIA DO TRATO INTESTINAL
O intestino é considerado a parte caudal do canal alimentar, e divide-se em intestino delgado, constituído por duodeno, jejuno e íleo e o intestino grosso é composto pelo ceco, colón e reto. Com efeito o intestino dos carnívoros resulta da adaptação gastrointestinal a diversas dietas e hábitos alimentares. O trato intestinal dos carnívoros é relativamente curto comparado aos herbívoros. De modo geral, considera-se que o intestino é cinco vezes o tamanho do corpo em carnívoros (König et al., 2016).
O mesmo, participa de uma etapa importante para manutenção homeostática através de ações enzimáticas, da microbiota residente e secreções adicionais do fígado e do pâncreas, ocorre a metabolização no qual a ingesta é digerida, substâncias são absorvidas e depois excretadas (Howard, 2013).
Como mencionado, o trato intestinal secreta substâncias necessárias para o funcionamento de todo organismo. Não é à toa que o intestino é considerado o segundo cérebro do corpo humano e animal, pois possui neurônios que agem independentemente do sistema nervoso central, no qual a sua regulamentação é promovida em parte pelo sistema nervoso autônomo, que possui o componente extrínseco e intrínseco. O componente extrínseco é a inervação simpática e parassimpática do trato gastrointestinal, que interage diretamente com o sistema nervoso central (SNC). O componente intrínseco, compõem o sistema nervoso entérico (Costanzo, 2014).
O sistema nervoso entérico, por sua vez, está inteiramente contido nos plexos submucoso e mioentérico na parede do trato gastrointestinal. Ele se comunica, extensivamente, com os sistemas nervosos simpático e parassimpático, podendo coordenar todas as funções do trato gastrointestinal, mesmo na ausência de inervação extrínseca (Costanzo, 2014).
A mucosa intestinal é composta por três camadas, constituída por células epiteliais revestindo o lúmen intestinal, células mesenquimais da lâmina própria e muscular da mucosa. Essas células funcionam como uma barreira permeável seletiva, contribuindo na absorção de nutrientes, eletrólitos e água, e excluindo patógenos, toxinas e antígenos. A lesão dessas estruturas pode resultar em disfunção digestiva e consequentemente diarreia. Logo, o conhecimento dos tipos celulares, bem como de suas funções nos processos de digestão e absorção, é importante para compreensão da fisiopatologia intestinal (Figura 1) (Howard, 2013).
Figura 1 – Representação esquemática das camadas do Trato Gastrointestinal.
Fonte: HOWARD, 2013.
São os tipos principais de células epiteliais, revestindo o intestino, que consiste em enterócitos, células de Paneth, células indiferenciadas ou da cripta, células caliciformes, células enterocromarfins (neuroendócrina, argentafins) e células M (micropregueadas) (Howard, 2013).
Os enterócitos apresentam glicocálix, em que há enzimas digestivas e absortivas. Possuem a mais rápida taxa de renovação entre todas as células fixas do corpo. As células de Paneth apresentam função secretora e fagocítica, e estão predominantemente nas criptas intestinais. As mesmas sintetizam um composto hidrogenado, criptidina é um aminoácido, lisina. Essas substâncias são consideradas tóxicas para as bactérias e provavelmente formam uma camada protetora, às células presentes na cripta contra infecções (Howard, 2013).
As células epiteliais indiferenciadas da cripta, apresentam pouca capacidade digestiva e são responsáveis pela substituição de todos os tipos celulares. Atuam como receptor para IgA e IgM. E também são fontes de secreção de íons cloro para o interior do lúmen intestinal. As células caliciformes, são responsáveis por produzirem muco e estão presentes nas vilosidades e criptas, contribuindo no aumento da absorção por toda extensão intestinal. As células enteroendócrinas, estão presentes primariamente na cripta e produzem serotonina, catecolaminas, gastrina, somastotatina, colescistoquinina, secretina, enteroglucagon entre outros hormônios (Howard, 2013).
As células M, são assim denominadas por apresentarem uma superfície micropregueada ou membranosa. As mesmas formam o epitélio que reveste o tecido linfoide associado ao intestino (GALP). São responsáveis pela realização de funções na captação de proteínas, antígenos e no transporte desses antígenos até o GALP, onde são captados por células dendríticas e macrófagos (Howard, 2013).
Além das células epiteliais intestinais, o sistema entérico possui um mecanismo de defesa imunológico, que constitui a área indutora primária de defesa, denominada placa de Peyer, situada nos folículos linfoides e no epitélio folicular associado (Dellmann, 2012).
Os hormônios intestinais agem independentemente de qualquer atividade neural, e são importantes para regulamentação do sistema gastrointestinal (Constanzo, 2014; Klein, 2020). O conhecimento dos principais hormônios secretados a partir do trato intestinal, serve como auxílio das possíveis compreensões que podem desencadear distúrbios inflamatórios intestinais.
• Colecistocinina (CCK): é secretada pelas células I da mucosa do duodeno e do jejuno. Esses estímulos alertam as células I da presença de alimento contendo gordura e proteína, que devem ser digeridos e absorvidos. As principais ações da CCK, são aumento da secreção enzimática pancreática; aumento da secreção HCO3 – pancreático; estimula a contração da vesícula biliar e relaxa o esfíncter de Oddi; estimula o crescimento do pâncreas exócrino e da vesícula biliar e inibe o esvaziamento gástrico (Constanzo, 2014; Klein, 2020).
• Secretina: é excretada pelas células S do duodeno, em resposta ao H+ e ácidos graxos no lúmen do intestino delgado. As suas principais funções são assegurar o aumento da secreção de bicarbonato HCO3 – pancreático e biliar; diminui a secreção gástrica de H+ e inibindo os efeitos tróficos da gastrina sobre as células parietais (Klein, 2020).
• Peptídeo Insulinotrópico Glicose-dependente (GIP): é secretado pelas células K da mucosa duodenal e jejunal. É o único hormônio gastrointestinal secretado em resposta a todos os três tipos principais de nutrientes: glicose, aminoácidos e ácidos graxos. A principal ação do GIP é promover a estimulação da secreção de insulina pelas células β do pâncreas. O GIP também promove a diminuição da secreção de H+ e esvaziamento gástrico (Klein, 2020; Silva, 2015).
DISTÚRBIOS OBSTRUTIVOS E ALIMENTARES
Corpos estranhos
As afecções gastrentéricas são muito frequentes na Clínica Médica de Pequenos Animais e correspondem cerca de 60% dos atendimentos emergenciais em filhotes (Jericó, 2015). Dentro dos quadros obstrutivos estão os corpos estranhos e intussuscepção. Os corpos estranhos são objetos deglutidos pelo animal a exemplo de panos, meias, barbantes, plásticos etc. e que podem permanecer alojados no estômago ou intestino, e consequentemente provocar um plissamento intestinal (João, 2015).
Após a ingestão do corpo estranho os sinais clínicos podem variar de horas a semanas. Sendo os mais comuns quadros de vômitos, diarreia, desconforto abdominal, inapetência e letargia. Estes são sinais inespecíficos e estão presentes de forma variável nos cães e gatos, decorrentes da inflamação local (Hayes, 2009). Ademais, estudos retrospectivos relatam que corpos estranhos lineares são mais propensos a causar perfuração intestinal e consequentemente peritonite, indicando a necessidade de um diagnóstico preciso (Santos; Auler, 2015).
De modo geral, o diagnóstico das enteropatias é baseado numa anamnese detalhada, sinais clínicos, exame clínico e específico do sistema digestório, exames complementares e também por exclusão de enteropatias infecciosas. A manifestação clínica pode variar de acordo com as afecções citadas, porém geralmente são manifestadas em sinais gastrointestinais, como vômito, halitose, diarreia, disenteria, tenesmo, hiporexia, perda de peso, dor abdominal, polifagia e polidipsia (João, 2015).
A- Epidemiologia
Em quadros obstrutivos, no intestino delgado o jejuno é um dos locais mais afetados e os filhotes sem distinção de raça ou sexo, são mais predispostos devido a menor discriminação alimentar e consequentemente menor seletividade. No entanto, os animais adultos também podem ser vítimas desse agravo (Hobday et al.,2014).
Além disso, distúrbios comportamentais que incluem a síndrome de Pica em gatos, consiste numa perturbação do comportamento alimentar em que de forma conscientes ingerem substâncias impróprias para alimentação (Franziska, 2022).
Os corpos estranhos lineares, são mais frequentes em gatos, pelo fato de os felinos terem o comportamento de brincar com fios de lã, novelos e linhas em geral. Adicionalmente por apresentarem estruturas anatômicas em sua língua, descritas como papilas linguais filiformes, elas auxiliam na fixação do corpo estranho linear como por exemplo os fios de lã, o que proporciona a deglutição desse material (João, 2015; König, 2016).
Um estudo retrospectivo realizado de 208 casos, em cães e gatos contendo corpos estranhos, demonstrou que 94% dos cães e 100% dos gatos sobreviveram a corpos estranhos discretos, enquanto que 80% dos cães e 63% dos gatos, a corpos estranhos lineares. Em cães 63% ocorreram no jejuno, com maior incidência de objetos plásticos, além de apresentar maior duração de sinais clínicos na presença de corpos estranhos lineares (Hayes, 2009).
B- Diagnóstico
No exame clínico é necessário avaliar os parâmetros fisiológicos, como frequência cardíaca, frequência respiratória, temperatura, avaliar as mucosas e linfonodos, observar o escore corporal e expressões faciais, o grau de desidratação (turgor cutâneo) e o tempo de preenchimento capilar (TPC). No exame específico é importante observar a região abdominal e perianal, e em seguida advir com a palpação local (Feitosa, 2014).
Especificamente para auxiliar no diagnóstico de corpos estranhos, é importante realizar o exame físico completo, pois inicia-se pela inspeção da cavidade oral, onde se avalia a língua para visualização de algum objeto ancorado naquela região. É crucial também realizar a palpação abdominal, é uma possível forma de encontrar o objeto, porém apenas consta como diagnóstico presuntivo (Hayes, 2009).
O clínico deve solicitar exames de triagem como hemograma, bioquímicas e eletrólitos, pois nos casos mais graves em que há obstrução, a hipopotassemia e a hipocloremia podem estar presentes. Além disso solicita-se exames radiográficos, que podem detectar objetos radiopacos, melhor visualizados em imagens contrastadas, em que se pode visualizar o pregueamento do intestino delgado (plicatura), observando o encurtamento ou dobras intestinais, com aumento intraluminal de bolhas gasosas e sinais de peritonite (Figura 2) (Felts et al., 1984).
Figura 2 – 2A) Raio-X simples de um cão. 2B) RX contrastado. 2C) Laparotomia exploratória foi possível encontrar o corpo estranho. 2D) Caroço de manga retirado da porção final do jejuno.
Fonte: Adaptado de CABRAL, et al., 2018.
No exame ultrassonográfico (USG), o corpo estranho pode ser visto de acordo com o tipo de material, efeito de sombra acústica e a hiperecogenicidade. O diagnóstico mais preciso, é a colonoscopia em, que além de confirmar a presença do corpo estranho, viabiliza a sua remoção na maioria das vezes, contribuindo tanto para o diagnóstico como para a terapêutica. Todavia, pode haver impossibilidade de remoção a depender do corpo estranho, principalmente se for linear, pois pode causar laceração e piora do quadro clínico (Santos; Auler, 2015).
C- Tratamento
Geralmente, o tratamento é prescrito conforme a sua causa de base, se primária ou secundária. Porém, segundo Feitosa (2014), João (2015) e Spinosa et al. (2006) este baseia-se na terapêutica do trato gastrointestinal geral e nas manifestações dos sinais clínicos, que podem ser divididas em quatro tipos de terapia:
✓ Terapias de suporte: consiste na correção do desequilíbrio hídrico e eletrolítico, juntamente com repouso do Trato Gastrointestinal (TGI);
✓ Terapia sintomática: a exemplo dos antieméticos, antidiarreicos, antifiséticos, prócinéticos, catárticos, hepatoprotetores, etc.;
✓ Terapia específica: antibióticos, anti-inflamatórios, imunossupressores, antiácidos etc.;
✓ Terapia dietética: é recomendável fornecer alimentos leves, com baixo teor de gordura e dietas hipoalergênicas.
Especificamente, os corpos estranhos são considerados emergências cirúrgicas, pela probabilidade de causarem rupturas intestinais (Brentano, 2010). Em casos de objetos pequenos, podem adentrar o TGI sem causar lesões importantes, no entanto a grande parcela de casos necessita de remoção cirúrgica através da laparotomia exploratória ou endoscopia. Em episódios em que há hipopotassemia e hipocloremia a terapia de suporte deve ser feita para correção desses desequilíbrios. O prognóstico geralmente é bom, se não houver casos de perfuração gastroentérica e peritonite secundária (Santos; Auler, 2015).
Intussuscepção
Intussuscepção ocorre quando há invaginação de uma parte da alça intestinal (intussuscepto) no lúmen (intussuscipiente) no seguimento seguinte a essa invaginação. Resulta na redução do lúmen intestinal causando obstrução parcial ou total, mais comumente encontrada na junção ileocólica e associado a essa enfermidade, uma torção de alça pode estar presente em alguns casos. Vale ressaltar, que tal distúrbio se não for diagnosticado 19 corretamente pode levar a morte do animal (Lappin, 2010; Silva, 2015; Jennes, 2020).
Sabemos que os gatos diferem dos cães, tanto na sua anatomia, fisiologia e comportamento, portanto há distinções na apresentação clínica de várias doenças. Essas diferenças podem estar presentes na intussuscepção intestinal, no entanto há poucos relatos que comparem as intussuscepções felinas com as caninas (Patsikas et al., 2003).
Segundo Nelson (2015), a fisiopatologia não está completamente elucidada, entretanto uma enterite ativa parece estar associada a intussuscepção, que altera a motilidade intestinal de forma que o íleo que possui um diâmetro menor, pode a se intussuceptar no cólon que possui maior diâmetro. Ainda segundo este autor, o animal que possui corpos estranhos, agentes parasitários, neoplasia intestinal e/ou passou por uma cirurgia intestinal prévia, poderá cursar concomitantemente a uma intussuscepção.
Desde 1998, Carlton e Mcgavin descreviam a ocorrência da intussuscepção, em que os movimentos intestinais precisam estar aumentados e o intussuscepto devia apresentar uma lesão que auxiliaria de ponto de fixação. Exemplo disso ocorrem em animais jovens, com as placas de Peyer aumentadas, em consequências de distúrbios inflamatórios, onde a falta de homogeneidade e o aumento do peristaltismo excessivo causam uma dobra na parede intestinal, dando início a esta patologia (Figura 3) (Applewhitte; Cornel; Selcer, 2002).
Figura 3 – Representação esquemática da intussuscepção. (A) área focal com falta de homogeneidade; (B) contração da parede intestinal criando uma torção; (C) Força causou uma completa invaginação; (D) força propagada completando a formação da intussuscepção.
Fonte: Applewhitte; Cornel; Selcer, 2002.
A intussuscepção ileocólica aguda, causa obstrução e congestão intestinal. A diarreia sanguinolenta, quadros de vômitos, sensibilidade à palpação abdominal e uma massa palpável são alterações clínicas comuns. Cita-se como sinais clínicos mais relevantes a anorexia (83%) e massa abdominal palpável (92%), enquanto que vômitos e diarréia foram observados em 54% dos casos (Barros; Matera, 2009).
No entanto, as intussuscepções ileocólicas crônicas geralmente se manifestam com uma proporção menor de vômitos, dor abdominal e hematoquezia. Esses animais possuem uma diarreia intratável, e consequentemente uma hipoalbuminemia. Geralmente esses animais com o quadro crônico apresentam uma perda de peso progressiva (Nelson, 2015).
Outro aspecto relevante sobre o quadro clínico, é que a intussuscepção jejuno-jejunal de forma aguda frequentemente não causa hematoquezia, porém a congestão da mucosa pode ser mais severa do que a observada na intussuscepção ileocólica. Ocasionalmente ocorre disfunção intestinal e assim as bactérias juntamente com as toxinas acessam a cavidade peritoneal, resultando no agravamento do quadro clínico (Nelson, 2015).
A- Epidemiologia
As intussuscepções são afecções mais comuns em cães do que em gatos, e geralmente acometem caninos com menos de um ano de idade podendo ocorrer em qualquer segmento do TGI, mas a maioria é encontrada na junção ileocólica (Applewhite et al., 2002; Graham et al., 2020).
Podem ocorrer em animais com insuficiência renal aguda, neoplasias, cirurgia intestinal prévia entre outros. As intussuscepções não possuem uma predisposição quanto ao sexo e raça, apesar de relatos de predisposição em Labrador, Golden Retriever, Pastor Alemão e com maior incidência na raça Pastor Alemão (Jennes, 2020).
A predisposição para intussuscepções intestinais em felinos é pouco conhecida e a sua incidência é rara. É mais frequente em animais mais velhos associada a neoplasia intestinal subjacente, diferente dos cães que são mais propensos a desenvolverem processos inflamatórios associados (Levien; Baines, 2011). Autores relatam que a maioria dos gatos acometidos eram da raça Shorthair (gatos de pelo curto inglês), Siamês e Burmese (Andrade et al., 2019).
Em suma, quando se refere a cães jovens, deve-se suspeitar de parasitismo, corpos estranhos ou enterite como causa da intussuscepção, visto que estes possuem alta incidência de parasitas no intestino, o que gera um aumento dos movimentos peristálticos e consequentemente a invaginação dos seguimentos intestinais. Em casos de animais adultos a idosos, sugere como causa a neoplasia intestinal (Patsikas et al., 2019).
B- Diagnóstico
Para o diagnóstico da intussuscepção intestinal é imprescindível realizar a palpação abdominal no exame físico, com a qual é possível sentir uma massa tubular em forma de “salsicha” (Jannes, 2020). Todavia, permite apenas um diagnóstico presuntivo, mimetizando outras doenças, devendo ser diferenciadas de fezes e corpos estranhos (Patsikas et al., 2003).
A radiografia simples raramente permite o diagnóstico, pois é inviável a visualização, principalmente nos casos de obstruções parciais, no qual a produção do acúmulo de gás intestinal não é o suficiente para formar uma radiografia conclusiva, perdendo a sensibilidade do diagnóstico (Patsikas et al., 2003).
O exame radiográfico contrastado, pode revelar o defeito de preenchimento do cólon. Com o íleo intussusceptado, o material é visto como uma fita dentro do lúmen do intussuscepto. Se caso a obstrução for total a intussuscepção nos mostra como uma falha de preenchimento na coluna de contraste (Jennes, 2020).
A USG é considerada o método mais preciso para o diagnóstico das intussuscepções intestinais, visto que, no plano transversal é visível aglomerados de camadas, de forma circular, ou em várias camadas no padrão longitudinal (Figura 4) (Jennes, 2020).
Figura 4 – Imagem ultrassonográfica de intussuscepção em plano transversal de um cão. A seta mostra o intestino intussusceptado.
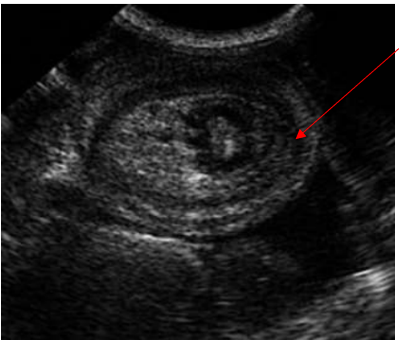
Fonte: Adaptado de Rabelo, 2012.
O doppler colorido é um grande aliado, pois permite avaliar o fluxo sanguíneo, o qual quando dentro da intussuscepção indica a ausência de colapso vascular no intestino intussusceptado (Jennes, 2020). Vale ressaltar a importância das associações de outras doenças, pois a intussuscepção pode estar integrada a corpos estranhos, linfomas e formações tumorais, principalmente em cães idosos. Qualquer alteração do espessamento da parede intestinal (inflamação, edema, corpos estranhos, neoplasia etc.) pode mimetizar a intussuscepção na USG (Patsikas et al., 2019).
Por isso algumas características úteis, auxiliam na diferenciação da intussuscepção de outras patologias, como conformação alvo com largura total ou superior a 18mm em cães, consistindo em vários anéis concêntricos; integridade dos anéis periféricos da estrutura do 23 anéis concêntricos; avaliar mais de um plano de imagem; um centro hiperecoico semilunar ou em forma de G da configuração do alvo (Patsikas et al., 2019).
Ademais, os exames laboratoriais como hemograma e as provas bioquímicas que incluem ALB, ALT, FAL, URE CRE, PT, são essenciais para complementar o diagnóstico e descartar outras suspeitas que também podem estar concomitantes, como as doenças metabólicas, e assim permitir o direcionamento de uma terapia pré-operatória. No leucograma, pode haver uma leucocitose com desvio à esquerda, e no perfil bioquímico, cursar com aumento da fosfatase alcalina sérica sugestivos de condição inflamatória ou estresse do animal. Também pode haver hipocalemia e alcalose metabólica devido a êmese recorrente, e como a mucosa intestinal está congesta, pode haver hipoalbuminemina por perda de proteínas (Fossum, 2014).
C- Tratamento
As intussuscepções devem ser tratadas cirurgicamente. Embora tenha sido retratada a redução espontânea, na prática o tratamento cirúrgico juntamente com a redução (em casos agudos) e ressecção (em casos crônicos), traz o melhor direcionamento operatório. Para que não ocorra recidivas recomenda-se a enteropexia ou enteroplicatura (Figura 5) (Larose et al., 2020).
Figura 5 – realização da enteroplicação o intestino delgado é colocado lado a lado desde o ligamento duodenocólico a junção ileocólica, suturados com ponto interrompido simples para formar uma série de voltas suaves.
Fonte: Patsikas et al., 2019.
Hipersensibilidade alimentar
Os distúrbios alimentares podem ser de origem imunológica com base na sensibilidade alimentar ou com base na intolerância à dieta sem comprometimento imunomediado. Tornou Se comum fornecer comida caseira, petiscos e guloseimas aos animais, o que pode predispor a um quadro de intolerância a exemplo da lactose ou hipersensibilidade alimentar, esta última caracterizada por uma desordem cutânea decorrente da ingestão de componentes ou aditivos antigênicos na dieta, ou seja, partindo desse pressuposto o intestino está imunologicamente ligado a pele (Nascente et al., 2006; Aléssio et al., 2017).
Os aditivos antigênicos são glicoproteínas hidrossolúveis, de peso molecular entre 10 kD e 60 kD e estáveis em pH baixo. O modo de preparo dos alimentos pode afetar a alergenicidade de certas proteínas. Por isso, alguns animais podem ter hipersensibilidade a uma proteína da ração, mas não serem alérgicos à mesma proteína in natura e vice-versa (Silva, 2015).
A hipersensibilidade alimentar pode ser classificada como um distúrbio da mucosa intestinal, caracterizada em má absorção, que acomete o intestino delgado, provocando diarréias, afetando o trato gastrintestinal e a pele. Doenças inflamatórias intestinais, como a enterite linfocítica-plasmocítica e a enterite eosinofílica, muitas vezes são responsivas apenas à alteração da dieta, e acredita-se que antígenos dietéticos sejam uma parte importante na etiopatogenia dessas doenças (Silva, 2015).
O processo fisiopatológico, ocorre basicamente com a resposta do sistema imunológico, mediante as hipersensibilidades do tipo II, III e IV. A hipersensibilidade do tipo II, promove a formação de imunocomplexos (antígeno/anticorpo – Ag-Ac), que resultam da fase tardia na degranulação de células IgE mediadas. Estes podem se acumular na lâmina própria intestinal e produzir reação de hipersensibilidade local, causando então sinais gastrointestinais e respostas intestinais agudas ao alimento. A hipersensibilidade tipo III e IV, são caracterizadas como hipersensibilidade alimentar retardada, pouco conhecida. A tipo III promove a formação de complexos Ag-Ac e a do tipo IV é causada pela hipersensibilidade mediada por células, ambas irão provocar doença inflamatória intestinal, colite e síndrome de má absorção (Silva, 2015).
Os sinais clínicos são manifestados pela liberação de citocinas, especificamente a IL-4 e IL-13, fazendo com que haja uma estimulação de células secretoras de muco, e consequentemente o surgimento de alterações gastrointestinais. Há também liberação de 25 prostaglandinas e leucotrienos, que irão promover aumento da contração da musculatura lisa intestinal; aumento do peristaltismo e diminuição da reabsorção de água no intestino grosso (IG). Dessa maneira, inicia-se as manifestações clínicas, diarreia aquosa, cólica abdominal, flatulência e podendo também está presente o vômito (Mandigers; German, 2010).
A- Epidemiologia
Nos distúrbios alimentares, Gehres (2019), afirma que os animais mais predispostos são os que apresentam excesso de peso, e os fatores que podem predispor a essa condição física e metabólica são raças, idade, fatores genéticos, fatores hormonais, atividade física, ansiedade, estresse, depressão e densidade genética da dieta. Os distúrbios são mais observados em cães de meia idade a geriátricos, com idade entre cinco a dez anos e as principais raças de cães predispostas são de estatura pequena a média.
Apesar de que a maioria dos estudiosos não concordarem com predisposição racial evidente, algumas raças específicas aparecem com maior frequência, como, Cocker spaniel, Poodle, Sharpei, Akita, Golden Retriever, Pastor alemão entre outras (Harvey; Hall, 2009; Nascente et al., 2006).
B- Diagnóstico
O diagnóstico definitivo de hipersensibilidade alimentar baseia-se na análise detalhada sobre a alimentação do paciente e não obstante o fornecimento provocativo, em que o animal é exposto a alimentos selecionados e adicionados à dieta hipoalergênica. Se ocorrer recidiva dos sintomas durante sua administração, tal alimento é reconhecido como um possível alergênico (Mandigers; German, 2010).
A dieta hipoalergênica deve ser seguida durante 6 a 8 semanas, sem administração de imunossupressores e caso ocorra a remissão do quadro clínico nesse período, deve-se suspeitar de hipersensibilidade alimentar (Silva, 2015).
Além da eliminação de outras causas, que tem como diagnósticos diferenciais as dermatopatias de etiologia alérgica, e pode ser difícil de diferenciar da DII, o que torna mais complexo para o clínico (Mandigers; German, 2010).
C- Tratamento
Quando há uma melhora clínica e remoção parcial ou total do antígeno, é necessário que haja o fornecimento de dietas comerciais contendo proteínas hidrolisadas e outros componentes oligoantigênicos. Proteínas hidrolisadas nada mais são que a redução da sua partícula, fazendo com que o mastócito não sofra degranulação, e não havendo esta, será inibida a quimiotaxia e consequentemente a inflamação (Mandigers; German, 2010; Silva, 2015).
Caso haja a impossibilidade do fornecimento de dietas hipoalergênicas, o clínico deve optar pela dieta de eliminação, no qual consiste em dietas contendo carboidratos e proteína. A fonte de proteína deverá ser “inovadora’’, ou seja, sem que o animal a tenha ingerido antes. A fonte de carboidratos segue o mesmo padrão. O tratamento é baseado nas duas dietas mencionadas acima (Mandigers; German, 2010).
DOENÇAS IDIOPÁTICA, IMUNOLÓGICA, CONGÊNITA OU ADQUIRIDA
Doença Inflamatória Intestinal Idiopática
É uma doença inflamatória idiopática, caracterizada por disfunções gastrointestinais crônicas, e pelo infiltrado de células inflamatórias, podendo afetar conjuntamente estômago, intestino delgado e grosso ou apresentar-se isoladamente (João, 2015).
A doença inflamatória intestinal é classificada de acordo com a região afetada, com o tipo de célula inflamatória e pelas alterações morfológicas do tecido. A enterite linfocítica-plasmocítica é a forma mais comum, seguida da enterite eosinofílica e da enterite granulomatosa (Bastan et al., 2017; Melo et al., 2018). A enterite linfoplasmocítica foi diagnosticada pela primeira vez em 1972 por Van Kruiningen e Hayden como uma causa idiopática de diarreia no cão (Figura 6) (Münster, 1995).
Figura 6 – Infiltrado celular linfoplasmocítico em duodeno de um cão. A) Corte histopatológico de região duodenal (x40). Biopsia adquirida por endoscopia digestiva; B) Aumento do corte obtido em A (x100). As setas indicam presença de infiltrado inflamatório linfoplasmocitário.
Fonte: Gôuvea et al., 2020
De acordo com Júnior e Pimenta (2015), a enterite eosinofílica parece ser mais grave do que a enterite linfoplasmocítica, e são constatadas duas formas de apresentação, a isolada no intestino ou distribuída em vários órgãos, que inclui o fígado baço e TGI, caracterizada por síndrome hipereosinofílica (Figura 7).
Figura 7 – Duodeno de um cão. Hematoxilina e Eosina, aumento de 20x: Infiltrado inflamatório intenso, predominantemente eosinofílico, nas camadas mucosa e submucosa.
Fonte: Trindade et al., 2021.
Como mencionado, a DII, não possui uma etiologia definida, entretanto, acredita -se que a sua causa é de caráter multifatorial, e que seja uma doença de cunho genético imunomediada, além de uma possível perda da tolerância imunológica em resposta a antígenos dietéticos ou microbianos intraluminais. A inflamação crônica no intestino delgado causa alterações na arquitetura da mucosa intestinal desencadeando síndrome de má absorção. Os sinais clínicos da DII tanto em cães como em gatos, são recorrentes do TGI, como vômitos, diarreia e perda de peso, que pode ser avaliada através do escore de cada manifestação clínica (Figura 8) (Jericó et al., 2015).
Figura 8 – Escore para avaliação das Doenças inflamatórias intestinais em cães.
Fonte: Silva, 2015.
As manifestações clínicas em felinos não diferem muito no que se refere aos cães. No entanto, quando um gato apresenta quadros de diarreia, não responsivo a terapias antiparasitárias, antimicrobianas e as dietas hipoalergênicas, deve-se suspeitar de DIIF, em que o animal pode estar nos estágios mais avançados da doença. Com efeito, também deve-se descartar outras afecções, principalmente as metabólicas (Júnior; Pimenta, 2015).
A- Epidemiologia
Na doença inflamatória intestinal não há predisposição sexual, ocorrendo mais em animais de meia idade a idosos e em algumas raças caninas, como o Yorkshire, Bulldog Francês, Pastor Alemão, Sharpei e Rottweilers, que parecem ser mais predispostas (Gouvêa et al., 2020; Silva, 2015). Na espécie felina também acomete animais de meia idade, porém não há relatos relevantes com relação à predisposição racial (Moretti et al., 2020).
Segundo Littler et al., (2006), raças de pastores alemães possuem uma maior suscetibilidade à enteropatia crônica, caracterizada por inflamação linfocítico-plasmocítica e também por apresentarem uma deficiência na produção de IgA, respostas a antibióticos, dieta ou imunossupressão. Estudos relatam que a mucosa da DII canina e felina representa numerados conjuntos de células pré e pró-inflamatórias, incluindo plasmócitos de lâmina própria IgA+, IgG+, CD3+, CD4+, macrófagos e neutrófilos são aumentados, enquanto que mastócitos está diminuído na DII canina (Jergens; Simpson, 2012).
B- Diagnóstico
O diagnóstico da DII, baseia-se na exclusão de outras causas de diarreia, incluindo hipersensibilidade alimentar e na avaliação anatomopatológicas de biopsias do TI, sendo do intestino delgado o diagnóstico definitivo. Em gatos o diagnóstico da doença inflamatória intestinal felina (DIIF) deverá ser feito por exclusão de outras enteropatias e/ou quadros de hipertireoidismo, parasitismo intestinal, intolerância alimentar e linfoma (Figura 9), visto que um infiltrado linfocítico-plasmocítico pode ser encontrado nestes diagnósticos diferenciais e até em pacientes sem sinais clínicos do TGI (Melo et al.,2018).
Figura 9 – Representação esquemática dos preditores diagnósticos doença inflamatória intestinal felina (DIIF).
Fonte: Júnior; Pimenta, 2015.
A análise histopatológica do trato intestinal e o perfil bioquímico, como ALB, ALT, FAL, URE, CRE e PT são de extrema importância para auxiliar no monitoramento do paciente em tratamento, assim como permite avaliar a repercussão sistêmica do processo inflamatório ou o acometimento de outros órgãos, como o pâncreas e fígado, sendo relativamente corriqueiro o envolvimento destes (Simpson; Jergens, 2011).
C- Tratamento
Geralmente o tratamento de primeira escolha são os imunossupressores, associado a dieta hipoalergênica e ao uso de pré-bióticos e probióticos. O corticoide de escolha é a prednisolona, na dose de 1 a 2mg/kg, SID/ durante 2 a 4 semanas. Para felinos que apresentam uma baixa resposta à prednisolona, outra alternativa seria o acetado de metilprednisolona, 20mg/gato, por via SC ou IM, a cada 2 semanas por 6 ciclos, após fornecer mensalmente até o desaparecimento do quadro. E em cães o uso da budesonida também é indicado. Em seguida deve-se submeter ao desmame, até a total retirada ou promover a menor dose até a supressão dos sinais clínicos (Malewska et al., 2011, Jergens, 2010).
A azatioprina funciona como tratamento associado ou não a corticoideoterapia, para aqueles pacientes refratários a corticoides. O seu principal efeito cursa com a mielosupressão grave, que quando descontinuada é reversível. Dessa forma, o ideal seria realizar o monitoramento através da avaliação hematológica, a cada sete dias nos primeiros dois meses, e então mensalmente para pacientes que fazem uso do medicamento. A azatioprina deve ser utilizada na dose de 2mg/kg, via oral (VO), SID, durante 30 dias, posteriormente a dose deve ser reduzida para 1 mg/kg (Gouvêa et al., 2020, Malewska et al., 2011).
A ciclosporina deve ser utilizada para aqueles pacientes refratários ao uso de corticoides e indicados para casos graves de enterite linfocítica-plasmocítica. Por ser um imunossupressor potente é um medicamento pouco utilizado nas DII, fornecido na dose de 5 a 10 mg/kg, SID. Para o tratamento da DIIF, também é recomendado o uso do metronidazol, na dose de 10-20mg, BID, durante dois meses. O mesmo possui efeitos imunomoduladores e anti-inflamatórios, contra bactérias anaeróbicas e protozoários (Gouvêa et al., 2020).
Linfangiectasia Intestinal
Linfangiectasia intestinal (LI) é relatada como uma dilatação acentuada dos vasos linfáticos intestinais da mucosa e submucosa intestinal. Caracteriza-se como a mais comum das enteropatias associadas à má absorção e perda de proteína, de desordem congênita ou adquirida, mais comum em cães e relativamente raro em gatos (Howard, 2013).
A forma congênita ou primária apresenta-se como malformação dos vasos linfáticos, enquanto na forma adquirida, predomina a dilatação dos vasos linfáticos decorrente da obstrução da drenagem linfática, causada por alterações da mucosa e submucosa intestinal, por doenças inflamatórias ou infiltrativas ou obstrução dos vasos linfáticos por lipogranulomas. Como consequência, a obstrução do fluxo linfático causa perda da linfa para o lúmen intestinal, que contém proteínas plasmáticas, linfócitos e lipídios e vitaminas lipossolúveis (Howard, 2013).
Os sinais clínicos mais frequentes são a diarreia crônica com fezes semi-sólidas ou aquosas, amareladas ou hematoquezia. Vômitos esporádicos, emagrecimento progressivo, letargia, anorexia, ascite e intolerância ao exercício também são observados (Teixeira, 2019 apud Barros, 2004). A inflamação e linfagite granulomatosa, são as principais alterações anatomopatológicas da doença. Os cães podem desenvolver ascite devido a diminuição da pressão oncótica do plasma e além da hipocalcemia, que provavelmente é decorrente da má absorção da vitamina D (Silva, 2015).
Relatórios que foram publicados até o momento, mostram que a enteropatia por perda de proteína (PLE) em cães está associada em cerca de 50% dos casos de linfangiectasia. A LI secundária resulta de bloqueio direto aos vasos linfáticos, por exemplo, neoplasia, ou um bloqueio indireto, associado à reação inflamatória densa e drenagem prejudicada.É relatado que LI existe em uma alta proporção de biópsias endoscópicas (53%) de cães com doença GI crônica, e nesta população de pacientes, houve uma associação significativa de LI com hipoalbuminemia (76%). Em estreita concordância, na biópsia de espessura total, (59%) dos cães com doença GI crônica mostraram ter linfangiectasia (Melanie et al., 2019).
A- Epidemiologia
Cães da raça Soft-coat Wheaton Terriers possuem uma forma hereditária de linfangiectasia, mais relatada em fêmeas de meia-idade. Yorkshire terrier é a raça mais comumente afetada, associada à enterite linfocítica-plasmocítica. Outras raças frequentemente acometidas são os Sharpei e Rottweilers, os quais apresentam maior predisposição a DII sendo a linfangiectasia consequência da DII grave (Littman et al., 2000; Peterson; Willard, 2003).
B- Diagnóstico
O diagnóstico baseia-se numa anamnese detalhada e na manifestação dos sinais clínicos, além de exames laboratoriais como hemograma e bioquímica. Cães com hipoproteinemia grave, hipercolesterolemia (que pode provocar complicações cardiovasculares severas) e linfopenia são suspeitos de linfangiectasia. Este último achado também pode ser encontrado em pacientes durante estresse crônico, dessa forma é importante avaliar o leucograma de estresse caracterizado por neutrofilia e eosinopenia, respectivamente (Rodríguez et al., 2012).
O diagnóstico também poderá ser feito por exclusão, já que pacientes podem ter perda de peso, precedendo com a diarreia. Nesses casos, a realização da urinálise para detecção de proteinúria é crucial para descartar síndrome nefrótica, outra causa de hipoproteinemia marcante. O diagnóstico definitivo é realizado através da avaliação histopatológica de biópsias intestinais, que podem ser obtidas por meio de cirurgia e endoscopia, ou pela necropsia (Lorenzi, 2011; Jericó et al., 2015).
C- Tratamento
Depende da causa de base, pois o paciente que apresenta a linfangiectasia decorrente de DII grave e neoplasias, devem ser tratados para sua doença primária. Cães que desenvolvem linfangiectasia em decorrência de lipogranulomas, sem inflamação concomitante, devem receber dieta restrita em gordura. Recomenda-se o oferecimento de dietas comerciais, tais como, Royal Canin® Gastro Intestinal Low Fat Canine e Hills® Canine Prescription Diet I/D Low Fat, os quais têm uma resposta positiva no tratamento de linfangiectasia em alguns cães (Rodríguez et al., 2012; Melanine et al., 2018).
Para aqueles pacientes que apresentam hipoalbuminemia, o uso de colóides é indicado, entretanto deve-se atentar-se às possíveis reações alérgicas e aos danos renais. O mais utilizado é o plasma fresco, tanto para pacientes normovolêmicos quanto para crise hipovolêmica, ademais ambos são ministrados em doses distintas (Fossum, 2014).
Constipação Intestinal
Outro distúrbio intestinal, que pode ser resultante de fratura pélvica, estenose, neoplasia de intestino grosso, corpo estranho, hiperplasia prostática grave, disfunção congênita ou adquirida, tem como consequência a constipação intestinal por fecaloma, caracterizada por fezes ressecadas e retidas no interior do intestino grosso (Fossum, 2014; Howard, 2013; Jericó et al., 2015; Winter et al., 2006). A constipação intestinal é um distúrbio intestinal, caracterizado por defecação infrequente e fezes excessivas firmes e ressecadas, e dependendo do tempo em que essas fezes ficam retidas, o animal pode desenvolver um fecaloma. Este último é uma massa extremamente firme de fezes acumuladas no intestino grosso, simulando um tumor, por isso a terminação “-oma” (Silva, 2015).
Pode ser desencadeada por diversos fatores e muitas vezes mais de uma causa associada está presente em um paciente. Muitos desses casos estão relacionados ao tenesmo e disquezia, fazendo com que o animal evite a defecação. Fatores ambientais ou de manejo também podem fazer com que o animal evite a evacuação. Um exemplo comum de casos que chegam na clínica, são felinos em que os tutores se mudam ou mudam algum objeto da casa e o animal começa a apresentar sinais clínicos que perpetuam o estresse, além dos mesmos serem mais resistentes ao ingerir água, de forma que podem desencadear outras afecções relacionadas principalmente ao trato urinário inferior (Fossum, 2014).
Os sinais clínicos mais evidentes são tenesmo e disquezia, observados durante tentativas inválidas de defecação (Figura 10). Os animais e principalmente os felinos, podem ter quadros de vômitos durante essas tentativas e sofrer hematoquezia, em decorrência da lesão da mucosa intestinal, pelas fezes excessivamente ressecadas. O ato de defecar em locais inapropriados são as queixas mais comuns e com menor frequência, tais pacientes podem desenvolver prolapso retal (Silva, 2015). Outros sinais da constipação intestinal variam de acordo com a cronicidade, podendo incluir anorexia, emagrecimento, letargia, distensão abdominal, desidratação, má condição corporal e até mesmo em situações mais agravantes, o megacólon (Silva, 2015).
Figura 10 – Felino constipado, adotando posição de defecação.
Fonte: Silva, 2015.
A- Epidemiologia
O fecaloma é comumente diagnosticado em animais adultos e senis entre cinco e nove anos de idade. Com alta incidência em felinos por razões comportamentais instintivas, pois quando não se encontra nas condições adequadas, incluindo limpeza da água e temperatura agradável, estes animais diminuem a ingestão hídrica. Além de reprimir a evacuação, quando encontram o local sujo, contendo fezes antigas; e ainda pela ingestão de pelos, que quando em excesso, podem alojar-se ao bolo fecal e levar a formação de impactações fecais (Freiche, 2011).
Segundo Silva (2015), muitos dos animais com megacólon são atendidos com fecaloma. O megacólon é uma condição de cólon afuncional e acomete principalmente, felinos e cães Pastores Alemães. Estudos relatam que o megacólon idiopático felino seja decorrente de um distúrbio da musculatura lisa intestinal e pode ser observado em gatos sem distinção de idade raça ou sexo. Porém, a maioria são de meia idade e cerca de 70%, são machos.
B- Diagnóstico
O histórico associado com a grande quantidade de fezes ressecadas durante a palpação abdominal, levam ao diagnóstico de constipação intestinal. Entretanto, a constipação não é um diagnóstico final, devendo investigar a causa de base. Também deve-se realizar exame de períneo e toque retal, para identificar retoceles, tumores retais e outras etiologias. A realização de exames como radiografia da pelve, geralmente necessita da estabilização do paciente e o cólon completamente esvaziado, antes do exame de imagem (Silva, 2105).
C- Tratamento
De acordo com Silva (2015), pacientes que apresentam constipação de grau moderado a grave devem ser submetidos à remoção das fezes antes do tratamento domiciliar. Tal procedimento, pode ser feito através do enema de lactulose com água, na proporção de 1:1. Enemas fosfatados são contraindicados a felinos, pelo fato de causarem hiperfosfatemia, hipernatremia e hipocalcemia graves. Em casos mais críticos, é necessário realizar a lavagem do cólon. Entretanto, antes do procedimento, caso haja distúrbios hidroeletolíticos estes devem ser corrigidos e o paciente deverá ser submetido à anestesia geral inalatória ou leve sedação associada à anestesia epidural para remoção das fezes.
A lavagem deve ser feita com solução fisiológica morna para evitar hipotermia, além de que o uso da lactulose inviabiliza tal procedimento. Se houver o insucesso de tais tentativas, o clínico deve avaliar cautelosamente e encaminhar o animal para a cirurgia de colotomia. Ademais, também pode ser feito dietas ricas em fibras, como por exemplo Psyllium em pó, adquirido em farmácias de manipulação (Freiche et al., 2011).
O uso de laxantes osmóticos são alternativas para tratar a constipação a curto prazo. O mesmo estimula a inervação e a musculatura lisa do cólon, causando o aumento do peristaltismo e a quantidade de água nas fezes. O bisacodil é o fármaco mais utilizado, e são indicados para realizar a limpeza intestinal antes dos exames de colonoscopia (Silva, 2015).
ALTERAÇÕES METABÓLICAS E NEOPLÁSICAS
Os distúrbios inflamatórios intestinais também podem ser de origem secundária a alterações metabólicas, devido a hepatopatias e insuficiência pancreática exócrina (Siqueira, 2012). Além das doenças metabólicas, as neoplasias adenocarcinomas intestinais, linfoma gastrointestinal, tumor estromal gastrointestinal e leiomiossarcoma intestinal também podem cursar com este distúrbio (Gameiro, 2016; Howard, 2013).
Hepatopatias
Sabe-se que o fígado é um órgão essencial para a digestão, absorção, metabolismo e estoque de nutrientes, além de participar da detoxificação, catabolismo e excreção de muitas toxinas, hormônios e xenobióticos (Biourge, 2010). De acordo com a literatura, há uma comunicação metabólica entre fígado e o TGI, através do ciclo entero-hepático. Tal achado evidencia em um animal com hepatopatia, sinais como, vômito e diarreia. No entanto, nesses casos a diarreia é menos comum que o vômito (Rothuizen; Meyer, 2004; Johnson; Sherding, 2006).
A doença hepática é qualquer distúrbio que ocasione lesão de hepatócitos, colestases ou ambas, que ocorre na presença de intoxicação, inflamação, neoplasia, traumatismo e doenças metabólicas. A insuficiência hepática consiste na incapacidade da remoção de substâncias contidas no sangue, comumente excretadas pelo fígado. No entanto, a doença hepática nem sempre causa insuficiência hepática (Lassen, 2007).
Tanto nas doenças intra-hepáticas quanto extra-hepáticas, causadas por obstrução do ducto biliar, o ciclo entero-hepático normal dos ácidos biliares séricos (ABS) é interrompido, o que reduz a quantidade do conteúdo biliar, resultando numa menor absorção de gordura da dieta, levando a um material intestinal hiperosmótico. Quando há um aumento na resistência do fluxo sanguíneo portal, que resulta em hipertensão portal e congestão visceral, também contribui para congestão dos vasos intestinais, como consequência reduz a reabsorção de água no intestino e aumenta o volume do conteúdo intestinal (Rothuizen; Meyer, 2004).
Assim, quando há uma disfunção hepática de moderada a grave, em que há uma redução parcial da eliminação de toxinas, o intestino delgado que possui placa de peyer capaz para eliminar tais antígenos locais, não é por si só o mecanismo suficiente. Dessa maneira, as toxinas que não foram totalmente excretadas pelo fígado, retornam à circulação entero-hepática, podendo até causar uma disbiose intestinal, juntamente com inflamação local (fator de risco para ulceração gastroduodenal) e vice-versa. (Howard, 2013).
Animais com doença hepatobiliar crônica podem apresentar poliúria e polidipsia, apesar de serem sinais clínicos inespecíficos, em estados crônicos são frequentemente notados. As mucosas podem estar pálidas a ictéricas, quando há obstrução dos ductos biliares, como também fezes acólicas (resultam da total ausência de pigmento biliar no intestino). Em cães pode ocorrer disúria devido a produção de urólitos de amônia que se formaram pelos distúrbios causados na insuficiência hepática (Rothuizen; Meyer, 2004).
Em casos de insuficiência hepática, frequentemente não se desenvolvem os sinais clínicos, até que 70% a 80% ou mais da massa funcional do fígado seja comprometida (Johnson, 1988; Tennant, 1997; Rothuizen; Meyer, 2004; Lassen, 2007). Em episódios crônicos, os sinais clínicos podem simular uma doença hepática aguda, sendo os sinais mais persistentes a perda de peso e ascite (Johnson, 1988; Johnson, 1992; Johnson; Sherding, 1998).
A- Epidemiologia
Nos cães, as hepatopatias crônicas são mais comuns do que as agudas, podendo afetar cães de várias idades (Nelson, 2015). Em gatos a lipidose hepática, seguida de colangite e obstrução dos ductos biliares, são doenças hepáticas e extra-hepáticas mais comuns (Júnior; Pimenta, 2015). De acordo com a literatura, as raças de cães predispostas a desenvolverem doenças hepáticas são, Cocker spaniel, Yorkshire terrier, Doberman, Pinscher, Maltês, Labrador retriever, Dálmata e Poodle e em gatos, são, Persa, Siamês, Abissínios e Hima laios (Johnson, 2004; Teixeira et al., 2008).
B- Diagnóstico
O exame físico pode ser realizado com a palpação do fígado para mais do arco costal, se este estiver aumentado (hepatomegalia) (ROTHUIZEN; MEYER, 2004). Exames de sangue, imagens, citológicos ou biópsia. A alanina aminotransferase (ALT), aspartato aminotransferase (AST), fosfatase alcalina (FAL) e gama glutamil transpeptidase (GGT), podem ser biomarcadores de lesões hepatobiliares. A ALT indica o grau de lesão dos hepatócitos, em que na fase aguda há um aumento significativo da ALT, já na fase crônica, a quantidade é diminuída (Thawley, 2016).
No hemograma observa-se, anemia microcítica hipocrômica, sugestivo de perda crônica de sangue gastrointestinal. Numa lesão hepática, a leucocitose ou leucopenia podem estar presentes, decorrente da inflamação sistêmica ou sepse. A trombocitopenia é um achado clínico evidente, resultado da produção prejudicada à síntese hepática de trombopoietina (Allison et al., 2016).
Também é importante realizar a urinálise independente da causa da hepatopatia, pois é um exame de triagem que pode mostrar outros tipos de alterações. Enquanto, a bilirrubinúria é um achado comum em cães sadios, pois os mesmos são capazes de conjugar a bilirrubina dentro dos tubos renais; esta é sempre um achado patológico em gatos (Berente, 2015).
Conforme as evidências experimentais, a USG abdominal completa, é a modalidade de imagem com maior utilidade em pacientes com lesão hepática, pois permite avaliar a arquitetura geral do fígado, bem como avaliar comorbidades como a pancreatite ou ulceração gastrointestinal. Radiografias de abdome, podem evidenciar hepatomegalia, ou neoplasia subjacente, como teste de triagem para metástases (Thawley, 2016).
C- Tratamento
Segundo Thawley (2016), não há um tratamento definitivo para a maioria das causas de disfunção hepática aguda, e de acordo com o conhecimento do autor, o transplante de fígado ainda não está disponível na Medicina Veterinária. No entanto, esses animais necessitam de um monitoramento de suporte, sobre a fluidoterapia, sendo o mais recomendado o cloreto de sódio à 0,9%. O uso de colóides podem ser considerados para pacientes com hipoalbuminemia; porém esses fluidos devem ser utilizados com cautela em animais com riscos de coagulopatia ou lesão renal aguda (Silverstein; Santoro, 2015).
A ulceração gastroduodenal, que pode resultar em sangramento no TGI, é um fator de risco à doença hepática. Dessa maneira, o uso de antiácidos, como o inibidor da bomba de prótons (pantoprazol ou omeprazol, 0,5- 1 mg/ kg; SID via oral ou IV, em cães e gatos) e/ou uso de um protetor da mucosa gástrica (sucralfato, 0,5- 1g/ animal, TID ou BID, em cães e 250-500mg/ animal para gatos), são consideráveis. Antieméticos e antiácidos podem melhorar a tolerância do paciente, visto que muitos chegam com êmese (Tolbert; Bissett; Fitt, 2011).
Em pacientes com disfunção hepática, pode ocorrer deficiência de vitamina K, resultante de colestase intra-hepática ou extra-hepática, ou ao uso de antimicrobianos sistêmicos, que desregulam a flora intestinal, o qual sintetiza a vitamina K2. A deficiência de vitamina K causa disfunção da coagulação, pois a mesma é responsável pela funcionalidade dos fatores de coagulação II, VII, IX e X. Apesar de ser uma administração empírica, é recomendada na dose de 1mg/kg, SC; SID (Pereira et al., 2005).
O uso de hepatoprotetores foi avaliado na terapia de doenças hepáticas, embora haja informações limitadas. A administração de Silimarina (10-20mg/kg/dia, via oral, dividida a 39 cada 8 horas), pode auxiliar o “estresse’’ oxidativo hepático (Berente, 2015). Outro ponto importante a considerar, seria o tipo mais indicado de fornecimento de alimentos para esses pacientes, o qual quando tolerado, é a alimentação enteral, apesar de ser preferível à parenteral. Para aqueles pacientes que não toleram alimentação espontânea, a colocação da sonda esofágica é o mais indicado (Thawley, 2016).
Insuficiência pancreática exócrina
O pâncreas exócrino é responsável por sintetizar enzimas que auxiliam na digestão. O suco pancreático, composto por enzimas digestivas, é sintetizado nos ácinos pancreáticos e secretado em ductos. O ducto pancreático principal, em cães, desemboca na papila duodenal, juntamente com o ducto biliar (König, 2016).
Já nos gatos, o ducto pancreático faz uma espécie de anastomose com o ducto biliar, para então desembocar no duodeno. Essa especificidade anatômica dos gatos, facilita a entrada de substâncias indesejáveis e cerca de 20% dos gatos possuem um ducto pancreático acessório, com entrada separada para o duodeno (Figura 11) (Cerná et al., 2020).
Figura 11 – Representação esquemática da diferença anatômica do ducto biliar, pancreático de cães e gatos.
Fonte: Costa (2014), adaptado por Murakami, Reis e Scaramucci (2016).
As principais enzimas que formam o suco pancreático são a tripsina e a quimotripsina (enzimas proteolíticas), a lipase pancreática, a fosfolipase A, a amilase e o colesterol esterase. O pâncreas também libera bicarbonato para manter pH intestinal funcional (> 8) (König, 2016; Silva, 2015).
A insuficiência pancreática exócrina (IPE) é um distúrbio caracterizado pela secreção inadequada de enzimas pancreáticas no duodeno. Em cães, a principal etiologia de IPE, é atrofia acinar, como causa da destruição imunomediada do pâncreas exócrino. A atrofia acinar pancreática é o estágio crônico de uma pancreatite linfocítica, ou seja, a doença é consequência da destruição imunológica do pâncreas exócrino. Outras causas pouco comuns de IPE, são a pancreatite crônica terminal e a obstrução de ducto pancreático, além de uma possível deficiência da produção de lipase pancreática. A IPE, decorrente de pancreatite crônica terminal, possivelmente cursa como a principal causa de IPE em felinos (Silva, 2015; Xenoulis et al., 2016).
Como a IPE altera a produção de enzimas e bicarbonato, o intestino delgado sofrerá uma diminuição do ph, o que promove uma disbiose intestinal e inflamação local, a disbiose não sessa com a suplementação enzimática (Simpson; Jergens, 2011).
Em gatos, a IPE pode estar associada a tríade felina, pois como mencionado anteriormente, os felinos possuem um tipo de conexão direta com o ducto pancreático e biliar o que predispõe a uma colangite, conlangiohepatite, pancreatite e DII (Cerná et al., 2020) Estudos relatam que os animais acometidos com IPE têm diarreia pastosa, volumosa e de cor amarela. Cães que recebem dieta caseira, podem eliminar alimentos não digeridos nas fezes que são identificáveis macroscopicamente (Figura 12). Os animais também apresentam aumento da frequência de defecação, associados ao emagrecimento, polifagia, parorexia ou coprofagia e borborigmos (Silva, 2016).
Figura 12 – Fezes pastosas e coloração amarelada (A) e com conteúdo alimentar não digerido (B) de cão com insuficiência pancreática exócrina.
Fonte: Jericó et. al., 2015.
A- Epidemiologia
Raças como Pastor alemão, Collie pelo longo, Chow-Chow, Cavalier King Charles Spaniel e Dachushund são predispostas. É importante destacar que a doença tem caráter hereditário, porém o modo de transmissão genética não foi elucidado. A atrofia acinar pancreática habitualmente acomete cães adultos a jovens, entre dois e cinco anos (Leal, 2018).
Em felinos não há descrição em relação a predisposição racial para IPE, tendo sido relatada mais em gatos idosos (Steiner, 2012), porém podendo se manifestar dos três meses até aos 19 anos de idade (Xenoulis et al., 2016).
B- Diagnóstico
Exames laboratoriais como hemograma e bioquímicas, na IPE não apresentam alterações, visto que a anemia ou leucocitose e os valores de proteínas totais e albumina séricas geralmente estão sobre os valores de referências normais. Entretanto, o achado mais comum é a redução dos valores de triglicerídeos e colesterol, que eventualmente estão abaixo do valor de referência (Silva, 2015).
Silva (2015), também relata que a dosagem sérica de amilase ou lipase não serve para o diagnóstico da IPE, com base nisso, cães submetidos à pancreatectomia total, têm valores dessas enzimas dentro dos valores de referência, pois há uma produção extrapancreática delas.
O diagnóstico definitivo da IPE é feito por meio da dosagem da imunorreatividade sérica da tripsina e do tripsinogênio, do inglês (TLI, serum trypsin-like immunorreactivity), com jejum prévio de 12 horas. Os valores normais da TLI é >5,2μg/ℓ e abaixo de 2,5 μg/ ℓ em cães e menor que 8 μg/ ℓ em gatos confirmam o diagnóstico de IPE. Valores entre 2,6 e 5,1 μg/ ℓ são sugestivos de destruição parcial do pâncreas exócrino, e nesses casos normalmente o animal ainda é assintomático. O TLI possui alta especificidade e sensibilidade, portanto se o animal estiver recebendo suplementação com enzimas pancreáticas, não ocorrerá interferência no resultado do teste (Törner et al., 2021; João, 2015).
Vale ressaltar que animais com doença pancreática crônica, com o desenvolvimento da IPE, podem atingir o pâncreas endócrino e perder a função endócrina e nesses casos o ideal seria dosar a glicose, assim como realizar a urinálise. Se houver hiperglicemia com glicosúria respectivamente, deve-se suspeitar de diabetes mellitus secundária à pancreatite crônica ou hipoplasia pancreática (Simpson; Jergens, 2011)
C- Tratamento
Após a confirmação de IPE, o tratamento consiste em minimizar os sinais clínicos e compensar as deficiências nutricionais do animal. Como principal terapia, indica-se a reposição enzimática que constitui na suplementação de pancreatina em pó (pâncreas suíno dessecado e triturado), que deve ser misturada à dieta, com dose variando em função do peso do animal, devendo ser ajustada de acordo com a resposta do tratamento. Cães geralmente iniciam com 10 gramas para cada 20 kg, e caso não obtiver sucesso na terapia, recomenda-se fornecer 30 minutos antes da pancreatina, fármaco antagonista de H2 como a Famotidina, na dose de 0,5-0,1mg/kg, VO, BID (Pacheco; Salzo, 2019).
O manejo dietético também faz parte do sucesso da terapia de animais com IPE. Anteriormente era indicada dietas com alta digestibilidade e baixo teor de gordura. Porém, estudos realizados com cães mostraram que quando alimentados com teor de gordura maior na alimentação, os mesmos apresentaram menos esteatorreia. Portanto, as dietas hidrolisadas e de alta digestibilidade juntamente com dietas contendo triglicerídeos de cadeia média que são digeridas por lipases gástricas, são as mais indicadas (Pacheco; Salzo, 2019).
Ressalta-se que o suco pancreático também contém propriedades antibacteria nas, e a sua ausência induz ao supercrescimento bacteriano intestinal, sendo assim indicado a antibioticoterapia com metronidazol 15 mg/kg, VO, BID (Chrivellenti et al., 2015).
Neoplasias intestinais
Os tumores intestinais fazem parte dos distúrbios intestinais que podem surgir do estroma intestinal, células redondas, células enteroendócrinas e/ou células epiteliais das criptas intestinais, podendo afetar intestino delgado ou grosso. No entanto, nos cães e gatos os tumores são poucos comuns em relação às outras localizações do trato gastrointestinal quando comparadas às neoplasias colorretais, e são mais prevalentes em animais de meia idade (sete anos ou mais), em ambas as espécies felinas e caninas (Gameiro, 2016; Leandro; Sá, 2015).
Em cães os tumores mais comumente relatados são, adenocarcinoma (tumor maligno com origem de células glandulares epiteliais); linfoma (caracterizado por infiltração de linfócitos neoplásicos na mucosa e submucosa intestinal); leiomiossarcoma (tumor maligno mesenquimatoso com origem nas células musculares lisas intestinais) e o tumor gastrointestinal do estroma (neoplasia de origem mesenquimatosa semelhante ao leiomioma ou leiomiossarcoma), sendo mais comum no intestino grosso. Em contrapartida, os tumores mais comuns em gatos são linfoma, mastocitoma, adenocarcinoma, com predisposição da raça Siamesa (German, 2005).
Os linfomas são classificados de acordo com a região, sendo o linfoma alimentar a forma anatômica mais comumente encontrada em felinos, que acomete em maiores proporções o intestino delgado e consequentemente a perda na absorção de nutrientes. Animais podem apresentar anorexia, perda de peso progressiva, vômito e diarreia crônica (RECHE; MALVINI, 2015).
Além disso, também há uma maior incidência da doença em gatos que contraíram o FIV, o qual contribui indiretamente na tumorigênese dos linfomas, pois o vírus não é oncogênico, porém com a imunossupressão que o mesmo causa impede o sistema imune de debelar as células cancerígenas. Animais com FIV e FeLV, podem ter desenvolvimento de linfoma potencializado, assim como os fatores de risco que inclui, DII; infecção por Helicobacter sp. e carcinógenos químicos presentes na fumaça de cigarro, que podem induzir a formação do tumor (Reche; Malvini, 2015).
A-Diagnóstico
Em cerca de 86% dos gatos com tumores intestinais, é comum encontrar aumento de volume intra-abdominal, por conta dos linfonodos mesentéricos aumentados. Dessa maneira, o exame físico completo e principalmente na palpação abdominal e de todos os linfonodos acessíveis condiz a um diagnóstico presuntivo das neoplasias intestinais (Reche; Malvini, 2015).
Em casos suspeitos de linfoma alimentar, os gatos estão susceptíveis à infiltração na medula óssea, o que possibilita ao clínico solicitar exames hematológicos, bioquímicos e mielograma, especialmente se o animal apresentar anemia atípica e leucopenia. Para diferenciar o linfoma de outras patologias como lesão renal ou hepática, é necessário a realização do hemograma, perfil bioquímico e urinálise (Reche; Malvini, 2015).
O tumor estromal gastrointestinal é o mais diagnosticado, e a sua diferenciação necessita de métodos complementares como a reação de imuno-histoquímica, já que possuem diagnósticos diferenciais, podendo ser o leiomioma e leiomiossarcoma (Leandro, 2009).
O exame citológico é a base do diagnóstico das neoplasias, porém com baixa especificidade. Dessa forma o diagnóstico definitivo, é obtido com o exame histopatológico, podendo ser feito em biópsias intestinais, através da laparotomia exploratória. Os exames de imagem também podem auxiliar no diagnóstico, visto que especificamente a USG, visualiza se um padrão nodular focal ou multifocal, principalmente em linfomas, além da radiografia que pode auxiliar no perfil metastático (Reche; Malvini, 2015).
No geral, exames laboratoriais como hemograma também podem ser solicitados, em que se pode observar anemia arregenerativa normocítica normocrômica e microcítica hipocrômica, que indicam doenças crônicas, porém são inespecíficas para as neoplasias intestinais (Leandro, 2015).
B- Tratamento
Nos casos de linfoma, o tratamento é feito com quimioterapia, exceto quando há perfuração intestinal, obstrução ou se houver necessidade de biópsia cirúrgica. Os principais antineoplásicos utilizados são doxorrubicina, ciclofosfamida, vincristina, metotrexato, L-asparaginase, lomustina e prednisolona, sendo que o paciente deve ser encaminhado ao Médico Veterinário Oncologista que irá elaborar um protocolo específico após avaliação do prognóstico (Reche; Malvini, 2015).
O suporte intensivo é fundamental, principalmente em animais anoréticos ou com hiporexia prolongada, sendo considerado a nutrição enteral via esofágica de primeira escolha. Em situações que o TGI, encontra-se afuncional, em que é necessário a desestimulação do órgão afetado, devido à ocorrência de vômitos ou regurgitação persistente, deve-se optar pela alimentação parenteral. Nesses casos o uso de medicações como protetores gástricos e inibidores de ácidos estomacais são recomendados (Reche; Malvini, 2015).
Adicionalmente, é preconizado a terapia antimicrobiana de amplo espectro contra infecções oportunistas secundárias, visto que em gatos que apresentam linfoma gastrointestinal, há um aumento de bactérias do gênero Fusobacterium spp, comparado com gatos que apresentam doença inflamatória intestinal (Garraway et al., 2018).
CONSIDERAÇÕES FINAIS
Os distúrbios intestinais não infecciosos são afecções que possuem uma alta casuística e muitas das vezes são tratados apenas como doenças infecciosas. Sendo que a maioria dos animais que são atendidos, possuem enterite de causa secundária.
A busca do diagnóstico eficaz se torna o meio mais preciso para o prognóstico favorável, tendo em vista que, distúrbios e doenças intestinais devem ser investigados, sendo necessário a exclusão de outras enfermidades.
Contudo para obtenção de um sucesso terapêutico deve-se buscar a causa de base, visto que a maioria dos distúrbios intestinais são secundárias a outras patologias
REFERÊNCIAS
ALÉSSIO, B. C.; CHIMENES, D. N.; SOARES, F. S.; PALUMBO, M. I.; TERRA, V.J.
Hipersensibilidade Alimentar em Cão. In: UFMS, Campo Grande: 2017. Mostra Científica. Disponível em: https://famez.ufms.br/files/2015/09/HIPERSENSIBILIDADE-ALIMENTAR- EM-UM-C%C3%83O-1.pdf. Acesso em: 23 mar. 2021.
ALLISON M. G.; SHANHOLTZ C. B.; SACHDEVA A. Questões hematológicas na doença hepática. Crit Care Clin, 2016. Disponível em: http://refhub.elsevier.com/S0195- 5616(16)30156-5/sref59. Acesso em: 02 jun, 2022.
ANDRADE, S. C. A.; VIAES, S. E.; MARCUSSO, F. P.; SABADIN, C. J.; FREITAS, E.;
JÚNIOR, P. M. O. Intussuscepção Duodenojejunal em American Curl. Vet. e Zootec. 2019. Disponível em: https://rvz.emnuvens.com.br/rvz/article/view/107/237. Acesso em: 20 maio 2022.
APPLEWHITE A. A; CORNELL K. K; SELCER B. A. Pylorogastric intussusception in a dog: case report and literature review. J Am Anim Hosp Assoc. 2002, v. 37, pág. 238-243. Disponível em: https://pubmed.ncbi.nlm.nih.gov/11361115/. Acesso em: 15 maio 2022.
BARROS, L. M.; MATERA, J. M. Intussuscepção em cães. Revista Acadêmica Ciência Agraria Ambiental. v. 7, n. 3, p. 265-272 2009. Disponível em: https://pucpr.emnuvens. com.br/cienciaanimal/ issue/view/1134. Acesso em: 21 maio 2022.
BASTAN, I., ROBINSON, N.A., GE, X.N., RENDHAL, A.K., RAO, S.P., WASHABAU, R.
J., SRIRAMARAO, 335 P. Assessment of eosinophil peroxidase as a potential diagnostic and prognostic marker in dogs with inflammatory bowel disease. Journal of the American Veterinary Medical Association, v.78, n.1, p. 36-41, 2017.
BERENTE, A. Insuficiência hepática. In: SILVERSTEIN D. C.; HOPPER K. Medicina de cuidados críticos de pequenos animais. 2 ed. St Lois: Elsevier/Saunders; 2015. Disponível em: http://refhub.elsevier.com/S0195-5616(16)30156-5/sref60. Acesso em: 02 jun, 2022.
BIOURGE, V. Dietary management of live disease. Veterinary Focus: Bolonha, FRA, v. 20, n.3, 2010. Disponível em: https://www.ivis.org/library/veterinary-focus/liver-disease- veterinary-focus-vol-203-oct-2010/dietary-management-of-liver-disease. Acesso: 31 maio 2022.
BRENTANO, L. M. Cirurgia Gástrica em cães. Porto Alegre: Universidade Federal do Rio Grande do Sul, 2010. Trabalho de Conclusão de Curso. Disponível em: https://lume.ufrgs.br/handle/10183/38782. Acesso em: 25 maio 2022.
CABRAL, A. E. P.; SILVA, C. I. B.; ROFRIGUES, M. C. B. SILVA, D. TRAMUJAS, W. G.
MANRIQUE. Corpo estranho no sistema digestório em cão: relato de caso. ARS Veterinária, Jaboticabal, SP, v.34, n.4, 168-205, 2018.
CARLTON, W; MCGAVIN, M Donald. Patologia Veterinária Especial. 2. ed. Porto Alegre: Artmed, 1998.
CERNÁ, P.; KILPATRICK, S.; GUNN-MOORE, D. A. What do we really know about feline triaditis? Journal of Feline Medicine and Surgery, v. 22, p. 1047-1067, 2020.
COSTA, P. R. S. Tríade felina. Revista Conselho Federal de Medicina Veterinária (CFMV). v. 62, p. 39-40, 2014.
COSTANZO S. L. Fisiologia do Trato Gastrointestinal. In: Fisiologia. 5. ed. Elsevier, 2014. E-book.
CRIVELLENTI L. Z.; CRIVELLENTI B.S. Casos de Rotina em Medicina Veterinária de Pequenos Animais. 2. ed. São Paulo: MedVet, 2015.
DELLMANN; EURELL, J. A.; FRAPPIER, L. B. Histologia Veterinária de Dellmann. 6 ed. Manole, 4 abr 2012. E-book.
FEITOSA, F. L. E. Semiologia do Sistema Digestório de Cães e Gatos. In: FEITOSA, F. L. E. Semiologia Veterinária a Arte do Diagnóstico. 4. ed. São Paulo: Roca, 2014. Seção D, pág. 391-465. E-book.
FELTS, J. F.; FOX, P. R.; BURK, R. L. Thread an sewing needles as gastrointestinal foreign bodies in the cat: a review of 64 cases. JVMA, v.184, p. 56-59, 1984. Disponível em: https://pubmed.ncbi.nlm.nih.gov/6698839/. Acesso em: 25 maio 2022.
FOSSUM, T.W. Cirurgia de pequenos animais. v.4, ed. Rio de Janeiro, 2014. Cap. 20, pág. 1441-1452. E-book.
FRANZISKA G. Síndrome de Pica em gatos. v. 6, zooplus, 2022.Disponível em: https://www.zooplus.pt/magazine/gatos/saude-do-gato-e-cuidados/sindrome-de-pica-nosgat os. Acesso em: 20 ago. 2022.
FREICHE, V. G.; HOUSTON, D.; WEESE H. Uncontrolled study assessing the impact of a psyllium-enriched extruded dry diet on fecal consistency in cats with constipation. J Feline Med Surg., v.13, p. 903-911, 2011. Disponível em: https://pubmed.ncbi.nlm.nih.gov/21944542/. Acesso em: 28 maio 2022.
GAMEIRO, A. C. P. Estudo das doenças do intestino do cão e do gato diagnosticadas por histopatologia. Dissertação (Mestrado em Medicina Veterinária) – Faculdade de Medicina Veterinária, Universidade Lusófona de Humanidades e Tecnologias, Lisboa, 2016. Disponível em:https://recil.grupolusofona.pt/bitstream/10437/7604/1/disserta%C3%A7%C3%A3o%20 fi nal%20-%20ACPG.pdf. Acesso em: 24, mar. 2021.
GARRAWAY, K., JOHANNES, C. M., BRYAN, A., PEAUROI, J., ROSSI, G., ZHANG, M., WANG, C., ALLENSPACH, K., & JERGENS, A. E. (2018). Relationship of the
mucosal microbiota to gastrointestinal inflammation and small cell intestinal lymphoma in cats. Journal of Veterinary Internal Medicine, v.5, P. 1692–1702. Disponível em: https://doi.org/10.1111/jvim.15291. Acesso em: 17 jun 2022.
GEHRES, D.; PAPPIS, M.; ARALDI, D. F.; PALMA, H. Relação entre obesidade e desenvolvimento de doenças em cães e gatos: revisão de literatura. In: UNICRUZ, Rio
Grande do Sul: 2019. XXII Seminário interinstitucional de pesquisa e extensão. Disponível em: file:///C:/Users/eduar/OneDrive/Documentos/med%20vet/PROJETO%20TCC/OBESI DADE.pdf. Acesso em: 15, abr. 2021.
GERMAN, A. J. Diseases of small intestine. In: HALL, E. J.; SIMPSON J. W.; WILLIAMS
D. A. BSAVA Manual of Canine and Feline Gastroenterology, 2 ed, 2005. Gloucester: British Small Animal Veterinary Association.
GOUVÊA, F. N.; PENNACCHI C. S. P.; ASSAF N. D.; ARANTES E. A. L.; STEFANISZEN A. G.; VIEIRA E. M.; GENARI V.; GUIMARÃES-OKAMOTO P. T. C;
MELCHERT, A. Doença Inflamatória Intestinal Em Cães – Relato De Casos. Ars Veterinária, Jaboticabal, Sp, v.36, n.4, p. 332-336, 2020. Disponível em: http://dx.doi.org/10.15361/2175-0 106.2020v36 n4 p332-336. Acesso em: 09 maio 2022.
GRAHAM, L. T; AUGER A.; WATSON A. M.; CRISTÃO F.; HESPEL A. M. “Images and clinical features of a true gastrogastric intussusception in a dog”. La revue veterinaire canadienne vol. 61, n.7, 2020, p.715-718. Disponível em: https://www.ncbi.nlm.nih.gov/pmc /articles/PMC796876/#b1 -cvj_07_715. Acesso em: 15 maio 2022.
HARVEY, R.; HALL, E. Food allergy/intolerance. Veterinary Focus, Descalvado, SP: Royal Canin, v. 19, n. 1, p. 36-41, 2009.
HAYES, G. Gastrointestinal foreign bodies in dogs and cats: a retrospective study of 208 cases. J Small Anim Pract. 2009, v.50, n.11, p.576-83. Disponível em: 10.1111/j.1748- 5827.2009.00783. x.Epub 2009 Oct 8. PMID: 19814770.
HOBDAY, M.M.; PACHTINGER G.E.; DROBATZ K.J.; SYRING R. S. Linear versus non-linear gastrointestinal foreign bodies in 499 dogs: clinical presentation, management and short-term outcome. J Small Anim Pract. Nov 2014, v. 55 n.11, p. 560-5 . Disponível em: 10.1111/jsap.12271. PMID: 25352109.
HOWARD, B. G. Sistema Alimentar, Peritônio, Omento, Mesentério e cavidade Peritoneal. In: McGAVIN, M.D.; ZACHARY, J.F. Bases da Patologia em Veterinária. 5. ed. Rio de Janeiro: Elsevier, 2013. Cap.7, p. 357-374.
JENNES, D. Intussusception in canines: A review. The Pharma Innovation. S. L., p. 89- 97. jan. 2020.
JERGENS A. E.; SIMPSON K. W. Inflammatory Bowel Disease in Veterinary Medicine. Department of Veterinary Clinical Sciences, Iowa State University, Ames, Iowa. College of Veterinary Medicine, Cornell University, Ithaca, New York, 2012. Disponível em: https://pubmed.ncbi.nlm.nih.gov/22201965/. Acesso em: 23 maio 2022.
JERGENS, A. E., CRANDELL, J., MORRISON, J. A., DEITZ, K., PRESSEL, M., ACKERMANN, M., SUCHODOLSKI, J. S., STEINER, J. M., EVANS, R. Comparison oral prednisone and prednisone combined with metronidazole for induction therapy of canine inflammatory bowel disease: a randomized-controlled trial. Journal of Veterinary Internal Medicine, v.24, n.2, p. 269-77, 2010.
JERICÓ, M.; NETO, J. P. A.; KOGIKA, M. Tratado de Medicina Interna de cães e gatos.1 ed. Vol. 2. Rio de Janeiro: Rocca, 2015. E-book
JOÃO, C. F. Gastroenterologia e Hepatologia. In: CRIVELLENTI. L.Z.; CRIVELLENTI
B.S. Casos de Rotina em Medicina Veterinária de Pequenos Animais. 2. ed. São Paulo: MedVet, 2015. Cap. 8, p. 317-321.
JOHNSON, S. E.; SHERDING, R. G. Diseases of the and the biliary tract. In: BIRCHARD,
S. J.; SHERDING, R. G. Saunders Manual of Small Animal Practice. 3 ed. Philadelphia, USA: Elsevier Inc. 2006, cap. 71, p. 747-809.
JOHNSON, S. E. Insuficiência hepática aguda. In: KIRK, R.W. (Ed.). Atualização terapêutica veterinária: pequenos animais. 9.ed. São Paulo: Manole, 1988. v.2, p.1194-1204.
JOHNSON, S.E. Liver and biliary tract. In: ANDERSON, N.V.; SHERDING, R.G.; MERIT,
A.M.; WHITLOCK, R.H. (Eds.). Veterinary gastroenterology. 2.ed. Pennsylvania: Lea & Febiger, 1992. p.504-569.
JOHNSON, S. E.; SHERDING, R. G. Hepatopatias e doenças do trato biliar. In: BIRCHARD, S.J.; SHERDING R.G. Manual Saunders: clínica de pequenos animais. São Paulo: Roca, 1998. p.812-856.
JÚNIOR A. R.; PIMENTA M. Doença inflamatória intestinal em felinos. In: JERICÓ, M.; NETO, J. P. A.; KOGIKA, M. Tratado de Medicina Interna de cães gatos. 1 ed, Rio de Janeiro: Rocca, 2015. E-book.
KLEIN, B. G. Cunningham Tratado de Fisiologia Veterinária. 6 ed. GEN Guanabara Koogan, 2020. E-book.
KÖNIG, H. E.; SÓTONYI, P.; RUBERLE, J.; LIEBICH. H. G. Sistema Digestório. In:
KÖNIG, H.E.; LIEBICH. H.G. Anatomia dos Animais Domésticos. 6. ed. São Paulo: Cunha, 2016. Cap. 7, p. 350-354. E-book.
LAROSE, P.C.; SINGH A.; GIUFFRIDA M.A.; HAYES G.; MOYER J. F.; GRIMES J. A.; RUNGE J.; CURCILLO C.; THOMSON C. B.; MAYHEW P.D.; BERNSTEIN R.; DOMINIC C.; MANKIN K. T.; REGIER P.; CASE J. B.; ARAI S.; GATINEAU M.;
LIPTAK J. M.; BRUCE C. Clinical findings and outcomes of 153 dogs surgically treated for intestinal intussusceptions. Veterinary Surgery. Canada, p. 1-9. mar. 2020. Disponível em:https://pubmed.ncbi.nlm.nih.gov/32415881/#:~:text=Postoperative%20complications%2 0 occurred%20in%2053,all%20within%2072%20hours%20postoperatively. Acesso em: 22 jul 2022.
LAPPIN, M. R. Desordens do Trato Intestinal. In: COUTO, C. G; NELSON, R. W. Medicina interna de pequenos animais. 4. ed. Rio de Janeiro: Elsevier, 2010. E-book.
LASSEN, E. D. Avaliação laboratorial do fígado. In: THRALL, M.A.; BAKER, D.C.; CAMPBELL, T.W.; DENICOLA, D.; FETTMAN, M.J.; LASSEN, E.D.; REBAR, A.;
WEISER, G. Hematologia e bioquímica clínica veterinária. São Paulo Roca, 2007. p.335-354.
LEAL, N. I. Insuficiência Pancreática Exócrina: Relato de caso. Santa Catarina: Universidade Federal de Santa Catarina. Campus Curitibanos. 2018. Disponível em: https://repositorio.ufsc.br/handle/123456789/188498. Acesso em: 21 ago. 2022.
LEANDRO R. M. Estudo clínico epidemiológico e anatomopatológico das neoplasias do trato gastrintestinais de cães [Dissertação]. São Paulo: Universidade de São Paulo, Faculdade de Medicina Veterinária e Zootecnia; 2009. Disponível em: https://www.teses.usp. br/teses/disponiveis/10/10133/tde-25042012-100054/publico/RAFAEL_MAGDANELO_LEANDRO.pdf. Acesso em: 28 jun 2022.
LEANDRO, R. M.; SÁ, L. M. Neoplasias gastrointestinais. In: JERICÓ, M.; NETO, G. A.; KOGIKA, M. Tratado de Medicina Interna de Cães e Gatos. 1. ed. Vol. 2. Rio de Janeiro: Roca, 2015. Cap. 13, pag. 3029-3040. E-book.
LEVIEN, A. S; BAINES, S. J. Histological examination of the intestine from dogs and cats with intussusception. J Small Anim Pract. 2011. Disponível em: https://pubmed.ncbi.nlm.ni h.gov/21985611/. Acesso em: 20 maio 2022.
LITTLER, R. M. E.; BALT R. M.; LLOYD A. D. Deficiência total e relativa de IgA da mucosa intestinal em cães pastores alemães demonstrada por análise fecal. Vet Rec 158 , 334-341, 2006.
LITTMAN, M. P.; DAMBACH D. M.; VADEN S.L.; GIGER U. Familial protein-losing enteropathy and protein-losing nephropathy in Soft Coated Wheaten Terriers: 222 cases (1983-1997). J Vet Intern Med. 2000, v.1 n. 14, p. 68-80. Disponível em: https://pubmed.ncbi.nlm .nih.gov/10668820/. Acesso em: 28 jun 2022.
LORENZI, D.; FREICHE, V.; TODD, T.; ELLIOTTI, D.; EWAN, M.; CARMEN, R.
Armadilhas em distúrbios gastrintestinais no cão. Centro de Pesquisas da Royal Canin. França, 2011. PortalVet. Disponível em: https://portalvet.royalcanin.com.br/saude-e- nutricao/trato-gastrointestinal/alteracoes-gastrointestinais-responsivas-a-ingestao-de-fibras/.
MALEWSKA, K., RYCHLIK, A., NIERADKA, M., KANDER, M. Treatment of inflammatory bowel disease (IBD) in dogs and cats. Polish Journal of Veterinary Sciences, v.14, n.1, p.165-170, 2011.
MANDIGERS P.; GERMAN A. J. Dietary hypersensitivity in cats and dogs. Tijdschr Diergeneeskd. 2010, v.19, p.706-10. Disponível em: https://pubmed.ncbi.nlm.nih. gov/2107 3096/. Acesso em: 21 maio 2022.
MELANIE, D. C., ROBERT J. W. Comparative pathophysiology and management of protein-losing enteropathy. Journal of Veterinary Internal Medical, 2019. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6430879/#jvim15406-bib-0040. Acesso em: 10 maio 2022.
MELO, A. M. C., CARNEIRO, R. S. R., ANDERLINI, G. P. O. S., OMENA, P. N. M.,
LIMA, K, A, C. Doença inflamatória intestinal em felinos: revisão de literatura. Brazilian Journal of Animal and Environmental Research, v.1, n.2, p.315-319, 2018.
MORETTI, M. F.; SOUZA, R. E.; MORETTI, B. Doença Inflamatória Intestinal Felina – Relato de Caso. Brazilian Journal of Animal and Environmental Research, Curitiba, v.4, n.1, p. 236-239 jan./mar. 2021. Disponível em: https://www.brazilianjournals.com/index.php/BJAER/article/view/23670/19031. Acesso em: 19, abr, 2021.
MÜNSTER, M. Die lympho-plasmazelluläre Enteritis bei Hund und Katze – klinische Befunde und Therapieergebnisse. Kleintierpraxis, 1995, vol 8. Pág. 581-590.
MURAKAMI, V. Y.; REIS, G. F. M.; SCARAMUCCI, C. P. Tríade Felina. Revista
Científica Eletrônica de Medicina Veterinária, v. 26, p. 7-15, 2016.
NASCENTE, P. S. Hipersensibilidade Alimentar em Cães e Gatos. Revista Clínica Veterinária, n. 64. p.60-66, 2006. E-book.
NELSON, R. W.; COUTO C. G. Intussuscepção/prolapso do intestino grosso. In: NELSON, R. W.; COUTO C. G. Medicina Interna de Pequenos Animais. 5 ed. Elsevier, 2015. Pag. 1454-1455. E-book,
PACHECO T. A.; SALZO P. S. Insuficiência Pancreática Exócrina (IPE), em cães de raça Border collie: Relato de caso. XXI Congresso Metodista de Iniciação e produção Científica. Universidade Medodista de São Paulo. 2019. Disponível em: http://www.metodista.br/com gressos-cientificos/index.php/CM2019/. Acesso em: 07 jun 2022.
PATSIKAS, M. N.; PAPAZOGLOU L.G.; PAPAIOANNOU, N. G.; SAVVAS, I;
KAZAKOS, G. M. Ultrasonographic findings of intestinal intussusception in seven cats. J Feline Med Surg. 2003. Disponível em: https ://journals. sagepub.com /doi/abs/10 .1016 /S1 098-612X%2803%2 900066-4. Acesso em: 20 maio 2022.
PATSIKAS, M. N.; PAPAZOGLOU L. G.; PARASKEVAS G. K. Current views in the diagnosis and treatment of intestinal intussusception. Topics In Companion Animal Medicine. Thessaloniki,, p. 1-39. jan. 2019.
PATSIKAS, M; JAKOVLJEVIC S.; MOUSTARDAS N.; PAPAZOGLOU L. G.;
KAZAKOS G. M.; DESSIRIS A. K. Intussusception Associated With Acute Enteritis or Gastroenteritis in 19 Young Dogs. J American Animal Hospital Association, S. L, v. 39, n. 0, p. 57-66, jan. 2003. Disponível em: https://pubmed.ncbi.nlm.nih.gov/12549615 /. Acesso em: 23 jul 2022.
PEREIRA, S. P.; ROWBOTHAM D.; FITT S. Farmacocinética e eficácia dafiloquinona micelar mista oral versus intravenosa (vitamina K1) na doença hepática aguda grave. J Hepatol, 2005. Disponível em: Farmacocinética e eficácia da filloquinona oral versus intravenosa misólar (vitamina K1) em doença hepática aguda grave – ScienceDirect. Acesso em: 03 jun, 2022.
PETERSON, P. B.; WILLARD M. D. Protein-losing enteropathies. Vet Clin North Am Small Anim Pract. 2003, v.33 n.5, p.1061-82. Disponível em: https://pubmed.ncbi.nl m.nih.gov/ 14552161/. Acesso em: 28 jun 2022.
RABELO, R. C. Emergências de pequenos animais: condutas clínicas e cirúrgicas no paciente grave. Rio de Janeiro: Elsevier Editora Ltda., vol. 1. 2012. E-book.
RECHE, A. J.; MALVINI M. P. Linfoma alimentar felino. In: JERICÓ M. M. Tratado de Medicina Interna de cães e gatos. 1 ed. Cap. 50. Rio de Janeiro: Rocca, 2015. Pag.812 -822. E-book.
RODRÍGUEZ, A. C.; BERISTAÍN, R. D. M.; PÉREZ, C. F.; RIVERA R.; OCHOA, G.;
MARTÍN, O.U. Protein-losing enteropathy in a dog with lymphangiectasia, lymphoplasmacytic enteritis and pancreatic exocrine insufficiency. Vet Q. 2012. Disponível em: https://pubmed.ncbi.nlm.nih.gov/23106499/. Acesso em: 10 maio 2022.
ROTHUIZEN, J.; MEYER, H. P. Anamnese, exame físico e sinais da doença hepática. In: ETTINGER, S. J.; FELDMAN, E. C. Tratado de Medicina Interna Veterinária: doenças do cão e gato. 5 ed. Rio de Janeiro: Guanabara Koogan, 2004. v. 2, cap. 140, p. 1342-1347.
SANTOS, M. C. F. P.; AULER F. A. B. Doenças Gástricas. In: JERICÓ, M.; NETO, J. P. A.; KOGIKA, M. Tratado de Medicina Interna de cães e gatos. 1 ed. Rio de Janeiro: Rocca, 2015. E-book.
SILVA, R. D. Doenças do Intestino Delgado | Diarreias Crônicas. In: JERICÓ, M.; NETO,
G. A.; KOGIKA, M. Tratado de Medicina Interna de Cães e Gatos. 1. ed. Rio de Janeiro: Roca, 2015. p.2983-2990. E-book.
SILVA, R. D; PONCE, F. G. Pancreatite. In: JERICÓ, M.; NETO, G. A.; KOGIKA, M. Tratado de Medicina Interna de Cães e Gatos. 1. ed. Rio de Janeiro: Roca, 2015. p. 3187 – 3190. E-book.
SILVERSTEIN, D. C.; SANTORO B. K. Fluidoterapia intravenosa diária. In: HOPPER K. Medicina de cuidados intensivos de pequenos animais. 2 ed. St Louis: Elsevier/Saunders, 2015. Disponível em: Daily Intravenous Fluid Therapy – ScienceDirect. Acesso em: 03 jun, 2022.
SIMPSON, K. W., JERGENS, A. E. Pitfalls and progress in the diagnosis and management of canine inflammatory bowel disease. Veterinary Clinics: Small Animal Practice, v. 41, n. 2, p. 381-98, 2011.
SIQUEIRA, P. F. Doença inflamatória intestinal felina. Monografia (Graduação em Medicina Veterinária) – Faculdade de Medicina Veterinária, Universidade Federal do Rio Grande do Sul, Porto Alegre, 2012. Disponível em: http://doenca inflamatoria intestinal em felinos.pdf . Acesso em: 13, abr. 2021.
SPINOSA, H. S. Medicamentos que interferem nas funções gastrointestinais. In: SPINOSA, H.S.; GÓRNIAK, S.L.; BERNARDI, M.M. Farmacologia Aplicada à Medicina Veterinária. 4. ed. Rio de Janeiro: Guanabara Koogan, 2006. Cap. 33, p. 418-428.
STEINER, J. M. Exocrine Pancreatic Insufficiency in the Cat. Topics in Companion Animal Medicine, v. 27, n.3, 2012, p. 113–116. Disponível em: https://doi.org/10.1053/j.tcam. 2012.04.005. Acesso em: 06 jun 2022.
TEIXEIRA, A. K. Linfangiectasia Intestinal em cães. Monografia (Curso de Medicina Veterinária) – Faculdade de Ciências Biológicas e da Saúde, Universidade Tuiuti do Paraná,
Curitiba, 2019. Disponível em: https://tcconline.utp.br/media/tcc/2019/08/LINFANGIECTA SIA-INTESTINAL.pdf. Acesso em: 26 Jan. 2022.
TENNANT, B.C. Hepatic function. In: KANEKO, J.J.; HARVEY, J.W. (Eds.). Clinical biochemistry of domestic animals. 5.ed. San Diego: Academic Press, 1997. p.327-352.
THAWLEY, V. Acute Liver Injury and Failure. Vet Clin North Am Small Anim Pract. 2017 May;47(3):617-630. doi: 10.1016/j.cvsm.2016.11.010. Epub 2017 Jan 6. PMID:28065578.Disponível em: https://pubmed.ncbi.nlm.nih.gov/28065578/. Acesso em: 02 jun, 2022.
TOLBERT, K.; BISSETT S.; FITT S. Efficacy of oral formulation of famotidine and omeprazole for intragastic pH control in dogs. J Vet intern Med, 2011. Disponível em: Eficácia da Famotidina Oral e 2 Formulações de Omeprazol para o Controle do PH Intragastric em Cães – Tolbert – 2011 – Journal of Veterinary Internal Medicine – Wiley Online Library. Acesso em: 03 jun 2022.
TÖRNER, K.; GRASSINGER J. M.; WEBER C. N.; AUPPERLE L. H.; CEREZO E. A.;
MÜLLER E. Signalment and Clinical Data of Cats with Exocrine Pancreatic Insufficiency Diagnosed Using Feline Trypsin-like Immunoreactivity in Routine Diagnostics. Vet Sci. v.3, n.8, p.155, 2021. Disponível em: 10.3390/vetsci8080155. PMID: 34437477; PMCID: PMC8402856.
TRINDADE, F. S.; DORETTO I. L.; CALLEGARETTE N. C.; PORTO C. D.; HATAKA A.
Gastroenterite eosinofílica em um cão: relato de caso. Serviço de Patologia Veterinária, Faculdade de Medicina Veterinária e Zootecnia (FMVZ) – UNESP, Botucatu, SP, 2021. Disponível em: http://201.62.80.75/index.php/ciencias/article/viewFile/1670/936 . Acesso em: 21 ago. 2022.
WATSON, P.J. O pancreas exócrino. In: NELSON, R.W.; COUTO, C. G. Medicina Interna de Pequenos Animais, 5ª ed., Rio de Janeiro: Elsevier, p.598-628, 2015.
WINTER, M. D.; LOCKE, J. E.; PENNICK, D. G. Imaging diagnosis- urinary obstruction secondary to prostatic lymphoma in a young dog. Veterinary Radiology and Ultrasound. v.47, p.597–601, 2006.
XENOULIS, P. G, ZORAN D. L, FOSGATE G. T, SUCHODOLSKI J. S, STEINER J. M.
Feline Exocrine Pancreatic Insufficiency: A Retrospective Study of 150 Cases. J Vet Intern Med. 2016, v.30, n.6, p.1790-1797. Disponível em: 10.1111/jvim.14560. Epub 2016 Sep 19. PMID: 27641602; PMCID: PMC5115185.
1Médica Veterinária, Residente da Clínica Médica de Pequenos Animais do Hospital Veterinário Universitário Prof. Ivon Macêdo Tabosa, Universidade Federal de Campina Grande (UFCG), Campus de Patos-PB eduardafranca1235@outlook.com
2Discente do curso de Bacharelado em Medicina Veterinária no Centro Universitário de Patos – UNIFIP, Patos-PB josesantos@medvet.fiponline.edu.br, amanda34luisa@gmail.com, jessica.dantaspb123@gmail.com, lucaslourencofnsr@hotmail.com, joaosilva1@medvet.fiponline.edu.br, lacerdamica@hotmail.com, victorsoares3443@gmail.com
3Médico Veterinário, Professor, Doutor, Unidade Acadêmica de Medicina Veterinária, UFCG, Campus de Patos-PB almir@cstr.ufcg.edu.br
