REGISTRO DOI: 10.69849/revistaft/cs10202505302310
Marcus Alexandre Borges Pires1,2
ABSTRACT
In the present study, we describe and illustrate in detail the complete larval development of the neotropical mangrove fiddler crab Minuca rapax, cultured under laboratory conditions. Larvae were obtained from an egg-bearing female that was collected in the mangroves of the Caeté River estuary, Pará State (North Brazil). After hatching, the larvae were cultured in 250 ml plastic vials (at a density of ca. 10 larvae per vial) at an ambient temperature of 26.7 ± 1.6 °C, salinity 30, pH 8.1 ± 1.0, with photoperiod regime (12h light/ 12h dark cycle) and without aeration in the culture medium. Rotifers (Brachionus plicatilis; ca. 200 individuals ∙ mL–1), microalgae (Thalassiosira sp.; ca. 4 x 104 cells ∙ mL–1) and brine shrimp nauplli (Artemia sp.; ca. 8 nauplii ∙ mL–1, only start from the third zoeal stage) were offered to larvae as food items. The early development of M. rapax consisted of 5 zoeal stages (ZI–ZV) plus a megalopal larval stage. All zoea larvae (ZI–ZV) survived with success in the culture. The development period of the ZI and ZII larval stages varied from 1 to 2 days, with averages of 1.8 ± 0.4 and 1.1 ± 0.3 days, respectively. The ZIII and ZIV stages developed from 1 to 3 days (2.0 ± 0.3 days), while the ZV stage developed within 3 to 5 days (3.9 ± 0.4 days). The total zoeal developmental period until moulting to megalopa ranged from 11 to 13 days (11.8 ± 0.6 days). The ZI and megalopal stages of M. rapax were morphologically compared with larvae from congeneric fiddler crab species previously described in the literature.
Keywords: Decapoda. Megalopa. Morphology. Neotropical species. Zoea.
RESUMO
No presente estudo, descrevemos e ilustramos em detalhes o desenvolvimento larval completo do caranguejo-violinista de mangue neotropical Minuca rapax, cultivado em condições de laboratório. As larvas foram obtidas de uma fêmea portadora de ovos coletada nos manguezais do estuário do Rio Caeté, no Estado do Pará (norte do Brasil). Após a eclosão, as larvas foram cultivadas em frascos plásticos de 250 ml (a uma densidade de cerca de 10 larvas por frasco) a uma temperatura ambiente de 26,7 ± 1,6 °C, salinidade 30, pH 8,1 ± 1,0, com regime de fotoperíodo (ciclo de 12h claro/ 12h escuro) e sem aeração no meio de cultura. Rotíferos (Brachionus plicatilis; cerca de 200 indivíduos ∙ mL–1), microalgas (Thalassiosira sp.; cerca de 4 x 104 células ∙ mL–1) e náuplios de artêmia (Artemia sp.; cerca de 8 náuplios ∙ mL–1, somente a partir do terceiro estágio zoeal) foram oferecidos às larvas como itens alimentares. O desenvolvimento inicial do M. rapax consistiu em 5 estágios zoeais (ZI-ZV) mais um estágio larval megalopal. Todas as larvas zoea (ZI-ZV) sobreviveram com sucesso na cultura. O período de desenvolvimento dos estágios larvais ZI e ZII variou de 1 a 2 dias, com médias de 1,8 ± 0,4 e 1,1 ± 0,3 dias, respectivamente. Os estágios ZIII e ZIV se desenvolveram de 1 a 3 dias (2,0 ± 0,3 dias), enquanto o estágio ZV se desenvolveu de 3 a 5 dias (3,9 ± 0,4 dias). O período total de desenvolvimento zoeal até a muda para megalopa variou de 11 a 13 dias (11,8 ± 0,6 dias). Os estágios ZI e megalopa de M. rapax foram comparados morfologicamente com larvas de espécies congêneres de caranguejos violinistas descritas anteriormente na literatura.
Palavras-chave: Decapoda. Megalopa. Morfologia. Espécies neotropicais. Zoea.
INTRODUÇÃO
Há poucos estudos disponíveis sobre os aspectos morfológicos dos estágios larvais das espécies de caranguejos violinistas, que são os crustáceos decápodes mais abundantes encontrados em manguezais e estuários (CRANE, 1975).
De 107 espécies de caranguejos violinistas atualmente reconhecidas (Shih et al., 2016), somente 14 tiveram a morfologia de todos os seus estágios larvais descritos na literatura, totalizando quase 13,1% (ANGER et al., 1990; FEEST, 1969; HYMAN, 1920; KO & KIM, 1989; KUMAR & AL-AIDAROOS, 2022; MARTINS, 2018; MURAOKA, 1976; RABALAIS & CAMERON, 1983; RIEGER, 1996, 1997, 1998, 1999; RODRÍGUEZ & JONES, 1993; TERADA, 1979).
Das dez espécies que ocorrem ao longo do litoral do Brasil, seis já tiveram todos os seus estágios de desenvolvimento larval descritos: Leptuca thayeri (Rathbun, 1900) (ANGER et al., 1990); Leptuca uruguayensis (Nobili, 1901) (RIEGER, 1996); Minuca mordax (Smith, 1870) (RIEGER, 1997); Minuca burgersi (Holthuis, 1967) (RIEGER, 1998); Minuca vocator (Herbst, 1804) (RIEGER, 1999), e Leptuca leptodactyla (Rathbun, 1898) (MARTINS, 2018). Contudo, grande parte do conhecimento, acerca das informações da morfologia larval de outras espécies fica geralmente restrita somente ao estágio de zoea I, como para Minuca rapax (Smith,1870) (SERBINO, 2008b; SOUZA et al., 2013) e Leptuca cumulanta (Crane, 1943) (DO ROSÁRIO et al., 2021) ou não existem trabalhos na literatura reportando informações sobre o desenvolvimento dos estágios larvais, como é observado para Minuca victoriana (von Hagen, 1987).
Mais recentemente, Negreiros-Fransozo et al. (2009) descreveram os estágios ZI e megalopa de Uca maracoani (Latreille,1802-1803), e ambos foram estudados a partir de larvas zoea I recém-eclodidas em laboratório e de espécimes no estágio de megalopa coletados diretamente na Praia do Jabaquara, Paraty, Rio de Janeiro.
Apesar dos numerosos estudos que descrevem a morfologia dos estágios larvais iniciais, dos caranguejos violinistas de mangue, por enquanto, nenhum estudo até o presente momento foi abordado para completar o desenvolvimento larval do M. rapax. Essa espécie de caranguejo violinista está distribuída ao longo da costa atlântica das Américas subtropical e tropical (MELO, 1996). Nos estuários do norte do Brasil, o M. rapax é normalmente encontrado nas zonas de maré alta a média e representa uma das espécies de caranguejo mais abundantes no habitat do manguezal (KOCH e WOLFF, 2002; KOCH et al., 2005). Seu desenvolvimento larval bem-sucedido ocorre em salinidades ≥ 25, indicando que os estágios iniciais do histórico de vida dessa espécie são dispersos fora dos manguezais parentais para se desenvolverem em condições de salinidade mais alta encontradas em águas costeiras adjacentes ou totalmente marinhas (SIMITH et al., 2014).
No presente estudo, apresentamos uma descrição morfológica detalhada dos estágios larvais (zoea e megalopa) dessa espécie de caranguejo violinista da região amazônica, cultivada em condições de laboratório. As principais características morfológicas de cada estágio de desenvolvimento também foram comparadas a outras espécies de caranguejos violinistas.
MATERIAIS E MÉTODOS
Uma fêmea de M. rapax foi coletada (um dia antes da eclosão) na maré baixa, nas margens lamacentas da região entremarés de um grande igarapé (Furo Grande) na região de manguezal do estuário do Rio Caeté (00°50’421” S; 046°38’398” W), Estado do Pará, Norte do Brasil. No laboratório de Carcinologia do Campus da Universidade Federal do Estado do Pará, a fêmea foi lavada e mantida em um aquário de vidro com 5 L de água do mar, com aeração constante e sem alimento até a liberação da larva. Após a eclosão, as larvas foram transferidas para frascos plásticos de 250 mL para cultivo em massa (em uma densidade de aproximadamente 10 larvas por frasco) até atingirem o estágio de megalopa. Todas as larvas de zoea foram criadas em temperatura ambiente de 26,7 ± 1,6 °C, salinidade 30 (condição ideal de salinidade, conforme Simith et al. (2014), regime de fotoperíodo de 12h claro/12h escuro, pH 8,1 ± 1,0 e sem aeração no meio de cultura. As larvas foram alimentadas diariamente com rotíferos Brachionus plicatilis (com densidade de 200 indivíduos ∙ mL–1) e microalgas Thalassiosira sp. (com densidade de 4 x 104 células ∙ mL–1). A partir do terceiro estágio de zoea, as larvas também foram alimentadas com náuplios de Artemia sp. em uma densidade de aproximadamente 8 indivíduos ∙ mL–1. A água do mar da cultura foi trocada a cada 3 a 5 dias. A água do mar usada para o cultivo de larvas de M. rapax foi coletada na praia de Ajuruteua, no norte do Brasil (00°49’751” S; 046°36’248” W). A água do mar foi previamente filtrada (Eheim-Filter, Alemanha; e Diatom-Filter, 5 µm) e armazenada em tanques (500 L) com aeração constante no laboratório.
Amostras de exúvias e espécimes de cada estágio de desenvolvimento de M. rapax foram coletadas e preservadas em solução de glicerina + álcool etílico 70% (1:1). Posteriormente, as larvas e exúvias foram dissecadas com agulhas finas (12,7 x 0,33 mm, BD Ultra-Fine®) e ilustradas em um microscópio óptico binocular (Zeiss Axioskop 40), equipado com câmara clara e um disco micrométrico. Para visualização de algumas estruturas, utilizou-se o corante azul de metileno a 0,5%. No presente estudo, a primeira zoea e o estágio de megalopa de M. rapax foram inteiramente descritos em detalhes; no entanto, apenas as principais diferenças morfológicas observadas nos estágios larvais subsequentes foram descritas.
A terminologia utilizada nas descrições morfológicas segue os estudos desenvolvidos por Anger et al. (1990), Batistelli (2003), Clark et al. (1998), Factor (1978), Garm (2004), Ghory & Siddiqui (2006), Horn & Buckup (2004), Ko & Kim (1989), Pohle & Telford (1981), Rabalais & Cameron (1983), Rieger (1996, 1997, 1998, 1999), Rieger & Santos (2001), Rodríguez & Jones (1993). A fêmea e amostras de larvas de M. rapax foram depositadas na Coleção de Invertebrados do Museu Paraense Emílio Goeldi de Belém-PA, sob o código MPEG.CRU 1117.
RESULTADOS
Sobrevivência e período de desenvolvimento das larvas de Minuca rapax
O desenvolvimento larval do M. rapax incluiu 5 estágios larvais zoeais e um estágio larval megalopal. Embora tenha sido observado um intenso comportamento canibal entre as megalopas, nenhuma mortalidade foi observada durante o cultivo larval, onde todas as larvas mudaram com sucesso para o estágio megalopal (Fig. 1).

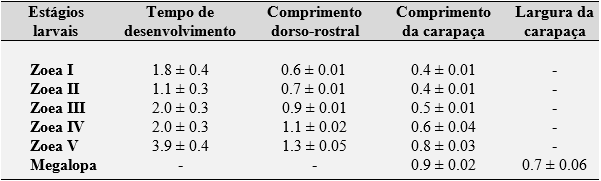
O período de desenvolvimento dos estágios larvais ZI e ZII variou de 1 a 2 dias, com médias de 1,8 ± 0,4 e 1,1 ± 0,3 dias, respectivamente. As larvas nos estágios ZIII e ZIV se desenvolveram de 1 a 3 dias (2,0 ± 0,3 dias), enquanto o período de desenvolvimento dos espécimes no estágio ZV variou de 3 a 5 dias (3,9 ± 0,4 dias). O período total de desenvolvimento zoeal até o dia da muda para megalopa variou de 11 a 13 dias (11,8 ± 0,6 dias) (Tabela 1).
Tabela 1. Tempo de desenvolvimento (em dias; média ± desvio padrão) e parâmetros morfométricos (mm, média ± desvio padrão) dos respectivos estágios larvais (zoea I–V and megalopa) do caranguejo violinista Minuca rapax.
Descrições morfológicas das larvas de Minuca rapax
Estágio Zoea I (Fig. 2A)
Carapaça (Fig. 2A): Globosa e lisa com 1 par de cerdas simples posterodorsais. Espinho dorsal presente e fortemente curvado. Espinho rostral ligeiramente curvado, ultrapassando a antena. Olhos sésseis.
Antênula (Fig. 3A): Unirreme, cônica e não segmentada com 2 estetos e 2 cerdas simples desiguais.
Antena (Fig. 3G): Protopodito bem desenvolvido com 2 fileiras de pequenos espinhos. Exópodo com cerca de 1/3 do comprimento do protopodito, com 3 cerdas simples terminais desiguais.
Mandíbulas (Fig. 4A): Simétrica, palpo ausente, processo incisivo com um dente proeminente seguido por uma fileira de dentes pequenos de tamanho desigual e dois dentes dispostos separadamente na margem interna. Processo molar com um dente grande na base e regiões circulares providas de dentes pequenos e irregulares.
Maxílula (Fig. 5A): Endito coxal com 4 (3 plumodenticuladas + 1 simples subterminal) cerdas e 1 cerda plumosa subterminal lateral. Endito basal com 2 cerdas cuspidatas e 3 cerdas plumodenticuladas (2 subterminais). Endópodo com 2 segmentos, com o segmento proximal sem cerdas e 4 cerdas pouco paposas terminais no segmento distal.
Maxila (Fig. 6A): Endito coxal bilobado com 4 cerdas (3 subterminais) + 3 cerdas (1 similar a hamate) plumosas. cerdas. Endito basal bilobado com 5 cerdas (1 subterminal) + 4 cerdas (1 subterminal) plumosas. Endópodo bilobado com 1 + 2 cerdas pouco paposas. Escafognatito com 4 cerdas plumosas marginais e um longo processo distal com microtríquias.
Primeiro maxilípede (Fig. 7A): Base com 2 + 2 + 3 + 2 pouco paposas na margem interna. Endópodo 5-segmentado com 2 cerdas pouco paposas, 2 cerdas (1 pouca paposa e 1 simples), 1 cerda pouco paposa, 2 cerdas pouco paposas, 5 cerdas (4 pouca paposas e 1 simples lateral), do segmento proximal para o distal.; exópodo 2-segmentado com 4 longas cerdas natatórias plumosas terminais.
Segundo maxilípede (Fig. 8A): Base com 1 + 1 + 1 + 1 cerdas pouco paposas na margem interna. Endópodo 3-segmentado com 0, 0, 5 cerdas (2 simples + 2 pouco paposas + 1 denticulada), do segmento proximal para o distal. Exópodo com 2 segmentos e 4 longas cerdas natatórias plumosas terminais.
Abdômen e telson (Fig. 9A): Com 5 somitos e telson. Somitos 2 e 3 com um par de espinhos dorsolaterais. Somitos 2-5 com um par de pequenas cerdas simples posterodorsal. Pleópodos ausentes. Telson bifurcado, com 1 diminuto espinho lateral. Margem interna com 6 (3 + 3) cerdas plumodenticuladas separadas por um arco medial.
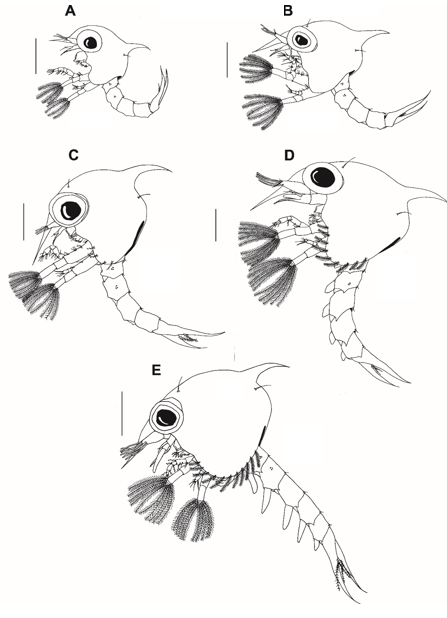
Fig. 2: Estágios larvais de zoea do caranguejo violinista Minuca rapax. Vista lateral: A = zoea I; B = zoea II; C = zoea III; D = zoea IV; E = zoea V. Barra de escala: A–D = 0.5 mm; E = 0.75 mm.
Estágio Zoea II (Fig. 2B)
Carapaça (Fig. 2B): Com um par de cerdas anterodorsal e um par de cerdas posterodorsal. Olhos levemente estriados.
Antênula (Fig. 3B): Exópodo com 3 longos estetos e 2 cerdas simples de tamanho desigual.
Antena (Fig. 3H): Inalterada.
Mandíbulas (Fig. 4B): Inalteradas.
Maxílula (Fig. 5B): Endito coxal com 4 cerdas plumodenticuladas e 1 cerda plumosa lateral subterminal. Endito basal com 2 cerdas cuspidatas e 5 cerdas plumodenticuladas (2 subterminais). O exópodo está presente como uma longa cerda plumosa marginal.
Maxila (Fig. 6B): Endito coxal bilobado, com 4 + 3 cerdas plumosas. Endito basal bilobado com 5 + 4 cerdas plumosas. Escafognatito com 8 cerdas plumosas (últimas 3 cerdas reduzidas em tamanho).
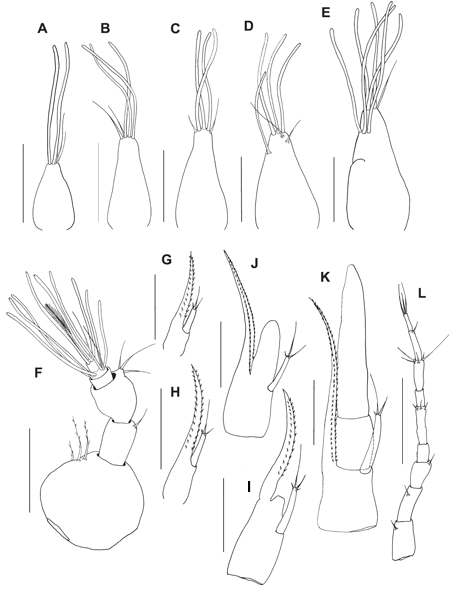
Fig. 3. Antênula e antena dos estágios larvais (zoea I–V e megalopa) do caranguejo violinista Minuca rapax. Antênula: A = zoea I; B = zoea II; C = zoea III; D = zoea IV; E = zoea V; F = megalopa. Antena: G = zoea I; H = zoea II; I = zoea III; J = zoea IV; K = zoea V; L = megalopa. Barra de escala: A – E e G – K = 0,08 mm; F e L = 0,15 mm.
Primeiro maxilípede (Fig. 7B): Base com 2 cerdas pouco paposas + 2 cerdas simples + 3 cerdas (2 pouco paposas e 1 simples) + 2 cerdas simples. Endópodo 5-segmentado com 2 cerdas (1 pouca paposa e 1 simples), 2 cerdas (1 pouca paposa e 1 simples), 1 cerda pouco paposa, 2, 5 cerdas simples, do segmento proximal para o distal. Exópodo com 6 longas cerdas natatórias plumosas terminais.
Segundo maxilípede (Fig. 8B): Base com 1 cerda pouco paposa + 1 + 1 + 1 cerdas simples. Endópodo com 4 cerdas simples e 1 cerda denticulada no segmento distal. Exópodo com 6 longas cerdas natatórias plumosas terminais.
Abdômen e telson (Fig. 9B): Primeiro somito com 1 cerda simples dorsal. Telson sem espinho.
Estágio Zoea III (Fig. 2C)
Carapaça (Fig. 2C): Com 4 cerdas pouco paposas em cada margem ventral.
Antênula (Fig. 3C): Inalterada.
Antena (Fig. 3I): Endópodo presente como pequeno broto. Exópodo com 3 cerdas simples desiguais e 1 pequeno espinho.
Mandíbula (Fig. 4C): Processo incisivo com 3 dentes espaçados e dispostos na margem interna.
Maxílula (Fig. 5C): Inalterada.
Maxila (Fig. 6C): Escafognatito com 12 cerdas plumosas (últimas 4 cerdas reduzidas em tamanho).
Primeiro maxilípede (Fig. 7C): Base com 2 cerdas pouco paposas + 2 cerdas (1 pouco paposa e 1 simples) + 3 (1 pouco paposa e 2 simples) + 2 cerdas simples. Endópodo com 2 cerdas (1 pouco paposa e 1 simples), 2 cerdas (1 pouco paposa e 1 simples), 1 cerda pouco paposa, 2, 6 cerdas simples, do segmento proximal para o distal. Exópodo com 8 longas cerdas natatórias plumosas terminais.
Segundo maxilípede (Fig. 8C): Endópodo com 2 cerdas simples + 2 cerdas pouco paposas (na maioria das larvas analisadas) e 1 cerda denticulada no segmento distal. Exópodo com 8 longas cerdas natatórias plumosas terminais.
Abdômen e telson (Fig. 9C): Com 6 somitos. Telson inalterado.
Estágio IV da zoea (Fig. 2D)
Carapaça (Fig. 2D): Com 9 cerdas plumosas em cada lado da margem ventral.
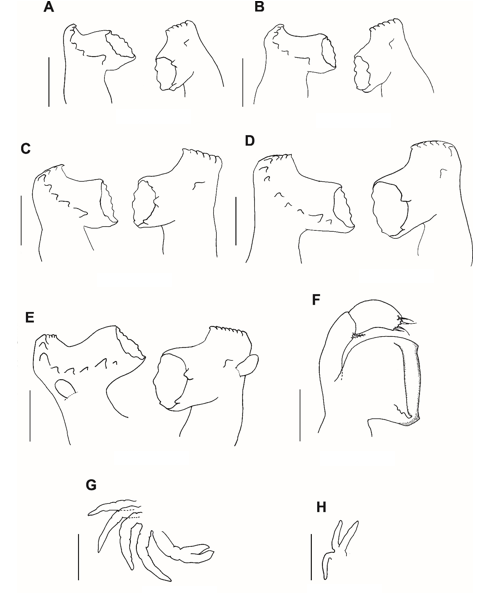
Fig. 4. Mandíbula dos estágios larvais (zoea I–V e megalopa) do caranguejo violinista Minuca rapax. A = zoea I; B = zoea II; C = zoea III; D = zoea IV; E = zoea V; F = megalopa; G = quelípodo e pereiópodos (zoea V); H = terceiro maxilípede (zoea V). Barra de escala: A – E e G – H = 0,05 mm; F = 0,1 mm.
Antênula (Fig. 3D): Com 1 esteto subterminal + 3 longos estetos terminais e 2 cerdas simples.
Antena (Fig. 3J): Endópodo mais desenvolvido, mais longo que o exópodo.
Mandíbula (Fig. 4D): Processo incisivo com 4 dentes espaçados. Processo molar com dois dentes desiguais na base.
Maxílula (Fig. 5D): Endito coxal com 4 cerdas plumodenticuladas + 1 cerda simples subterminal e 1 cerda plumosa lateral subterminal. Endito basal com 3 cerdas cuspidatas + 6 cerdas plumodenticuladas (3 subterminais) e 1 cerda plumosa lateral subterminal. Base do exópodo com 1 cerda pouco paposa (epípode).
Maxila (Fig. 6D): Endito coxal bilobado com 5 + 3 cerdas plumosas. Endito basal bilobado com 5 cerdas (1 plumodenticulada e 4 plumosas) + 5 cerdas plumosas. Escafognatito com 16 cerdas plumosas marginais.
Primeiro maxilípede (Fig. 7D): Base com 2 cerdas (1 pouco paposa e 1 simples) + 2 cerdas (1 pouco paposa e 1 simples) + 3 (1 pouco paposa e 2 simples) + 2 cerdas simples. Exópodo com 10 longas cerdas natatórias plumosas terminais.
Segundo maxilípede (Fig. 8D): Endópodo semelhante ao estágio anterior. Exópodo com 10 longas cerdas natatórias plumosas terminais.
Abdômen e telson (Fig. 9D): Primeiro somito abdominal com 3 cerdas simples. Pleópodos se apresentam em forma de botão. Telson com 1 par adicional de pequenas cerdas simples na margem média.
Estágio V da zoea (Fig. 2E)
Carapaça (Fig. 2E): Com 11 cerdas plumosas em cada margem ventral.
Antênula (Fig. 3E): Exópodo com 3 longos estetos subterminais + 3 terminais e 1 cerda simples terminal. Endópodo presente como um pequeno botão.
Antena (Fig. 3K): Endópodo com 2 segmentos bem desenvolvidos, ultrapassando o protópodo. Exópodo com 2 cerdas simples de tamanho desigual e um pequeno espinho.
Mandíbula (Fig. 4E): Palpo presente como botão.
Maxílula (Fig. 5E): Extremidade coxal com 6 cerdas plumodenticuladas (1 lateral subterminal) + 2 cerdas simples subterminais e 1 cerda plumosa lateral subterminal. Extremidade basal com 3 cerdas cuspidatas + 10 plumodenticuladas (6 subterminais) e 1 cerda plumosa lateral subterminal.
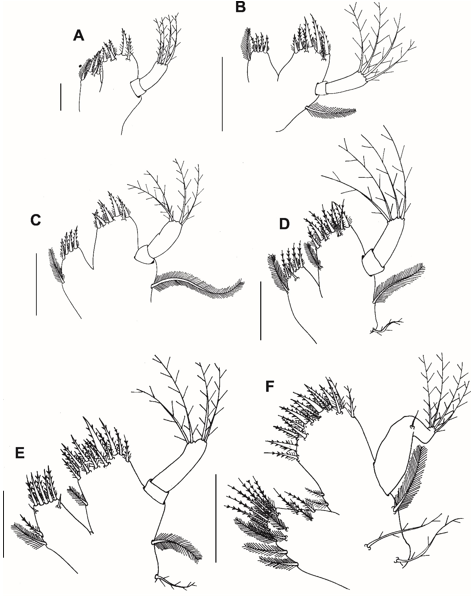
Fig. 5. Maxílula dos estágios larvais (zoea I–V e megalopa) do caranguejo violinista Minuca rapax. A = zoea I; B = zoea II; C = zoea III; D = zoea IV; E = zoea V; F = megalopa. Barra de escala: A – B e D – F = 0,08 mm; C = 0,15 mm.
Maxila (Fig. 6E): Endito coxal bilobado com 8 + 5 (1 lateral subterminal) cerdas plumosas. Endito basal bilobado com 7 cerdas (1 plumodenticulada e 6 plumosas) + 6 cerdas (1 simples, 1 plumodenticulada e 4 plumosas). Escafognatito com 27 cerdas plumosas marginais.
Primeiro maxilípede (Fig. 7E): Coxa com 2 cerdas pouco paposas. Base com 4 cerdas (2 pouco paposas e 2 simples) + 4 cerdas (1 pouco paposa e 3 simples) + 3 cerdas (1 pouco paposa e 2 simples). Endópodo com 2 cerdas (1 pouco paposa e 1 simples), 3 cerdas (2 pouco paposas e 1 simples), 2 cerdas pouco paposas, 2 cerdas simples, 6 cerdas (1 pouco paposa e 5 simples), do segmento proximal para o distal.
Segundo maxilípede (Fig. 8E): Base com 1 + 1 (simples) + 1 + 1 cerdas pouco paposas.
Terceiro maxilípede (Fig. 4H): Presente e rudimentar.
Quelípodo e pereiópodos (Fig. 4G): Presentes e rudimentares.
Abdômen e telson (Fig. 9E): Primeiro somito com 6 cerdas dorsais (2 pouco paposas e 4 simples).
Pleópodos (Fig. 9H–L): Mais desenvolvidos quando comparados ao estágio anterior.
Estágio megalopal (Fig. 10A)
Carapaça (Fig. 10A): Subrectangular, lisa, mais longa que larga. Espinho rostral agudo e alongado defletido para baixo no lado ântero-ventral, não visível dorsalmente; 12 cerdas regularmente dispostas na margem posterior.
Antênula (Fig. 3F): Pedúnculo 3-segmentado com 3 cerdas pouco paposas, 1 cerda simples, 0, respectivamente. Endópodo não desenvolvido com 3 cerda simples. Exópodo com 3 segmentos, com 0, 6, 2 estetos, respectivamente, e 0, 1, 1 cerdas simples + 1 cerda plumosa, respectivamente.
Antena (Fig. 3L): Pedúnculo 3-segmentado com 1, 1, 1 cerdas simples, respectivamente. Flagelo 7-segmentado, segmentos 2-3 incompletamente segmentados (em alguns indivíduos bem segmentados) com 0, 0, 3, 0, 5, 1, 3 cerdas simples terminais, respectivamente.
Mandíbula (Fig. 4F): Com uma lâmina bem desenvolvida, palpo 2-segmentado com 1 pequena cerda pouco paposa no segmento proximal e 4 pequenas cerdas simples no segmento distal.
Maxilula (Fig. 5F): Endito coxal com 9 cerdas plumodenticuladas (3 laterais subterminais), 6 cerdas plumosas subterminais (4 laterais). Endito basal com 7 cerdas cuspidatas, 7 cerdas plumodenticuladas, 2 cerdas pouco paposas e 2 cerdas plumosas laterais subterminais. Endópodo não segmentado com 1 cerda medial simples e 4 cerdas pouco paposas. Base com 2 cerdas pouco paposas e 1 cerda plumosa.
Maxila (Fig. 6F): Endito coxal bilobado com 7 cerdas plumosas e 7 cerdas simples (3 subterminais e 4 terminais) + 6 cerdas plumosas e 1 cerda simples. Endito basal bilobado com 7 cerdas simples, 2 cerdas plumosas e 1 cerda plumodenticulada + 8 cerdas simples e 2 cerdas plumosas. Endópodo não segmentado com 2 cerdas pouco paposas (1 terminal e 1 subterminal) + 1 cerda simples subterminal. Escafognatito com 43 cerdas plumosas marginais e 3 cerdas simples laterais.
Primeiro maxilípede (Fig. 7F): Extremidade coxal com 6 cerdas simples e 1 cerda pouco paposa. Endito basal com 14 cerdas simples. Endópodo não segmentado com 2 cerdas simples subterminais. Exópodo com 2 segmentos, com 2 curtas cerdas plumosas no segmento proximal e 5 cerdas plumosas mais longas no segmento distal. Epipodito com 6 longas cerdas simples.
Segundo maxilípede (Fig. 8F): Coxa e base indistintamente diferenciadas com 2 cerdas simples. Endópodo 4-segmentado com 0, 1 cerda pouco paposa, 4 cerdas (2 plumodenticuladas + 2 simples) e 6 cerdas plumodenticuladas. Exópodo com 2 segmentos, segmento proximal com 1 curta cerda simples medial, segmento distal com 6 longas cerdas plumosas terminais. Epipodito reduzido e desprovido de cerdas.
Terceiro maxilípede (Fig. 10B): Coxa e base fundidas e lisas. Endópodo 5-segmentado com 11 cerdas (1 plumodenticulada + 10 simples), 8 cerdas (1 serrata + 7 simples), 4 cerdas simples, 5 cerdas (3 plumodenticuladas + 2 simples), 6 cerdas plumodenticuladas, do segmento proximal para o distal. Exópodo com 2 segmentos, segmento proximal com 1 curta cerda simples medial, segmento distal com 5 cerdas longas plumosas terminais. Epipodito alongado, com 3 curtas + 4 longas cerdas plumosas no segmento medial e 16 longas cerdas simples na porção distal.
Quelípodo (Fig. 10C): Iguais em tamanho e sem dentes. A base tem 1 pequena cerda simples. Ísquio com 1 pequena cerda simples. Mero liso. Carpo com 2 pequenas cerdas simples. Própodo e dáctilo com algumas cerdas simples irregulares, conforme ilustrado.
Pereiópodos 2, 3 e 4 (Fig. 10D–F): Dáctilo dos 2°, 3° e 4° pereiópodos com 1 pequeno espinho subterminal.
Pereiópodo 5 (Fig. 10G): Dáctilo com 3 longas cerdas curvas e serrilhadas e 1 pequena cerda simples subterminal.
Abdômen e telson (Fig. 9F-G): Somitos (do proximal ao distal) com 0, 4, 6, 8, 8, 2 cerdas simples. Telson subquadrado com 2 pares de cerdas simples dorsais e 6 cerdas plumodenticuladas terminais na margem posterior.
Pleópodos 1–4 (Fig. 10H-K): Endópodos não segmentados com 3 ganchos de acoplamento na margem interna. Exópodos 1-4 com 15, 15, 15, 14 cerdas natatórias plumosas marginais, respectivamente.
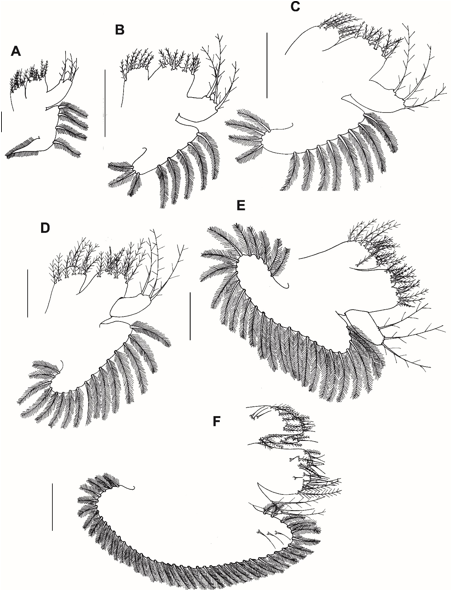
Fig. 6. Maxila dos estágios larvais (zoea I-V e megalopa) do caranguejo violinista Minuca rapax. A = zoeaI; B = zoeaII; C = zoeaIII; D = zoeaIV; E = zoea V; F = megalopa. Barra de escala: A – B e D – F = 0,08 mm; C = 0,15 mm.
Urópodo (Fig. 10L): 2 segmentos sem endópodo, exópodo com 1 cerda plumosa no segmento proximal e 7 cerdas natatórias plumosas no segmento distal.
CONSIDERAÇÕES FINAIS
O desenvolvimento larval das espécies de caranguejos chama-marés não foi amplamente estudado no passado e, portanto, existem poucos dados sobre a morfologia dos estágios larvais (RABALAIS; CAMERON, 1983; ANGER et al., 1990; RIEGER, 1997, 1998). Em geral, as espécies de caranguejos violinistas são muito difíceis de serem cultivadas em laboratório ao longo de todos os estágios larvais e como resultado disso, há poucos estudos sobre seu completo desenvolvimento até o estágio megalopal. Esse fato possivelmente se deve ao tamanho reduzido dos estágios larvais iniciais dessas espécies. Apesar disso, o cultivo bem sucedido de espécies brasileiras foi relatado por Anger et al. (1990), Rieger (1996, 1997, 1998, 1999) e Martins (2018); incluindo a espécie cultivada no presente estudo, 7 das 10 espécies encontradas nos manguezais brasileiros já tiveram seu desenvolvimento morfológico completo descrito.
Estudos anteriores revelaram variações entre as larvas de caranguejos-violinistas quanto ao número de estágios larvais, mas a maioria tem de 5 a 6 estágios (Tabela 1). Por outro lado, cultivos de laboratório, incluindo os descritos no presente estudo, demonstraram que algumas zoeas pertencentes à mesma espécie são capazes de antecipar a metamorfose para o estágio megalopal, enquanto outras larvas continuam com 1 ou 2 estágios adicionais de zoeas, como as observadas em L. uruguaensis e M. vocator que geram 4, 5, 6 zoeas (RIEGER, 1996, 1999), M. mordax (RIEGER, 1997) e L. leptodactyla (MARTINS, 2018) com 5, 6 zoeas.
Entretanto, esses estágios adicionais observados em caranguejos têm sido associados à combinação desfavorável de temperatura e salinidade (ANGER, 2001; NEGREIROS-FRANSOZO et al., 2009). O desenvolvimento lecitotrófico já foi observado em caranguejos violinistas, onde foi detectado um ciclo larval abreviado constituído por apenas dois estágios para L. subcylindrica (RABALAIS; CAMERON, 1983).
De acordo com esses autores, o ciclo larval abreviado confere uma vantagem aos caranguejos, que podem se reproduzir em áreas efêmeras, e oferece à espécie a vantagem de poder sobreviver em ambientes semiáridos.
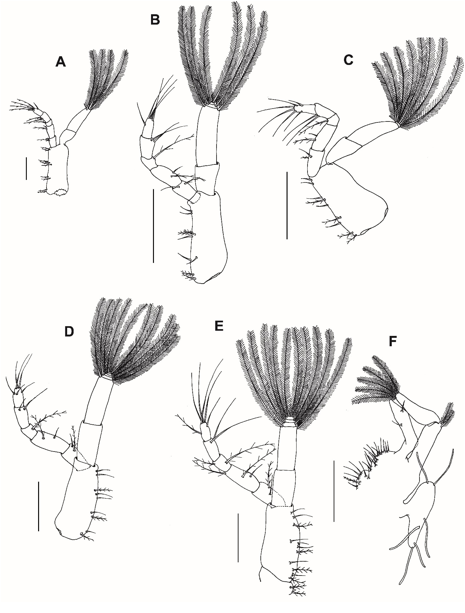
Fig. 7. Primeiro maxilípede dos estágios larvais (zoea I-V e megalopa) do caranguejo violinista Minuca rapax. A = zoeaI; B = zoeaII; C = zoeaIII; D = zoeaIV; E = zoea V; F = megalopa. Barra de escala: A e C = 0,15 mm; B, D, E = 0,11 mm; F = 0,08 mm.
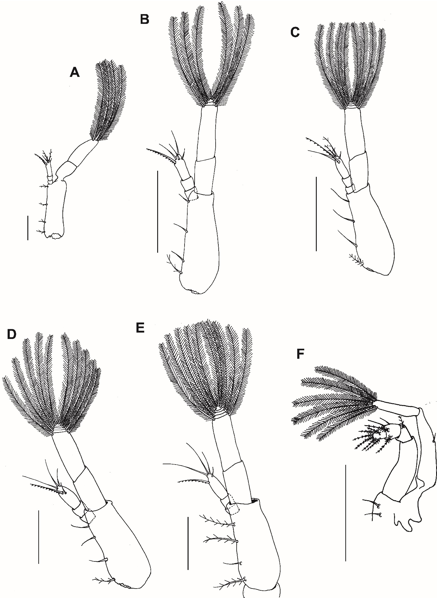
Fig. 8. Segundo maxilípede dos estágios larvais (zoea I-V e megalopa) do caranguejo violinista Minuca rapax. A = zoeaI; B = zoeaII; C = zoeaIII; D = zoea IV; E = zoea V; F = megalopa. Barra de escala: A e C = 0,15 mm; B, D, E = 0,11 mm; F = 0,3 mm.

Fig. 9. Abdômen e telson dos estágios larvais (zoea I-V e megalopa) do caranguejo violinista Minuca rapax. Vista dorsal: A = zoea I; B = zoea II; C = zoea III; D = zoea IV; E = zoea V; F = megalopa. Vista lateral: G = megalopa. H-L = pleópodos (zoea V). Barra de escala: A – G = 0,3 mm; H – L = 0,15 mm.
No cultivo de caranguejos violinistas em laboratório, foi observada uma variação considerável no período entre-mudas das espécies que habitam os manguezais brasileiros. O período entre-mudas pode ter uma duração de apenas algumas horas (por exemplo, L. subcylindrica: RABALAIS; CAMERON, 1983) ou pode durar vários dias (por exemplo, L. uruguayensis, M. mordax, M. burguesi e M. vocator) (RIEGER, 1996, 1997, 1998, 1999). Entretanto, os períodos entre-mudas da maioria das larvas zoea foram detectadas uma variação de 2 a 5 dias, com algumas exceções, principalmente nos estágios mais avançados (Tabela 1).
Pérez (1980) relatou que experimentos sobre a dieta melhoraram a taxa de sobrevivência das larvas de M. pugnax. Durante o presente experimento, o autor avaliou a combinação de itens alimentares, como diatomáceas e rotíferos para os estágios larvais iniciais, e a utilização de Artemia a partir do estágio ZIII. Esse método foi posteriormente seguido por Ko e Kim (1989), Rabalais e Cameron (1983), Rieger (1996, 1997, 1998, 1999), Rodríguez e Jones (1993). O mesmo procedimento de alimentação também foi usado com sucesso na criação de M. rapax, o que demonstra a viabilidade da aplicação desses padrões de alimentação para os caranguejos violinistas em culturas de laboratório.
Em relação à duração do período larval até o estágio megalopal, o cultivo de M. rapax mostrou similaridade em relação ao observado para L. thayeri (ANGER et al., 1990), pois o parâmetro da duração para M. rapax ficou compreendido na faixa de 10 a 14 dias. A maior diferença na duração da cultura larval foi demonstrada por U. subcylindrica, que apresentou um período larval abreviado (dentro de 2,5 dias) devido ao comportamento lecitotrófico demonstrado por essa espécie até o estágio de megalopa (RABALAIS; CAMERON, 1983).
Em termos quantitativos, podemos inferir que a taxa de 100% de sobrevivência para o estágio de megalopa (Figura 1), obtido no presente estudo, foi superior a todos os trabalhos descritos na literatura, envolvendo caranguejos violinistas.
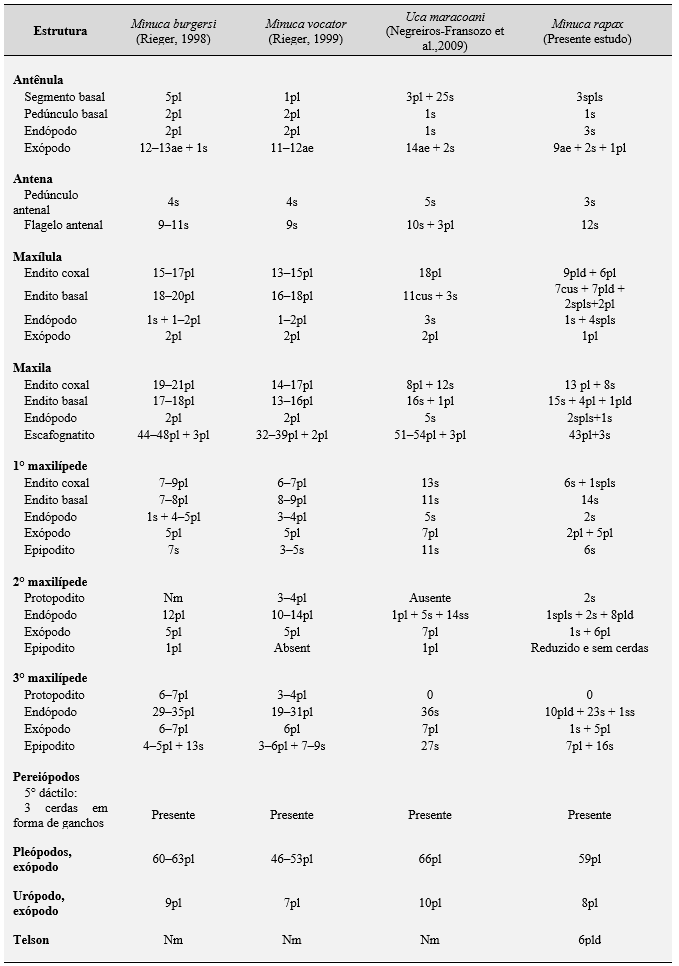
Morfologicamente, a análise comparativa das características dos apêndices encontrados na zoea I de U. rapax é semelhante à descrita anteriormente para essa espécie por Serbino (2008b). Portanto, foram encontradas semelhanças estreitas no número de cerdas entre quase todos os apêndices larvais, exceto no número de cerdas no lobo proximal da extremidade basal da maxila e na base do 1° maxilípede (Tabela 2).
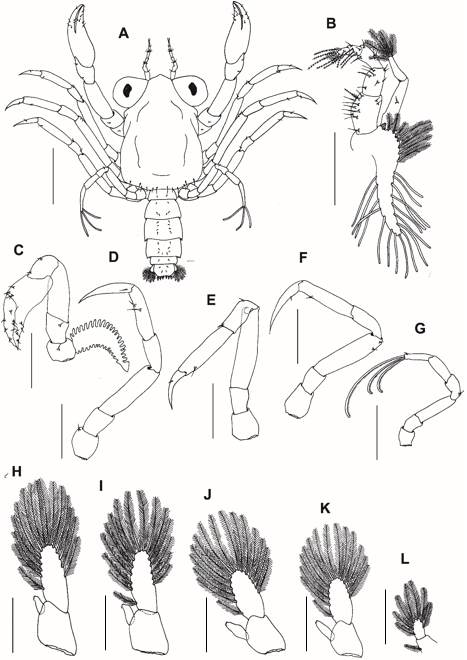
Fig. 10. Estágio megalopal do caranguejo violinista Minuca rapax. A = Vista dorsal; B = terceiro maxilípede; C = quelípodo; D-G = segundo ao quinto pereiópodo; apêndices abdominais: H-K = primeiro ao quarto pleópodo; L = urópodo. Barra de escala: D – G = 0,3 mm; H – L = 0,15 mm.
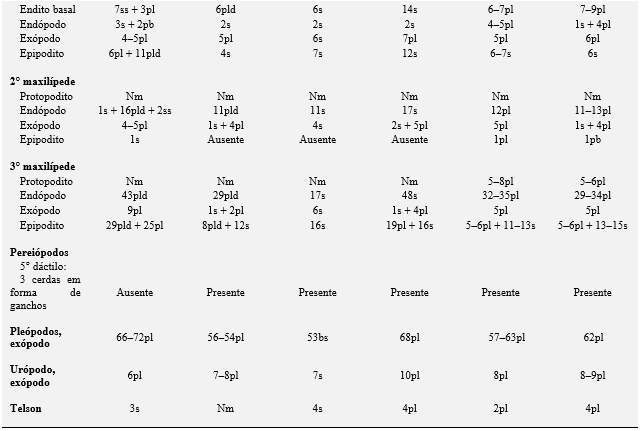
As comparações com outras descrições do desenvolvimento morfológico de caranguejos violinistas (Tabela 3) apontaram que existem muitas características comuns durante os primeiros estágios larvais zoeas, tais como: ausência dos 3° maxilípedes, o número de cerdas dispostas no telson e nos exópodo dos 1° e 2° maxilípedes. As exceções a isso são encontradas em U. subcylindrica (RABALAIS; CAMERON, 1983), no entanto, essa espécie eclode larvas com desenvolvimento avançado e apresentando comportamento lecitotrófico.
Outra diferença importante no primeiro estágio larval é a presença ou ausência de espinhos laterais na carapaça. Essa estrutura está ausente em U. rapax e em todas as espécies de chama-marés descritas, exceto em U. maracoani e Afruca tangeri, que são encontradas apenas na Europa Ocidental (RODRÍGUEZ; JONES, 1993). De acordo com Negreiros-Fransozo et al. (2009), a presença de espinhos laterais pode ser útil na identificação de larvas da família Ocypodidae do sudoeste do Atlântico, pois somente a zoea I de Ocypode quadrata e U. maracoani têm essas características. Rieger (1996, 1997, 1998, 1999) também concorda que a presença ou ausência dos espinhos laterais na carapaça das larvas de Ocypodidae pode ser considerada um critério importante para a diferenciação morfológica entre Uca e Ucides. Morgan (1990, 1992) menciona que as projeções ou espinhos laterais na carapaça são características morfológicas que aumentam a capacidade de natação, ajudam na dispersão e no recrutamento e também desempenham um papel importante na antipredação e na recepção de impulsos sensoriais da espécie.
O estágio de megalopa de M. rapax apresenta características morfológicas que as diferenciam de outras espécies de caranguejos violinistas descritas. Essas diferenças são: os arranjos do segmento basal e na segmentação do exópodo da antênula; a segmentação do flagelo antenal, a setação da extremidade basal da maxila; o exópodo do 1° e do 2° maxilípedes (Tabela 4).
Essas diferenças parecem ser muito úteis para distinguir as larvas da família Ocypodidae, entretanto, tais fatos sugerem fortemente que são necessários mais estudos moleculares e de relações filogenéticas e para esclarecer essas diferenças morfológicas.
REFERÊNCIAS BIBLIOGRÁFICAS
ANGER, K. The biology of Decapod Crustacean Larvae. In: VONK, R. Crustacean Issues 14. Lisse: A. A. Balkema Publishers, 2001. p. 109 – 144.
ANGER, K.; MONTÚ, M.; BAKKER, C.; LOUREIRO FERNANDES, L. L. Desenvolvimento larval de Uca thayeri Rathbun, 1900 (Decapoda: Ocypodidae) criado em laboratório. Meeresforschung, v. 32, p. 276 – 294, 1990.
BATISTELLI, N. M. Descrição morfológica e aspectos evolutivos larvais em Ocypodidae e grupos relacionados (Decapoda: Brachyura). 2003. 134f. Dissertação (Mestrado) – Curso de Pós-Graduação em Ciências Biológicas, Área de Concentração em Zoologia, Instituto de Biociências de Botucatu, Universidade Estadual Paulista, Botucatu, São Paulo, 2003.
CLARK, P. F.; CALAZANS, D. K; POHLE, G. W. Accuracy and standardization of brachyuran larval descriptions. Invertebrate Reproduction & Development, v. 33, n. 2-3, p. 127 – 144, 1998.
CRANE, J. Fiddler crabs of the world: Ocypodidae: Genus Uca. New Jersey: Princeton University Press, 1975. 736 p.
DO ROSÁRIO, T. N.; ABRUNHOSA, F. A.; DE SOUZA, A. S. Descrição do primeiro estágio larval (zoea I) do caranguejo chama-maré Leptuca cumulanta (Crane, 1943) (Ocypodidae: Gelasiminae) da Região Amazônica. In: Engenharia de pesca: Aspectos teóricos e práticos. Editora Científica Digital, 2021. p. 138 – 146.
FACTOR, J. R. Morphology of the mouthparts of larval lobsters, Homarus americanus (Decapoda: Nephropidae), with special emphasis on their setae. The Biological Bulletin, v. 154, n. 3, p. 383 – 408, 1978.
FEEST, J. Morphophysiological studies on the ontogeny and sexual biology of Uca annulipes and Uca triangularis as compared to Ilyoplax gangetica. Forma et Function, v. 1, p. 159 – 225, 1969.
GARM, A. Revising the definition of the crustacean seta and setal classification systems based on examinations of the mouthpart setae of seven species of decapods. Zoological Journal of the Linnean Society, v. 142, n. 2, p. 233 – 252, 2004.
GHORY, F. S.; SIDDIQUI, F. A. A comparative study of the first zoeal stage of Uca urvillei and Uca annulipes (Crustacea: Brachyura: Ocypodidae) reared in the laboratory. Turkish Journal of Zoology, v. 30, n. 2, p. 161 – 166, 2006.
HORN, A. C. M.; BUCKUP, L. Morfologia setal de Parastacus brasiliensis (von Martens) (Crustacea, Decapoda, Parastacidae). Revista brasileira de Zoologia, v. 21, n. 4, p. 765 – 768, 2004.
HYMAN, O. W. The development of Gelasimus after hatching. Journal of Morphology, v. 33, n. 2, p. 484 – 525, 1920.
KO, H. S.; KIM, C. H. Complete larval development of Uca arcuata (Crustacea, Brachyura, Ocypodidae) reared in the laboratory. The Korean Journal of Systematic Zoology, v. 5, n. 2, p. 89 – 105, 1989.
KOCH, V.; WOLFF, M. Energy budget and ecological role of mangrove epibenthos in the Caeté estuary, North Brazil. Marine Ecology Progress Series, v. 228, p. 119 – 130, 2002.
KOCH, V.; WOLFF, M.; DIELE, K. Comparative population dynamics of four fiddler crabs (Ocypodidae, genus Uca) from a North Brazilian mangrove ecosystem. Marine Ecology Progress Series, Bremen, v. 291, p. 177 – 188, 2005.
KUMAR, A. A. J.; AL-AIDAROOS, A. M. Larval development of the mangrove fiddler crab Austruca albimana (Kossmann, 1877) (Crustacea: Brachyura: Ocypodidae) under laboratory conditions. Zoological Studies, v. 61, n. 70, p, 1 – 23, 2022.
MARTINS, S. B. Estratégia reprodutiva e variabilidade morfológica e genética dos caranguejos chama-maré Leptuca leptodactyla (Rathbun, 1898) e Minuca mordax (Smith, 1870) (Crustacea, Decapoda, Ocypodidae) ao longo da costa do Brasil. 2018. Tese de Doutorado. PhD thesis, Curitiba, Brazil: Federal University of Paraná, 2018.
MELO, G. A. S. Manual de identificação dos Brachyura (Caranguejos e Siris) do litoral brasileiro. São Paulo: Plêiade/FAPESP, 1996. 604 p.
MORGAN, S. G. Impact of planktivorous fishes on dispersal, hatching, and morphology of estuarine crab larvae. Ecology, v. 71, n. 5, p. 1639 – 1652, 1990.
MORGAN, S. G. Predation by planktonic and benthic invertebrates on larvae of estuarine crabs. Journal of Experimental Marine Biology and Ecology, v. 163, n. 1, p. 91 – 110, 1992.
MURAOKA, K. The post-larval development of Uca lactea (de Haan) and Macrophthalmus (Mateotis) japonicus (de Haan) (Crustacea, Brachyura, Ocypodiae). Zoological Magazine (Japan), v. 85, n. 1, p. 40 – 51, 1976.
NEGREIROS-FRANSOZO, M. L.; HIROSE, G. L.; JÚNIOR, E. A. B. First zoeal stage and megalopa of Uca (Uca) maracoani (Decapoda: Brachyura), with comments on the larval morphology of South-American species of Ocypodidae. Journal of Crustacean Biology, v. 29, n. 3, p. 364 – 372, 2009.
PÉREZ, L. A. V. Desenvolvimento embrionário e larval de Uca pugnax (Smith, 1870) (Crustacea, Brachyura, Ocypodidae) em laboratório. 1980. 79 f. Dissertação (Mestrado) – Curso de Ecologia de Ecossistemas Costeiros e Estuarinos, Departamento de Oceanografia Biológica, Instituto Oceanográfico da Universidade de São Paulo, São Paulo, 1980.
POHLE, G.; TELFORD, M. Morphology and classification of decapod crustacean larval setae: a scanning electron microscope study of Dissodactylus crinitichelis Moreira, 1901 (Brachyura: Pinnotheridae). Bulletin of Marine Science, v. 31, n. 3, p. 736 – 752, 1981.
RABALAIS, N. N.; CAMERON, J. N. Abbreviated development of Uca subcylindrica (Crustacea, Decapoda, Ocypodidae) reared in the laboratory. Journal of Crustacean Biology, v. 3, n. 4, p. 519 – 541, nov. 1983.
RIEGER, P. J. Desenvolvimento larval de Uca (Celuca) uruguayensis (Nobili, 1901) (Crustacea, Decapoda, Ocypodidae), em laboratório. Nauplius, Rio Grande do Sul, v. 4, p. 73 – 103, 1996.
RIEGER, P. J. Desenvolvimento larval de Uca (Minuca) mordax (Smith, 1870) (Crustacea, Decapoda, Ocypodidae), em laboratório. Trabalhos Oceanográficos da Universidade Federal Pernambuco, Recife, v. 25, p. 227 – 267, 1997.
RIEGER, P. J. Desenvolvimento larval de Uca (Minuca) burguersi (Holthuis, 1967) (Crustacea, Decapoda, Ocypodidae), em laboratório. Revista Brasileira de Zoologia, Curitiba, v. 15, n. 3, p. 727 – 756, 1998.
RIEGER, P. J. Desenvolvimento larval de Uca (Minuca) vocator (Herbst, 1804) (Crustacea, Decapoda, Ocypodidae) em laboratório. Nauplius, Rio Grande do Sul, v. 7, p. 1 – 37, 1999.
RIEGER, P. J.; SANTOS, A. L. F. Larval development of Chasmagnathus granulata Dana (Crustacea, Decapoda, Grapsidae) under laboratory conditions: I. study of setae morphology in the zoea and megalopae phases and the variations in body patterns of megalopae. Revista Brasileira de Zoologia, v. 18, n. 4, p. 1281 – 1317, 2001.
RODRÍGUEZ, A.; JONES, D. A. Larval development of Uca tangeri (Eydoux, 1835) (Decapoda: Ocypodidae) reared in the laboratory. Journal of Crustacean Biology, v. 13, n. 2, p. 309 – 321, 1993.
SERBINO, N. M. B. Descrição do primeiro estágio larval de Uca leptodactyla (Rathbun, 1898) (Brachyura: Ocypodidae). Revista Eletrônica Inter.Texto, v. 2, p. 42 – 52, 2008a.
SERBINO, N. M. B. Descrição do primeiro estágio larval de Uca rapax (SMITH, 1870) (Brachyura: Ocypodidade). Revista Eletônica Inter.Texto, v. 1, p. 6 – 15, 2008b.
SERBINO, N. M. B. Descrição do primeiro estágio larval de Uca vocans (Linnaeus, 1758) (Brachyura: Ocypodidae). Revista Eletrônica Inter.Texto, v. 2, p. 68 – 79, 2008c.
SERBINO, N. M. B. Descrição do primeiro estágio larval de Uca clorophthalmus (H. Milne edwards, 1852) (Brachyura: Ocypodidae). Revista Eletrônica Inter.Texto, v. 4, p. 65 – 76, 2009.
SHIH, H.-T., NG, P. K. L., DAVIE, P. J. F., SCHUBART, C. D., TÜRKAY, M., NADERLOO, R., JONES, D.; LIU, M.-Y. Systematics of the Family ocypodidae Rafinesque, 1815 (Crustacea: Brachyura), based on phylogenetic relationships, with a reorganization of subfamily rankings and a review of the taxonomic status of Uca Leach, 1914, sensu lato and its subgenera. Raffles Bulletin of Zoology, v. 64, p. 139 – 175, 2016.
SIMITH, D. J. B., PIRES, M. A. B., ABRUNHOSA, F. A., MACIEL, C. R.; DIELE, K. Is larval dispersal a necessity for decapod crabs from the Amazon mangroves? Response of Uca rapax zoeae to different salinities and comparison with sympatric species. Journal of Experimental Marine Biology and Ecology, v. 457, p. 22 – 30, 2014.
SOUZA, A. S. D.; COSTA, R. M. D.; ABRUNHOSA, F. A. Comparative morphology of the first zoea of twelve brachyuran species (Crustacea: Decapoda) from the Amazon region. Zoologia (Curitiba), v. 30, n. 3, p. 273 – 290, 2013.
TERADA, M. On the zoea larvae of five crabs of the family Ocypodidae. Zoological Magazine, v. 88, n. 1, p. 57 – 72, 1979.
TABELAS
Tabela 2. Características morfológicas e formula da setação dos estágios larvais de zoea e megalopa do caranguejo violinista Minuca rapax. Abreviações: s = cerda simples; ss = cerda serratas; ds = cerda denticulada; pl = cerda plumosa; pp = processo plumoso; spls = cerda pouco paposas; pld = cerda plumodenticulada; cus = cerda cuspidata; ae = esteto; seg = segmentado; sp = espinho; so = somito;
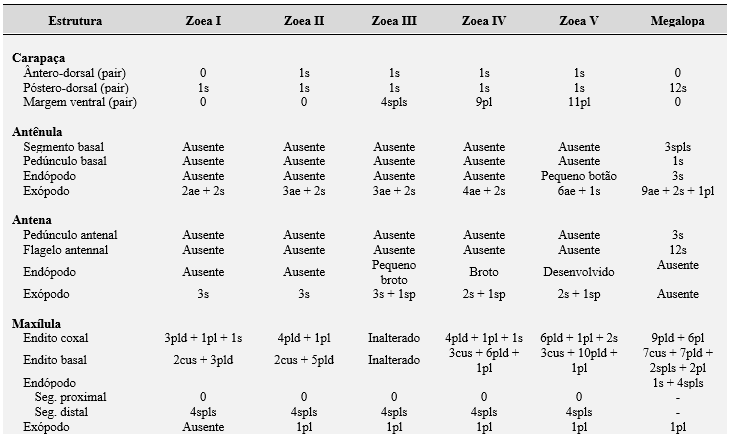
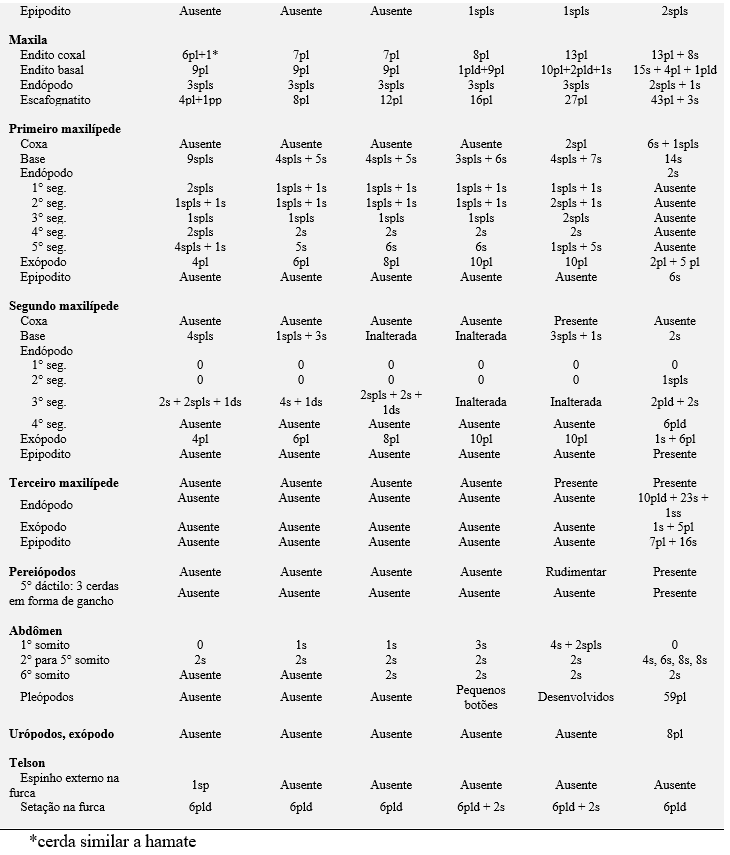
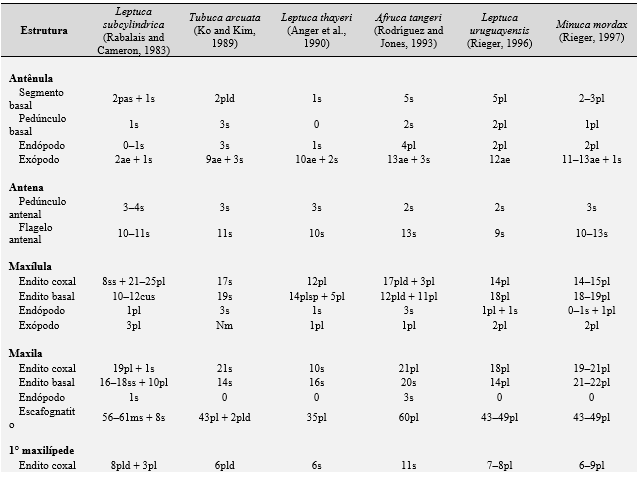
Tabela 3. Comparações morfológicas entre o primeiro estágio de zoea das espécies de caranguejos violinistas. ae = esteto; cus = cerda cuspidata; ds = cerda denticulada; pl = cerda plumosa; pld = cerda plumodenticulada; pldcus = cerda plumodenticulada cuspidata; pp = processo plumoso; s = cerda simples; ss = cerda serrata; sp = espinho; ssp = espinho serrilhado; plsp= espinho plumoso; ns = cerda natatória; mic = fileira de microtríquias; ms = cerda marginal; sps = cerda espinhosa; spls = cerda pouco plumosa; Nm = não mencionada; não descrita e ilustrada pelo autor.
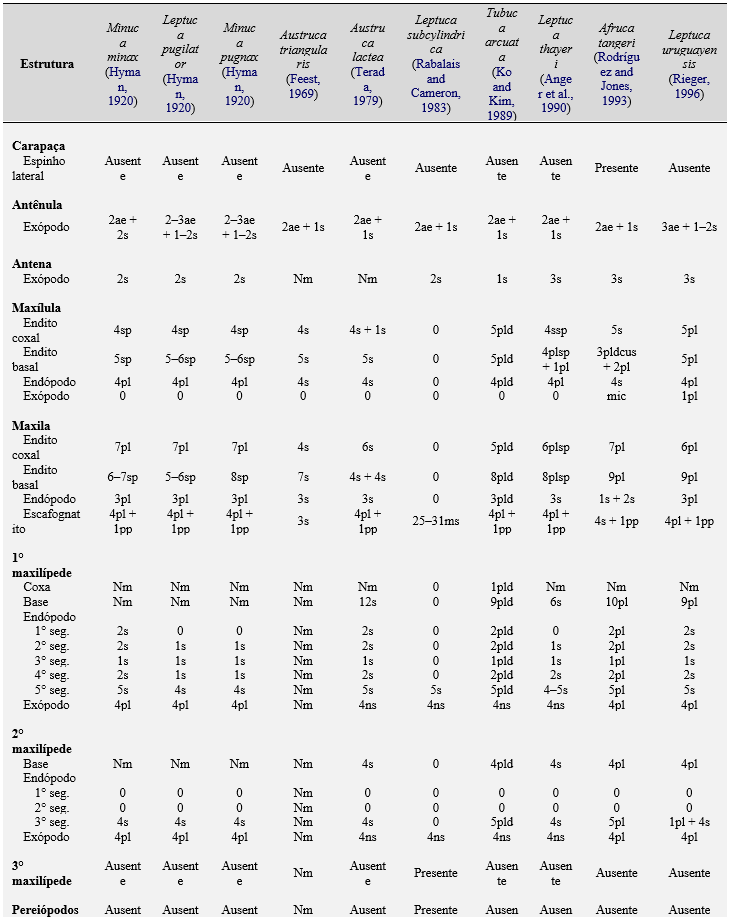
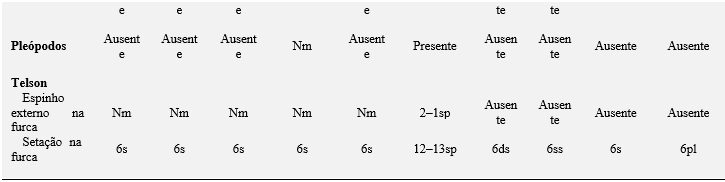
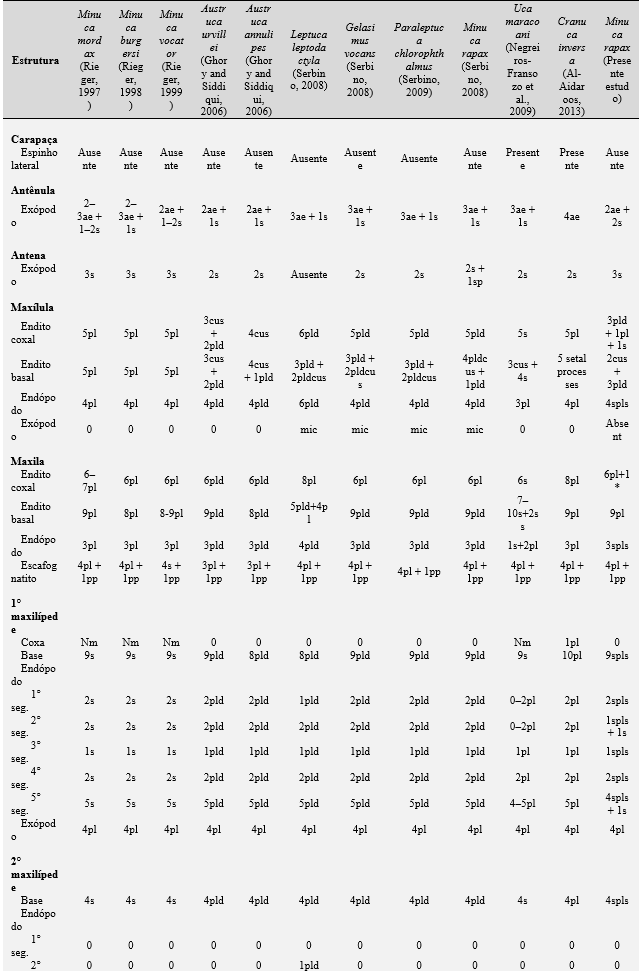
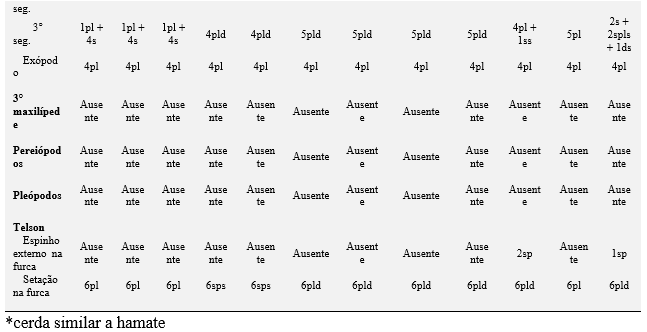
Tabela 4. Comparações morfológicas entre o estágio de megalopa das espécies de caranguejos violinistas. ae = esteto; cus = cerda cuspidata; ds = cerda denticulada; pb = brotos; pl = cerda plumosa; pld = cerda plumodenticulada; pldcus = cerda plumodenticulada cuspidata; pp = processo plumoso; s = cerda simples; ss = cerda serrata; sp = espinho; ssp = espinho serrilhado; plsp = espinho plumoso; ns = cerda natatória; ms = cerda marginal; sps = cerda espinhosa; spls = cerda pouco plumosa; pas = cerda paposa; is = ísquio; me = merus, ca = carpo, pr = própodo, da = dáctilo; Nm = não mencionada; não descrita e ilustrada pelo autor.
1Laboratório de Carcinologia / Instituto de Estudos Costeiros (IECOS), Universidade Federal do Pará (UFPA), Campus Universitário de Bragança. Alameda Leandro Ribeiro s/n, Bairro: Aldeia, 68600-000, Bragança, PA, Brasil; 2Secretária de Educação do Estado do Pará (SEDUC-PA).E-mail: marcusalexandre159@gmail.com. Orcid: https://orcid.org/0000-0002-6227-4272
