REGISTRO DOI: 10.69849/revistaft/dt10202505311601
Marcus Alexandre Borges Pires1,2*
ABSTRACT
Information on development and morphology of the feeding appendages and foregut of crustacean larvae have aided to the identification of adequate food for improvement of the culture conditions and increasing larval survival. The structures of outer feeding appendages and foregut were examined in zoea I larvae of red mangrove-root crab G. cruentata. Ovigerous females were manually caught in the “Furo do Café”, Bragança City, Northeastern Pará State, on March 2022. After hatch, the larvae were reared in the Carcinology Laboratory. The zoea I of G. cruentata showed numerous enlarged setae in the feeding appendages and in the cardiac and pyloric foregut chambers indicating functionality of these structures.
Keywords: Inner and outer feeding apparatus, External oral structures, Red mangrove-root crab, Larva, Morphology.
RESUMO
Informações sobre o desenvolvimento e morfologia dos apêndices bucais e estômago das larvas de crustáceos, têm auxiliado na identificação de alimentos e condições de cultivo satisfatórias, para o aumento da sobrevivência durante o desenvolvimento larval. As estruturas do estômago e dos apêndices bucais foram examinadas em larvas zoea I do caranguejo aratu vermelho G. cruentata. Fêmeas ovígeras de G. cruentata foram capturadas manualmente no Furo do Café, Cidade de Bragança, Nordeste do Estado do Pará, em março de 2022. Após a eclosão, as larvas foram cultivadas em Laboratório de Carcinologia. Zoea I de G. cruentata apresentou inúmeras e largas cerdas nos apêndices bucais e nas câmaras cardíacas e pilóricas do estômago indicando a funcionalidade destas estruturas.
Palavras-chave: Aparelho digestivo interno e externo, Estruturas bucais externas, Caranguejo Aratu vermelho, Larva, Morfologia.
INTRODUÇÃO
Aspectos morfológicos e funcionais do estômago de crustáceos decápodes foram extensivamente examinados em espécimes adultos na tentativa de se compreender o funcionamento dos processos digestivos (MEISS & NORMAN, 1977; KUNZE & ANDERSON, 1979; SUTHERS & ANDERSON, 1981; SUTHERS, 1984; SKILLETER & ANDERSON, 1986; MINAGAWA & TAKASHIMA, 1994; PINN et al., 1999; JHA & HOMECHAUDHURI, 2001; BRÖSING et al., 2002; CASTRO & BOND-BUCKUP, 2003). Por outro lado, poucos esforços foram feitos para se conhecer este mecanismo em suas larvas e pós-larvas.
Estudos sobre a morfologia do sistema digestivo realizados nas últimas duas décadas com larvas de lagostas têm revelado dados importantes sobre a biologia alimentar dos diferentes estágios larvais e pós-larvais (NISHIDA et al., 1990; WOLFE & FELGENHAUER, 1991; MIKAMI & TAKASHIMA, 1993; LEMMENS & KNOTT, 1994), sendo que foi sugerido que estes animais não se alimentam durante os estágios transitórios (puerulus/nisto), pois exibem apêndices bucais e estômagos incapazes morfologicamente de ingerirem e transformarem os alimentos, respectivamente. Fato semelhante foi observado em caranguejos do gênero Paralithodes (importante recurso pesqueiro capturado no Norte do Oceano Pacífico) que apresentaram comportamento lecitotrófico no estado transitório, megalopa. Estes resultados contribuíram para o aumento da produção de juvenis cultivados, com baixas taxas de mortalidade nos cultivos em laboratório por Abrunhosa (1997), Abrunhosa e Kittaka (1997 a,b).
Experimentos anteriores visando o cultivo larval de Goniopsis cruentata apresentaram alta mortalidade nos primeiros dias de cultivo. Os fatores pelos quais ocorre esta mortalidade ainda são desconhecidos, podendo estar relacionados aos aspectos alimentares da espécie. Um dos aspectos que pode estar associado a este fenômeno pode ser o fato de que alguns crustáceos decápodes possuem reservas nutritivas oriundas da fêmea adulta. Esse estoque energético permite ao animal, completar um estágio larval ou mesmo o completo desenvolvimento larval sem requerer alimento planctônico. Este fenômeno é conhecido comumente como lecitotrofia (ANGER, 2001). Neste sentido, a investigação da morfologia do sistema digestivo do primeiro estágio larval de G. cruentata poderá revelar se ocorre ou não, lecitotrofia em larvas desta espécie. Assim, outros parâmetros como salinidade, temperatura e pH poderiam ser investigados como causadores da mortalidade, eliminando o fator alimentação.
O presente trabalho fornece a descrição morfológica do estômago e dos apêndices bucais de zoea I de G. cruentata comparando a organização estrutural do estômago desta espécie com a de outros representantes dos decápodes, com objetivo de investigar se as larvas alimentam-se durante o estágio I ou se são lecitotróficas.
MATERIAL E MÉTODOS
Duas fêmeas ovígeras foram coletadas manualmente no estuário do Furo do Café (00°50’752” S; 046°38’392” W), Nordeste do Estado do Pará, em março de 2022, transportadas para o laboratório de Carcinologia do Campus da UFPA e acondicionadas em aquários (capacidade de 5 L), contendo água marinha com 25 de salinidade, com suprimento de aeração constante e submetidas à fotoperíodo artificial de 12/12 horas na presença e ausência de luz, permanecendo sem alimento até a eclosão dos ovos. Após a eclosão, as larvas foram submetidas à larvicultura, como está descrito no capítulo 3.
Tratamento para dissecação
Para dissecação dos estômagos, foram utilizados indivíduos correspondentes ao primeiro estágio larval de G. cruentata. As amostras foram fixadas em solução aquosa de formalina a 10% (v/v) por 24h e posteriormente, imersas em solução aquosa de hidróxido de potássio (KOH) 5% (p/v) e aquecidas em estufa a 80°C por 20 minutos. Em seguida, foram lavadas em água destilada e imersas em solução de álcool etílico 70% + glicerol (1:1).
Dissecação, ilustração e descrição dos estômagos
Após o tratamento citado anteriormente, os indivíduos foram colocados em lâminas contendo álcool etílico 70% + glicerol (1:1). A dissecação foi realizada em microscópio óptico binocular Zeiss com auxílio de agulhas finas (BD Ultra-Fine®, 12,7 x 0,33mm). Os estômagos foram extraídos e transferidos para outras lâminas, onde foram corados com solução aquosa de azul de metileno 1%.
Os estômagos foram observados em vista lateral, dorsal e ventral. Posteriormente, ilustrados em vista lateral direita através de desenho manual com auxílio de um disco micrométrico e régua. A descrição segue as terminologias descritas por Meiss e Norman (1977); Nishida et al. (1990); Abrunhosa e Kittaka (1997a); Abrunhosa et al. (2006).
RESULTADOS
Descrição morfológica dos apêndices bucais de zoea I de G. cruentata
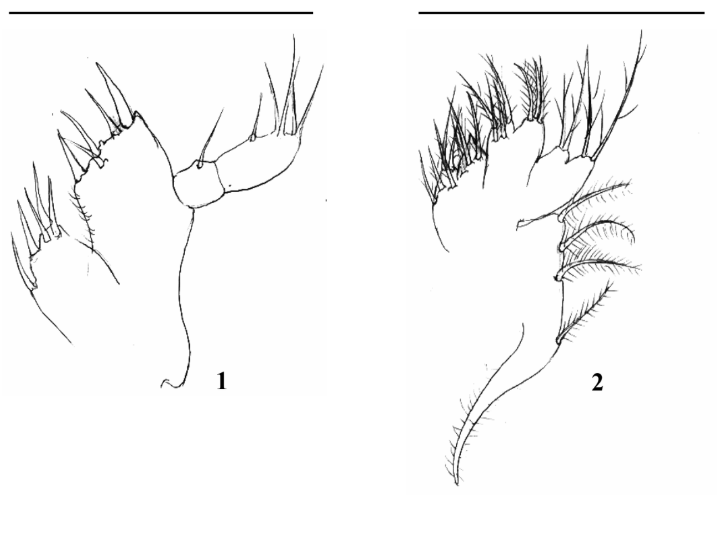
Maxílula (Fig. 1): Endópodo 2-segmentado, segmento distal com 4 longas cerdas terminais e 1 simples cerda média, segmento proximal com 1 cerda simples. Endito basal com 4 cerdas plumas denticuladas e 1 cerda simples. Endito coxal com 5 cerdas plumosas. Protópodo ausente.
Maxila (Fig. 2): Escafognatito mostrando 4 cerdas plumosas e um alongado processo coberto por microtríquias. Endópodo não segmentado com 2 + 2 longas cerdas plumosas. Endito basal com lóbulos proximal e distal suportando 3 e 4 cerdas plumosas. Endito coxal com lóbulos proximal e distal parcialmente fundidos com 3 e 5 cerdas plumosas.
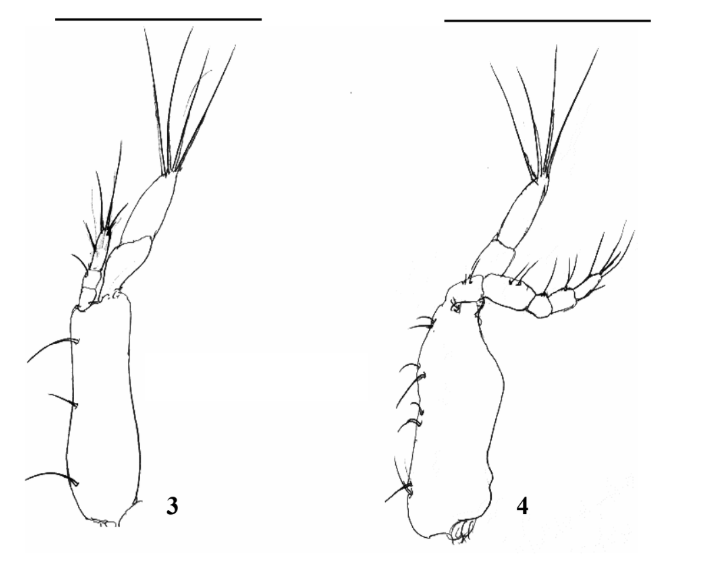
Primeiro Maxilípede (Fig. 3): Basípodo mostrando margem interna com 2, 2, 2, 2 cerdas simples. Endópodo 5-segmentado com 2, 2, 1, 2, 5 cerdas, respectivamente. Exópodo 2- segmentado, segmento distal com 4 longas cerdas plumo-natatórias.
Segundo Maxilípede (Fig. 4): Basípodo com 3 a 4 cerdas simples. Endópodo 3- segmentado com 0, 1, (3 + 1) cerdas, respectivamente. Exópodo 2-segmentado, segmento distal com 4 cerdas longas plumo-natatórias.
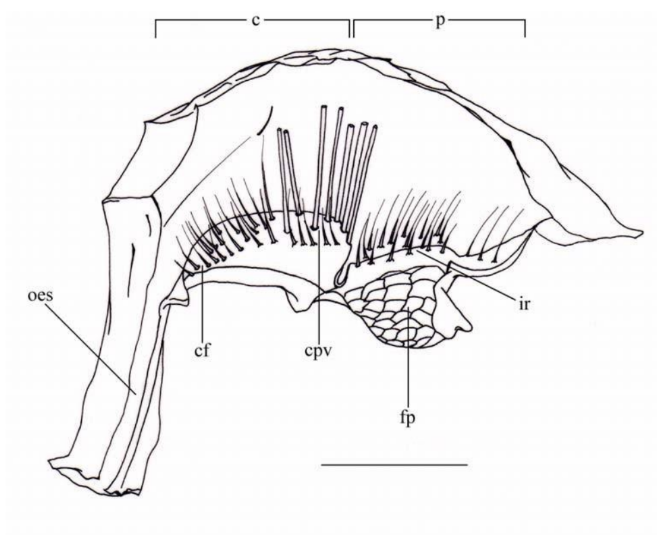
Morfologia geral do estômago do zoea I de G. cruentata
Estômago pequeno, simples e quitinoso; moinho gástrico ausente (Fig. 5). Câmara cardíaca: Achatada lateralmente, aproximadamente do mesmo tamanho da câmara pilórica; ausência de cerdas na parede cardíaca; válvula cardio-pilórica alargada e robusta com fileiras de finas cerdas anteriormente e armada com longas, cerdas largas e eréteis sobre a porção posterior.
Câmara pilórica: Larga; filtro pilórico em forma de colméia, ocupando toda porção inferior da câmara, cerdas medianas e finas na crista interampulária.
CONSIDERAÇÕES FINAIS
As inúmeras e largas cerdas encontradas nos apêndices bucais e nas câmaras cardíacas e pilóricas (Figs. 1-5) observadas no presente estudo indicaram fortemente a funcionalidade destas estruturas e seguem as características comuns encontradas na maioria das larvas dos decápodes anteriormente descritas na literatura (FACTOR, 1978; ANGER, 2001; ABRUNHOSA et al., 2006) não apresentando sinais rudimentares em suas estruturas.
Apêndices bucais e estômagos atrofiados ou rudimentares apresentando poucas cerdas ou mesmo, totalmente desprovidos delas, foram observados nos desenvolvimentos larvais completos ou mesmo em alguns estágios específicos. Estas características têm fortemente indicado abstinência alimentar pelas larvas (NISHIDA et al., 1990; WOLFE & FELGENHAUER, 1991; MIKAMI & TAKASHIMA, 1993; LEMMENS & KNOTT, 1994; ABRUNHOSA & KITTAKA, 1997a,b).
Em geral, atrofia dos apêndices bucais e estômago são observados na fase transitória conhecida como megalopa (de caranguejos) ou nisto e puerulus (de lagostas). Vários estudos mostrando atrofia destas estruturas foram publicados (NISHIDA et al., 1990; WOLFE & FELGENHAUER, 1991; LEMMENS & KNOTT, 1994 para puerulus de lagosta e ABRUNHOSA & KITTAKA, 1997a,b, em megalopas de caranguejos do gênero Paralithodes). No entanto, pouco foi reportado sobre rudimento ou atrofiamento do estômago em zoeae de anomuros e braquiuros. Abrunhosa et al. (2005) notaram reduzidos números de cerdas nessas estruturas em zoeae do corrupto Lepidophthalmus siriboia e evidenciaram que o comportamento lecitotrófico ocorria durante o desenvolvimento desta espécie. Contrário a isso, as inúmeras cerdas observadas em G. cruentata sugerem fortemente que a lecitotrofia não ocorre no primeiro estágio desta espécie.
Por outro lado, algumas espécies podem apresentar lecitotrofia facultativa, isto é, as larvas são morfologicamente aptas a se alimentar, mas conseguem sucesso em mudar de alguns estágios ou mesmo completar o ciclo larval sem a ingestão do alimento externo. Anger (1995) reportou, após observações em cultivo larval, que larvas de Sesarma curacaoense apresentam lecitotrofia facultativa, sendo capazes de alcançar o estágio megalopa com completa ausência de alimento. Este fato foi posteriormente comprovado por Melo et al. (2006) que registrou, após análises morfológicas, a presença de numerosas cerdas na válvula cardio pilórica e um filtro pilórico especializado e complexo nos estômagos das larvas de S. curacaoense. Anger (1995) apontam que lecitotrofia facultativa ocorrem quando as espécies apresentam uma larga quantidade de reserva nutritiva oriunda da mãe. O fato do sucesso em completar todo o ciclo larval mesmo sem a presença do alimento está relacionado ao fato do curto período larval destas espécies.
Para G. cruentata a alta mortalidade no primeiro estágio durante o cultivo demonstra claramente que a quantidade de reserva nutritiva não é suficiente para mudança de estágio (Fig. 1 do capítulo 3). Assim, pelas observações de cultivo larval e pela morfologia do sistema digestivo, sugere-se que estas larvas não são lecitotróficas e que o alimento é essencial para seu desenvolvimento. Neste sentido, novos estudos são necessários para desvendar a mortalidade encontrada nas larvas de G. goniopsis.
REFERÊNCIAS BIBLIOGRÁFICAS
ABRUNHOSA, F. A. Developmental morphology of digestive system and mouthparts in the King Crabs with particular reference to biological significance on non-feeding metamorphosed stage. 138f.Thesis (Doutorado) – Curso de PhD in Aquaculture, Faculty of Biology Engineer, The Science University of Tokyo, Noda. 1997.
ABRUNHOSA, F. A. & KITTAKA, J. Functional morphology of mouthparts and foregut of the last zoea, glaucothoe and first juvenile of the king crabs Paralithodes camtschaticus, P. brevipes and P. platypus. Fisheries Science, Tóquio, v. 63, n. 6, p. 923- 930, 1997a.
ABRUNHOSA, F. A.; KITTAKA, J. Functional morphology of mouthparts and foregut of the last zoea, glaucothoe and first juvenile of the king crabs Paralithodes camtschaticus, P. brevipes and P. platypus. Fisheries Science, Tóquio, v. 63, n. 6, p. 931- 940. 1997b.
ABRUNHOSA, F. A.; MELO, M. A.; ABRUNHOSA, J. P. Development and functional morphology of the foregut of larvae and postlarva of Ucides cordatus (Decapoda, Ocypodidae). Nauplius, Rio Grande, v. 11, n. 1, p. 37-43, 2003.
ABRUNHOSA, F. A.; PIRES, M. A. B.; LIMA, J. F.; COELHO-FILHO, P. A. Larval development of Lepidophthalmus siriboia Felder & Rodrigues, 1993 (Decapoda: Thalassinidea) from the Amazon region, reared in the laboratory. Acta Amazonica, Manaus, v. 35, n. 1, p. 77-84, 2005.
ABRUNHOSA, F.A.; MELO, M. A.; ABRUNHOSA, J.P. Developmental morphology of mouthparts and foregut of larvae and postlarvae of Lepidophtalmus siriboia Felder & Rodrigues, 1993 (Decapoda: Callianassidae). Acta Amazonica, Manaus, v. 36, n. 3, p. 335 – 342, 2006.
ANGER, K. Starvation resistance in larvae of a semiterrestrial crab Sesarma curacaoense (Decapoda: Grapsidae). Journal of Experimental Marine Biology and Ecology, Amsterdam, v. 187, n. 2, p. 161 – 174, 1995.
ANGER, K. The biology of Decapod Crustacean Larvae. In: VONK, R. Crustacean Issues 14. Lisse: A. A. Balkema Publishers, 2001. p. 109 – 144.
BRÖSING, A.; RICHTER, S.; SCHOLTZ, G. The foregut-ossicle system of Dromia wilsoni, Dromia personata and Lauridromia intermedia (Decapoda, Brachyura, Dromiidae), studied with a new staining method. Arthropod Structure & Development, Seewiesen, v. 30, n. 4, p. 329 – 338, 2002.
CASTRO, T.S.; BOND-BUCKUP, G. The morphology of cardiac and pyloric foregut of Aegla platensis Schmitt (Crustacea: Anomura: Aeglidae). Memoirs of Museum Victoria, Melbourne, v. 60, n. 1, p. 53 – 57, 2003.
FACTOR, J. R. Morphology of the mouthparts of larval lobsters, Homarus americanus (Decapoda: Nephropidae), with special emphasis on their setae. Biological Bulletin, v. 154, n. 3, p. 383 – 408, 1978.
JHA, A.; HOMECHAUDHURI, S. Understanding the gastric mill structure of a macrophagous shrimp Metapenaeus monoceros (Fabricius). Current Science, Bangalore, v. 80, n. 5, p. 620 – 622, 2001.
KUNZE, J.; ANDERSON, D. T. Functional morphology of the mouthparts and gastric mill in the hermit crab Clibanarius taeniatus (Milne Edwards), Clibanarius virescens (Krauss), Paguristes squamosus McCulloch and Dardanus setifer (Milne Edwards) (Anomura: Paguridae). Australian Journal of Marine and Freshwater Research, [S. I.], v. 30, n. 5, p. 683 – 722, 1979.
LEMMENS, J. W. T. J.; KNOTT, B. Morphological changes in external and internal feeding structures during the transition phyllosoma-puerulus-juvenile in the western rock lobster (Panulirus cygnus, Decapoda: Palinuridae). Journal of Morphology, Hoboken, v. 220, n. 3, p. 271 – 280, 1994.
MEISS, D. E.; R. S. NORMAN. Comparative study of the stomatogastric system of several decapod Crustacea. Journal of Morphology, Hoboken, v. 152, n. 1, p. 21 – 54, 1977.
MELO, M. A.; F. ABRUNHOSA; SAMPAIO, I. The morphology of the foregut of larvae and postlarva of Sesarma curacaoense De Man, 1892: a species with facultative lecithotrophy during larval development. Acta Amazonica, Manaus, v. 36, n. 3, p. 375 – 380, 2006.
MIKAMI, S.; TAKASHIMA, F. Development of the proventriculus in larvae of the slipper lobster, Ibacus ciliatus (Decapoda, Scyllaridae). Aquaculture, Asheville, v. 116, n. 2 -3, p. 199 – 217, 1993.
MINAGAWA, M.; TAKASHIMA, F. Developmental changes in larval mouthparts and foregut in the red frog crab, Ranina ranina (Decapoda: Raninidae). Aquaculture, Asheville, v. 126, n. 1 – 2, p. 61 – 71, 1994.
NISHIDA, S.; QUIGLEY, B. D.; BOOTH, J. D.; NEMOTO, T.; KITTAKA, J. Comparative morphology of the mouthparts and foregut of the final stage phyllosoma, puerulus, and postpuerulus of the rock lobster Jasus edwardsii (Decapoda: Palinuridae). Journal of Crustacean Biology, Lawrence, v. 10, n. 2, p. 293 – 305, 1990.
PINN, E. H.; NICKELL, L. A. A.; ROGERSON, A.; ATKINSON, R. J. A. Comparison of gut morphology and gut microflora of seven species of mud shrimp (Crustacea:Decapoda: Thalassinidea). Marine Biology, Berlin, v. 133, p. 103 – 114, 1999.
SKILLETER, G. A.; ANDERSON, D.T. Functional morphology of the chelipeds, mouthparts and gastric mill of Ozius truncates (Milne Edwards) (Xanthidae) and Leptograpsus variegatus (Fabricius) (Grapsidae) (Brachyura). Australian Journal of Marine and Freshwater Research, [S. I.], v. 37, n. 1, p. 67 – 79, 1986.
SUTHERS, I. M. Functional morphology of the mouthparts and gastric mill in Penaeus plebejus Hess (Decapoda: Penaeidea). Australian Journal of Marine and Freshwater Research, [S. I.], v. 35, n. 1, p. 785 – 792, 1984.
SUTHERS, I. M.; ANDERSON, D. T. Functional morphology of mouthparts and gastric mill of Ibacus peronii (Leach) (Palinura: Scyllaridae). Australian Journal of Marine and Freshwater Research, [S. I.], v. 32, n. 1, p. 931 – 944, 1981.
WOLFE, S. H.; FELGENHAUER, B. E. Mouthpart and foregut ontogeny in larval, postlatval, and juvenile spiny lobster Panulirus argus Latreille (Decapoda: Palinuridae). Zoologica Scripta, Oslo, v. 20, n. 1, p. 57 – 75, 1991.
1Laboratório de Carcinologia / Instituto de Estudos Costeiros (IECOS), Universidade Federal do Pará (UFPA), Campus Universitário de Bragança. Alameda Leandro Ribeiro s/n, Bairro: Aldeia, 68600-000, Bragança, PA, Brasil;
2Secretária de Educação do Estado do Pará (SEDUC-PA). *Autor correspondente
E-mail: marcusalexandre159@gmail.com Orcid: https://orcid.org/0000-0002-6227-4272
