REGISTRO DOI:10.5281/zenodo.7879213
Dala Kezen Vieira Hardman Leite1
Larissa Marques de Lucena2
Hanna Cristiny Mello Gonçalves2
Karina da Silva Delfino2
Daniela Mello Vianna Ferrer1
Paula Fernanda Chaves Soares1
INTRODUÇÃO
Na bovinocultura tem sido utilizado métodos para avaliar a capacidade reprodutiva de touros com alto valor zootécnico por meio de exame andrológico. A avaliação dos reprodutores baseia-se na observação da saúde geral, saúde hereditária, saúde do aparelho genital com determinação da capacidade de produção espermática, buscando detectar touros inférteis ou subférteis evitando prejuízos no final da estação de monta. [1]
Importante ressaltar que no processo de fertilização a análise de morfologia espermática permite a identificação de touros de baixo potencial de fertilidade, evitando que esses animais entrem no programa de seleção de sêmens doadores para Inseminação Artificial, Inseminação Artificial por Tempo Fixo, Transferência de Embriões, Produção in vitro . [1,2]
Uma das primeiras técnicas utilizadas para avaliação de sêmen era a análise de morfologia espermática que predomina até os dias de hoje, logo os métodos de avaliação seminal é baseada por meio de microscopia tendo parâmetros necessários para avaliar motilidade, morfologia, integridade, vigor e concentração. [3]
O exame andrológico é avaliado da seguinte forma, sendo a primeira a realização do exame clínico e em seguida o espermograma. A coloração da lâmina seminal é feita de forma rápida e segura, de baixo custo e são utilizados métodos por meios de coloração de esfregaço de sêmen onde deve ser visualizado de forma rápida para ter o resultado fidedigno, sem perder o material coletado. [3-5]
A coloração da lâmina é feita com o corante de Eosina-nigrosina modificada, conhecida popularmente como Botuvital, exibindo espermatozoides corados de vermelho e branco. É utilizado na coloração da lâmina já com o sêmen para analisar membrana citoplasmática como também patologias presentes nos espermatozoides.[7-9] Esse produto é uma inovação que surgiu como uma nova alternativa para realizar essa avaliação da integridade de membrana do espermatozoide, pois a mesma possui um bom potencial de permeabilidade nas membranas lesadas, facilitando o reconhecimento e leitura dos espermatozoides. [8]
Deste modo diversos estudos tem sido guiados no sentido de determinar a conexão de cada teste laboratorial agregados a amostras de conteúdo seminal, que visam associações com índices positivos para reprodução bovina.[10]
OBJETIVO:
O objetivo do trabalho visa avaliar a integridade de membrana espermática dos touros da raça Nelore (Bos taurus indicus).
METODOLOGIA:
Foi realizado o exame andrológico em 10 animais da espécie bovina de idades variadas da raça Nelore, na Fazenda, localizada em Itaguaí, no estado do Rio de Janeiro.
O trabalho foi submetido ao Comitê de Ética- PEBIO/UNIG N° 001/2022
Todos os touros foram submetidos a exame andrológico completo, onde foram avaliados os seguintes parâmetros: histórico e anamnese, exame clínico, biometria testicular, exames macroscópico e microscópico do sêmen. A bolsa escrotal, os testículos, epidídimos, cordão espermático, prepúcio e pênis e glândulas sexuais acessórias foram avaliados por meio de exame clínico: inspeção e palpação retal. Os dados dos animais foram anotados em fichas individuais.
O método de coleta utilizado foi o Eletroejaculador. A colheita de sêmen pela técnica de eletroejaculação foi utilizada com um aparelho específico e o animal foi contido em tronco individual não necessitando de anestesia. Após coletado o sêmen foi avaliado macroscopicamente e microscopicamente o sêmen. A coloração para corar as lâminas foi utilizado a eosina que é um indicador da integridade da membrana plasmática corando somente espermatozoides mortos, ou seja, que apresentam membrana lesada. Denominado com nome comercial Botuvital. Uma gota de sêmen foi colocada na lâmina com uma gota do corante Botuvital, e realizado o esfregaço, fazendo a junção com o corante, ocorrendo a homogeneização do material depositado. Em seguida, com a secagem das lâminas as lâminas foram levadas para o Laboratório d Patologia Clínica do curso de graduação da Medicina Veterinária – UNIG. No laboratório foram contadas duzentas células, ao microscópio no com aumento de 1.000x. Essa técnica foi executada em todas as lâminas, onde foram visualizadas a membrana plasmática de cada célula. Os espermatozoides que visualmente foram identificados com uma coloração mais roxa/rosa foram os que apresentaram a membrana citoplasmática lesada.Os espermatozoides que não corraram são os espermatozoides íntegros, no qual a integridade da membrana não foi afetada.
RESULTADOS E DISCUSSÃO:
De todos os 10 touros analisados apenas 1 (10%) apresentou defeitos maiores e menores de patologias espermáticas, acima da normalidade. Um dos touros apresentou no momento de coleta oligospermia, dificultando a análise. Esse touro apresentou o turbilhonamento com classificação 1, motilidade com 20%, vigor com classificação 1 e concentração baixa. Indicando um animal inapto para reprodução de acordo com os autores Gonçalves et al. [1] Zorzetto et al [6]. Quanto a integridade de membrana espermática plasmática desse touro, foram observados muitos espermatozoides com a coloração avermelhada (Figura 1), divergindo dos demais que estavam íntegros e havia diminuição nas unidades de espermatozoides presente, de acordo com Celeghini et al. [3], a qualidade do sêmen depende da sua integridade tem em vista sua morfologia na qual são avaliadas separadamente para diagnosticar a capacidade fecundante do espermatozoide , tornando- o animai infértil conforme o presente trabalho. A maioria das células observadas apresentaram muitos defeitos de morfologia como: cauda enrolada, cauda dobrada, duas cabeças, no qual foi diagnosticado o animal como infértil e inapto para reprodução (Figura 2). No total do sêmen deste animal, de 200 espermatozoides avaliados, 64 apresentaram membrana plasmática lesada, correspondendo a 32% do valor total, relatado por Freitas et al. [2] Este número excede o limite considerado aceitável para que o animal seja apto a reprodução, logo deveria apresentar no mínimo de 70% das células íntegras conforme descrevem os autores Gonçalves et al. [1] e Celeghini et al. [3],
Nos outros 9 touros foram observados grande quantidade de espermatozoides normais no espermograma, entretanto 90% dos demais touros não apresentaram lesão de integridade de membrana espermática como também patologia inexistente (Figura 3) conforme descrevem autores como Gonçalves et al. [1], Celeghini et al. [3], Alves et al. [4] e afirmam que são considerados touros aptos para reprodução.
De acordo com Freitas et al. [1,2] a observação de elementos como morfologia espermática e integridade requer o emprego de métodos mais objetivos utilizando análise computadorizada da morfometria espermática, método que pode proporcionar a identificação de touros com problemas de fertilidade.
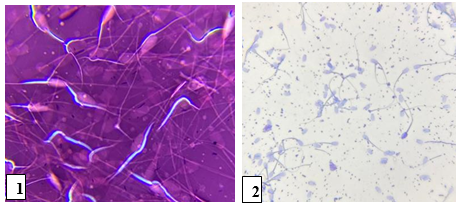
Figura 1: Lâmina com integridade de membrana lesionada. Figura 2: Lâmina com pouca presença de espermatozoides e com lesão na integridade de membrana e morfologia.
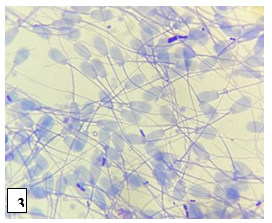
Figura 3: Lâmina com grande quantidade de espermatozoides com sua maioria íntegros e sem patologia de morfologia.
CONCLUSÕES:
A avaliação de integridade de membrana espermática com corante de Eosina-Nigrosina modificada (Botuvital) é uma técnica de diagnóstico simples, barato e eficaz que possibilita a avaliação da morfologia espermática e integridade de membrana, auxiliando no diagnóstico da fertilidade de touros destinados a reprodução.
Palavras-chave: Integridade; Membrana; Reprodução; Espermatozoide.
REFERÊNCIAS:
1. Gonçalves p.b.d; fFigueiredo j.r; Gasperin B.G. Biotécnicas aplicadas à Reprodução Animal e Humana. 3ª ed., Rio de Janeiro: Roca, 2021, 416 p.
2. Freitas-dell’aqua, C.P; Crespilho, A.M; Papa, F.O. (2009). Metodologia de avaliação laboratorial do sêmen congelado bovino. Rev. Bras, Reprod. Anim.,33(4):213-222.
3. CeleghinI, E.C.C; Arruda, r.p; Florez-rodriguez, S.A. (2017). Impacto da qualidade do sêmen sobre a fertilidade a campo em bovinos. Rev. Bras, Reprod. Anim.,41(1):40-45.
4. Alves, M.B.R; Arruda R.P; Silveira, J.C. (2017). MicroRNAs: uma nova abordagem para a predição da fertilidade em touros. Rev. Bras, Reprod. Anim.,41(1): 46-53.
5. Botta, D. Arruda, R.P. Carvalho, C.P.T. (2017). Categorização computadorizada da motilidade de espermatozoides criopreservado de touros compostos após desafio térmico in vitro. 2ª Reunião da Associação Brasileira de Andrologia Animal (ABRAA) ANAIS, 86-89.
6. Zorzetto, M.F; Dias, E. K; Monteiro, F.M. (2017). Análise do ejaculado de touros da raça Nelores (Bos indicus) de alta e baixa resistência espermática à criopreservação. 2ª Reunião da Associação Brasileira de Andrologia Animal (ABRAA) ANAIS, 64-66.
7. Crespilho, A.M. (2017). Variáveis metodológicas na avaliação do movimento espermático. 2ª Reunião da Associação Brasileira de Andrologia Animal (ABRAA) ANAIS, 53-55.
8. Filho, G.D. M. (2017). Princípios da eletroejaculação. 2ª Reunião da Associação Brasileira de Andrologia Animal (ABRAA) ANAIS, 49-52.
9. Arruda, R.P; Celeghini, E.C.C; Garcia, A.R. (2015). Morfologia espermática de touros: interpretação e impacto na fertilidade. Rev. Bras, Reprod. Anim.,39(1): 47-60.
10. Frederico, O.P. (2020). Reprodução em garanhões. 1ª ed., São Paulo: MEDVET, 2020,336.
1Docente do Curso de Medicina Veterinária – Universidade Iguaçu campus Nova Iguaçu/RJ.
2Discente do Curso de Medicina Veterinária – Universidade Iguaçu campus Nova Iguaçu/RJ.
