ROLE OF NEUROPLASTICITY IN MOTOR REHABILITATION
EL PAPEL DE LA NEUROPLASTICIDAD EN LA REHABILITACIÓN MOTORA
REGISTRO DOI: 10.69849/revistaft/cs10202504300632
Victória Vieira Bueno e Silva1
Jonatas Alves Braga Pereira2
Guilherme Hideki Cavalcante Yamada3
Bárbara Cardoso Del Nery Batistuta Teixeira Vale4
Thamirys Fraga Amorim5
Carlos Gustavo Sakuno Rosa6
Fernando Mendonça Cardoso7
Resumo
O Sistema Nervoso Central é encarregado de receber e transmitir informações para todo o corpo, respondendo a estímulos, gerando, assim, modificações e readaptações ao longo da vida. A neuroplasticidade envolve a reorganização dos circuitos neurais, promovendo melhoria da comunicação entre neurônios. Por meio desse processo, ocorre a aprendizagem de novos comportamentos, sendo importante na reabilitação de lesões cerebrais. Acredita-se que o trabalho motor possui um potencial tanto preventivo quanto terapêutico para danos cerebrais, podendo levar a recuperação progressiva, possibilitando uma melhora em déficits motores e cognitivos, minimizando as sequelas. O estudo analisou o modo como a plasticidade neural atua, em decorrência de estímulos motores, e os seus efeitos na recuperação funcional do indivíduo. Esta revisão constatou que o exercício físico influenciou diretamente no aumento da plasticidade neural e reorganização sináptica, gerando efeitos positivos na melhora da funcionalidade e recuperação motora do indivíduo.
Palavras-chave: Plasticidade Cerebral. Plasticidade Sináptica. Aprendizado Motor. Atividade Física.
Abstract
The Central Nervous System is responsible for receiving and transmitting information throughout the body, responding to stimuli and thus generating modifications and readaptations over the course of life. Neuroplasticity involves the reorganization of neural circuits, promoting improved communication between neurons. Through this process, new behaviors are learned, making it important in the rehabilitation of brain injuries. It is believed that motor activity has both preventive and therapeutic potential for brain damage, which can lead to progressive recovery, allowing for improvements in motor and cognitive deficits while minimizing sequelae. The study analyzed how neural plasticity operates in response to motor stimuli and its effects on the individual’s functional recovery. This review found that physical exercise directly influenced the increase of neural plasticity and synaptic reorganization, resulting in positive effects on the improvement of functionality and motor recovery of the individual.
Keywords: Brain Plasticity. Synaptic Plasticity. Motor Learning. Physical Activity.
Resumen
El Sistema Nervioso Central es el encargado de recibir y transmitir información a todo el cuerpo, respondiendo a los estímulos, generando así modificaciones y readaptaciones a lo largo de la vida. La neuroplasticidad implica la reorganización de los circuitos neuronales, promoviendo una mejor comunicación entre neuronas. A través de este proceso se aprenden nuevas conductas, lo cual es importante en la rehabilitación de lesiones cerebrales. Se cree que el trabajo motor tiene potencial tanto preventivo como terapéutico del daño cerebral, y puede conducir a una recuperación progresiva, permitiendo una mejora de los déficits motores y cognitivos, minimizando las secuelas. El estudio analizó cómo actúa la plasticidad neuronal, como resultado de estímulos motores, y sus efectos en la recuperación funcional del individuo. Esta revisión encontró que el ejercicio físico influyó directamente en el aumento de la plasticidad neuronal y la reorganización sináptica, generando efectos positivos en la mejora de la funcionalidad y la recuperación motora del individuo.
Palabras clave: Plasticidad cerebral. Plasticidad sináptica. Aprendizaje motor. Actividad física.
1. Introdução
A neuroplasticidade abrange a reorganização de circuitos neurais, em que as sinapses podem ser fortalecidas, enfraquecidas ou estabelecidas em rotas alternativas do cérebro. Nesse ramo da neurociência, o objetivo do estudo é descobrir mais sobre como o cérebro se adapta e muda em resposta a diferentes estímulos. Enquanto a reabilitação motora aborda o indivíduo ao todo, de forma a promover o estímulo necessário para a busca do equilíbrio funcional do próprio corpo ou dos sistemas (Bonfim et al., 2019).
Após uma lesão neurológica, como um acidente vascular cerebral (AVC), lesão na medula espinhal ou traumatismo craniano, áreas do cérebro podem ser danificadas. Em resposta a essas lesões e danos no sistema nervoso, a neuroplasticidade permite que o cérebro reorganize as funções nessas áreas danificadas, na tentativa de recuperar funções após uma lesão ou encontrar rotas alternativas para executar as funções perdidas. A aprendizagem motora é intimamente ligada à cognição, visto que estímulos motores são altamente eficientes para a memória de novas aprendizagens e são, logo, fundamentais para a neurorreabilitação, pois se o cérebro estiver ativo, novos circuitos neurais serão gerados e suas funções serão mantidas ou adaptadas (Ashcroft et al. 2022).
A modulação da plasticidade cerebral tem sido explorada como um método promissor de tratamento. A estimulação magnética transcraniana e a estimulação elétrica transcraniana são duas técnicas que, de modo não invasivo, podem modular a neuroplasticidade, mediante meios elétricos e/ou magnéticos no couro cabeludo. Essas técnicas são utilizadas tanto para disfunções neurológicas, como um pós-AVC e traumatismo raquimedular, quanto para disfunções psiquiátricas. Em vista disso, estudos recentes da Universidade de Lisboa, têm analisado também a relação entre neuroplasticidade e algumas condições psíquicas, como depressão, ansiedade, esquizofrenia e transtorno do espectro autista (Davis, 2023).
A plasticidade neural é um campo de pesquisa em rápido desenvolvimento, tendo um impacto significativo na ciência do cérebro e no desenvolvimento de novas abordagens terapêuticas. Portanto, é essencial que cientistas, educadores e profissionais da saúde se mantenham atualizados acerca desse meio, para que assim possam compreender e promover a capacidade de adaptação e recuperação do cérebro. Sendo importante reconhecer a relevância dessa habilidade para a implementação do tratamento e de terapias para pacientes com doenças neurodegenerativas e com lesões cerebrais (Bonfim et al., 2019).
A literatura apresenta o consenso de que a prática de tarefas motoras induz mudanças plásticas e dinâmicas no Sistema Nervoso Central. De modo a promover benefícios para o enriquecimento motor, reduzir a degeneração e proporcionar a recuperação da função em cérebros lesionados, assim como favorecer a sensação de satisfação, independência funcional e bem-estar, proporcionando um ambiente favorável ao aprendizado e à memória. Dessa forma, os estímulos físicos proporcionam uma memória motora de consistência. Entretanto, na fisioterapia, os mecanismos relacionados à plasticidade cerebral ainda não estão totalmente definidos. Nesse contexto, esta revisão pretende mostrar como a reabilitação estimula a neuroplasticidade e seu impacto para a recuperação das funções motoras, analisando os mecanismos envolvidos e as principais patologias relacionadas (Neves et al., 2019).
2. Referencial Teórico
2.1 Sistema Nervoso
O Sistema Nervoso Central (SNC) é altamente complexo, responsável por receber e enviar informações em todo o corpo. Desempenha um papel crucial em inúmeras atividades relacionadas às emoções, pensamento e interação com o ambiente externo. No entanto, também está associado a disfunções e várias doenças neurodegenerativas que podem ter um impacto significativo na vida das pessoas afetadas (Caimar et al., 2020).
Apresentando notável variedade celular, incluindo neurônios e células da glia, a ação do SNC depende diretamente do funcionamento dessas células. Neurônios são células especializadas formadas no início da vida embrionária, capazes de estabelecer conexões entre si e com outras células do corpo. Chamadas de sinapses, essas conexões permitem a transmissão de informações e sinais elétricos de um neurônio para outro, bem como do corpo para o sistema nervoso e vice-versa. Essas conexões podem originar-se tanto de dentro do organismo quanto do ambiente externo, desencadeando respostas e permitindo a comunicação dentro do sistema nervoso e com o mundo ao redor (Lima, 2020).
As células da glia, também chamadas de neuróglia ou gliócitos, são um grupo de células no sistema nervoso que desempenham um papel importante ao fornecer suporte e nutrição aos neurônios. Elas se dividem em dois tipos principais: macroglia, composta por astrócitos, oligodendrócitos e células de Schwann. Sua função principal inclui a mielinização dos axônios, produção do líquido cefalorraquidiano, e fornecimento de fatores de crescimento essenciais para os neurônios; e micróglia, composta por macrófagos, cuja função principal é a fagocitose e proteção neural contra possíveis danos (Castro et al. 2017).
O cérebro humano possui cerca de 86 milhões de neurônios, que realizam constantemente inúmeras conexões sinápticas. Essa comunicação entre neurônios envolve tanto impulsos elétricos quanto estímulos químicos, associados à aprendizagem. De modo que os estímulos gerados do meio interno ou externo, impulsionam a atividade cerebral, fortalecem as conexões neurais e estimulam o crescimento da rede neuronal, assim com os estímulos corretos, os neurônios podem se modificar (Caimar et al., 2020).
O SNC possui duas áreas, a primária (sensoriomotoras) e as de associação desse sistema. A região de associação do SNC é composta pelas partes: pré-frontal, responsável pela atenção e comportamento direcionado ao objetivo; parietotemporal, que desempenha um papel crucial na integração sensorial, resolução de problemas, compreensão da linguagem e na percepção de relações espaciais; límbica, fundamental para o processamento das emoções, motivação e os processos de memória; e o núcleo estriado, um componente dos gânglios da base, está especialmente envolvido no fenômeno de aprendizagem. A comunicação contínua entre essas áreas possibilita o aprendizado de tarefas complexas, interpretação e integração sensorial, moldagem da personalidade, além de facilitar a memória e consolidar padrões motores (Caimar et al., 2020).
2.2 Neuroplasticidade
Antigamente a neurociência sustentava a crença de que neurônios perdidos não poderiam ser recuperados, porém novas pesquisas confirmaram que novos neurônios podem ser formados em região de bulbo olfatório e hipocampo. Essas células nervosas se movem para áreas onde neurônios foram prejudicados pela isquemia, criando conexões com neurônios de diferentes regiões e restaurando circuitos cerebrais danificados. Esse processo é conhecido como neurogênese e plasticidade neural, e é definido como a flexibilidade do sistema nervoso em adaptar sua organização em resposta a uma série de eventos, como o desenvolvimento do organismo, conquista de novas aprendizagens e a reorganização após lesões ou privação sensorial (Neves et al., 2019).
O SNC é altamente plástico, quando uma região do cérebro é prejudicada, células especializadas de outras áreas podem se adaptar e assumir as funções da região danificada. Entretanto, esse mecanismo não se limita somente a casos patológicos, ocorrendo tanto desde os primeiros anos de desenvolvimento, quanto ao longo da vida. Por meio dessa capacidade é possível a recuperação progressiva de indivíduos que sofrem perdas cerebrais, permitindo superar gradualmente déficits motores, visuais, auditivos ou de fala, e assim minimizar as sequelas (Salomão, 2021).
O grau de plasticidade varia conforme a idade do indivíduo. Ao longo do desenvolvimento ontogenético, o sistema nervoso é extremamente flexível, sendo moldado pela interação entre o genoma e o ambiente. Contudo, ao atingir a maturidade, a capacidade plástica desse sistema é modificada, tornando-se mais restrita. Isso esclarece o fato de as crianças possuírem maior facilidade para aprender novas habilidades e conhecimentos, de modo que a quantidade de sinapses nos cérebros infantis é cerca de 50% maior do que nos cérebros adultos. Em indivíduos com mais de trinta anos, a preservação dos neurônios no hipocampo é crucial, pois é nessa fase que, devido a alterações hormonais, o corpo naturalmente sofre uma perda gradual de conexões cerebrais (Neves et al., 2019).
O conceito de aprendizagem está intrinsecamente ligado ao conceito de plasticidade.
As aprendizagens são registradas no cérebro por meio de neurônios e sinapses, porém podem ocorrer perdas neuronais devido a fatores naturais ou ambientais. No entanto, esse processo é contínuo, visto que novos estímulos e interações em ambientes diversos proporcionam oportunidades para a formação de memórias. Estímulos e recordações ativam os neurônios, contribuindo para a constante adaptação e armazenamento de novas informações, ou seja, a cada vez que adquirimos novos conhecimentos, a comunicação sináptica entre neurônios é fortalecida. Logo, a plasticidade ocorre por meio do aprendizado, assim como o aprendizado estimula a plasticidade, conforme Figura 1 (Carvalho et al., 2021).
Figura 1 Relação entre plasticidade neural e aprendizado.

O progresso mental ou cerebral se desenrola através das variadas atividades que proporcionam estímulos, gerando o conhecimento. Diferentes estímulos, como o uso de substâncias psicoativas, hormônios, medicamentos inflamatórios, dieta, fatores genéticos, doenças mentais e lesões cerebrais, podem impactar a capacidade do cérebro de formar conexões neurais, como representa a Figura 2. Além disso, hormônios liberados em resposta ao estresse podem ter efeitos negativos, contribuindo para perdas cognitivas e depressão. Diante disso, vários elementos desempenham um papel no bom funcionamento do cérebro e afetam a plasticidade neural, cada um deles possui uma função importante para a aprendizagem (Lima, 2020).
Figura 2 Fatores ambientais e neuroplasticidade.
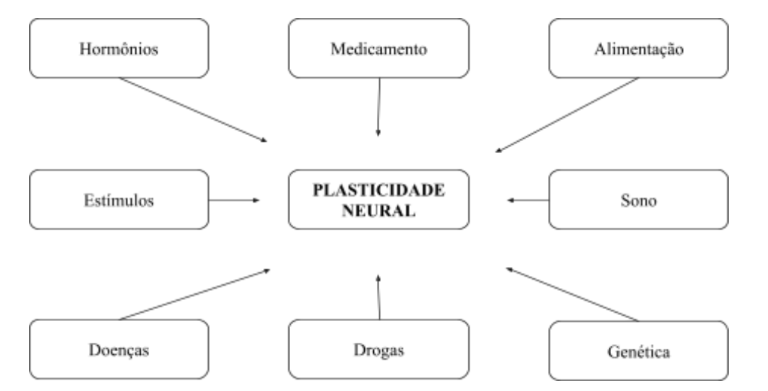
Composto por células especializadas, o SNC é uma rede que forma inúmeras conexões que influenciam a sensibilidade e ações motoras, moldando o comportamento. Quando ocorrem lesões, essa rede neural sofre desorganização, iniciando meios de reorganização e regeneração pelo SNC. A reabilitação, seja neurológica, psicológica ou motora, é embasada no fato de o cérebro ser um órgão maleável, dinâmico e adaptativo, apto a reorganizar os seus circuitos neuronais, se moldando a novas demandas do ambiente ou superando limitações funcionais decorrentes de lesões cerebrais (Neves et al., 2019).
A plasticidade intervém da proliferação de sinapses e brotamento axonal, e é classificada em três estágios. O primeiro é o desenvolvimento, que é a maturação do SNC do período embrionário até a vida extra-uterina, influenciado pela genética, ambiente fetal e externo. O segundo é a aprendizagem, que ocorre em qualquer momento da vida e requer aquisição de conhecimento. Por último, após lesão neural, em que os processos de reparação e reorganização do SNC ocorrem de forma imediata, podendo persistir por meses ou anos (Caimar et al., 2020).
Existem diversos mecanismos de reparo e reestruturação desse sistema, o mais conhecido após uma lesão cerebral é o brotamento. Nesse processo, há a criação de novos brotos de axônios, originados tanto de neurônios lesionados quanto de neurônios não afetados e possui dois tipos: o brotamento regenerativo, em axônios lesados, envolve a formação de novos brotos a partir do segmento proximal, visto que o coto distal geralmente sofre degeneração rápida; e o brotamento colateral, em axônios não lesionados, em reação a um estímulo que não integra o processo convencional de desenvolvimento, resultando em brotos colaterais ao redor da lesão, nas áreas que mantêm sua integridade (Salomão, 2021).
Com estímulos apropriados, é possível desencadear a formação de sinapses que ativam a plasticidade sináptica. Isso, por sua vez, resulta no crescimento de novos neurônios, os quais podem migrar para áreas comprometidas. No entanto, as mudanças no cérebro são graduais e sutis, variando conforme a extensão e a localização da lesão. Apesar disso, a plasticidade não garante automaticamente a recuperação, em termos neurais, pois uma lesão pode resultar em uma reorganização neural não funcional (Castro et al. 2017).
2.3 Patologias relacionadas a plasticidade neural
2.3.1 Acidente Vascular Cerebral
A plasticidade cerebral em contextos patológicos envolve a capacidade do cérebro de se adaptar após lesões, remoção de tumores cerebrais, eventos como AVC, epilepsia e condições neurodegenerativas, como Doença de Alzheimer, de Parkinson e de Huntington. No âmbito celular, a plasticidade sináptica é crucial para preservar as conexões entre os neurônios. Distúrbios no contato entre neurônios podem resultar em mudanças e doenças associadas ao envelhecimento, como demência. As principais causas de demência englobam a doença de Alzheimer, demência relacionada à doença de Parkinson, demência vascular, demência com corpos de Lewy e demência frontotemporal (Dorszewska et al., 2020).
O AVC é uma das principais causas de óbito e incapacidade globalmente. Do ponto de vista clínico, o diagnóstico ocorre quando há um déficit neurológico persistente por mais de 24 horas, manifestado através de distúrbios na fala, visão, fraqueza muscular ou disfunções cerebelares. As implicações funcionais da patologia estão condicionadas à extensão, localização e região afetada, sendo também influenciadas pela aplicação de intervenções terapêuticas apropriadas em diferentes fases da doença. Sua reabilitação é fundamentada em três bases: adaptação, regeneração e neuroplasticidade, visando reduzir as sequelas, recuperar danos funcionais e promover a independência funcional (Penna et al., 2021).
Na isquemia celular, a privação de oxigênio para os neurônios no AVC provoca uma série de eventos destrutivos no local do infarto em formação, podendo perdurar por horas, frequentemente conduzindo à progressão do dano. A plasticidade neural é primordial nos mecanismos de recuperação pós-AVC, de modo que o cérebro irá compensar os danos provocados pelo evento isquêmico ou hemorrágico, através da reorganização e formação de novas conexões entre neurônios não prejudicados. Ou seja, durante o processo de reestruturação funcional, o cérebro pode ajustar suas conexões, devido às mudanças na fisiologia cerebral e organização que levam a padrões distintos de ativação cerebral, geradas pelo pós-AVC. Isso resulta em alterações clínicas ao longo do período de reabilitação (Ashcroft et al. 2022).
Após um AVC, as principais disfunções funcionais incluem afasia e hemiplegia, sendo necessária uma equipe multidisciplinar, conforme a variabilidade do quadro clínico. Durante o evento de aprendizagem e memória, representações nas áreas corticais sensoriais e motoras podem ser alteradas pela estimulação ambiental. No processo de neuroplasticidade do sistema nervoso há a recuperação espontânea, que é típica no período inicial pós-AVC, e a reorganização cortical, que é comum e essencial para a recuperação após lesões cerebrais. As estratégias de fisioterapia utilizadas durante a recuperação afetam a neuroplasticidade espontânea (Dabrowski et al., 2019).
Após um acidente vascular cerebral (AVC), a neuroplasticidade ocorre por meio de três mecanismos principais: aumento da atividade funcional no sistema somatossensorial do lado oposto ao infarto, integridade estrutural aprimorada no trato corticoespinhal do lado afetado, e restauração da conectividade funcional entre os hemisférios, promovendo reorganização das funções danificadas. Esses mecanismos contribuem para a adaptação do cérebro e ocorrem de forma mais ativa nos primeiros meses após o AVC (Marín-Medina et al., 2023).
2.3.2 Doença de Parkinson
A doença de Parkinson (DP) é uma condição neurodegenerativa que, atualmente, não há cura. As características predominantes da DP compreendem tremor em repouso, rigidez muscular e bradicinesia, além de instabilidade postural e os distúrbios da marcha. A histopatologia da DP é marcada pela perda de neurônios dopaminérgicos na substância negra, podendo ser determinado pelo comprometimento da função cognitiva, juntamente com alterações na personalidade e nas emoções, incluindo transtornos psicopatológicos (Johansson et al., 2020).
Na análise de condições neurodegenerativas, a DP se destaca como a segunda mais comum, causando não apenas sintomas motores, mas também distúrbios do sono, depressão e disfunções cognitivas. Apesar dos avanços nas pesquisas farmacológicas e cirúrgicas, ainda não existem tratamentos que modifiquem a progressão da doença. No entanto, estudos sugerem que o exercício físico pode melhorar os sintomas motores e não motores da DP, levando a comunidade científica a considerar a atividade física como uma terapia promissora para promover a neuroplasticidade na doença, oferecendo novas perspectivas para a reabilitação dos pacientes (Rotondo et al., 2023).
Metodologia
O presente estudo foi do tipo descritivo, de natureza qualitativa, realizado por meio de uma revisão sistemática. A pesquisa foi executada por meio de consulta a artigos científicos, em inglês e português, disponíveis nas bases de dados PubMed, Lilacs, PEDro, CAPES, SciELO e Europe PMC. Utilizou-se uma combinação de descritores indexados nos Descritores em Ciências da Saúde (DeCS): “plasticidade neural” “aprendizagem motora” “neural plasticity” “physical exercise”. Considerou-se o período de publicação entre 2017 e 2024. Os operadores booleanos “AND” e “OR” foram aplicados para refinar os resultados.
Quanto aos critérios para inclusão, foram considerados: a) publicações em língua portuguesa e inglesa; b) pertinência temática; c) artigos, monografias, revisões e teses; d) publicadas de 2017 a 2024. Por outro lado, os critérios para exclusão foram: a) língua estrangeira sem tradução; b) publicações duplicadas; c) impertinência temática; d) publicações anteriores a 2016.
Os estudos foram selecionados em três fases: a) leitura dos títulos para eliminação de estudos fora do escopo; b) análise dos resumos para triagem dos artigos que atendiam aos critérios de inclusão; c) leitura na íntegra dos artigos selecionados para confirmação de sua inclusão na revisão, conforme apresentado na Figura 3.
Figura 3 Fluxograma do processo de seleção dos estudos de 2017 a 2024.
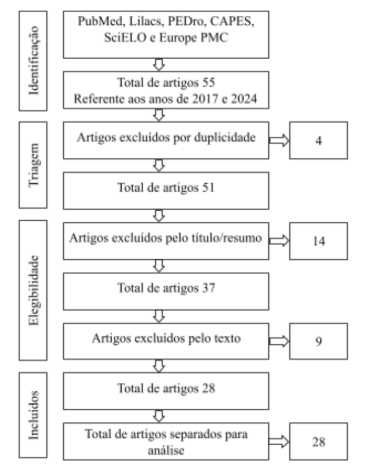
A análise foi conduzida de forma descritiva, com os estudos sendo organizados em quadros para simplificar a comparação e a interpretação dos resultados. Sendo classificados conforme os tipos de desfechos analisados, e a qualidade metodológica foi avaliada.
Resultados e Discussões
O presente tópico revela os resultados obtidos a partir da análise de dezoito artigos selecionados com base nos critérios de inclusão e exclusão previamente estabelecidos. O tema central deste estudo, a relação entre neuroplasticidade e reabilitação motora, foi explorado nos artigos com o objetivo de identificar os principais efeitos plásticos do sistema nervoso, mediante ao trabalho motor, em pacientes que sofreram lesão cerebral. A relevância desse tema está respaldada na crescente busca por mecanismos de ação e recuperação que possam complementar o estudo da neurociência e tratamento de doenças neurodegenerativas. Os dados obtidos estão organizados e discutidos no Quadro 1, onde são apresentados os principais achados dos estudos analisados, permitindo uma comparação do impacto e mecanismos da neuroplasticidade adjacentes ao exercício físico (EF).
Quadro 1 Quadro demonstrativo de Títulos, Autoria/ano de publicação, Objetivos, Tipo de estudo e Principais achados.
| Título | Autor/Ano | Objetivos | Tipo de Estudo | Principais achados |
| Atividade física e o desenvolvimento da Plasticidade Cerebral | Neves et al. (2019) | Refletir sobre os efeitos da atividade física na plasticidade cerebral. | Revisão bibliográfica | – A prática de tarefas motoras induz mudanças plásticas e dinâmicas no SNC. |
| Neuroplasticity induced by exercise | Abrahamson (2017) | Abordar de maneira geral a plasticidade relacionada ao exercício. | Revisão bibliográfica | – O trabalho motor intensifica a recuperação e prevenção de danos cerebrais. – A neuroplasticidade leva a um aumento das neurotrofinas. |
| Effects of Physical Exercise on Neuroplasticity and Brain Function: a systematic review in human and animal studies | Fernandes et al. (2020) | Avaliar os efeitos de diferentes protocolos de EF nos componentes da neuroplasticidade e na função cerebral em um modelo humano e animal. | Revisão bibliográfica | – Níveis diminuídos de neurotrofinas estão associados à redução de funções cerebrais. – O BDNF atravessa a barreira hematoencefálica para ativar o SNC. – O EF aumenta a expressão de BDNF. |
| Exerkines and long-term synaptic potentiation: Mechanisms of exercise-induced neuroplasticity | Vints et al. (2022) | Resumir as vias sinápticas que são ativadas pelo exercício e podem potencializar a LTP. | Revisão bibliográfica | – EF induz a neuroplasticidade – A permeabilidade da barreira hematoencefálica é um tema em discussão. – EF gera alterações nos neurotransmissores que afetam a plasticidade cerebral. |
| Rehabilitation Induced Neural Plasticity after Acquired Brain Injury | Turolla et al. (2018) | Identificar a possibilidade de induzir a reorganização funcional dos circuitos corticais após lesões do sistema nervoso central por meio da neuroplasticidade dependente, mediante a reabilitação. | Revisão Bibliográfica | – A neuroplasticidade estimula a aprendizagem de habilidades motoras. -Atividades motoras aumentam os níveis de BDNF. |
| Intensive exercise ameliorates motor and cognitive symptoms in experimental Parkinson’s disease restoring striatal synaptic plasticity | Marino et al. (2023) | Esclarecer os mecanismos subjacentes aos efeitos benéficos do exercício nas alterações neuronais associadas à DP | Estudo experimental | – O BDNF é o principal biomarcador de neuroplasticidade induzida pelo EF. -.O exercício aeróbico pode melhorar a neuroplasticidade em pacientes com DP. |
| Effect of Exercise on Brain-Derived Neurotrophic Factor in Stroke Survivors: A Systematic Review and Meta-Analysis | Ashcroft et al. (2022) | Investigar como os parâmetros do exercício físico influenciam a concentração do BDNF em sobreviventes de AVC. | Revisão sistemática e meta-análise | – EF pode favorecer a reaprendizagem motora e promover melhorias funcionais. |
| Possible Neuroprotective Mechanisms of Physical Exercise in Neurodegeneration | Mahalakshmi et al. (2020) | Revisar os efeitos protetores do exercício físico em decorrência de doenças neurodegenerativas | Revisão sistemática | – EF afeta múltiplas vias neurofisiológicas, incluindo a autofagia, neurogênese e defesa antioxidante, reduzindo a apoptose e a neurodegeneração. – O EF aumenta a expressão de fatores neurotróficos e regula neurotransmissores e citocinas inflamatórias no hipocampo. |
| Cytokine-, Neurotrophin-, and Motor Rehabilitation-Indu ced Plasticity in Parkinson’s Disease | Policastro et al. (2020) | Fornecer uma visão geral sobre o papel biológico das moléculas pró-inflamatórias na DP e como a reabilitação motora modular a neuroinflamação, restaurar a plasticidade neural e melhorar a função motora na DP. | Revisão Bibliográfica | – O exercício físico restaura sinapses e propriedades neurofisiológicas através da regulação de neurotransmissores. – Mediadores pró-inflamatórios podem comprometer a plasticidade cerebral. |
| The Neuroprotective Effect of Irisin in Ischemic Stroke | Liu et al. (2020) | Resumir a estrutura e distribuição da irisina em diferentes tecidos, o efeito neuroprotetor da geração de irisina via exercício em acidente vascular cerebral isquêmico e a correlação do exercício e da irisina na dinâmica mitocondrial. | Revisão bibliográfica | – A irisina, liberada durante o exercício, pode aumentar os níveis do BDNF. |
| Effects of aerobic physical exercise on neuroplasticity after stroke: systematic review | Penna et al. (2021) | Investigar o impacto do exercício aeróbico na neuroplasticidade em pacientes com sequelas de AVC. | Revisão sistemática | – A atividade física tem um efeito positivo na neuroplasticidade pós-AVC. |
| Exercício físico, neuroplasticidade e acidente vascular encefálico | Oliveira et al. (2024) | Buscar na literatura quais os estímulos a partir do exercício físico que geram neuroplasticidade em pacientes de pós AVE. | Revisão integrativa da literatura | – O treinamento físico pode promover a neuroplasticidade. |
| Brain Functional Reserve in the Context of Neuroplasticity after Stroke. | Dabrowski et al. (2019) | Explorar os biomarcadores e mecanismos de neuroplasticidade após o AVC isquêmico para melhorar diagnósticos, prognósticos e terapias. | Revisão de literatura | – O trabalho físico individualizado influência no reaprendizado motor global. |
| Neuroplasticity and Neuroprotective Effect of Treadmill Training in the Chronic Mouse Model of Parkinson’s Disease | Palasz et al. (2019) | Investigar o impacto do início precoce e tardio do treinamento físico em modelos de camundongos com parkinsonismo induzido por neurotoxinas (MPTP) | Estudo experimental | – O EF promove mecanismos neuroprotetores na DP. |
| Treadmill exercise intervention improves gait and postural control in alpha-synuclein mouse models without inducing cerebral autophagy | Minakaki et al. (2019) | Avaliar os efeitos do exercício em esteira na marcha, controle postural e regulação bioquímica em modelos de camundongos com expressão de alfa-sinucleína, relevante para a doença de Parkinson. | Estudo experimental | – O exercício pode reduzir a neurodegeneração e promover a recuperação funcional em indivíduos com DP. |
| Exercise-Induced Neuroplasticity in Parkinson’s Disease: a metasynthesis of the literature | Johansson et al. (2020) | Realizar uma revisão sistemática e metassíntese de estudos em humanos sobre os efeitos do exercício físico na neuroplasticidade em pessoas com doença de Parkinson (DP) | Revisão sistemática e metassíntese | – A neuroplasticidade é essencial para o aprendizado e a memória. – A repetição de um estímulo possibilita ao indivíduo adaptar seu desempenho. |
| Efeitos do exercício físico no sistema nervoso do indivíduo idoso e suas consequências funcionais. | Scianni et al. (2019) | Revisar a literatura sobre os efeitos do exercício físico nas estruturas e funções do sistema nervoso (SN) de idosos e reportar os exercícios e parâmetros frequentemente usados. | Revisão de literatura | – A atividade motora influenciou positivamente as funções cerebrais e cognitivas. |
| Os efeitos da prática de atividades motoras sobre a neuroplasticidade | Borella et al. (2019) | Propor que a neuroplasticidade seja dependente do aprendizado ou do treino de atividades. | Revisão bibliográfica | – A reabilitação física visa facilitar a aprendizagem ou a reaprendizagem motora. |
A análise dos estudos do Quadro 1 evidencia que a prática de tarefas motoras induz mudanças plásticas e dinâmicas no SNC, de modo que as evidências científicas atuais indicam que a cada atividade, o cérebro altera sua própria estrutura, otimiza seus circuitos e se torna mais capacitado para realizar diversas tarefas. Esse mecanismo se dá pelo processo de aprendizagem, em que as células neurais e suas conexões passam por modificações, incluindo o crescimento de novas terminações sinápticas, o aumento das áreas sinápticas funcionais e um incremento nos níveis de neurotransmissores (Neves et al., 2019).
De forma semelhante, Abrahamson (2017) reafirma a ideia de que o trabalho motor pode intensificar a recuperação e prevenção de danos cerebrais, evidenciado por dados científicos que demonstram que o cérebro responde a estímulos provenientes da atividade física. Tal autor, assim como Fernandes et al. (2020), reforça a influência das neurotrofinas na neuroplasticidade, de modo que desempenham um papel vital na sobrevivência e funcionalidade dos sistemas nervosos central e periférico. Destacando-se principalmente o fator neurotrófico derivado da linha celular glial (GDNF), fator de crescimento nervoso, neurotrofina 3, neurotrofina 4 e fator neurotrófico derivado do cérebro (BDNF), essa família de proteínas, em baixos níveis, estão diretamente associadas à redução das funções cerebrais, como concentração, aprendizado e memória.
Segundo Vints et al. (2022), o exercício físico pode induzir neuroplasticidade, fortalecendo as conexões neurais no cérebro. Isso ocorre por meio de mecanismos que promovem adaptações estruturais e funcionais no SNC, como o aumento da sinaptogênese, neurogênese e reorganização sináptica, favorecendo uma melhor comunicação entre os neurônios. Turolla et al. (2018) confirmaram o achado e completou que o desenvolvimento de movimentos habilidosos fortalece as conexões espaço-temporais entre redes neurais específicas, enquanto outras conexões são enfraquecidas, ajustando a eficiência das redes para otimizar o desempenho motor. Porém, alertou que oferecer treinamento sem promover a aprendizagem pode prejudicar o cérebro, resultando em uma redução no número de sinapses, respostas pós-sinápticas mais fracas e deterioração nas habilidades comportamentais.
Dois estudos fornecem uma visão abrangente sobre a plasticidade neural induzida pela reabilitação. Turolla et al. (2018) reconheceram cinco grupos de biomarcadores como cruciais para a recuperação, mediante o treinamento após AVC: miocinas, fatores neurotróficos, neuropeptídeos, fatores de crescimento (GF) e moléculas semelhantes a GF e citocinas. Por outro lado, Marino et al. (2023) destacam o BDNF como o principal biomarcador de neuroplasticidade e benefícios do exercício. Os autores Ashcroft et al. (2022) e Mahalakshmi et al. (2020) validam a constatação e de forma análoga, citam que a regulação do BDNF por meio do exercício físico é crucial, já que essa molécula exerce funções importantes na plasticidade neuronal, transmissão sináptica, resiliência ao estresse neuronal e diferenciação de neurônios. O BDNF também ativa moléculas de suporte como o NFκB (fator nuclear kappa B) e dopamina, influenciando processos de reparação e adaptação neuronal. Por isso, o exercício físico apresenta muitos efeitos interligados e positivos no cérebro, impactando diversos mecanismos que sustentam a neuroplasticidade e o funcionamento cerebral, como mostrado na Figura 4.
Figura 4 Efeitos do exercício físico no cérebro.
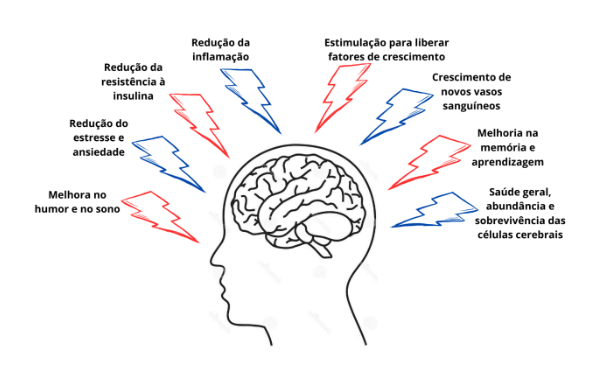
O BDNF é reconhecido como um fator de crescimento com diversas propriedades neurotróficas e neuroprotetoras no sistema nervoso central e na periferia. Fernandes et al. (2020) explicam que tal fator trófico pode inclusive agir como um metabólito em resposta à contração do músculo esquelético, transportado pela corrente sanguínea e atravessando a barreira hematoencefálica para ativar o SNC. Em contrapartida, Vints et al. (2022) demonstram que a discussão sobre a relação entre os níveis periféricos e centrais de BDNF é complexa, sugerindo que a permeabilidade da barreira hematoencefálica pode ser baixa ou ausente, sendo possível que os aumentos de BDNF no SNC após o exercício sejam apenas resultado da estimulação de sua síntese central.
Quadro 2 Quadro demonstrativo do papel do exercício nas doenças neurológicas e mecanismos envolvidos.
| O papel do exercício nas doenças neurológicas e mecanismos envolvidos | Resultados |
| Regulação neuroendócrina | – O exercício leva a uma redução da resposta hormonal ao estresse em exercícios submáximos. – A resposta neuroendócrina aumenta com o volume do exercício. |
| Regulação de neurotransmissores | – O EF afeta os sistemas dopaminérgico, serotoninérgico e noradrenérgico centrais. |
| Sinalização de insulina neural | – O EF pode melhorar a sinalização da insulina e exercer efeitos neuroprotetores. |
| Sinalização do fator neurotrófico derivado do cérebro BDNF | – O trabalho motor aumenta a expressão de BDNF, promovendo a plasticidade neural. |
| Produção e Secreção de Irisina | – A irisina pode aumentar a expressão do BDNF no cérebro, promovendo efeitos neuroprotetores. |
| Respostas anti-neuro-inflamatórias e anti-neuro-oxidativas | – Após o EF, diversas proteoformas séricas relacionadas a funções antioxidantes e anti-inflamatórias são alteradas, contribuindo para a proteção neuronal. |
| Efeitos neurais pró-sobrevivência e anti-apoptose | – O EF aumenta a expressão de fatores neurotróficos, favorecendo o crescimento neuronal e preservando células neuronais. |
| Autofagia | – O EF pode promover a autofagia, crucial para a proteção neuronal e prevenção de doenças neurodegenerativas. |
Sob a óptica de Mahalakshmi et al. (2020), a falta de atividade física aumenta o risco de AVC, Alzheimer e Parkinson, consequentemente, um estudo realizado com idosos, demonstrou que exercícios aeróbicos melhoram a função cognitiva. Em vista disso, ele apontou o papel do EF nas doenças neurológicas e os mecanismos envolvidos no processo, conforme o Quadro 2. O autor inicia discorrendo acerca da regulação neuroendócrina, abordando a prática de EF como um estressor que ativa o sistema neuroendócrino. Com o treinamento crônico, há adaptações que reduzem a resposta hormonal ao estresse durante exercícios submáximos. O EF altera os níveis de hormônios como vasopressina e cortisol, e quanto maior o volume de exercício, maior a resposta neuroendócrina. Essa prática desencadeia respostas fisiológicas coordenadas, envolvendo o eixo hipotálamo-hipófise adrenal e ativação do sistema nervoso simpático.
Na sequência, discorre sobre a regulação de neurotransmissores, Mahalakshmi et al. (2020) relata que o EF afeta os sistemas dopaminérgico, serotoninérgico e noradrenérgico centrais. Ele modula a liberação de neurotransmissores como dopamina (DA), noradrenalina (NA) e serotonina (5-HT), que são aumentados durante o exercício. A DA, por exemplo, é regulada pelo aumento dos níveis de cálcio no cérebro durante a atividade física. Além disso, o exercício também promove adaptações neurais que protegem contra o estresse, inibindo a liberação de NA, o que reduz a ansiedade e favorece a memória. O EF ainda aumenta os níveis de NA na medula espinhal, indicando uma possível relação com melhorias cognitivas induzidas pelo exercício. Vints et al. (2022) atesta e conclui que além da DA, o trabalho motor agudo também causa mudanças temporárias nos níveis de neurotransmissores, como glutamato e GABA. De modo que esses neurotransmissores são essenciais na neuroplasticidade, atuando na potenciação de longo prazo (LTP) e na depressão de longo prazo (LTD) sináptica. A LTP fortalece conexões sinápticas, enquanto LTD as enfraquece, ambos através de processos rápidos, como a fosforilação, e de processos mais lentos, que envolvem a produção de novas proteínas sinápticas ao ativar a transcrição gênica.
Seguindo a mesma linha de raciocínio, Policastro et al. (2020) apresentam que o trabalho motor aumenta a liberação de dopamina e reduz a expressão do transportador de dopamina (DAT), melhorando a plasticidade sináptica. Em exercícios extenuantes, é possível reverter a redução dos receptores de dopamina D2 no estriado dorsal, um efeito crucial para o aprendizado motor avançado e o desenvolvimento da automaticidade. Além de impactar o sistema dopaminérgico, o exercício também modula a neurotransmissão do glutamato, ajudando a restaurar receptores como AMPA (ácido α-amino-3-hidroxi-5-metil-4-isoxazolpropiónico), importantes em várias doenças neurológicas e potencialmente alvo de tratamentos. Esses efeitos do exercício sobre os receptores de glutamato melhoram o armazenamento e a liberação do neurotransmissor, o que é essencial para equilibrar a excitabilidade e reduzir a inibição excessiva no estriado depletado de dopamina, como ocorre no Parkinson. Assim, o exercício físico promove a restauração das sinapses e das propriedades neurofisiológicas no estriado, suportando o funcionamento normal dos circuitos motores e contribuindo para a melhoria da função motora em condições neurológicas.
Conforme mencionado por Mahalakshmi et al. (2020), outro mecanismo na neuroplasticidade por meio da reabilitação motora é a sinalização da insulina no cérebro, que é essencial para a sobrevivência neuronal e a manutenção de funções cognitivas, além de prevenir defeitos no transporte de BDNF. A desregulação dela está ligada a várias doenças, como diabetes e doenças neurodegenerativas. O receptor de insulina, altamente expresso no hipocampo, é crucial para funções de aprendizado e memória. O EF pode melhorar a sinalização da insulina e exercer efeitos neuroprotetores, além de promover a neurogênese, angiogênese e plasticidade sináptica. Contudo, afirmaram que os mecanismos moleculares envolvidos ainda não são completamente compreendidos.
Adicionalmente, ressaltou a sinalização do BDNF, uma neurotrofina expressa no hipocampo, essencial para processos de memória e aprendizado. Ele regula a plasticidade sináptica, a diferenciação e maturação neuronal, e contribui para a resistência ao estresse neuronal. O exercício físico, especialmente de resistência, é conhecido por aumentar a expressão do BDNF, promovendo crescimento cerebral e melhorando funções cognitivas. Estudos em animais mostraram que atividades motoras aumentam os níveis de BDNF, influenciam a morfologia dos astrócitos, aprimoram a função neuronal e promovem a recuperação em casos de lesão nervosa, melhorando a plasticidade neuronal e a regeneração, especialmente em áreas ligadas à memória, confirmado por Turolla et al. (2018) e Fernandes et al. (2020), anteriormente citados.
Liu et al. (2020) e Mahalakshmi et al. (2020) contribuem com um ponto de vista adicional acerca da produção e secreção de irisina após trabalho motor. Ela é uma miocina liberada pelos músculos em resposta ao exercício, originada da proteína FNDC5 e desempenha um papel importante na termogênese, melhora da homeostase da glicose e pode ajudar a prevenir a obesidade. Acredita-se que a irisina, liberada durante o exercício, pode aumentar os níveis do BDNF, um componente essencial para a proteção e sobrevivência de células nervosas, especialmente em contextos de AVC isquêmico. Essa miocina também influencia positivamente a dinâmica mitocondrial, que é crucial para manter a função adequada das células nervosas e apoiar a recuperação neuronal após lesões. Esses efeitos contribuem para a neuroplasticidade e ajudam a mitigar danos causados por eventos isquêmicos, reforçando assim o papel da irisina como uma ponte entre a atividade motora e a saúde cerebral.
Outro tópico relevante são as respostas anti-neuro-inflamatórias e anti-neuro-oxidativas decorrentes da plasticidade neural induzida pelo EF. Mahalakshmi et al. (2020) ressaltam que a atividade motora ativa o sistema nervoso autônomo e o eixo hipotálamo-hipófise-adrenal, o que resulta no aumento dos níveis de cortisol e catecolaminas, além de estimular a liberação de hormônios como o do crescimento e prolactina. Estudos recentes revelaram que, após o EF, diversas proteoformas séricas relacionadas às funções antioxidantes e anti-inflamatórias são alteradas, contribuindo para a proteção neuronal. Essas mudanças promovem a neuroplasticidade e podem ajudar a prevenir doenças neurodegenerativas.
De modo similar, Policastro et al. (2020) confirmam e atesta que a superprodução de mediadores pró-inflamatórios podem comprometer a plasticidade cerebral ao reduzir a produção de fatores como o BDNF e o GDNF, o que afeta a capacidade do SNC de se adaptar a estímulos externos. O exercício físico, por outro lado, tem sido reconhecido por sua capacidade de aumentar a neuroplasticidade, melhorando o desempenho motor e cognitivo, pois promove a preservação dos neurônios dopaminérgicos e a restauração dos terminais dopaminérgicos no estriado. Esse efeito neuroprotetor do exercício é frequentemente associado ao aumento de fatores neurotróficos e à regulação do DAT.
Em última análise, foi referido os efeitos neurais pró-sobrevivência e antiapoptose, e autofagia resultantes dos efeitos plásticos estimulados pela reabilitação motora. No primeiro, Mahalakshmi et al. (2020) mencionou que o EF não só influencia a atividade celular no cérebro, mas também sua sobrevivência e morte. Um estudo com animais revelou que o exercício, em combinação com um ambiente enriquecido, melhora a função cognitiva e promove a neurogênese e microvasculatura cerebral em condições de hipóxia. O EF também aumenta a expressão de fatores neurotróficos, favorecendo o crescimento neuronal e preservando células neuronais. Além disso, a expressão de proteínas de sobrevivência, como mTOR (mammalian target of rapamycin) e BDNF, é elevada, contribuindo para a proteção contra demência e diabetes tipo II. Já no último, é citado que a evolução favoreceu organismos que desenvolvem habilidades físicas e cognitivas superiores em condições estressantes. O exercício físico pode otimizar a função cerebral e ativar vias de resposta ao estresse, promovendo a biogênese mitocondrial e a autofagia. Essa última é crucial para a saúde neuronal e pode ajudar a prevenir doenças neurodegenerativas, como Alzheimer, ao reduzir a acumulação de beta-amiloide. O exercício voluntário é um indutor fisiológico da autofagia, oferecendo proteção neuronal.
Penna et al. (2021), com enfoque em patologias associadas à neuroplasticidade, relatam que a atividade diária, o treinamento e o aprendizado desempenham uma influência essencial sobre a função cerebral. Pesquisas recentes apontam que a atividade física tem um efeito positivo na neuroplasticidade pós-AVC, indicando que o trabalho motor pode aprimorar a cognição e a funcionalidade. Isso em razão da sua ação potencializadora da neuroplasticidade, por meio da angiogênese, reestruturação glial, neurogênese e crescimento neuronal. Desse modo, é evidente a capacidade de considerável aumento na capacidade intelectual, memória, concentração e raciocínio lógico através de aprendizado especializado regular. No contexto de distúrbios neurológicos, com a plasticidade neural compensatória, é possível alcançar melhorias significativas no desempenho prejudicado.
Seguindo essa lógica, Oliveira et al. (2024), em sintonia com o que foi discutido, relatam que o treinamento físico pode reduzir alterações no trato corticoespinhal após um AVC, que afetam a marcha e a coordenação, promovendo a neuroplasticidade. Uma pesquisa revelou que uma sessão de exercício aeróbico moderado pode estimular a neuroplasticidade em sobreviventes de AVC, preparando o cérebro para outras formas de reabilitação. Essas abordagens, que fortalecem as conexões no hemisfério cerebral oposto à lesão, podem potencializar a recuperação funcional após um AVC.
Na mesma direção argumentativa, Dabrowski et al. (2019) e Ashcroft et al. (2022), concordam que o trabalho físico individualizado pode influenciar positivamente a melhoria cognitiva, desempenhando assim um papel direto no reaprendizado motor global. Essa prática pode estimular redes neurais adicionais, contribuindo para uma aprimorada recuperação motora, assim promovendo melhorias funcionais no indivíduo. No entanto, observa-se uma considerável oscilação nas respostas à prescrição de exercícios e nas métricas de neuroplasticidade. Porém, entre as diversas técnicas para reabilitação da hemiplegia, sequela do AVC, foram relevantes: a facilitação neuromuscular proprioceptiva, o tratamento neurodesenvolvimental ou Bobath, a terapia de movimento induzido por restrição, treinamento orientado para cima em uma abordagem de treinamento orientado para tarefas, plasticidade neuromusculoesquelética e terapia ocupacional baseada na abordagem SMART – específica, mensurável, atrativa, real e oportuna. Logo, a terapia proposta para a reabilitação de cada paciente deve ser adaptada às necessidades e capacidades individuais em cada momento.
Conforme descrito por Palasz et al. (2019), o EF é reconhecido como uma parte essencial do manejo da DP, devido aos seus mecanismos neuroprotetores. O trabalho motor ativa processos celulares e moleculares que promovem e mantêm a plasticidade cerebral, incluindo expressão de genes relacionados, neurogênese, aumento da vascularização e do metabolismo cerebral. Os astrócitos, como fatores influentes na plasticidade sináptica e neurogênese, merecem atenção especial. Sendo as células gliais mais abundantes, desempenham um papel essencial na função cerebral. Apesar disso, há uma lacuna significativa nas pesquisas sobre o papel dos astrócitos na neurodegeneração. Estudos em modelos experimentais destacam a importância das vias de sinalização entre astrócitos e neurônios dopaminérgicos. Na DP, os astrócitos estão diretamente envolvidos na sobrevivência e viabilidade dos neurônios.
A pesquisa de Marino et al. (2023) reforça essa proposta ao sugerir que o exercício aeróbico pode melhorar a neuroplasticidade em pacientes com DP, fortalecendo as conexões entre o putâmen e o córtex sensório-motor, contribuindo para melhorias cognitivas e motoras. Além disso, a reabilitação motora modula a via dopaminérgica, aumentando a liberação de dopamina e promovendo a plasticidade na rede corticoestriatal. O referido autor e Minakaki et al. (2019) concordaram que esses efeitos, potencialmente mediados pelo aumento do BDNF, indicam que o exercício pode ser uma estratégia viável para reduzir a neurodegeneração e estimular a recuperação funcional em indivíduos com DP, oferecendo benefícios para a função motora.
Ao analisar as contribuições de Johansson et al. (2020), observa-se que a neuroplasticidade, além de restaurar a função cerebral, também corrige distúrbios do desenvolvimento e desempenha um papel crucial no aprendizado e na memória. Sua ativação é uma resposta a diversas influências, incluindo doenças neurodegenerativas e intervenções farmacológicas. A recuperação de danos cerebrais está intrinsecamente ligada ao grau e à extensão das lesões centrais, sendo crucial na implementação de estratégias de neuroreabilitação e tratamento neuropsicológico em pacientes com distúrbios do SNC.
Coerente com essa visão, Dabrowski et al. (2019) discutem que a plasticidade neural viabiliza o avanço do SNC mediante a influência da predisposição dos indivíduos e estímulos ambientais variáveis, favorecendo o aprendizado e memorização. Desse modo, uma abordagem de tratamento bem executada possibilita que a reabilitação transcenda os limites hospitalares ou domiciliares, promovendo a independência funcional dos pacientes. Porém, o modo de alcançar esse resultado ainda é incerto, assim, terapeutas e pesquisadores persistem explorando novas perspectivas de influenciar o sistema neuronal, podendo contribuir para avanços funcionais e aprimorar a capacidade de utilizar os mecanismos de plasticidade neuronal em casos de lesões no futuro.
De forma consistente com essa ideia, Scianni et al. (2019) defendem que a atividade motora influenciou positivamente as funções cerebrais e cognitivas, gerando um aumento da matéria branca e cinzenta, melhorando o aprendizado e a memória. Além disso, pode minimizar o risco de doenças neurodegenerativas e retardar o declínio cognitivo, assim como resultar na redução da ansiedade e da depressão. Essas melhorias sugeridas pela atividade física estão relacionadas ao aumento da neurogênese adulta no hipocampo e à elevação da plasticidade sináptica dependente da atividade. Logo, o exercício físico está relacionado a avanços na saúde física, contentamento na vida, desempenho cognitivo e bem-estar psicológico.
Em concordância com essa abordagem, Borella et al. (2019) revelam que a reabilitação física visa facilitar a aprendizagem ou a reaprendizagem motora. Este processo envolve a modificação das respostas motoras dos organismos podendo ser temporária ou definitiva, resultando em aprimoramento de desempenho por meio da prática. Desse modo, a execução regular de uma atividade motora que exige habilidade leva a um aumento na representação cortical dos músculos utilizados nessa atividade específica. Por exemplo, indivíduos com deficiência visual apresentam uma expansão na representação sensório-motora cortical dos dedos usados para leitura em braille, variando de acordo com o padrão de atividade de leitura.
Por fim, Johansson et al. (2020) concluem que a neuroplasticidade é um fenômeno contínuo, que impulsiona a remodelação gradual de todo o cérebro ao longo do tempo, adaptando suas funções neuronais a curto, médio e longo prazo. A repetição de uma resposta a estímulos especializados consecutivos, em contextos variados, possibilita ao indivíduo identificar consciente ou inconscientemente a sua importância e adaptar seu desempenho em atividades funcionais. Esta teoria pode ser um meio eficaz de aprendizagem, de forma que utiliza abordagens como a imitação de ações, a repetição verbal durante o treinamento e a prática contínua com aprimoramento.
Conclusão
Este estudo revisou o papel da plasticidade neural em resposta a estímulos motores, destacando os mecanismos subjacentes que influenciam a recuperação funcional. Os resultados mostraram que o exercício físico é um catalisador importante para o aumento da plasticidade neural e da reorganização sináptica, promovendo melhorias na funcionalidade e na recuperação motora. Esses efeitos positivos estão ligados a mecanismos específicos, como a neurogênese, sinaptogênese e a liberação de fatores neurotróficos, que contribuem para a resiliência e adaptação do sistema nervoso.
Estes achados reforçam a importância do exercício como uma intervenção potencialmente eficaz para a reabilitação, pois proporciona adaptações neurais que contribuem para a restauração das capacidades motoras do indivíduo. De modo que, futuras pesquisas poderão explorar mais profundamente os tipos e intensidades de exercícios que maximizam esses efeitos, além de investigar a aplicabilidade dessas intervenções em diferentes fases de recuperação e em populações com variados perfis de lesões, com o objetivo de otimizar a reabilitação funcional.
Em suma, este trabalho contribui para uma visão abrangente do potencial da neuroplasticidade em decorrência do estímulo motor, atuando não apenas como um meio de recuperação, mas também como uma ferramenta poderosa para a ativação de processos neurais que sustentam a adaptação e a saúde cerebral. A fim de promover assim uma compreensão mais ampla da relação entre neuroplasticidade e exercício físico, oferecendo insights para aprimorar estratégias de reabilitação funcional.
Referências
ABRAHAMSSON, Sebastian. Neuroplasticity induced by exercise. Diva, Skövde, p. 1-56, ago. 2017. Disponível em: https://www.diva-portal.org/smash/get/diva2:1120798/FULLTEXT01.pdf. Acesso em: 07 ago. 2024.
ASHCROFT, Sarah K. et al. Effect of Exercise on Brain-Derived Neurotrophic Factor in Stroke Survivors: a systematic review and meta-analysis. Stroke, [S.L.], v. 53, n. 12, p. 3706-3716, dez. 2022. Ovid Technologies (Wolters Kluwer Health). http://dx.doi.org/10.1161/strokeaha.122.039 919.
BONFIM, Vânia da Silva Galves et al. A importância do exercício físico para neuroplasticidade e aprendizado. Arquivos do Mudi, Maringá, v. 23, n. 3, p. 189-200, set. 2019. Disponível em: https://periodicos.uem.br/ojs/index.php/A rqMudi/article/view/51537/751375149159. Acesso em: 03 set. 2023.
BORELLA, Marcella de Pinho et al. Os efeitos da prática de atividades motoras sobre a neuroplasticidade. Revista Neurociências, [S.L.], v. 17, n. 2, p. 161-169, 23 jan. 2019. Universidade Federal de São Paulo. http://dx.doi.org/10.34024/rnc.2009.v17.85 77.
CAIMAR, Bruna Araújo; LOPES, Gabriel César Dias. NEUROPLASTICIDADE: uma análise da neurociência. Cognitionis Scientific Journal, [S.L.], v. 3, n. 1, p. 1-7, 10 maio 2020. South Florida Publishing LLC. http://dx.doi.org/10.38087/2595.8801.37
CARVALHO, Aline dos Santos Moreira de et al. Neural plasticity, a path to learning: a brief analysis: a brief analysis. Research, Society And Development, [S.L.], v. 10, n. 16, p. 1-6, 18 dez. 2021. Disponível em: https://rsdjournal.org/index.php/rsd/articl e/view/24103/21192. Acesso em: 10 set. 2023.
CASTRO, Cristine de Paula Nascimento et al. Exercício físico e neuroplasticidade hipocampal: Revisão de literatura. Vittalle: Revista de Ciências da Saúde, Florianópolis, v. 29, n. 2, p. 57-78, 12 nov. 2017. Disponível em: https://seer.furg.br/vittalle/article/view/74 61. Acesso em: 29 ago. 2023.
DABROWSKI, Jan et al. Brain Functional Reserve in the Context of Neuroplasticity after Stroke. Neural Plasticity, p. 1-10, 27 fev. 2019. Hindawi Limited. http://dx.doi.org/10.1155/2019/9708905
DAVIS, Katrina. A ciência por trás da neuroplasticidade: como podemos reprogramar nosso cérebro. Jovens Cientistas Brasil, 03 mai. 2023. Disponível em: https://www.jovenscientistasbrasil.com.br/post/a-ci%C3%AAncia-por-tr%C3%A1sda-neuroplasticidade-como-podemos-reprogramar-nosso-c%C3%A9rebro. Acesso em: 06 ago. 2024.
DORSZEWSKA, Jolanta et al. Neuroplasticity in the Pathology of Neurodegenerative Diseases. Neural Plasticity, [S.L.], p. 1-2, 27 maio 2020. Hindawi Limited. http://dx.doi.org/10.1155/2020/4245821.
FERNANDES, Matheus Santos de Sousa et al. Effects of Physical Exercise on Neuroplasticity and Brain Function: a systematic review in human and animal studies. Neural Plasticity, [S.L.], p. 1-21, 14 dez. 2020. Hindawi Limited. http://dx.doi.org/10.1155/2020/8856621.
JOHANSSON, Hanna et al. Exercise-Induced Neuroplasticity in Parkinson’s Disease: a metasynthesis of the literature. Neural Plasticity, [S.L.], p. 1-15, 6 mar. 2020. Hindawi Limited. http://dx.doi.org/10.1155/2020/8961493.
LIMA, Maria do Carmo Gonçalves da Silva. Plasticidade neural, neurociência e educação: as bases do aprendizado. Arquivos do Mudi, Maringá, v. 24, n. 2, p. 30-41, 01 set. 2020.
LIU, Yaqiang et al. The Neuroprotective Effect of Irisin in Ischemic Stroke. Frontiers In Aging Neuroscience, [S.L.], v. 12, n. 2020, p. 1-7, 22 dez. 2020. Frontiers Media SA. http://dx.doi.org/10.3389/fnagi.2020.5889 58.
MAHALAKSHMI, B. et al. Possible Neuroprotective Mechanisms of Physical Exercise in Neurodegeneration. International Journal Of Molecular Sciences, [S.L.], v. 21, n. 16, p. 1-17, 16 ago. 2020. MDPI AG. http://dx.doi.org/10.3390/ijms21165895.
MARÍN-MEDINA, Daniel S. et al. New approaches to recovery after stroke. Neurological Sciences, [S.L.], v. 45, n. 1, p. 55-63, 11 set. 2023. Springer Science and Business Media LLC. http://dx.doi.org/10.1007/s10072-023-070 12-3.
MARINO, Gioia et al. Intensive exercise ameliorates motor and cognitive symptoms in experimental Parkinson’s disease restoring striatal synaptic plasticity. Science Advances, [S.L.], v. 9, n. 28, p. 1-14, 14 jul. 2023. American Association for the Advancement of Science (AAAS). http://dx.doi.org/10.1126/sciadv.adh1403.
MINAKAKI, Georgia et al. Treadmill exercise intervention improves gait and postural control in alpha-synuclein mouse models without inducing cerebral autophagy. Behavioural Brain Research, [S.L.], v. 363, p. 199-215, maio 2019. Elsevier BV. http://dx.doi.org/10.1016/j.bbr.2018.11.035.
NEVES, Geraldo Nepomuceno das et al. Atividade física e o desenvolvimento da Plasticidade Cerebral. Faculdade Sant’ana em Revista, Ponta Grossa, v. 3, n. 2, p. 158-169, 09 out. 2019. Disponível em: https://www.iessa.edu.br/revista/index.ph p/fsr/article/view/1237. Acesso em: 10 set. 2023.
OLIVEIRA, Luciana Mendes et al. EXERCÍCIO FÍSICO, NEUROPLASTICIDADE E ACIDENTE VASCULAR ENCEFÁLICO. Centro de Pesquisas Avançadas em Qualidade de Vida, [S.L.], v. 16, n. 1, p. 1-11, 10 fev. 2024. Revista CPAQV. http://dx.doi.org/10.36692/v16n1-6r.
PALASZ, Ewelina et al. Neuroplasticity and Neuroprotective Effect of Treadmill Training in the Chronic Mouse Model of Parkinson’s Disease. Neural Plasticity, [S.L.], v. 2019, n. 0, p. 1-14, 3 abr. 2019. Hindawi Limited. http://dx.doi.org/10.1155/2019/8215017.
PENNA, Leandro Goursand et al. Effects of aerobic physical exercise on neuroplasticity after stroke: systematic review. Arquivos de Neuro-Psiquiatria, [S.L.], v. 79, n. 9, p.832-843, set. 2021. FapUNIFESP (SciELO). http://dx.doi.org/10.1590/0004-282x-anp-2020-0551.
POLICASTRO, Gabriella et al. Cytokine-, Neurotrophin-, and Motor Rehabilitation-Induced Plasticity in Parkinson’s Disease. Neural Plasticity, [S.L.], v. 2020, n. 1, p. 1-15, 26 nov. 2020. Hindawi Limited. http://dx.doi.org/10.1155/2020/8814028.
ROTONDO, Rossella et al. Physical activity and neurotrophic factors as potential drivers of neuroplasticity in Parkinson’s Disease: a systematic review and meta-analysis. Ageing Research Reviews, [S.L.], v. 92, dez. 2023. Elsevier BV. http://dx.doi.org/10.1016/j.arr.2023.102089
SALOMÃO, Laís Monteiro. Neuroplasticidade: uma abordagem neurocientífica do cérebro em transformação. 2021. Trabalho de Conclusão de Curso (Graduação) – Faculdade de Ciências Farmacêuticas, Universidade de São Paulo, São Paulo, 2021. Disponível em: https://repositorio.usp.br/directbitstream/ 87cab12f-ab67-4528-b22d-eb4265f1e8e3/3070039.pdf. Acesso em: 10 set.. 2023.
SCIANNI, Aline Alvim et al. Efeitos do exercício físico no sistema nervoso do indivíduo idoso e suas consequências funcionais. Revista Brasileira de Ciências do Esporte, [S.L.], v. 41, n. 1, p. 81-95, jan. 2019. FapUNIFESP (SciELO). http://dx.doi.org/10.1016/j.rbce.2018.03.02 6.
TUROLLA, Andrea et al. Rehabilitation Induced Neural Plasticity after Acquired Brain Injury. Neural Plasticity, [S.L.], v. 2018, n. 1, p. 1-3, maio 2018. Hindawi Limited. http://dx.doi.org/10.1155/2018/6565418.
VINTS, Wouter A.J. et al. Exerkines and long-term synaptic potentiation: mechanisms of exercise-induced neuroplasticity. Frontiers In Neuroendocrinology, [S.L.], v. 66, n. 2022, p. 1-27, jul. 2022. Elsevier BV. http://dx.doi.org/10.1016/j.yfrne.2022.1009 93.
1Graduada em Fisioterapia pelo Ceulp/Ulbra. Palmas, Tocantins, Brasil. E-mail: victoriavieira.fisio@gmail.com
2Graduando em Fisioterapia pelo Ceulp/Ulbra. Palmas, Tocantins, Brasil. E-mail: jonatasalvesbpereira@gmail.com
3Graduando em Fisioterapia pelo Ceulp/Ulbra. Palmas, Tocantins, Brasil. E-mail: gyamada17@gmail.com
4Graduanda em Fisioterapia pelo Ceulp/Ulbra. Palmas, Tocantins, Brasil. E-mail: babi03teixeiravale@gmail.com
5Especialista em Traumato-ortopedia e Terapia intensiva neurológica. Palmas, Tocantins, Brasil. E-mail: thamirys.fisio93@gmail.com
6Doutor em Biologia celular e molecular aplicado à Saúde. Palmas, Tocantins, Brasil. E-mail: gustavosakuno@ceulp.edu.br
7Mestre em Ciências do Ambiente. Palmas, Tocantins, Brasil. E-mail: mendonça.fcardoso@gmail.com
