REGISTRO DOI: 10.5281/zenodo.7117183
Autoria de:
Tâmyza Maria Pimentel Feitosa1
Marcimar Silva Sousa2
1Graduandas do Curso de Medicina Veterinária do Centro Universitário Fametro, Manaus, Amazonas, Brasil.
2Docente Orientador Medicina Veterinária do Centro Universitário Fametro, Manaus, Amazonas, Brasil.
RESUMO
O objetivo deste estudo foi realizar uma revisão de literatura sobre processos inflamatórios no útero de éguas, com foco na endometrite equina. A endometrite é um processo inflamatório que pode ser agudo ou crônico no revestimento do útero e pode ser causado por bactérias, fungos ou outras causas. Seu principal patógeno é o Streptococcus zooepidemicus. A doença pode ser adquirida através de outros fatores como acasalamento de garanhões, inseminação artificial. Através do mecanismo de defesa uterina, a égua é capaz de eliminar o processo inflamatório. Os sintomas clínicos da endometrite são secreção de muco vulvar, relaxamento uterino, edema e derrame uterino. O diagnóstico é baseado em achados clínicos, história reprodutiva, ultrassonografia, citologia e biópsia uterina. A terapia de erradicação do patógeno, a administração de antibióticos sistêmicos ou tópicos e a limpeza uterina devem ser realizadas o mais rápido possível para manter a integridade reprodutiva do animal.
Palavras-chave: Éguas. Endometrite. Éguas atletas. Inflamação em éguas.
ABSTRACT
The aim of this study was to provide a literature review on the inflammatory process in the uterus of mares, focusing on equine endometritis. Endometritis is an inflammatory process that can be acute or chronic in the lining of the uterus and can be caused by bacteria, fungi, or other causes. Its main pathogen is Streptococcus zooepidemicus. The disease can be acquired through other factors such as stallion mating, artificial insemination. Through the uterine defense mechanism, the mare is able to eliminate the inflammatory process. The clinical symptoms of endometritis are vulvar mucus secretion, uterine relaxation, swelling and intrauterine effusion. Diagnosis is based on clinical findings, reproductive history, ultrasound, cytology, and uterine biopsy. Treatments carried out to eliminate the causative agent, administration of systemic or topical antibiotics, cleaning of the uterus, must be performed as soon as possible to preserve the reproductive integrity of the animal.
Keywords: Mares. Endometritis. Athlete mares. Inflammation in mares.
1. INTRODUÇÃO
Originalmente, os cavalos eram caçados e usados como fonte de alimento e peles, porém, começaram a ser domesticados, beneficiando ambos (RAMEY, 2017). Segundo Mcdonnell (2017), a data de domesticação dos cavalos é contestada e ocorreu na Eurásia há cerca de 8.000 anos. Entretanto Cintra (2017) estima que ocorreu entre 4.500 a 6.500 anos atrás.
Com mais 5 milhões e 777 mil cavalos, hoje o Brasil ocupa o quarto lugar no ranking mundial de maiores rebanhos, dos quais apenas 700.000 estão registrados nos serviços oficiais de genealogia (FAO, 2017, IBGE 2016). Essa posição destaca a importância da pesquisa, especialmente na área de criação de cavalos, para ampliar os produtos e serviços de biotecnologia. O Brasil transferiu 14.422 embriões de cavalos em 2010, representando 43% da atividade mundial, seguido por Argentina e Estados Unidos, segundo o Comitê de Estatísticas do IETS.
A equideocultura é um ramo do agronegócio com faturamento anual de R$ 16,15 bilhões, sendo responsável direta e indiretamente pela ocupação de 3 milhões de pessoas (BRASIL, 2017). Esse movimento é devido a criação voltada ao trabalho, esporte e ao lazer. Cavalos esportivos ou recreativos exigem mais cuidados e gastos do que os animais de trabalho no manejo de animais (CINTRA, 2017).
A reprodução desta espécie vem ganhando cada vez mais importância e nesse sentido, qualquer fator que reduza a taxa reprodutiva de uma égua pode causar enormes perdas econômicas. Segundo Nascimento e Santos (2017), as principais e mais comuns causas infertilidade em éguas são as endometrites causadas por fungos, vírus e pós-acasalamento ou inseminação, sendo as duas últimas consideradas fisiológicas (ALVES, 2020).
A endometrite pode ser considerada a maior e mais importante incidência de lesões uterinas em éguas. A infecção geralmente é adquirida durante o acasalamento ou pós-parto. A suscetibilidade pós-acasalamento à endometrite está associada a mau formações do trato reprodutivo, defeitos nos mecanismos de limpeza física do útero ou mau funcionamento dos mecanismos celulares e imunológicos, função da cérvix alterada e transmissão sexual, ou seja, de garanhões infectados (FELICIANO, 2017; THOMAS, 2017).
Normalmente, éguas suscetíveis são aquelas que não respondem rápida e efetivamente à inflamação, comumente animais com maior idade e com histórico reprodutivo ruim, como aborto espontâneo, estro recorrente e falha na coleta de embriões. Na ultrassonografia, a presença de líquido na cavidade uterina entre o estro ou 6 a 36 horas após a inseminação pode ser considerada uma égua suscetível a endometrite pós-cópula (ALVES, 2020).
2. ASPECTOS RELEVANTES NA ENDOMETRITE EM ÉGUA
2.1 Anatomia do útero na Égua
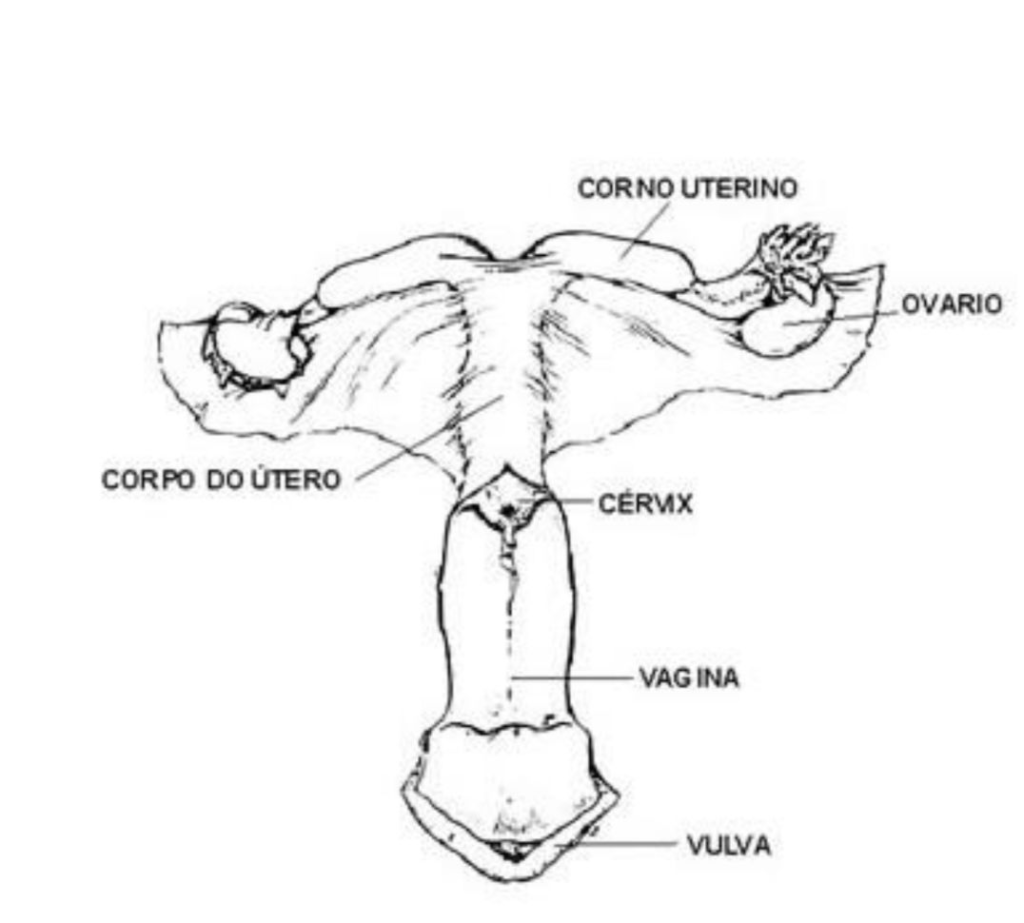
O sistema reprodutivo da égua compartilha características semelhantes a outras espécies domesticadas, mas com certas peculiaridades em tamanho, localização, anatomia macroscópica e microscópica. Seus componentes incluem os ovários, tubas uterinas, cornos uterinos, corpo do útero, cérvix, vagina vulva e clitóris, os órgãos reprodutores internos são sustentados por ligamentos, mesentério formando um grupo denominado ligamento largo do útero (PAIVA JÚNIOR, 2018). O útero está localizado na cavidade abdominal, onde se estende por uma curta distância na cavidade pélvica. Em sua composição há dois cornos uterinos, um corpo e a cérvix (HAFEZ, 2017).
A estrutura do útero é composta por três camadas de adventícia: a serosa (perimétrio) a estrutura muscular (miométrio), com uma camada externa de fibras longitudinais e outra mais espessa interna de fibras circulares, a mucosa do lúmen (endométrio) coberto por uma única camada de células colunares altas e muitas glândulas uterinas longas (DINIZ DA SILVA, 2021; GETTY, 1986).
2.2 Manejo de Égua Problema
As éguas consideradas “problema” precisam ser avaliadas individualmente para observar a evolução do quadro clínico. Para que a égua problema seja identificada é preciso um exame completo do animal, desde a nutrição ao controle parasitário, em geral são animais que quando submetidos a um manejo reprodutivo de qualidade, sêmen de boa fertilidade e um bom estado sanitário e mesmo com todos os requisitos não desenvolve gestação em três ciclos consecutivos (MCKINNON, 2011).
Inúmeras são as causas que levam a um potencial infertilidade nas éguas, desde tumores a administração de compostos que inibem a produção de GnRH, entretanto a causa mais importante é a infecção uterina. (McKINNON, 2011). Observar a suscetibilidade dos patógenos às drogas é fundamental para o sucesso do tratamento, pois a resistência bacteriana está cada vez mais presente na rotina clínica (BONEV; HOOPER; PARISOT, 2018).
2.3 Endometrite na Égua
A endometrite infecciosa equina é uma doença sexualmente transmissível causada pela bactéria Taylorella equigenitalis e algumas cepas de Klebsiella pneumoniae e Pseudomonas aeruginosa (BRITO; BARTH, 2017). A infecção através do processo de reprodução, seja por copula natural ou inseminação artificial, pode ocorrer também por instrumentos contaminados (MOREIRA, 2017). Patógenos infecciosos associados a infecções uterinas incluem também Streptococcus, Staphylococcus, Escherichia coli e Proteus e Actinomyces pyogenes, causando infecções simples ou mistas, assim como Clostridium, Micrococcus, Enterobacter e Bacillus spp. (ANDRADE, 2005; CARLTON, 2018.)
Os termos endometrite, metrite, perimetrite e parametrite referem-se à inflamação do endométrio e do miométrio, da superfície serosa uterina e das estruturas de suporte do útero, respectivamente. Sabe-se que, na grande maioria dos casos, a endometrite é uma infecção multimicrobiana causada pela ascensão de bactérias da flora vaginal normal para as estruturas uterinas. Os grupos bacterianos mais comuns são aeróbios Gram-negativos, aeróbios Gram-positivos e anaeróbios (RODRIGUEZ, 2009).
A maioria das infecções uterinas começa no endométrio e está associada à introdução do sêmen, gestação, parto ou involução uterina pós-parto. Os problemas reprodutivos mais comuns causados por infecção uterina foram retenção de placenta (49%), aborto espontâneo (38%), metrite (29%) e endometrite (30%) (GREGORY, 2010).
Éguas com endometrite são clinicamente estéreis, com exsudato mucopurulento da vulva, perda embrionária precoce e ciclos estral irregular e curto em média inferior a 14 dias, principalmente em endometrite subclínica (PAIVA JÚNIOR, 2018; BLANCHARD, 1998).
De acordo com Carvalho (2017), o número de neutrófilos por campo visual, o grau de endometrite pode ser classificado como leve (1 a 2), moderado (3 a 5) ou grave (5 ou mais). Em um estudo do útero de seis éguas inoculadas com Pseudomonas aeruginosa, foram observados mais de 5 neutrófilos em cada área das seis éguas, caracterizados citologicamente por inflamação grave do endométrio. Assim, a citologia de 8 a 10 neutrófilos por campo e a presença de Pseudomonas aeruginosa confirmaram a gravidade da endometrite nas éguas estudadas, manifestada por falha na reprodução por duas estações reprodutivas (ALVES, 2020).
Éguas mais velhas e suscetíveis têm menor depuração mecânica através do colo do útero, levando ao acúmulo de líquido uterino após a inoculação bacteriana durante o estro, devido localização do útero, para dentro da cavidade abdominal em um ângulo maior e é mais baixo do assoalho pélvico. Outro é a liberação de prostaglandina F2α (PGF2α) é menor, isso resulta em acúmulo de líquido na cavidade uterina com quadro inflamatório persistente (LEBLANC, 2017).
Os garanhões são assintomáticos e as bactérias podem persistir por meses ou anos na superfície do pênis e no esmegma do prepúcio (CRUZJUNIOR, 2016). Os potros podem ser infectados ao nascimento e permanecer portadores assintomáticos por longos períodos de tempo (MOREIRA, 2017).
2.4 Endometrite Persistente Pós-Cobertura
Espermatozoides, proteínas do plasma seminal e bactérias presentes no pênis dos garanhões podem causar uma resposta inflamatória aguda após o sêmen ser depositado na cavidade uterina, processo que deve ser considerado um evento fisiológico necessário para eliminar espermatozoides mortos ou morfologicamente anormais, bactérias, células inflamatórias e outros subprodutos do processo inflamatório, assim, o útero responde até 30 minutos após a ejaculação ou inseminação atingido seu pico em torno de 12 horas. (TROEDSSON, 2017; (CAMOZZATO, 2017). Porém, para que esse mecanismo de eliminação do processo inflamatório seja efetivo, é essencial uma boa contratilidade endometrial (PAIVA JÚNIOR, 2018).
Quando o processo inflamatório começa, os neutrófilos liberam mediadores que atuam nas células endoteliais vasculares, células endometriais danificadas e macrófagos ativados. As prostaglandinas atuam induzindo alterações na permeabilidade vascular, citocinas que mantêm a inflamação ativa e alterações na colagenase, elastase e gelatinase que favorecem o suprimento celular e iniciam os processos de reparo (MCKAY, 2017).
Algumas éguas desenvolvem inflamação uterina exacerbada após a inseminação com sêmen congelado, demostrando assim que o plasma seminal inibe a quimiotaxia polimorfonuclear, a fagocitose e a atividade hemolítica do complemento, com isso, regula a resposta inflamatória aos espermatozoides (PAIVA JÚNIOR, 2018).
2.5 Endometrite Crônica Degenerativa (Endometriose)
A endometriose pode ser definida como fibrose perigonadal e intersticial ativa ou inativa, incluindo alterações glandulares com focos fibróticos. As glândulas podem ser afetadas (MOREIRA, 2017). Segundo Brito; Barth (2017), a doença é caracterizada por alterações crônicas e degenerativas no endométrio, como fibrose periglandular, estase linfática e dilatação glandular, que podem ser decorrentes de inflamações uterinas recorrentes.
Em todos os tipos de endometriose, as células estro mais fibróticas têm expressão reduzida de receptores de hormônios esteroides em comparação com o estroma intacto, indicando sua diferenciação (CRUZ JUNIOR, 2016). No entanto, a expressão do receptor de hormônio esteroide no epitélio glandular associado parece ser dependente da atividade fibrótica. Esses resultados demonstram a independência de todos os focos fibróticos aos mecanismos de controle hormonal uterino (HOFFMANN et al, 2018).
3. DIAGNÓSTICO
O exame ginecológico é fundamental para o diagnóstico das endometrites e baseia-se no histórico que o animal apresenta, inspeção, palpação retal e vaginoscopia acompanhados de outras técnicas complementares como a citologia endometrial, cultura bacteriológica, biópsia uterina e ultrassonografia (CRUZ JUNIOR, 2016). Na avaliação dos órgãos reprodutivos internos deve-se utilizar o endoscópio (HAFEZ, 2007). Segundo Hafez (2017) e Abd-El-Razek (2019), a ultrassonografia é uma ferramenta indispensável para o diagnóstico de endometrite, com 70% dos casos de endometrite diagnosticados pela avaliação ultrassonográfica uterina. Os fatores avaliados nas imagens têm que incluir: espessamento da parede uterina, edema endometrial e derrame intrauterino (ABD-EL-RAZEK et al, 2019).
Umimportante aspecto do histórico reprodutivo das éguas é o número de temporadas que permanecem vazias (quando expostas ao garanhão). Outro aspecto que deve ser levado em consideração é o histórico reprodutivo das éguas, as doenças que já apresentou, se o tratamento foi realizado com sucesso (CAMOZZATO, 2017) Considera-se duas temporadas sucessivas vazias como um sério indicativo de infertilidade da égua sugerindo um prognóstico reservado. Tem sido demonstrado que a idade é um fator ainda mais importante que o número de crias. Éguas mais velhas apresentam taxas de prenhez menores do que éguas mais novas (GINTHER, 2017).
A conformação perineal é um dos mais importantes aspectos quando se realiza a inspeção. Deve-se avaliar a conformação e inserção da vulva, se os lábios vulvares promovem um fechamento adequado da entrada da vagina, se existe a presença de secreções ou evidências de vulvoplastia já realizada anteriormente (RIET CORREA et al., 2001).
A avaliação do canal vaginal e cérvix por varginoscópio auxiliando na identificação do estágio do ciclo estral, alterações patológicas e nas variações anatômicas (PAIVA JÚNIOR, 2008). Através deste método pode-se verificar abertura da cérvix, coloração da mucosa, natureza e quantidade de secreções (RIET-CORREA, et al., 2001), além de sinais de traumatismo da cérvix e vagina (PAIVA JÚNIOR, 2008).
O exame de citologia vaginal é muito utilizado por ser de baixo custo, de fácil empregabilidade e possibilita um diagnóstico rápido (RIET-CORREA, et al., 2001). E o método para auxiliar no controle da sanidade uterina da égua (MATTOS, 2017). Rotineiramente a técnica do “swab” é mais utilizada, porém, há outras técnicas de citologia endometrial como a substituição do swad por uma escova ginecológica (ALVARENGA & PASTORELLO, 1994). Existe também a técnica do lavado endometrial que consta de infusão de pequeno volume de solução fisiológica no interior do útero, realizando uma lavagem e, posteriormente, a recuperação do volume infundido, o qual é centrifugado formando um precipitado que é esfregado em uma lâmina para posterior coloração e análise microscópica (BALL, 1988).
Cultura bacteriana serve para identificar o agente associado, à inflamação e realizar o antibiograma para futuro tratamento (RIETCORREA, 2001). A cultura uterina pode fornecer informações valiosas, sendo que os achados da cultura uterina precisam ser avaliados em associação com sinais positivos de endometrite na biópsia ou citologia (MOREIRA, 2017). Assim a avaliação citológica é considerada o teste definitivo da endometrite, observando as etapas do processo inflamatório do endométrio (BLANCHARD, 1998). O termo biópsia endometrial se refere ao fragmento de tecido coletado para análise do endométrio, sendo importante para avaliação histológica na tentativa de identificar a presença de infecção aguda ou crônica e auxiliar no diagnóstico de degeneração endometrial. Seu resultado permite um prognóstico sobre o potencial reprodutivo da fêmea, onde se faz a avaliação da capacidade do útero levar sua gestação de forma eficiente até a parição (CAMOZZATO, 2017).
4. TRATAMENTO DE ÉGUAS COM ENDOMETRITE
4.1 Lavagem Uterina
É utilizada como forma de promover a limpeza física do endométrio, facilitando a ação de fármacos posteriormente infundidos (como antibióticos) que não funcionam satisfatoriamente na presença de secreções purulentas ou tecido necrótico (ROMEIRAS, 2017). A utilização de infusões intrauterinas com antibióticos é benéfica em casos de endometrite bacteriana confirmado, entretanto é muito utilizado de forma empírica como uma única lavagem pós ovulação para tratar éguas (LIU, 2011). Este procedimento consiste na realização de uma lavagem uterina em que é instilado um volume pequeno, 60 a 150 ml, de uma solução estéril de Lactato de Ringer (LR), de tampão fosfato salino (PBS) ou de soro fisiológico, através da utilização de uma seringa ou um dispositivo plástico adaptado à extremidade de um cateter de lavagem uterina ou de uma pipeta de inseminação (MATTOS, 2017). É administrada ocitocina para facilitar a recuperação de todo o fluido utilizado, que pode ficar retido nas pregas endometriais edematosas (FERRIS, 2015).
4.2 Antibioticoterapia
Os antibióticos utilizados no tratamento da endometrite podem ser utilizados por infusão intrauterina ou de forma sistêmica por três a sete dias durante o estro, dependendo do grau de infecção. Deve ser ressaltado que nem todos os antibióticos utilizados por via sistêmica podem ser administrados no útero sem alguns ajustes. Como a enrofloxacina que pode levar a necrose uterina (RODRIGUEZ, 2012). Como as infecções podem ser locais ou difusas, a decisão entre antibioterapia local ou sistémica passa pelo conhecimento do tipo de infecção (DASCANIO 2017). O antibiótico mais utilizado no tratamento é o Ceftiofur (cefalosporina semissintética de terceira geração), seguido de gentamicina, ticarcilina mais ácido clavulânico, ampicilina, penicilina procaína, amicacina, penicilina potássica e ticarcilina. Com exceção da amicacina, a maioria desses medicamentos não é adequada para uso tópico intrauterino. Tratamentos com antibióticos realizados de forma inadequada podem induzir a processo crônico com bactérias resistentes, devido às baixas concentrações que o fármaco pode atingir no endométrio (GONZÁLEZ, 2010). Esse fato se torna importante porque o desenvolvimento de resistência bacteriana é considerado inevitável e o uso de uma gama maior de antimicrobianos (DASCANIO, 2018). A nível sistêmico, os antibióticos mais utilizados são o sulfametoxazol com trimetropim, ampicilina, penicilina, gentamicina e administração oral de enrofloxacina (PASOLINI, 2017).
4.3 Antifúngicos
O tratamento de endometrites fúngicas é um processo demorado e nem sempre bem-sucedido, sendo o teste de sensibilidade a antifúngicos o principal requisito para iniciar o tratamento (DASCANIO, 2017). O tratamento inclui lavagem uterina com ácido acético diluído ou iodopovidona diluído, além de infusão sistêmica e/ou intrauterina de drogas antifúngicas e correção de fatores predisponentes que podem levar à falha da terapia (FERRIS, 2017).
Existem duas classes de medicamentos antifúngicos comumente usados em medicina veterinária, os azólicos e os polienos. Essas drogas interferem na membrana citoplasmática do fungo ligando-se ao ergosterol (polieno) ou inibindo sua síntese (azol). Em geral, os polienos possuem atividade fungicida contra a maioria dos fungos patogênicos, enquanto os azólicos são considerados fungistáticos, ou seja, inibem o crescimento de fungos (COUTINHO; SILVA; ALVARENGA, 2018). Para éguas contaminadas com fungos, Kelly (2012), recomenda-se infusão intrauterina de 5.000 UI de nistatina (polieno) por 7 a 10 dias ou infusão intrauterina concomitante de 3.200 mg de cetoconazol (azol).
4.4 Plasma Rico em Plaquetas (PRP)
A infusão intrauterina de plasma rico em plaquetas pode ser realizada pré e pós inseminação artificial para controlar a inflamação em éguas susceptíveis à endometrite pós cobertura persistente e incrementar as taxas de prenhez (SEGABINAZZI, 2017). Esta técnica permite que 80% dos leucócitos presentes no 29 sangue coletado sejam mantidos no plasma, onde 95% deles estão viáveis (CASTILHO, 1997).
O plasma rico em plaquetas (PRP) é um concentrado proteico de propriedades biológicas utilizado na terapia, que envolve a retirada de uma certa quantidade de sangue do próprio animal ou de outros animais saudáveis. Este derivado do sangue total contém três a cinco vezes mais plaquetas do que os níveis fisiológicos. Sua ação visa reduzir ou mesmo interromper o processo inflamatório e promover a recuperação do endométrio lesado por meio de seus efeitos mitogênicos e neovasculares (MONTEIRO, 2019). Em estudos, Monteiro (2019) concluíram que o PRP pode ser usado como adjuvante à terapia de suporte na tentativa de modular a resposta inflamatória pós-acasalamento em éguas para aumentar a fertilidade por meio da ativação plaquetária e liberação do fator de crescimento.
4.5 Ozonioterapia
Uso do ozônio (O3) como terapia alternativa na medicina veterinária ainda está em desenvolvimento e pesquisas são necessárias para determinar a dosagem e possíveis efeitos adversos no organismo, porém, os efeitos antioxidantes, antibacterianos e imunoestimulantes dessa molécula são conhecidos (NASCENTE 2019). As moléculas de ozônio são capazes de interagir com moléculas orgânicas e inorgânicas para oxidá-las completamente. Ele reage por meio de ligações biológicas com outras espécies de ligações duplas e triplas, como proteínas, aminoácidos, ácidos graxos e outras partes das membranas celulares (REPCIUC; CRECAN; OANA, 2016).
Giuliani et al (2018) demonstraram o efeito antimicrobiano da água de ozônio contendo 4000 mcg de ozônio no combate a diferentes tipos de bactérias, como Staphylococcus aureus, Streptococcus, Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, após o uso da solução por 40 minutos. Sendo os principais agente causador da endometrite bacteriana é o Streptococcus equi. Zoodoenças, Staphylococcus, Escherichia coli, Pseudomonas aeruginosa e Klebsiella pneumoniae (TROEDSSON, 2017).
O uso do ozônio tornou-se uma alternativa de tratamento para a endometrite. O ozônio ajuda a estimular linfócitos e monócitos para ajudar a liberar várias citocinas que melhoram a regeneração do tecido e iniciam o processo de formação do tecido de granulação e do epitélio. Apesar de ser um potente oxidante e um dos gases mais deletérios da troposfera o O3 atua como um estressor terapêutico quando empregado em baixas concentrações (Rodríguez 2018).
O ozônio destrói as membranas celulares dos microrganismos. Os efeitos da ozonioterapia estão relacionados às suas propriedades restauradoras, oxigenantes, antioxidantes, imunomoduladoras, vasodilatadoras, analgésicas e anti-inflamatórias. Além disso, o O3 atua como biocida devido ao processo de oxidação de peróxidos depletados de ozônio presentes na microflora. Ele ataca a membrana plasmática bacteriana por meio de aminoácidos, como glicolipídios ou triptofano, e atua nos grupos sulfidrila de certas enzimas, interrompendo a atividade enzimática bacteriana (DURRANI et al., 2017). Utilizando uma dose de 40 ml de óleo vegetal ozonizado no final de cada corno uterino, observaram remoção efetiva do biofilme uterino em 100% das éguas doadoras de embriões tratadas com histórico de endometrite recorrente, assim, a taxa de recuperação embrionária após o tratamento foi de 62,5% (VARGAS, 2019).
4.6. Imunomoduladores
A administração de agentes imunomoduladores visando alcançar um equilíbrio da expressão de citocinas pró e anti-inflamatórias e restaurar a homeostase das respostas inflamatórias locais pode ajudar a reduzir a endometrite relacionada ao acasalamento e melhorar as taxas de concepção. Os glicocorticoides suprimem a resposta imune, reduzem a expressão de citocinas pró-inflamatórias, promovem a melhora dos mecanismos de defesa uterina e melhoram a resposta anti-inflamatória. (PASOLINI et al. 2017). No entanto há que ter em conta que o uso de glucocorticóides destina-se fundamentalmente a éguas que apresentem hipersensibilidade ao sémen e não deve ser utilizado para as outras patologias (CHRISTOFFERSEN, 2012).
A prednisolona provoca uma diminuição de fluido uterino, acompanhada de um aumento de claridade do fluido e da taxa de prenhez. A dexametasona implica uma única administração (50mg, IV) logo antes da cobrição ou inseminação, mas são necessários mais estudos para averiguar das suas vantagens/desvantagens face a outros tratamentos. (Christoffersen, 2012; LeBlanc; McKinnon, 2011).
5. MEDIDAS PREVENTIVAS
Preventivamente, deve-se implantar manejo sanitário rigoroso. Quando adquirir uma égua solicitar exames clínicos e bacteriológicos do aparelho genital. Deve-se fazer o “swab uterino” das éguas que irão ser cobertas como recomendado por Thamassian, 2005. Métodos de controle e regulação do trânsito de equinos adquiridos são necessários para minimizar e controlar a doença. Cuidados com a higiene referentes ao garanhão, égua, instrumentais (desinfecção), manejo durante parto e pós-parto são de fundamental importância. Boas condições de higiene, quando permitidas, podem beneficiar éguas susceptíveis (MATTOS, 2017).
6. CONSIDERAÇÕES FINAIS
A endometrite é um grande obstáculo à reprodução equina, causando enormes prejuízos. Portanto, é necessário compreender a fisiopatologia, os fatores predisponentes e as correlações encontradas durante os exames físicos e complementares do trato reprodutivo para rápido diagnóstico, tratamento.
Atenção especial deve ser dada aos animais com histórico reprodutivo de endometrite durante a cobertura ou inseminação. Portanto, para um tratamento eficiente, e, considerando novas tecnologias a ser empregada, a ozonioterapia torna-se uma terapia para a patologia, sendo associada aos tratamentos já consolidados.
7. REFERÊNCIAS
ABD-EL-RAZEK, E.M.M.; GENEDY, T.M.; ELBAZ, H.T.; ELWEZA, A.E.; ZAGHLOUL, A.H.; FADEL, M.S.; ALMOKHATAR, E. A. Monitoramento ultrassonográfico e tratamento da endometrite em égua. Journal of Current Veterinary Research, v. 1, pág. 139-145, 2019.
ALVES, Lorena Matos Côrtes; SANTOS, Paulo Roberto Curcino; ALVARES, Caio Tácito Gomes. Endometrite bacteriana de Pseudomonas aeruginosa em égua doadora de embrião: relato de caso. Revista Brasileira de Pesquisa Animal e Ambiental, v. 3, não. 2, pág. 638-647, 2020.
ANDRADE, J.R.A.; SILVA, N.; SILVEIRA, W.; et ai.; Estudo epidemiológico de problemas reprodutivos em rebanhos bovinos na bacia leiteira de Goiânia. Arch Brazilian of Veterinary Medicine and Animal Science, v. 57, nº. 06. Belo Horizonte – MG, dez., 2005.
ALVARENGA, M. A.; PASTORELLO, M.. Comparação entre a eficiência da escova ginecológica e swab de algodão na coleta de material endometrial de éguas. In: l Congresso Brasileiro de Medicina Eqüina, 1994, São Paulo-SP. Ars Veterinária, 1994.
BALL, B.A.; SHIN, S.J.; PATTON, V.H.; LEIN, D.H.; WOODS, G.L. Use of a lowvolume uterine Nush for microbiologie and eytologic examination of the mare’s endometrium. Theriogenology. V. 29(6), p. 1269-1283, 1988.
BLANCHARD, T. L.; VARNER, DICKSON, SHUMACHER, Manual of Equine Reproduction. United States of America: Mosby – Year Book, 1998, p. 5, 54-58, 133- 134, 1998.
BONEV, B.; HOOPER, J.; PARISOT, J. Princípios de avaliação da suscetibilidade bacteriana a antibióticos pelo método de difusão em ágar. Journal of Antimicrobial Chemotherapy, v. 61, pág. 1295-1301, 2018.
BRASIL. Análise do estudo do complexo agroindustrial do cavalo. 2017.
BRITO, L.F.C.; BARTH, A. D. Endometrite em éguas. Rodadas Veterinárias de Grandes Animais. v. 3, e. 9, pág. 279-283, 2017.
CAMOZZATO, G. C. Endometrite na esposa. Monografia (Graduação) – Universidade Federal do Rio Grande do Sul, Faculdade de Medicina Veterinária, Porto Alegre, p. 36, 2017.
CARLTON, W. W.; MCGAVIN; trans. BARROS, C.S.L.; Patologia Veterinária Especial de Thomson. 2ª edição; Porto Alegre – RS; Ed. ArtMed, 2017; P. 547 – 552, 2018.
CASTILHO, L.F.F. Endometrites na égua: plasma autólogo acrescido de leucócitos como forma de tratamento. Dissertação (Mestrado em Ciências Veterinárias). Faculdade de Veterinária, UFRGS, Porto Alegre, RS, 1997.
CINTRA, A.G.C. Suplementação para equinos atletas da gestação à velhice, Revista Online André Cintra, nutrição e interacionismo, 2017.
CHRISTOFFERSEN, M., BRANDIS, L., SAMUELSSON, J., BOJESEN, A. M., TROEDSSON, M. H. T., PETERSEN, M. R.Diagnostic double-guarded low-volume uterine lavage in mares. Theriogenology, v. 83, p. 222-227, 2012).
COUTINHO DA SILVA, M.A.; ALVARENGA, M. A. Endometrite fúngica em éguas. Criação de cavalos. Iowa: 2ª ed., Wiley-Blackwell, 2011. 3056p, 2018.
CRUZ JUNIOR, Processo inflamatório no útero de éguas: Endometrite, 2016.
DASCANIO, J. Como e quando tratar a endometrite com antibióticos sistêmicos ou locais. Reprodução AAEP, v.57, n.1, pp.24–31, 2017.
DASCANIO, J.; BOWEN, J. M. Como realizar e interpretar a citologia uterina. Associação Americana de Praticantes de Equinos, v.43, p.182-186, 2018.
DURRANI, A.Z.; RAZA, M.U.; CHANNA, A. A. Uma Terapia Alternativa com Ozônio para Prevenir a Resistência Antimicrobiana (RAM) em Infecções Uterinas em Bovinos Leiteiros. Biomédico. Revista de Pesquisa Científica e Técnica. v.1, n.1, p.774-778, 2017.
FAO – Organização das Nações Unidas para Agricultura e Alimentação. 2017.
FERRIS, R. A. Conhecimento atual sobre biofilmes bacterianos e infecção latente: uma perspectiva clínica, Revista Brasileira de Produção, v.41, p. 74-80, 2018.
FERRIS, R. A. Endometrite: ferramentas diagnósticas para endometrite infecciosa, Veterinary Clinics Equine Practice, v. 32, pág. 481-498, 2015.
FERRIS, R.A.; FRISBIE, D. D.; MCCUE, P. M. Uso de células-tronco mesenquimais ou soro condicionado autólogo para alterar a resposta inflamatória de espermatozoides em éguas. Theriogenology, v.82, n.1, pp.36–42, 2017.
GINTHER, O.J.; GASTAL, E. L.; GASTAL, M.O.; BEG, M. A. Incidência, endocrinologia, vascularização e morfologia do folículo anovulatório hemorrágico em éguas. Journal of Equine Veterinary Science, v. 27, pág. 130-139, 2017.
GETTY, R. Anatomia dos animais domésticos. Rio de Janeiro, Brasil: Guanabara Koogan, v. 1, 5. ed. p. 511, 1986.
GREGORY, Estudo comparativo entre a vaginoscopia, a ultrassonografia e a histopatologia para o diagnóstico da endometrite, 2010.
GONÇALVES, R. W. Efeito da endogamia nas características morfométricas e reprodutivas dos equinos da raça Mangalarga Marchador. 2010. 88p. Dissertação (Mestrado). Universidade Estadual de Montes Claros Unimontes.
HAFEZ, B.; HAFEZ, E. S. E. Reprodução animal. 7. ed. Barueri-SP: Manole, p. 21-24, 2017.
HOFFMANN, C.; ELLENBERGER, C.; MATTOS, R.C.; AUPPERLE, H.; DHEIN, S.; STIEF, B.; SCHOON, H. Endometrose equina: Novos insights sobre a patogênese. Ciência da Reprodução Animal, 2018.
IBGE, PESQUISA PECUÁRIA MUNICIPAL. Validade do rebanho equino brasileiro, Brasil, 2016.
LEBLANC, M. M. A associação continuada é causada por endometrite. In: Robinson, N. E. (ed.) Terapia atual em medicina equina 5. Filadélfia: WB Saunders, p.234-237, 2017.
LEBLANC, M.M.; CAUSA, R. C. Endometrite clínica e subclínica na égua: ambas ameaças à fertilidade. Reprodução de Animais Domésticos, v. 44, 2019.
LEBLANC, M.M.; MCKINNON, A. O. A reprodução é a égua problema. In: MCKINNON A.O., SQUIRES E.L., VAALA W.E., VARNER, D.V., Equine Reproduction, 2ª ed., Reino Unido: Wiley Blackwell, 2017. 3056p.
LIU, I.K.M.; MITCHELL, G.; PERRYMAN, L.E.; STEWART, E.W. immunological defence mechanisms of the uterus in the maré. Teriogenology, p. 265-267, 2011.
MACKAY, R. J. Inchaço em cavalos. Clínicas veterinárias norte-americanas: treinamento de cavalos. v. 16, pág. 15-27, 2017.
MATTOS, R.C.; MALSCHITZKY, E.; JOBIM, M.I.M. Endometrite na bunda. Revista Brasileira de Reprodução Animal, Belo Horizonte, v.27, n.2, p.150-157, 2017.
McDONNELL, S. M. Comportamento do cavalo. Por Jensen (Ed.). The Ethology of Domestic Animals, CABI Publishing, Reino Unido, pp. 119-130. 2017.
McKINNON, A. O., VOSS, J. L. Equine Reproduction, 1ª ed., Lea & Febinger, Malvern – Pennsylvania, p. 381 – 391, 2011.
MONTEIRO, A.T.; TONGU, E.A.; SEGABINAZZI, L.G.T.M.; ALVARENGA, M. A. Plasma rico em plaquetas uma nova alternativa para o tratamento da endometrite fúngica. Revista Brasileira de Medicina Equina, n.81, 2019. 48p.
MOREIRA, J. F. E. Avaliação histopatológica e imuno-histoquímica de células inflamatórias no endométrio de éguas sadias e repetidoras de estro em programas de transferência de embriões. (Tese) – Programa de Pós-Graduação em Medicina Veterinária, Universidade Federal Fluminense, 2017.
NASCENTE, E. P.; CHAGAS, S.R.; CÂNDIDA-PESSOA, A.V.; CHEDIAK-MATOS, M.P.; ANDRADE, M.A.; PASCOAL, L. M. Potencial antimicrobiano do ozônio: aplicações e perspectivas na medicina veterinária. Pubvet, v. 13, pág. 1-14, 2019.
PAIVA JÚNIOR, O. L. de. Endometrite na bunda. Monografia apresentada ao curso de Medicina Veterinária, Universidade Federal de Campina Grande, Patos, p. 40, 2018.
PASOLINI, M.P.; PRETE, C. D.; FABRI, S.; AULETTA, L. Endometrite e Infertilidade na Égua – Os Desafios na Indústria da Criação Equina – Uma Revisão. Em Infecções genitais e infertilidade, pp.285–328, 2017.
RAMEY, domesticação de cavalos aconteceu a 4.200 anos atrás concluindo novo estudo. 2017.
REPCIUC, C.C.; CRECAN, C.M.; OANA, L. I. Ozonoterapia em medicina veterinária, Revista Romana de Medicina Veterinária, v. 26, pág. 49-53, 2016.
RIET-CORREA, F.; SCHILD, A. L.; MENDEZ, M. del C.; LEMOS, R. A. A. Doenças de ruminantes e equinos. volume II, São Paulo, Varela, 2017, 574 p.
ROMEIRAS, M.I.B. Abordagem da endometrite em centro de reprodução equina: presença de líquido uterino como indicador de inflamação. 2017. 113p. (Dissertação de Mestrado Integrado em Medicina Veterinária). Universidade de Lisboa, Faculdade de Medicina Veterinária, Lisboa, 2017.
RODRÍGUEZ, Z.B.Z.; GONZÁLEZ, E.F.; LOZANO, O.E.L. Ozonioterapia em Medicina Veterinária. Ed. Multimídia, 2018, 282p.
SEGABINAZZI, Modulação Da Resposta Inflamatória No Útero De Éguas Tratadas Com Plasma Rico Em Plaquetas, São Paulo- sp, 2017).
THOMAS, A. Doenças de equinos. 4. ed. Varela, São Paulo – SP, p. 258-259, 2017.
TROEDSSON, M.H.T. Endometrite, cap.271, p. 2608-2619. In: MCKINNON, A.O.; ESCUDEIROS, E.U.; VAALA, W.E.; VARNER, D. D. Reprodução Equina. 2ª edição. Nova Deli, Índia, John Wiley & Sons, 2017.
TROEDSSON, M.H.T.; LIU, I.K.M.; ING, M.; PASCOE, J.; THURMOND, M. J. Registro eletromiográfico de múltiplos sítios da atividade uterina após desafio bacteriano intrauterino em éguas suscetíveis e resistentes à infecção uterina crônica. Revista de reprodução e fertilidade suppl. v. 99, pág. 307-313, 2017.
