REGISTRO DOI: 10.5281/zenodo.7362529
Gabriela Alves dos Santos1
Lohanna de Farias Lopes²
Maurício da Silva Baptista²
Priscila Ferreira Silva3
Adjaci Uchôa Fernandes3
RESUMO
A terapia fotodinâmica é uma modalidade terapêutica que pode ser utilizada para finalidades que incluem eliminação de patógenos, doenças imunossupressoras e mesmo câncer. Essa modalidade se baseia na aplicação de luz em tecidos com fotossensibilizadores incorporados e em ambiente oxigenado. Para que a TFD tenha sucesso em sua aplicação, é interessante que o FS de escolha seja puro, absorva na faixa da luz visível, tenha baixa toxicidade no escuro, e preferencialmente, rápida eliminação de tecidos saudáveis. Clorinas, são uma classe de compostos fotossensíveis derivada de porfirinas e com aplicação na TFD. O presente estudo, tem por objetivo avaliar características fotoquímicas e fotobiológicas da clorina MCHC-CHLORIN a fim de melhor conhecer o potencial fotoativo dessa molécula e a fotoquímica envolvida em mecanismos de morte celular. Para isso, realizou-se ensaios que incluíram medidas espectrofotométricas, medida de oxigênio singleto e ensaio de viabilidade celular. Os resultados indicaram ampla absorção na faixa do visível com duas bandas principais, em 410 e 670nm, absortividade molar de 31605M-1.cm-1, em solução de DMSO e no comprimento de onda de 670nm, produção de oxigênio singleto quando solubilizada em DMSO e irradiada em 400nm, considerável redução da viabilidade celular em TFD aplicada a linhagem celular de queratinócitos imortalizados. Os resultados indicam que a molécula é promissora para aplicação de TFD para induzir morte celular, e dada a fotoquímica, reações do tipo II podem estar sendo favorecidas e dessa forma, induzir o estresse oxidativo celular.
Palavras chaves: 1. Fotossensibilizador; 2. Terapia fotodinâmica; 3. Morte celular; 4. Câncer; 5. Luz.
ABSTRACT
Photodynamic therapy is a therapeutic modality that can be used for purposes that include pathogen elimination, immunosuppressive diseases, and even cancer. This modality is based on the application of light to tissues with incorporated photosensitizers in an oxygenated environment. For DFT to be successful in its application, it is of interest that the FS of choice is pure, absorbs in the visible light range, has low toxicity in the dark, and preferably, rapid elimination from healthy tissue. Chlorines are a class of photosensitive compounds derived from porphyrins and with application in DFT. The present study, aims to evaluate photochemical and photobiological characteristics of the chlorin MCHC-CHLORIN in order to better understand the photoactive potential of this molecule and the photochemistry involved in cell death mechanisms. To this end, we performed assays that included spectrophotometric measurements, singlet oxygen measurement and cell viability assay. The results indicated broad absorption in the visible range with two main bands, at 410 and 670nm, molar absorptivity of 31605M-1.cm-1, in DMSO solution and at a wavelength of 670nm, production of singlet oxygen when solubilized in DMSO and irradiated at 400nm, considerable reduction of cell viability in DFT applied to immortalized keratinocyte cell lines. The results indicate that the molecule is promising for DFT application to induce cell death, and given the photochemistry, type II reactions may be favored and thus induce cellular oxidative stress.
Keywords: 1. Photosensitizer; 2. Photodynamic therapy; 3. Cell death; 4. Cancer; 5. Light
INTRODUÇÃO
A terapia fotodinâmica (TFD) é uma modalidade terapêutica que se baseia na absorção de luz por moléculas fotossensíveis mediante condições específicas de intensidade, comprimento de onda, concentração molecular e tempo de irradiação em presença de oxigênio molecular. A aplicação dessa modalidade se estende desde o tratamento de doenças infecciosas e inflamatórias até neoplasias, sendo muito vantajosa por não provocar imunossupressão e apresentar maior seletividade1,2,3.
Segundo o Instituto Nacional do Câncer (INCA), o câncer de pele é o de maior ocorrência no Brasil representando cerca de 30% de todos os tumores diagnosticados no país, surgindo cerca de 150 mil novos casos por ano. O principal tratamento para esse tipo de câncer é a remoção cirúrgica, o que pode provocar mutilações expressivas nos pacientes a depender do local, gravidade e extensão das lesões além de encarecer o tratamento (INCA, 2019). Levando em consideração o número de pessoas acometidas por essa doença e as limitações dos tratamentos disponíveis, é importante estudar alternativas terapêuticas que visem o bem estar dos acometidos.
Diferentes estudos indicam a eficiência da TFD em provocar morte de células tumorais, inclusive em linhagens celulares de câncer de pele4,5.
Uma das classes moleculares exploradas na TFD são as clorinas. Isso acontece por diferentes motivos incluindo a favorável absorção na faixa espectral da luz visível e, em relação ao fotossensibizador (FS) de escolha para o presente estudo, a vantajosa diminuição da agregação molecular quando comparada a outras classes de compostos fotoativos6.
Sendo a TFD uma opção de baixo custo e que se mostrou eficiente em eliminar células indesejadas4,5,7. O presente estudo avalia o potencial da MCHCchlorin, em induzir mecanismos de morte celular em linhagem celular de queratinócitos imortalizados, HaCat, tratados com essa molécula e luz visível.
JUSTIFICATIVA
A prevalência do câncer de pele, bem como a limitação nos tratamentos disponíveis indicam a importância de estudar alternativas de tratamento para essa doença. A TFD por apresentar menor custo e efeitos adversos em relação a outras terapias tradicionais, torna-se uma opção interessante a se explorar1,2,3,7,8,9.
Outro ponto relevante envolve a vantagem em se explorar clorinas como fotossensibilizadores. Essas moléculas absorvem no espectro de luz visível, podendo absorver no azul e no vermelho, aumentando consideravelmente o alcance do tratamento, além de apresentar estrutura molecular isenta de auto-agregação e consequente mente optimização fotofísica10,11,12,13.
Considerando tais informações, tornase relevante estudar a aplicação da Clorina MCHC-CHLORIN ® na TFD em linhagem celular de HaCat a fim de aumentar o conhecimento sobre mecanismos fotoativos de ação envolvidas na TFD com esse FS.
OBJETIVOS
Geral:
Estudar a fotofísica envolvida na molécula Clorina MCHC-CHLORIN ®, bem como o potencial desse fotossensibilizador na TFD em linhagem de células HaCat.
Específicos:
ESTUDO FOTOFÍSICOS

ESTUDO BIOLÓGICO
- Realizar ensaio de viabilidade celular em células HaCat tratadas com FS, irradiadas em 410nm;
DESENVOLVIMENTO
REFERENCIAL TEÓRICO
Contexto histórico da TFD
Embora o primeiro estudo da TFD seja do fim do século XIX, com Raab, a técnica é milenar, há cerca de 4.000 anos atrás as civilizações antigas já detinham do conhecimento empírico do tema. Civilizações egípcias, indianas e chinesas através da experiência em observar que a ingestão de plantas com compostos psoralenos, somada à exposição da luz solar (UVA), foram capazes de tratar doenças como o vitilígio, estimulando assim a produção de melanina14,15,16.
Desde então, o potencial terapêutico de corantes combinados à luz visível vem ganhando espaço na área clínica após descobertas como o efeito antimicrobianos envolvendo azul de metileno, laranja de acridina e cristal violeta, combinação de eosina e luz para tratamento de câncer de pele, fotossensibilização cutânea por porfirinas e principalmente, após os avanços nas décadas de 60 quando a TFD tratou pela primeira vez uma mulher com câncer de mama e de 70, quando os medicamentos fotossensíveis Photofrin, LevulanKerastick, Visudyne e Verteporfina passaram a ser considerados no tratamento de câncer como FSs14,15,17,18.
Princípio terapêutico da TFD
Para o êxito da TFD, é necessário que a molécula fotossensível esteja no alvo em concentrações mínimas para atividade, seja irradiada em comprimento de onda inerente à sua estrutura molecular e que a dose seja o suficiente para exercer o efeito terapêutico. Uma vez sob essas condições, é possível induzir morte celular por diferentes vias como por exemplo necrose e/ou apoptose1,2,3,19.
A morte celular acontece principalmente por estresse oxidativo originado em dois eventos principais: as reações de tipo I ou de tipo II (figura 1). Ambas reações se iniciam a partir da fotoexcitação do cromóforo, sendo a de tipo I favorecida quando o FS no estado tripleto excitado transfere energia diretamente para biomoléculas do microambiente celular originando radicais livres a partir da oxidação dessas moléculas, enquanto a reação de tipo II se caracteriza pela formação de oxigênio singleto (1O2), uma espécie extremamente reativa e capaz de induzir a formação de muitas outras espécies reativas de oxigênio (ROS) no mesmo microambiente15,18,20,,22,23. Ambos os mecanismos provocam estresse oxidativo na célula e, a depender do tipo celular e espécies oxidativas produzidas, diferentes vias de morte celular podem ser induzidas2,20,24,25.
Figura 1. Mecanismo de transferência de energia do fotossensibilizador. FS, ¹FS, ³FS: fotossensibilizador em seu estado fundamental, estado singleto e tripleto, respectivamente; O2 e ¹O2: Oxigênio em seu estado fundamental e em seu estado excitado singleto, respectivamente; CIS: Cruzamento intersistemas, entre os estados singleto e tripleto, respectivamente.
Fonte: Adaptado de JUNQUEIRA, 2008.
Clorinas como moléculas fotossensíveis na TFD
O FS é de fundamental importância para aplicação da TFD. Trata-se de uma molécula capaz de desencadear reações químicas ou físicas a partir da absorção de luz em determinado comprimento de onda (KWIATKOWSKI et al., 2018). Para que seja viável à essa aplicação, é importante que o FS siga critérios como: apresentar pico de absorção dentro do espectro da luz visível, alto grau de pureza, estabilidade em temperatura ambiente, baixa toxicidade na ausência de luz, rápida eliminação em tecidos normais e alta penetração em tecidos doentes1. As clorinas, são uma classe de compostos fotossensibilizadores da segunda geração, moléculas derivadas da porfirina que sofreram modificações em sua estrutura periférica (figura 2.)26.
Essas alterações, desencadearam melhorias nas propriedades fotofísicas e fotoquímicas favoráveis à TFD, como aumento da absorção de luz em um comprimento de onda mais longo na luz vermelha (650-690nm) que penetra profundamente no tecido, além da alta absorção na região de luz azul (400nm)27. Outra característica partidária, é de conter períodos curtos de fotossensibilização, que garantem baixa toxicidade ao organismo, devido à rápida eliminação do organismo28. As clorinas, quando equiparadas com os FS de primeira geração como o PHOTOFRIN®, demonstra desempenho superior, uma vez que os primeiros apresentam baixa solubilidade em solventes polares, menor coeficiente de absortividade molar, principalmente na luz vermelha e maior toxicidade29.30,31,32.
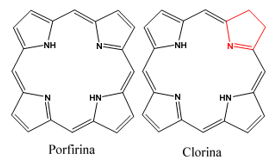
Figura 2.: Representação estrutural da Porfirina e sua derivação Clorina.
Fonte: (LINARES; PERUSSI, 2018)
O composto 21,22[N,N-Dicarbonyl-Nocthyl]-13,17-bis[2(methoxycarbonyl)ethyl]-2,7,12,18tetramethyl-8-vinyl-2,21,22,23tetrahydrobenzo[b]porphyrin (MCHC CHLORIN ®) (figura 3), é uma aposta promissora de fotossensibilizadores. Trata-se de uma clorina substituída, que apresentam boas características fotoquímicas e fotofísicas por apresentar alta absorção no comprimento de onda na região do vermelho e na região da luz azul e pouca agregação em comparação com outras clorinas, o que aumenta a eficiência fotoquímica e consequentemente, o estresse oxidativo em ambiente celular11,12,13.
Figura 3. Molécula da Clorina MCHC-CHLORIN ®
Fonte: UCHOA et al., 2011
TFD com clorinas
Trabalhos mostram bons resultados na aplicação de TFD com clorinas fotossensíveis para diferentes doenças, como infecções bucais na atuação de odontologia, como foram observados em estudos com Streptococcus mutans e de biofilme com bactérias de pacientes com acne vulgar33,34 Além de doenças relacionadas à microrganismos, outros estudos constataram a eficiência de TFD com clorinas em diferentes tipos de cânceres como de próstata, mama e de pele35,36,37.
Em relação ao câncer de pele, Reis e colaboradores demonstraram que a TFD com clorina se mostrou benéfica em estudo aplicado ao câncer de pele de maior prevalência na população: o carcinoma de células basais da epiderme. No caso, demonstrou-se alta penetração e eficiência na regressão da doença9,38.
A TFD pode ser bastante seletiva à lesão, uma vez que a administração do FS pode ser por via tópica seguida de irradiação local39,40. Isso aumenta a vantagem dessa terapia em comparação a outros tipos de intervenção como a cirúrgica, a radioterapia e a quimioterapia tendo em vista custos ao paciente como a imunossupressão, queimaduras e mesmo mutilações expressivas a depender do local e extensão da região acometida pelo câncer41.
Logo, as clorinas demonstram potencial promissor para aplicação em diferentes áreas da saúde, incluindo câncer. Esse estudo tem como finalidade analisar características fotoquímicas e fotobiológicas do composto MCHCCHLORIN.
MATERIAL E MÉTODOS Ensaios fotoquímicos
ESPECTRO DE ABSORÇÃO
Preparou-se uma solução de clorina MCHC-CHLORIN ® em DMSO (composto dimetilsulfóxido) com concentração 2,18 mM, em seguida, foi realizada uma diluição para a concentração de 1,74 mg/mL. O espectro de absorção foi obtido em espectrofotômetro SHIMADZU UV-1800 (figura 4) utilizando-se cubeta de quartzo com caminho óptico de 1cm.
Figura 4: Espectrofotômetro (SHIMADZU)
ABSORTIVIDADE MOLAR (E)
Foram realizadas medidas sucessivas em concentrações crescentes do FS a partir da solução estoque previamente preparada na concentração 1,74mg/mL. Os espectros foram plotados no software Origin (2019) e, a partir dos valores de absorbância obtidos no comprimento de onda de maior absorção, um segundo gráfico foi plotado relacionando esses valores com a concentração de cada medida. O valor do slope no segundo gráfico corresponde ao valor de absortividade molar do composto para o solvente escolhido (DMSO) em determinado comprimento de onda.

Inicialmente, preparou-se as soluções da amostra e do cromóforo escolhido para ser o padrão (fenalenona) em mesmo solvente (DMSO). As absorbâncias foram ajustadas para valores próximos à 0,3 no comprimento de onda de 400 nm. Em seguida, as soluções foram transferidas para cubeta redonda de quartzo e as medidas foram tiradas em fluorímetro resolvido no tempo com detecção no infravermelho (SHB).

Ensaios Biológicos
Os experimentos seguiram devidamente as normas de biossegurança.
CULTIVO CELULAR
Os efeitos da TFD com MCHCCHLORIN foram analisados em linhagem celular de queratinócitos imortalizados (HaCat). As células foram cultivadas em garrafa T75 (10mL) em meio DEMEM suplementado com 10% de soro fetal bovino, 1% de piruvato e 1% de antibiótico.
O tratamento das células foi realizado a cada dois dias ou conforme a necessidade (quando a confluência era de aproximadamente 80% da garrafa). Para o repique, retira-se o meio da garrafa, realiza-se lavagem com 5mL de tampão fosfato (PBS), adiciona-se 2mL de tripsina e posterior incubação por 8 minutos em estufa 5% de CO2 à 37oC. Em seguida adiciona-se 3mL de meio DEMEM que é homogeneizado com as células tripsinizadas. A etapa seguinte consiste em deixar na parte do volume na garrafa e descartar o restante, completando o volume deixado para 10mL finais (geralmente, 1mL do volume de células para 9mL de meio fresco). Finalmente, a garrafa é incubada em estufa com condições de temperatura e CO2 previamente citadas.
PLAQUEAMENTO
O plaqueamento para o ensaio de viabilidade celular foi realizado em placas de 96 poços, volume de trabalho de 200uL e 10.000 células por poço, enquanto que para o experimento de internalização, será utilizada placa de 12 poços, volume de trabalho de 1mL e confluência de 100.000 células por poço. Para o procedimento, segue-se os passos descritos no item 5.2.1 de repique, mas dessa vez, acondicionando o volume de células homogeneizadas em tubo Falcon.
Em etapa seguinte, realiza-se a contagem das células fazendo uma diluição de 1 para 4 em azul de tripan. Para isso, adiciona-se 60uL de azul de tripan em parafilm e 20uL da suspensão de céulas. Uma vez homogeneizado, 10uL dessa mistura é pipetada em câmara de Neubauer e realiza-se a contagem das células em microscópio invertido na objetiva de 4000x. O número total de células é dividido pelo número de quadrantes e multiplicado por 4 (correção da diluição). O valor final é dado na ordem de 104 células por mL de suspensão.
Para a diluição utiliza-se a equação 2 descrita abaixo:

Ci corresponde ao valor obtido pela contagem, Vi é o volume do conteúdo celular do falcon que se deve pipetar para diluir em um volume final, Vf, que se pretende obter na concentração final Cf, que corresponda a quantidade de células que se deseja ter por poço.
Finalmente, a diluição preparada é devidamente homogeneizada, adicionada nas placas de poços e incubada por 24 horas em estufa à 5% CO2 e 37 oC.
TRATAMENTO COM FS E LUZ
Para o tratamento, a solução estoque de MCHC-Chlorin em DMSO foi diluída em diferentes concentrações em PBS. A cada repetição do experimento, o tratamento com o FS foi adicionado em 2 placas, no qual uma delas foi fotossensibilizada em irradiador BIOLAMBDA com LED no comprimento de onda de 410nm e a outra permaneceu em mesmas condições de temperatura, porém protegidas da luz em papel alumínio. As concentrações de tratamento foram: controle (somente células e PBS); DMSO 1%; 0,125uM; 0,25uM; 0,50uM; 1,0uM; 1,5uM; 3uM; 6uM; 12uM (figura 5).
Figura 5: Placa representando tratamento. Nas colunas de 2 à 11 seguiu-se as diluições do tratamento com FS, sendo: 2 controles somente PBS, 3 controle DMSO 1%, 4 a 11 diluições crescentes do tratamento.
Previamente ao tratamento com as diluições do FS, retirou-se o meio das placas, sendo as mesmas lavadas duas vezes com PBS para retirada de células não aderidas metabólitos. Após adição do tratamento, as células foram incubadas por 1 hora em estufa à 5% CO2 e 37 oC. Após esse tempo, retirouse o tratamento, lavou-se os poços uma vez com PBS e posteriormente adicionou-se o mesmo tampão para a irradiação.
A dose de luz foi de 12J/cm2 por 30 minutos e irradiância de 6,66mV/cm2 no comprimento de onda de 410nm. É importante ressaltar que a irradiação aconteceu apenas à uma das placas tratadas com o FS para que seja possível a comparação da atividade da clorina com e sem luz. Finalmente, as

placas foram devidamente identificadas quanto à presença ou ausência de irradiação e incubadas novamente, dessa vez em meio fresco suplementado com 1% de SFB por 24 horas.
ENSAIO DE VIABILIDADE CELULAR
O ensaio de viabilidade foi realizado após 24h da irradiação e o método colorimétrico a partir da incubação do 3-(4,5-dimetiltiazol-2yl)-2,5-di- fenil brometo de tetrazolina (MTT).
A solução estoque de MTT foi previamente preparada na concentração de 5mg/mL. Para incubação, essa solução foi diluída em meio DEMEM 1% de SFB e antes de adicioná-la nas células, as placas foram lavadas 1 vez com PBS.
Após adicionar o meio com o MTT, as placas foram incubadas por 2horas e 30 minutos. A etapa seguinte consistiu em retirar o meio, adicionar álcool isopropílico (200uL em cada poço) e agitar no Termo Mixer por 30 minutos a 300 RPM cada placa antes da leitura. A leitura foi realizada em leitor de placas SPECTRAMAX I3 (figura 6) em 550nm com referência em 800nm.
Figura 7. Leitor de placas (SpectraMax i3)
RESULTADOS Ensaios fotoquímicos
ESPECTRO DE ABSORÇÃO
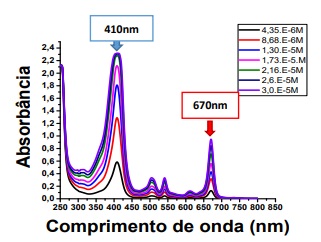
Figura 8. Gráfico de absorbância por Comprimento de onda (nm). Composto MCHCCHLORIN®.
ABSORTIVIDADE MOLAR (Ε)
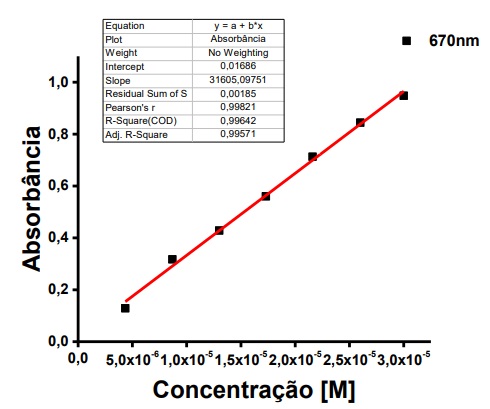
Figura 9. Gráfico de absorbância x Concentração Molar, composto MCHCCHLORIN®.
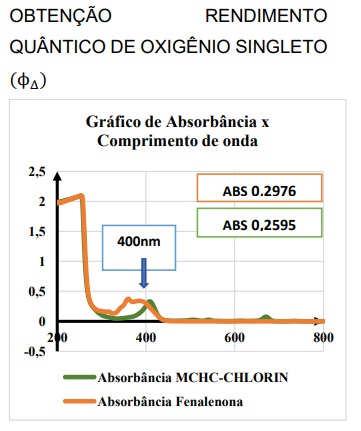
Figura 10. Gráfico indicando valor de absorção próximo para solução da clorina MCHCCHORIN® (verde) e da fenalenona (alaranjado) em DMSO, respectivamente, para 400nm.
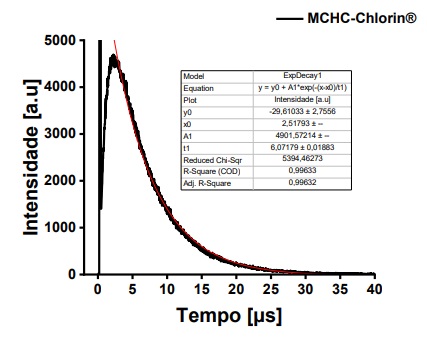
Figura 11. Gráfico com a intensidade de singleto obtido para a clorina em solução de DMSO, irradiada com LED 400nm dada por tempo em microssegundos.
Ensaios Biológicos
MTT
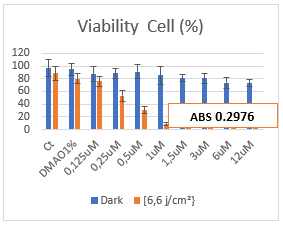
Figura 10. Gráfico de Viabilidade Celular. Médias de 4 repetições do experimento MTT. Dark: Placa de controle, sem a presença da luz. 6,66 j/cm²: Placa irradiada.
DISCUSSÃO
Ensaios fotoquímicos
ESPECTRO DE ABSORÇÃO
O espectro de absorção do composto MCHC-CHLORIN® (figura 8.), apresenta absorção na faixa do visível em duas bandas principais: uma em 410nm (seta azul) e outra banda em 670nm (seta vermelha). Tais características, corroboram com achados relacionados a faixas de absorção de clorinas e tornam esse FS uma opção promissora na TFD uma vez que os picos em questão são bem definidos e em faixas de maior penetração tecidual12,27.
ABSORTIVIDADE MOLAR (Ε)
O composto estudado, apresentou valor de absortividade molar de 31605,09 M-1.cm-1 quando solubilizada em DMSO e em comprimento de onda de 670nm (figura 9). O resultado se relaciona com a literatura acerca do comportamento das clorinas de alta absorção na faixa do visível43.
Os resultados de obtenção do oxigênio singleto do composto MCHCCHLORIN® indicam que o composto apresenta considerável rendimento, o que está de acordo com a literatura13,43, O transiente obtido no experimento indicou a produção de singleto mediante irradiação da solução em comprimento de onda de 400nm em intensidade inicial comparável à Fenalenona (padrão bem conhecido e de larga utilização na avaliação de rendimento de singleto) uma vez que os espectros de absorção foram ajustados para mesma absorbância em 400nm (figura 10). Contudo, apesar de ser claro o sinal do oxigênio singleto, é necessário que o ensaio seja repetido para confirmar o valor da intensidade a ser utilizada no cálculo para o rendimento.
O sinal do transiente da clorina mostrou intensidade máxima de 4901 e tempo de vida do singleto de 6 microssegundos, o que é condizente com o solvente utilizado.
Ensaios Biológicos
MTT
Por meio da média dos quatro N’s do experimento MTT, a estatística revela alta porcentagem (%) de morte celular na placa que sofreu irradiação em comparação com a placa de controle escura. A partir da concentração de 0,25uM já é possível visualizar expressiva morte celular do composto quando irradiado, em comparação com a placa controle. Esse resultado era esperado e se corrobora com o padrão de comportamento de outras clorinas13,27.
CONSIDERAÇÕES FINAIS
O estudo fotoquímico da clorina MCHCCHLORIN® indicou espectro de absorção com picos na faixa da luz visível com duas bandas principais: uma em 410nm e outra em 670nm;
O coeficiente de extinção molar para solução desse FS em DMSO no comprimento de onda de 670nm foi de 31605,1 M-1.cm-1;
O composto quando irradiado em 400nm induz formação de oxigênio singleto em valores comparativos à fenalenona;
A TFD com a clorina estudada em pequenas concentrações e dose de luz de 12J/cm2 apresentou significante redução da viabilidade celular em linhagem celular HaCat quando comparado o mesmo tratamento em células não irradiadas.
REFERÊNCIAS BIBLIOGRÁFICAS
1. AGOSTINIS, P. et al. Photodynamic therapy of cancer: an update. CA: a cancer journal for clinicians, v. 61, n. 4, p. 250–281, 2011. Disponível em: https://acsjournals.onlinelibrary.wiley.com/doi/full/10.3322/caac.20114. Acesso em: 07 maio 2022.
2. DOS SANTOS, A. F. et al. Methylene blue photodynamic therapy induces selective and massive cell death in human breast cancer cells. BMC cancer, v. 17, n. 1, p. 1–15, 2017. Disponível em: https://bmccancer.biomedcentral.com/articles/10.1186/s12885-017-3179-7. Aceso em: 07 maio 2022.
3. LI, W.; MA, Q.; WU, E. Perspectives on the role of photodynamic therapy in the treatment of pancreatic cancer. International Journal of Photoenergy, v. 2012, 2011. Disponível em: https://www.hindawi.com/journals/ijp/2012/637429/. Acesso em: 07 maio 2022.
4. JUSTINIANO, R. et al. The Endogenous Tryptophan‐derived Photoproduct 6formylindolo [3, 2‐b] carbazole (FICZ) is a Nanomolar Photosensitizer that Can be Harnessed for the Photodynamic Elimination of Skin Cancer Cells in Vitro and in Vivo. Photochemistry and photobiology, v. 97, n. 1, p. 180–191, 2021. Disponível em: https://onlinelibrary.wiley.com/doi/abs/10.1111/php.13321. Acesso em: 22 ago. 2022.
5. LEÓN, D. et al. Epigallocatechin gallate enhances MAL-PDT cytotoxic effect on PDT-resistant skin cancer squamous cells. International journal of molecular sciences, v. 21, n. 9, p. 3327, 2020. Disponível em: https://www.mdpi.com/1422-0067/21/9/3327. Acesso em: 07 maio 2022.
6. ABRAHAMSE, H.; HAMBLIN, M. R. New photosensitizers for photodynamic therapy. Biochemical Journal, v. 473, n. 4, p. 347–364, 2016.
7. SCOTTINI, A. Terapia fotodinâmica com azul de metileno em células derivadas de carcinoma espinocelular: estudo in vitro, 2021. Disponível em: http://tede2.uepg.br/jspui/handle/prefix/3571. Acesso em: 06 jun. 2022.
8. CASSEMIRO, R. G. et al. Anais II JAM UFMS/CPTL-II Jornada Acadêmica de Medicina da Universidade Federal de Mato Grosso do Sul-Campus Três Lagoas. ARCHIVES OF HEALTH INVESTIGATION, v. 7, 2018. Disponível em: https://www.archhealthinvestigation.com.br/ArcHI/article/view/3915. Acesso em: 07 maio 2022.
9. INSTITUTO NACIONAL DE CÂNCER JOSÉ ALENCAR GOMES DA SILVA. Tipos de câncer. Rio de Janeiro: INCA, 2019. Disponível em: https://www.inca.gov.br/tipos-de-cancer. Acesso em: 28 ago. 2022.
10. SIMÕES, J. C. S. et al. A new generation of ring-fused fluorinated chlorins as promising pdt agents: from synthesis to in vitro studies. Tese de Doutorado. Universidade de Coimbra, 2018. Disponível em: https://estudogeral.sib.uc.pt/handle/10316/86651
11. BONNETT, R.; MARTINEZ, G. Photobleaching of sensitisers used in photodynamic therapy. Tetrahedron, v. 47, n. 57, p. 9513–9547, 2001. Disponível em: https://www.academia.edu/48406651/Photobleaching_of_sensitisers_used_in _photodynamic_therapy?auto=citations&from=cover_page. Acesso em: 07 maio 2022.
12. DOUGHERTY, T. J. Photochemistry in the treatment of cancer. Advances in photochemistry, v. 17, p. 275–311, 1992.
13. UCHOA, A. F. et al. Chlorin photosensitizers sterically designed to prevent selfaggregation. The Journal of Organic Chemistry, v. 76, n. 21, p. 8824–8832, 2011. Disponível em: https://pubs.acs.org/doi/abs/10.1021/jo201568n. Acesso em: 07 maio 2022.
14. RAAB, O. On the effect of fluorescent substances on infusoria. Z Biol, v. 39, p. 524–526, 1900.
15. SIMPLICIO, F. I.; MAIONCHI, F.; HIOKA, N. Terapia fotodinâmica: aspectos farmacológicos, aplicações e avanços recentes no desenvolvimento de medicamentos. Química Nova, v. 25, p. 801–807, 2002. Disponível em: https://www.scielo.br/j/qn/a/yM7QMHW8Mr7LzsHBbcNZ49k/?lang=pt. Acesso em: 19 abr. 2022.
16. STERNBERG, E. D.; DOLPHIN, D.; BRÜCKNER, C. Porphyrin-based photosensitizers for use in photodynamic therapy. Tetrahedron, v. 54, n. 17, p. 4151–4202, 1998. Disponível em: https://www.sciencedirect.com/science/article/abs/pii/S0040402098000155. Acesso em: 19 abr. 2022.
17. MEYER-BETZ, F. Investigations on the biological (photodynamic) action of haematoporphyrin and other derivatives of blood and bile pigments. Deutsch Arch Klin Med, v. 112, p. 476–503, 1913.
18. UCHOA, A. F.; MS, B. Terapia fotodinâmica: Mecanismos e perspectivas de desenvolvimentos de novos fotossensibilizadores. J Bras Laser, v. 2, n. 4, p. 10–23, 2007.
19. KWIATKOWSKI, S. et al. Photodynamic therapy–mechanisms, photosensitizers and combinations. Biomedicine & Pharmacotherapy, v. 106, p. 1098–1107, 2018. Disponível em: https://www.sciencedirect.com/science/article/abs/pii/S0753332218341611. Acesso em: 07 maio 2022.
20. JUNQUEIRA, H. C. Síntese e estudo das propriedades fotoinduzidas de derivados fenotiazínicos em sistemas biomiméticos. [s.l.] Universidade de São Paulo, 2008. Disponível em: https://www.teses.usp.br/teses/disponiveis/46/46131/tde-18122008105257/en.php. Acesso em: 28 ago, 2022.
21. SANTOS, A. F. DOS et al. Methylene blue photodynamic therapy induces selective and massive cell death in human breast cancer cells. BMC Cancer, v. 17, n. 194, p. 1–15, 2017. Disponível em: https://bmccancer.biomedcentral.com/articles/10.1186/s12885-017-3179-7. Acesso em: 07 maio 2022.
22. FOOTE, C. S. Mechanisms of photosensitized oxidation: there are several different types of photosensitized oxidation which may be important in biological systems. Science, v. 162, n. 3857, p. 963–970, 1968. Disponível em: https://www.science.org/doi/abs/10.1126/science.162.3857.963. Acesso em: 27 ago. 2022.
23. MACHADO, A. E. DA H. Terapia fotodinâmica: princípios, potencial de aplicação e perspectivas. Química Nova, v. 23, p. 237–243, 2000. Disponível em: https://www.scielo.br/j/qn/a/PTsbrFMBBzN6HhXjSrfqRGz/?lang=pt. Acesso em: 19 abr. 2022.
24. ACEDO, P. et al. Two combined photosensitizers : a goal for more effective photodynamic therapy of cancer. Cell Death and Disease, v. 5, p. 1–12, 2014. Disponível em: https://www.nature.com/articles/cddis201477. Acesso em: 07 maio. 2022.
25. TARDIVO, J. P. et al. Methylene blue in photodynamic therapy : From basic mechanisms to clinical applications. Photodiagnosis and Photodynamic Therapy, v. 2, p. 175–191, 2005. Disponível em: https://www.sciencedirect.com/science/article/abs/pii/S1572100005000979. Acesso em: 07 maio. 2022.
26. ZHANG, J. et al. An updated overview on the development of new photosensitizers for anticancer photodynamic therapy. Acta pharmaceutica sinica B, v. 8, n. 2, p. 137–146, 2018. Disponível em: https://www.sciencedirect.com/science/article/pii/S2211383517302174. Acesso em: 25 ago. 2022.
27. LINARES, I. A. P.; PERUSSI, J. R. Síntese, caracterização estrutural, fotofísica e químico-biológica de novas clorinas visando aplicação em Terapia Fotodinâmica. 2018. Disponível em: https://repositorio.usp.br/item/002899382. Acesso em: 25 ago. 2022.
28. OLIVEIRA, C. B. DE. Inativação fotodinâmica do microrganismo Staphylococcus aureus presente em leite cru e pasteurizado. 2016. Disponível em: https://www.repositorio.ufal.br/handle/riufal/3742. Acesso em: 26 ago. 2022.
29. DE ASSIS, F. F. et al. Synthesis and photophysical studies of a chlorin sterically designed to prevent self-aggregation. Dyes and Pigments, v. 98, n. 1, p. 153–159, 2013. Disponível em: https://www.sciencedirect.com/science/article/abs/pii/S0143720813000612. Acesso em: 02 jun. 2022.
30. MACDONALD, I. J.; DOUGHERTY, T. J. Basic principles of photodynamic therapy. Journal of Porphyrins and Phthalocyanines, v. 5, n. 02, p. 105–129, 2001.
31. NAYAK, C. S. Photodynamic therapy in dermatology. Indian Journal of Dermatology, Venereology & Leprology, v. 71, n. 3, 2005.
32. SILVA, Alexia Marques. Complexos rutênio-ftalocianinas conjugados à superfície aminofuncionalizada de nanopartículas de conversão ascendente de óxido de ítrio dopado com Er3+ e Yb3+. Caracterização química, fotoquímica e fotobiológica. Tese de Doutorado. Universidade de São Paulo. 2019. Disponível em: https://www.teses.usp.br/teses/disponiveis/60/60136/tde18122019-162459/en.php. Acesso em: 27 ago. 2022.
33. GARCIA, M. T. Clorina com fotossensibilizador para Terapia Fotodinâmica sobre Streptococcus mutans. Repositório Institucional Unesp, 2018. Disponível em: http://hdl.handle.net/11449/154030. Acesso em: 27 ago. 2022.
34. DE ANNUNZIO, S. R. Avaliação da terapia fotodinâmica contra biofilmes acneicos polimicrobianos: um estudo pré-clínico. Repositório Institucional Unesp, 2022. Disponível em: https://repositorio.unesp.br/handle/11449/235269. Acesso em: 25 ago. 2022.
35. GOMES, L. C. M. et al. Uso da terapia laser fotodinâmica associada ao azul de metileno (PDT-MB) em células tumorais de próstata humanas (PC3). Repositório Institucional – Universidade Federal de Uberlândia, 2021. Disponível em: https://repositorio.ufu.br/handle/123456789/33803. Acesso em: 25 ago. 2022.
36. LOPES, N. S. DOS S. Avaliação fotodinâmica em células tumorais do câncer de mama e fibroblasto utilizando o fotossensibilizador bacterioclorina–trisma. 2018. Disponível em: https://repositorio.ufscar.br/handle/ufscar/10827. Acesso em: 27 ago. 2022.
37. TORINO, A. B. B. Análise comparativa entre Terapia Fotodinâmica plataforma Lince versus Criocirurgia no tratamento do Carcinoma Basocelular de baixo risco-estudo prospectivo randomizado. Biblioteca Digital Brasileira de Teses e Dissertações, 2022. Disponível em: https://bdtd.ibict.br/vufind/Record/UNICAMP-30_b5f2a96af8ad7a8b291a1999305edad1. Acesso em: 27 ago. 2022.
38. REIS, T. A. Desenvolvimento e avaliação in vitro de complexo de inclusão de cloreto de alumínio ftalocianina com ciclodextrina para a terapia fotodinâmica tópica de câncer de pele. xvii, 78 f., il. Tese (Doutorado em Ciências Farmacêuticas) – Universidade de Brasília, 2018. Disponível em: https://repositorio.unb.br/handle/10482/32650. Acesso em: 25 ago. 2022.
39. CHOI, S.-H.; KIM, K.-H.; SONG, K.-H. Effect of methyl aminolevulinate photodynamic therapy with and without ablative fractional laser treatment in patients with microinvasive squamous cell carcinoma: a randomized clinical trial. JAMA dermatology, v. 153, n. 3, p. 289–295, 2017. Disponível em: https://jamanetwork.com/journals/jamadermatology/article-abstract/2603496. Acesso em: 25 ago. 2022.
40. LEE, P. K.; KLOSER, A. Current methods for photodynamic therapy in the US: comparison of MAL/PDT and ALA/PDT. Journal of drugs in dermatology: JDD, v. 12, n. 8, p. 925–930, 2013. Disponível em: https://europepmc.org/article/med/23986167. Acesso em: 25 ago. 2022.
41. ALBUQUERQUE, I. O. Ensaio clínico para a avaliação da segurança e eficácia da terapia fotodinâmica mediada por nanoemulsão de al-cl-ftalocianina no tratamento do carcinoma basocelular de pele, 2017.
42. DOS SANTOS, F. A. B. et al. Synthesis of functionalized chlorins stericallyprevented from self-aggregation. Dyes and Pigments, v. 99, n. 2, p. 402–411, 2013. Disponível em: https://www.sciencedirect.com/science/article/abs/pii/S0143720813001952. Acesso em: 25 ago, 2022.
43. DUARTE, Joana Sofia da Silva. Caraterização de Fotossensibilizadores para Terapia Fotodinâmica. Tese de Doutorado. Universidade de Coimbra. 2021. Disponível em: https://estudogeral.sib.uc.pt/handle/10316/98012. Acesso em: 27 ago. 2022
1Discente da Universidade Anhembi Morumbi, São Paulo / SP, Brasil
2Docente do Instituto de Química – Universidade de São Paulo, São Paulo/ SP, Brasil
3Docente da Universidade Anhembi Morumbi, São Paulo / SP, Brasil
