REGISTRO DOI: 10.5281/zenodo.7139497
Autores:
Radji Citrini Merched Chaar1
Roniery Carlos Gonçalves Galindo2
RESUMO
No início de maio de 2022, um surto de casos de varíola dos macacos começou a ser relatado em países não endêmicos e endêmicos em áreas geográficas muito díspares, levando a Organização Mundial da Saúde (OMS) a declarar o atual surto de varíola dos macacos uma Emergência de Saúde Pública de Interesse Internacional (ESPII). A transmissão de humano para humano ocorre em aproximadamente 10% dos casos por gotículas respiratórias, ambiente ou ítens contaminados pelo paciente (fômites) e por contato próximo com lesões infectadas ou fluidos corporais de pessoas infectadas. Durante o atual surto, as manifestações clínicas estão se apresentando de maneira diferente quando comparadas aos surtos anteriores da doença, com os primeiros sintomas geralmente se apresentando como leves ou até assintomáticos, e o primeiro sinal clínico da doença sendo o surgimento de erupções cutâneas. Considerando a importância para a saúde pública desta doença e a mudança nos seus aspectos epidemiológicos, este manuscrito apresenta uma visão geral de importantes aspectos epidemiológicos e clínicos da varíola dos macacos, bem como sua importância para a saúde pública em todo o mundo e perspectivas para melhorar as estratégias futuras de prevenção e mitigação.
Palavras-chave: Varíola dos Macacos; Doença Viral Reemergente; Doença Infecciosa; Epidemiologia; Doenças Negligenciadas.
ABSTRACT
In early May 2022, an outbreak of monkeypox cases started to be reported in non-endemic and endemic countries in widely disparate geographical areas, leading the World Health Organization (WHO) to declare the current monkeypox outbreak a Public Health Emergency of International Concern (PHEIC). Human-to-human transmission occurs in approximately 10% of cases by respiratory droplets, contaminated patient’s environment or items (fomites) and by close contact with infected lesions or bodily fluids of infected people. During the current outbreak, clinical manifestations are presenting in a different manner when compared to previous disease outbreaks, with early symptoms usually present as mild or even asymptomatic, and the first signal of disease often being the emergence of the skin rashes. Considering the public health importance of this disease and its current changing epidemiology, with cases being reported in multiple regions where historically there had been no reports of the disease until this year, this manuscript presents an overview of important epidemiological and clinical aspects of the monkeypox disease, as well as its importance for public health worldwide and perspectives for enhancing future prevention and mitigation strategies.
Keywords: Monkeypox; Reemerging Viral Disease; Infectious Disease; Epidemiology; Neglected Diseases.
1. INTRODUÇÃO
Monkeypox (MPXV) é um vírus de DNA de fita dupla envelopado do gênero Orthopoxvirus da família Poxviridae (OMS, 2022). O vírus foi isolado pela primeira vez de macacos em 1958 (HARRIS, 2022), com infecções em humanos sendo inicialmente identificadas em 1970 na República Democrática do Congo (RDC), tendo se espalhado para outras regiões da África (principalmente Ocidental e Central) e se tornando endêmico lá, onde milhares de casos são relatados todos os anos (BUNGE et al., 2022; HARRIS, 2022).
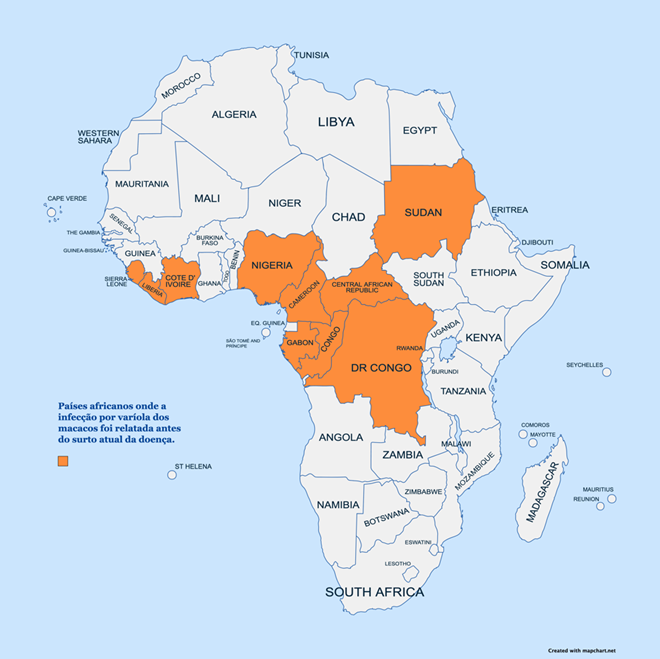
Desde 1970, casos humanos de MPXV foram relatados em 10 outros países africanos, nomeadamente: Benin, Camarões, República Centro-Africana, Gabão, Costa do Marfim, Libéria, Nigéria, República Democrática do Congo, Serra Leoa e Sudão do Sul (Fig 1). (OMS, 2022a).
FIGURA 1: PAÍSES AFRICANOS QUE RELATARAM INFECÇÕES POR VARÍOLA DOS MACACOS À OMS DESDE 1970 ATÉ 2022 (ANTERIOR AO ATUAL SURTO GLOBAL DA DOENÇA)
Existem duas estirpes de MPXV identificados até esta data: a estirpe da África Ocidental (AO) e a estirpe da Bacia do Congo (BC), sendo esta última associada a maior morbidade, mortalidade e transmissão de humano para humano (BEER; BHARGAVI RAO, 2019). O vírus MPXV está intimamente relacionado ao vírus da varíola humana (ICTV, 2022) , resultando em manifestações clínicas semelhantes ao vírus da varíola humana, consistindo em erupções pustulosas e doenças sistêmicas que podem variar de leves a fatais (BEER; BHARGAVI RAO, 2019), com linfadenopatia sendo uma característica proeminente da doença MPXV (DAMON, 2011).
Além disso, embora tenha uma apresentação clínica semelhante à da varíola humana em termos de início dos sintomas, tempo de ocorrência do exantema e distribuição do exantema, geralmente causa doença menos grave do que a varíola, com taxa de mortalidade em torno de 3% a 6%, de acordo com a OMS (OMS, 2022a). A vacina para a varíola humana demonstrou conferir proteção ao vírus MPXV, no entanto, desde a erradicação da varíola humana em 1980, a vacinação de rotina contra a mesma cessou em todo o mundo (DOSHI et al., 2019).
No início de maio de 2022, um surto de casos de MPXV começou a ser relatado em países não endêmicos e endêmicos em áreas geográficas muito díspares (OMS, 2022b) , levando a Organização Mundial da Saúde (OMS) a declarar o atual surto de MPXV uma Emergência de Saúde Pública de Interesse Internacional (ESPII) em 23 de Julho de 2022 (NUZZO; BORIO; GOSTIN, 2022).
Com isso em mente, este manuscrito apresenta uma visão geral de importantes aspectos epidemiológicos e clínicos da doença varíola dos macacos, bem como sua importância para a saúde pública em todo o mundo e perspectivas para melhorar as estratégias futuras de prevenção e mitigação, a fim de melhorar a capacidade das autoridades de saúde pública para gerenciamento, prevenção e mitigação desta doença viral reemergente.
2. EPIDEMIOLOGIA
A RDC é o país mais afetado pelo MPXV, sem que nenhum outro país tenha relatado casos continuamente durante as últimas cinco décadas (BUNGE et al., 2022). Depois da RDC vem a Nigéria, com 181 casos confirmados e prováveis relatados em um surto que começou em setembro de 2017 (NCDC, 2019). Com poucas exceções, surtos de MPXV têm sido consistentemente relatados em populações que vivem em áreas rurais, pequenas aldeias (menos de 1.000 pessoas) adjacentes ou dentro de florestas tropicais úmidas perenes – na chamada interface homem-animal (BEER; BHARGAVI RAO, 2019).
A varíola dos macacos é uma doença zoonótica, o que significa que pode se espalhar entre animais e pessoas (ALAKUNLE et al., 2020). Como tal, pode ser transmitida de roedores para humanos por inoculação direta através de mordidas ou arranhões, e contato próximo com animais vivos ou mortos infectados e/ou seus fluidos corporais, o que muitas vezes acontece por meio de caça, esfola, preparação de carcaças para refeições ou contato com animais selvagens (DIAZ, 2021; DOSHI et al., 2019).
A transmissão de humano para humano ocorre em aproximadamente 10% dos casos por gotículas respiratórias, ambiente ou itens contaminados pelo paciente (fômites) e por contato próximo com lesões infectadas ou fluidos corporais de pessoas infectadas (ALAKUNLE et al., 2020; DOSHI et al., 2019). Embora o reservatório animal desse vírus ainda seja desconhecido, os dados disponíveis sugerem que pequenos roedores africanos podem ser o principal reservatório do vírus (CDC, 2022).
O vírus MPXV pode infectar uma ampla gama de espécies de mamíferos, incluindo macacos, tamanduás, ouriços, cães da pradaria, esquilos, musaranhos e cães (PARKER; BULLER, 2013). Em agosto de 2022, foi publicado um relato sobre a transmissão de MPXV de humano para cão (SEANG et al., 2022), no entanto, ainda não se sabe se cães e gatos podem ser um vetor para esse vírus.
3. PATOLOGIA E APRESENTAÇÕES CLÍNICAS
A doença começa com a infecção da derme (após a transmissão por animais infectados) ou do epitélio respiratório (após a transmissão de uma pessoa infectada). O vírus se dissemina através do sistema linfático, resultando em viremia primária e infecção sistêmica. Uma viremia secundária resulta em infecção do epitélio, produzindo lesões na pele e nas mucosas.
A patologia da doença é caracterizada por inclusões eosinofílicas intracitoplasmáticas proeminentes nas células epiteliais. Outras alterações observadas na epiderme podem incluir degeneração em balão, necrose de queratinócitos e hiperplasia. A derme apresenta inflamação linfocítica e, à medida que a ulceração ocorre, há infiltração de neutrófilos, eosinófilos e células gigantes multinucleadas. A vasculite também está presente (GUARNER; DEL RIO; MALANI, 2022).
O vírus MPXV, como outros poxvírus, desenvolveu mecanismos para evadir as respostas imunes do hospedeiro. É provável que seja estável em fômites e acredita-se que o número de vírions necessários para a infecção seja baixo, com base em potenciais semelhanças com o vírus da varíola. Podem existir diferenças entre as estirpes, com estirpes de MPXV circulando na África Ocidental sendo mais atenuadas e menos transmissíveis do que aquelas presentes na Bacia do Congo (CHEN et al., 2005; MOSS, 2013).
Os primeiros sintomas geralmente se desenvolvem 1 a 2 semanas após uma pessoa ser infectada e podem incluir febre, calafrios e linfonodos inchados, seguidos pelo desenvolvimento de erupções cutâneas alguns dias depois. As lesões cutâneas causadas pelo vírus progridem por vários estágios, desde lesões semelhantes a bolhas até crostas, cada uma com duração de 1 a 2 dias. Depois que as crostas da lesão caem para revelar tecido saudável por baixo, o que geralmente leva de 2 a 4 semanas após o início dos sintomas, o indivíduo não é mais infeccioso (HARRIS, 2022).
Durante o atual surto de MPXV, as manifestações clínicas estão se apresentando de maneira diferente quando comparadas aos surtos anteriores da doença, com os primeiros sintomas geralmente se apresentando como leves ou até assintomáticos, e o primeiro sinal da doença geralmente é o surgimento de erupções cutâneas (HARRIS, 2022).
Não obstante, os sintomas geralmente começam na região da cabeça e progridem para os braços, pernas, palmas das mãos e plantas dos pés do paciente, no entanto, em casos atuais, foi descrito que a erupção começa na região genital ou perianal antes de se espalhar para as extremidades (BRAGAZZI et al., 2022; THORNHILL et al., 2022). Alguns pacientes também apresentaram proctite, ou inflamação do reto (ANTINORI et al., 2022; TARÍN-VICENTE et al., 2022). A maioria das pessoas infectadas é sintomática, mas a infecção subclínica pode ocorrer como sugerido por estudos anteriores (KAREM et al., 2007; LEWIS et al., 2007; MOSS, 2013).
4. DIFERENÇAS ENTRE AS LINHAS DA ÁFRICA OCIDENTAL (WA) E DA BACIA DO CONGO (CB)
Como mencionado anteriormente, existem dois clados filogenéticos distintos de vírus MPXV: o da África Ocidental (AO) e o da Bacia do Congo (BC). Antes do surto atual, a infecção causada pela estirpe AO havia sido relatada apenas na Libéria, Serra Leoa, Nigéria e Costa do Marfim entre 1970 e 2005, e nos Estados Unidos em 2003 (REYNOLDS; DAMON, 2012; WILSON et al., 2014). A principal diferença entre as duas estirpes é o fato de que infecções com a estirpe AO resultam em doenças menos graves em humanos e primatas não humanos (DAMON, 2011; ROTHMAN, 2011; SAIJO et al., 2009; WILSON et al., 2014).
No entanto, é difícil determinar quais são os principais fatores responsáveis pelas diferenças de virulência e apresentações clínicas das duas estirpes diferentes de MPXV, pois dados comparativamente rigorosos relativos aos parâmetros clínicos da doença humana ainda são escassos (REYNOLDS; DAMON, 2012)e mais pesquisas sobre o tema ainda são necessárias.
No entanto, comparações dos genomas das estirpes AO e BC apontaram para um conjunto de genes que podem estar envolvidos nas diferenças de virulência entre as duas estirpes (WILSON et al., 2014). Mais especificamente, polimorfismos específicos de clado em relativamente poucos genes na família ‘Ortólogos de Virulência’ podem explicar essas diferenças observadas (CHEN et al., 2005; LIKOS et al., 2005; REYNOLDS; DAMON, 2012).
A estirpe BC, por exemplo, impede a ativação de células T mediada por receptores de células T, proibindo a produção de citocinas inflamatórias em células humanas derivadas de pacientes com varíola dos macacos previamente infectados, sugerindo que ela pode produzir um modulador que suprime a ativação de células T cognatas (HAMMARLUND et al., 2008).
Os potenciais mediadores do aumento da virulência na estirpe BC incluem proteínas virais visando características da imunidade inata e adaptativa de mamíferos, incluindo o receptor de IL-1b e a proteína de controle do complemento, ambos ausentes na estirpe AO de MPXV, bem como a regulação negativa das respostas do hospedeiro (KINDRACHUK et al., 2012), incluindo proteínas que suprimem a apoptose em linfócitos infectados pelo vírus (CHEN et al., 2005; ESTEP et al., 2011; LIKOS et al., 2005; LISZEWSKI et al., 2006; REYNOLDS; DAMON, 2012; WILSON et al., 2014).
5. SURTO ATUAL DA DOENÇA NO MUNDO E IMPORTÂNCIA PARA A SAÚDE PÚBLICA
Em 5 de setembro de 2022, havia 53.027 casos confirmados de infecção por MPXV em todo o mundo. Desses casos confirmados, 52.516 são de locais que não haviam relatado historicamente a varíola dos macacos (CDC, 2022b).
A maioria dos casos de MPXV atualmente relatados estão concentrados em regiões da Europa e do hemisfério ocidental, com a Espanha tendo o maior número de casos na Europa até agora (6.543). No entanto, duas mortes foram relatadas na Espanha em julho de 2022 e uma morte na Bélgica em agosto de 2022 (ECDC, 2022).
Muitos dos casos confirmados de MPXV estão entre indivíduos com idade inferior a 40 anos, com idade média de 31 anos (PETERSEN et al., 2019). Isso pode ser devido ao fato de essa faixa etária ter nascido após a descontinuação da campanha de vacinação contra a varíola, portanto, sem imunidade de proteção cruzada dessa vacina (PETERSEN et al., 2019). Segundo a OMS, o atual surto continua afetando principalmente homens que praticam relações sexuais com homens e que relataram relações sexuais recentes com novos ou múltiplos parceiros (OMS, 2022c).
Embora as investigações epidemiológicas ainda estejam em andamento para elucidar mais aspectos da doença no atual surto, a maioria dos casos relatados recentemente foram identificados por meio de saúde sexual ou outros serviços de saúde em unidades de saúde primária ou secundária, com histórico de viagens principalmente para países da Europa e América do Norte ou outros países, e, cada vez mais, viagens recentes locais ou nenhuma viagem (OMS, 2022c).
É importante ressaltar que, até agora, a varíola dos macacos era considerada uma doença rara e autolimitada, não tendo atraído muita atenção desde sua descoberta há mais de 70 anos (PETERSEN et al., 2019). Como tal, ainda existem poucos laboratórios bem treinados e habilitados para realizar análises definitivas para casos suspeitos de MPXV e descartar as causas mais comuns de doença exantemática sistêmica, incluindo catapora. Além disso, questões de transporte e manuseio seguro de amostras também precisam ser abordadas para facilitar o envio de materiais infecciosos suspeitos e confirmados (DAMON, 2011).
No entanto, o cenário mudou com o atual surto da doença em vários países e a maneira como as autoridades de saúde em todo o mundo olham para a doença, já que não é mais um problema restrito à África Ocidental e à Bacia do Congo. Esse surto inesperado de transmissão de MPXV em áreas do globo onde não havia relatos anteriores da doença e a ampla disseminação geográfica de casos indicam que o vírus MPXV pode estar circulando abaixo dos níveis detectáveis pelos sistemas de vigilância em vigor e a transmissão sustentada de humano para humano pode não ter sido detectada por algum tempo (OMS, 2022c).
Agora, muito tem sido discutido sobre as razões para o ressurgimento de casos de varíola. Em primeiro lugar, os dados históricos mostraram que a vacinação contra a varíola humana demonstrava aproximadamente 85% de proteção contra a varíola dos macacos (FINE et al., 1988) e, após a campanha de vacinação bem-sucedida contra a varíola humana, a doença foi declarada erradicada em 1980 pela Assembleia Mundial da Saúde, e a vacinação de rotina cessou desde então (JEZEK; KHODAKEVICH; WICKETT, 1987), abrindo um “nicho imunológico” que pode ser explorado pelo vírus MPXV (REYNOLDS; DAMON, 2012).
Esse nicho imunológico pode ser definido como a diminuição da imunidade do rebanho devido à cessação da vacinação contra a varíola em todo o mundo (SIMPSON et al., 2020). Essa diminuição da imunidade pode resultar em um aumento no potencial de transmissão de animal para humano, seguido por um aumento na transmissão comunitária de pessoa para pessoa (DIAZ, 2021), conforme evidenciado pelo atual surto da doença em vários países.
Além disso, acredita-se que outros fatores também desempenham um papel na disseminação da doença para áreas anteriormente não endêmicas, como mudanças climáticas, exploração de florestas tropicais, conflitos geopolíticos e armados em áreas de doença e populações altamente móveis (SIMPSON et al., 2020).
6. MONKEYPOX NO BRASIL
O primeiro caso de MPXV foi relatado no Brasil em 9 de junho de 2022, quando um homem em São Paulo foi registrado como paciente zero no país. Este homem tinha histórico de viagens recentes a Espanha e Portugal e apresentou-se numa unidade de saúde com uma erupção vesicular com evolução de oito dias (LIMA et al., 2022).
Os primeiros sinais clínicos da doença foram prurido e sensação de queimação na glande peniana, além de duas lesões vesiculares de base eritematosa. No segundo dia de sintomas, as lesões vesiculares tornaram-se ulcerativas. No terceiro dia de sintomas, passou a apresentar febre alta, mialgia, cefaleia, hiporexia e mal-estar geral, além do desenvolvimento de mais lesões vesiculares em outras partes do corpo, momento em que o paciente procurou atendimento em uma unidade de saúde (LIMA et al., 2022).
Desde então, até 12 de setembro de 2022, foram notificados à OMS 6.033 casos de MPXV no Brasil, incluindo dois óbitos. É importante ressaltar que, antes do surto atual, o Brasil não tinha historicamente casos da doença notificados (CDC, 2022a).
As diretrizes atuais para o tratamento de casos suspeitos e prováveis de varíola no Brasil determinam que as amostras clínicas desses pacientes precisam ser coletadas e encaminhadas a um laboratório de referência para diagnóstico e confirmação através do teste molecular da reação em cadeia da polimerase (PCR, do inglês, polymerase chain reaction), que deverá ser seguido pelo sequenciamento do genoma completo, se possível (ANVISA, 2022; CVE et al., 2022; Lima et al., 2022).
A gravidade da doença no paciente e a necessidade de internação devem ser avaliadas e, caso o paciente possa receber alta, deve ser orientado adequadamente sobre o período de isolamento domiciliar. Além disso, o profissional de saúde que identificou o caso suspeito deve notificar imediatamente o caso, e o rastreamento de contatos próximos deve ser realizado o quanto antes (ANVISA, 2022; CVE et al., 2022; Lima et al., 2022).
7. CONCLUSÕES E PERSPECTIVAS PARA O FUTURO
A epidemiologia da infecção por varíola dos macacos em humanos agora mudou, e essa doença que antes era vista como “apenas mais uma doença negligenciada” tem demonstrado seu potencial de disseminação geográfica e sua relevância global para a saúde pública. Quando focamos na América Latina, os países desta região devem permanecer vigilantes ao vírus nas portas de entrada de pessoas nos países oriundas de países estrangeiros, melhorar a vigilância, a capacidade de diagnóstico e a pesquisa clínica e epidemiológica, para que assim possam ter uma compreensão clara dessa doença viral negligenciada e reemergente, bem como como seu impacto atual nos sistemas de saúde e na carga de doenças.
Não obstante, também é importante que as autoridades de saúde não apenas na América Latina, mas em todo o mundo, eduquem e conscientizem a população sobre o surto da doença, situações epidemiológicas atuais, modos de transmissão, riscos individualizados e período de quarentena, pois quanto mais adequadamente informada a população estiver sobre a doença, menos provável é que contribuam para aumentar a transmissão comunitária da mesma.
8. DECLARAÇÃO DE CONFLITOS
Os autores declaram que não têm interesses financeiros concorrentes conhecidos ou relacionamentos pessoais que possam ter influenciado o trabalho relatado neste artigo.
REFERÊNCIAS BIBLIOGRÁFICAS
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA – ANVISA. ORIENTAÇÕES PARA PREVENÇÃO E CONTROLE DA MONKEYPOX NOS SERVIÇOS DE SAÚDE – atualizada em 02/06/2022. Brasília 2022. Disponível em: https://www.gov.br/anvisa/pt-br/centraisdeconteudo/publicacoes/servicosdesaude/notas-tecnicas/nota-tecnica-gvims-ggtes-dire3-anvisa-no-03-2022-orientacoes-para-prevencao-e-controle-da-monkeypox-nos-servicos-de-saude-2013-atualizada-em-02-06-2022.
ALAKUNLE, Emmanuel; MOENS, Ugo; NCHINDA, Godwin; OKEKE, Malachy I. Monkeypox Virus in Nigeria: Infection Biology, Epidemiology, and Evolution. Viruses 2020. (11) ISBN: 1999-4915. DOI: 10.3390/v12111257.
ANTINORI, Andrea et al. Epidemiological, clinical and virological characteristics of four cases of monkeypox support transmission through sexual contact, Italy, May 2022. Euro surveillance : bulletin Europeen sur les maladies transmissibles = European communicable disease bulletin, [S. l.], v. 27, n. 22, 2022. ISSN: 1560-7917 (Electronic). DOI: 10.2807/1560-7917.ES.2022.27.22.2200421.
BEER, Ellen M.; BHARGAVI RAO, V. A systematic review of the epidemiology of human monkeypox outbreaks and implications for outbreak strategy. PLoS Neglected Tropical Diseases, [S. l.], v. 13, n. 10, p. 1–20, 2019. ISSN: 19352727. DOI: 10.1371/journal.pntd.0007791.
BRAGAZZI, Nicola L.; KONG, Jude D.; MAHROUM, Naim; TSIGALOU, Christina; KHAMISY-FARAH, Rola; CONVERTI, Manlio; WU, Jianhong. Epidemiological trends and clinical features of the ongoing monkeypox epidemic: A preliminary pooled data analysis and literature review. Journal of Medical Virology, [S. l.], n. June, 2022. ISSN: 10969071. DOI: 10.1002/jmv.27931.
BUNGE, Eveline M.; HOET, Bernard; CHEN, Liddy; LIENERT, Florian; WEIDENTHALER, Heinz; BAER, Lorraine R.; STEFFEN, Robert. The changing epidemiology of human monkeypox—A potential threat? A systematic review. PLoS Neglected Tropical Diseases, [S. l.], v. 16, n. 2, p. 1–20, 2022. ISSN: 19352727. DOI: 10.1371/journal.pntd.0010141. Disponível em: http://dx.doi.org/10.1371/journal.pntd.0010141.
CENTERS FOR DISEASE CONTROL AND PREVENTION (CDC). Monkeypox in Animals. 2022a. Disponível em: https://www.cdc.gov/poxvirus/monkeypox/veterinarian/monkeypox-in-animals.html. Acesso em: 4 set. 2022.
CENTERS FOR DISEASE CONTROL AND PREVENTION (CDC). 2022 Monkeypox Outbreak Global Map. [s.l.: s.n.]. Disponível em: https://www.cdc.gov/poxvirus/monkeypox/response/2022/world-map.html.
CENTRO DE VIGILÂNCIA EPIDEMIOLÓGICA “PROF. ALEXANDRE VRANJAC”; CENTRAL / CIEVS – CENTRO DE INFORMAÇÕES ESTRATÉGICAS EM VIGILÂNCIA EM SAÚDE; INSTITUTO ADOLFO LUTZ. Alerta Epidemiológico – Número 2 / 2022 – 26/05/2022. MONKEYPOX – MPX (Varíola símia). São Paulo. Disponível em: https://www.prefeitura.sp.gov.br/cidade/secretarias/upload/saude/Alerta Epidemiológico CVE n_2 Monkeypox_26MAIO.pdf.
CHEN, Nanhai et al. Virulence differences between monkeypox virus isolates from West Africa and the Congo basin. Virology, United States, v. 340, n. 1, p. 46–63, 2005. ISSN: 0042-6822 (Print). DOI: 10.1016/j.virol.2005.05.030.
DAMON, Inger K. Status of human monkeypox: Clinical disease, epidemiology and research. Vaccine, [S. l.], v. 29, n. SUPPL. 4, p. D54–D59, 2011. ISSN: 0264410X. DOI: 10.1016/j.vaccine.2011.04.014. Disponível em: http://dx.doi.org/10.1016/j.vaccine.2011.04.014.
DIAZ, James H. The Disease Ecology, Epidemiology, Clinical Manifestations, Management, Prevention, and Control of Increasing Human Infections with Animal Orthopoxviruses. Wilderness and Environmental Medicine, [S. l.], v. 32, n. 4, p. 528–536, 2021. ISSN: 10806032. DOI: 10.1016/j.wem.2021.08.003. Disponível em: https://doi.org/10.1016/j.wem.2021.08.003.
DOSHI, Reena H. et al. Epidemiologic and ecologic investigations of Monkeypox, Likouala department, Republic of the Congo, 2017. Emerging Infectious Diseases, [S. l.], v. 25, n. 2, p. 273–281, 2019. ISSN: 10806059. DOI: 10.3201/eid2502.181222.
ESTEP, Ryan D. et al. Deletion of the monkeypox virus inhibitor of complement enzymes locus impacts the adaptive immune response to monkeypox virus in a nonhuman primate model of infection. Journal of virology, [S. l.], v. 85, n. 18, p. 9527–9542, 2011. ISSN: 1098-5514 (Electronic). DOI: 10.1128/JVI.00199-11.
EUROPEAN CENTRE FOR DISEASE PREVENTION AND CONTROL (ECDC). Epidemiological data on the 2022 monkeypox outbreak. 2022. Disponível em: https://www.ecdc.europa.eu/en/infectious-disease-topics/z-disease-list/monkeypox/epidemiological-data-2022-monkeypox-outbreak. Acesso em: 5 set. 2022.
FINE, P. E.; JEZEK, Z.; GRAB, B.; DIXON, H. The transmission potential of monkeypox virus in human populations. International journal of epidemiology, England, v. 17, n. 3, p. 643–650, 1988. ISSN: 0300-5771 (Print). DOI: 10.1093/ije/17.3.643.
GUARNER, Jeannette; DEL RIO, Carlos; MALANI, Preeti N. Monkeypox in 2022—What Clinicians Need to Know. JAMA, [S. l.], v. 328, n. 2, p. 139–140, 2022. ISSN: 0098-7484. DOI: 10.1001/jama.2022.10802. Disponível em: https://doi.org/10.1001/jama.2022.10802.
HAMMARLUND, Erika; DASGUPTA, Anindya; PINILLA, Clemencia; NORORI, Patricia; FRÜH, Klaus; SLIFKA, Mark K. Monkeypox virus evades antiviral CD4+ and CD8+ T cell responses by suppressing cognate T cell activation. Proceedings of the National Academy of Sciences, [S. l.], v. 105, n. 38, p. 14567–14572, 2008. DOI: 10.1073/pnas.0800589105. Disponível em: https://doi.org/10.1073/pnas.0800589105.
HARRIS, Emily. What to Know About Monkeypox. JAMA, [S. l.], v. 327, n. 23, p. 2278–2279, 2022. ISSN: 0098-7484. DOI: 10.1001/jama.2022.9499. Disponível em: https://doi.org/10.1001/jama.2022.9499.
INTERNATIONAL COMMITTEE ON TAXONOMY OF VIRUSES (ICTV). Monkeypox virus. Taxon Details 2022. Disponível em: https://ictv.global/taxonomy/taxondetails?taxnode_id=202104771. Acesso em: 4 set. 2022.
JEZEK, Z.; KHODAKEVICH, L. N.; WICKETT, J. F. Smallpox and its post-eradication surveillance. Bulletin of the World Health Organization, [S. l.], v. 65, n. 4, p. 425–434, 1987. ISSN: 0042-9686 (Print).
KAREM, Kevin L. et al. Monkeypox-induced immunity and failure of childhood smallpox vaccination to provide complete protection. Clinical and vaccine immunology : CVI, [S. l.], v. 14, n. 10, p. 1318–1327, 2007. ISSN: 1556-6811 (Print). DOI: 10.1128/CVI.00148-07.
KINDRACHUK, Jason; ARSENAULT, Ryan; KUSALIK, Anthony; KINDRACHUK, Kristen N.; TROST, Brett; NAPPER, Scott; JAHRLING, Peter B.; BLANEY, Joseph E. Systems kinomics demonstrates Congo Basin monkeypox virus infection selectively modulates host cell signaling responses as compared to West African monkeypox virus. Molecular & cellular proteomics : MCP, [S. l.], v. 11, n. 6, p. M111.015701, 2012. ISSN: 1535-9484 (Electronic). DOI: 10.1074/mcp.M111.015701.
LEWIS, Matthew W.; GRAHAM, Mary Beth; HAMMARLUND, Erika; HANIFIN, Jon; SLIFKA, Mark K. Monkeypox without Exanthem. New England Journal of Medicine, [S. l.], v. 356, n. 20, p. 2112–2114, 2007. ISSN: 0028-4793. DOI: 10.1056/NEJMc062788. Disponível em: https://doi.org/10.1056/NEJMc062788.
LIKOS, Anna M. et al. A tale of two clades: Monkeypox viruses. Journal of General Virology, [S. l.], v. 86, n. 10, p. 2661–2672, 2005. ISSN: 00221317. DOI: 10.1099/vir.0.81215-0.
LIMA, Evelyn Lepka De et al. First case report of monkeypox in Brazil: clinical manifestations and differential diagnosis with sexually transmitted infections. Revista do Instituto de Medicina Tropical de Sao Paulo, [S. l.], v. 64, n. 54, p. 1–7, 2022. Disponível em: https://www.scielo.br/j/rimtsp/a/PsVw9gQSWvvzB4NfVY3hPvC/?lang=en#ModalArticles.
LISZEWSKI, M. Kathryn; LEUNG, Marilyn K.; HAUHART, Richard; BULLER, R. Mark L.; BERTRAM, Paula; WANG, Xuefeng; ROSENGARD, Ariella M.; KOTWAL, Girish J.; ATKINSON, John P. Structure and regulatory profile of the monkeypox inhibitor of complement: comparison to homologs in vaccinia and variola and evidence for dimer formation. Journal of immunology (Baltimore, Md. : 1950), United States, v. 176, n. 6, p. 3725–3734, 2006. ISSN: 0022-1767 (Print). DOI: 10.4049/jimmunol.176.6.3725.
MOSS, William J. 28 – Viral Infections with Cutaneous Lesions. In: MAGILL, Alan J.; HILL, David R.; SOLOMON, Tom; RYAN, Edward T. B. T. Hunter’s Tropical Medicine and Emerging Infectious Disease (Ninth Edition) (org.). Hunter’s Tropical Medicine and Emerging Infectious Disease. 9. ed., London: W.B. Saunders, 2013. p. 251–268. ISBN: 978-1-4160-4390-4. DOI: https://doi.org/10.1016/B978-1-4160-4390-4.00170-3. Disponível em: https://www.sciencedirect.com/science/article/pii/B9781416043904001703.
NIGERIA CENTRE FOR DISEASE CONTROL (NCDC). Nigeria monkeypox monthly situation report. [s.l.: s.n.]. Disponível em: https://reliefweb.int/sites/reliefweb.int/files/resources/5a1a9820f21136842ba43f186b8d09e7.pdf.
NUZZO, Jennifer B.; BORIO, Luciana L.; GOSTIN, Lawrence O. The WHO Declaration of Monkeypox as a Global Public Health Emergency. JAMA, [S. l.], v. 328, n. 7, p. 615–617, 2022. ISSN: 0098-7484. DOI: 10.1001/jama.2022.12513. Disponível em: https://doi.org/10.1001/jama.2022.12513.
PARKER, Scott; BULLER, R. Mark. A review of experimental and natural infections of animals with monkeypox virus between 1958 and 2012. Future virology, [S. l.], v. 8, n. 2, p. 129–157, 2013. ISSN: 1746-0794. DOI: 10.2217/fvl.12.130.
PETERSEN, Eskild; KANTELE, Anu; KOOPMANS, Marion; ASOGUN, Danny; YINKA-OGUNLEYE, Adesola; IHEKWEAZU, Chikwe; ZUMLA, Alimuddin. Human Monkeypox: Epidemiologic and Clinical Characteristics, Diagnosis, and Prevention. Infectious Disease Clinics, [S. l.], v. 33, n. 4, p. 1027–1043, 2019. ISSN: 0891-5520. DOI: 10.1016/j.idc.2019.03.001. Disponível em: https://doi.org/10.1016/j.idc.2019.03.001.
REYNOLDS, Mary G.; DAMON, Inger K. Outbreaks of human monkeypox after cessation of smallpox vaccination. Trends in Microbiology, [S. l.], v. 20, n. 2, p. 80–87, 2012. ISSN: 0966842X. DOI: 10.1016/j.tim.2011.12.001. Disponível em: http://dx.doi.org/10.1016/j.tim.2011.12.001.
ROTHMAN, Alan L. Immunity to dengue virus: A tale of original antigenic sin and tropical cytokine storms. Nature Reviews Immunology, [S. l.], v. 11, n. 8, p. 532–543, 2011. ISSN: 14741733. DOI: 10.1038/nri3014. Disponível em: http://dx.doi.org/10.1038/nri3014.
SAIJO, Masayuki et al. Virulence and pathophysiology of the Congo Basin and West African strains of monkeypox virus in non-human primates. The Journal of general virology, England, v. 90, n. Pt 9, p. 2266–2271, 2009. ISSN: 0022-1317. DOI: 10.1099/vir.0.010207-0.
SEANG, Sophie; BURREL, Sonia; TODESCO, Eve; LEDUCQ, Valentin; MONSEL, Gentiane; LE PLUART, Diane; CORDEVANT, Christophe; POURCHER, Valérie; PALICH, Romain. Evidence of human-to-dog transmission of monkeypox virus. Lancet (London, England), [S. l.], v. 400, p. 658–659, 2022. ISSN: 1474-547X. DOI: 10.1016/S0140-6736(22)01487-8. Disponível em: http://www.ncbi.nlm.nih.gov/pubmed/35963267.
SIMPSON, Karl et al. Human monkeypox – After 40 years, an unintended consequence of smallpox eradication. Vaccine, [S. l.], v. 38, n. 33, p. 5077–5081, 2020. ISSN: 18732518. DOI: 10.1016/j.vaccine.2020.04.062. Disponível em: https://doi.org/10.1016/j.vaccine.2020.04.062.
TARÍN-VICENTE, Eloy José et al. Clinical presentation and virological assessment of confirmed human monkeypox virus cases in Spain: a prospective observational cohort study. Lancet (London, England), [S. l.], v. 400, p. 661–669, 2022. ISSN: 1474-547X. DOI: 10.1016/S0140-6736(22)01436-2. Disponível em: http://www.ncbi.nlm.nih.gov/pubmed/35952705.
THORNHILL, John P. et al. Monkeypox Virus Infection in Humans across 16 Countries – April-June 2022. The New England journal of medicine, [S. l.], 2022. ISSN: 1533-4406. DOI: 10.1056/NEJMoa2207323. Disponível em: http://www.ncbi.nlm.nih.gov/pubmed/35866746.
WILSON, Mary E.; HUGHES, James M.; MCCOLLUM, Andrea M.; DAMON, Inger K. Human monkeypox. Clinical Infectious Diseases, [S. l.], v. 58, n. 2, p. 260–267, 2014. ISSN: 10584838. DOI: 10.1093/cid/cit703.
WORLD HEALTH ORGANIZATION (WHO). Monkeypox. 2022a. Disponível em: https://www.who.int/news-room/fact-sheets/detail/monkeypox. Acesso em: 4 set. 2022.
WORLD HEALTH ORGANIZATION (WHO). Monkeypox outbreak, 2022. 2022b. Disponível em: https://www.who.int/emergencies/situations/monkeypox-oubreak-2022. Acesso em: 4 set. 2022.
WORLD HEALTH ORGANIZATION (WHO). Multi-country monkeypox outbreak. 2022c. Disponível em: https://www.who.int/emergencies/disease-outbreak-news/item/2022-DON393. Acesso em: 5 set. 2022.
1Graduando do curso de medicina veterinária do Centro Universitário Fametro, Manaus, Amazonas, Brasil.
E-mail: radcitrinii@gmail.com
2Professor do curso de medicina veterinária do Centro Universitário
Fametro, Manaus, Amazonas, Brasil.
