REGISTRO DOI: 10.5281/zenodo.7092778
Autores:
Kamilla Taveira Gomes1
João Victor Amaral da Silva2
Orientadora:
Keila Dayane do Espírito Santo Pereira3
RESUMO
O Brasil tem o terceiro maior rebanho equino do mundo, com de 5,6 milhões de equinos, movimentando um valor em torno R$16,5 bilhões ao ano, gerando cerca de 3 milhões de empregos diretos e indiretos. O vírus da AIE tem distribuição mundial. No Brasil já foram confirmados 141.860 casos de AIE até o ano de 2021, porém com decréscimo de 73,11% entre o ano de 2014 a 2021. No mesmo período, o Amazonas registrou 21 casos em 2014 e 91 casos em 2021, um crescimento de 333,34%, totalmente inverso aos índices nacionais. O vírus da anemia infecciosa equina (VAIE) pertence ao gênero Lentivirus da Família Retroviridae, subfamília Orthoretrovirinae, causador de uma infecção recorrente de transmissibilidade rápida e incurável, acometendo equídeos, asininos e muares. O sinal mais marcante do vírus é a anemia, dependendo da sua fase, podendo ser aguda, crônica ou inaparente. A sua transmissão pode ocorrer de forma vertical (intra uterina) e horizontal (através de fômites, leite, sêmen, e insetos hematófagos), sendo abundante espécies de tabanídeos no Amazonas, um dos vetores mais eficientes. O seu ambiente propício e a abundância de insetos hematófagos tornam o estado um local perfeito para os vetores e a fácil propagação da doença. Assim, é necessário mais estudo na região, bem como a divulgação do VAIE de forma completa para a comunidade amazonense, assegurando dessa forma a sanidade dos rebanhos e mais segurança para os produtores.
Palavras-chave: Anemia Infecciosa Equina, Amazonas, epidemiologia.
ABSTRACT
Brazil has the third largest equine herd in the world, with 5.6 million horses, moving a value of around R$16.5 billion per year, generating about 3 million direct and indirect jobs. The EIA virus has a worldwide distribution. In Brazil, 141,860 cases of EIA have already been confirmed by the year 2021, but with a decrease of 73.11% between the year 2014 and 2021. In the same period, Amazonas recorded 21 cases in 2014 and 91 cases in 2021, a growth of 333.34%, totally inverse to the national indexes. The equine infectious anemia virus (EAV) belongs to the genus Lentivirus of the Retroviridae family, subfamily Orthoretrovirinae, causing a recurrent infection of rapid and incurable transmissibility, affecting horses, donkeys and mules. The most striking sign of the virus is anemia, depending on its phase, which can be acute, chronic or inapparent. Its transmission can occur vertically (intrauterine) and horizontally (through fomites, milk, semen, and blood-sucking insects). Its favorable environment and the abundance of blood-sucking insects make the state a perfect location for vectors and the easy spread of the disease. Thus, more study is needed in the region, as well as the dissemination of the VAIE in a complete way to the Amazonian community, thus ensuring the health of the herds and more safety for the producers.
Keywords: Equine Infectious Anemia, Amazonas, epidemiology.
INTRODUÇÃO
O Brasil tem o terceiro maior rebanho equino do mundo, com de 5,6 milhões de equinos, movimentando um valor em torno R$16,5 bilhões ao ano, gerando cerca de 3 milhões de empregos diretos e indiretos (LIMA, 2006; BRASIL, 2016). No estado do Amazonas, sabe-se que a região obtém um rebanho de 28.884 mil equinos (IBGE, 2020), que compõem o complexo de agronegócio de cavalos com mais de 30 segmentos empregatícios (BRASIL, 2016).
O vírus da anemia infecciosa equina (VAIE) pertence ao gênero Lentivirus da Família Retroviridae, subfamília Orthoretrovirinae, causador de uma infecção recorrente em equídeos, asininos e muares. Ocasionando um entrave na equinocultura local por ser uma doença de transmissibilidade rápida e incurável, impedindo o desenvolvimento econômico e admissão no comércio internacional (ALMEIDA, 2006; CURSINO, 2018).
O vírus da AIE, de acordo com Almeida et al. (2017), tem distribuição mundial. Dentre todas as regiões nacionais, a região norte apresenta prevalência de AIE 14 vezes maior comparada à região sul do Brasil. O ambiente úmido e quente das florestas temperadas da região amazônica propicia a disseminação de insetos hematófagos, principalmente da família Tabanídea, como a mosca do cavalo e mosca do estábulo Stomoxys spp, que atua como o maior transmissor rápido de AIE, sendo um vetor mecânico de vestígios sanguíneos entre cavalos infectados e não infectados (FERREIRA; RAFAEL, 2006; SANTOS et al. 2016). O contágio também pode ser transpassado de forma iatrogênica, através de instrumentos cirúrgicos ou equipamentos contaminados (SHARAV, 2017; NOGUEIRA, 2017).
A AIE se trata de uma doença vertiginosa, pois uma vez que o vírus infecta o hospedeiro há transcrição mediante a ação da enzima transcriptase, englobando a produção de DNA dupla hélice ao genoma do hospedeiro, originando o provírus (POLTRONIERI et al., 2015).
A doença possui curso clínico agudo, crônico ou inaparente. Os primeiros sinais clínicos podem aparecer entre 15 a 60 dias após a exposição (FRANCO; PAES, 2011). No entanto é possível que em equinos portadores não existam ciclos de episódios reguláveis da doença, sendo assim mais abstruso o diagnóstico (COSTA, 2018).
O Ministério da Agricultura, Pecuária e Abastecimento (MAPA) através da Secretaria de Defesa Agropecuária determinou na instrução Normativa Nº 52, de 26 de novembro de 2018 , critérios e exigências fundamentadas para o diagnóstico de anemia infecciosa equina, contemplando como base a constatação da doença soropositiva apenas mediante a técnica de Imunodifusão em Gel de Agar (IDGA) e ensaio imunoenzimático (ELISA), sendo o teste IDGA majoritariamente relevante sobre o teste de Elisa no qual é legitimado apenas após a contraprova em IDGA, que prevalece mesmo em casos de divergências dos resultados (BRASIL,2018).
A notificação da infecção pelo vírus da anemia infecciosa equina (VAIE) é obrigatória e determinada pela Organização Mundial de Saúde Animal (OIE) (BRASIL, 2013; COOK et al., 2013). Segundo a legislação de defesa sanitária do Brasil o equino portador da doença (AIE) deve passar por um abate sanitário, mediante a um laudo de comprovação soropositiva em Ágar Gel (IDGA) com prerrogativa de reteste, exceto em lugares de alto risco, onde o ambiente oportuniza a disseminação do vírus (BRASIL, 2004).
Dessa forma, é notória a necessidade de uma maior divulgação da patogenia e profilaxias existentes para AIE, entendendo primariamente as dificuldades ambientais e climáticas que podem estar favorecendo a propagação do VAIE na região Norte. Assim, essa presente revisão de literatura contribuirá para uma maior sensibilização sobre a importância da AIE no estado do Amazonas, analisando a patologia como um todo, bem como as suas formas de profilaxia e as particularidades que o estado enfrenta.
1. ETIOLOGIA
O Vírus da Anemia Infecciosa Equina (VAIE) é um vírus pertencente à família Retroviridae, subfamília Orthoretrovirinae gênero Lentivirus, assim podendo ser classificado como um Lentivírus (QUINN et al., 2005). O genoma do vírus é diploide, possuindo duas moléculas idênticas de RNA de fita simples. Após a entrada do vírus em uma célula, ele se codifica em DNA através da enzima transcriptase reversa, dando origem ao DNA proviral. O seu genoma é dividido em três genes principais: gag (antígenos específicos de grupo), pol (polimerase) e env (envelope) (RAVAZZOLO; COSTA, 2017).
Os equídeos são os únicos animais da ordem Perissodáctilos que se transformaram susceptíveis ao VAIE. Assim, sugere-se que a primeira infecção possa ter ocorrido após a sua divergência evolutiva das antas e dos rinocerontes entre 40 a 55 milhões de anos atrás (COOK et al, 2013). Os primeiros casos relacionados à patologia ocorreram na França, em 1843. Porém, somente no ano de 1904, Vallée e Carré atribuíram a etiologia da doença a um agente viral, classificando-o como pertencente ao “grupo dos micróbios invisíveis” (VALLÉE, CARRÉ, 1904 apud. PANISSET, 1938).
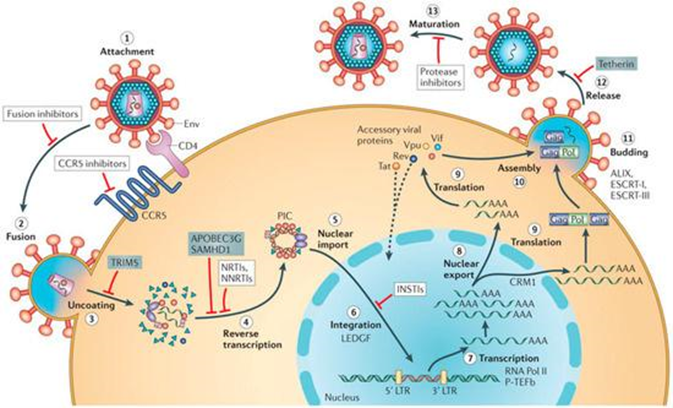
A infecção do VAIE na célula se inicia quando as glicoproteínas de superfície do vírus são reconhecidas, se ligando aos receptores ELR-1 que estão na superfície das células-alvo (Figura 1, nº 1) (LEROUX et al., 2004). Em seguida, o receptor celular e a superfície viral modificam as suas conformações, fundindo-se, ocorrendo o desnudamento do material genético do vírus no citoplasma da hospedeira, realizando então a síntese de DNA a partir do RNA viral, sob a ação da enzima transcriptase reversa, que vem acoplada ao vírion (Figura 1, nº 2, 3 e 4) (KURITZKES, 2004). Após passadas 24 horas da infecção, o DNA do vírus é levado para o núcleo da célula hospedeira, onde se integra ao genoma e forma o provírus (Figura 1, nº 5 e 6) (LIU et al., 2016). Logo, o DNA proviral é transcrito pela RNA polimerase II da célula, produzindo mRNAs virais com tamanhos diferentes (Figura 1, nº 7). Os mRNAs que possuem o propósito da síntese das proteínas Tat, Rev e S2 são transportados para o citoplasma (Figura 1, nº 8 e 9), onde são traduzidas, e apenas a proteína Tat retorna ao núcleo para regular a transcrição dos demais genes. Ao mesmo tempo, os mRNAs que foram destinados a fabricação das poliproteínas estruturais env e gag-pol por serem moléculas grandes, ficam separadas no núcleo celular, onde a sua migração para fora do núcleo só é permitida via receptor CRM1, que necessita de uso energético (DESROSIERS, 2007; MUSUMECI et al., 2015). Para isso, a proteína Rev volta ao núcleo e, através do seu domínio rico em arginina, liga-se ao receptor CRM1, permitindo a liberação dos mRNAs maiores para o citoplasma da hospedeira, onde são traduzidos em proteínas estruturais, atuando na montagem de partículas infecciosas novas (POLLARD e MALIN, 1998). O RNA genômico é ligado ao complexo de nucleoproteína, produto resultante da transcrição dos genes gag-pol, e após o fechamento da nucleoproteína, o VAIE é envelopado e passa pelo processo de brotamento e maturação. Por fim, há a liberação de novas partículas virais que, após a sua maturação, podem infectar novas células-alvo, propagando-se no animal (Figura 1, nº 10, 11, 12 e 13) (DESROSIERS, 2007).
FIGURA 1 – REPRESENTAÇÃO ESQUEMÁTICA DO CICLO DE REPLICAÇÃO DO VAIE NA CÉLULA HOSPEDEIRA
2. EPIDEMIOLOGIA
A população brasileira de equídeos totalizou no ano de 2020 5.962.126 mil cabeças de equinos, sendo no Amazonas 28.884 mil animais em constante crescimento ao longo dos anos (IBGE, 2020). Estes animais são usados de forma geral como meios de subsistência, para fins domésticos e comerciais. A principal importância está diretamente relacionada à movimentação econômica gerada pela indústria equídea, nos quais abrangem consideravelmente o comércio e utilização dos animais para trabalho, cultura, esporte, turismo, entre outros (LIMA; CINTRA, 2015).
O VAIE possui uma vasta distribuição no mundo, porém a sua prevalência é bem variada em diversas regiões. Como os índices de prevalência da patologia estão baseados nos resultados dos testes de diagnóstico, que na maioria das vezes é aplicado em animais destinados à comercialização, participação em eventos agropecuários e exposições, é provável que os quantitativos que refletem a presença da AIE no mundo estejam subestimados (OLIVEIRA, 2016). No Brasil já foram confirmados 141.860 casos de AIE até o ano de 2021, porém com decréscimo de 73,11% entre o ano de 2014 a 2021. No mesmo período, o Amazonas registrou 21 casos em 2014 e 91 casos em 2021, um crescimento de 333,34%, totalmente inverso aos índices nacionais (BRASIL, 2022).
A transmissão da AIE pode ocorrer de forma vertical (intra uterina) e horizontal (através de fômites, leite, sêmen, e insetos hematófagos). Entretanto, as formas de transmissão que possuem maior expressão epidemiológica são as de transmissão vetorial, ocorrendo por insetos hematófagos e de forma iatrogênica (SELLON, 1993). Dessa forma, o sangue de equídeos infectados se constitui como a fonte mais importante de transmissão para o VAIE (MEALEY, 2014). A elevada prevalência dessa doença é um reflexo das condições geoclimáticas que são propícias à sobrevivência dos insetos vetores que propagam o vírus entre os equídeos (ALMEIDA et al., 2006, FRANCO; PAES, 2011).
Cezar e Henriques (2011) registraram na região amazônica 222 espécies de tabanídeos, nas quais 141 espécies eram endêmicas, alertando sobre as sérias chances do aumento descontrolado desses insetos em casos de bruscas mudanças ambientais. Os tabanídeos são os insetos que estão mais envolvidos na transmissão do VAIE; esses insetos carreiam em sua probóscide o vírus. As mutucas são dípteros que pertencem à família Tabanidae, sendo também vetores de outras patologias (FOIL, 1989a). A transferência do agente viral ocorre quando repasto sanguíneo é interrompido e imediatamente continuado em um segundo animal (BOWMAN et al, 2006, RAVAZZOLO; COSTA, 2017). Isso ocorre pois os tabanídeos são extremamente móveis e excelentes transmissores mecânicos. Os mesmos possuem a capacidade de interromper a picada, ou serem interrompidos pela dor do hospedeiro, e se transferir para outro, finalizando a refeição sanguínea e consequentemente transmitindo a patologia do hospedeiro anterior (FOIL, 1989b; LUZ-ALVES et al. 2007; DESQUESNES et al. 2009).
Outra forma de disseminação do VAIE muito relevante é o compartilhamento de instrumentos cirúrgicos, agulhas ou acessórios equinos contaminados, sendo o homem o vetor principal da doença (MEALEY, 2007). Ainda é frequente a reutilização de agulhas entre os animais, facilitando a disseminação do vírus no rebanho e demonstrando um possível desconhecimento dos tratadores. Uma agulha de 22G (0,7 mm) pode transferir aproximadamente 1000 nl de sangue retido após uma coleta sanguínea. Em tabanídeos a quantidade de sangue retida em suas peças bucais varia apenas entre 5 a 10 nl (ISSEL; FOIL, 2015).
Ainda, levanta-se a possibilidade da transmissão do VIAE por outras vias, além da inoculação direta de sangue entre um animal infectado em um animal sadio, como pela inalação de partículas virais aerossolizadas, contudo as suspeitas ainda se encontram sobre investigação e objetos de estudo. (CULLINANE et al., 2007; BOLFA et al., 2013).
3. SINAIS CLÍNICOS
A AIE possui o seu curso clínico já bem elucidado na espécie Equus ferus caballus, sendo que os sinais clínicos e a sua intensidade podem variar consideravelmente de acordo com a carga viral concebida pelo animal (Cook et al., 2003).
O sinal mais marcante do VAIE e característico é a anemia. A anemia pode ocorrer na forma de hemólise imunomediada (eritrofagocitose e hemólise mediada pelo complemento), ou também na forma de depressão da medula óssea (ligada à replicação viral). Dentre os sinais, o mais precoce é a trombocitopenia, sinal este quase sempre presente nesta patologia. Porém, mesmo ainda não sendo bem elucidada essa questão, sugere-se que a trombocitopenia ocorra pela existência do TNF-α, TNF-β e IL-6 produzidos pelos macrófagos, causando inibição do crescimento dos megacariócitos (LEROUX et al., 2005; CRAIGO; MONTELARO, 2008; RAVAZZOLO; COSTA, 2017).
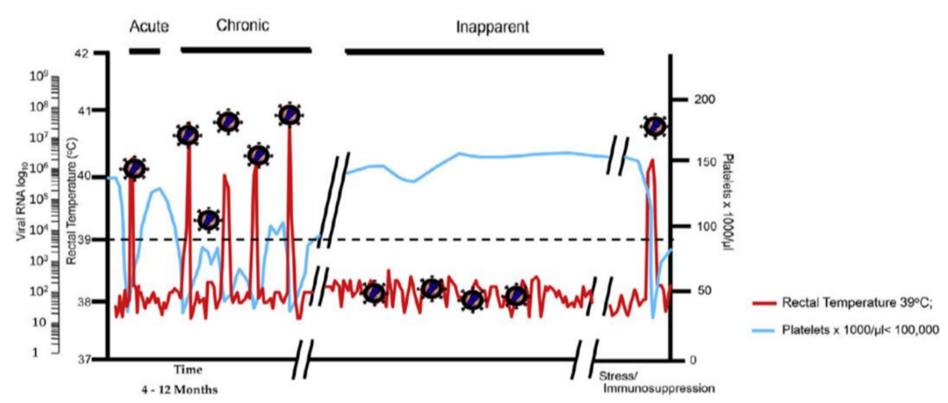
O VAIE pode se desenvolver em três fases: fase aguda, fase crônica ou fase inaparente (Figura 2). Na fase aguda, que pode ocorrer de 7 a 30 dias pós-infecção, ocorrendo um pico de viremia, o equino desenvolve um quadro clínico de febre, trombocitopenia, inapetência e letargia (ISSEL; COGGINS, 1979; SELLON, 1993). Entretanto, pode ocorrer ausência de sintomatologia ou sintomas febris brandos. Na ocorrência de casos mais graves, o animal pode apresentar petéquias, epistaxe e anemia hemolítica (ISSEL et al., 2014).
Na fase crônica, que pode ocorrer até 12 meses pós-infecção, é marcada por episódios múltiplos e também recorrentes de febre, trombocitopenia, e eventuais desenvolvimentos de sinais clínicos e neurológicos como ataxias ou encefalites (ISSEL et al., 2014; LEROUX; COOK, 2016;). Ainda, há ocorrências de manifestações de edema ventral, anorexia, esplenomegalia e hemorragias que dificultam ainda mais uma possível recuperação do animal (LEROUX et al., 2005).
Contudo, a AIE geralmente apresenta a sua infecção de forma subclínica, discreta ou inaparente. Assim, os animais tornam-se assintomáticos, mas permanecem como portadores vitalícios do vírus, possuindo anticorpos contra ele (MCVEY et al., 2017).Isso ocorre normalmente quando diminuem os episódios de viremia crônica, onde a mesma se torna dificilmente detectável e a replicação do VAIE ocorre somente em macrófagos associados aos tecidos, gerando essa ausência de sinais clínicos. (DONG et al., 2012).
FIGURA 2 – CORRELAÇÃO DO CURSO CLÍNICO DA AIE COM A TEMPERATURA CORPORAL (VERMELHO),
CARGA DE RNA VIRAL NO PLASMA DURANTE AS FASES DA DOENÇA
E A CONTAGEM DE PLAQUETAS (AZUL).
4. DIAGNÓSTICO E PROFILAXIA
O controle sobre a AIE é desempenhado através de identificação, segregação e eutanásia dos animais com laudos soropositivos, visto que não é possível o tratamento da doença, o diagnóstico adequado e prevenção são essenciais para o controle de casos (BRASIL, 2013).
De acordo com a legislação da defesa sanitária no Brasil, o teste de imonudifusão em Gel Agar (IDGA) é uma técnica específica que detectam o VAIE (BRASIL, 2018), no entanto de acordo com United States Departament of Agriculture a Imunoabsorção Enzimáticas (ELISA) foi apresentada como uma solução mais sensíveis a AIE, resultando no aumento de diagnósticos em 17%, reduzindo os índices de falso-negativo e sendo capaz de detectar as menores porções de proteína do núcleo viral existentes no soro (SCICLUNA et al., 2013).
O Ministério da Agricultura, Pecuária e Abastecimento através da Secretaria de Defesa Agropecuária declarou por meio da instrução normativa Nº 52, de 26 de novembro de 2018 a eficácia e a autorização do teste ELISA para fins de verificação digno de nota na triagem dos equinos (BRASIL, 2018). Contudo, os animais que apresentarem reação soropositiva terão que se submeter ao teste IDGA, no qual o resultado IDGA prevalece de forma legítima digno de notificação, sendo descartado em caso de negativo no mesmo (CURSINO et al., 2018).
De acordo a Instrução Normativa Nº 45 de 15 de junho de 2004 do Ministério da Agricultura, Pecuária e Abastecimento, é determinada as normas para o diagnóstico, ações de profilaxia e controle, que visam a erradicação do VAIE de regiões focais e a fiscalização de trânsito dos animais em todo território Nacional (BRASIL, 2004 ).
A notificação dos animais infectados é obrigatória ao órgão Federativo de serviço da Sanidade equina do Amazonas, assim como consta na Instrução Normativa Nº 52, de 26 de novembro de 2018 (BRASIL, 2018). As propriedades que forem identificadas animais com AIE devem ser imediatamente interditadas, e realizado o procedimento de abate sanitário nos animais efetivados, bem como a sorologia dos outros animais presentes no local (MALOSSI, 2019).
CONSIDERAÇÕES FINAIS
A AIE é uma enfermidade de grande relevância e impacto para a equideocultura no Amazonas. O seu ambiente propício e a abundância de insetos hematófagos, principalmente os tabanídeos, torna o estado um local perfeito para os vetores e a fácil propagação da doença. Este fato também pode justificar o aumento progressivo de casos ao longo dos anos, divergindo à queda nacional. Assim, torna-se necessário mais estudos na região, apontando os pontos de falha e quem sabe alguma resolução mais efetiva como uma vacina. Ainda, a sua divulgação para a comunidade amazonense com vistas à conscientização da existência da doença e dos seus impactos se faz de suma importância para efetivar ações de controle, prevenção e vigilância epidemiológica, assegurando dessa forma a sanidade dos rebanhos e mais segurança para os produtores.
REFERÊNCIAS BIBLIOGRÁFICAS
ALMEIDA, V. M. A.; GONÇALVES, V. S. P.; MARTINS, M. F.; et al. Anemia infecciosa equina: Prevalência em equídeos de serviço em Minas Gerais. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, v. 58, n. 2, p. 141–148, 2006.
ALMEIDA, V. M. A.; OLIVEIRA, C. H. S.; FIORILLO, K. S.; MARTINS, M. F.; LEITE, R. C.; REIS, J. K. P.; Gonçalves, V.S.P. Prevalência da anemia infecciosa equina em haras de Minas Gerais, Brasil. Semina: Ciência Agrária, v.38, n.3, p.1335-1346, 2017.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento (MAPA). Coordenação de Informação e Epidemiologia. Diário Oficial da União, Brasília, DF, 2022. Disponível em: https://indicadores.agricultura.gov.br/saudeanimal/index.htm. Acesso em 11 de set de 2022.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento (MAPA). Instrução Normativa Nº 45, de 15 de junho de 2004. Aprova as normas para a prevenção e o Controle da Anemia Infecciosa Equina – A.I.E. Diário Oficial da União, Brasília, DF, 2004.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento (MAPA). Instrução Normativa Nº 50, de 23 de setembro de 2013. Alterar a lista de doenças passíveis da aplicação de medidas de defesa sanitária animal. Diário Oficial da União, Brasília, DF, 2013.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento (MAPA). Instrução Normativa Nº 52, de 26 de novembro de 2018. Define os requisitos e critérios para a realização do diagnóstico de Anemia Infecciosa Equina (AIE). Diário Oficial da União, Brasília, DF, 2018.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento (MAPA). Revisão do Estudo do Complexo do Agronegócio do Cavalo. Diário Oficial da União, Brasília, DF, 2016. Disponível em: < https://www.gov.br/agricultura/pt-br/assuntos/camaras-setoriais-tematicas/documentos/camaras-setoriais/equideocultura/anos-anteriores/revisao-do-estudo-do-complexo-do-agronegocio-do-cavalo/view> Acesso em 11 de set de 2022.
BOWMAN, D. D., LYNN, R. C.; EBERHARD, M. L.; ALCARAZ, A. Artrópodes. In: BOWMAN, D. D., LYNN, R. C.; EBERHARD, M. L.; ALCARAZ, A. Parasitologia Veterinária de Georgis. Trad.: FIGUEIREDO, C.; FIGUEIREDO, T. H. B. 8ª ed. Barueri, SP, p. 1-81, 2006.
BOLFA, P.; NOLF, M.; CADORÉ, J.L.; et al. Interstitial lung disease associated with Equine Infectious Anemia Virus infection in horses. Veterinary Research, v. 44, n. 1, 2013.
CEZAR, K. F. S.; HENRIQUES, A. L. Distribuição de tabanidae (insecta: diptera) na região amazônica. XX Jornada de Iniciação Cientifica PIBIC INPA–CNPq/FAPEAM, 2011. Disponível em: https://repositorio.inpa.gov.br/bitstream/1/3208/1/pibic_inpa.pdf . Acesso em: 12 set 2022.
COOK, R. F.; COOK, S. J.; BERGER, S. L.; et al. Enhancement of equine infectious anemia virus virulence by identification and removal of suboptimal nucleotides. Virology, v.313, n.2, p.588–603, 2003.
COOK, R. F.; LEROUX, C.; ISSEL, C. J. Equine infectious anemia and equine infectious anemia virus in 2013: A review. Veterinary Microbiology, v.167, n.1–2, p.181–204, 2013.
COSTA, A. M. P. S. Análise temporal da ocorrência da anemia infecciosa equina no Brasil no período de 2005 a 2016. Dissertação (Mestrado). Universidade Estadual Paulista – UNESP – Câmpus de Jaboticabal. 40 p., 2018. Disponível em: <http://hdl.handle.net/11449/180494>. Acesso em: 12 set 2022.
CRAIGO, J. K.; MONTELARO, R. C. EquineInfectious Anemia Virus. In: MAHY, B. J. W.; VAN REGENMORTEL, M. H. V. Encyclopedia of Virology. Academic Press; 3 ed., p. 167-174, 2008.
CULLINANE, A.; QUINLIVAN, M.; NELLY, M.; et al. Diagnosis of equine infectious anaemia during the 2006 outbreak in Ireland. Veterinary Record, v.161, n.19, p.647–652, 2007.
CURSINO, A. E.; VILELA, A. P. P.; FRANCO-LUIZ, A. P. M.; et al. Equine infectious anemia virus in naturally infected horses from the Brazilian Pantanal. Archives of Virology, v.163, n.9, p. 2385–2394 2018.
DESQUESNES, M.; BITEAU-COROLLER, F.; BOUYER, J.; DIA, M. L.; FOIL, L. Development of a mathematical model for mechanical transmission of trypanosomes and other pathogens of cattle transmitted by tabanids. Int. J. Parasitol., v. 39, p. 333–346, 2009. Disponível em: https://pubmed.ncbi.nlm.nih.gov/18755195/ . Acesso em: 12 set 2022.
DESROSIERS, R. C. Nonhuman lentiviruses. In.: Knipe, D.M.; Howley, P.M. (Eds.), Fields Virology, vol. 2. Lippincott Williams & WilKins, Philadelphia, p. 2215, 2007.
DONG, J. B.; ZHU, W.; COOK, F. R.; et al. Development of a nested PCR assay to detect equine infectious anemia proviral DNA from peripheral blood of naturally infected horses. Archives of Virology, v.157, n.11, p.2105–2111, 2012.
FERREIRA, R. L. M.; RAFAEL, J. A. Criação de imaturos de mutuca (Tabanidae: Diptera) utilizando briófitas e areia como substrato. Neotropical Entomology [online]. v. 35, n. 1, p. 141-144, 2006. Disponível em: <https://doi.org/10.1590/S1519-566X2006000100020>. Acesso em: 13 Set 2022.
FRANCO, M. M. J.; PAES, A.C. Anemia infecciosa equina. Veterinária e Zootecnia, v.197, p.207, 2011.
FOIL, L. D. Tabanids as vectors of disease agents. Parasitology Today, v. 5, n. 3, p. 88-86, 1989a. Disponível em: https://doi.org/10.1016/0169-4758(89)90009-4. Acesso em: 12 set 2022.
FOIL, L. Tabanids as vectors of disease agents. Parasitology today, v. 5, n. 3, p. 225 –275, 1989b. Disponível em: https://doi.org/10.1016/0169-4758(89)90009-4. Acesso em: 12 set 2022.
IBGE – Instituto Brasileiro de Geografia e Estatística. Rebanho de equinos (cavalos). 2020. Disponível em: https://www.ibge.gov.br/explica/producao-agropecuaria/equinos/am. Acesso em 11 de set de 2022.
ISSEL, C. J.; COGGINS, L. Equine infectious anemia: current knowledge. Journal of the American Veterinary Medical Association, v.174, n.7, p.727-733, 1979.
ISSEL, C. J.; COOK, R. F.; MEALEY, R. H.; et al. Equine infectious anemia in 2014: Live with it or eradicate it? Veterinary Clinics of North America – Equine Practice, v.30, n.3, p.561–577, 2014.
ISSEL, C. J., FOIL, L. D. Equine infectious anaemia and mechanical transmission: man and the wee beasties. Scientific and Technical Review of the Office International des Epizooties, v. 34, n. 2, p. 513-523, 2015.
KURITZKES, D. R. Quantification of human immunodeficiency virus type 1 by reverse transcriptasecoupled polymerase chain reaction. The Journal of infectious diseases, v.190, n.11, p.2047–54, 2004.
LEROUX, C.; CADORE, J. L.; MONTELARO, R. C. Equine Infectious Anemia Virus (EIAV): what has HIV’s country cousin got to tell us? Veterinary Research, v.35, n.4, p.485-512, 2004.
LEROUX, C.; COOK, R. F. Equine Infectious Anemia Virus. In: LIU, D. (Organizador)Molecular detection of Animal Viral Pathogens.1 st ed.Norway, CRC Press, p. 177-189, 2016.
LEROUX, C.; MONTELARO, R. C.; SUBLIMEC, E.; CADORÉ, J.-L. EIAV (equine infectious anemia virus): mieux comprendre la pathogenèse des infections lentivirales. Virologie, v. 9, n. 4, 2005.
LIMA, R. A. S.; CINTRA, A. G. Revisão do Estudo do Complexo do Agronegócio do Cavalo. Ministério da Agricultura, Pecuária e Abastecimento, Brasília, v. 56, 2015.
LIMA, R. A. S.; SHIROTA, R.; BARROS, G. S. C. Estudo do complexo do agronegócio cavalo CEPEA/ESALQ/USP, Piracicaba: 2006. Disponível em:< https://www.cepea.esalq.usp.br/br/documentos/texto/estudo-do-complexo-do-agronegocio-do-cavalo-a-relatorio-completo.aspx. > Acesso em 11 de set de 2022.
LIU, Q.; MA, J.; WANG, X. F.; et al. Infection with equine infectious anemia virus vaccine strain EIAVDLV121causes no visible histopathological lesions in target organs in association with restricted viral replication and unique cytokine response. Veterinary Immunology and Immunopathology, v.170, p.30–40, 2016.
LUZ-ALVES, W. C.; GORAYEB, I. S.; SILVA, J. C. L.; LOUREIRO, E. C. B. Bactérias transportadas em mutucas (Diptera: Tabanidae) no nordeste do estado do Pará, Brasil. Bol. Mus. Para. Emilio Goeldi Cienc., 2007. Disponível em: http://scielo.iec.gov.br/scielo.php?script=sci_arttext&pid=S198181142007000300002&lng=pt. Acesso em: 12 set 2022.
MCVEY, S.; KENNEDY, M; CHENGAPPA, M. M.; Retroviridae. In: Microbiologia Veterinária. 3ª ed. – Rio de Janeiro: Guanabara Koogan, 2017.
MEALEY, R. H. Equine Infectious Anemia. In: SELLON, D. C.; LONG, M. T.Equine Infectious Diseases. 2 ed, St. LouisMissouri, Saunders Elsevier, p. 232-238, 2014.
MEALEY, R. Equine infectious anemia. In: Sellon, D. C.; Long, M. T. Equine infectious diseases. Saint Louis: Saunders Elsevier, p.213-219, 2007.
MUSUMECI, D.; RICCARDI, C.; MONTESARCHIO, D. G-Quadruplex forming oligonucleotides as Anti-HIV agents. Molecules, v.20, n.9, p.17511–17532, 2015.
MALOSSI, C. D. Caracterização molecular do Vírus da Anemia Infecciosa Equina do Pantanal e padronização de qPCR para diagnóstico. 30 p. Tese de doutorado. Universidade Estadual Paulista “JÚLIO DE MESQUITA FILHO” Instituto de Biociências de Botucatu, fevereiro de 2019. Disponível em: <http://hdl.handle.net/11449/181800>. Acesso em 11 de set de 2022.
NOGUEIRA, M. F.; OLIVEIRA J. M.; SANTOS, C. J. S.; PETZOLD H. V.; AGUIAR, D. M.; JULIANO, R. S.; REIS, J. K. P.; ABREU, U. G. P.. Equine infectious anaemia in equids of Southern Pantanal, Brazil: seroprevalence and evaluation of the adoption of a control programme. Pesquisa Veterinária Brasileira, v. 37, n. 3, p. 227-233, 2017.
PANISSET, M. L. Anémie Inféctieuse des Équidés. In : PANISSET, M. L.Traité des maladies infectieuses des animaux domestiques. Vigot Frères, éditeurs, Belgique, p. 181- 198, 1938.
POLLARD, V. W.; MALIM, M. H. The HIV-1 Rev Protein: Overview of the Retroviral Life Cycle. Ann, v.52, p.491–532, 1998.
POLTRONIERI, P.; SUN, B.; MALLARDO, M. RNA Viruses: RNA Roles in Pathogenesis, Coreplication and Viral Load. Current genomics, v.16, n.5, p.327-335, 2015.
QUINN, P.J.; MARKEY, B.K; CARTER, M.E.; DONNELLY, W.J.; LEONARD, F.C. Retroviridae. In: QUINN, P.J.; MARKEY, B.K; CARTER, M.E.; DONNELLY, W.J.; LEONARD, F.C. (Ed.). Microbiologia veterinária e doenças infecciosas. Porto Alegre: Artmed, 2005.
RAVAZZOLO, A. P.; COSTA, U. M. Retroviridae. In: FLORES, E. F. (Organizador) Virologia Veterinária: virologia geral e doenças víricas. 3.ed. rev. e ampl. Santa Maria: Ed. da UFSM, 2017. p. 809-837.
SANTOS, J. D.; LOURENÇO, F. J.; CASTRO, B. G. Estudo retrospectivo da anemia infecciosa equina na região médio-norte matogrossense, Brasil, 2006-2011. Revista Brasileira de Medicina Veterinária. v. 38, n. 1, p. 79-85, 2016.
SCICLUNA, M. T.; ISSEL, C. J.; COOK, F. R.; et al. Is a diagnostic system based exclusively on agar gel immunodiffusion adequate for controlling the spread of equine infectious anaemia. Veterinary Microbiology, v.165, n.1–2, p.123–134, 2013.
SELLON, D. C. Equine Infeccious Anemia. Veterinary Clinics of North America: Equine Practice, v. 9, n. 2, p. 321-336, 1993.
SHARAV, T.; KONNAI, S.; OCHIRKHUU, N.; Ts, E. O.; MEKATA, H.; SAKODA, Y. et al. Detection and molecular characterization of equine infectious anemia virus in Mongolian horses. J Vet Med Sci, v. 79, n. 11, p. 1884–1888, 2017.
1 Discente do curso de Medicina Veterinária – Centro Universitário Fametro – CEUNI.
E-mail: kamillatgomes@gmail.com
ORCID: https://orcid.org/0000-0001-9148-1898
2 Discente do curso de Medicina Veterinária – Centro Universitário Fametro – CEUNI.
ORCID: https://orcid.org/0000-0001-6849-7322
3 Docente do curso de Medicina Veterinária – Centro Universitário Fametro – CEUNI.
