REGISTRO DOI: 10.5281/zenodo.6623453
Autores:
Jéssica Fernandes1
Lucas dos Santos2
Nathália Barsotti3
RESUMO
O glioblastoma multiforme (GBM) é o tumor cerebral maligno mais comum, sendo também um dos mais letais. Mesmo com tratamento à base de radioterapia, quimioterapia e intervenção cirúrgica, a sobrevida média de pacientes com GBM é inferior a 2 anos. Diante disso, é necessária a busca de novas alternativas de tratamento que sejam mais eficazes contra essa neoplasia. A imunoterapia já possui destaque no tratamento de diversas classes de tumores, e no contexto do GBM, as vacinas em fase clínica vêm apresentando alguns resultados animadores, representando um avanço no tratamento da doença. Sendo assim, esse projeto científico visa discutir aspectos moleculares e imunológicos do GBM, assim como esquadrinhar as principais vacinas em teste para o tratamento desse câncer (desde vacinas que estão em estudos iniciais até as que estão em fase clínica), trazendo informações que possam incentivar novas pesquisas sobre vacinas. Foi possível constatar que vários estudos enfrentam um grande problema em relação à eficácia das vacinas, a mutação constante do GBM e as novas populações de células que essas mutações ocasionam. Dentro as vacinas discutidas, averiguar que as vacinas peptídicas personalizadas obtiveram uma maior eficácia quando comparado o tempo de sobrevida global das demais vacinas. Esse projeto terá como metodologia de pesquisa a busca de artigos científicos publicados na plataforma de pesquisa PubMed, no período de 2000 até o ano atual.
Palavras-chave: câncer; cérebro; glioblastoma; imunoterapia; vacina.
ABSTRACT
Glioblastoma multiforme (GBM) is the most common malignant brain tumor and one of the most lethal. Even with treatment based on radiotherapy, chemotherapy and surgical intervention, the median survival of patients with GBM is less than 2 years. Therefore, it is necessary to search for new treatment alternatives that are more effective against this neoplasm. Immunotherapy is already prominent in the treatment of several classes of tumors, and in the context of GBM, vaccines in the clinical phase have shown some encouraging results, representing an advance in the treatment of the disease. Therefore, this scientific project aims to discuss the molecular and immunological aspects of GBM, as well as to scrutinize the main vaccines being tested for the treatment of this cancer (from vaccines that are in initial studies to those that are in the clinical phase), bringing information that can encourage new vaccine research. It was possible to verify that several studies face a major problem regarding the effectiveness of vaccines, the constant mutation of GBM and the new cell populations that these mutations cause. Among the vaccines discussed, to verify that the personalized peptide vaccines were more effective when compared to the overall survival time of the other vaccines. This project will have as research methodology the search for scientific articles published on the PubMed search platform, from 2000 to the current year.
Keywords: brain; cancer; glioblastoma; immunotherapy; vaccine.
1. INTRODUÇÃO
O glioblastoma multiforme é considerado um glioma de grau IV segundo a última classificação da OMS realizada em 2016. É um câncer cerebral maligno e o mais comum do sistema nervoso central, com um dos piores prognósticos. A sobrevida média é de apenas 2 anos após o diagnóstico (Zhang e al. 2020). Atualmente, os únicos tratamentos disponíveis para esse câncer são a cirurgia de ressecção total ou parcial quando há indicação, seguida de radioterapia e quimioterapia com Temozolomida (Batash et al. 2017). Recentemente, foi aprovado pelo FDA o uso de mais três medicamentos como medida terapêutica: lomustina, carmustina e bevacizumabe. (Sarkaria et al. 2018)
Além da localização do tumor ser um obstáculo para o seu tratamento, outra dificuldade encontrada se dá devido ao seu ambiente tumoral imunossupressor, que conta com componentes imunes e não imunes que contribuem para um microambiente tumoral favorável ao seu crescimento (Dapash et al. 2021). Devido aos empecilhos encontrados para o tratamento deste câncer, a ciência vem buscando novas técnicas que sejam mais sofisticadas e assertivas para assegurar uma melhor qualidade de vida e de sobrevida aos portadores da doença. Nesse sentido, a imunoterapia tem se destacado como uma forte candidata, visto sua eficiência comprovada contra outros tumores.
As imunoterapias têm sido implementadas como uma alternativa contra tumores sólidos e dentre as modalidades em teste para glioblastoma estão as vacinas peptídicas, dendríticas, além de outras modalidades como as terapias oncolíticas virais, os inibidores de checkpoint e outros (Batash et al. 2017). Visando proporcionar uma discussão sobre os tratamentos mais eficazes contra o glioblastoma que estejam em teste. Nesse trabalho pretendemos compilar informações sobre testes experimentais e clínicos de vacinas contra a patologia, fornecendo uma visão molecular e imunológica sobre o assunto.
2. OBJETIVOS
2.1 Objetivo Geral
Apresentar uma revisão sobre o uso de vacinas no tratamento do glioblastoma multiforme.
2.2 Objetivos Específicos
◉ Abordar os principais mecanismos moleculares envolvidos no surgimento do GBM;
Abordar os aspectos gerais da resposta imunológica do GBM;
◉ Abordar aspectos moleculares e imunológicos das construções vacinais em teste contra o GBM;
◉ Discutir os resultados experimentais e clínicos envolvendo testes de vacinas contra o GBM;
◉ Incentivar pesquisas sobre vacinas no tratamento de GBM.
3. METODOLOGIA
O presente estudo tem por intuito realizar uma revisão bibliográfica descritiva sobre o uso de vacinas no tratamento do Glioblastoma Multiforme, utilizando como base de dados o PubMed com artigos publicados no período de janeiro de 2005 até pesquisas mais recentes.
Para responder às questões levantadas, o método escolhido trará dados que serão obtidos via artigos científicos e terá como finalidade apresentar os diversos tipos de vacinas estudadas até o atual momento como medida terapêutica no tratamento do GBM.
4. NOVAS PERSPECTIVAS NOS TRATAMENTOS IMUNOTERÁPICOS PARA PACIENTES COM GLIOBLASTOMA MULTIFORME
4.1 Câncer
O câncer pode ser brevemente resumido, segundo Courtnay et al. (2015), como “uma doença que envolve o crescimento celular anormal, com potencial de metástase para outras partes do corpo”. Esse crescimento anormal deve-se ao desenvolvimento atípico das células cancerígenas, já que essas possuem uma proliferação exagerada, capaz de realizar divisão celular ilimitada (Xu et al. 2015; Weber 2008).
Em um organismo saudável, os mecanismos homeostáticos são responsáveis por inativar a proliferação e proteger as células saudáveis contra a morte celular. As mutações são consequências de danos no genoma que podem ser resultantes de fatores endógenos, como erros de replicação do DNA ou exógenos, como exposição à radiação ionizante e/ou UV, agentes infecciosos e substâncias químicas. Para uma célula saudável sofrer uma mutação ela precisará se envolver em processos dos quais genes responsáveis no controle da proliferação e morte celular sofram danos mutacionais. Os genes supressores de tumor que inibiram a proliferação são inativados, os oncogêneses irão estimular a proliferação celular e proteger essas células contra o processo de morte celular. Todo esse processo é denominado carcinogênese, mas para ocorrer de fato uma mutação além de conseguir burlar os mecanismos citados acima, é ainda necessário criar um ambiente propício para o desenvolvimento e crescimento das células mutadas e ainda conseguir passar ilesas pelas vias de reparo do DNA (Bertram 2000).
Existem três vias que são as principais responsáveis pelos reparos dos danos causados no DNA, são elas: reparo por excisão de bases, excisão de nucleotídeos, reparo de incompatibilidade, junção de extremidade não homóloga e reparo por recombinação homóloga. Os reparos por excisão de base são responsáveis por remover bases danificadas, na excisão de nucleotídeos teremos a reparação de grandes lesões e por fim o reparo de incompatibilidade que será responsável por uma revisão após a replicação do DNA. Os reparos por junção de extremidade não homóloga e reparo por recombinação homóloga são responsáveis por reparar danos quando há quebras na dupla fita, logo, levam-se anos para que uma mutação consiga desenvolver alterações significativas no DNA e desencadear o desenvolvimento de células malignas (Minten and Yu 2019).
O câncer por si só engloba uma gama de vertentes para a sua compreensão, dentre elas sua biologia celular, tecidual, genética e como se dá sua resposta às terapias. Atualmente ferramentas tecnológicas e computacionais auxiliam na melhor avaliação da doença. O sequenciamento genômico e a classificação das variações mutagênicas do câncer são exemplos de algumas tecnologias atuais que auxiliam na avaliação da doença e até mesmo no prognóstico do paciente (Hanahan 2022).
De acordo com Hanahan (2022), o câncer se desenvolve como produto de um processo de várias etapas e, com o auxílio das HallMarks (conjunto de características marcantes do câncer), tem sido possível destilar melhor os seus mecanismos de desenvolvimento e progressão. Em sua atualização mais recente, Hanahan propôs quatorze características no total como marcas registradas do câncer, são elas: as capacidades adquiridas para sustentar a sinalização proliferativa, evitar supressores de crescimento, resistir à morte celular, permitir a imortalidade replicativa, induzir/acessar a vasculatura, ativar a invasão e metástase, reprogramar o metabolismo celular, evitar a destruição imunológica, desbloqueio da plasticidade fenotípica, reprogramação epigenética não mutacional, microbiomas polimórficos e senescência celular (Hanahan 2022).
4.2 Glioblastoma Multiforme
O cérebro, o maior órgão do sistema nervoso, consegue controlar e processar a maioria das funções humanas, e tumores nesse órgão tendem a ser muito agressivos e deixam muitas sequelas nos pacientes (Lah, Novak and Breznik 2020).
Virchow foi o primeiro a descrever os gliomas em 1865. Sessenta e um anos após a primeira descrição dos gliomas realizada por Virchow, Bailey e Cushing deram a primeira descrição patológica para o tumor mais agressivo do sistema nervoso central (SNC), o Glioblastoma (DeAngelis and Mellinghoff 2011).
O termo glioma inclui todos os tumores originários de células da glia, incluindo graus I: astrocitomas pilocíticos, xantoastrocitomas pleomórficos e astrocitomas subependimários de células gigantes, oligodendrogliomas e astrocitomas; grau II: oligodendrogliomas anaplásicos; grau III: astrocitomas anaplásicos, oligoastrocitomas anaplásicos, ependimomas anaplásicos e glioblastoma multiforme grau IV (GBM) (Soomro et al. 2017).
O glioblastoma multiforme (GBM) é um glioma difuso (Wesseling and Capper 2018), um câncer cerebral primário maligno e o mais comum do SNC. O termo multiforme foi empregado devido às diversas características histológicas que podem coexistir dentro de uma mesma amostra, sendo possível observar células de um tom azul intenso a células gigantes e multinucleadas (Stoyanov et al. 2018) (DeAngelis and Mellinghoff 2011).
O GBM pode ser classificado de acordo com suas bases moleculares e seu estado mutacional (Snuderl 2021). Em 2016, a OMS dividiu o GBM de duas formas: mutação IDH e IDH do tipo selvagem e essa classificação foi uma importante contribuição para a patologia. A Isocitrato Desidrogenase (IDH) é uma enzima subclassificada em IDH 1, IDH 2 e IDH 3 (Yan et al. 2009). A IDH 1 está presente principalmente no meio citoplasmático da célula, enquanto IDH 2 e IDH 3 estão na matriz mitocondrial (Zhang et al. 2020). Os GBM com mutação em IDH do tipo selvagem possuem três subclasses: Mesenquimal, Clássica e Proneural (Wang et al. 2021; Lasorella and Iavarone 2021).
Mutação IDH ou mutações na isocitrato desidrogenase 1 e 2 (IDH 1/2) também fazem parte da genotipagem tumoral padrão. IDH1 e IDH2 ajudam a iniciar a tumorigênese convertendo α-cetoglutarato (α-KG) no oncometabólito 2- hidroxiglutarato (2-HG), mutações nesses genes estão associadas a um bom prognóstico (Desland and Hormigo 2020).
Na subclasse proneural, mutações no IDH1 foram amplamente observadas. A IDH possui um papel essencial no ciclo ácido cítrico, e no GBM foi observada uma mutação pontual no aminoácido 132 (R132H). Além disso, essa subclasse possui amplificação focal no “locus” em 4q13, que abriga o receptor A do fator de crescimento derivado de plaquetas (PDGFRA). Na subclasse clássica foram constantemente observados eventos genéticos nas vias de sinalização do receptor tirosina quinase (RTK) e mutações engajadas pela ativação do fator de crescimento epidérmico (EGFR). Mutações no gene neurofibromatose tipo I (NF1) faz parte da classe mesenquimal e desempenha um importante papel na supressão tumoral, e no contexto do GBM, Wang explica que essa proteína é desativada através da perda de cópias genômicas ou mutações somáticas (Verhaak et al. 2010; Wang et al. 2017; Way et al. 2017; Eskilsson et al. 2018).
Variações na sobrevida dos pacientes com GBM estão relacionadas à idade no momento do diagnóstico, localização do tumor e a possibilidade da ressecção completa através de cirurgia. Um desempenho funcional melhor dos pacientes está relacionado a uma maior sobrevida e é medido pela escala de Karnofsky Performance Status (KPS) (McNair et al. 2021; Wach et al. 2021). Além disso, a taxa de resposta do tumor a quimioterapias e à radioterapia também influencia na sobrevida média dos pacientes. O GBM é um dos tumores com o pior prognóstico e possui maior incidência em pessoas adultas. A sobrevida média é de 15 meses euma sobrevida de 2 anos é esperada em 26,5% dos casos. (Witthayanuwat et al. 2018) (Chen and Hambardzumyan 2018)
Apesar dos avanços e estratégias em técnicas de tratamentos aprimoradas ao decorrer dos anos, no caso do GBM ainda são encontrados grandes obstáculos e limitações em seu tratamento, devido a sua localização e resistência aos tratamentos e ainda há evidências de alterações genéticas e regulação epigenética que incluem alterações na estrutura da cromatina, metilação do DNA, modificação de histonas e de moléculas de RNA (Wu et al. 2021), que geram um grande número de mutações causando resistência às terapias comuns, além de um microambiente tumoral altamente imunossupressor (Batash et al. 2017). Devido ao avanço progressivo da doença, se fazem necessários diagnóstico e tratamentos intensos, o tratamento central inclui o protocolo Stupp, que consiste em realizar o debulking (uma medida cirúrgica que visa remover toda massa tumoral sem grandes déficits neurológicos), seguido de radioterapia e quimioterapia com temozolomida (Batash et al. 2017).
5. TRATAMENTOSCONVENCIONAIS PARA GLIOBLASTOMA
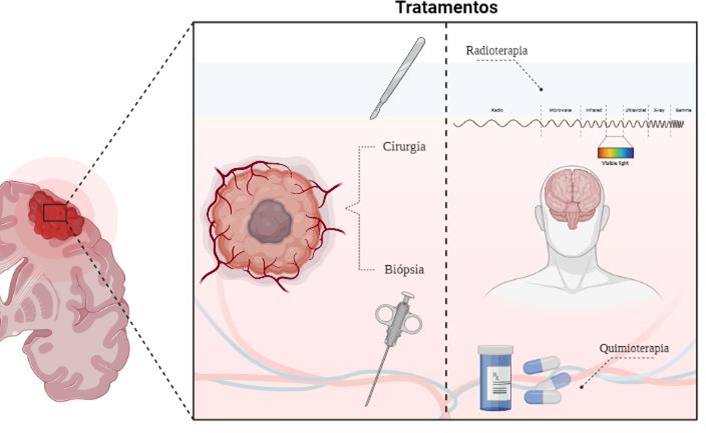
A radioterapia é uma estratégia terapêutica em uso desde 1970 e foi o tratamento único e padrão até 2005. Com os avanços na medicina, a radioterapia passou a ser associada à cirurgia e à quimioterapia. A cirurgia de ressecção do tumor quando o paciente possui indicação visa aumentar sua sobrevida e aliviar os sintomas (Batash et al. 2017). Com os avanços tecnológicos, as técnicas cirúrgicas foram sendo aprimoradas e associadas ao uso de recursos de imagem que orientam na hora do procedimento, principalmente para evitar áreas eloquentes do cérebro. Apesar de todas essas estratégias, o GBM cresce com projeções microscópicas dificultando a remoção tumoral completa (Wu et al. 2021). Logo após a cirurgia, a radioterapia é iniciada com dose típica de 60 Gray (Gy) em frações de 1,8 a 2,0 Gy (Batash et al. 2017). A radiação vem para tratar as áreas onde os resquícios do tumor não foram removidos na cirurgia (Wu et al. 2021). A quimioterapia associada a radioterapia, representada de forma ilustrativa na Figura 1, é um recurso terapêutico, pós cirúrgicos contra o GBM que inclui 6 semanas com Temozolomida (TMZ) (75 mg/m2). Outras terapias aprovadas pela FDA são o tratamento com lomustina, carmustina e bevacizumabe. A lomustina e carmustina são medicamentos alquilantes simples, já o bevacizumabe é um anticorpo monoclonal que se liga ao fator de crescimento endotelial vascular (VEGF), eficaz no controle do edema em alguns pacientes (Sarkaria et al. 2018).
FIGURA 1 – TRATAMENTOS CONVENCIONAIS DO GLIOBLASTOMA MULTIFORME
6. MICROAMBIENTE TUMORAL
O microambiente tumoral é um local onde as células tumorais crescem e se desenvolvem, favorecendo a progressão do tumor. O microambiente do GBM, ilustrado na Figura 2, contém uma série de células não neoplásicas, incluindo células imunes infiltrantes e residentes, células vasculares e outras células gliais (Chen and Hambardzumyan 2018). O cérebro sempre foi reconhecido como um tecido imuno privilegiado. Entretanto, esse conceito foi redefinido classificando-o agora como um órgão imunologicamente distinto (De Leo Ugolini and Veglia 2020).
Um dos componentes do tecido cerebral é a matriz extracelular (MEC) constituída por uma membrana basal e uma matriz intersticial (Da Ros et al. 2018). Em indivíduos saudáveis, é composta por várias proteínas e polissacarídeos que interagem com neurônios, astrócitos e outras células. A MEC é composta por proteoglicanos, glicoproteínas, glicosaminoglicanos, colágeno e outras proteínas da matriz fibrosa (Dapash et al. 2021). Durante a tumorigênese é comum o aumento de colágeno, bem como superexpressão de outros componentes que acabam contribuindo para a desregulação, proliferação, diferenciação, morte e invasão celular. O glioblastoma parece mais rígido em comparação com o tecido não tumoral. Essa rigidez da matriz, em combinação com o aumento da pressão do fluido, compressão celular e aumento da contratilidade promove a rigidez do glioblastoma. Todas essas alterações são um obstáculo significativo para a entrada de macromoléculas no microambiente tumoral, incluindo os agentes quimioterápicos (Da Ros et al. 2018). Além disso, as células estromais mesenquimais (MSCs) desempenham um papel importante na migração tumoral liberando citocinas que contribuem para a degradação da MEC, bem como edema e compressão celular (Dapash et al. 2021).
Outro componente não imune importante do microambiente tumoral (TME) é a barreira hematoencefálica (BHE). A BHE é composta por células endoteliais não fenestradas conectadas por junções apertadas, pericitos e processos astrocíticos; essas células endoteliais atuam para dar suporte e integridade da BHE. A BHE funciona como uma barreira física e química, regulando ativamente o tráfego de moléculas, patógenos e células imunes transmitidas pelo sangue (Desland and Hormigo 2020). A composição da BHE é importante, pois separa o cérebro do sistema circulatório, protegendo de agentes nocivos e regulando o transporte de moléculas essenciais e mantendo o microambiente estável (Da Ros et al. 2018).
No cenário de GBM, a BHE é comprometida não apenas devido à inflamação e distorção física, mas também pelo aumento da vascularização que contribui para o vazamento dos vasos sanguíneos. O crescimento distrófico da vasculatura contribui para a heterogeneidade das paredes permeáveis dos vasos. Este aumento da angiogênese é principalmente devido às altas quantidades de fator de crescimento endotelial vascular (VEGF) no TME (Dapash et al. 2021). Logo, ela fica comprometida e com vazamento, permitindo o influxo de algumas células imunes. As células de glioma conseguem se moldar perfeitamente no ambiente hipóxico do TME, isso ocorre devido aos fatores induzíveis por hipóxia (HIFs), sendo os mais prevalentes os HIF- 1α e o HIF-2α, eles desempenharem um papel no crescimento e sobrevida do tumor regulando a biologia tumoral, o metabolismo glicolítico, homeostase do pH, angiogênese, autofagia mitocondrial e resistência à apoptose. Essa baixa no aporte de oxigênio é causada pelas células tumorais, levando a necrose celular e acidose (Grabowski et al. 2021). Essa deficiência de sangue nas áreas necróticas dos tumores diminui a oferta de oxigênio para o tecido, contribuindo para o estabelecimento de regiões hipóxicas que atraem macrófagos promovendo a imunossupressão (Dapash et al. 2021).
O compartimento glial, além de ser composto por neurônios, também compreende astrócitos, oligodendrócitos e micróglia, que desempenham um papel importante na mielinização dos axônios, realiza a manutenção da BHE e realiza a vigilância imunológica. Durante o crescimento do GBM, os astrócitos saudáveis são deslocados por astrócitos associados ao tumor, que contribuem para o enfraquecimento da BHE. Os astrócitos sofrem astrogliose reativa, essa ação contribui no aumento da infiltração de células tumorais e acaba realizando uma modulação do sistema imunológico dentro do microambiente tumoral (TME), aumentando a sua imunossupressão. A micróglia também é recrutada para o TME por sinais pró- migratórios, sendo secretada por células tumorais. Os macrófagos associados ao tumor se originam de duas fontes: micróglia residente no cérebro ou monócitos derivados da medula óssea, sendo que a micróglia é o único macrófago residente do sistema nervoso central (SNC) (Chen and Hambardzumyan 2018).
Cinquenta por cento da massa tumoral do GBM é composta por células mieloides associadas ao tumor (TAMCs), que compreendem uma população variável de células dendríticas (DCs), neutrófilos, macrófagos derivados de medula óssea (BMDMs), micróglias e células supressoras derivadas de mieloides (MDSCs). Além dessas células citadas, dentro deste compartimento os macrófagos associados ao tumor (TAMs) também são muito numerosos, sendo representados por micróglia e BMDMs (DAPASH et al. 2021). O número de TAMs irá variar conforme o status da mutação IDH, tendo maior incidência em GBM com mutação no IDH do tipo selvagem (Crivii et al. 2022).
Os TAMs são subdivididos em dois grupos: M1-polarizado que é pró- inflamatório e antitumoral e M2-polarizado que é anti-inflamatório e pró tumoral. A maioria dos TAMs recrutados para o TME acabam se tornando M2-polarizados e eles induzem a anergia das células T, secretam componentes da MEC e estimulam a angiogênese (Da Ros et al. 2018). Ademais, dentro do TME os TAMs serão os principais responsáveis por liberar fatores imunossupressores como a interleucina 10 (IL-10) e o fator de crescimento transformador beta (TGF-β) (Dapash et al. 2021).
Podemos também dar um destaque para os neutrófilos associados ao tumor (TANs), eles não costumam ser tão numerosos, mas são associados ao prognóstico dos pacientes de forma bem negativa, pois dentro do TME eles são capazes de secretar elastase, arginase-1, fator estimulador de colônias de granulócitos (G-CSF) e proteína A4 de ligação ao cálcio S100 (S100A4). A elastase por si só contribui para proliferação das células cancerígenas e na angiogênese, já as demais substâncias mesmo sendo secretadas em menor quantidade acabam contribuindo para a imunossupressão (Dapash et al. 2021).
As MDSCs são heterogêneas e expressam arginase, que acaba diminuindo a L-arginina, um aminoácido importante na regulação da função das células T, além de secretar óxido nítrico e produzir espécies reativas de oxigênio auxiliando na supressão das células T. Esses mecanismos acabam auxiliando na imunossupressão dentro do TME inibindo a imunidade antitumoral (Grabowski et al. 2021).
A micróglia é afetada ainda mais dentro do TME quando ocorre a interação com células de glioma, por vesículas extracelulares (EVs). As EVs são responsáveis pelo transporte de diferentes cargas; como: DNA, RNA, proteínas e outros. No caso de algumas malignidades, inclusive o GBM, as EVs realizam um papel de transporte bidirecional das células para GBM pela BHE, o que promove invasividade, progressão tumoral, angiogênese, degradação da MEC e resistência a drogas (Crivii et al. 2022). Quando ocorre a interação da micróglia com as células de glioma é desencadeada uma série de alterações genotípicas e fenotípicas. A micróglia sofre diminuição em sua atividade antitumoral levando a progressão do tumor. Além disso, quando há interação da micróglia com os macrófagos associados ao tumor (TAMs) a imunossupressão aumenta devido à liberação de fatores solúveis, como o fator estimulador de colônia de granulócitos-macrófagos (GM-CSF), C-X3-C Motif Chemokine Ligand 1, (CX3CL1) e SDF1 (DAPASH et al. 2021). Outro fator importante a ser destacado referente às células tumorais é a ligante 2 de quimiocina de motivo C-C (CCL2) sendo peça fundamental no aumento da angiogênese que atrai os macrófagos e micróglia para o TME (Dapash et al. 2021).
Existe uma forte interação das células do GBM com a micróglia que aumenta sua invasividade, ativando as vias de sinalização TGFβ e EGFR. As EVs também serão usadas, onde as células de glioma conseguem inibir a apoptose dos astrócitos, fato que contribui para a agressividade desse tumor. Além disso, EVs incorporando PD-L1 em sua superfície conseguem inibir a ativação de células T, promovendo ainda mais a imunossupressão TME (DAPASH et al. 2021). As células-tronco de glioma (GSCs), servem como um reservatório para auto renovação e diferenciação no tumor. As diferenciações em muitas linhagens celulares únicas contribuem para a heterogeneidade observada no GBM e, consequentemente, também coopera com a diminuição da sensibilidade à quimioterapia (Dapash et al. 2021).
As células dendríticas (DCs) são células apresentadoras de antígenos que agem como uma ponte entre o sistema imunológico inato e o adaptativo, elas são extremamente importantes no monitoramento de patógenos ou nas respostas inflamatórias que podem acontecer no corpo. As DCs vão fazer fagocitose de antígenos tumorais, processar e apresentar às células T, promovendo sua ativação. No caso dos processos inflamatórios como acontece no GBM, elas estarão sujeitas a efeitos imunossupressores no TME, além de conseguir ativar as células T reguladoras (Tregs) e regular negativamente o recrutamento de células T CD8 + (Dapash et al. 2021).
As Tregs também são componentes do TME possuindo um papel vital na resposta imune adaptativa, modulando a homeostase imunológica através de medidas imunossupressoras. No GBM, as Tregs são recrutadas para o TME por citocinas CXCL9/10/11-CXCR3 e CCL5-CCR5 e láse submetem a condições que permitem uma maior viabilidade e expansão, além de secretar citocinas IL-10 e TGF-β promovendo assim uma maior imunossupressão. Elas também se mostram capazes de exercer um efeito imunossupressor em células natural killer (NK), auxiliar na geração de MDSCs e prejudicar a capacidade de apresentação dos antígenos das DCs (Dapash et al. 2021).
O sistema imunológico inato acaba contribuindo para o microambiente, as NK são uma parte importante desse sistema e são críticas para a resposta imune antitumoral. Elas usam granzima B e perforina, e ajudam a controlar o crescimento do tumor através de liberação de citocinas. Mesmo assim, dentro do TME as NK são submetidos a fatores imunossupressores e isso acontece devido ao contato com as células do glioma que expressam moléculas MHC-I que se ligam a receptores na superfície das células NK, suprimindo assim suas funções (Dapash et al. 2021).
FIGURA 2 – MICROAMBIENTE TUMORAL DO GLIOBLASTOMA MULTIFORME

6. IMUNOTERAPIA
Devido ao ambiente imunossupressor do GBM, faz-se necessária a busca por novas alternativas de tratamento que tenham como objetivo aumentar a qualidade e sobrevida média dos pacientes acometidos com a doença. A imunoterapia vem sendo foco de estudo nos últimos anos, definida pelo National Cancer Institute (NCI) como “uma terapia biológica que usa substâncias para estimular ou suprimir o sistema imunológico de modo a ajudar o corpo a combater o câncer, ou outras doenças” (Kong Wang and Ma 2018).
William B. Coley, cirurgião de sarcoma ósseo, foi o primeiro a tentar estimular o sistema imunológico para tratar um tumor. Em 1891, ele injetou organismos estreptocócicos em um paciente com câncer, seu intuito era causar erisipela para analisar se haveria a diminuição do tumor, ele obteve sucesso e durante cerca de quarenta anos apesar das severas críticas ele ainda tratou vários pacientes com sarcoma ósseo usando a imunoterapia (McCarthy 2006).
A imunoterapia é basicamente dividida em ativa e passiva. Enquanto na imunoterapia passiva são usados produtos biológicos e imunomoduladores que estimulam respostas imunes antitumorais preexistentes, na imunoterapia ativa, o objetivo é induzir a ativação do sistema imunológico e geração de novas células antitumorais pela injeção de antígenos tumorais, como é o caso das vacinas antitumorais (Kong et al. 2018).
7. VACINAS
Para o GBM as imunoterapias passivas se mostraram ineficazes, já a imunoterapia ativa trouxe resultados um pouco mais satisfatórios, já que o principal objetivo de uma vacina é fortalecer a resposta do sistema imune cerebral contra as células cancerígenas, podem ser baseadas em ácidos nucleicos, peptídeos ou células (Igarashi and Sasada 2020; Thomas et al. 2013).
As vacinas peptídicas, também conhecidas como vacinas proteicas, vão induzir a resposta imunológica a partir de interação de um epítopo e o reconhecimento desse pelas células T. Os peptídeos que compõem essas vacinas são, em suma, captados pelas células apresentadoras de antígenos (APCs) e expressos na membrana dessas células, com o complexo do sistema antígeno leucocitário humano (HLA), que, serão reconhecidos pelas células T. Para o GBM, algumas vacinas peptídicas incluem a EGFRvIII, IDH R132H, tumor de Wilms 1 (WT1) e survivina. Estudos já constataram que epítopos antigênicos de antígenos associados a tumores (AAT) capazes de ligar em moléculas de HLA foram identificados em células tumorais (Igarashi and Sasada 2020).
O receptor do fator de crescimento epidérmico específico do GBM variante tipo III (EGFRvIII, do inglês, epidermal growth factor receptor variant type III) é um gene mutado e expresso apenas em tumores malignos. O gene EGFR tem uma amplificação em tumores do GBM do tipo IDH selvagem, em cerca de 40% dos casos. Essa amplificação causa um rearranjo genético específico entre íntrons que resultará na mutação desse gene, surgindo assim o EGFRvIII (Winograd, Ciesielski and Fenstermaker 2016) (Cuoco et al. 2018). A mutação desse receptor está presente em mais de 50% dos pacientes diagnosticados com GBM, que consegue causar a proliferação da massa tumoral e a resistência à radioterapia. Devido à alta especificidade do EGFRvIII por conta de um epítopo presente nessa proteína, vacinas voltadas para esse gene são alvo de pesquisa no campo da neuro-oncologia. A vacina ACTIVATE, que tem como alvo o EGFRvIII, mostrou em um estudo de fase I um resultado de uma sobrevida média de 26 meses com os pacientes que participaram do estudo, mas outras fases do estudo mostraram ineficácia nesse tratamento, pois alguns pacientes pararam de expressar o EGFRvIII conforme a evolução do tumor. A vacina ADU-623 é outro estudo de fase I que está em andamento e usa como base os resultados da ACTATIVE, porém esse estudo ainda não teve seus resultados publicados (Cuoco et al. 2018; Medikonda et al. 2021; Winograd et al. 2016).
Assim como a EGFR, a IDH1 sofre mutações devido às condições do GBM, mutação essa que está presente em mais de 70% dos pacientes diagnosticados com GBM. Essa mutação acontece com a substituição do aminoácido arginina pela histidina na posição 132, transformando a IDH1 em Isocitrato Desidrogenase R132H (IDH1-R132H), fazendo dessa enzima um biomarcador único do GBM. A IDH1-R132H colabora com o ambiente imunossupressor do GBM, produzindo oncometabólito D-2- hidroxiglutarato (enzima que irá promover oncogênese e a progressão do tumor), hipermetilação epigenética de genes supressores de tumor e suprimindo a chegada de células T no ambiente tumoral, aumentando assim a progressão da massa tumoral. Pela IDH1-R132H ser uma enzima exclusiva do GBM, estudos de vacinas voltadas para essa enzima são alvos de pesquisa. A ideia é formular uma vacina que estimula uma resposta imune contra a variante IDH1-R132H. Atualmente há dois ensaios com essa vacina, e um deles é o ensaio NCT02193347 referente à vacina RESIST, que usa em seu composto o peptídeo PEPIDH1M, peptídeo que abrange a região do IDH1- R132H; o estudo em questão ainda não foi concluído e não teve seus resultados publicados. O ensaio NCT02454634 referente à vacina NOA-16, foi o primeiro ensaio em humanos com a IDH1-R132H como alvo; esse estudo de fase I contou com a participação de 32 pacientes que faziam o tratamento convencional de GBM, com ou sem a ressecção de tumor, e ele obteve um resultado promissor de uma sobrevida global de 84,4% a mais que a taxa de sobrevida com tratamentos convencionais; entretanto o mesmo estudo diz serem necessárias mais investigações funcionais sobre essa vacina (Cuoco et al. 2018; Platten et al. 2021).
A super expressão gênica da proteína WT1 (do inglês, Wilms Tumor 1) é detectada em várias malignidades, incluindo o GBM, que varia de 63 a 94% dos casos. O WT1, considerado um driver oncogênico, é uma proteína que se liga na fita dupla de DNA, regulando a proliferação oncogênica do GBM e controlando a apoptose da massa tumoral. Atualmente há vários estudos sobre vacina usando como alvo a WT1, como estudos NCT03149003 e NCT02750891, estudos de fase I/II/III que estão em andamento, e estudos de fase I como o NCT01621542 e o NCT02498665 que já foram concluídos (Cuoco et al. 2018; Lim et al. 2018). No NCT 01621542, um estudo de fase 1 usou uma vacina chamada WT 2725, um oligo peptídeo sintético derivado da WT1, e essa vacina foi projetada para estimular o sistema imune do hospedeiro induzindo o aumento do número de linfócitos T citotóxicos (LTC) específicos contra WT1 apresentada no contexto do HLA do tipo A*0201+ e do A*0206+ (moléculas bastante expressas em células malignas do GBM), em tumores que possuíam um aumento significativo da WT1 (Myers et al. 2011; Fu et al. 2021). Para ser injetada nos pacientes, a WT 2725 é emulsionada em uma solução de água em óleo composta pelo peptídeo sintético e uma solução de diluição peptídica. Os resultados da fase 1 desse estudo mostraram que 63,5% dos pacientes que participaram do estudo morreram; foi constatado reação no local da injeção e nenhuma outra reação; a sobrevida livre de progressão (SLP) dos pacientes do estudo foi de em média 59 dias e a sobrevida global (SG) foi de 309 dias; 14% dos pacientes dos estudos sobreviveram por 18 meses após o tratamento e 10% sobreviveram por 2 anos; constatou-se o aumento de 7,5% da taxa de resposta do sistema imune de 40 pacientes avaliados no estudo; 62,3% dos pacientes tiveram um aumento no número de CTLs no tumor. O estudo conclui que a WT 2725 fornece uma atividade antitumoral e que há uma justificativa para o desenvolvimento do estudo no futuro, já que ela tem potencial para ser usada nos tratamentos de pacientes com GBM, até mesmo a administração da vacina de WT1 por RNA ou vírus oncolítico, de modo a obter uma eficácia maior (Fu et al. 2021). Já o estudo de fase I NCT 02498665 usou uma vacina chamada DSP-7888, composta por dois peptídeos sintéticos derivados da WT1, cujo intuito é o mesmo do estudo NCT 01621542, gerar aumento no número de CTLs e de linfócitos T CD4+ auxiliares (LTHs), já que os LTHs são responsáveis por reconhecer antígenos apresentados pelas APCs, secretam citocinas para proliferar e gerar memória aos CTLs (Fu et al. 2021; Spira et al. 2021). Vinte e quatro pacientes participaram do NCT02498665, no qual a DSP-7888 foi administrada de forma intradérmica ou subcutânea nos participantes e não foi observada nenhuma toxicidade ou efeito adverso grave; 83,3% dos pacientes estudados que possuíam tumores sólidos apresentaram uma melhor resposta global, porém nenhum deles apresentou uma resposta completa ou parcial; 14 (58,3%) dos pacientes estudados faleceram no final do estudo; a sobrevida global dos pacientes foi de em média 108 dias; foi avaliado que 21 dos pacientes estudados possuíam CTLs específicos para WT1, e que os pacientes administrados com a injeção via intradérmica possuíam 20% a mais de CTLs que o grupo que teve a injeção administrada de forma subcutânea. Para o futuro desse estudo, pretende-se fazer o uso da vacina somente via intradérmica (Spira et al. 2021).
A survivina é uma proteína intracelular que pertence ao grupo de proteína inibidora de apoptose (IAP), funcionando como uma proteína inibidora da ativação de algumas caspases e, consequentemente, regulando negativamente a cascata apoptótica. Nas células tumorais, a survivina altera todo o ciclo celular, fazendo com que a fase S seja acelerada, tendo uma resistência à parada na fase G1 e tendo uma expressão bastante exacerbada na fase G2, tudo isso colaborando para uma maior proliferação celular. Por esses fatores, a survivina é reconhecida como um marcador específico de câncer, inclusive no GBM, onde é bastante expressa. Há estudos em andamento da vacina peptídica SurVaxM, que estão na fase I e II. A SurVaxM é uma vacina composta por um conjugado peptídico que funcionará como um anti-survivina, capaz de se ligar na HLA e desempenhar uma resposta inibitória contra a ação da survivina nas células tumorais, e ainda, por epítopos de CTLs que estarão presentes nesse conjugado peptídico, vai estimular a presença de células T CD4+ na massa tumoral, que consequentemente vai induzir a resposta de células T CD8+. Em um dos estudos de fase I, a vacina foi testada em 9 pacientes com GBM, dos quais 6 apresentaram uma resposta humoral à vacina, sem efeitos adversos e toxicidades, com uma média de sobrevivência livre de progressão do tumor de 17,6 semanas; 7 destes 9 pacientes tiveram uma sobrevida de mais de um ano fazendo o tratamento com a SurVaxM. Em outro estudo com camundongos com glioma intracraniano com a expressão de survivina foram tratados com SurVaxM, sendo observado a sobrevida de mais de um ano em 25% dos camundongos do estudo, e os sobreviventes de longo prazo foram confirmados como livres do tumor por ressonância magnética. Há outros estudos, ainda não publicados, de tratamento feito com a SurVaxM em combinação com o tratamento convencional do GBM, e outros estudos que avaliam o tratamento de SurVaxM composta com outras vacinas peptídicas, de modo a promover uma resposta antitumoral mais potente. As abordagens futuras em relação à SurVaxM estão voltadas também no uso dessa imunoterapia em pacientes que fizeram a ressecção cirúrgica do tumor, para diminuir os efeitos imunossupressores intrínsecos do próprio tumor (Cuoco et al. 2018; Winograd et al. 2016; Fenstermaker and Ciesielski 2014).
Vários estudos começaram a investigar a eficácia de vacinas multipeptídicas, que são projetadas para conter múltiplos antígenos associados ao glioma, já que como observado na presente revisão, o tumor consegue apresentar um escape imunológico para algumas vacinas peptídicas. Até então não há nenhuma indicação certa no que diz respeito a eficácia dessas vacinas (Cuoco et al. 2018, Lim et al. 2018, Sampson et al. 2020). A IMA950 é uma vacina composta por 11 peptídeos de antígenos associados a tumor identificados em receptores de superfície de HLA em tecido de GBM. Os pacientes recrutados para participar desse estudo precisavam ter HLA-A2 na sua massa tumoral, ter feito a ressecção do tumor e receber a vacina com o tratamento padrão do GBM. A IMA950 tem como intuito desencadear uma resposta imunológica pela ativação de CTLs e de linfócitos CD4+ específicos para esses antígenos (Rampling et al. 2016). Dos 40 pacientes presentes nesse estudo, 90% deles tiveram uma resposta imunológica com o tratamento de IMA950, sendo que 50% desses tiveram uma resposta imunológica contra dois ou mais peptídeos; a sobrevida livre de progressão foi de 74% em 6 meses e 31% em 9 meses, com uma sobrevida global de 15,3 meses (Rampling et al. 2016, Weller et al. 2017). SL-701 é uma vacina multipeptídica composta por survivina, interleucina 13 alfa-2 e EphA2.90, proteínas expressas em pacientes com GBM. O estudo foi separado em 2 estágios, sendo que no primeiro a vacina foi administrada com os adjuvantes GM-CSF e imiquimod, no intervalo de quinze dias dentro de um período de seis meses; e no segundo a vacina foi administrada com os adjuvantes bev e o imunoestimulador poly-ICLC, também no intervalo de quinze dias dentro de um período de seis meses. Os resultados mostraram que o estágio 2 foi melhor que o estágio 1, já que foi possível observar estabilidade da doença de 19 semanas no estágio 2 comparados com a estabilidade de 15 semanas do estágio 1, além da sobrevida média global de 11,7 meses no estágio 2 comparados com as 11 semanas do estágio 1. Foi possível concluir neste estudo de fase 2 que a SL-701 administrada com bev e poly-ICLC demonstrou uma maior atividade antitumoral para o GBM; mais dados do estudo em questão ainda serão apresentados (Winograd, Ciesielski and Fenstermaker 2016, Cuoco et al. 2018, Peereboom et al. 2018).
Vacinas peptídicas personalizadas são imunoterápicos que consideram a diversidade genética e de biomarcadores tumorais de cada paciente, com o propósito de criar terapias com direcionamentos individuais para uma maior eficácia na luta contra o GBM. A Glioma Actively Personalized Vaccine Consortium (GAPVAC) iniciou um estudo de fase I de uma vacina composta por peptídeos específicos de tumor e peptídeos associados ao tumor (Weller et al. 2017, Cuoco et al. 2018). Nesse estudo os pacientes faziam o uso de duas vacinas, a APVAC1 que consistia em 9 antígenos/peptídeos específicos e pré-fabricados de uma biblioteca do estudo, onde era selecionado o antígeno que tivesse maior compatibilidade com o tumor do paciente (sendo essa responsável por gerar uma resposta imune de células T CD8+), e a APVAC2, que visava novos antígenos com neoepitopos conforme o estado da mutação do paciente, a apresentação de HLA e imunogenicidade (onde essa era responsável por induzir respostas de células T CD4+). Esse estudo contou com um n de 15 pacientes que tiveram uma sobrevida global média de 29 meses (Cuoco et al. 2018, Weller et al. 2017, Wang et al. 2019). A NeoVax, outra vacina personalizada que está sendo estudava e não teve seus resultados finalizados, porém, ela visa aumentar a resposta de células T CD8+ com a indução de neoantígenos previamente selecionados de uma biblioteca de proteínas compatível com os antígenos do paciente, em combinação com a enzima O6-metilguanina-DNA metiltransferase (MGMT), enzima essa que promove o reparo da fita dupla de DNA de células cancerígenas sendo presente ativamente em alguns tumores como o GBM. Esse estudo tem como previsão de conclusão em 2026/2027 (Cuoco et al. 2018, Winograd et al. 2016). Assim como a NeoVax, o estudo NCT02510950 se encontra em andamento e visa a criação de uma vacina personalizada, contendo antígenos sintéticos associados aos antígenos expressos nas células tumorais do paciente, e poli-ICLC, um composto terapêutico que gera respostas antitumorais (Cuoco et al. 2018, Winograd et al. 2016, Sultan, Salazar and Celis 2020).
As vacinas celulares, em especial as de células dendríticas (DCs, do inglês, dendritic cells), são uma abordagem terapêutica que vem sendo estudada desde o final da década de 90, já que as células dendríticas são uma das principais células apresentadoras de antígeno, induzindo a imunidade inata, adquirida, no recrutamento de linfócitos e promovendo a ativação do sistema imunológico. Vacinas de DCs conseguem carregar e entregar uma grande variedade e quantidade de antígenos tumorais, proteínas ou peptídeos derivados de tumor, materiais genéticos e até mesmo vírus (Winograd et al. 2016, Igarashi and Sasada 2020, Datsi and Sorg 2021, Zhao et al. 2022). As DCs fazem a apresentação de antígenos às células T CD8+ e CD4+ via MHC do tipo I e II respectivamente, dando origem a uma cascata imunológica com uma resposta imune mais específica (Cuoco et al. 2018).
A ICT-107N é uma vacina multipeptídica desenvolvida exclusivamente para esse câncer cerebral. Composta por 6 proteínas de antígenos associados a tumor, a ICT-107 é preparada a partir de monócitos autólogos do paciente, obtidos pelo método de leucoferese. Essas células são cultivadas por alguns dias com os seguintes antígenos e peptídeos oriundos do GBM: HLA-A1 e HLA-A2 restritos do GBM, MAGE1, EADPTGHSY, AIM-2, RSDSGQQARY, TRP-2 SVYDFFVWL, gp100 IMDQVPFSV, HER2 VMAGVGSPYV, IL13Ra2 e WLPFGFILI. A vacina era administrada três vezes nos pacientes em um intervalo de duas semanas, onde esses monócitos eram diferenciados em células dendríticas. A fase I deste estudo contou com 20 pacientes e obteve bons resultados, com uma progressão livre de tumor de em média 16,9 meses e uma sobrevida global média de 38,4 meses. A fase II do estudo contou com 124 pacientes, porém a diferença dos resultados não foi significativa. Em 2016 havia interesse de realizar a fase III deste estudo, mas por falta de financiamento o programa foi encerrado (Phuphanich et al. 2013, Cuoco et al. 2018, Lim et al. 2018, Medikonda et al. 2021).
O estudo de fase III da vacina DCVax-L, atualmente é um dos mais avançados e longos estudos se tratando de imunoterapias com DCs, já que ele teve uma abordagem pré-clínica bastante positiva no que diz ao aumento de células T no tecido tumoral quando ela foi administrada em roedores com GBM. Como já discorrido aqui sobre o ambiente imunossupressor tumoral, ele impede a maturação das DCs. Com a DCVax-L, a maturação das DCs ocorre in vitro, injetadas no paciente com lisado tumoral e antígenos específicos de tumor do paciente a partir da amostra de tumor ressecado (Cuoco et al. 2018, Lim et al. 2018, Hdeib and Sloan 2015). A DCVax-L na sua fase III foi estudar um n randomizado de 331 pacientes que já fizeram o tratamento convencional de GBM (incluindo a ressecção do tumor), e o resultado médio de sobrevida global foi de 23,1 (Cuoco et al. 2018, Wang et al. 2019).
O ensaio HGG-2006 foi um estudo de fase II que contou com a participação de
77 pacientes que estavam fazendo tratamento do GBM com quimioterapia e radioterapia. Esse ensaio estudava uma vacina de células dendrítica autólogas, que eram coletadas por leucaférese antes do início da radioterapia, e a vacina era administrada no paciente após a sexta semana de radioterapia, num ciclo semanal de quatro doses; após isso, os pacientes receberam mais 4 doses da vacina. Os resultados desse estudo mostraram que 71% dos pacientes tiveram uma progressão livre de tumor após 6 meses do uso do imunoterápico, e que a sobrevida global média desses pacientes foi de 18,3 meses. (Ardon et al. 2012, Winograd et al. 2016).
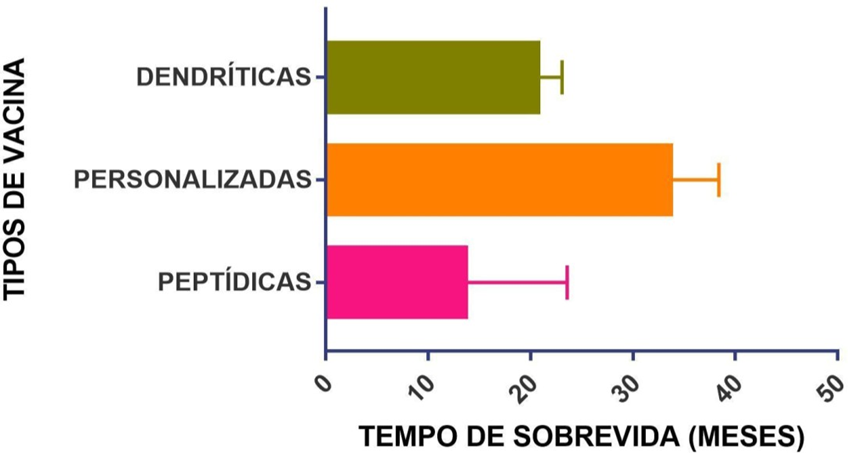
Diante as imunoterapias discorridas até aqui, no Gráfico 1 é possível visualizar as informações referente à sobrevida média global de todas essas vacinas, enquanto no Gráfico 2 mostra uma média da sobrevida média global separada pelos tipos de vacinas que foram discutidas aqui (como as peptídicas, de células dendríticas, entre outras).
GRÁFICO 1 – SOBREVIDA MÉDIA GLOBAL DOS ESTUDOS DAS VACINAS PARA O TRATAMENTO DO GBM
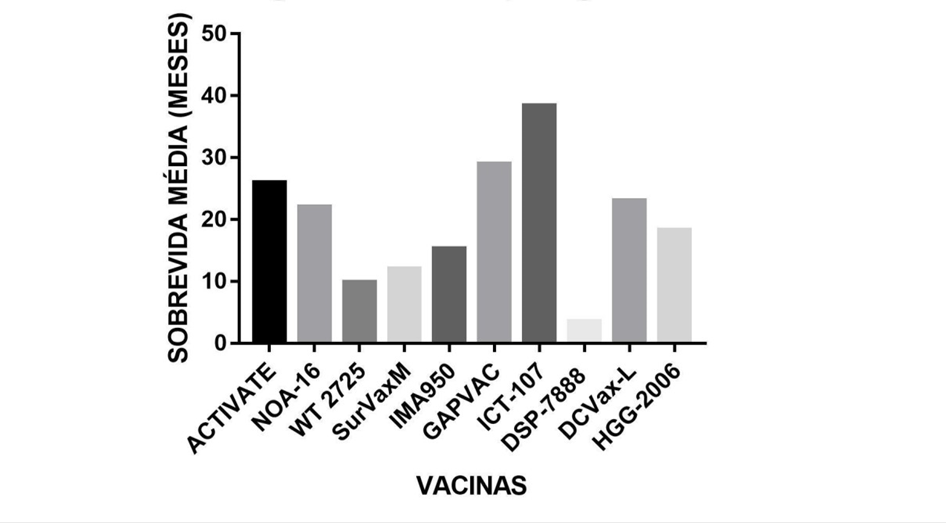
GRÁFICO 2 – SOBREVIDA MÉDIA GLOBAL POR CATEGORIA VACINA
8. CONCLUSÃO
As vacinas para o tratamento do glioblastoma multiforme são uma revolução na oncologia, devido às respostas antitumorais notáveis e duradouras e efeitos adversos minimizados quando comparadas aos tratamentos convencionais dessa malignidade; resultados promissores quanto a eficácia de algumas vacinas pode ser analisada em estudos iniciais de vacinas peptídicas personalizadas e vacinas virais oncolíticas.
Existem obstáculos a serem suplantados no que diz respeito a essa imunoterapia, como as mutações constantes da massa tumoral, a heterogenia do microambiente tumoral e o surgimento de novas populações de células malignas. Esses problemas são as principais razões que explicam a baixa eficácia de algumas vacinas.
Com base no que foi discutido nesse trabalho, uma hipótese para o futuro das vacinas contra o GBM seria a elaboração de vacinas peptídicas personalizadas contendo neoantígenos específicos do tumor do paciente, direcionando-as aos biomarcadores tumorais.
A perspectiva é que no futuro essas vacinas sejam eficazes e seguras ao ponto de serem incluídas no protocolo de tratamento convencional do glioblastoma multiforme, para assim diminuir a incidência de mortes ocasionadas por essa doença.
REFERÊNCIAS BIBLIOGRÁFICAS
- Ardon, H., S. W. Van Gool, T. Verschuere, W. Maes, S. Fieuws, R. Sciot,
- G. Wilms, P. Demaerel, J. Goffin, F. Van Calenbergh, J. Menten, P. Clement, M. Debiec-Rychter & S. De Vleeschouwer (2012) Integration of autologous dendritic cell- based immunotherapy in the standard of care treatment for patients with newly diagnosed glioblastoma: results of the HGG-2006 phase I/II trial. Cancer Immunol Immunother, 61, 2033-44.
- Batash, R., N. Asna, P. Schaffer, N. Francis & M. Schaffer (2017) Glioblastoma Multiforme, Diagnosis and Treatment; Recent Literature Review. Curr Med Chem, 24, 3002-3009.
- Bertram, J. S. (2000) The molecular biology of cancer. Molecular Aspects of Medicine, 21, 167-223.
- Chen, Z. & D. Hambardzumyan (2018) Immune Microenvironment in Glioblastoma Subtypes. Front Immunol, 9, 1004.
- Courtnay, R., D. C. Ngo, N. Malik, K. Ververis, S. M. Tortorella & T. C. Karagiannis (2015) Cancer metabolism and the Warburg effect: the role of HIF-1 and PI3K. Mol Biol Rep, 42, 841-51.
- Crivii, C. B., A. B. Boșca, C. S. Melincovici, A. M. Constantin, M. Mărginean, E. Dronca, R. Suflețel, D. Gonciar, M. Bungărdean & A. Șovrea (2022) Glioblastoma Microenvironment and Cellular Interactions. Cancers (Basel), 14.
- Cuoco, J. A., M. J. Benko, C. M. Busch, C. M. Rogers, J. T. Prickett & E.
- Marvin (2018) Vaccine-Based Immunotherapeutics for the Treatment of Glioblastoma: Advances, Challenges, and Future Perspectives. World Neurosurg, 120, 302-315.
- Da Ros, M., V. De Gregorio, A. L. Iorio, L. Giunti, M. Guidi, M. de Martino,
- L. Genitori & I. Sardi (2018) Glioblastoma Chemoresistance: The Double Play by Microenvironment and Blood-Brain Barrier. Int J Mol Sci, 19.
- Dapash, M., D. Hou, B. Castro, C. Lee-Chang & M. S. Lesniak (2021) The Interplay between Glioblastoma and Its Microenvironment. Cells, 10.
- Datsi, A. & R. V. Sorg (2021) Dendritic Cell Vaccination of Glioblastoma: Road to Success or Dead End. Front Immunol, 12, 770390.
- De Leo, A., A. Ugolini & F. Veglia (2020) Myeloid Cells in Glioblastoma Microenvironment. Cells, 10.
- DeAngelis, L. M. & I. K. Mellinghoff. 2011. Virchow 2011 or how to ID(H) human glioblastoma. In J Clin Oncol, 4473-4. United States.
- Desland, F. A. & A. Hormigo (2020) The CNS and the Brain Tumor Microenvironment: Implications for Glioblastoma Immunotherapy. Int J Mol Sci, 21.
- Eskilsson, E., G. V. Røsland, G. Solecki, Q. Wang, P. N. Harter, G. Graziani, R. G. W. Verhaak, F. Winkler, R. Bjerkvig & H. Miletic (2018) EGFR heterogeneity and implications for therapeutic intervention in glioblastoma. Neuro Oncol, 20, 743-752.
- Fenstermaker, R. A. & M. J. Ciesielski (2014) Challenges in the development of a survivin vaccine (SurVaxM) for malignant glioma. Expert Rev Vaccines, 13, 377-85.
- Fu, S., D. E. Piccioni, H. Liu, R. V. Lukas, S. Kesari, D. Aregawi, D. S. Hong, K. Yamaguchi, K. Whicher, Y. Zhang, Y. L. Chen, N. Poola, J. Eddy & D. Blum (2021) A phase I study of the WT2725 dosing emulsion in patients with advanced malignancies. Sci Rep, 11, 22355.
- Grabowski, M. M., E. W. Sankey, K. J. Ryan, P. Chongsathidkiet, S. J. Lorrey, D. S. Wilkinson & P. E. Fecci (2021) Immune suppression in gliomas. J Neurooncol, 151, 3-12.
- Hanahan, D. (2022) Hallmarks of Cancer: New Dimensions. Cancer Discov, 12, 31-46.
- Hdeib, A. & A. E. Sloan (2015) Dendritic cell immunotherapy for solid tumors: evaluation of the DCVax® platform in the treatment of glioblastoma multiforme. CNS Oncol, 4, 63-9.
- Igarashi, Y. & T. Sasada (2020) Cancer Vaccines: Toward the Next Breakthrough in Cancer Immunotherapy. J Immunol Res, 2020, 5825401.
- Kong, Z., Y. Wang & W. Ma (2018) Vaccination in the immunotherapy of glioblastoma. Hum Vaccin Immunother, 14, 255-268.
- Lah, T. T., M. Novak & B. Breznik (2020) Brain malignancies: Glioblastoma and brain metastases. Semin Cancer Biol, 60, 262-273.
- Lasorella, A. & A. Iavarone (2021) The making of the glioblastoma classification. Br J Cancer, 125, 4-6.
- Lim, M., Y. Xia, C. Bettegowda & M. Weller (2018) Current state of immunotherapy for glioblastoma. Nat Rev Clin Oncol, 15, 422-442.
- McCarthy, E. F. (2006) The toxins of William B. Coley and the treatment of bone and soft-tissue sarcomas. Iowa Orthop J, 26, 154-8.
- McNair, K. M., D. Zeitlin, A. M. Slivka, A. H. Lequerica & M. D. Stubblefield (2021) Translation of Karnofsky Performance Status (KPS) for use in inpatient cancer rehabilitation. Pm r.
- Medikonda, R., G. Dunn, M. Rahman, P. Fecci & M. Lim (2021) A review of glioblastoma immunotherapy. J Neurooncol, 151, 41-53.
- Minten, E. V. & D. S. Yu (2019) DNA Repair: Translation to the Clinic. Clin Oncol (R Coll Radiol), 31, 303-310.
- Myers, C. E., P. Hanavan, K. Antwi, D. Mahadevan, A. J. Nadeem, L. Cooke, A. C. Scheck, Z. Laughrey & D. F. Lake (2011) CTL recognition of a novel HLA- A*0201-binding peptide derived from glioblastoma multiforme tumor cells. Cancer Immunol Immunother, 60, 1319-32.
- Peereboom, D. M., L. B. Nabors, P. Kumthekar, M. A. Badruddoja, K. L. Fink, F. S. Lieberman, S. Phuphanich, E. M. Dunbar, T. Walbert, D. Schiff, D. D. Tran, L. S. Ashby, N. A. Butowski, F. M. Iwamoto, R. Lindsay, J. Bullington, M. Schulder, J. Sherman, T. Goswami & D. A. Reardon (2018) Phase 2 trial of SL-701 in relapsed/refractory (r/r) glioblastoma (GBM): Correlation of immune response with longer-term survival. Journal of Clinical Oncology, 36, 2058-2058.
- Phuphanich, S., C. J. Wheeler, J. D. Rudnick, M. Mazer, H. Wang, M. A. Nuño, J. E. Richardson, X. Fan, J. Ji, R. M. Chu, J. G. Bender, E. S. Hawkins, C. G. Patil, K. L. Black & J. S. Yu (2013) Phase I trial of a multi-epitope-pulsed dendritic cell vaccine for patients with newly diagnosed glioblastoma. Cancer Immunol Immunother, 62, 125-35.
- Platten, M., L. Bunse, A. Wick, T. Bunse, L. Le Cornet, I. Harting, F. Sahm, K. Sanghvi, C. L. Tan, I. Poschke, E. Green, S. Justesen, G. A. Behrens, M. O. Breckwoldt, A. Freitag, L. M. Rother, A. Schmitt, O. Schnell, J. Hense, M. Misch, D. Krex, S. Stevanovic, G. Tabatabai, J. P. Steinbach, M. Bendszus, A. Von Deimling, M. Schmitt & W. Wick (2021) A vaccine targeting mutant IDH1 in newly diagnosed glioma. Nature, 592, 463-468.
- Rampling, R., S. Peoples, P. J. Mulholland, A. James, O. Al-Salihi, C. J. Twelves, C. McBain, S. Jefferies, A. Jackson, W. Stewart, J. Lindner, S. Kutscher, N. Hilf, L. McGuigan, J. Peters, K. Hill, O. Schoor, H. Singh-Jasuja, S. E. Halford & J. W. Ritchie (2016) A Cancer Research UK First Time in Human Phase I Trial of IMA950 (Novel Multipeptide Therapeutic Vaccine) in Patients with Newly Diagnosed Glioblastoma. Clin Cancer Res, 22, 4776-4785.
- Sampson, J. H., M. D. Gunn, P. E. Fecci & D. M. Ashley (2020) Brain immunology and immunotherapy in brain tumours. Nat Rev Cancer, 20, 12-25.
- Sarkaria, J. N., L. S. Hu, I. F. Parney, D. H. Pafundi, D. H. Brinkmann, N. N. Laack, C. Giannini, T. C. Burns, S. H. Kizilbash, J. K. Laramy, K. R. Swanson, T. J. Kaufmann, P. D. Brown, N. Y. R. Agar, E. Galanis, J. C. Buckner & W. F. Elmquist (2018) Is the blood-brain barrier really disrupted in all glioblastomas? A critical assessment of existing clinical data. Neuro Oncol, 20, 184-191.
- Snuderl, M. 2021. Molecular classification and deconvolution of the immune microenvironment in glioblastoma. In Neuro Oncol, 175-176.
- Soomro, S. H., L. R. Ting, Y. Y. Qing & M. Ren (2017) Molecular biology of glioblastoma: Classification and mutational locations. J Pak Med Assoc, 67, 1410- 1414.
- Spira, A., A. R. Hansen, W. A. Harb, K. K. Curtis, E. Koga-Yamakawa, M. Origuchi, Z. Li, B. Ertik & W. L. Shaib (2021) Multicenter, Open-Label, Phase I Study of DSP-7888 Dosing Emulsion in Patients with Advanced Malignancies. Target Oncol, 16, 461-469.
- Stoyanov, G. S., D. Dzhenkov, P. Ghenev, B. Iliev, Y. Enchev & A. B. Tonchev (2018) Cell biology of glioblastoma multiforme: from basic science to diagnosis and treatment. Med Oncol, 35, 27.
- Sultan, H., A. M. Salazar & E. Celis (2020) Poly-ICLC, a multi-functional immune modulator for treating cancer. Semin Immunol, 49, 101414.
- Thomas, A. A., J. L. Fisher, M. S. Ernstoff & C. E. Fadul (2013) Vaccine- based immunotherapy for glioblastoma. CNS Oncol, 2, 331-49.
- Verhaak, R. G., K. A. Hoadley, E. Purdom, V. Wang, Y. Qi, M. D. Wilkerson, C. R. Miller, L. Ding, T. Golub, J. P. Mesirov, G. Alexe, M. Lawrence, M. O’Kelly, P. Tamayo, B. A. Weir, S. Gabriel, W. Winckler, S. Gupta, L. Jakkula, H. S. Feiler, J. G. Hodgson, C. D. James, J. N. Sarkaria, C. Brennan, A. Kahn, P. T. Spellman, R. K. Wilson, T. P. Speed, J. W. Gray, M. Meyerson, G. Getz, C. M. Perou & D. N. Hayes (2010) Integrated genomic analysis identifies clinically relevant subtypes of glioblastoma characterized by abnormalities in PDGFRA, IDH1, EGFR, and NF1. Cancer Cell, 17, 98-110.
- Wach, J., M. Hamed, P. Schuss, E. Güresir, U. Herrlinger, H. Vatter & M. Schneider (2021) Impact of initial midline shift in glioblastoma on survival. Neurosurg Rev, 44, 1401-1409.
- Wang, L. B., A. Karpova, M. A. Gritsenko, J. E. Kyle, S. Cao, Y. Li, D. Rykunov, A. Colaprico, J. H. Rothstein, R. Hong, V. Stathias, M. Cornwell, F. Petralia, Y. Wu, B. Reva, K. Krug, P. Pugliese, E. Kawaler, L. K. Olsen, W. W. Liang, X. Song, Y. Dou, M. C. Wendl, W. Caravan, W. Liu, D. Cui Zhou, J. Ji, C. F. Tsai, V. A. Petyuk, J. Moon, W. Ma, R. K. Chu, K. K. Weitz, R. J. Moore, M. E. Monroe, R. Zhao, X. Yang, S. Yoo, A. Krek, A. Demopoulos, H. Zhu, M. A. Wyczalkowski, J. F. McMichael, B. L. Henderson, C. M. Lindgren, H. Boekweg, S. Lu, J. Baral, L. Yao, K. G. Stratton, L. M. Bramer, E. Zink, S. P. Couvillion, K. J. Bloodsworth, S. Satpathy, W. Sieh, S. M. Boca, S. Schürer, F. Chen, M. Wiznerowicz, K. A. Ketchum, E. S. Boja, C. R. Kinsinger, A. I. Robles, T. Hiltke, M. Thiagarajan, A. I. Nesvizhskii, B. Zhang, D. R. Mani, M. Ceccarelli, X. S. Chen, S. L. Cottingham, Q. K. Li, A. H. Kim, D. Fenyö, K. V. Ruggles, H. Rodriguez, M. Mesri, S. H. Payne, A. C. Resnick, P. Wang, R. D. Smith, A. Iavarone, M. G. Chheda, J. S. Barnholtz-Sloan, K. D. Rodland, T. Liu & L. Ding (2021) Proteogenomic and metabolomic characterization of human glioblastoma. Cancer Cell, 39, 509-528.e20.
- Wang, Q., B. Hu, X. Hu, H. Kim, M. Squatrito, L. Scarpace, A. C. deCarvalho, S. Lyu, P. Li, Y. Li, F. Barthel, H. J. Cho, Y. H. Lin, N. Satani, E. Martinez- Ledesma, S. Zheng, E. Chang, C. G. Sauvé, A. Olar, Z. D. Lan, G. Finocchiaro, J. J. Phillips, M. S. Berger, K. R. Gabrusiewicz, G. Wang, E. Eskilsson, J. Hu, T. Mikkelsen, R. A. DePinho, F. Muller, A. B. Heimberger, E. P. Sulman, D. H. Nam & R. G. W. Verhaak (2017) Tumor Evolution of Glioma-Intrinsic Gene Expression Subtypes Associates with Immunological Changes in the Microenvironment. Cancer Cell, 32, 42- 56.e6.
- Way, G. P., R. J. Allaway, S. J. Bouley, C. E. Fadul, Y. Sanchez & C. S. Greene (2017) A machine learning classifier trained on cancer transcriptomes detects NF1 inactivation signal in glioblastoma. BMC Genomics, 18, 127.
- Weber, G. F. (2008) Molecular mechanisms of metastasis. Cancer Letters, 270, 181-190.
- Weller, M., P. Roth, M. Preusser, W. Wick, D. A. Reardon, M. Platten & J. H. Sampson (2017) Vaccine-based immunotherapeutic approaches to gliomas and beyond. Nat Rev Neurol, 13, 363-374.
- Wesseling, P. & D. Capper (2018) WHO 2016 Classification of gliomas. Neuropathol Appl Neurobiol, 44, 139-150.
- Winograd, E. K., M. J. Ciesielski & R. A. Fenstermaker (2016) Novel vaccines for glioblastoma: clinical update and perspective. Immunotherapy, 8, 1293- 1308.
- Witthayanuwat, S., M. Pesee, C. Supaadirek, N. Supakalin, K. Thamronganantasakul & S. Krusun (2018) Survival Analysis of Glioblastoma Multiforme. Asian Pac J Cancer Prev, 19, 2613-2617.
- Wu, W., J. L. Klockow, M. Zhang, F. Lafortune, E. Chang, L. Jin, Y. Wu & H. E. Daldrup-Link (2021) Glioblastoma multiforme (GBM): An overview of current therapies and mechanisms of resistance. Pharmacol Res, 171, 105780.
- Xu, X. D., S. X. Shao, H. P. Jiang, Y. W. Cao, Y. H. Wang, X. C. Yang, Y. L. Wang, X. S. Wang & H. T. Niu (2015) Warburg effect or reverse Warburg effect? A review of cancer metabolism. Oncol Res Treat, 38, 117-22.
- Yan, H., D. W. Parsons, G. Jin, R. McLendon, B. A. Rasheed, W. Yuan, Kos, I. Batinic-Haberle, S. Jones, G. J. Riggins, H. Friedman, A. Friedman, D. Reardon, J. Herndon, K. W. Kinzler, V. E. Velculescu, B. Vogelstein & D. D. Bigner (2009) IDH1 and IDH2 mutations in gliomas. N Engl J Med, 360, 765-73.
- Zhang, P., Q. Xia, L. Liu, S. Li & L. Dong (2020) Current Opinion on Molecular Characterization for GBM Classification in Guiding Clinical Diagnosis, Prognosis, and Therapy. Front Mol Biosci, 7, 562798.
- Zhao, T., C. Li, H. Ge, Y. Lin & D. Kang (2022) Glioblastoma vaccine tumor therapy research progress. Chin Neurosurg J, 8, 2.
1Discente da Universidade Anhembi Morumbi, São Paulo/SP, Brasil.
2Discente da Universidade Anhembi Morumbi, São Paulo/SP, Brasil.
3Docente da Universidade Anhembi Morumbi, São Paulo/SP, Brasil.
