REGISTRO DOI: 10.5281/zenodo.6622151
Autores:
Sofia Lacerda Campos1
Roberta Redede Pereira Xavier2
Leandro Spinelli3
RESUMO
A Síndrome da Imunodeficiência Humana Adquirida é uma doença que se caracteriza pela atenuação do sistema imunológico, deixando o organismo vulnerável e suscetível a outras infecções. Atualmente cerca de 37,6 milhões de pessoas vivem com o vírus do HIV, agente infeccioso da AIDS. Estudos já concluídos demonstram que o mecanismo de infecção do HIV consiste principalmente na interação da proteína de superfície viral (gp120) com receptor CD4 e os co-receptores CXCR4 e CCR5 presentes nas células de defesa, como por exemplo células dendríticas, linfócitos TCD4+ e macrófagos. A partir de uma mutação genética (CCR5 Δ32/Δ32), o co- receptor CCR5 deixa de ser expresso impedindo que o HIV-1 entre nessas células, se a cepa viral for R5-trópca, e consequentemente acaba se evitando a infecção. Recentes relatos de casos envolvendo o transplante de células-tronco hematopoiéticas (TCTH), contendo essa mutação, para pacientes com neoplasias do sistema-linfático e/ou hematopoiético e com HIV, comprovam que pode haver uma redução total da carga viral. O TCTH para pacientes com HIV-1, portanto, vem sendo discutido como base para novas técnicas, principalmente relacionadas a modificações genéticas, que poderiam resultar em uma possível cura e uma alternativa à Terapia Antirretroviral. Este artigo em questão, baseado em uma revisão bibliográfica, tem como objetivo, a partir de uma análise dos estudos de caso e da descrição da mutação do CCR5, demonstrar e explicar outros tipos de abordagens terapêuticas que estão em desenvolvimento e quais são os seus desafios.
Palavras-chave: HIV, CCR5, Mutação, Transplante, Terapia.
ABSTRACT
The Acquired Immunodeficiency Syndrome is a disease that is characterized by the depletion of the immune system, resulting in leaving the body vulnerable and susceptible to other infections. Nowadays, about 37.6 million people live with the infectious agent of AIDS, the HIV virus. Studies already completed conclude that the HIV infection mechanism mainly consists of the interaction of the viral surface protein (gp120) with the CD4 receptor and the CXCR4 and CCR5 co- receptors present in defense cells, such as dendritic cells, CD4+ T lymphocytes and macrophages. From a genetic mutation (CCR5 Δ32/Δ32), the CCR5 co-receptor is no longer expressed, preventing HIV-1 from entering these cells, if the viral strain is R5- tropic, and consequently ends up avoiding infection. Recent case reports involving the transplantation of hematopoietic stem cells (HSCT), containing this mutation, for patients with neoplasms of the lymphatic and/or hematopoietic system and with HIV, prove that there can be a total reduction in viral load. HSCT for HIV-1 patients, therefore, has been discussed as a foundation for new techniques, mainly related to genetic modifications, which could result in a possible cure and an alternative to Antiretroviral Therapy. This article aims, based on a bibliographic reference review, from an analysis of case studies and the description of the CCR5 mutation, to demonstrate and explain other types of therapeutic approaches that are under development and what challenges they are to encounter.
Keywords: HIV, CCR5, Mutation, Transplant, Therapy.
1. INTRODUÇÃO
A Síndrome da Imunodeficiência Humana Adquirida (AIDS) causada pelo Vírus da Imunodeficiência Humana (HIV) caracteriza-se pela presença de uma intensa imunossupressão do organismo acometido com o comprometimento funcional dos sistemas imunes adaptativo e inato, além do aparecimento de infecções oportunistas e tumores malignos (ABBAS; LICHTMAN; PILLAI, 2019). O primeiro relato, do que veio a ser reconhecida posteriormente como AIDS, se deu em 1980 nos Estados Unidos, com a ocorrência de casos de pneumonia causada por Pneumocistis carinii em homens homossexuais jovens e saudáveis, sendo a principal evidência em comum a depleção consistente de linfócitos T. Nesse período também outras infecções e tumores (como o sarcoma de Kaposi) vinham surgindo em outros pacientes e com a mesma característica de imunodeficiência. Devido a esses achados, médicos epidemiologistas propuseram que um novo agente infeccioso pudesse estar circulando entre a população e que sua transmissão ocorreria principalmente através da relação sexual. O agente etiológico da AIDS foi denominado HIV em 1986 (OLIVEIRA; VILLELA; DUTRA, 2017)
De acordo com dados estatísticos obtidos pelo Programa Conjunto das Nações Unidas sobre HIV/AIDS (UNAIDS), foi estimado que, em 2020, cerca de 37,6 milhões de pessoas estavam vivendo com o vírus no mundo. No Brasil, de acordo com o boletim epidemiológico da Secretaria de Vigilância de Saúde, a estimativa no mesmo ano era de 920 mil indivíduos positivados. As principais formas de transmissão são a sexual com a troca de determinados fluidos corporais, a parental pela transfusão de sangue contaminado, a transmissão vertical, através da placenta o aleitamento materno, e ocupacional, em acidentes de trabalho, como no caso de profissionais da área da saúde. (OLIVEIRA; VILLELA; DUTRA, 2017).
Atualmente, a fim de se obter uma redução dos níveis plasmáticos de RNA viral, chegando ao indetectável, e restaurar a contagem de CD4 a parâmetros normais, resultando em uma reconstituição imunológica, a alternativa utilizada é a da terapia antirretroviral (TARV) (CACHAY, 2019). Na década de 80, os primeiros antirretrovirais (ARVs) foram introduzidos no mercado com o objetivo de inibir a proliferação viral do organismo, diminuindo assim a imunossupressão (BRASIL, MINISTÉRIO DA SAÚDE, s.d.). Entretanto, apesar da TARV inibir o ciclo viral, reduzir as taxas de transmissão e melhorar a expectativa de vida, infelizmente não é uma medida curativa, sendo necessário o uso de medicamentos diários por tempo indeterminado, e ainda se interrompida, a consequência seria o retorno da carga viral e a progressão da doença (BITANTE; FILHO, 2017). Além disso, a adesão e a continuidade ao tratamento podem causar alguns efeitos colaterais como náusea e diarreia e/ou distúrbios metabólicos, como a hepatotoxicidade, dislipidemia, reações no sistema nervoso central e entre outros (SILVA, 2013).
Outros métodos e estratégias de novas terapias estão sendo pesquisados com base em estudos de caso. Em um deles há o relato de um paciente denominado “Paciente de Berlim” que, diagnosticado com HIV, teve a remissão total do vírus após receber dois transplantes de células-tronco para tratar uma Leucemia Mieloide Aguda (LMA) (HIGHLEYMAN, 2019). Foi constatado que o doador dessas células era homozigoto para uma mutação rara conhecida como CCR5 delta 32, que resultava na desativação do co-receptor CCR5 e na resistência ao vírus (DIDIGU; DOMS, 2012). A princípio quando foi identificada a LMA, o paciente estava em uso da TARV e com a carga viral indetectável. Todavia, com o início do tratamento da leucemia e com o primeiro transplante, foi interrompida a terapia antirretroviral, porém da mesma forma a carga viral permaneceu indetectável (MAZUR;SCHAUREN, 2020). Outras tentativas de uma descontinuação desta medida terapêutica foram realizadas em pacientes com histórico semelhante, como por exemplo o “Paciente de Londres”, que acometido por um Linfoma de Hodgkin, recebeu o transplante e continuou com a remissão viral mesmo após 18 meses da interrupção da TARV, e o “Paciente de Essen”, com um linfoma não – Hodgkin de células T, que entrou em óbito após 14 dias do início do processo (MAZUR; SCHAUREN, 2020).
Estão em desenvolvimento várias linhas de pesquisa com objetivo de lançar novas perspectivas terapêuticas mais amplas e aplicáveis que possam obter a remissão parcial ou total do HIV (BITANTE; FILHO, 2017). Entre as técnicas em estudo que continuam sobre avaliação de pesquisadores, estão principalmente métodos envolvendo o próprio transplante de células-tronco com a mutação, o silenciamento genômico e edição genética do CCR5, sendo este último, atualmente, o mais reconhecido. O silenciamento do gene pode ocorrer por meio de RNAs de interferência e a edição do genoma pelo sistema CRISPR/Cas9 ou pela técnica ZFN (Zinc-Finger Nucleases), onde o alvo pode ser o próprio CCR5 ou o genoma do HIV (PAIVA, 2017). Fundamentado nisso e com a persistência da infecção durante a TARV, por conta da latência viral no organismo, é demonstrada a importância desses estudos e dos resultados de um transplante de células-tronco hematopoiéticas CCR5 Δ32/Δ32, com a cura esterilizante para o HIV, como base para futuras abordagens em alternativa a terapia antirretroviral.
2. OBJETIVOS
2.1 Objetivo Geral
Abordar, a partir da apresentação dos estudos de casos clínicos sobre a inexpressão do co-receptor CCR5, em células tronco transplantadas em pacientes com HIV e as estratégias terapêuticas que vem sendo estudadas para prevenção desse correceptor.
2.2 Objetivos Específicos
◉ Apresentar a estrutura viral e o mecanismo de infecção do HIV;
◉ Analisar os casos clínicos;
◉ Explicar a mutação do co-receptor CCR5;
◉ Expor novas perspectivas de terapia, principalmente as relacionadas a terapia gênica, e seus desafios.
3. METODOLOGIA
Este projeto será feito a partir de uma revisão bibliográfica e terá como apoio uma metodologia qualitativa, sendo descritiva e explicativa dos casos clínicos e da mutação, além de comparativa em relação as pesquisas em andamento, a fim de demonstrar outras terapias como possíveis alternativas a terapia antirretroviral.
Os artigos e textos dispostos para o projeto foram produzidos entre o período de 2003 até 2022 e retirados de sites de busca de dados acadêmicos como PubMed, EBSCO, SCIELO, Google Acadêmico e governamentais como o Ministério da Saúde. Foram também utilizados sites de organizações como a UNAIDS e o Grupo de Incentivo à Vida, que lutam pelos direitos das pessoas que vivem com HIV/AIDS.
Os descritores de busca foram os seguintes: HIV-1, co-receptor CCR5, mutação, transplante de células-tronco, TARV, terapia gênica, terapia celular, edição genômica e silenciamento CCR5. Os critérios de inclusão foram artigos em português e inglês datados entre o período dito anteriormente e de cunho científico. Já os critérios de exclusão foram artigos que estivessem em desacordo ao tema abordado e aqueles que não estavam presentes nas bases de dados acadêmicas.
4. DESENVOLVIMENTO
4.1 Características Biológicas e Estruturais do HIV
O HIV é um membro da família Retroviridae, subfamília Orthoretrovirinae e do gênero Lentivirus, pois o curso e a evolução da infecção ocorrem de forma progressiva e lenta.Os lentívirus causam nas células infecções de longo prazo e feitos citopáticos de curto prazo, além de desencadearem doenças fatais (ABBAS; LICHTMAN; PILLAI, 2019). De acordo com a classificação filogenética do vírus, foram evidenciados, até o momento, dois tipos virais, o HIV-1 e HIV-2, sendo o HIV-1 o tipo mais virulento, mais dissipado pelo mundo e a causa mais comum de AIDS, enquanto o HIV-2 é considerado o menos patogênico, sendo diferenciado estruturalmente e causando a forma de AIDS de progressão mais lenta do que o HIV-1 (OLIVEIRA; VILLELA; DUTRA, 2017).
A classificação atual ainda segue divisões em grupos, subtipos, sub- subtipos e formas recombinantes, onde o HIV-1 é subdividido em 4 grupos: M, N, O, P, onde o do grupo M é, por sua vez, o mais comum na maioria das infecções. Quando ocorre uma infecção mista com subtipos de linhagens diferentes, pode acontecer uma troca de material genético entre eles, gerando assim formas recombinantes que se tornam circulantes dependendo do número de pessoas que forem infectadas. A variação genética do HIV implica na biologia do vírus, transmissão, reatividade, reação cruzada em testes diagnósticos e até mesmo é uma das principais dificuldades para o tratamento com os antirretrovirais e para o desenvolvimento de vacinas eficazes (WERSOM et al., 2013).
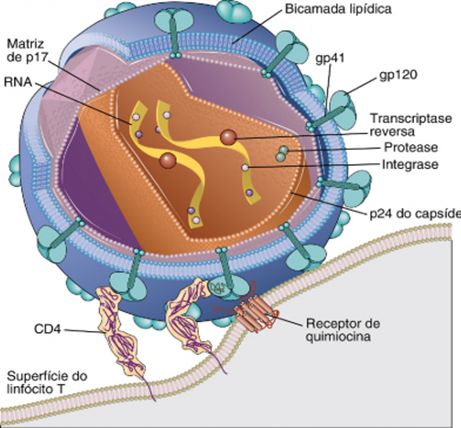
Em relação a sua estrutura, a partícula viral apresenta de 100 a 120 nm de diâmetro e é caracterizada pelo seu envelope glicoproteico (bicamada fosfolipídica resultante da membrana da célula hospedeira infectada após o vírus sair pelo mecanismo de brotamento). Ligadas ao envelope estão as proteínas de membrana codificadas pelo vírus, sendo um trímero das glicoproteínas de superfície (gp120) e transmembrana (gp41). Logo abaixo do envelope, está a matriz do vírus composta por subunidades de uma proteína de matriz (p17) que envolve o capsídeo viral formado pelas proteínas de capsídeo (p24). Dentro do capsídeo se encontra o genoma viral, composto por duas fitas simples de RNA de aproximadamente 9,2 kb de comprimento, as enzimas transcriptase reversa, integrase e protease e algumas proteínas como vif,vpr,nef e p6 (Figura 1) (SILVEIRA, 2007).
FIGURA 1 – ESTRUTURA DO HIV E LIGAÇÃO AO RECEPTOR CD4 E RECEPTOR DE QUIMIOCINA
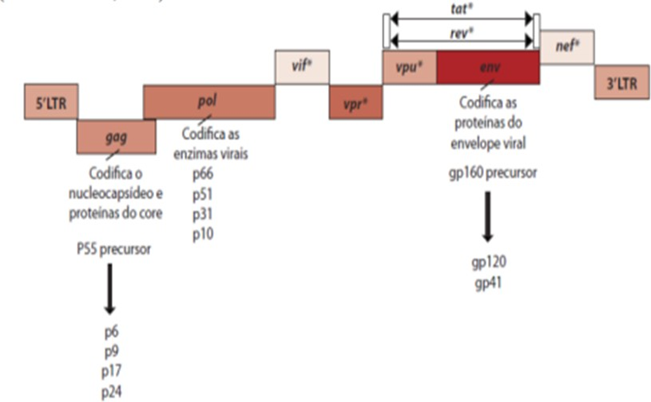
Tanto as proteínas que compõe a estrutura viral, quanto enzimas e proteínas que possuem outras funções, são codificadas por grandes sequências repetitivas de nucleotídeos. As repetições terminais longas (LTRs), regulam a incorporação à célula hospedeira, a expressão de genes e replicação viral. A sequência do gene Env codifica as glicoproteínas gp41 e gp120 (produzidas a partir da clivagem da gp160 precursora), o gene Gag está relacionado com as proteínas da estrutura do capsídeo (sendo formado pela p24, p6 e p9, e a p17 formando a matriz proteica que reveste a superfície da membrana interna viral) e o Pol com as enzimas transcriptase reversa, protease e integrase. Outros genes, como Tat, Rev, Vif, Vpr, Nef e Vpu, são chamados de genes regulatórios da replicação viral, pois são responsáveis, respectivamente, pelo alongamento dos transcritos virais, exportação nuclear de RNAs, superação dos efeitos das enzimas inibidoras das células hospedeiras, aumento a replicação viral, viabilização e facilitação da replicação viral e por último pela regulação negativa dos receptores CD4 das células hospedeiras, fazendo com que aconteça o aumento da liberação do vírus a partir dessas células (Figura 2) (SILVEIRA, 2007).
FIGURA 2 – GENOMA DO HIV E IDENTIFICAÇÃO DAS SEQUÊNCIAS GENÉTICAS RESPONSÁVEIS PELA PRODUÇÃO DE PROTEÍNAS VIRAIS
4.2 Fisiopatologia do HIV-1 e Ciclo de Replicação Viral
A exposição ao vírus gera uma infecção persistente crônica, caracterizada pela depleção consistente de linfócitos TCD4+, disfunção de células apresentadoras de antígeno, exaustão de linfócitos T e B e ativação exacerbada do sistema imunológico, incapacitando o organismo de responder de forma adequada à outras doenças. O curso natural de progressão da infecção, pode ser caracterizado em três fases: fase primária, fase da latência e a fase da imunodeficiência humana adquirida (AIDS). A fase primária, ou fase aguda, ocorre entre a 2° e a 4° semana da infecção e é definida pela intensa replicação viral, gerando uma alta taxa de carga viral plasmática. Os sintomas são inespecíficos, entre eles febre e cefaleia, e a soroconversão do paciente ocorre após a 6° semana do contágio. A fase da latência, ou fase crônica da infecção, vem logo em seguida, é assintomática e pode durar vários meses, ou alguns anos. É reconhecida pelas alterações inespecíficas em exames laboratoriais, como a presença de plaquetopenia, anemia e leucopenia, além da gradual queda de linfócitos TDC4+ e aparecimento de infecções atípicas ou reativação de antigas infecções. O final dessa fase e o início da AIDS é caracterizado pela queda constante da contagem de linfócitos TCD4+ e o aparecimento de infecções oportunistas ou neoplasias (RODRIGUES, 2017; NETO, 2020).
A entrada do vírus na célula alvo se inicia com a ligação do mesmo, através da interação do complexo de glicoproteínas gp120 e gp41, à superfície celular com o receptor primário do HIV-1, o CD4 (Figura 1). Esse receptor é também uma glicoproteína expressa na superfície de subpopulações de linfócitos T helper (ou auxiliar), nos precursores de células T, eosinófilos, monócitos, em celulas apresentadoras de antígeno, como células dentríticas e macrófagos, e microglias do sistema nervoso (VANNI, 2011). Ao ancorar na superfície da célula, a estrutura do vírus sofre uma alteração conformacional na gp120 que expõe o sito de ligação da sua alça V3 e promove uma melhor afinidade e posteriormente a ligação adicional à um co-receptor, da família de receptores de quimiocinas, sendo principalmente o CCR5 e o CXCR4, para efetivar a entrada na célula (Figura 1). A ligação do HIV ao co-receptor induz uma outra mudança conformacional, mas agora na gp 41, permitindo que a membrana viral se funda à membrana da célula alvo internalizando assim o vírus (Figura 3) (ARRUDA, 2010).
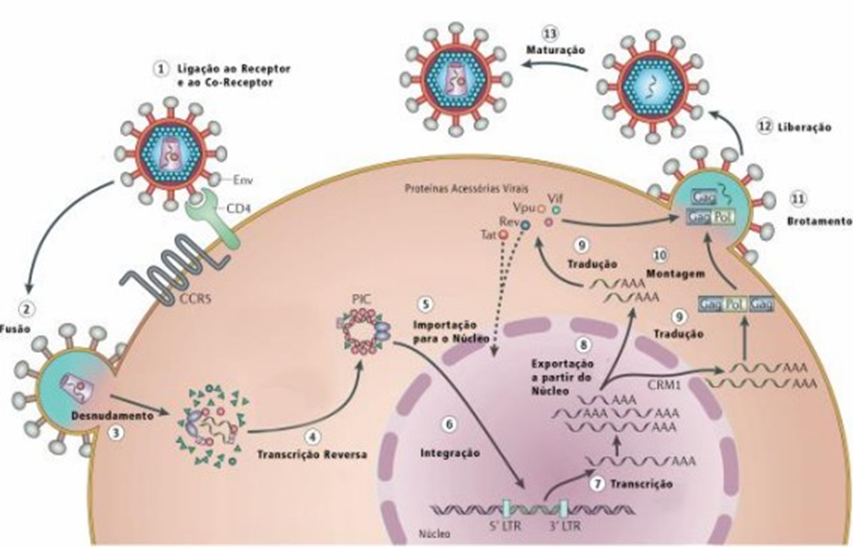
Após a fusão entre as membranas, e uma vez que o vírus entra na célula, as enzimas no interior do nucleocapsídeo tornam-se ativas e iniciam o ciclo replicativo viral. No citoplasma, ocorre o desnudamento do nucleocapsídeo e a liberação do genoma viral (RNA do HIV), e em seguida das enzimas e proteínas virais. O RNA viral passa pela transcrição reversa, a partir da enzima transcriptase reversa, se transformando em um DNA dupla-fita. Logo em seguida, o DNA viral é transportado até o núcleo juntamente com a integrase, que catalisa a integração ao genoma da célula hospedeira. Este DNA integrado, chamado de provírus, pode estar transcricionalmente inativo, ou seja, permanecer latente dentro da célula hospedeira ou se comportar como um gene que poderá ser transcrito em RNAm pela maquinaria celular. A regulação da síntese de RNA é realizada pela sequência LTR, inseridas durante o processo de transcrição reversa nas terminações do DNA integrado. Os RNAs, após a transcrição, são exportados para o citoplasma para que sejam traduzidos em proteínas virais que darão forma a novas partículas virais. Ainda no citoplasma, ocorre o processo proteolítico das proteínas Gag e Pol, através da enzima protease. Com a finalização de todo mecanismo de replicação viral, as proteínas virais são liberadas da célula por brotamento, que após a maturação, formarão um novo vírus (Figura 3) (RODRIGUES, 2017).
FIGURA 3 – CICLO REPLICATIVO DO HIV-1
4.3 Tropismo do HIV por Co-Receptores
O tropismo viral está relacionado com a capacidade de um vírus de infectar, dependendo do vírus a ser discutido, um determinado tipo celular que contenha também seus receptores e co-receptores específicos. No caso do HIV-1, como foi dito anteriormente, o principal receptor de ligação é o CD4, enquanto os co-receptores auxiliares são o CCR5 e/ou o CXCR4, pois geralmente durante a progressão natural da doença há modificações temporais e estruturais das cepas ou variantes virais, que resultam também na mudança do tropismo.
Durante a infecção recente, prevalecem as variantes “macrófagotrópicas” ou “monocitotrópicas”, que possuem a capacidade de infectar células que expressam os receptores CCR5 (cepas R5). Essas cepas infectam preferencialmente, durante a fase de latência clínica e após a soroconversão, os macrófagos, mas também podem infectar células T de memória que utilizem do co-receptor CCR5, e são caracterizadas pela melhor adaptação virológica durante o curso da doença em relação as outras cepas. (GOMES, 2009).Uma vez dentro dos macrófagos, o HIV insere seu material genético no genoma, garantido a transferência de genes virais a cada vez que essas células se replicarem, tornando os macrófagos reservatórios virais.(STEFANI et al., s.d )
Em uma fase mais avançada, há prevalência de variantes “linfotrópicas”, com tropismo para os receptores CXCR4 (cepas X4), que são responsáveis pela depleção acelerada de células T, indicando a progressão para a AIDS. Já as cepas R5X4, são capazes de utilizar ambos os co-receptores, resultando em um tropismo intermediário que surge durante a transição da R5 para X4, pois a cepa X4 é considerada uma evoulção, ou adaptação da R5, e depletam preferencialmente células naive, com uma deterioração imunológica acentuada. (GOMES, 2009).
Isolados primário de HIV-1, em sua maioria, utilizam o co-receptor CCR5. Embora as cepas R4 estejam na fase mais avançada da imunodeficiência, as cepas R5 são as mais transmitidas para os hospedeiros durante o processo de infecção. A transmissão predominante dessas cepas, pode ser explicada por uma combinação de mecanismos imunológicos celulares, como a ligação preferencial das cepas R5 por células apresentadoras de antígeno (APCs), que transportam patógenos para os linfonodos e apresentam para células T e B para que se inicie a resposta imune adaptativa. Essas cepas permanecem dentro dessas células por pelo menos cinco dias e quando há interação das APCs com as células TCD4+, o vírus passa a se replicar de maneira favorável. (VANNI, 2011).
4.4 Receptores de Quimiocina
Quimiocinas, ou as chamadas citocinas quimiostáticas, são pequenas proteínas solúveis de baixo peso molecular (8-12 kDa) que regulam processos biológicos, como ativação e recrutamento de leucócitos e outros tipos celulares (MACÊDO, 2003). As quimiocinas são estruturalmente muito semelhantes e são classificadas em subfamílias, de acordo com o espaçamento de aminoácidos (cisteínas) presentes em posições altamente conservadas, sendo nomeadas de CXC (α- quimiocina), CC (β – quimiocina), C e CXXXC. (SALDANHA, 2008).
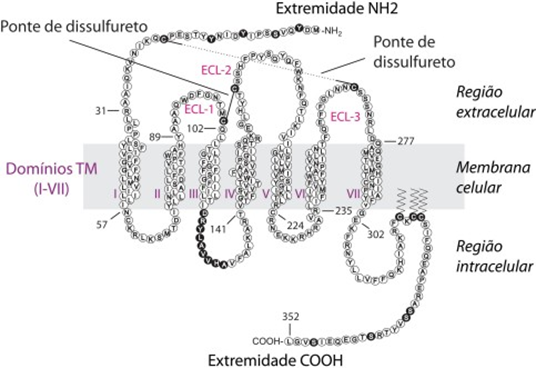
Os receptores dessas quimiocinas fazem parte de uma superfamília de receptores acoplados a proteínas G (proteínas responsáveis pela sinalização intracelular que resulta em alterações de funções fisiológicas da célula). Estão presentes na membrana das células-alvo, possuem um peso molecular de 40 kDa e são compostos por aproximadamente 350 aminoácidos. Estruturalmente esses receptores possuem sete domínios transmembranares, onde 3 segmentos e a região N-terminal estão no meio extracelular, enquanto os outros 3 segmentos e a região C- terminal estão no meio intracelular (Figura 4). A nomenclatura baseia-se na especificidade deles para com sua subfamília, logo, os receptores podem ser designados como CXCR, CCR, CXXXCR e XCR (GUERREIRO; COSTA; PEREIRA, 2011).
FIGURA 4 – ESTRUTURA DO RECEPTOR DE QUIMIOCINA HUMANA, CCR5
Fonte: SALDANHA, 2008.
Recentemente, foi identificado que os receptores de quimiocina são importantes co-receptores para algumas infecções, inclusive para infecção de células hospedeiras pelo vírus da imunodeficiência humana adquirida (HIV-1). Os principais envolvidos, já mencionados, são os co-receptores CXCR4 e o CCR5. O CXCR4 foi o primeiro receptor a ser identificado como co-receptor para o HIV e é expresso na maioria das células hematopoiéticas, incluindo neutrófilos, linfócitos T e B, e suas precursoras, células progenitoras CD34+, células de Langerhans, monócitos e células dendríticas.É um receptor que participa do processo de formação de plaquetas, quimiotaxia celular e também do desenvolvimento embriológico(GUERREIRO; COSTA; PEREIRA, 2011). Já o receptor CCR5, é expresso preferencialmente em macrófagos, tecidos linfoides e não linfoides, linfócitos auxiliares e em células dendríticas e está relacionado a processos inflamatórios e quimioestáticos, além de que sua elevação é simultânea à ativação do sistema imune e replicação viral em infecções pelo HIV-1(MACÊDO, 2003).
4.5 Mutação CCR5 Δ32/Δ32
Alguns indivíduos que são expostos ao HIV-1 podem não se infectar se possuírem uma mutação no gene que codifica o receptor CCR5. A proteína CCR5 é produto do processo de transcrição e tradução do gene CMKBR5, que possui uma região codificadora de 1056 pares de base, 352 aminoácidos e está localizado na região p21.3 do cromossomo humano 3. A mutação desse gene consiste numa deleção de 32 pares de base, dando origem a um alelo mutado (CCR5 Δ32/Δ32) e a uma proteína truncada que não pode ser detectada na superfície celular (Figura 5) (SALDANHA, 2008).
FIGURA 5 – REPRESENTAÇÃO DA DELEÇÃO DE 32 PARES DE BASE DO GENE CMKBR5
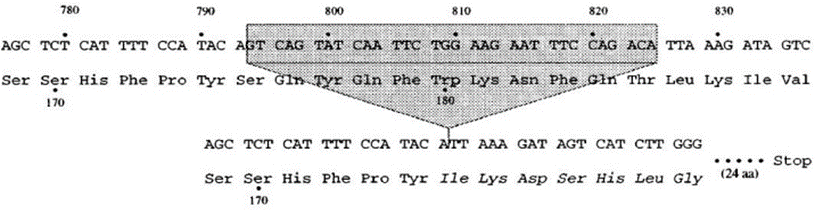
A deleção promove um “frameshift”, ou seja, uma terminação prematura da tradução dessa proteína, por conta de uma mudança na leitura da sequência de nucleotídeos. Como resultado, a proteína mutada passa a ter apenas 215 aminoácidos e acaba perdendo os três últimos segmentos transmembrânicos intracelulares e duas alças extracelulares, assim como o sítio de ligação com a proteína G, responsável pela transdução dos sinais celulares (Figura 6) (TEMPAKU; FILHO, 2014).
FIGURA 6 – REPRESENTAÇÃO DO RECEPTOR CCR5 MUTADO

Fonte: SALDANHA, 2008.
Essa mutação tem característica autossômica recessiva e consequentemente os indivíduos heterozigotos para CCR5 Δ32/Δ32 expressam, de maneira reduzida, o receptor na superfície celular, já os indivíduos homozigotos para essa deleção apresentam a inexpressão, ou ausência, do receptor CCR5. Esses, portanto, podem chegar a ser imunes ao HIV-1, demonstrando uma evidência sobre a possibilidade de controle duradouro da infecção viral (TEMPAKU; FILHO, 2014).
O alelo mutado, provavelmente, foi transmitido ao norte da Europa durante os últimos 700 anos, o que explica a predominância dessa condição, atualmente, na maioria da população europeia caucasiana, com uma frequência de cerca de 10%. Já as populações africanas e asiáticas, cujos continentes fazem divisa com a Europa, carregam uma baixa incidência, praticamente não há levantamento suficiente sobre a frequência dessa mutação nesses lugares (NUNES et al., 2013).No resto do mundo, assim como na América do Sul, principalmente no Brasil, a mutação é rara, tendo uma variação entre 0,030 e 0,065 de frequência (SILVA et al., 2020).
4.6 Transplante de Células Tronco CCR5 Δ32/Δ32 e a Cura Esterilizante do HIV
O transplante de células-tronco hematopoiéticas é uma prática terapêutica direcionada a pacientes que possuam doenças onco-hematológicas, como leucemias, linfomas, anemia de células falciformes, talassemias, imunodeficiências e outros distúrbios malignos da medula óssea. A coleta dessas células pode ser feita a partir da medula óssea, sangue periférico do doador ou pelo cordão umbilical e placenta. O doador pode ser o próprio paciente (transplante autólogo), outro individuo, parentado ou não, (transplante alogênico) ou ainda a doação pode advir de um irmão gêmeo idêntico (transplante singênico) (HOFFBRAND; MOSS, 2018).
No caso de um transplante alogênico, é necessário que o doador e o paciente façam a tipificação HLA e tenham a maior histocompatibilidade possível, para se evitar a rejeição do enxerto, isso porque o sistema de antígenos leucocitários humanos (sistema HLA ou complexo maior de histocompatibilidade – MHC) se refere aos antígenos processados e expressos em todas as células nucleadas do organismo humano e que auxiliam as células T a reconhecerem outros antígenos(MENEZES, 2019).
Esse procedimento ainda requer, antes da infusão e substituição por células-tronco colhidas do doador, a eliminação dos sistemas hematopoiéticos e imune do paciente, a fim de reduzir ao máximo a atividade medular e a produção de células malignas ou de células com algum tipo de alteração, por meio de um condicionamento feito com drogas quimioterápicas associadas ou não a radioterapia (BOUZAS et al., 2012).
Embora esse tipo de tratamento seja aplicado geralmente em casos específicos, como os citados anteriormente, três transplantes de células – tronco, contendo a mutação celular CCR5 Δ32/Δ32, em três pacientes diferentes que apresentavam neoplasias hematopoiéticas e a infecção por HIV, obtiveram resultados importantes, não somente para as doenças que o tratamento foi recomendado, como também para a compreensão de uma provável cura esterilizante do vírus da imunodeficiência humana através de uma nova terapêutica.
4.6.1 Paciente de Berlim
Timothy Ray Brown, denominado “Paciente de Berlim”, foi o primeiro paciente a ser curado pelo HIV. Homem americano, branco, com 40 anos e residente da cidade de Berlim, foi diagnosticado em 1995 com HIV e teve a remissão total da carga viral após receber um transplante de célula-tronco para tratar uma leucemia mieloide aguda (LMA), que foi diagnosticada em 2006. Durante os 4 anos que antecederam o procedimento, Timothy estava em uso da terapia antirretroviral e por todo esse tempo, a carga viral permaneceu indetectável, além dele não ter apresentado nenhuma doença associada a AIDS (SOUZA;FERNANDES;ACOSTA, 2012).
Para o tratamento da LMA, foi submetido inicialmente a um ciclo de quimioterapia de indução e posteriormente a um ciclo de quimioterapia de consolidação. Na fase de indução, o paciente apresentou diversos efeitos hepatotóxicos graves seguidos de uma insuficiência renal, logo precisou interromper a TARV, que culminou no rebote viral. Consecutivamente, a TARV foi retomada e só depois de 3 meses a carga viral novamente se tornou indetectável. Após sete meses, a leucemia entrou em recidiva, então foi indicado a um transplante alogênico de células-tronco (MAZUR; SCHAUREN, 2020).
Foi selecionado do Centro Germânico de Doadores de Medula Óssea, depois um sequenciamento de DNA genômico na região CCR5, um doador HLA-idêntico e portador homozigoto da mutação CCR5 Δ32/Δ32. A profilaxia contra a doença do enxerto foi aplicada três dias antes e dez dias após o transplante, já a TARV administrada até o dia anterior.
Em fevereiro de 2007, o transplante foi realizado e não foi observada nenhuma infecção grave, além de uma doença do enxerto de pele grau I, a qual foi tratada. Mais tarde, a leucemia teve novamente uma reincidência, sendo necessário mais um transplante do mesmo doador e mais um condicionamento por quimioterapia de indução associado a irradiação total do corpo. Esse segundo transplante, obteve o sucesso esperado tanto para a atenuação da leucemia quanto para cura esterilizante do HIV, sem o uso da TARV (KALLÁS; DONINI, 2016).
A genotipagem da cepa viral que acometia Timothy, um pouco antes do procedimento, revelou que o vírus possuía em maior parte um tropismo R5, enquanto apenas 2,9% da carga viral exibiam tropismo X4 ou intermediário, ou seja, sem evidências da evolução significativa do tropismo. A possível explicação seria eliminação de células reservatórias do vírus X4 pela irradiação, o que provavelmente favoreceu os resultados positivos desse estudo (SOUZA; FERNANDES; ACOSTA, 2012).
4.6.2 Paciente de Londres
O venezuelano Adam Castillejo, ou “Paciente de Londres”, ficou conhecido mundialmente como o segundo caso de cura do HIV. Ele foi diagnosticado em 2003 com HIV-1 e em 2012 com um linfoma de Hodgkin em estágio IV-B. Quando obteve o último diagnóstico, já fazia uso da TARV, entretanto, no mesmo ano, alterou o esquema de medicamentos. Para o linfoma, foi aplicada uma quimioterapia de primeira linha, que devido a resposta inadequada, teve que ser alterada para esquemas de resgate. Como o linfoma ainda não correspondia ao tratamento e o transplante autólogo não foi possível (devido a baixa mobilização celular), foi recomendado um transplante alogêncio, de um doador não parentado, HLA- idêntico e que apresentava a mutação CCR5 Δ32/Δ32, que de acordo com os médicos da época poderia ser uma possibilidade de cura para Adam (MAZUR; SCHAUREN, 2020).
Em maio de 2016, seguido da quimioterapia e remissão metabólica, Adam recebeu o transplante CCR5 Δ32/Δ32 e 30 dias depois recebeu alta. Durante seu acompanhamento a infecção pelo vírus Epstein-Barr e a doença do enxerto contra o hospedeiro de grau I surgiram, porém foram devidamente tratados. No pós-transplante foi avaliado o quimerismo completo em todas as células leucocitárias e nas frações de TCD3+, o retorno de tecidos linfoides a níveis normais, além da perda da expressão do CCR5 na superfícies de células TCD4 e TCD8. A TARV foi mantida por todo esse tempo, sendo descontinuada apenas 16 meses depois do transplante (MAZUR; SCHAUREN, 2020).
Desde a descontinuação da TARV, testes pós-transplante confirmaram que não era possível localizar o HIV funcional em seu sangue, sêmen, nódulos linfáticos, líquido cefalorraquidiano ou tecido intestinal. Adam portanto, estava com carga viral indetectável e curado do HIV-1( OLIVEIRA, 2021).
4.6.3 Paciente de Essen
Um paciente anônimo de 27 anos, diagnosticado com infecção pelo HIV-1 e com um linfoma não-Hodgkin de células T, foi direcionado à um transplante alogênico e HLA-idêntico de um doador homozigoto para mutação CCR5Δ32. Entretanto, nesse caso o transplante não foi bem sucedido como nos estudos anteriores (MAZUR; SCHAUREN, 2020).
A genotipagem da cepa infectante, com a análise dos aminoácidos da alça V3,expôs a trajetória do tropismo viral ao longo da doença: 287 dias antes do transplante, o tropismo era intermediário (R5X4); 103 dias antes, o tropismo era R5- trópico e 18 dias antes, o tropismo era X4-trópico. A TARV, interrompida previamente ao transplante, permitiu a evolução do vírus para utilização de um co-receptor alternativo, configurando um escape viral e em uma falha na abordagem da mutação no co-receptor CCR5. Com um rebote viral e 20 dias após o transplante, o paciente precisou retornar com a TARV, porém, novamente, teve que descontinuar o tratamento pela recorrência da leucemia. Infelizmente, o caso foi encerrado devido a morte do paciente, com um último rebote viral de 7.582.496 cópias de RNA do HIV-1 por mililitro (KALIDASAN; THEVAS DAS, 2020).
4.7 Novas Perspectivas Terapêuticas Baseadas no Co-receptor CCR5
Enquanto o desenvolvimento de medidas preventivas, como uma vacina eficaz, estão sendo um desafio para comunidade científica, algumas outras abordagens terapêuticas, baseadas principalmente em alterações ou edições genéticas, demonstram grande avanço e potencial para futuro uso clínico (sem a necessidade de antirretrovirais). As principais técnicas são as que utilizam o co- receptor CCR5 como uma ferramenta para o bloqueio da entrada do HIV nas células, por exemplo, o sistema CRISPR/Cas9, o ZFN (Zinc Finger Nuclease) e a utilização de RNAs de interferência.
4.7.1 CRISPR/CAS9
O sistema CRISPR/Cas9 é um mecanismo molecular derivado do sistema imunonológico adaptativo bacteriano, como das bactérias Streptococcus pyogenes e Escherichia coli , contra qualquer material genético que venha a ser reconhecido como invasor (PEREIRA,2018). A estrutura genética do locus CRISPR, presente no genoma bacteriano, é constituida por repetições palindrômicas curtas, agrupadas e que são regularmente interespaçadas por espaçadores de origem exógena. Na prática, quando um vírus bacteriófago, por exemplo, invade a bactéria, um complexo de endonucleases ( Cas1 e Cas2) promove a clivagem de um fragmento do DNA viral e o incorpora ao genoma bacteriano como um espaçador dessas repetições. Basicamente, durante o processo de transcrição do locus CRISPR, esse fragmento é transcrito em um RNA guia que se associa a endonuclease Cas9, que por fim é direcionada até o vírus invasor, eliminando-o em uma reexposição (BRITO, s.d ).
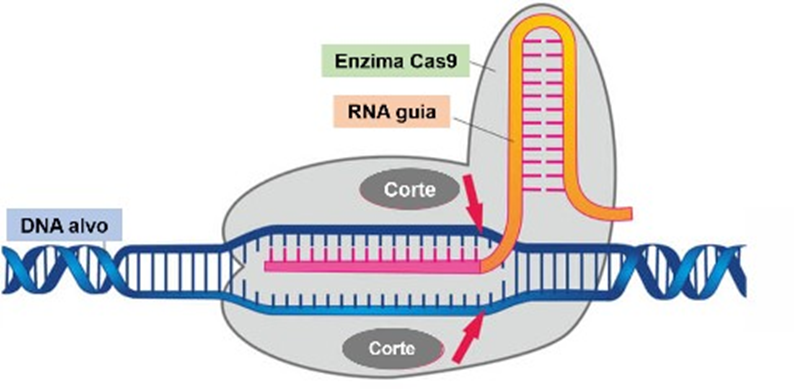
Aproveitando-se deste sistema foi desenvolvido em laboratório uma ferramenta de edição genética, a partir da utilização da Cas9 e de um RNA guia, sintetizado para ser correspondente a uma sequência do gene que se deseja modificar. Assim como no mecanismo bacteriano, o RNA guia conduz a Cas9 até a dupla-fita do DNA alvo para cliva-la (Figura 7). Após o dano causado, se inicia um processo de correções intracelulares na tentativa de reparar a dupla-fita. Entretanto, o mecanismo de reparo caracterizado por inserções e deleções (indels) de nucleotídeos, em uma união de extremidades não homólogas, acaba induzindo inúmeras mutações e falhas nas sequências, gerando por fim uma proteína não- funcional (AREND; PEREIRA; MARKOSKI, 2017).
Em estudos sobre a inativação do co-receptor CCR5, da mesma forma que em outras estratégias de edição genética, são utilizadas, em ensaios in vitro ou in vivo, células – tronco hematopoieticas ou células TCD4+. Em células TCD4+, a eficiência da edição do gene por CRISPR/Cas9 obteve resultados piores do que pela técnica ZFN, sendo que em um dos primeiros estudos, foi apontado que apenas 30% das células T CD4+ primárias continham indels dentro do gene CCR5, comparada utilização da ZFN, que ficou entre 40% e 60%. Em um estudo em camundongos, houve resultados positivos tanto para CRISPR quanto para ZFN. Esse estudo, demonstrou eficiência na inativação e a prevenção do co-receptor em células-tronco hematopoiéticas, com cerca de 32% dessas células sem o co-receptor. Foi concluido que para uma possível cura, seria necessário, primeiramente, que ao menos as células-tronco transplantadas fossem cinco vezes mais prevalentes que as células- tronco endógenas, consecutivamente após a radiação corporal total e, em segundo, a frequência de células-tronco mutadas em um paciente deveria estar entre 76% a 94% (MOHAMED et al., 2022).
FIGURA 7 – REPRESENTAÇÃO DA CLIVAGEM DO DNA ALVO PELO SISTEMA CRISPR-CAS9, A PARTIR DA ASSOCIAÇÃO DE UM RNA GUIA À ENZIMA CAS 9
O sistema CRISPR/Cas9 surgiu há pouco tempo como uma alternativa simples,eficiente e de baixo custo em comparação a outros métodos de edição genética. Entretanto, mais estudos são necessários para avaliar o potencial dos efeitos fora do alvo, pois ainda não está claro se ele tem a capacidade de reconhecimento para atingir um único sítio do genoma(BADIA et al., 2014).
4.7.2 Zinc Finger Nuclease (ZFN)
Zinc Finger Protein (ZFP) ou “proteína dedo de zinco”, compõe um grupo de proteínas responsáveis por variadas funções em células eucarióticas, como reconhecimento, replicação, reparo e transcrição de DNA, regulação de apoptose, ligação ao RNA entre outras (VASCONCELOS; FIGUEIREDO, 2016). Essas proteínas têm como característica estrutural a presença de quatro resíduos de aminoácidos (cisteína ou histidina), cuja estabilidade é determinada pela ligação de um átomo de zinco (TAKAHASHI, 2017). A técnica Zinc Finger Nuclease, ou Nuclease Dedo de Zinco, é portanto a associação dessas proteínas, projetadas e desenvolvidas para reconhecer uma sequência de DNA em sítios específicos do genoma, com uma endonuclease (Fok-l), que realiza a clivagem da mesma sequência (Figura 8).O resultado da ruptura do gene, assim como no sistema CRISPR/Cas, é o estímulo de mecanismos de reparo do DNA, levando a inserções de nucleotídeos , mutação gênica, inexpressão do gene e por fim alterações nas funções celulares (MORAIS; PAIVA; NASSER, 2021).
FIGURA 8 – REPRESENTAÇÃO DA FUNCIONALIDADE DOS DEDOS DE ZINCO ASSOCIADOS A ENDONUCLEASE FOK I, ONDE AS PROTEÍNAS IDENTIFICARAM COM PRECISÃO OS PARES DE BASE CORRESPONDENTES A SEQUÊNCIA DE DNA ALVO

A expressão do CCR5 também pode ser interrompida por ZFN. Alguns estudos pré-clínicos in vitro, visaram mimetizar o fenótipo CCR5Δ32 em células autólogas, a partir da utilização dessa técnica. A células alvo para estudo foram os linfócitos T e células-tronco hematopoíeticas. Em populações de células T primárias, foi relatada a interrupção de pelo menos 50% dos alelos CCR5, tornando essas células resistentes e fazendo com que elas se multiplicassem de maneira estável em culturas infectadas pelo HIV (CANNON;JUNE,2011). Quando essas células foram transplantadas em um camundongo imunodeficiente, com uma infecção pela cepa R5 trópica, foi demonstrada a mesma estabilidade contra o vírus, e ainda após 50 dias, houve um aumento de células TCD4+ e uma redução significativa na carga viral em seu sangue periférico.
Em células-tronco hematopoíeticas, o efeito da interrupção do gene CCR5 se demonstrou mais duradorou e ainda com uma vantagem de que todas as linhagens subquentes, que o HIV-1 infecta, apresentavam a inexpressão do co-receptor. Todavia, o processo de manipulação dessas células não é simples, pois são células difíceis de manter em cultura sem perda de viabilidade. Inicialmente, quando enxertadas nos camundongos, a carga viral se manteve alta e os níveis de TCD4+ caíram. Somente 6 semanas depois a carga viral diminuiu, os níveis de TCD4+ foram recuperados.(BADIA et al., 2014).
O grande desafio dessa técnica, assim como na CRISPR/Cas9, é certificar que somente a sequência alvo seja clivada, além de garantir que não haverá um rebote viral pela mudança do tropismo para uma cepa CXCR4 trópica.
4.7.3 RNAs de Interferência
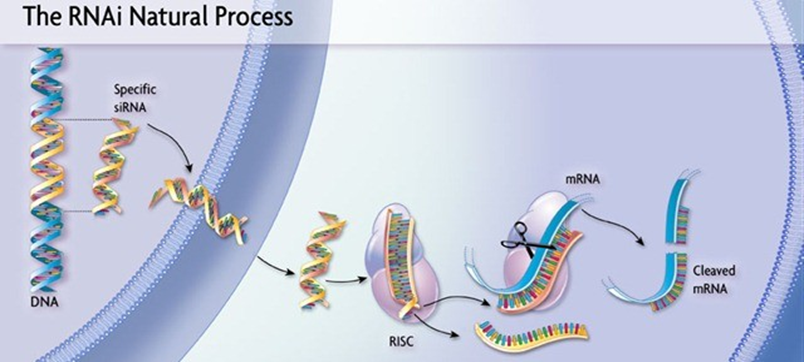
O mecanismo de knock-out (nocaute), por RNAs de interferência (RNAi), foi observado primeiramente em plantas, porém foi estudado com mais clareza por Andrew Fire e Craig Mello, em 1998, como um sistema de defesa do nematelminto Caenorhabditis elegans e hoje é considerado uma das estratégias promissoras e poderosas de edição gênica, a partir do silenciamento genético pós-transcricional (PRADO; SOUZA, 2021). O processo consiste na regulação da síntese de uma proteína pela degradação do RNA mensageiro, bloqueando assim a informação que posteriormente seria traduzida. Esse sistema funciona por meio da inserção, no citoplasma da célula alvo, de um RNA dupla-fita (dsRNA ou RNAi) sintetizado para que uma das sequências seja complementar ao RNA mensageiro. Logo em seguida, uma nuclease (Dicer) cliva essa dupla-fita, gerando fragmentos curtos de RNA (siRNAs de 21 a 25 nucleotídeos), que se associam a um complexo proteíco denominado RISC (RNA Interference Specificity Complex). Esses siRNAs correspondem a fita sense e antisense, onde a fita antisense guia o complexo RISC até RNA mensageiro para degradá-lo (Figura 9) (BARBOSA; LIN, 2004).
FIGURA 9 – REPRESENTAÇÃO DA ESTRATÉGIA DE RNA DE INTERFERÊNCIA A ASSOCIAÇÃO AO COMPLEXO RISC PARA O BLOQUEIO PÓS-TRANSCRICIONAL DO RNA MENSAGEIRO DO GENE ALVO
Sobre os estudos realizados com o co-receptor CCR5, foram utilizados os shRNAS (RNA em forma de grampo) que são semelhantes aos siRNAS, pois possuem como alvo apenas um transcrito de RNA mensageiro, mas diferentes em relação a sequência de codificação, porque a do shRNA, quando integrada, se comporta de maneira mais estável na célula. Os dois tipos celulares principais, novamente, são as células – tronco e células TCD4+(SWAMY; WU; SHANKAR, 2016). As primeiras experimentações, focaram no silenciamento in vitro do CCR5 em células-tronco hematopoiéticas, derivadas de células-tronco pluripotentes induzidas, sendo que 99% destas possuíam o shRNA contra o co-receptor.
Com o prosseguimento da pesquisa, apenas os macrófagos puderam se diferenciar, onde somente 6,7 % ainda apresentavam o co-receptor, enquanto as células TCD4+ não foram geradas. Esses macrófagos conseguiram inibir a infecção pelo HIV-1. Em células TCD4+ periféricas, que são mais viáveis para proliferação prolongada in vitro, o uso de shRNAs artificiais, alcançou um silenciamento de 39% de co-receptores, com sucesso e redução de quase toda carga viral (MOHAMED et al., 2022).
Apesar de uma grande quantidade de pesquisas apontar sucesso sobre a ferramenta de RNAi in vitro, ela apresenta algumas desvantagens quando aplicada ao um ser vivo, como por exemplo desencadear uma resposta imune inata, um bloqueio incompleto dos genes ou ainda efeitos fora do alvo de interesse(MOHAMED et al., 2022).
5. CONCLUSÃO
Um transplante de células-tronco hematopoiéticas, como descrito anteriormente, é um procedimento atribuído como principal forma de tratamento de pacientes que possuam doenças hematológicas malignas. Com o sucesso de dois casos de transplante de células-tronco, com a mutação CCR5 Δ32/Δ32, para remissão da carga viral do HIV, a medida terapêutica começou a ser considerada como uma possível via alternativa ao uso da terapia antirretroviral. Contudo, dificilmente essa prática será utilizada em uma grande quantidade de pacientes infectados pelo HIV, isso porque existem vários fatores de risco, como uma elevada morbimortalidade, em decorrência de todo processo de condicionamento por quimioterapia e irradiação, a sucessão de possíveis intercorrências após o procedimento, como a doença do enxerto contra hospedeiro, além da baixa disponibilidade de doadores que são HLA compatíveis e que possuam a mutação, sendo esta, em número limitado quando relacionada a população mundial.
Apesar da não funcionalidade, os resultados dos estudos, prestaram um grande apoio ao desenvolvimento de novas estratégias de edição genética baseadas no co- receptor CCR5 e na tentativa de mimetizar a mutação. Entretanto, essas estratégias ainda possuem alguns empecilhos como por exemplo a evolução do tropismo das cepas R5 para X4, que acaba inviabilizando-as pela disrupção exclusiva de um só co- receptor, risco de efeitos fora do alvo (off-target), onde uma sequência aleatória acaba sendo modificada ao invés da sequência alvo, a não substituição completa de células CCR5 positivas, que podem ocasionar em um mecanismo de escape viral e a persistência do HIV em células e reservatórios latentes. Portanto, para se chegar em resultados satisfatórios de uma cura definitiva, em uma população infectada pelo HIV, ainda são necessárias mais pesquisas, talvez focadas em terapias combinadas que possam solucionar esses problemas sem causar respostas imunológicas agressivas e outras alterações funcionais do organismo do paciente.
REFERÊNCIAS BIBLIOGRÁFICAS
ABBAS, A. K.; LICHTMAN, A.; PILLAI, S. Imunologia Celular e Molecular. 9 ed. Amsterdã: Editora Elsevier, 2019.
AREND, M. C.; PEREIRA, J. O.; MARKOSKI, M. M. O Sistema CRISPR/Cas9 e a Possibilidade de Edição Genômica para a Cardiologia. Arq. Bras. Cardiol., v. 108, n. 1, jan 2017, p. 81-83.
ARRUDA, L. B. Determinação do Tropismo do HIV-1 pelos Correceptores CCR5 e CXCR4 pelo Uso de Ferramentas de Bioinformática. Dissertação de Mestrado (Programa de Pós-Graduação em Ciências Médicas, Universidade de São Paulo (USP), São Paulo, 2010.
BADIA, R. RIVERA M. E.; CLOTET B.; ESTÉ, J. A.;, BALLANA E. Gene editing using a zinc- finger nuclease mimicking the CCR5Δ32 mutation induces resistance to CCR5-using HIV-1. J. Antimicrob. Chemother., 69(7), 2014, p. 1755-1759.
BARBOSA, A. S.; LIN, C. J. Silenciamento de Genes com RNA Interferência: Um Novo Instrumento para Investigação da Fisiologia e Fisiopatologia do Córtex Adrenal. Departamento de Clínica Médica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo, v. 48, n. 5, out 2004.
BOUZAS, L. F. S.; PINTO, D. O.; RODRIGUES, M. C.; MARADEI, S.; COLLARES, M.; TAVARES, R. C.; ATTA, E. H. Tópicos em Transplante de Células-Tronco Hematopoéticas. Rio de Janeiro: Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA)/Ministério da Saúde, 2012.
BITANTE, O. J.; FILHO, R. O. Terapia genética: Nova perspectiva no avanço à cura da infecção pelo HIV. Neurociências em Debate, 2017. Disponível em: http://cienciasecognicao.org/neuroemdebate/arquivos/3949.
BRASIL. Ministério da Saúde. Departamento de Condições Crônicas e Doenças Sexualmente Transmissíveis. Disponível em: http://www.aids.gov.br/pt-br/publico-geral/hiv/tratar-todas-pessoas-vivendo-com-hivaids.
BRITO, F. B. Sistema CRISPR-Cas: como funciona o mecanismo de imunidade dos procariotos que se tornou tendência no ramo da edição gênica. Instituto de Microbiologia Paulo de Góes/UFRJ, Rio de Janeiro, s.d. Disponível em: https://www.microbiologia.ufrj.br/portal/index.php/pt/graduacao/informes-da-graduacao/947-sistema-crispr-cas-como-funciona-o-mecanismo-de-imunidade-dos-procariotos-que-se-tornou-tendencia-no-ramo-da-edicao-genica.
CANNON, P.; JUNE, C. Chemokine receptor 5 knockout strategies. Curr. Opin. HIV AIDS, 6(1), 2011, p. 74-79.
DIDIGU, C. A.; DOMS, R. W. Novel Approaches to Inhibit HIV Entry. Viruses Journal, Philadelphia, 2012, 4(2), p. 309–324. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3315218/pdf/viruses-04-00309.pdf.
EDWARD, R.; CACHAY, M. Tratamento farmacológico da infecção pelo HIV. 2019. Disponível em: https://www.msdmanuals.com/pt-br/profissional/doen%C3%A7as-infecciosas/v%C3%ADrus-da-imunodefici%C3%AAncia-humana-hiv/tratamento-farmacol%C3%B3gico-da-infec%C3%A7%C3%A3o.
GOMES, E. R. Avaliação do Polimorfismo no Gene CCR5 em Portadores do HIV-1. Trabalho de Conclusão de Curso (Graduação em Medicina), Universidade Federal do Pará, Belém, 2009.
GUERREIRO, R.; COSTA, Q. S.; PEREIRA, J. M. A. As Quimiocinas e os seus Receptores, Características e Funções Fisiológicas. Artigo de Revisão, Centro de Patogênese Molecular, Unidade dos Retrovírus e Infecções Associadas, Universidade de Lisboa, 2011. Disponível em: https://actamedicaportuguesa.com/revista/index.php/amp/article/download/1571/1155.
HIGHLEYMAN, L. Paciente de Londres tem Remissão do HIV de Longo Prazo Após Transplante de Células-Tronco. Grupo de Incentivo a Vida, mar 2019. Disponível em: http://giv.org.br/boletimvacinas/33/paciente-de-londres-tem-remissao-do-hiv-de-longo-prazo-apos-transplante-de-celulas-tronco.php.
HOFFBRAND, A. V.; MOSS, P. A. H. Fundamentos em Hematologia de Hoffbrand. Porto Alegre: Editora Artmed, 2018.
KALLÁS, G. E.; DONINI, S. C. Perspectivas de cura da infecção pelo HIV. The Brazilian Journal of Infectious Diseases, 166, 167, 168, 2016.
KALIDASAN, V.; THEVA DAS K. Lessons Learned From Failures and Success Stories of HIV Breakthroughs: Are We Getting Closer to an HIV Cure? Front Microbiol., 11(46), 2020.
MACÊDO, A. K. V. Determinação do Polimorfismo de deltaCCR5 e Comparação com a Distribuição de Frequências Encontradas em Indivíduos Infectados pelo HIV-1 na População de Pernambuco. Dissertação de Mestrado (Programa de Pós-Graduação em Genética), Universidade Federal de Pernambuco, Recife, 2003.
MAZUR, B. F.; SCHAUREN, J. Transplante de Células Tronco Hematopoiéticas em Pacientes Infectados com HIV-1. Biociências, Biotecnologia e Saúde, Curitiba, v. 13, n. 27, mai 2020, p. 68-74.
MENEZES, A. R. P. Transplante de Medula Óssea: Importância do Sistema HLA. Trabalho de Conclusão de Curso (Especialização em Hematologia Prática e Essencial), Academia de Ciência e Tecnologia, São José do Rio Preto, 2018.
MOHAMED, H.; GURROLA, T.; BERMAN, R.; COLLINS, M.; SARIYER, I. K.; NONNEMACHER, M. R.; WIGDAHL, B. Targeting CCR5 as a Component of an HIV-1 Therapeutic Strategy. Journal Frontiers in Immunology, v. 12, 2022. Disponível em: https://www.frontiersin.org/article/10.3389/fimmu.2021.816515.
MORAIS, P. B.; PAIVA, P. M. H.; NASSER, T. F. Terapia Gênica: nova perspectiva no avanço à cura da infecção pelo HIV. Brazilian Journal of Development, Curitiba, v. 7, n. 6, jun 2021, p. 60983-60999. Disponível em: https://www.brazilianjournals.com/index.php/BRJD/article/view/31589/pdf.
NACIF P.; PIRES, C. A. F.; Lovizutto Protti B.; Boullosa Alonso Neto, J.; Bazzo, M. L.; Villares Martins, M.; Franchini, M.; Barbosa Lopes Francisco, R. Diagnóstico do HIV – Aula 1. TELELAB, out 2014. Disponível em: https://telelab.aids.gov.br/moodle/pluginfile.php/22163/mod_resource/content/2/HIV%20-%20Manual%20Aula%201_SEM.pdf.
NETO, L. F. S. P.; PERINI, F. B.; ARAGÓN, M.G.; FREITAS, M. A.; MIRANDA, A. E. Protocolo Brasileiro para Infecções Sexualmente Transmissíveis 2020: Infecção pelo HIV em Adolescentes e Adultos. Brasília: Ministério da Saúde do Brasil, 2020. Disponível em: http://scielo.iec.gov.br/pdf/ess/v30nesp1/2237-9622-ess-30-esp1-e2020588.pdf.
NUNES, A. C.; SENA, M. M.; GARCIA, S. B.; PEREIRA, A. P. L.; TRUGILO, K. P.; WATANABE, M. A. E.; OLIVEIRA, K. B. Análise da Deleção delta32 do Receptor de Quimiocina CCR5 em Descendente asiáticos em Maringá – Paraná. Biosaúde, Londrina, v. 15, n. 1, 2013. Disponível em: https://www.uel.br/revistas/uel/index.php/biosaude/article/view/24338.
OLIVEIRA S. N. S. D.; VILLELA R. M. T.; DUTRA W. M. Virologia Humana. 3 ed. Rio de Janeiro: Guanabara Koogan, 2015.
OLIVEIRA, K. H. Dispositivos Experimentais para a Cura do HIV: os casos de Berlim e Londres. VIII Reunião de Antropologia da Ciência e da Tecnologia, Universidade Estadual de Campinas, 22 a 26 de novembro de 2021. Disponível em: https://ocs.ige.unicamp.br/ojs/react/article/view/3739/3610.
PAIVA, J. C. C. Terapia gênica e suas aplicações no tratamento de doenças. Trabalho de Conclusão de Curso (Graduação em Biomedicina), Centro Universitário de Brasília (CEUB), Brasília, 2017.
PEREIRA, G. F. P. M. Uso do Sistema CRISPR-CAS9 como Terapia no Combate ao HIV: Uma Revisão Crítica. Trabalho de Conclusão de Curso (Graduação em Ciências Biológicas), Universidade Federal do Rio Grande do Sul, Porto Alegre, 2018.
PRADO, M. S. G.; SOUZA, C. B. RNA de interferência e CRISPR/Cas9 como alternativas terapêuticas para a doença de Alzheimer: uma Revisão de Literatura. Conexão Ciência, v. 16, n. 2, 2021.
RODRIGUES, N. F. Imunomodulação da Replicação do HIV-1 pela Hemaglutinina do Vírus Influenza. Tese de Doutorado (Programa de Pós-Graduação em Biologia Celular e Molecular), Ministério da Saúde/Fundação Oswaldo Cruz, Rio de Janeiro, 2017.
SALDANHA, C. J. P. Avaliação da Mutação CCR5delta32 do Receptor da B – Quimiocina 5 como Marcador Genético-Histórico na População de Triunfo – PE. Dissertação de Mestrado (Programa de Pós- Graduação em Genética), Universidade Federal de Pernambuco, Recife, 2008.
SILVA, D. F. O Genótipo CCR5Δ32 em pacientes infectados pelo HIV candidatos à Transplante Medula. Brazilian Journal of health Review, Curitiba, v. 3, n. 3, 2020, p. 5082-5099. Disponível em: https://www.brazilianjournals.com/index.php/BJHR/article/view/10613.
SILVA, S. P. Fatores genéticos e reações adversas aos antirretrovirais em pacientes portadores do HIV-1. Dissertação de Mestrado (Programa de Pós-Graduação em Inovação Terapêutica), Universidade Federal de Pernambuco, Recife, 2013.
SILVEIRA, A. A. Caracterização da Diversidade Genética do HIV-1 em Pacientes do Estado do Mato Grosso do Sul. Dissertação de Mestrado (Programa de Pós-Graduação em Medicina Tropical), Universidade Federal de Goiás, Goiânia, 2007.
SOUZA, T. L.; FERNANDES, R. C. S. C.; ACOSTA, E. M. Série “Desmistificando a Ciência”- Tratamento para Cura do HIV-1: “O Paciente de Berlim”. Revista Cientifica da Faculdade de Medicina de Campos, Rio de Janeiro, v. 7, n. 1, 2012. Disponível em: http://www.fmc.br/ojs/index.php/RCFMC/article/view/95
STEFANI, M. M. A.; VIEIRA, R. B. B.; PEREIRA, G. A. S.; JR, J. T.; FERRO, M. O. Entendendo como o HIV Infecta Células Humanas: Quimiocinas e seus Receptores. Revista de Patologia Tropical, v. 27, n. 1, p. 01-10, 1998.
SWAMY,M. N.; WU, H.; SHANKAR, P. Recent advances in RNAi-based strategies for therapy and prevention of HIV-1/AIDS. Adv. Drug. Deliv. Rev., n. 103, 2016, p. 174-186.
TAKAHASHI, J. M. Clonagem e Caracterização de uma Proteína Zinc Finger CCCH em Trypanosoma cruzi. Trabalho de Conclusão de Curso (Graduação em Ciências Biológicas), Universidade Federal do Paraná, Curitiba, 2007.
TEBAS, P. et al. Gene editing of CCR5 in autologous CD4 T cells of persons infected with HIV. The New England Journal of Medicine, v. 370, n. 10, 2014, p. 901-909.
TEMPAKU, P. F.; FILHO, J. S. Análise do Gene CCR5 em Pacientes Infectados pelo Vírus da Imunodeficiência Humana (HIV). Revista UNILUS Ensino e Pesquisa, v. 12, n. 26, jan/mar 2015.
VANNI, A. C. Análise das Características Genéticas da Região V3 e do Tropismo pelos Co-receptores CCR5 e CXCR4 do Vírus da Imunodeficiência Humana Tipo-1 e Subtipos B, C e Recombinantes BC Através de Ferramentas Genotípicas. Dissertação de Mestrado (Programa de Pós-Graduação em Genética e Biologia Molecular), Universidade Federal do Rio Grande do Sul, Porto Alegre, 2011.
VASCONCELOS, M. J. V.; FIGUEIREDO, J. E. F. Edição de Genoma com Nuclease “Zinc Finger”. Sete Lagoas: Empresa Brasileira de Pesquisa Agropecuária/Ministério da Agricultura, Pecuária e Abastecimento, 2016.
WERSOM, E. S. S.; MOTTA, L. R.; BAZZO, M. L.; FRANCHINI, M.; JUNIOR, O. C.F. Manual Técnico para Diagnóstico da Infecção pelo HIV. Brasília: Ministério da Saúde, 2013.
1Discente da Universidade Anhembi Morumbi, São Paulo/SP, Brasil.
2Discente da Universidade Anhembi Morumbi, São Paulo/SP, Brasil.
3Docente da Universidade Anhembi Morumbi, São Paulo/SP, Brasil.
