CHRONIC MYELOID LEUKEMIA: EVOLUTION OF THERAPEUTIC STRATEGIES IN RECENT DECADES
REGISTRO DOI: 10.69849/revistaft/cl10202510101240
Kamylla Rosa de Oliveira1
Luiza Gabrielly Lima dos Santos2
Romer Antônio Carneiro de Oliveira Junior3
Beatriz Tinoco Franceschi4
Resumo
O tratamento da Leucemia Mieloide Crônica (LMC) representa um dos maiores avanços na oncologia. Tudo começou com a descoberta do cromossomo Filadélfia e da proteína Bcr-Abl (tirosina quinase), que impulsiona a doença. Esse entendimento permitiu o desenvolvimento de terapias-alvo precisas, como os inibidores de tirosina quinase (iTQs), que transformaram a LMC de uma condição letal em uma doença crônica controlável. O Imatinibe, o primeiro iTQ, revolucionou o cuidado ao induzir remissões duradouras na maioria dos pacientes. No entanto, casos de resistência ou intolerância levaram aos iTQs de segunda geração, como Dasatinibe e Nilotinibe, que oferecem respostas mais rápidas e profundas. Para os desafios mais complexos, como a mutação resistente T315I, o Ponatinibe, iTQ de terceira geração, se mostrou eficaz. Alternativas como a Omacetaxina existem para casos refratários a múltiplos iTQs. Os resultados são impressionantes. A sobrevida dos pacientes em fase crônica hoje se equipara à da população geral. Estudos mostram que mais de 65% dos pacientes respondem bem ao Imatinibe após quatro anos e o risco de progressão para a fase aguda é baixo (cerca de 4%) para aqueles em remissão completa. Apesar do sucesso, os desafios persistem. A adesão ao tratamento oral a longo prazo é um obstáculo significativo, afetando mais de um terço dos pacientes em alguns cenários. Efeitos colaterais cumulativos e as barreiras de acesso devido ao alto custo também são preocupações reais. Em conclusão, os iTQs são um marco na medicina, oferecendo uma vida longa e com qualidade aos pacientes. O foco agora está em superar os desafios remanescentes resistência, efeitos adversos e adesão com estratégias cada vez mais personalizadas para consolidar esse extraordinário progresso.
Palavras-chave: Leucemia Mieloide Crônica. Inibidores da Tirosina Quinase. Avanços Terapêuticos. Qualidade de Vida.
1. INTRODUÇÃO
A leucemia mieloide crônica (LMC) é um tipo de câncer que afeta a medula óssea, local onde são produzidas as células do sangue. Nessa doença, ocorre uma produção descontrolada de células sanguíneas anormais, que se acumulam tanto na medula óssea quanto no sangue periférico (LOPES e THERESA, 2009).
A LMC representa entre 15% e 20% dos casos de leucemia e é mais comum em adultos, principalmente entre os 40 e 60 anos, sendo mais frequente em homens. Apesar de ser rara em jovens, ela pode ocorrer em pessoas de todas as idades. A exposição à radiação ionizante é o fator de risco mais conhecido, já que pacientes que fizeram radioterapia têm maior probabilidade de desenvolver a LMC. No entanto, na maioria dos casos, não se identifica um fator predisponente específico ao desenvolvimento da doença (SOSSELA et al., 2017).
O diagnóstico da LMC pode ser feito com base em exames laboratoriais, especialmente o hemograma, que muitas vezes mostra alterações mesmo em pacientes que não apresentam sintomas. Porém, o diagnóstico conclusivo é feito através de exames moleculares (SOSSELA et al., 2017).
O tratamento da LMC teve grandes avanços com o uso de medicamentos específicos que ajudam a controlar a multiplicação das células sanguíneas anormais, proporcionando uma boa qualidade de vida na maioria dos casos. Mesmo assim, alguns pacientes podem apresentar resistência ao tratamento, sendo necessário o uso de medicamentos mais potentes (LOPES e THERESA, 2009). Já o transplante de medula óssea é considerado a única forma de cura definitiva, mas é indicado apenas em casos específicos, geralmente para pacientes mais jovens e com um doador compatível, devido aos riscos envolvidos no procedimento (TABAK, 2000).
Diante desse cenário de avanços rápidos e profundos, surge uma questão central que norteia este trabalho: Como os avanços terapêuticos no tratamento da LMC impactam a sobrevida e a qualidade de vida dos pacientes acometidos pela doença?
Embora os benefícios em termos de sobrevida global sejam inquestionáveis, a jornada do paciente vai além dos números. A experiência de viver com uma doença crônica, o manejo dos efeitos adversos da medicação a longo prazo, o desafio da adesão terapêutica e as próprias limitações dos tratamentos, como o surgimento de resistências, são facetas críticas que merecem análise. A verdadeira medida do sucesso dessas inovações não está apenas em prolongar a vida, mas em garantir que esses anos adicionais sejam vividos com dignidade e qualidade.
É com este propósito que o presente trabalho se propõe a investigar os avanços terapêuticos da LMC e como o tratamento adequado impacta a qualidade de vida do paciente. Para isso, fizemos um levantamento da evolução histórica dos medicamentos para tratar a LMC e os seus mecanismos de ação, abordamos sobre a eficácia desses medicamentos, o impacto do tratamento no cotidiano e no bem-estar dos pacientes, e as limitações inerentes ao tratamento, como a resistência medicamentosa e os obstáculos à adesão terapêutica.
Através desta análise, busca-se não apenas compilar conquistas científicas, mas também compreender a experiência humana por trás delas, oferecendo uma visão integrada que reconhece tanto o triunfo da inovação farmacológica quanto os desafios que persistem no cuidado ao paciente.
2. METODOLOGIA
A pesquisa realizada consistiu em uma revisão de literatura, com o propósito de reunir e analisar os principais avanços terapêuticos no tratamento da LMC. Foram consultados livros acadêmicos e artigos científicos selecionados em bases de dados reconhecidas pela comunidade científica. As buscas ocorreram nas plataformas SciELO, PubMed e Google Scholar, abrangendo publicações entre 2000 e 2025. A escolha desse recorte temporal teve como objetivo assegurar a atualidade e a relevância das informações obtidas. Os critérios de inclusão consideraram estudos que abordaram especificamente os tratamentos mais recentes e inovadores aplicados à LMC, com foco em eficácia, segurança e impacto na qualidade de vida dos pacientes. As palavras-chave empregadas para a realização das buscas foram: “leucemia mieloide crônica”, “tratamentos”, “avanços terapêuticos” e “inibidores de tirosina quinase”. Os materiais selecionados foram avaliados criticamente, a fim de subsidiar a fundamentação teórica e discutir os progressos alcançados no enfrentamento dessa neoplasia hematológica.
3. REVISÃO DA LITERATURA
3.1 LEUCEMIA MIELÓIDE CRÔNICA
A LMC é uma enfermidade clonal que afeta as células progenitoras hematopoéticas, marcada pela presença do cromossomo Filadélfia. Esse cromossomo é resultante da translocação cromossômica entre os cromossomos 9 e 22 (t(9;22)(q34;p11)), levando à formação de um gene híbrido e anormal, o gene BCR-ABL (Figura 1). Esse gene gera uma proteína de alta atividade, denominada tirosina quinase, responsável pelo controle da proliferação das células hematopoéticas. Esses acontecimentos moleculares se manifestam laboratorialmente e clinicamente como hiperplasia mieloide, leucocitose, neutrofilia com desvio à esquerda não escalonado, basofilia e esplenomegalia (ZAGO et al., 2013).
Figura 1: Translocação cromossômica entre os cromossomos 9 e 22 (t(9;22)(q34;p11)) na Leucemia Mieloide Crônica.
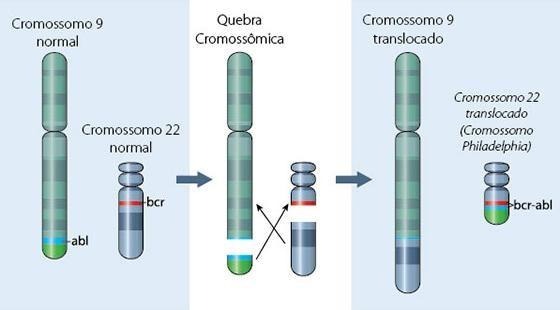
Fonte: https://labnetwork.com.br/noticias/xgen-oferece-teste-de-biologia-molecular-paradiagnostico-de-leucemia/
A LMC não é uma doença hereditária, mas sim adquirida. Apesar da causa exata para o desenvolvimento da LMC ainda não ser completamente compreendida, alguns fatores de risco já foram identificados, sendo eles a exposição à radiação ionizante, sexo e idade. É observado um leve aumento da doença em alguns pacientes que receberam doses altas de radioterapia para tratar outros tipos de câncer (MANUAL – LMC. TUDO SOBRE A LEUCEMIA MIELOIDE CRÔNICA, 2013).
A LMC também é mais comum em pessoas adultas, especialmente entre aquelas que têm entre 40 e 60 anos, predominantemente do sexo masculino. Contudo, pode afetar indivíduos de qualquer idade, com menos de 10% dos casos ocorrendo em pacientes com até 20 anos (SOSSELA et al., 2017). A taxa de incidência desse tipo de leucemia em crianças menores de 10 anos é de 1 para 1 milhão. Por outro lado, entre os adultos, essa taxa é de aproximadamente 1 para cada 100.000 indivíduos (HAMERSCHLAK, 2008).
Na LMC, os sinais clínicos variam conforme a fase em que a doença se encontra (fase crônica ou fase blástica) e o grau de acometimento hematológico. Durante a fase crônica, geralmente prolongada, com duração média entre três e cinco anos, os pacientes tendem a ser assintomáticos ou apresentarem sintomas leves e inespecíficos. Entre eles, destacam-se o cansaço persistente, perda de peso involuntária, sudorese noturna e febre baixa. A maioria dos pacientes apresentam esplenomegalia, o que pode gerar desconforto abdominal, sensação precoce de saciedade após as refeições e, em alguns casos, dor intensa devido a infartos esplênicos. Também é comum encontrar aumento moderado do fígado e número elevado de leucócitos no sangue. Em situações mais raras, podem surgir manifestações causadas por aumento da viscosidade sanguínea, como distúrbios visuais, priapismo e zumbidos (ZAGO et al., 2013).
À medida que a LMC avança, pode ocorrer uma transformação para a fase blástica, caracterizada pela presença de um grande número de células imaturas (blastos) no sangue e na medula óssea, ultrapassando 20% do total celular. Nessa etapa, os sintomas se intensificam, com febre persistente, sudorese noturna, dores nos ossos, perda de apetite e emagrecimento progressivo. Além disso, podem surgir infiltrações extra-medulares, atingindo linfonodos, pele, ossos e o sistema nervoso central. Sem tratamento adequado, a sobrevida média dos pacientes nessa fase é bastante limitada, variando entre três e seis meses. Em alguns casos, o tratamento pode reverter temporariamente a fase blástica e retornar o paciente à fase crônica, porém com duração reduzida (ZAGO et al., 2013).
Na maioria das situações, a LMC é assintomática em sua fase inicial. Sendo assim, muitos pacientes são diagnosticados acidentalmente durante exames de rotina, como o hemograma (SANT´ANNA, 2010). Nessa fase, o hemograma apresenta-se com uma leucocitose e, na contagem diferencial dos leucócitos, observa-se hiperplasia da série mieloide, destacando-se uma neutrofilia com a presença de quase todas as fases de maturação (mieloblastos, promielócitos, mielócitos, metamielócitos, bastonetes e neutrófilos) (Figura 2). Geralmente, esse desvio à esquerda ocorre de forma não sequencial, denominado desvio à esquerda não-escalonado (SILVA et al., 2016). A doença também causa basofilia e eosinofilia. Na série vermelha, é possível observar uma anemia normocítica e normocrômica, além de achados que não são exclusivos da LMC, como o aumento da contagem das plaquetas, que é frequentemente observado na doença (HOFFBRAND; MOSS, 2018).
Figura 2: Observação morfológica do sangue periférico na Leucemia Mieloide Crônica.
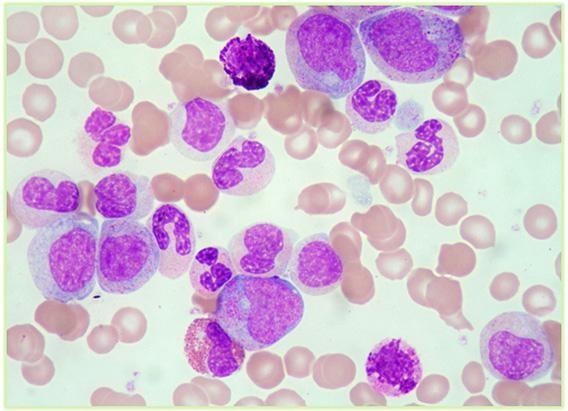
Fonte: https://www.germanodesousa.com/areas-clinicas/exame-morfologico-sangueperiferico-medula-ossea/
Entre os métodos utilizados para o diagnóstico e acompanhamento da doença estão as abordagens de cariotipagem com bandas G, que identificam a t(9;22)(q34;p11 (Figura 3), a hibridização in situ fluorescente (FISH), que identifica o gene de fusão BCR-ABL (Figura 4), e a reação em cadeia da polimerase com transcriptase reversa (RT-PCR) ou reação em cadeia da polimerase em tempo real quantitativa (qRT-PCR), além de testes como mielograma, imunofenotipagem e hemograma (SANT´ANNA, 2010; FRANCA; CARBONEZE; PEGO, 2024).
Figura 3: Cariótipo de um caso de Leucemia Mieloide Crônica demonstrando a t(9;22)(q34;p11.
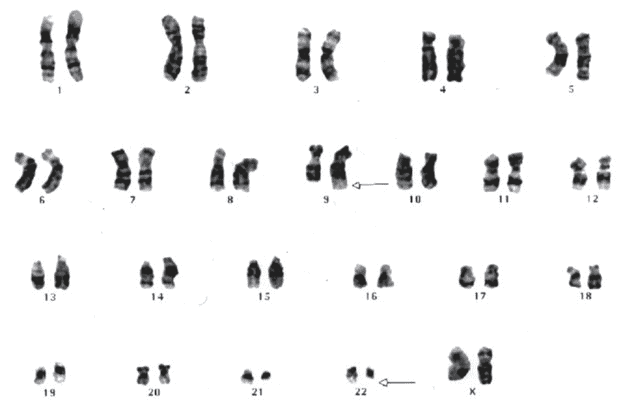
Fonte: https://abrale.org.br/doencas/leucemia/lmc/cromossomo-filadelfia-e-o-bcr-abl/
Figura 4: Técnica de FISH na Leucemia Mieloide Crônica identificando o gene de fusão BCR-ABL.
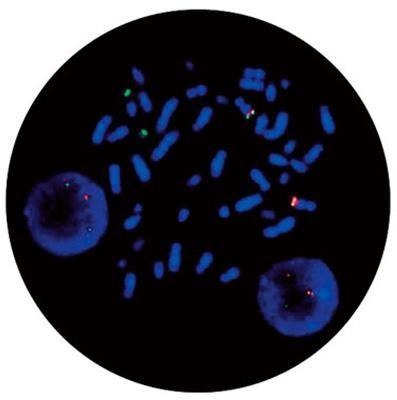
Fonte: https://www.usf.edu.br/galeria/getImage/768/1892362684904866.pdf
3.2 AVANÇOS TERAPÊUTICOS NO TRATAMENTO DA LMC
A presença do cromossomo Filadélfia em mais de 90% dos casos de LMC, com a consequente produção da tirosina quinase mutada, impulsionou o desenvolvimento de medicamentos inibidores da tirosina quinase (iTQs). Tal avanço terapêutico marcou um ponto decisivo na história da medicina oncológica e hematológica, já que antes da era dos iTQs, o tratamento da LMC era bastante limitado. No entanto, com o surgimento desses medicamentos, a doença passou de uma condição letal para uma enfermidade crônica e controlável (CAVALCANTE; LUNA, 2024).
O primeiro iTQ desenvolvido e utilizado na prática clínica foi o Imatinibe. Atualmente, este medicamento continua sendo a principal opção terapêutica para pacientes com diagnóstico de LMC (CAVALCANTE; LUNA, 2024). O Imatinibe atua inibindo especificamente a proteína tirosina quinase Bcr-Abl, promovendo remissão hematológica e citogenética da doença, caracterizadas, respectivamente, pela normalização dos parâmetros sanguíneos e pela redução ou ausência do cromossomo Filadélfia (GOVINDAN, 2017).
O mecanismo de ação do Imatinibe envolve a ligação ao sítio do ATP na forma inativa da tirosina quinase, bloqueando sua autofosforilação e, consequentemente, a sinalização celular desregulada. Com isso, o crescimento das células da medula óssea BCR-ABL positivas é inibido (GOVINDAN, 2017). O medicamento é indicado tanto para a fase crônica quanto para a fase blástica da LMC (CAVALCANTE; LUNA, 2024).
Os efeitos adversos do Imatinibe são, na maioria dos casos, leves. Entre eles, destacam-se náuseas, vômitos, diarreia, dores musculares, cãibras, erupções cutâneas e inchaços superficiais (CAVALCANTE; LUNA, 2024).
Apesar de sua eficácia, alguns pacientes desenvolvem resistência ou intolerância ao Imatinibe. Essa resistência pode estar associada à superexpressão do gene BCR-ABL ou a mutações que afetam a tirosina quinase, o que levou ao desenvolvimento de novos iTQs (CAVALCANTE; LUNA, 2024).
O Dasatinibe é um iTQ de segunda geração aprovado para tratar pacientes em fase crônica ou blástica da LMC. Ele atua como inibidor duplo, bloqueando as tirosinas quinases das famílias Src e Abl. Sua ligação ao sítio do ATP difere daquela do Imatinibe, permitindo a inibição tanto da forma ativa quanto da inativa da tirosina quinase Bcr-Abl, tornando-o um inibidor altamente potente (CAVALCANTE; LUNA, 2024).
Outro iTQ de segunda geração é o Nilotinibe. Ele compete com o ATP e se liga à tirosina quinase Bcr-Abl, bloqueando sua atividade. Dessa forma, inibe a proliferação celular e promove a apoptose das células leucêmicas BCR-ABL positivas. Estudos demonstraram que o Nilotinibe possui melhor penetração intracelular e é eficaz em concentrações menores do que o Imatinibe. Em pacientes resistentes ou intolerantes ao Imatinibe, mostrou-se promissor e bem tolerado em todas as fases da doença. Seus efeitos adversos incluem neutropenia, plaquetopenia, náuseas, erupções cutâneas, cefaleia, prurido, fadiga e elevação de enzimas hepáticas. Em pacientes na fase blástica, também apresentou boa tolerância, com efeitos adversos leves a moderados (DELAMAIN; CONCHON, 2008; CAVALCANTE; LUNA, 2024).
O Bosutinibe, também um iTQ de segunda geração, foi inicialmente desenvolvido como um inibidor específico da família das tirosinas quinases Src. Posteriormente, demonstrou capacidade de inibir também a tirosina quinase Bcr-Abl. Aprovado pela FDA em 2012, é indicado para adultos com LMC resistentes ou intolerantes aos demais iTQs. Seu mecanismo de ação é semelhante ao do Imatinibe, porém, eficaz em doses menores, o que pode resultar em menor toxicidade e resposta clínica mais favorável. Embora eficaz contra várias mutações do BCR-ABL, o Bosutinibe ainda não tem aprovação da ANVISA para uso no Brasil (CAVALCANTE; LUNA, 2024).
O Ponatinibe é um iTQ de terceira geração. É um inibidor multiquinase, especialmente eficaz contra a mutação T315I, uma das mais difíceis de tratar. Seu uso é indicado para pacientes com resistência ou intolerância aos iTQs anteriores. Também é aprovado para o tratamento da leucemia linfoblástica aguda (LLA) com cromossomo Filadélfia positivo. Apesar de sua eficácia, pode causar efeitos adversos graves, como hipertensão, isquemia arterial, dor abdominal, cefaleia, neuropatia periférica, entre outros. Por isso, seu uso é geralmente reservado para casos mais complexos (CAVALCANTE; LUNA, 2024).
A Omacetaxina Mepesuccinato é um alcaloide com mecanismo diferente dos iTQs. Atua inibindo a síntese proteica, afetando diretamente a tirosina quinase Bcr-Abl, inclusive a mutação T315I. Foi aprovada para uso em pacientes com LMC em fase crônica que não responderam a pelo menos dois iTQs. Os efeitos adversos mais comuns incluem neutropenia, trombocitopenia, anemia, câimbras musculares, hiperglicemia e desconforto abdominal (CAVALCANTE; LUNA, 2024).
Outra alternativa terapêutica é o transplante alogênico de células-tronco hematopoéticas (TCTH). Este procedimento pode ser curativo, porém envolve riscos significativos, como complicações graves ou até fatais. Por esse motivo, não é indicado para pacientes idosos ou com comorbidades importantes. Além disso, a realização do transplante tem se tornado cada vez menos comum devido ao fato de que a maioria dos pacientes responde bem aos iTQs, com boa qualidade de vida e controle da doença a longo prazo. Sendo assim, o TCTH é reservado para pacientes com resistência a pelo menos dois iTQs, em fase blástica ou com intolerância a todos os inibidores disponíveis (ABRALE, 2020).
A Tabela 1 sintetiza as informações discutidas acima sobre os iTQs e demais tratamentos para a LMC.
Tabela 1. Medicamentos para tratamento da LMC.
| Medicamen-tos | Indicação principal | Mecanismo de ação | Efeitos adversos |
| Imatinibe iTQ 1ª geração | Primeira linha para LMC em fase crônica e fase blástica. | Inibe a tirosina quinase Bcr-Abl ligando-se ao sítio do ATP inativo. | Náuseas, diarreia, cãibras, erupções cutâneas, inchaços |
| Dasatinibe iTQ 2ª geração | LMC crônica/blástica resistente ou intolerante ao Imatinibe. | Inibe formas ativas/inativas das tirosinas quinases Bcr-Abl e Src. | Retenção de líquidos, diarreia, fadiga, cefaleia. |
| Nilotinibe iTQ 2ª geração | LMC resistente ou intolerante ao Imatinibe. | Compete com o ATP e bloqueia a tirosina quinase Bcr-Abl; induz apoptose. | Neutropenia, náuseas, rash, elevação de enzimas hepáticas. |
| Bosutinibe iTQ 2ª geração | LMC resistente ou intolerante a outros iTQs. | Inibe as tirosinas quinases Bcr-Abl e Src em baixas doses. | Diarreia, náuseas, elevação de enzimas hepáticas, fadiga. |
| Ponatinibe iTQ 3ª geração | Casos com mutação T315I ou resistentes a outros iTQs de 1ª e 2ª geração. | Inibe múltiplas quinases, eficaz contra mutações resistentes. | Hipertensão, isquemia, dor abdominal, cefaleia, neuropatia. |
| Omacetaxina Mepesuccinato Alcaloide | LMC crônica sem resposta a dois ou mais iTQs. | Inibe síntese proteica, age sobre Bcr-Abl e mutações como T315I. | Neutropenia, anemia, câimbras, hiperglicemia, desconforto abdominal. |
Fonte: Autores (2025).
3.3 EFICÁCIA DOS iTQs
Com a introdução dos iTQs e a possibilidade de alcançar remissão hematológica e citogenética, o acompanhamento dos pacientes tornou-se essencial. Esse monitoramento visa comprovar a eficácia do tratamento, lidar com possíveis resistências ou recaídas e implementar estratégias alternativas em caso de falha terapêutica. Sabe-se que a resposta aos iTQs varia entre os pacientes, seja pela heterogeneidade da leucemia ou pelas particularidades individuais na metabolização dos medicamentos. Por isso, é necessário avaliar o nível de resposta em diferentes momentos do tratamento (CHAUFFAILLE, 2008).
O monitoramento citogenético, feito por cariótipo ou FISH, é fundamental devido alguns fenômenos importantes. Entre eles, destacam-se: (1) ausência ou atraso na remissão, o que pode exigir ajustes na dose dos iTQs; (2) recaídas, com ou sem interrupção do tratamento; (3) progressão clonal, mesmo com a terapia em curso; e (4) surgimento de alterações clonais em células BCR-ABL negativas. Normalmente, a resposta ao tratamento segue um padrão, primeiro o baço retorna ao tamanho normal, depois os níveis sanguíneos se estabilizam. Em seguida, o cromossomo Filadélfia desaparece nos testes citogenéticos da medula óssea. Por fim, os transcritos BCR-ABL diminuem. Esses parâmetros podem ser utilizados de forma sequencial no acompanhamento da resposta e eficácia terapêutica (CHAUFFAILLE, 2008).
A maioria dos pacientes com LMC em fase crônica possui o cromossomo Filadélfia típico. Em média, os pacientes respondem aos iTQs dentro de seis meses após o início do tratamento na dose convencional. Para avaliar a resposta citogenética completa, ou seja, ausência do cromossomo Filadélfia, o acompanhamento deve ser feito por PCR quantitativo, para medir a quantidade de transcritos BCR-ABL, geralmente entre três e seis meses de tratamento. Após essa fase, recomenda-se repetir a análise citogenética anualmente para verificar perda de resposta, alterações clonais em células cromossomo Filadélfia-negativas ou evolução da doença (CHAUFFAILLE, 2008).
A ausência de resposta citogenética após três meses de uso de Imatinibe é um sinal isolado de mau prognóstico. Por isso, é essencial realizar o cariótipo da medula óssea nesse período. O cariótipo é o único exame capaz de detectar alterações clonais, muitas vezes associadas à progressão da doença. Isso o torna uma ferramenta diagnóstica essencial, mesmo quando os exames moleculares indicam níveis baixos do transcrito BCR-ABL (CHAUFFAILLE, 2008).
Um estudo da Fag (2024) acompanhou pacientes em uso de Imatinibe e mostrou aumento na taxa de sobrevivência. Mais de 65% dos casos apresentaram boas respostas hematológicas e citogenéticas após quatro anos de evolução da doença (CAVALCANTE; LUNA, 2024).
A ocorrência de crise blástica em pacientes com remissão citogenética completa que utilizam iTQs é rara, sendo registrada em apenas 4% dos casos. Nesse caso, acredita-se que a inibição da tirosina quinase possa permitir o surgimento de subclones mais agressivos entre as células normais recuperadas (CHAUFFAILLE, 2008).
Nos casos em que não há resposta citogenética, é fundamental verificar a adesão do paciente à medicação, especialmente na dose padrão de 400 mg/dia de Imatinibe. Caso esteja sendo usada corretamente, recomenda-se aumentar a dose para 600 mg ou 800 mg/dia. Essa elevação pode induzir resposta, embora não haja garantia. Se mesmo assim não houver melhora, o paciente deve ser encaminhado para tratamento com um iTQ de segunda geração (CHAUFFAILLE, 2008).
Nesse contexto, deve-se considerar a possibilidade de mutações que conferem resistência ao Imatinibe, o que justifica a troca de medicação. A comprovação laboratorial de resistência a um ou mais iTQs é fundamental para orientar a escolha terapêutica. Sempre que houver perda de resposta molecular, é imprescindível realizar um cariótipo da medula óssea. Esse exame é o único capaz de identificar alterações clonais, comuns nessas situações (CHAUFFAILLE, 2008).
3.4 IMPACTO DO TRATAMENTO NA QUALIDADE VIDA DOS PACIENTES COM LMC
Vários fatores afetam a qualidade de vida dos pacientes com LMC, incluindo o controle da doença e o impacto do tratamento. A chegada dos iTQs transformou radicalmente o tratamento da LMC, possibilitando a muitos pacientes uma sobrevida prolongada e a capacidade de conviver com a doença de maneira crônica (SOUZA; REZENDE, 2024).
No entanto, apesar da comprovada eficácia dos iTQs, aspectos como os efeitos colaterais, a adesão ao tratamento e o impacto psicológico e social da doença exercem influência direta sobre a qualidade de vida dos pacientes. Nesse contexto, destaca-se que o suporte familiar e social desempenha papel fundamental, pois auxilia no enfrentamento dos desafios emocionais e físicos decorrentes do tratamento. Pacientes que contam com uma rede de apoio consistente tendem a apresentar maior adesão terapêutica, melhor capacidade de lidar com os efeitos adversos e, consequentemente, uma qualidade de vida mais satisfatória (SOUSA E REZENDE, 2024).
As interações com grupos de apoio e a troca de experiências com outros pacientes também podem ser muito benéficas. Além dos fatores externos, a resposta ao tratamento é um aspecto chave na qualidade de vida. Pacientes que conseguem atingir uma remissão molecular ou resposta citogenética completa tendem a experimentar uma melhora significativa na saúde física e mental. A resposta positiva ao tratamento está associada a uma menor carga de sintomas relacionados à doença e a uma maior segurança no controle da LMC a longo prazo, proporcionando uma sensação de alívio e bem-estar (SOUZA; REZENDE, 2024).
3.5 LIMITAÇÕES DO TRATAMENTO DA LMC, COMO A RESISTÊNCIA AOS MEDICAMENTOS E ADESÃO TERAPÊUTICA
Com o aumento da disponibilidade de tratamentos oncológicos orais, como os iTQs para a LMC, torna-se necessário discutir a questão da adesão ao tratamento. Esses medicamentos são mais eficazes e melhor tolerados, mas possuem um custo elevado. Porém, mesmo quando estão disponíveis, a adesão inadequada ao tratamento é uma realidade frequente, e os profissionais de saúde precisam estar atentos a essa situação, buscando estratégias para enfrentá-la (NONINO, 2008).
Esse desafio é ainda mais evidente em doenças com poucos sintomas e que exigem tratamentos prolongados, como a LMC. A baixa adesão ocorre mesmo em países com melhores indicadores socioeconômicos que o Brasil. Um estudo realizado por Halpern R, Barghout V e Williams D (2007), com pacientes em uso de Imatinibe no M.D. Anderson Cancer Center revelou que mais de um terço dos pacientes faziam uso inadequado da medicação consumindo menos de 70% da dose recomendada (HALPERN; BARGHOUT; WILLIAMS, 2007). Isso acarreta não apenas na redução da efetividade terapêutica, mas também em um aumento dos custos com o tratamento (NONINO, 2008).
Outro desafio no tratamento da LMC é a resistência ao Imatinibe, que pode ser primária ou secundária. A resistência está ligada a fatores como a superexpressão do BCR-ABL, defeitos genéticos extras e mutações na molécula da tirosina quinase. Ademais, a utilização tardia do Imatinibe e o estágio avançado da enfermidade elevam a probabilidade de resistência. Assim, torna-se imprescindível a criação de alternativas terapêuticas e a personalização do tratamento de acordo com as demandas de cada paciente (CHAUFFAILLE, 2008).
4. DISCUSSÃO
A análise do panorama terapêutico da LMC revela uma das transformações mais significativas na prática hematológica contemporânea. Os achados desta revisão permitem uma reflexão crítica que transcende os indicadores de eficácia, abordando os impactos reais na vida dos pacientes, os desafios persistentes e os horizontes que se delineiam no cuidado integral.
Os estudos revisados demonstram uma mudança paradigmática no prognóstico da LMC. Como futuros farmacêuticos, observamos que até o início dos anos 2000, o transplante de medula óssea representava a única alternativa com potencial curativo, porém restrito a pacientes jovens com doadores compatíveis (TABAK, 2000). A introdução dos iTQs, particularmente o Imatinibe, reescreveu completamente essa história, transformando uma doença fatal em condição crônica controlável (CAVALCANTE; LUNA, 2024).
Esta evolução posiciona a LMC como caso de sucesso da terapia-alvo, onde medicamentos desenvolvidos para atuar especificamente na proteína BCR-ABL demonstram o potencial da abordagem molecular racional. Como estudantes de Farmácia, compreendemos que tratamentos concebidos com base na compreensão íntima dos mecanismos fisiopatológicos representa o futuro da terapia medicamentosa.
A prática clínica evidencia que a eficácia dos iTQs não é uniforme entre os pacientes. Embora muitos pacientes alcancem respostas hematológicas e citogenéticas profundas em poucos meses, uma parcela significativa apresenta resistência primária ou secundária. Mutações como a T315I permanecem como desafios terapêuticos importantes (CHAUFFAILLE, 2008). Esta variabilidade ressalta a importância do acompanhamento farmacoterapêutico individualizado. Os resultados dependem não apenas do fármaco, mas de fatores como perfil genético, adesão ao tratamento e estágio da doença no momento do diagnóstico. Como futuros farmacêuticos, reconhecemos que nosso papel inclui a identificação precoce de possíveis falhas terapêuticas e a colaboração na adequação dos esquemas posológicos.
Os iTQs permitiram que pacientes mantenham suas atividades cotidianas e projetem um futuro a longo prazo (SOUZA; REZENDE, 2024). Entretanto, os relatos de efeitos adversos persistentes, como fadiga, alterações gastrointestinais e retenção hídrica, revelam o outro lado desta revolução terapêutica. Esta contradição entre sobrevida aumentada e qualidade de vida comprometida reforça a necessidade de abordagem multiprofissional. Como acadêmicos de Farmácia, entendemos que nossa atuação deve englobar não apenas a gestão da farmacoterapia, mas também o suporte no manejo de efeitos adversos e a promoção de adesão ao tratamento.
A literatura evidencia que desafios significativos persistem além dos aspectos puramente clínicos. Estudos indicam que parcela relevante dos pacientes utiliza doses inferiores às prescritas, comprometendo os desfechos terapêuticos (NONINO, 2008). Adicionalmente, o alto custo dos iTQs continua limitando o acesso em países com sistemas de saúde desiguais, como o Brasil. Estas limitações destacam a dimensão socioeconômica do cuidado em saúde. Como futuros farmacêuticos, reconhecemos nossa responsabilidade na advocacia pelo acesso equitativo aos medicamentos e no desenvolvimento de estratégias para melhorar a adesão terapêutica.
As tendências mais recentes apontam para o desenvolvimento de iTQs de última geração e terapias alternativas, como imunoterapias. Paralelamente, ganha força a investigação sobre descontinuação segura do tratamento em pacientes com resposta molecular profunda sustentada (ABRALE, 2020). Este duplo movimento de terapias mais potentes e estratégias de desescalonamento reflete a maturidade do campo terapêutico da LMC.
Por fim, a evolução do tratamento da LMC representa um marco na oncologia, mas também serve como alerta sobre os desafios que acompanham o avanço terapêutico. A maximização dos benefícios dos iTQs exigirá não apenas inovação farmacológica, mas também modelos de cuidado que integrem aspectos clínicos, psicossociais e econômicos. Como futuros farmacêuticos, devemos nos preparar para atuar nesta interface complexa, garantindo que os avanços científicos se traduzam em melhorias reais na vida dos pacientes.
5. CONSIDERAÇÕES FINAIS
Os avanços no tratamento da LMC representam uma das maiores conquistas da hematologia nas últimas décadas. A chegada dos iTQs transformou radicalmente o panorama da doença: de um diagnóstico antes considerado fatal, a LMC passou a ser uma condição controlável, com pacientes levando uma vida praticamente normal, com qualidade e expectativa preservadas.
O Imatinibe, como pioneiro dessa classe, trouxe respostas hematológicas e citogenéticas consistentes. Mais tarde, vieram os iTQs de segunda e terceira gerações, que ampliaram as possibilidades de tratamento para casos de resistência ou intolerância. Esse salto terapêutico reforça o valor da medicina de precisão e do investimento em ciência para revolucionar o cuidado em oncologia.
Ainda assim, persistem obstáculos relevantes. A resistência aos medicamentos, os efeitos adversos e, sobretudo, a dificuldade de manter a adesão ao tratamento a longo prazo continuam sendo desafios diários. Some-se a isso o alto custo dessas terapias, que restringe o acesso principalmente em países com sistemas de saúde desiguais, como é o caso do Brasil.
Diante desse contexto, fica claro que o futuro do tratamento da LMC depende de dois eixos: (1) o desenvolvimento contínuo de terapias inovadoras incluindo novos iTQs e imunoterapias e (2) a busca por estratégias que individualizem o cuidado, como protocolos de descontinuação segura para pacientes com resposta molecular mantida.
Assim, os progressos alcançados até aqui não são apenas um marco científico, mas também um lembrete de que precisamos unir inovação, acesso e humanização. Nesse processo, o farmacêutico tem um papel fundamental seja no apoio à adesão, no manejo de efeitos adversos ou na defesa de políticas que garantam tratamentos para todos, reforçando uma prática clínica verdadeiramente centrada no paciente.
REFERÊNCIAS
ALIMENA, Giuliana et al. Crise blástica súbita em pacientes com leucemia mieloide crônica positiva para cromossomo Filadélfia que alcançaram remissão citogenética completa após terapia com imatinibe. Cancer, v. 96, n. 4, p. 501-509, 2002. Disponível em: https://doi.org/10.1002/cncr.22046. Acesso em 16 de abr. de 2025.
CAVALCANTE, Ana Beatriz Ribeiro; LUNA, Mylena de Lima. Inibidores de tirosina quinases no tratamento da Leucemia Mieloide Crônica (LMC) – revisão bibliográfica. Brazilian Journal Of Health Review, [S.L.], v. 7, n. 3, p. 1-12, 24 maio 2024. South Florida Publishing LLC. http://dx.doi.org/10.34119/bjhrv7n3-174.
CHAUFFAILLE, Maria de Lourdes L. F.. Análise citogenética e FISH no monitoramento da LMC em tratamento com inibidores da tirosino quinase. Revista Brasileira de Hematologia e Hemoterapia, São Paulo, v. 30, n. 1, p. 13-19, 23 mar. 2008. Acesso em 17 de abr de 2025.
DELAMAIN, Márcia T.; CONCHON, Mônika. Os inibidores de tirosino quinase de segunda geração. Revista Brasileira de Hematologia e Hemoterapia, [S.L.], v. 30, p. 1-12, abr. 2008. Elsevier BV. http://dx.doi.org/10.1590/s1516-84842008000700010.
HAMERSCHLAK, Dr. Nelson. Manual – LMC. Tudo sobre a Leucemia Mieloide Crônica, 2019. Conteúdo traduzido do manual da Leukemia and Lymphoma Society. Disponível em: https://search.app/rvDgf6LwR1SG62Bu9. Acesso em: 18 abr. 2025.
HAMERSCHLAK, Nelson. Leucemia: fatores prognósticos e genética. Jornal de Pediatria, [S.L.], v. 84, n. 4, p. 52-57, ago. 2008. FapUNIFESP (SciELO). http://dx.doi.org/10.1590/s0021-75572008000500008. Acesso 17 de abr. de 2025.
HOFFBRAND, A. Victor; MOSS, Paul A. H. Fundamentos em Hematologia de Hoffbrand. 7ª Edição. Porto Alegre: ARTMED EDITORA LTDA, p. 156. 2018.
LOPES, Nei R.; ABREU, Maria Theresa C. L.. Inibidores de tirosino quinase na leucemia mieloide crônica. Revista Brasileira de Hematologia e Hemoterapia, [S.L.], v. 31, n. 6, p. 449453, 2009. Elsevier BV. http://dx.doi.org/10.1590/s1516-84842009005000089. Acesso em 18 de março de 2025.
NONINO, Alexandre. Problemas e perspectivas do tratamento da Leucemia Mielóide Crônica no Brasil. Revista Brasileira de Hematologia e Hemoterapia, Brasília Df, v. 30, n. 1, p. 66-69, abr. 2008. Elsevier BV. http://dx.doi.org/10.1590/s1516-84842008000700015. Acesso em 17 de abr. de 2025.
SANT’ANNA, Joselita Brandão de. LEUCEMIA MIELÓIDE CRÔNICA – DIAGNÓSTICOS E TRATAMENTOS. Disponível em: https://search.app/kingXHVr6tAQVQjm8. Acesso em: 18 abr. 2025.
SANTOS, Mirella M. F. et al. Leucemia Mieloide, aguda e crônica: diagnósticos e possíveis tratamentos. Revista Saúde em Foco – Edição nº 11 – ano: 2019
SILVA, P. H.; ALVES H. B.; COMAR S. R.; et al. Hematologia Laboratorial: Teoria e procedimentos. Porto Alegre: ARTMED EDITORA LTDA, 2016. 280 p.
SOSSELA, Fernanda Roberta; ZOPPAS, Barbara Catarina de Antoni; WEBER, Liliana Portal. Chronic Myeloid Leukemia: clinical aspects, diagnosis and main changes observed in complete blood count. Revista Brasileira de Análises Clínicas, Caxias do Sul, v. 49, n. 2, p. 127-130, 24 jan. 2017. Revista Brasileira de Analises Clinicas. http://dx.doi.org/10.21877/2448-3877.201700543. Acesso em 18 de março de 2025.
SOUSA, Fabiula Amélia Barreto; REZENDE, Gabriel de Oliveira. FATORES ASSOCIADOS À QUALIDADE DE VIDA E À EFICÁCIA DOS MEDICAMENTOS NOS PORTADORES DE LEUCEMIA MIELÓIDE CRÔNICA. Revista Foco, [S.L.], v. 17, n. 12, p. 1-15, 4 dez. 2024. Brazilian Journals. http://dx.doi.org/10.54751/revistafoco.v17n12-026. Acesso 17 de abr. 2025.
TRATAMENTOS, Leucemia Mielóide Crônica. ABRALE,13 de mar. de 2020. Disponível em:https://abrale.org.br/doencas/leucemia/lmc/tratamento/#1583784596395-b9472e71-4d77. Acesso em 16 de abr. de 2025.
ZAGO, Marco Antonio; FALCÃO, Roberto Passetto; PASQUINI, Ricardo. TRATADO DE , 2013. 925 p. HEMATOLOGIA. São Paulo: Atheneu.
LABNETWORK. Imagem representando o acontecimento da translocação 9 e 22, originando o cromossomo Filadélfia e o gene BCR-ABL. 2017. Fotografia. Disponível em: https://labnetwork.com.br/noticias/xgen-oferece-teste-de-biologia-molecular-para-diagnostico-de-leucemia/. Acesso em: 26 set. 2025.
FAG. Vista do tratamento da leucemia mieloide crônica com inibidores da tirosino quinase. Disponível em: https://themaetscientia.fag.edu.br/index.php/RTES/article/view/974/1023 Acesso em 26 set. de 2025.
Halpern R, Barghout V, Williams D. Relationship between compliance with imatinib mesylate and medical costs for patients with CML and GIST. Journal of Clinical Oncology, 2007 ASCO Annual Meeting Proceedings Part I. Vol 25, No. 18S (June 20 Supplement), 2007: 6618
FRANCA, Victor; CARBONEZE, Emanueli; PEGO, Caroline.AS TÉCNICAS DA BIOLOGIA MOLECULAR PARA DIAGNÓSTICO DE LEUCEMIAS. Universidade São Francisco,26 jul. de 2024.Disponível em: https://www.usf.edu.br/galeria/getImage/768/1892362684904866.pdf. Acesso em 29 set. de 2025.
EXAME Morfológico de Sangue Periférico e medula óssea.GERMANO DE SOUSA, fotografia. Disponível em: https://www.germanodesousa.com/areas-clinicas/examemorfologico-sangue-periferico-medula-ossea/. Acesso em 26 set. de 2025
1Discente do Curso Superior de Farmácia do Centro Universitário UNITOP Campus Palmas. e-mail: kamyllarosa27@gmail.com
2Discente do Curso Superior de Farmácia do Centro Universitário UNITOP Campus Palmas. e-mail: Luizagabrielly195@gmail.com
3Docente do Curso Superior de Farmácia do Centro Universitário UNITOP Campus Palmas. Especialista em Biotecnologia. e-mail: romer.junior.1998@gmail.com
4Docente do Curso Superior de Farmácia do Centro Universitário UNITOP Campus Palmas. Doutora em Ciências. e-mail: beatfranceschi@gmail.com
