REGISTRO DOI: 10.69849/revistaft/pa10202506151646
Juliana Medeiros Oliveira
Lucas Caynan Xavier Sales
Orientadora: Prof. Dra. Fernanda Guimarães Valverde
RESUMO
A atuação do biomédico no diagnóstico laboratorial da anemia falciforme representa um avanço significativo na abordagem dessa doença hereditária, permitindo intervenções mais precisas e individualizadas. A partir da identificação da mutação responsável pela formação da hemoglobina S, métodos laboratoriais como hemograma, esfregaço sanguíneo, eletroforese de hemoglobina e testes de falcização revelam alterações celulares e fornecem subsídios para um diagnóstico seguro. O biomédico, por meio da realização, interpretação e validação dos exames, desempenha um papel crucial não apenas na detecção da condição, mas também no aconselhamento dos pacientes quanto aos desdobramentos genéticos e clínicos. Apesar dos avanços tecnológicos que aprimoram a acurácia dos diagnósticos, ainda existem desafios relacionados à padronização dos protocolos e à integração de métodos tradicionais com técnicas moleculares. Este estudo tem como objetivo discutir essas abordagens diagnósticas e evidenciar a importância do biomédico na condução dos exames laboratoriais para a anemia falciforme, por meio de uma revisão bibliográfica exploratória que selecionou publicações recentes com base em sua relevância e período de publicação. Conclui-se que, embora os métodos atuais ofereçam diagnósticos mais precisos, a eficácia do manejo clínico depende do contínuo aprimoramento dos protocolos e da constante atualização dos profissionais. Dessa forma, a integração entre tecnologia e conhecimento especializado mostra-se indispensável para a intervenção precoce e o acompanhamento adequado dos pacientes com anemia falciforme.
Palavras-chave: Anemia falciforme, anemia hemolítica, diagnóstico laboratorial, papel do biomédico, teste do pezinho
ABSTRACT
The role of the biomedical professional in the laboratory diagnosis of sickle cell anemia represents a significant advancement in the approach to this hereditary disease, enabling more precise and individualized interventions. Through the identification of the mutation responsible for the formation of hemoglobin S, laboratory methods such as complete blood count, blood smear, hemoglobin electrophoresis, and sickling tests reveal cellular alterations and provide support for an accurate diagnosis. The biomedical professional, through the execution, interpretation, and validation of tests, plays a crucial role not only in detecting the condition but also in counseling patients regarding genetic and clinical implications. Despite technological advances that enhance diagnostic accuracy, challenges related to the standardization of protocols and the integration of traditional methods with molecular techniques still persist. This study aims to discuss these diagnostic approaches and highlight the importance of the biomedical professional in conducting laboratory tests for sickle cell anemia, through an exploratory literature review that selected recent publications based on relevance and publication date. It is concluded that, although current methods offer more precise diagnoses, the effectiveness of clinical management depends on the continuous improvement of protocols and the constant updating of professionals. Therefore, the integration between technology and specialized knowledge is essential for early intervention and proper monitoring of patients with sickle cell anemia.
Keywords: Sickle cell anemia, hemolytic anemia, laboratory diagnosis, role of the biomedical scientist, heel prick test
1. INTRODUÇÃO
A Anemia Falciforme (AF) é uma doença hemolítica hereditária de caráter autossômico recessivo, presente em indivíduos homozigotos para a hemoglobina S (HbS). Essa condição é causada por uma mutação na posição 6 da extremidade N- terminal do gene da β-globina, localizado no cromossomo 11, em que ocorre a substituição do ácido glutâmico pela valina (de Almeida et al., 2017).
De modo geral, as principais complicações clínicas da doença falciforme decorrem das alterações morfofisiológicas dos eritrócitos após o processo de falcização. Entre as manifestações clínicas mais comuns estão as crises álgicas, pneumonias, úlceras de perna, esplenomegalia, acidente vascular cerebral (AVC), síndrome torácica aguda, priapismo, alterações ósseas e colelitíase (Costa et al., 2024).
Segundo dados do Programa Nacional de Triagem Neonatal do Ministério da Saúde (PNTN/MS), em 2019 foram diagnosticados 1.214 casos de doença falciforme e 61.021 de traço falciforme (presença de HbS). Estudos apontam que, na ausência de tratamento adequado e oportuno, apenas cerca de 20% das crianças acometidas conseguem atingir os cinco anos de idade.
No que diz respeito ao tratamento, o primeiro passo do cuidado integral é o diagnóstico precoce, realizado por meio da triagem neonatal com o teste do pezinho. Para indivíduos não diagnosticados na triagem inicial a confirmação pode ser feita a partir do quarto mês de vida, por meio da eletroforese de hemoglobina – exame incluído na rotina pré-natal e garantido às gestantes e seus parceiros pela Rede Cegonha, no âmbito do Sistema Único de Saúde (SUS) (Ministério da Saúde, 2020).
A investigação laboratorial da anemia falciforme pode ter início com alterações eritroides evidenciadas no eritrograma, como anemia moderada a grave, associada a achados típicos no esfregaço sanguíneo, que geralmente revelam células em forma de foice. Para confirmação diagnóstica, utilizam-se métodos confirmatórios, a exemplo da eletroforese de hemoglobina e exames complementares, como a prova de falcização e a curva de fragilidade osmótica (Souza et al, 2021).
Diante do crescente número de casos da doença falciforme no Brasil, destaca- se a relevância da atuação biomédica no processo diagnóstico e no apoio aos pacientes. O profissional biomédico tem responsabilidade de orientar o paciente quanto às alterações genéticas envolvidas, bem como esclarecer o diagnóstico
laboratorial. Para isso deve pautar sua conduta em princípios éticos fundamentais, como autonomia, igualdade, equidade, privacidade e qualidade, especialmente quando se trata de processos genéticos (de Alcantara et al, 2021).
2. OBJETIVO GERAL E ESPECÍFICOS
2.1 OBJETIVO GERAL
Analisar a atuação do biomédico no diagnóstico laboratorial e no aconselhamento genético de pacientes com anemia falciforme, destacando sua importância na integração de técnicas diagnósticas avançadas e na aplicação das diretrizes do SUS para o diagnóstico precoce e o manejo adequado da doença.
2.2 OBJETIVOS ESPECÍFICOS
- Descrever os aspectos clínicos e laboratoriais da anemia falciforme, ressaltando os principais sinais, alterações hematológicas e complicações identificadas por meio de exames como hemograma, esfregaço sanguíneo e eletroforese de hemoglobina;
- Investigar os métodos laboratoriais empregados no diagnóstico da doença, destacando a integração entre técnicas tradicionais e avanços tecnológicos, com ênfase especial nos testes moleculares, visando aprimorar a precisão e a eficiência diagnóstica;
- Evidenciar o papel do biomédico na realização, interpretação e validação dos exames laboratoriais, ressaltando sua contribuição como suporte técnico- científico essencial à tomada de decisões clínicas;
- Discutir a atuação ética do biomédico no atendimento a pacientes com doenças genéticas, enfatizando a relevância da formação contínua e da observância às diretrizes dos protocolos do SUS para a promoção de um serviço de saúde de qualidade.
3. METODOLOGIA
O presente estudo trata-se de uma revisão da literatura, de natureza descritiva e exploratória. A metodologia seguiu as etapas recomendadas para revisões da literatura: definição da pergunta de pesquisa, estabelecimento de critérios de inclusão e exclusão, busca na literatura, seleção dos estudos, análise crítica e síntese dos dados. A pergunta orientadora foi estruturada com base na estratégia PICo (População, Interesse, Contexto), sendo: População – pacientes com anemia falciforme; Interesse – atuação do biomédico no diagnóstico laboratorial e no aconselhamento genético; Contexto – serviços de saúde com ênfase em diagnóstico laboratorial.
Foram selecionadas 54 publicações científicas, publicadas no período de 2015 a 2025, obtidas por meio de buscas em bases de dados especializadas, como Ministério da Saúde (12) Pubmed (05), Google Acadêmico (21), Science Direct (04), Scielo (07) e Biblioteca Virtual de Saúde (BVS) (05). Para a busca, utilizaram-se operadores booleanos (“AND” e “OR”) com os seguintes termos: “Anemia falciforme”, “Diagnóstico”, “Teste do pezinho” e “Triagem neonatal”. Também foram empregados descritores controlados e padronizados, isoladamente ou em diferentes combinações, como: “Anemia falciforme”, “Técnicas de laboratório clínico”, “Hemoglobina falciforme” e “Triagem neonatal”.
A seleção dos estudos envolveu a leitura dos resumos, das seções introdutórias e das discussões, com o objetivo de verificar a adequação dos artigos aos critérios de inclusão previamente estabelecidos. Os artigos considerados pertinentes ao tema foram lidos na íntegra e utilizados como base para a análise e discussão dos principais aspectos relacionados à anemia falciforme e aos métodos diagnósticos, com ênfase na atuação do profissional biomédico.
Foram adotados como critérios de inclusão: artigos que abordassem diretamente os objetivos desta revisão, especialmente os que discutem o papel do biomédico no diagnóstico da anemia falciforme, enfatizando os métodos laboratoriais utilizados; publicados entre 2015 e 2025; disponíveis na íntegra em português,inglês ou espanhol; e provenientes de fontes confiáveis, como publicações revisadas por pares.
Foram excluídas publicações que não abordavam diretamente a temática central (diagnóstico laboratorial da anemia falciforme), como resumos simples, editoriais, cartas ao leitor, artigos duplicados nas bases de dados e estudos com linguagem excessivamente técnica, que dificultasse a compreensão por parte do público-alvo deste TCC. Essa seleção criteriosa teve como objetivo garantir a relevância, atualidade e consistência do material analisado, assegurando que as informações extraídas fossem úteis e pertinentes ao objeto de estudo.
Os dados extraídos dos estudos selecionados foram organizados em categorias temáticas, conforme os objetivos da pesquisa, abrangendo: (1) aspectos clínicos e laboratoriais da anemia falciforme; (2) métodos diagnósticos utilizados e (3) atuação do biomédico.
Para o gerenciamento e organização das referências, foi utilizado o software Excel, o que facilitou a identificação de duplicatas, o armazenamento dos artigos e a padronização das citações.
Por fim, destaca-se que, por se tratar de uma revisão da literatura, a análise está sujeita à qualidade metodológica e à disponibilidade dos estudos incluídos, o que pode limitar a abrangência das conclusões e recomendações apresentadas.
4. REVISÃO DE LITERATURA
4.1 ASPECTOS GERAIS DA ANEMIA FALCIFORME
A anemia falciforme é uma das hemoglobinopatias mais comuns e representa um importante problema de saúde pública em várias regiões do mundo, especialmente em populações afrodescendentes (Rees et al., 2010; Ministério da Saúde, 2019). Trata-se de uma doença genética hereditária causada por uma mutação no gene da hemoglobina, que altera a estrutura da molécula e afeta a funcionalidade dos glóbulos vermelhos (Higgs & Vickers, 2018). Essa alteração provoca a formação da hemoglobina S, responsável pela característica deformação em “foice” das hemácias, que compromete a circulação sanguínea e a oxigenação dos tecidos (Ware, 2017).
A complexidade da anemia falciforme está associada a múltiplos fatores, incluindo sua origem genética, as manifestações clínicas variadas e as complicações que podem surgir ao longo da vida do paciente (Serjeant, 2013). O entendimento dos aspectos gerais da doença, como sua epidemiologia, bases genéticas, fisiopatologia, sinais clínicos e impacto social, é fundamental para o desenvolvimento de estratégias eficazes de diagnóstico, manejo e prevenção (Piel et al., 2017).
Neste capítulo, serão abordados os principais conceitos relacionados à anemia falciforme, iniciando com a distribuição epidemiológica da doença no Brasil e no mundo, seguida da definição e características genéticas, fisiopatologia, manifestações clínicas e as implicações para a saúde pública. Esses elementos fornecerão uma base sólida para a compreensão dos métodos diagnósticos e da atuação do biomédico no contexto do diagnóstico laboratorial da doença.
4.1.1 EPIDEMIOLOGIA DA DOENÇA NO BRASIL E NO MUNDO
A anemia falciforme representa um importante problema de saúde pública tanto no Brasil quanto globalmente. Estima-se que cerca de 3.500 crianças nascem anualmente no Brasil com a forma homozigótica da doença (HbSS), enquanto aproximadamente 200 mil nascimentos apresentam o traço falciforme (heterozigose), segundo dados do Ministério da Saúde (2020). A maior incidência da doença concentra-se em estados com significativa população negra, como Bahia, Maranhão, Minas Gerais e Rio de Janeiro. Destaca-se o papel do Programa Nacional de Triagem Neonatal, que incorporou o teste do pezinho para anemia falciforme desde 2001, contribuindo para o diagnóstico precoce e o manejo adequado dos pacientes.
No Brasil, estudos epidemiológicos regionais destacam o impacto da doença nas internações hospitalares. No estado do Mato Grosso, por exemplo, foram registradas 363 internações por anemia falciforme em indivíduos com menos de 20 anos no período de..
Em seus estudos Melo et al (2024), observaram que o perfil dos pacientes apresentou predominância do sexo masculino (57,6%) e da população autodeclarados pardos (59%). A análise por faixa etária apontou maior concentração de internações entre crianças de 0 a 4 anos (39,9%), seguidas pelas faixas de 5 a 9 anos e 10 a 14 anos (ambas com 25,6%). Pacientes entre 15 e 19 anos corresponderam a 11,3% dos casos. Esses dados evidenciam a importância de estratégias de prevenção, diagnóstico precoce e acompanhamento contínuo desde os primeiros anos de vida.
Outra importante contribuição epidemiológica provém do estado da Bahia, que concentra a maior população negra do país. Entre 2008 e 2014, foram registradas 8.103 internações hospitalares por anemia falciforme, sendo 52,1% em homens. Crianças entre 5 e 14 anos representaram cerca de 34% das internações, seguidas pela faixa etária de 1 a 4 anos. Para a variável raça/cor, mais da metade das internações registradas no SIH-SUS não apresentavam informações para esse campo da Autorização de Internação hospitalar, seguido da raça/cor parda, que corresponde a 29,7% (Martins et al., 2017).
Esses dados ressaltam a concentração da doença em estados com maior proporção de população negra e reforçam a necessidade de políticas públicas direcionadas à prevenção, diagnóstico precoce e ampliação do acesso aos serviços de saúde. Além disso, indicam lacunas importantes nos registros oficiais, especialmente no campo de raça/cor, o que dificulta a avaliação precisa do perfil epidemiológico da doença.
No cenário mundial, a anemia falciforme é mais prevalente na África Subsaariana, especialmente em países como Nigéria, República Democrática do Congo e outras nações do Golfo da Guiné. Estima-se que aproximadamente 300 mil crianças nascem anualmente com a doença no mundo, número que pode alcançar 400 mil até 2050, caso não sejam implementadas medidas preventivas eficazes. Além da África, a doença é endêmica em regiões do Mediterrâneo, Oriente Médio, sul da Ásia e partes da América Latina. As migrações populacionais recentes também têm contribuído para o aumento da prevalência da anemia falciforme em países da Europa e América do Norte, tornando-se um desafio crescente para esses sistemas de saúde (Piel et al., 2013).
Diante desses dados, fica evidente que a anemia falciforme é um importante problema de saúde pública global, com impacto significativo também no Brasil. A compreensão da distribuição geográfica e dos grupos mais afetados é fundamental para a implementação de políticas públicas eficazes voltadas à triagem, diagnóstico precoce e cuidado integral dos pacientes.
4.1.2 DEFINIÇÃO E CARACTERÍSTICAS GENÉTICAS DA ANEMIA FALCIFORME
A anemia falciforme caracteriza-se por uma mutação de ponto no gene que codifica a cadeia β da globina, localizado no cromossomo 11. Especificamente, ocorre a substituição do ácido glutâmico pela valina na sexta posição (Glu6Val), em decorrência da transversão do códon normal GAG para GTG. Essa alteração modifica as propriedades físico-químicas da hemoglobina, resultando na formação da hemoglobina S (HbS) com menor solubilidade, fator crucial para a patogênese da doença (Broto, 2019).
Sob condições de baixa oxigenação, a HbS desoxigenada tende à polimerização, formando longas fibras dentro dos eritrócitos. Esse processo induz a falcização, onde as células se deformam adquirindo uma forma alongada e rígida (Imagem 1), o que prejudica sua capacidade de circular adequadamente nos vasos sanguíneos e consequentemente reduz sua vida útil. Inicialmente um fenômeno reversível, os ciclos repetidos de oxigenação e desoxigenação ocasionam danos irreversíveis à membrana celular, culminando em hemólise crônica e contribuindo para a obstrução vascular e complicações clínicas graves (Costa et al., 2024).

Imagem 1: Características morfológicas de uma hemácia falcizada (A) e uma hemácia normal (B) Fonte: Biblioteca Virtual em Saúde Adaptada (2007)
O padrão de herança da mutação que origina a HbS é autossômico recessivo, implicando que a manifestação clínica da doença ocorre apenas quando o alelo mutado é herdado de ambos os genitores, resultando no genótipo HbSS, correspondente à forma clássica da anemia falciforme. Genótipos alternativos, como HbSC, HbSD e HbSE, apresentam manifestações menos severas, enquanto indivíduos com o traço falciforme (HbAS) geralmente são assintomáticos, mas conferem uma vantagem evolutiva ao apresentarem resistência parcial à malária grave, causada pelo Plasmodium falciparum. Esse fenômeno, conhecido como vantagem heterozigótica, explica a elevada frequência da mutação em regiões endêmicas de malária (Costa et al., 2024; Ministério da Saúde, 2021).
4.1.3 FISIOPATOLOGIA DA ANEMIA FALCIFORME: MECANISMOS CELULARES E SISTÊMICOS
A anemia falciforme, doença genética que levou ao conceito de “doença molecular”, é caracterizada por anemia hemolítica crônica e fenômenos vaso oclusivos que levam a crises dolorosas agudas e à lesão tecidual e orgânica crônica e progressiva. É causada pela substituição de adenina por timina (GAG->GTG), codificando valina ao invés de ácido glutâmico, na posição 6 da cadeia da – globina, com produção de hemoglobina S (HbS) (SOUZA, et al, 2016).
Esta pequena modificação estrutural é responsável por profundas alterações nas propriedades físico-químicas da molécula da hemoglobina no estado desoxigenado. Estas alterações culminam com um evento conhecido como falcização, que é a mudança da forma normal da hemácia para a forma de foice, resultando em alterações da reologia dos glóbulos vermelhos e da membrana eritrocitária (SOUZA, et al, 2016).
Durante a desoxigenação que ocorre durante a passagem das células vermelhas do sangue pela microcirculação, a porção hemoglobina passa por uma mudança conformacional. Na HbS, a substituição do ácido glutâmico (hidrofílico) por valina (hidrofóbico) faz com que se estabeleça interações com outros resíduos hidrofóbicos da β globina com outra molécula desoxi-HbS. Um polímero é formado e se alonga em fibras helicoidais, que agrupadas umas com as outras, endurecem e induzem as características conhecidas pelas mudanças de forma, assumindo assim um formato classicamente falciforme (COSTA,et al,2019)
Por se tratar de uma anemia hemolítica crônica, tem como um dos seus efeitos a lise dos eritrócitos, expondo assim seus componentes. Dessa forma, a diferença entre as configurações hematológicas e os valores de referência eram esperados, apesar de os pacientes se encontrarem em estado estacionário da doença, sem crises. Com relação ao uso de HC, composto é como consequência do uso do aumento da produção de HbF. O aumento da quantidade de HbF na corrente sanguínea, além de carrear mais sobrecarga devido à sua maior camada pela molécula, prevenindo os efeitos de hipóxia tecidual, também diminui a ocorrência de polimerização da HbS, consequentemente causando a ocorrência de hemólise e de eventos de vaso-oclusão, interferindo diretamente nos valores dos índices hematimétricos (PEREIRA, L. R. et al., 2023).
A disfunção, ou estado de ativação endotelial, compreende uma resposta do endotélio a estímulos patológicos mediante a ativação da inflamação, fenómenos trombóticos, vasorregulação desordenada e propensão angiogênica aumentada que a longo prazo produz vasculopatia crônica e danos irreversíveis (TEIXEIRA, Rozana Santos, et al. 2020).
Os pacientes de AF possuem maior propensão a infecções causadas por micro-organismos no trato respiratório, como pneumonia, meningite, otite média, podendo também apresentar: síndrome torácica aguda, episódios de crise de dor, priapismo, úlceras de perna e insuficiência múltipla dos órgãos (DE ALMEIDA,et al.2017).
4.1.4 PRINCIPAIS SINAIS E SINTOMAS E COMPLICAÇÕES CLÍNICAS
Essas células falcizadas obstruem pequenos vasos sanguíneos, desencadeando eventos vaso-oclusivos e lesões isquêmicas em diversos tecidos e órgãos. Além disso, sua fragilidade leva à hemólise crônica, o que contribui para a anemia persistente e outras manifestações clínicas. As manifestações podem ser agudas ou crônicas, variando de leves a graves, com impacto significativo na morbidade e na qualidade de vida dos pacientes, afetando diversos sistemas biológicos (Tabela 1) (Ministério da Saúde, 2023).


Tabela 1- Principais sinais e sintomas por sistemas afetados.
Fonte: Autoria própria (2025)
As complicações frequentes compreendem crises vaso-oclusivas (CVO) são o evento clínico mais frequente é motivo recorrente de hospitalização. Estudos apontam que até 90% das internações estão associadas a essas crises (Rees et al., 2010). A síndrome mão-pé (dactilite) é uma das primeiras manifestações em lactentes. A síndrome torácica aguda é responsável por até 25% das mortes em adultos com anemia falciforme (Gladwin & Vichinsky, 2008). O acidente vascular encefálico afeta cerca de 11% das crianças com HbSS sem tratamento preventivo, com risco reduzido mediante uso de transfusões regulares (Adams et al., 1998). O priapismo afeta até 35% dos homens com AF em algum momento da vida (Mantadakis et al., 2020).
Diversos fatores desencadeantes podem precipitar as crises, como infecções, exposição ao frio, desidratação, esforço físico intenso, estresse emocional, variações bruscas de temperatura e hipóxia. A prevenção desses gatilhos é essencial na abordagem clínica da doença. Além disso, o impacto psicossocial e qualidade de vida podem associar-se às manifestações recorrentes da doença que comprometem significativamente a qualidade de vida dos indivíduos afetados. Internações frequentes, dor crônica, absenteísmo escolar e laboral, além de limitações nas atividades cotidianas, contribuem para quadros de ansiedade, depressão e isolamento social (Serjeant, 2013). A gestão adequada exige uma abordagem multidisciplinar, com suporte médico, psicológico e social.
4.1.5 IMPACTO NA SAÚDE PÚBLICA
O principal instrumento de detecção da doença é o PNTN, conhecido como “teste do pezinho”, que é oferecido pelo SUS. Uma vez realizado durante a triagem neonatal, o diagnóstico possibilita o início de cuidados específicos. Considerando que se trata de uma doença degenerativa, é importante iniciar os tratamentos o mais rápido possível, fator que pode ser determinante na limitação dos agravos (Ministério da Saúde, 2024).
O diagnóstico tardio pode ser realizado de diversas maneiras. Crianças a partir dos quatro meses de idade, jovens e adultos que ainda não fizeram diagnóstico para detecção da doença podem realizar o exame de sangue chamado eletroforese de hemoglobina, que é oferecido às gestantes e parceiros durante o pré-natal, e disponibilizado no SUS para toda a população. Além disso, a doação de sangue é também uma opção de rastreio, uma vez que a legislação prevê o rastreamento nos hemocentros e unidades de coleta nos estados e municípios (Ministério da Saúde, 2024).
A anemia falciforme é considerada um grave problema de saúde pública, pois além de impactar diretamente o sistema de saúde, acarreta consequências sociais e econômicas significativas para os pacientes e suas famílias. No Brasil, dados recentes do Ministério da Saúde e do Sistema de Informações sobre Nascidos Vivos (SINASC) indicam que a incidência da doença é expressiva, com o PNTN/MS registrando, por exemplo, cerca de 1 caso a cada 2,5 mil nascidos vivos. Essa condição afeta principalmente grupos populares menos favorecidos, especialmente a população negra, que é historicamente mais vulnerável à doença, conforme apontam pesquisas e estatísticas oficiais (Ministério da Saúde, 2021; Ministério da Saúde, 2022).
Do ponto de vista dos impactos, a anemia falciforme gera custos diretos consideráveis para o sistema de saúde, incluindo custos com internações frequentes, utilização de medicamentos específicos, realização de exames complementares e transfusões de sangue. Além disso, os impactos indiretos são igualmente preocupantes: faltas escolares, ausências no trabalho, afastamentos por invalidez e a sobrecarga dos serviços públicos agravada pelo estigma e pelo preconceito social enfrentados pelos pacientes. Esses fatores, somados à necessidade de tratamentos contínuos – como o uso de hidroxiureia –, dificultam o acompanhamento regular dos pacientes e impõem uma pressão adicional sobre o SUS (Ministério da Saúde, 2021; IBGE, 2020).
Em resposta a esse cenário, diversas ações de saúde pública têm sido implementadas com o intuito de mitigar os impactos da doença. Políticas existentes, como a obrigatoriedade do teste do pezinho e a estruturação da Rede Cegonha, visam ao diagnóstico precoce, fundamental para o manejo adequado da patologia. Tais iniciativas, aliadas à ampliação de programas de triagem, à capacitação contínua dos profissionais e à educação em saúde para comunidades em risco, são essenciais para reduzir a morbimortalidade e aliviar a sobrecarga do SUS. Nesse contexto, a atenção básica e a atuação integrada dos profissionais de saúde – entre eles, os biomédicos – desempenham papel crucial na oferta de um cuidado integral e na promoção de melhorias significativas nos indicadores de saúde pública relacionados à anemia falciforme (Ministério da Saúde, 2022; Datasus, 2022).
4.2 DIAGNÓSTICO LABORATORIAL DA ANEMIA FALCIFORME
O diagnóstico da anemia falciforme pode iniciar-se com a análise do hemograma, onde é possível identificar uma anemia de origem hemolítica, geralmente grave. Além disso, a morfologia das hemácias, observadas por microscopia óptica, pode evidenciar a presença de células em forma de foice, característica da doença (Sousa et al., 2021).
Dentre os exames laboratoriais utilizados para confirmação do diagnóstico, destacam-se: hemograma, teste de solubilidade, eletroforese de hemoglobina, teste de falcização, esfregaço sanguíneo, curva de fragilidade osmótica, testes moleculares e, no contexto neonatal, o teste do pezinho. Cada um desses métodos possui características específicas, com vantagens e limitações que devem ser consideradas na prática clínica (Sousa et al., 2021).
4.2.1 Hemograma e Esfregaço Sanguíneo
O hemograma é um dos principais exames automatizados laboratoriais iniciais mais solicitados e utilizados na triagem diante da suspeita de anemia falciforme, pois fornece dados quantitativos e qualitativos essenciais sobre os elementos figurados do sangue: hemácias, leucócitos e plaquetas. Ele permite identificar alterações hematológicas compatíveis com a fisiopatologia da doença, orientando a suspeita diagnóstica e o acompanhamento clínico do paciente (Silva et al., 2020).
Entre os parâmetros hematológicos (Tabela 2) mais relevantes, destacam-se a dosagem da hemoglobina (Hb), que geralmente encontra-se em níveis reduzidos, em decorrência da anemia hemolítica crônica característica da doença falciforme. O hematócrito (Ht) também tende a apresentar valores diminuídos, refletindo a baixa massa eritrocitária circulante. O volume corpuscular médio (VCM) pode se apresentar normal ou discretamente elevado, mas valores baixos sugerem deficiência concomitante de ferro. Já a concentração de hemoglobina corpuscular média (CHCM) permanece, em geral, dentro da normalidade, o que ajuda a diferenciar a anemia falciforme de outras formas de anemias hipocrômicas (Rodrigues et al., 2021).
O índice relacionado à variação do tamanho eritrocitário (RDW), costuma estar frequentemente aumentado (acima de 19%), evidenciando anisocitose, um achado comum na doença devido à constante renovação celular e à hemólise (de Almeida et al., 2017).
A contagem leucocitária pode estar elevada, especialmente durante crises vaso-oclusivas ou processos infecciosos, podendo refletir uma resposta inflamatória sistêmica. Já a elevação de plaquetas tende a mostrar trombocitose, muitas vezes associada ao hiperesplenismo funcional, uma condição comum em pacientes com anemia falciforme crônica (Silva et al., 2020; Rodrigues et al., 2021).
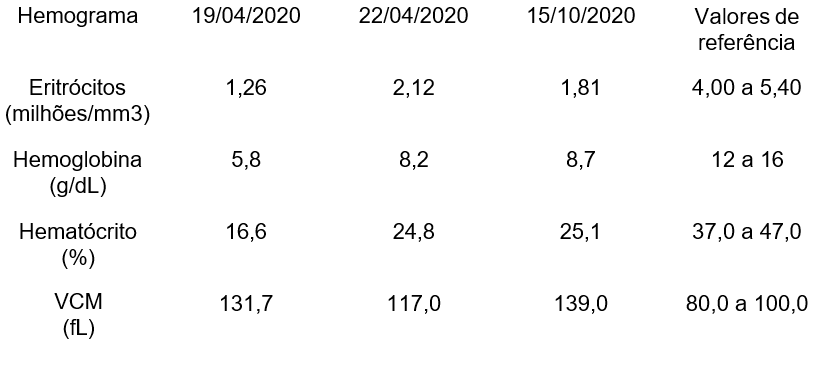

Tabela 2: Características hematimétricas de um hemograma de um paciente com anemia falciforme sem tratamento
Fonte: ALVES et al., (2022)
Além disso, através do hemograma é possível observar a presença de reticulócitos. Refletindo um parâmetro muito importante, através da contagem de reticulócitos, que nesse caso, encontra-se elevada. A reticulocitose indica resposta compensatória da medula óssea à destruição aumentada das hemácias. A contagem pode ser realizada por métodos automatizados ou por microscopia óptica, sendo um marcador indireto da eritropoiese (Martins et al., 2023).
O esfregaço sanguíneo, por sua vez, é fundamental para avaliação morfológica das células sanguíneas. Realizado com a coloração de May-Grünwald-Giemsa ou panótico, esse exame revela alterações típicas da anemia falciforme. As hemácias falcizadas, ou drepanócitos, representam o achado morfológico mais característico, sendo observadas com maior frequência em situações de hipóxia e acidose. Além disso, é comum a presença de policromasia (indicativa de reticulócitos circulantes), células em alvo, esferócitos e corpos de Howell-Jolly, estes últimos associados a perda da função esplênica (Imagem 3) (Martins et al., 2023).
A análise conjunta do hemograma e do esfregaço sanguíneo fornece evidências importantes que, embora não confirmem o diagnóstico por si só, são fundamentais para direcionar a investigação com exames específicos, como a eletroforese de hemoglobina (Ministério da Saúde, 2022).
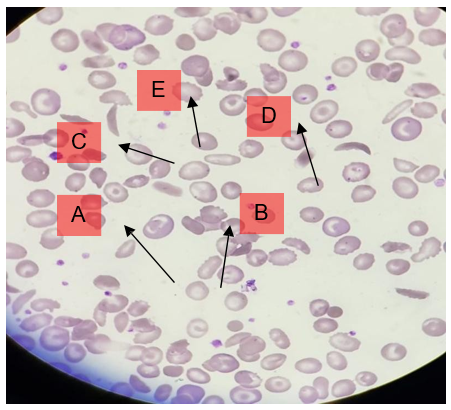
Imagem 3: Esfregaço Sanguíneo apresentando hemácias em alvo (A), esferócitos (B), hemácias falcizadas (C), corpos de Howell-Jolly (D) e policromasia (E)
Fonte: Autoria própria adaptada (2025)ada (2025)
4.2.2 Eletroforese de hemoglobina
A eletroforese de hemoglobina é considerada o principal exame confirmatório para o diagnóstico da anemia falciforme e outras hemoglobinopatias. Trata-se de uma técnica baseada na separação das diferentes frações de hemoglobina presentes no sangue, por meio da migração diferencial dessas moléculas em um campo elétrico, de acordo com sua carga elétrica e peso molecular (Ministério da Saúde, 2022).
Através da coleta de sangue total do paciente, a amostra é encaminhada para a triagem e submetida a eletroforese que irá identificar as diferentes hemoglobinas séricas circulantes. Assim, a amostra é submetida a uma corrente elétrica e a separação das hemoglobinas é baseada nas taxas de migração das moléculas, que se dividem em bandas diferentes de acordo com seu peso molecular (Lemos, 2021).
O exame pode ser realizado em meio alcalino (pH 8,6) ou ácido (pH 6,0), utilizando gel de agarose, acetato de celulose ou outros suportes. No pH alcalino, a hemoglobina A (HbA), A2 (HbA2), fetal (HbF) e S (HbS) apresentam padrões distintos de migração, o que permite sua identificação e quantificação. No entanto, a eletroforese em pH ácido é indicada em situações onde há sobreposição de bandas, como para diferenciar a HbS e HbD ou da HbG, que podem migrar de forma semelhante ao pH alcalino (Silva et al., 2020).
Em indivíduos com anemia falciforme, o exame revela uma predominância da fração de hemoglobina S (HbS), geralmente em homozigose (HbSS). Já em portadores do traço falciforme, observa-se a presença de HbA e HbS em proporções distintas, com predominância de HbA. A eletroforese também permite identificar outras hemoglobinas anormais coexistentes, como HbC, HbD, entre outras (Silva et al., 2020).
A principal vantagem da técnica é sua alta sensibilidade e especificidade na identificação de hemoglobinas variantes. Contudo, há limitações, como a possibilidade de falsos negativos em recém-nascidos devido à predominância de hemoglobina fetal (HbF), o que pode mascarar a presença da HbS. Nesses casos, exames complementares, como testes moleculares ou cromatografia líquida de alta eficiência (HPLC), são indicados para confirmação diagnóstica (Nascimento et al., 2022).
O exame é indicado tanto no contexto neonatal, por meio do teste do pezinho, quanto em crianças, adolescentes e adultos com suspeita clínica ou familiar de hemoglobinopatias. Além do diagnóstico, é útil no monitoramento da doença e na triagem de casais com risco genético, sendo de grande importância em programas de aconselhamento genético e planejamento familiar (Menezes et al., 2023).
4.2.3 Triagem neonatal (Teste do pezinho)
A triagem neonatal, popularmente conhecida como teste do pezinho, é uma das principais estratégias de diagnóstico precoce para doenças genéticas, metabólicas, infecciosas e hematológicas em recém-nascidos (Borges et al., 2019). No Brasil, essa triagem é coordenada pelo Programa Nacional de Triagem Neonatal (PNTN), instituído pelo Ministério da Saúde, com o objetivo de possibilitar a identificação precoce de agravos que podem comprometer o desenvolvimento neuropsicomotor e a qualidade de vida da criança, viabilizando intervenções terapêuticas oportunas e efetivas (Ministério da Saúde, 2021).
O teste consiste na coleta de gotas de sangue do calcanhar do recém-nascido, preferencialmente entre o terceiro e o quinto dia de vida, em papel filtro especial. Esse material é enviado para análise laboratorial, onde são pesquisadas diversas doenças, entre elas a doença falciforme e outras hemoglobinopatias, como o traço falciforme, por meio de técnicas como a eletroforese de hemoglobina (Silva et al., 2020).
Desde 2001, o SUS incorporou a triagem da doença falciforme à rotina do teste do pezinho, ampliando gradualmente a cobertura nacional. A detecção precoce dessa hemoglobinopatia permite o início imediato de cuidados clínicos, imunoprofilaxia, suporte nutricional, orientação familiar e monitoramento contínuo, reduzindo significativamente a morbimortalidade infantil associada à doença (Ministério da Saúde, 2022).
Segundo dados do Sistema de Informações sobre Nascidos Vivos (SINASC), o indicador de cobertura do PNTN atingiu 83,98% em 2017. Esse índice, no entanto, refere-se apenas aos exames realizados na rede pública, não contabilizando os testes realizados em laboratórios da rede privada. Apesar dos avanços, ainda existem desafios relacionados à cobertura universal e à equidade no acesso, especialmente em regiões mais remotas e vulneráveis (Ministério da Saúde, 2022).
4.2.4 Teste de falcização
O teste de falcização, também denominado teste de falcização induzida, é uma técnica laboratorial utilizada como método de triagem para detectar a presença da hemoglobina S (HbS) em eritrócitos. Por ser um exame simples, de baixo custo e rápida execução, é amplamente utilizado em regiões com recursos laboratoriais limitados, especialmente em campanhas de rastreamento populacional e atendimentos de urgência (Ministério da Saúde, 2022).
O princípio do teste baseia-se na capacidade das hemácias contendo HbS de sofrerem falcização – ou seja, assumirem uma forma alongada, semelhante a uma foice – quando expostas a ambientes com baixa tensão de oxigênio (hipóxia). Para induzir essa condição, a amostra de sangue é misturada com uma solução redutora, geralmente metabissulfito de sódio a 2%, e colocada entre lâmina e lamínula. A preparação é então incubada à temperatura ambiente e analisada ao microscópio óptico após 30 minutos a 2 horas. A presença de hemácias falcizadas é sugestiva da presença de HbS (Castro et al., 2024).
Segundo Rocha et al (2020), embora seja útil como triagem inicial, o teste apresenta limitações importantes. Sua sensibilidade e especificidade são moderadas, sendo os resultados suscetíveis à interferência de variáveis técnicas e fisiológicas. Entre os principais fatores que comprometem a acurácia estão:
- Presença de outras hemoglobinas variantes (HbC, HbD, HbE), que podem alterar a morfologia das células.
- Qualidade técnica da amostra: conservação dos reagentes, preparo do esfregaço e padronização da leitura.
- Presença do traço falciforme (HbAS), que pode produzir falcização parcial ou mesmo não induzir alterações visíveis.
- Amostras de recém-nascidos, cuja predominância de hemoglobina fetal (HbF) pode inibir o processo de falcização, mesmo na presença de HbS.
Em virtude dessas limitações, o teste de falcização não deve ser utilizado como exame diagnóstico definitivo. Casos suspeitos devem ser confirmados por técnicas mais específicas e sensíveis, como a eletroforese de hemoglobina, cromatografia líquida de alta eficiência (HPLC) ou análise molecular por PCR, especialmente quando se busca distinguir entre anemia falciforme (HbSS) e traço falciforme (HbAS).
Ainda assim, o teste de falcização mantém seu valor em contextos específicos, como triagens em áreas remotas, situações de urgência clínica ou ambientes com infraestrutura laboratorial limitada, sendo uma ferramenta complementar relevante no rastreamento inicial de pacientes sintomáticos (Silva et al., 2021).
4.2.5 Teste de solubilidade da hemoglobina S
O teste de solubilidade da HbS é um exame de triagem laboratorial utilizado para detectar a presença de HbS em amostras de sangue. O princípio do teste baseia- se na insolubilidade da HbS em soluções redutoras, como o ditionito de sódio, que promove a desoxigenação da hemoglobina. Quando a HbS está presente, ocorre precipitação da proteína, formando uma solução turva (opaca), visualmente perceptível em papel filtro ou tubo de ensaio. Já na ausência da HbS, a solução permanece límpida (Sousa et al., 2021).
Apesar de sua simplicidade, baixo custo e rapidez, esse teste apresenta limitações importantes, especialmente em recém-nascidos, nos quais a alta concentração de hemoglobina fetal (HbF) pode mascarar a presença da HbS, resultando em falsos negativos. Além disso, o teste não diferencia entre indivíduos homozigotos (com doença falciforme) e heterozigotos (portadores do traço falciforme), o que restringe sua aplicabilidade diagnóstica (Oliveira et al., 2020).
Dessa forma, o teste de solubilidade é indicado apenas como triagem inicial em populações de risco, devendo sempre ser complementado por métodos confirmatórios, como a eletroforese de hemoglobina ou testes moleculares, que oferecem maior sensibilidade e especificidade. A interpretação dos resultados também deve considerar dados clínicos, antecedentes familiares e outros exames laboratoriais, como hemograma e contagem de reticulócitos, que ajudam a compor o quadro diagnóstico (Santos et al., 2019).
O uso indiscriminado ou isolado do teste de solubilidade pode atrasar o diagnóstico correto e comprometer a adoção precoce de condutas terapêuticas adequadas. Portanto, sua aplicação deve ser criteriosa e integrada ao protocolo clínico de investigação das hemoglobinopatias (Santos et al., 2019).
Para contornar essas dificuldades, a realização de exames complementares é de suma importância. Hemogramas detalhados, a análise dos índices de reticulócitos e o estudo dos antecedentes familiares que geralmente envolvem a análise do sangue dos pais oferecem indícios mais precisos sobre a presença e a concentração da hemoglobina S. Metodologias moleculares e acompanhamento longitudinal também podem enriquecer o diagnóstico, fornecendo uma abordagem mais abrangente e segura para confirmar a condição e delinear o manejo clínico adequado (Sousa et al., 2021).
4.2.6 Curva de fragilidade osmótica
O Teste de Fragilidade Osmótica (FO), também conhecido como Curva de Fragilidade Osmótica, continua sendo um método de triagem laboratorial amplamente utilizado para avaliar a resistência ou fragilidade dos eritrócitos quando expostos a diferentes concentrações de cloreto de sódio (NaCl). Trata-se de um exame tradicional, simples e de baixo custo, especialmente útil em ambientes onde tecnologias mais avançadas, como a citometria de fluxo, ainda não estão disponíveis de forma ampla no território nacional. O teste consiste em submeter as hemácias a soluções hiposmolares graduadas de cloreto de sódio (NaCl), observando em qual concentração ocorre a lise celular. A integridade da membrana eritrocitária é o principal fator determinante do resultado, sendo que eritrócitos mais frágeis se rompem em soluções com concentrações salinas mais próximas da isotonicidade, enquanto células mais resistentes suportam concentrações menores antes de sofrer hemólise (RBAC, 2021).
Embora historicamente relevante, o teste de FO sofre com baixa precisão e reprodutibilidade devido a fatores técnicos, erros nas diluições salinas, identificação inadequada das amostras, operação manual e leitura subjetiva por espectrofotometria. Essas limitações têm levado laboratórios brasileiros a abandonarem o exame, comprometendo a triagem de anemias hereditárias membranares, como esferocitose, eliptocitose, estomatocitose e piropoiquilocitose (RBAC, 2021).
A fragilidade osmótica apresenta alterações distintas: aumenta com hemólise ocorrendo em concentrações mais elevadas de NaCl em condições como esferocitose hereditária, anemias hemolíticas não-esferocíticas e hemólises adquiridas (por exemplo, envenenamentos); e diminui com hemólise somente em soluções muito diluídas em casos de anemia ferropriva, talassemias, anemia falciforme e doença da hemoglobina C. Entretanto, o teste de FO, que não é diagnóstico isoladamente, deve ser interpretado em conjunto com hemograma, contagem de reticulócitos e análise da morfologia eritrocitária para identificar poiquilocitose e alterações típicas das membranopatias (RBAC, 2021).
4.2.7 Testes Moleculares
Atualmente, modernas técnicas de biologia molecular permitem o diagnóstico rápido e eficiente do gene da HbS em qualquer célula nucleada, de um embrião implantado com cerca de 10 semanas ou em embrião em fase de pré-implantação. A técnica da PCR pode ser realizada em indivíduos recentemente transfundidos e é importante para confirmação diagnóstica e diagnóstico pré-natal (Machado, R.F., 2010).
Por esta técnica tornou-se possível a amplificação do fragmento específico do gene da globina β que contém o sítio de mutação. Apesar de serem técnicas de alta especificidade, os métodos de biologia molecular ainda são caros para serem usados na prática diária. Porém, avanços na metodologia que os tornem mais rápidos e de menor custo certamente trarão vantagens no uso desta tecnologia (Machado, R. F., 2010).
Embora o período de 2015 a 2025 ofereça uma perspectiva contemporânea, a análise da produção acadêmica revela uma precariedade de informações aprofundadas sobre testes moleculares, caracterizando uma lacuna que limita a consolidação do referencial teórico e empírico deste trabalho.
4.3 ATUAÇÃO DO BIOMÉDICO NO DIAGNÓSTICO LABORATORIAL
Nessa perspectiva, o Biomédico atuará como um profissional que atuará nas áreas de ciência e saúde, prestando informações, cuidados aos pacientes e respondendo às dúvidas mais comuns sobre a anemia falciforme, mostrando que um profissional não atuará apenas para realizar exames e testes laboratoriais, mas precisará instruir os indivíduos sobre alterações genéticas e sintomas (de Alcantara et al., 2021).
Nesse sentido, fica evidente a importância de um profissional como o biomédico, que possui um enorme conhecimento multidisciplinar, podendo não só fazer diagnósticos laboratoriais, mas também aconselhar os pacientes sobre as alterações genéticas que estão ocorrendo (de Alcantara et al., 2021).
4.3.1 Competência e atribuições do biomédico nas análises clínicas
O profissional analista clínico tem competência para coletar amostras e realizar todos os tipos de exames de Análises Clínicas, como os processamentos de sangue, análises pré e pós-transfusionais, bem como a análise dos demais fluidos corporais, emitir e assinar os respectivos laudos. Além disso, estes profissionais podem assumir responsabilidade técnica por laboratórios de análises clínicas e estabelecimentos afins. As principais áreas de competência do analista clínico são: Parasitologia, Microbiologia, Bioquímica, Imunologia, Hematologia e Líquidos Corporais (Resolução CFBM nº 378, 2024).
4.3.2 Papel do biomédico na realização, interpretação e validação dos exames
O Biomédico é o profissional responsável por realizar exames que possibilitem o diagnóstico por imagem, elucidar crimes por meio de análises de tecidos na Polícia Federal ou Civil, realizar exames de biologia molecular, pesquisar e desenvolver produtos obtidos por biotecnologias, fazer manipulação de microrganismos para que possam ser industrializados como medicamento e executar exames clínicos em laboratórios e hospitais para ajudar a identificação de agentes causadores de patologias humanas, entre outras funções (CFBM, 2024).
O Biomédico é responsável pela identificação, classificação e estudo dos microrganismos causadores de enfermidades. Ele desenvolve medicamentos e produz vacinas para combatê-las. Faz exames e interpreta os resultados de análises clínicas, para diagnosticar doenças e análises gramatológicas para verificar contaminações em alimentos (CFBM, 2024).
A partir da análise dos artigos científicos, são diversas as causas que levam a erros pré-analíticos. Entre as principais causas apontadas pelos autores tem se: ocorrência na coleta de amostras para análise, falta de seguir os protocolos de coleta de material biológico, o médico tem a obrigatoriedade de informar os cuidados que o paciente precisa ter para coletar amostras biológica (prescrição de jejum, alterações na alimentação bem como na realização de atividades físicas, informar medicamentos que são consumidos pelo paciente ao laboratório), procedimentos realizados antes dos exames de laboratório (solicitação do médico, cadastro do paciente, coleta e transporte de amostras de material biológico) (Morgan et al., 2023).
Durante a coleta ocorrem erros pré-analíticos clássicos (envio de amostras de maneira incorreta, quantidade de amostra insuficiente, conservação no ideal), os erros pré-analíticos podem ocorrer na autocoleta (urina e fezes) pois depende da padronização dos processos de autocoleta, armazenagem e transporte até o laboratório (que deveriam ser instruídos de forma verbal ou escrita ao paciente. Assim, estas são as principais causas de erros pré-analíticos constatados na pesquisa realizada (Morgan et al., 2023).
A análise é de forma sanguínea e tem seu objetivo avaliar a saúde do indivíduo, como por exemplo a anemia falciforme. O hemograma se baseia na mensuração dos níveis de hemácias, que possuem a função de transportar o oxigênio para o corpo, a quantidade de plaquetas e os níveis de leucócitos (MONTEIRO et al,2015).
Na anemia falciforme a hemoglobina é usualmente da ordem de 7 a 8 g/dl, mas com limites mais amplos entre 4 a 11 g/dl (ALVES et al, 2022).
4.3.3. Interação com a equipe multiprofissional
O biomédico integra a equipe multiprofissional ao lado de médicos, enfermeiros, farmacêuticos e outros profissionais, contribuindo para um atendimento de saúde mais seguro e eficaz. Nesse contexto, o profissional não apenas executa e interpreta exames laboratoriais, mas também atua como apoio técnico-científico no esclarecimento de dúvidas e na tomada de decisão clínica. Essa colaboração intensiva entre as áreas permite que a comunicação seja mais eficaz, garantindo que cada integrante exerça suas funções com respeito às suas atribuições específicas e contribuindo para uma estratégia terapêutica integrada (Nichioka & Martins, [s.d.]; Silva et al., 2020).
Por exemplo, em um paciente com suspeita de anemia falciforme, o biomédico pode identificar, por meio de um hemograma e do esfregaço sanguíneo, a presença de hemácias com morfologia alterada – características que sugerem a ocorrência da falcização. Essa análise laboratorial, quando compartilhada de forma clara e tempestiva com a equipe médica, possibilita que o médico confirme a hipótese diagnóstica e inicie o manejo terapêutico adequado, reduzindo riscos e promovendo uma intervenção precoce. Assim, a integração do biomédico à equipe multiprofissional mostra-se imprescindível para a excelência na conduta clínica e na gestão do paciente (Morgan et al., 2023).
4.3.4 Importância da formação acadêmica e da ética profissional
A formação acadêmica do biomédico deve proporcionar uma base sólida de conhecimentos teóricos, técnicos e éticos, capacitando o profissional para uma atuação segura e responsável em todas as etapas do processo laboratorial. Nesse contexto, é fundamental que o ensino desta área enfatiza o sigilo dos dados, a responsabilidade na emissão e interpretação dos resultados e o compromisso contínuo com a qualidade dos serviços prestados, pontos esses que são rigorosamente orientados pelo Código de Ética do Biomédico (CFBM, 2024).
Essa orientação ética não apenas garante a integridade e a confiabilidade dos laudos, mas também promove um ambiente de trabalho pautado na transparência e no respeito aos direitos dos pacientes. Ademais, a constante capacitação, especialmente em áreas em rápida evolução como a hematologia e a genética, é essencial para que o profissional possa incorporar novas tecnologias e metodologias, acompanhando os avanços no diagnóstico das hemoglobinopatias e contribuindo para a melhoria contínua dos processos laboratoriais (Costa & Belo, 2022; de Alcantara et al., 2021).
4.3.5 Protocolos e normas do SUS relacionados ao diagnóstico
Os protocolos e normas estabelecidos pelo Sistema Único de Saúde (SUS) são fundamentais para a consolidação de um diagnóstico laboratorial seguro e eficaz. Nesse contexto, o Programa Nacional de Triagem Neonatal (PNTN) se destaca como uma estratégia imprescindível, pois garante a triagem obrigatória para doenças genéticas, incluindo a doença falciforme, por meio do teste do pezinho. Conforme as diretrizes e manuais do Ministério da Saúde, os exames laboratoriais para hemoglobinopatias são padronizados de modo a assegurar a qualidade e a precisão dos resultados, com atenção especial aos fluxos de atendimento e à integração entre os laboratórios públicos e privados credenciados.
Essa normatização não somente regulamenta a coleta, o processamento e a análise das amostras, mas também impõe a responsabilidade técnica dos profissionais biomédicos, que devem acompanhar e cumprir rigorosamente tais protocolos para garantir a assistência adequada aos pacientes. Assim, a atuação do biomédico torna-se indispensável para a conformidade com as normas do SUS, contribuindo para a detecção precoce e o manejo eficiente das hemoglobinopatias (Ministério da Saúde, 2021; Portaria GM/MS n° 1.369, 2022).
4.4 PERSPECTIVAS E AVANÇOS NO DIAGNÓSTICO DA ANEMIA FALCIFORME
Embora os métodos diagnósticos tradicionais, como o hemograma e eletroforese de hemoglobina, permaneçam fundamentais no diagnóstico da anemia falciforme, os avanços tecnológicos e a expansão da biomedicina molecular têm proporcionado um salto qualitativo nesse campo. Técnicas modernas – como o PCR em tempo real, o sequenciamento genético e a cromatografia líquida de alta performance (HPLC) – ampliam a precisão e a rapidez na identificação de portadores, traços falciformes e outras hemoglobinopatias, oferecendo uma abordagem complementar aos métodos convencionais (Sousa et al., 2021; Santos et al., 2019).
O uso integrado dessas novas metodologias têm permitido a detecção mais eficaz das mutações específicas associadas à doença, contribuindo para um diagnóstico precoce e personalizado. A incorporação de tecnologias de ponta à rotina dos laboratórios clínicos evidencia a importância da atualização constante em biomedicina molecular, promovendo não apenas a melhoria dos processos diagnósticos, mas também o desenvolvimento de estratégias terapêuticas mais direcionadas e eficazes, em consonância com a evolução do conhecimento científico e tecnológico (Oliveira et al., 2020; Martins et al., 2023).
4.4.1 Avanços tecnológicos nos métodos diagnósticos
O método de diagnóstico realizado pelo equipamento de Cromatografia líquida de alta eficiência (HPLC) proporciona a detecção de baixas concentrações de elementos ou substâncias, sendo considerada, então, uma técnica de alta especificidade e sensibilidade. É um procedimento vantajoso, pois pode ser utilizado em análises de compostos não voláteis ou instáveis termicamente no qual a cromatografia a gás não poderia ser a técnica mais adequada (DE JESUS, Gabriel et al, 2022).
O teste point-of-care (POC) trata-se de testagem conduzida próximo ao local de cuidado ao paciente, inclusive em consultórios e locais fora da área técnica de um laboratório, por profissionais de saúde ou por pessoal capacitado pelo Ministério da Saúde e ou Secretarias de Saúde Estaduais e Municipais. Este teste é realizado por meio de um equipamento laboratorial situado fisicamente fora da área de um laboratório clínico. Também chamado Teste Laboratorial Portátil -TLP, do inglês Point- of-care testing – PoCT (RDC nº 36/2015).
4.4.2 Papel da biomedicina em testes moleculares
A biomedicina tem se destacado na aplicação de testes moleculares que complementam os métodos diagnósticos convencionais, contribuindo para a identificação precisa e precoce das hemoglobinopatias. Técnicas como a reação em cadeia da polimerase (PCR) e o PCR em tempo real (qPCR) são fundamentais para detectar mutações no gene da β-globina (HBB), permitindo a identificação de alterações genéticas associadas à anemia falciforme e a outros distúrbios hemoglobinopáticos). De igual importância, o Sequenciamento de Nova Geração (NGS) possibilita a detecção de mutações raras e a identificação de hemoglobinas variantes com alta precisão, sendo especialmente útil em casos de resultados inconclusivos dos exames tradicionais. Além disso, o teste de DNA fetal livre em sangue materno, que se configura como uma abordagem pré-natal não invasiva, tem permitido diagnósticos precoces, ampliando as estratégias de triagem neonatal e proporcionando um melhor acompanhamento do feto em risco (Freitas et al., 2023).
Nesse cenário, essas técnicas moleculares não apenas ampliam a capacidade diagnóstica, mas também funcionam de forma complementar aos exames convencionais, oferecendo subsídios relevantes para uma análise mais detalhada do perfil genético dos pacientes. A integração desses métodos na rotina dos laboratórios potencializa a acurácia dos diagnósticos e favorece o delineamento de estratégias terapêuticas mais direcionadas, especialmente em neonatos e em pacientes com hemoglobinopatias. O papel do biomédico, nesse contexto, é de extrema importância, pois exige uma sólida capacitação em biologia molecular para a execução,
interpretação técnica e validação dos laudos. Este profissional atua como elo entre as inovações tecnológicas do laboratório e a prática clínica, assegurando que os avanços diagnósticos sejam implementados com excelência e contribuindo para a melhoria contínua da assistência à saúde (Freitas et al., 2023).
4.4.3 Desafios e oportunidades para atuação biomédica
Os desafios enfrentados pela atuação biomédica, especialmente no setor de testes moleculares, revelam um cenário marcado por desigualdades e limitações estruturais que impactam diretamente a eficácia do diagnóstico. Em diversas regiões menos favorecidas, observa-se uma desigualdade no acesso aos exames moleculares, decorrente de investimentos insuficientes em infraestrutura e tecnologia por parte do SUS, o que restringe a utilização de técnicas avançadas como a PCR em tempo real (qPCR), o Sequenciamento de Nova Geração (NGS) e os testes não invasivos pré-natais (Ministério da Saúde, 2022).
Essa fragilidade é acentuada pela falta de capacitação de uma parcela dos profissionais para adotar essas metodologias modernas, dificultando a consolidação de protocolos robustos e a padronização dos exames em âmbito nacional (COSTA, VG da; BELO, 2022).
Por outro lado, as oportunidades para a atuação biomédica são robustas e promissoras, impulsionadas pelo crescimento dos laboratórios de biomedicina molecular e pela consolidação dos biomédicos como referência técnica em diagnósticos genéticos e triagens. A expansão das tecnologias e a crescente integração em programas públicos como o PNTN, que promove o diagnóstico precoce e a educação em saúde, abrem espaço para o fortalecimento das estratégias de prevenção e intervenção. Ademais, o potencial de atuação em pesquisa e inovação tecnológica viabiliza o aprimoramento contínuo dos protocolos laboratoriais, gerando condições para a execução de diagnósticos mais precisos e personalizados (COSTA, VG da; BELO, 2022).
Vale ressaltar que o profissional biomédico é reconhecido por sua capacidade técnica para desempenhar atividades que dão suporte ao diagnóstico, por meio de gerenciamento, coordenação, avaliação, controle e execução – atuando tanto como membro quanto como líder de projetos em pesquisas, promoção do bem-estar e ensino superior (Conselho Regional de Biomedicina Região 1, 2025).
Como profissional da saúde, o biomédico deve dominar os conceitos e as estratégias para ser um efetivo promotor de saúde, exercendo práticas e mantendo um diálogo constante com a sociedade, o que reforça a importância de uma formação alinhada às propostas e diretrizes do SUS (COSTA, VG da; BELO, 2022).
5. CONCLUSÃO
A importância da atuação do biomédico no diagnóstico laboratorial da anemia falciforme. Destacou-se o papel fundamental desse profissional, não apenas na realização e interpretação de exames – como o hemograma, o esfregaço sanguíneo, a eletroforese de hemoglobina e os testes moleculares –, mas também na orientação genética e na contribuição para a definição de condutas clínicas adequadas.
Ao longo do estudo, foi possível observar que a atuação técnica e multiprofissional do biomédico, alicerçada em uma formação sólida e em princípios éticos, é essencial para a detecção precoce da doença. Essa atuação impacta diretamente na qualidade de vida dos pacientes e na eficiência dos serviços de saúde, em especial do SUS e de programas como o PNTN.
Os dados analisados reforçam a necessidade de ampliar os investimentos em capacitação de profissionais em biologia molecular e diagnóstico genético, além de promover o acesso a exames de maior complexidade. Também se evidencia a importância de fomentar pesquisas que investiguem o impacto da atuação biomédica em regiões com alta prevalência da anemia falciforme, contribuindo para o aperfeiçoamento dos protocolos clínico-laboratoriais e para a redução dos custos assistenciais associados à doença.
Por fim, conclui-se que a integração entre avanços tecnológicos e o conhecimento especializado do biomédico consolida sua posição estratégica na promoção da saúde e na qualificação do cuidado aos pacientes com anemia falciforme. Tal constatação reforça a urgência de políticas públicas que valorizem essa profissão e fortaleçam o atendimento integral, equitativo e resolutivo no enfrentamento das doenças hematológicas hereditárias no Brasil.
6. REFERÊNCIAS BIBLIOGRÁFICAS
ADAMS, R. J. et al. Prevention of a first stroke by transfusions in children with sickle cell anemia and abnormal results on transcranial Doppler ultrasonography. New England Journal of Medicine, v. 339, n. 1, p. 5–11, 1998. Disponível em: <https://doi.org/10.1056/NEJM1998…>.
Araujo, LAURA. Anemia Falciforme e abordagem laboratorial: uma breve revisão de literatura. Revista Brasileira de Análises Clínicas. DOI: 10.21877/2448- 3877.201700530
ANÁLISE QUALITATIVA DO TESTE DE FRAGILIDADE OSMÓTICA PARA AMOSTRAS PROCESSADAS A FRESCO OU APÓS 24 HORAS DE INCUBAÇÃO A 37º. Revista Brasileira de Análises Clínicas, [S.l.], v. [s.n.], p. [s.p.], s.d.
ANEMIA FALCIFORME: ESTUDO BIBLIOGRÁFICO. 2021. Disponível em: <https://www.ciencianews.com.br/arquivos/ACET/IMAGENS/biblioteca- digital/hematologia/serie_vermelha/anemia_falciforme/4.pdf>. Acesso em: 16 maio 2025.
BORGES, K. M. et al. Avanços e desafios na triagem neonatal no Brasil: uma análise do PNTN. Revista Brasileira de Saúde Materno Infantil, v. 19, n. 3, p. 733–740, 2019.
BRASIL. Ministério da Saúde. Ministério da Saúde reforça a importância da detecção da doença falciforme. 2020.
BRASIL. Ministério da Saúde. Composição do SAES – Triagem Neonatal. Disponível em: <https://www.gov.br/saude/pt-br/composicao/saes/triagem-neonatal>. Acesso em: 16 maio 2025.
BRASIL. Ministério da Saúde. Manual de Normas Técnicas e Rotinas Operacionais do Programa de Triagem Neonatal. Disponível em:<https://bvsms.saude.gov.br/bvs/publicacoes/manual_normas_tecnicas_rotinas_oper acionais_programa_triagem_neonatal.pdf>. Acesso em: 16 maio 2025.
BRASIL. Ministério da Saúde. Atos Normativos. Disponível em: <https://www.gov.br/saude/pt-br/acompanhe-o-ministerio/atos/normativos>. Acesso em: 16 maio 2025.
BRJD. [Artigo eletrônico]. Disponível em: <https://ojs.brazilianjournals.com.br/ojs/index.php/BRJD/article/view/31036/39714>. Acesso em: 16 maio 2025.
CASTRO, J. S. et al. Triagem da anemia falciforme: métodos laboratoriais e desafios diagnósticos. JRG de Estudos Acadêmicos, v. 6, n. 2, p. 89–97, 2024.
COSTA, V. G. da; BELO, M. S. da SP.; GAMARRA, T. P. das N. Artigo sobre profissionais biomédicos e promoção da saúde: uma revisão de escopo. Pesquisa, Sociedade e Desenvolvimento, s.d.
CFBM. Código de ética da profissão de biomédico. Disponível em: <https://cfbm.gov.br/codigo-de-etica-da-profissao-de-biomedico/>. Acesso em: 16 maio 2025.
CFBM. Legislação:Código de ética. Disponível em: <https://cfbm.gov.br/legislacao/codigo-de-etica/>. Acesso em: 16 maio 2025.
CFBM. O que faz o biomédico? Disponível em: <https://cfbm.gov.br/o-que-faz-o- biomedico/#:~:text=O%20Biom%C3%A9dico%20%C3%A9%20o%20profissional,biot ecnologias%2C%20fazer%20manipula%C3%A7%C3%A3o%20de%20microrganism os>. Acesso em: 16 maio 2025.
CFBM. [Site institucional]. Disponível em: <https://cfbm.gov.br/>. Acesso em: 16 maio 2025.
DE ALCÂNTARA, PGA; BENITHÁH, I. da S.; DOS SANTOS, RT. O papel da biomedicina no diagnóstico e aconselhamento genético nos casos de anemia falciforme / O papel da biomedicina no diagnóstico e aconselhamento genético em casos de anemia falciforme. Revista Brasileira de Desenvolvimento, [S. l.], v. 6, pág. 56590–56605, 2021. DOI: 10.34117/bjdv7n6-188. Disponível em: https://ojs.brazilianjournals.com.br/ojs/index.php/BRJD/article/view/31036. . Acesso em: 31 maio 2025.
DE ALMEIDA, Renata Araujo; BERETTA, A. L. R. Z. Anemia Falciforme e abordagem laboratorial: uma breve revisão de literatura. Revista brasileira de análises clínicas, v. 49, n. 2, p. 131-4, 2017.f
DE JESUS, João Gabriel Roque et al. Utilização de cromatografia líquida de alta eficiência para o diagnóstico laboratorial. Caderno de Graduação – Ciências Biológicas e da Saúde – UNIT-SERGIPE, v. 7, n. 2, p. 11–11, 2022.
FMU. Competências e Atribuições do Biomédico nas Análises Clínicas [Resolução CFBM nº 378, de 01 de abril de 2024]. Disponível em: <https://arquivo.fmu.br/prodisc/biomedicina/acn.pdf>. Acesso em: 16 maio 2025.
FREITAS, M. F. et al. Aplicações da biomedicina molecular no diagnóstico das hemoglobinopatias. J Mol Diagn Clin Lab, 2023.
GLADWIN, M. T.; VICHINSKY, E. Pulmonary complications of sickle cell disease. New England Journal of Medicine, v. 359, n. 21, p. 2254–2265, 2008.
HIGGS, D. R.; VICKERS, M. A. Hemoglobinopathies. In: HEMATOLOGY: Basic Principles and Practice. 7ª ed. Elsevier, 2018, p. 639–662.
LOPES, A.; DANTAS, M. T.; LADEIA, A. M. T. Prevalência das complicações cardiovasculares nos indivíduos com anemia falciforme e outras hemoglobinopatias: uma revisão sistemática. Arquivos Brasileiros de Cardiologia, v. 119, p. 893–899, 2022.
LUCIANO DA COSTA, J. .; GUIMARÃES DUARTE DOMÍNGUEZ, A.e/; INEZ MONTAGNER, M. .; ÂNGELO MONTAGNER, M. . TRANSPLANTE DE MEDULA ÓSSEA EM PESSOAS COM DOENÇA FALCIFORME: UMA REVISÃO BIBLIOGRÁFICA. Hegemonia, [S. l.], n. 27, p. 30, 2019. DOI:
10.47695/hegemonia.vi27.282. Disponível em: https://revistahegemonia.emnuvens.com.br/hegemonia/article/view/282. Acesso em: 22 maio. 2025.
MARTINS, L. A. et al. Alterações morfológicas no esfregaço de sangue periférico em pacientes com doença falciforme. Hematology, Transfusion and Cell Therapy, v. 45, n. 3, e20230045, 2023.
MANTADAKIS, E. et al. Priapism in sickle cell disease. Blood Reviews, v. 39, p. 100634, 2020.
MENEZES, P. F. et al. Utilização da eletroforese e técnicas moleculares no diagnóstico de hemoglobinas variantes. Revista de Patologia Tropical, v. 52, n. 1, p. 1–9, 2023.
MINISTÉRIO DA SAÚDE. Protocolo Clínico e Diretrizes Terapêuticas da Anemia Falciforme. Brasília: Ministério da Saúde, 2019.
MINISTÉRIO DA SAÚDE. Ministério da Saúde reforça a importância da detecção da doença falciforme. 2020.
MINISTÉRIO DA SAÚDE. Protocolo Clínico e Diretrizes Terapêuticas – Doença Falciforme. Brasília: MS, 2021.
MINISTÉRIO DA SAÚDE. Protocolo Clínico e Diretrizes Terapêuticas – Doença Falciforme. Brasília: Ministério da Saúde, 2022.
MINISTÉRIO DA SAÚDE. Programa Nacional de Triagem Neonatal – Resultados e Indicadores. 2022. Disponível em: <http://www.gov.br/saude>. Acesso em: 16 maio 2025.
MINISTÉRIO DA SAÚDE. Protocolo clínico e diretrizes terapêuticas: Doença Falciforme. Brasília: Ministério da Saúde, 2022.
MINISTÉRIO DA SAÚDE. Diretrizes para o cuidado integral da pessoa com doença falciforme no Brasil. 2022.
MINISTÉRIO DA SAÚDE. Protocolo Clínico e Diretrizes Terapêuticas: Doença Falciforme. Brasília: MS, 2023.
Ministério da Saúde DOENÇA FALCIFORME PORTARIA CONJUNTA SAES/SECTICS/MS Nº 16, DE 01 DE NOVEMBRO DE 2024 <https://www.gov.br/conitec/pt-br/midias/protocolos/resumidos/pcdt-resumido- doenca-falciforme>. Acesso em: 09 de junho de 2025.
NASCIMENTO, G. H. et al. Avanços no diagnóstico laboratorial das hemoglobinopatias: enfoque na eletroforese e HPLC. Revista Saúde e Pesquisa, v. 15, n. 3, p. 355–362, 2022.
OLIVEIRA, M. A. B. et al. Avaliação da eficácia do teste de solubilidade para hemoglobina S em comparação com métodos confirmatórios. Revista de Patologia Tropical, v. 49, n. 3, p. 231–237, 2020.
PEREIRA, L. R. et al. Perfil hemolítico de pacientes com anemia falciforme em uso de hidroxicarbamida. Hematology, Transfusion and Cell Therapy, v. 45, p. S69, 2023.
PIEL, F. B.; STEINBERG, M. H.; REES, D. C. Sickle cell disease. The New England Journal of Medicine, v. 376, n. 16, p. 1561–1573, 2017. Disponível em: <https://doi.org/10.1056/NEJMra1510865>.
PORTAL HOSPITAIS BRASIL. A importância da atuação do biomédico na equipe multiprofissional. Disponível em:<https://portalhospitaisbrasil.com.br/a-importancia- da-atuacao-do-biomedico-na-equipe-multiprofissional/>. Acesso em: 16 maio 2025.
REVISTA AMBIENTE ACADÊMICO. [Artigo – Competências e Atribuições do Biomédico nas Análises Clínicas]. Disponível em: <https://multivix.edu.br/wp- content/uploads/2022/05/revista-ambiente-academico-v07-n02-artigo07.pdf>. Acesso em: 16 maio 2025.
REES, D. C.; WILLIAMS, T. N.; GLADWIN, M. T. Sickle-cell disease. The Lancet, v. 376, n. 9757, p. 2018–2031, 2010. Disponível em: <https://doi.org/10.1016/S0140- 6736(10)61029-X>.
RODRIGUES, A. T. et al. Aspectos hematológicos na anemia falciforme: uma revisão integrativa. Revista Saúde (Santa Maria), v. 47, n. 1, p. 1–9, 2021.
ROCHA, D. F. et al. Aplicabilidade do teste de falcização como triagem inicial em populações vulneráveis. Revista Saúde e Biotecnologia, v. 18, n. 3, p. 95–102, 2020.
SANTOS, E. J. et al. Limitações do teste de solubilidade para triagem da anemia falciforme em neonatos. Revista Brasileira de Hematologia e Hemoterapia, v. 41, n. 2, p. 140–145, 2019.
SERJEANT, G. R. Sickle-cell disease. The Lancet, v. 381, n. 9861, p. 1837–1849, 2013. Disponível em: <https://doi.org/10.1016/S0140-6736(13)61029-4>.
SERJEANT, G. R. The natural history of sickle cell disease. Cold Spring Harbor Perspectives in Medicine, v. 3, n. 10, a011783, 2013.
SCIELO. [Artigo eletrônico]. Disponível em: <https://www.scielo.br/j/rsp/a/PM8YPvMJLQ4y49Vxj6M7yzt/>. Acesso em: 16 maio 2025.
SILVA, D. M. et al. Importância da triagem neonatal para o diagnóstico precoce da doença falciforme: revisão integrativa. Revista de Enfermagem e Saúde, v. 12, n. 2, p. 1–8, 2020.
SILVA, G. M.; SANTOS, T. R. Testes laboratoriais na triagem de hemoglobinopatias: abordagem prática e limitações. Revista Brasileira de Análises Clínicas, v. 53, n. 2, p. 141–147, 2021.
SILVA, L. M. et al. Métodos laboratoriais aplicados à detecção de hemoglobinopatias: uma revisão integrativa. Revista Brasileira de Hematologia e Hemoterapia, v. 42, n. 2, p. 124–130, 2020.
SILVA, R. C. et al. Hemograma como ferramenta no monitoramento da anemia falciforme. Revista Brasileira de Análises Clínicas, v. 52, n. 2, p. 187–194, 2020.
SOUZA, Janaina Martins et al. Fisiopatologia da anemia falciforme. Revista Transformar, v. 8, n. 8, p. 162–178, 2016.
SOUSA, T. M. et al. Advances in laboratory screening for sickle cell disease: a molecular approach. Hematology, Transfusion and Cell Therapy, 2024.
TEIXEIRA, Rozana Santos; LADEIA, Ana Marice. Disfunção endotelial na anemia falciforme: uma agressão vascular pela ativação do endotélio. In: Anemia Falciforme e Comorbidades Associadas na Infância e na Adolescência, 2020, p. 4.
WARE, R. E. Sickle cell disease. The Lancet, v. 390, n. 10091, p. 311–323, 2017. Disponível em: <https://doi.org/10.1016/S0140-6736(17)30193-9>.
