REGISTRO DOI: 10.69849/revistaft/dt10202505311602
Marcus Alexandre Borges Pires1,2*
ABSTRACT
This study observed the growth of juvenile Minuca rapax crabs reared in the laboratory up to the 10th juvenile instar. Juveniles were obtained after larval rearing and a total of 50 specimens were used for growth analysis, by measuring the width (L.C.) and length of the cephalothorax (C.C.). The crabs were kept individually in plastic containers containing sandy substrate and filtered seawater, without aeration and under constant conditions of salinity 30, temperature 26°C, pH 8.0 and photoperiod (12:12 h/light:dark). Newly hatched Artemia nauplii were used exclusively as food. The crabs reached the 10th juvenile instar after 184 days of cultivation, showing a reduction in survival rate over successive molts. The growth of M. rapax was continuous, with a strong positive correlation between C.C. and L.C., indicating a linear increase in these variables. A variation was also observed in the duration of the inter-moulting period of the respective instars. The average duration was shorter for the initial instars (4.9 ± 2.8) and extended throughout development, with the highest values in the most advanced instars (16.2 ± 7) days. The ratio between C.C. and L.C. showed a reduction as the juveniles grew, indicating that there was a change in the morphology of the cephalothorax during growth. The availability and type of food, as well as rearing conditions, can be determining factors in the growth of estuarine crab species in the laboratory.
Keywords: Fiddler crab, development, juvenile, neotropical species.
RESUMO
Neste estudo foi observado o crescimento de caranguejos juvenis Minuca rapax cultivado em laboratório até o 10º instar juvenil. Juvenis foram obtidos após o cultivo larval, sendo utilizado um total de 50 espécimes para as análises do crescimento, por meio da mensuração da largura (L.C.) e comprimento do cefalotórax (C.C.). Os caranguejos foram mantidos individualmente em recipientes plásticos contendo substrato arenoso e água do mar filtrada, sem aeração e em condições constantes de salinidade 30, temperatura 26°C, pH 8,0 e em regime de fotoperíodo (12:12 h/claro: escuro). Náuplios de Artemia recém eclodidos foram utilizados exclusivamente como alimento. Os caranguejos atingiram o 10º instar juvenil após 184 dias de cultivo, apresentando uma redução na taxa de sobrevivência ao longo das mudas sucessivas. O crescimento de M. rapax mostrou-se contínuo, apresentando uma forte correlação positiva entre o C.C. e L.C., o que indicou um aumento linear dessas variáveis. Observou-se ainda uma variação na duração do período entre-mudas dos respectivos instares. A duração média foi menor para os ínstares iniciais (4,9 ± 2,8) e prolongou-se ao longo do desenvolvimento, apresentando os maiores valores nos ínstares mais avançados (16,2 ± 7) dias. O quociente entre o C.C. e L.C. apresentou uma redução no decorrer do crescimento dos juvenis, indicando a existência de uma mudança na morfologia do cefalotórax durante o crescimento. A disponibilidade e o tipo de alimento, bem como as condições de cultivo podem ser fatores determinantes no crescimento de espécies de caranguejos estuarinos em laboratório.
Palavras-chave: Caranguejo violinista, desenvolvimento, juvenil, espécie neotropical.
1. INTRODUÇÃO
Os crustáceos possuem um padrão de crescimento bastante característico e bem diferente dos outros animais. O aumento no tamanho, volume e peso corporal destes organismos somente ocorre após um ciclo de mudas frequentes separadas por diferentes períodos de desenvolvimento e antes da calcificação do exoesqueleto (BERTALANFFY, 1938; HANCOCK & EDWARDS, 1967; NIKOLSKII, 1969; SANTOS, 1978; MACHILINE, 1977; HARTNOLL, 1982; LUPPI et al., 2000). A muda (ou ecdise) pode ser descrita como um processo biológico natural de eliminação e substituição do exoesqueleto antigo por um novo tegumento, fazendo parte do crescimento e estando ligado ao processo de reprodução em algumas espécies (HARTNOLL, 1982).
Estudos sobre o crescimento em crustáceos mostram-se de grande importância para conhecimento da biologia destes organismos. Tal importância pode ser comprovada pelo grande número de trabalhos realizados nos últimos 20 anos (HARTNOLL, 2001). Os crustáceos possuem características peculiares, as quais facilitam o estudo de seu crescimento, como por exemplo, presença de um exoesqueleto rígido que facilita as mensurações do organismo, evidências do processo de muda (carapaça antiga também chamada de exúvia) e diferenças na medida do incremento no tamanho entre juvenis e adultos ou entre espécimes de diferentes sexos (HARTNOLL, 1978). Além disso, algumas características morfológicas obtidas durante o desenvolvimento permitem a identificação do tamanho em que uma determinada espécie atinge a maturidade ou o dimorfismo sexual (HARTNOLL, 1982).
Segundo Hartnoll (1982), o incremento no tamanho e o período de desenvolvimento entre mudas consecutivas proporcionam relações que determinam a taxa de tempo do crescimento. Tais variáveis ainda poderiam indicar a idade de um indivíduo, porém, a determinação da idade em crustáceos é dificultada pela ausência de estruturas rígidas persistentes, as quais possuiriam os registros de uma determinada idade e, portanto, sendo possível sua mensuração, assim como os otólitos nos peixes, anéis ou linhas de crescimento nas conchas de moluscos (HARTNOLL, 2001; RODRIGUES & D’INCAO, 2006).
O padrão de crescimento nos caranguejos pode ser afetado por vários fatores ambientais externos, sendo que a temperatura, a disponibilidade, o tipo e a qualidade do alimento são os fatores mais importantes (HARTNOLL, 1982, 2001; VON HAGEN, 1987). Os efeitos da temperatura e tipos de alimento sobre o crescimento em crustáceos em condições de laboratório foram evidenciados em vários trabalhos por diversos autores (revisado por HARTNOLL, 2001). Ambos podem apresentar uma significativa variação espacial e temporal no ambiente e poderiam ser decisivos para o melhoramento das técnicas de cultivos das espécies em laboratório.
Muitos trabalhos objetivaram verificar o tamanho específico em que os indivíduos atingem a maturidade ou o dimorfismo sexual (MANTELATTO & FRANSOZO, 1996; PINHEIRO & FRANSOZO, 1998; BENETTI & NEGREIROS-FRANSOZO, 2004; CASTIGLIONI & NEGREIROS-FRANSOZO, 2004; CASTIGLIONI et al., 2004; MASUNARI & DISSENHA, 2005).
Os trabalhos mencionados acima tiveram um enfoque sobre o crescimento relativo, o qual proporciona apenas estimativas sobre os padrões de mudanças corporais que ocorrem ao longo do crescimento, já que não se conhece a idade real dos indivíduos coletados em campo para as análises. Em contraste, estudos sobre o crescimento absoluto de caranguejos obtidos e mantidos sob condições de laboratório fornecem dados mais confiáveis e precisos sobre cada parâmetro utilizado nas análises, uma vez que a idade de cada indivíduo é registrada e, portanto, torna-se possível a correlação do tamanho e a idade durante o desenvolvimento. No entanto, estudos sobre o crescimento absoluto em caranguejos ainda são bastante raros.
Adicionalmente, estudos realizados com a fase juvenil de caranguejos decápodes são relativamente escassos quando comparados com o grande número de trabalhos realizados com espécimes adultos. Somente poucas espécies de caranguejos foram consideradas para o estudo do crescimento juvenil. Dentre estas podemos citar: Panopeus austrobesus, P. herbstii (HEBLING et al., 1982), Sesarma rectum, Eurypanopeus abbreviatus, Eriphia gonagra (NEGREIROS FRANSOZO & FRANSOZO, 1991), Menippe nodifrons (FRANSOZO et al., 1998), M. mercenaria (TWEEDALE et al., 1993), Hyas coarctatus, Inachus dorsettensis (HARTNOLL & BRYANT, 2001), C. granulata (RIEGER & NAKAGAWA, 1995); Eurytium limosum (GUIMARÃES et al., 2005). Para as espécies de caranguejos violinistas destacam-se: L. panacea (NOVAK & SALMON, 1974), A. lactea (MURAOKA, 1976), M. pugilator, M. pugnax (O’CONNOR, 1993) e U. maracoani (HIROSE & NEGREIROS-FRANSOZO, 2008). O caranguejo violinista M. rapax é uma espécie semi-terrestre que habita as florestas situadas nas porções mais altas da zona entre-marés dos manguezais e estuários (KOCH & WOLFF, 2002; KOCH et al., 2005). Esta espécie pode ser encontrada ao longo da linha costeira da Flórida, Golfo do México, Antilhas, da Venezuela e do Brasil (Pará até Santa Catarina) (MELO, 1996). A estação reprodutiva da espécie ocorre principalmente durante o período de estiagem de chuva nos manguezais do Norte do Brasil (KOCH et al., 2005). Aspectos como crescimento, maturidade fisiológica, estrutura populacional e biologia reprodutiva desta espécie foram estudados por alguns autores no litoral Sudeste do Brasil (CASTIGLIONI & NEGREIROS FRANSOZO, 2004).
2. OBJETIVOS
2.1. Objetivo Geral
Analisar o crescimento e o desenvolvimento juvenil do caranguejo chama-maré M. rapax, do primeiro ao décimo instar juvenil, cultivado sob condições de laboratório.
2.2. Objetivo Específicos
Analisar,
(i) A taxa de sobrevivência dos juvenis ao longo do cultivo;
(ii) O período de desenvolvimento entre mudas consecutivas;
(iii) O percentual de incremento e o incremento absoluto no tamanho após cada muda sucessiva.
(iv) Verificar a relação morfométrica entre o comprimento (C.C.) e a largura do cefalotórax (L.C) e a relação entre (L.C) e a idade dos juvenis.
3. MATERIAL E MÉTODOS
3.1. Água para o cultivo
A água do mar (salinidade 35), utilizada para o cultivo das larvas e dos caranguejos juvenis de M. rapax, foi coletada através de barco a 35 km da região costeira da península bragantina, (Norte do Brasil). Após a coleta, a água foi filtrada (Filtro Eheim), esterilizada utilizando-se um sistema ultravioleta (Gehaka) e posteriormente foi armazenada em tanques (500 L) com aeração constante no laboratório. A água deionizada foi utilizada para diluição da água do mar. A salinidade foi mensurada com a utilização de um refratômetro de salinidade (Atago).
3.2. Condições de cultivo das larvas e juvenis
As larvas de M. rapax foram obtidas de uma fêmea ovígera com 2cm de largura de cefalotórax coletada em janeiro/2023 sendo capturada, durante a maré baixa nos bancos lamosos de um canal de maré no manguezal do estuário do Rio Caeté, Nordeste do Estado do Pará (Furo Grande) – (53° 09’ S e 46° 39’ W). Após a captura, a fêmea foi imediatamente transportada ao Laboratório de Carcinologia do Campus da Universidade Federal do Pará, onde foi cuidadosamente lavada com água salgada. Posteriormente a fêmea foi acondicionada em um aquário com 5 litros de água do mar filtrada com salinidade 30 até o momento da liberação larval.
Após a eclosão, as larvas foram cultivadas (densidade 20 larvas/recipiente) em recipientes de plástico (com 250 mL de água do mar), sem aeração e em condições constantes de salinidade 30, temperatura (26°C), pH (média 8,0) e em regime de fotoperíodo (12:12 h / luz:escuro) até o primeiro instar de caranguejo juvenil. Os valores de pH e temperatura foram obtidos utilizando-se um pHmetro (TOA, HM 119-HOA, precisão 0,01) e um termômetro (precisão 0,1 °C), respectivamente. A água do cultivo foi renovada a cada 3 – 4 dias. As larvas foram alimentadas diariamente com rotíferos Brachionus plicalis e náuplios recém-eclodidos de Artemia (a partir do 3° estágio). Microalgas Dunaliella sp e Thalassiosira sp.
Após o desenvolvimento larval, 50 caranguejos foram escolhidos e cultivados individualmente em recipientes plásticos (150 mL de água do mar), até o décimo ínstar juvenil. As condições de salinidade, temperatura, pH e fotoperíodo foram semelhantes ao cultivo das larvas.
Os juvenis foram alimentados exclusivamente com náuplios de Artemia (10 náuplios /mL). Areia fina, coletada na praia, foi utilizada como substrato para os juvenis. A água do cultivo e o substrato arenoso foram renovados a cada 3 dias para alcançar melhor qualidade no cultivo. Diariamente os juvenis foram monitorados quanto à mortalidade e muda dos respectivos instares. A exúvia de cada instar foi coletada, logo após a muda, e acondicionada em frascos com glicerol (álcool + glicerina, 1:1) para conservação.
Posteriormente, as exúvias foram mensuradas sob uma lupa estereoscópica (Leica MZ 75) com uma ocular acoplada e graduada, para obtenção das variáveis morfométricas (comprimento e largura do cefalotórax) de cada instar juvenil (Fig. 1).
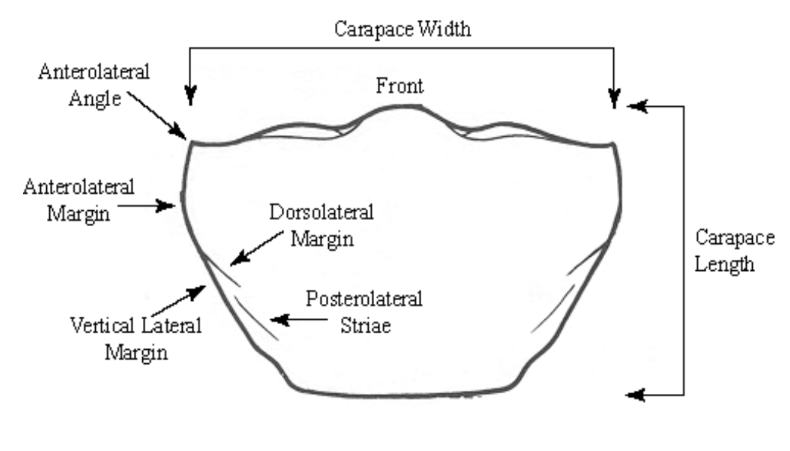
3.3. Análise dos dados
Ao longo do cultivo, foram obtidos dados referentes à sobrevivência e o período entre – mudas dos caranguejos em cada instar. A largura do cefalotórax (L.C.) foi considerada como variável independente ou de referência (x) por ser a medida de maior amplitude, além de ser também a dimensão mais representativa do tamanho geral do organismo (HARTNOLL, 1982). Esta variável foi utilizada para calcular o percentual de incremento e o incremento absoluto no tamanho após cada muda consecutiva.
O percentual de incremento no tamanho por muda (% I.M.) foi estimado por meio da seguinte fórmula (i), segundo López e Rodriguez (1998):

O incremento absoluto do tamanho (I.A.) após a muda de cada instar juvenil, foi obtido utilizando-se a seguinte equação (ii), segundo Luppi et al. (2004):

A relação morfométrica entre o comprimento (C.C.) e a largura do cefalotórax (L.C.) ao longo do desenvolvimento juvenil foi obtida por meio de regressão simples, assim como também a relação entre essas variáveis e os sucessivos ínstares. O quociente entre as dimensões corporais (C.C./L.C.) foi calculado como índice relativo de crescimento em cada instar juvenil, para verificar a existência de mudanças morfológicas no cefalotórax ao longo do crescimento dos juvenis.
4. RESULTADOS
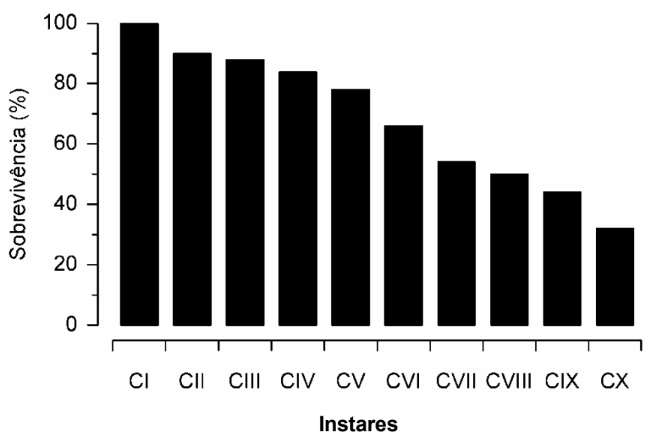
4.1. Redução na sobrevivência ao longo dos sucessivos instares.
A taxa de sobrevivência dos caranguejos juvenis de M. rapax apresentou uma redução ao longo dos sucessivos ínstares cultivados em laboratório (Fig. 2). Essa redução na sobrevivência tornou-se mais evidente a partir do instar VI (Fig. 2). Após 184 dias de cultivo, a taxa de sobrevivência dos juvenis até o instar X foi relativamente baixa (32%), considerando o número de espécimes inicialmente cultivados (Fig. 2).
4.2. Período de desenvolvimento entre mudas:
O período entre-mudas não apresentou um padrão muito claro ao longo dos sucessivos ínstares (Fig. 3). No entanto, ainda foi possível observar uma diferença no aumento da duração do desenvolvimento entre os instares iniciais (CI e CII) e os mais avançados (CIII – CX), sendo mais evidente entre os instares CII e CIII, com 4,9 ± 2,8 e 16,2 ± 7 dias, respectivamente (Fig. 3). Como exemplo desse padrão inconsistente, podemos citar o desenvolvimento dos instares CIII, CV e CVIII, o qual foi bem mais prolongado comparado aos instares CIV, CVI e CVII, os quais tiveram uma duração ao redor de 14 dias (Fig. 3). Os instares CIX e CX tiveram os maiores períodos de desenvolvimento comparados aos instares juvenis anteriores, com 25,5 ± 10,2 e 22,8 ± 7,8 dias, respectivamente (Fig. 3).

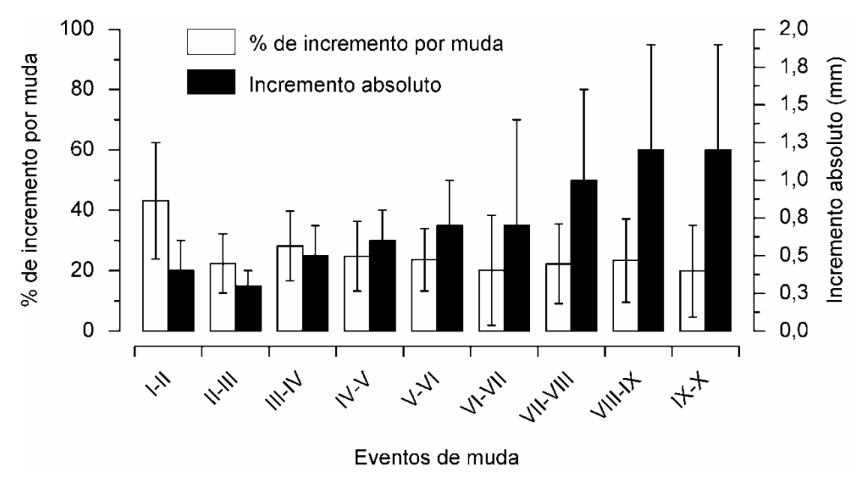
4.3. A porcentagem e a relação de incremento:
A porcentagem de incremento no tamanho também não apresentou um padrão muito consistente ao longo das sucessivas mudas (Fig. 4). Após a muda do primeiro para o segundo instar juvenil, observou-se um aumento de quase a metade do tamanho do animal (43,2 ± 19,3%) (Fig. 4), sendo que o aumento no tamanho foi bem menor após os demais eventos de muda, apresentando porcentagens entre 20 e 28% de incremento (Fig. 4).
Em relação ao incremento absoluto, observou-se um aumento gradual no tamanho (L C.) ao longo dos sucessivos eventos de muda entre os instares juvenis (Fig. 4). Entretanto, observaram-se duas exceções com relação a esse padrão: (1) não houve um aumento no tamanho após o evento de muda VI – VII, com média de 0,7 ± 0,7 mm, o qual foi similar ao incremento após a muda V – VI; e (2) não se registrou acréscimo no tamanho após a muda IX – X, apresentando média similar ao evento de muda anterior (VIII – IX), com 1,2 ± 0,7 mm (Fig. 4).
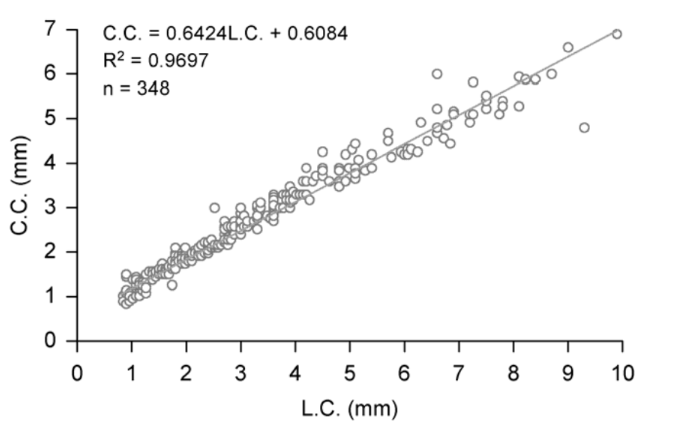
4.4. A relação morfométrica entre o comprimento (CC) e (LC) do cefalotórax.
A relação morfométrica entre o comprimento (C.C.) e a largura do cefalotórax (L.C.) apresentou uma forte correlação positiva, indicando um crescimento linear dessas variáveis ao longo do desenvolvimento juvenil (Fig. 5). A equação da função linear e o coeficiente de determinação estão expressos no gráfico da Fig. 5.
A relação entre a largura do cefalotórax (L.C.) e a idade dos caranguejos juvenis, também apresentou uma correlação positiva, demonstrando um aumento da variável morfométrica com o decorrer do desenvolvimento juvenil ao longo dos dias de cultivo, podendo ser expressa pela equação linear localizada no gráfico da Fig. 6. A análise dos pontos de dispersão mostrou que as medidas dos juvenis (L.C.) nos ínstares iniciais estão aglomeradas no gráfico e dispersas nos ínstares mais avançados (Fig. 6). Esse padrão ocorreu devido a um grande número de espécimes com tamanhos semelhantes ou aproximados nos ínstares iniciais, ao contrário dos mais desenvolvidos, os quais apresentaram tamanhos variados, mesmo para aqueles indivíduos pertencentes ao mesmo ínstar juvenil e, portanto, com mesma idade.
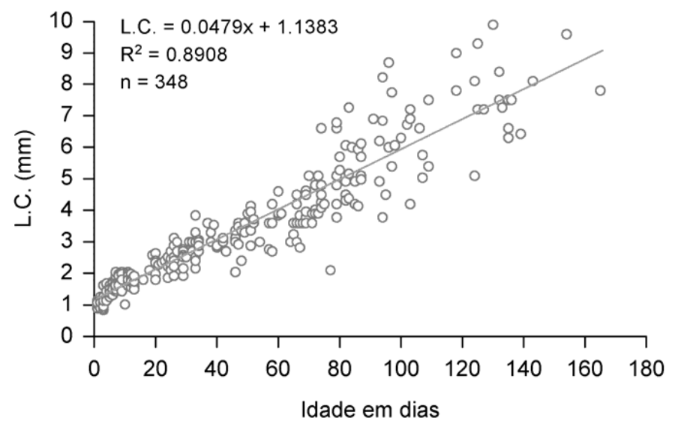
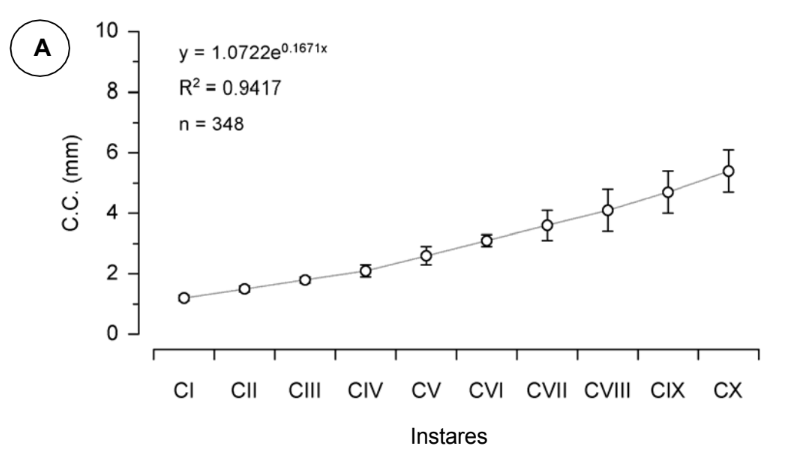
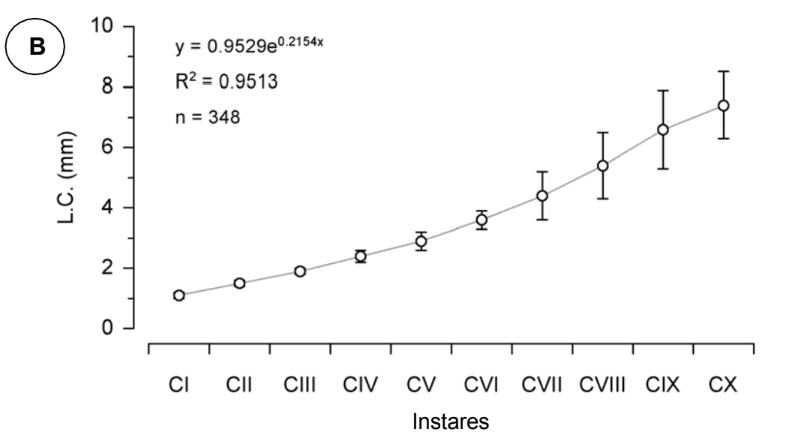
Ao se plotar os pontos de dispersão referentes aos dados do comprimento (C.C.) e largura do cefalotórax (L.C.), verificou-se que estas variáveis morfométricas apresentaram um aumento exponencial de acordo com o desenvolvimento e muda dos juvenis (Fig. 7). Logo, a função exponencial, cujas respectivas equações e coeficientes de determinação estão expressos nos gráficos A e B da Fig. 7, foi a que melhor descreveu a relação entre o tamanho do cefalotórax (comprimento e largura) e os instares juvenis CI a CX. Assim, o tamanho médio (C.C. e L.C.) de cada instar juvenil pode ser observado nos gráficos A e B (Fig. 7). O comprimento médio do cefalotórax variou de 1,2 ± 0,1mm, observado para o instar CI, a 5,4 ± 0,7 mm, registrado para o instar CX (Fig. 6A), enquanto que a largura média apresentou uma variação de 1,1 ± 0,1 a 7,4 ± 1,1 mm, observado para os instares CI e CX, respectivamente (Fig. 7B).
4.5. A análise da relação entre o comprimento e largura da carapaça.
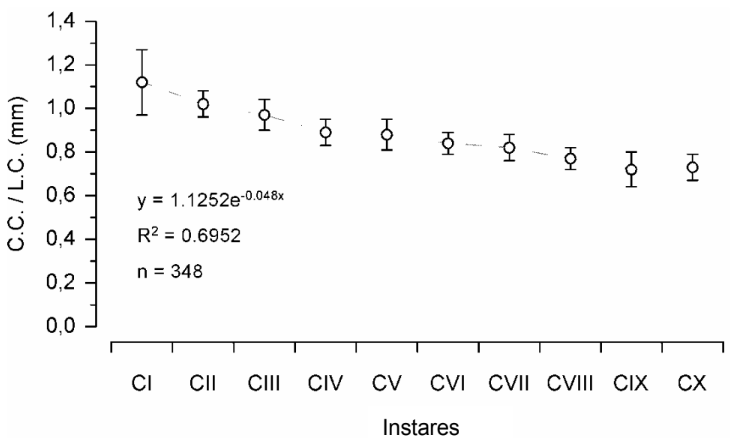
A análise do quociente entre o comprimento e a largura do cefalotórax (C.C./L.C.) dos caranguejos nos respectivos instares, mostrou que houve mudanças morfométricas ao longo do desenvolvimento até o décimo ínstar juvenil.
A maioria dos caranguejos no primeiro e no segundo instar juvenil apresentou um cefalotórax mais longo do que largo (C.C. > L.C.), sendo que essa relação foi mais acentuada no instar CI (C.C./L.C.= 1,12 ± 0,15 mm) do que no instar CII (C.C./L.C.= 1,02 ± 0,06 mm) (Fig. 8). Para o instar CIII, tanto o comprimento quanto a largura foram aproximados (C.C./L.C.= 0,97 ± 0,07 mm) (Fig. 8). No entanto, esse padrão morfométrico observado nos ínstares iniciais foi revertido nos ínstares subsequentes do desenvolvimento, os quais apresentaram um cefalotórax muito mais largo do que longo (C.C. < L.C.) o que levou a uma diminuição do C.C./ L.C. ao longo do crescimento juvenil (Fig. 8).
Quando os pontos de dispersão foram plotados no gráfico, observou-se um padrão exponencial de mudança morfométrica no decorrer do desenvolvimento dos caranguejos, cuja equação e o coeficiente de determinação estão expressos na Fig. 8.
5. CONSIDERAÇÕES FINAIS
No presente estudo os juvenis de M. rapax apresentaram uma maior sobrevivência durante os cinco primeiros instares, porém a partir do sexto instar houve uma redução acentuada e ao término do décimo e último instar a sobrevivência foi de apenas 32%, uma porcentagem muito baixa comparado ao número de indivíduos que iniciaram o cultivo.
Este fato provavelmente ocorreu devido a dieta ofertada durante o período de cultivo, na qual possivelmente surgiram dificuldades para obtenção de cálcio e suplementos orgânicos necessários para o endurecimento do novo tegumento (ADIYODI & ADIYODI, 1970), podendo está relacionado à quantidade insuficiente de alimento ou de nutriente na dieta dos juvenis durante o experimento (HARTNOLL, 1982) tanto que logo após a ecdise os juvenis mesmo alimentados comiam as mudas, estas observações reforçam a importância do papel da alimentação no crescimento e evidencia o déficit de suplementos organo-mineral na dieta alimentar.
Ressaltando que o sentido biológico do crescimento está relacionado com a disponibilidade de alimento e poderá ter influência direta sobre as taxas de sobrevivência e crescimento, além do potencial reprodutivo das espécies de caranguejos chama-maré (CHRISTI, 1978). Negreiros-Fransozo et al, (2003), afirmam que a reprodução é um dos fatores que determinam a variação do crescimento. Por exemplo, na pesquisa realizada, foi observado o dimorfismo sexual entre os juvenis no qual era visível o tamanho mais acentuado dos machos em relação à fêmea.
O ritmo de crescimento nos crustáceos nos ínstares iniciais é muito intenso, porém, este diminui à medida que avança a idade do animal (ANGELESCU & BOSCHI, 1959; TRAVIS, 1954; JEFFERIS, 1964). Este padrão de crescimento não foi diferente para os juvenis de M. rapax, onde diferentemente dos instares iniciais, os subsequentes tiveram períodos mais longos de intermuda. Isto também foi observado para outro crustáceo, Macrobrachium borellii, o qual apresentou um aumento na duração do período de intermuda na medida em que o comprimento da carapaça se tornava maior (BOND & BUCKUP, 1988). A relação entre o período de intermuda e o tamanho do organismo ainda foi observada para Goniopsis cruentata e Parastacus brasiliensis, onde se constatou que o tamanho do animal interfere na duração do período de intermuda, notando-se um período menor entre as ecdises dos juvenis (FRIES, 1984; SILVA & OSHIRO, 2002).
Segundo Chittleborough (1975), outro aspecto que pode influenciar na duração do período de intermuda é a redução na quantidade de alimento ministrado e ingerido pelos juvenis. De acordo com Valenti (1987) os indivíduos de uma população crescem com taxas que dependem do crescimento somático ocasionando as ecdises sucessivas durante ontogenia em estudos nas populações de M. rapax e Macrobrachium acanthurus. De acordo com, Colpo & Negreiros Fransozo (2003) e Von Hangen (1987), que pesquisaram populações distintas, o crescimento e a maturidade sexual estão associados com a disponibilidade de alimentos, em habitats distintos.
No presente trabalho, talvez o crescimento possa estar relacionado com as condições do cultivo como, apenas uma dieta alimentar ministrada, o substrato arenoso, o estresse devido o confinamento e espaço reduzido, e fatores abióticos como, temperatura, salinidade, pH, entretanto, o mais provável é o fator genético do animal.
O incremento por muda apresentou oscilações ao longo do desenvolvimento dos juvenis, onde o primeiro instar possuiu o maior crescimento de incremento e o último instar teve o menor crescimento. De acordo com Lima & Oshiro (2005), a diminuição no incremento de muda é comum entre os crustáceos Brachyuras sendo observado em outras espécies como G. cruentata Silva & Oshiro (2002), Ucides cordatus, Lima & Oshiro (2006).
Os resultados obtidos em laboratório para os juvenis de M. rapax mostraram que o cultivo não inibiu o crescimento somático dos juvenis sendo que houve um decréscimo no crescimento ao longo de sucessivas mudas, comportamento semelhante foi observado em U. cordatus (LIMA & OSHIRO, 2002), G. cruentata (SILVA & OSHIRO, 2002), Menippe nodifrons (BERTINI et al., 2007).
Os estudos referentes ao crescimento de caranguejos violinistas vêm sendo conduzidos por diversos autores como Miller (1973); Von Hagen (1987). Estudos comparativos entre espécies foram realizados por Benetti & Negreiros–Fransozo (2004), os quais encontraram diferenças nos padrões do comprimento e da largura do cefalotórax e o da quela.
Segundo Oliveira et. al. (2007), Hartnoll (1982) e Negreiros-Fransozo (2003) o crescimento relativo observado em M. rapax segue um padrão já descrito para outros crustáceos, embora haja grande variação nas taxas de crescimento de espécies para espécie, ele segue o mesmo padrão, com crescimento alométrico positivo na fase juvenil. Durante o experimento, os juvenis apresentaram um crescimento absoluto contínuo ao longo do desenvolvimento, proporcionando uma forte correlação positiva entre o comprimento e a largura da carapaça.
Lima & Oshiro (2006) citaram resultados semelhantes aos deste estudo na análise de crescimento em laboratório com indivíduos adultos de Ucides cordatus, a duração deste experimento foi de oito meses a sobrevivência estimada foi de 51%, os autores afirmaram que o confinamento não parece inibir o crescimento, embora tenha ocorrido um reduzido aumento somático ao longo de duas ou mais mudas sucessivas. A espécie apresentou um desenvolvimento lento nos últimos ínstares, tal fato foi observado neste mesmo experimento.
Analisando o quociente e a largura da carapaça durante o cultivo, observou- se que a diferença foi se reduzindo gradativamente ao desenvolvimento dos instares subsequentes, chegando ao ponto em que a largura ultrapassa o comprimento da carapaça deixando os juvenis morfologicamente mais largos do que compridos, seria uma referência de que o crescimento em laboratório tem certo grau de realidade com o que ocorre na natureza.
O crescimento absoluto por muda implicou que os juvenis sofriam oscilações no padrão de crescimento, no entanto haviam instares que o crescimento era maior enquanto outros demonstravam haver taxas menores de crescimento. Como observados em outras espécies, de acordo com Travis (1954), ao estudar o crescimento de Panulirus argus, constatou que a muda não precisa estar necessariamente associada a um aumento de tamanho, ou seja, os juvenis sofriam processo de ecdise, porém sem sofrer crescimento, fato que também foi observado neste experimento.
Os juvenis apresentaram diferenças significativas na relação LC/ Vs ínstares e CC / Vs instares, durante o cultivo os juvenis em um mesmo instar apresentavam diferenças no padrão de tamanho e na duração do período de mudas, indicando que indivíduos em um mesmo instar demonstravam proporções de medidas diferentes sob as mesmas condições de cultivo. A relação de LC / Vs ínstar apresentou um crescimento positivo, alterando a estrutura morfológica dos juvenis de acordo com os padrões morfométricos dos caranguejos violinistas. A analogia entre a largura da carapaça (LC) e a idade dos juvenis proporcionou forte correlação positiva, o mesmo ocorrendo com o comprimento da carapaça (CC), nos ínstares iniciais os juvenis possuíam a forma mais comprida do que larga e no transcorrer do cultivo a sua morfologia foi se tornando gradualmente mais larga. Resultados obtidos em estudos alométricos em Ucides cordatus por Leite et al. (2006), em relação ao comprimento da carapaça indicaram um crescimento com alometria negativa de acordo com a largura de ambos os sexos, o que constitui uma maior ampliação lateral da carapaça em comparação ao seu comprimento onde provavelmente ocorre devido às características determinadas pela genética do animal. Hartnoll (1982) e Leme (2005), afirmam que essas alterações morfológicas acontecem durante o incremento da muda do animal. De acordo com Flores & Negreiros-Fransozo (1999) essas alterações morfológicas acontecem em indivíduos com as estruturas corporais inteiramente desenvolvidas.
O estudo do crescimento em crustáceos tem sido realizado extensivamente em várias espécies de caranguejos decápodos, como por exemplo, em Goniopsis cruentata (COBO & FRANSOZO, 1998); Pachygrapsus transversus (FLORES & NEGREIROS-FRANSOZO, 1999); Armases angustipes (KOWALCZUK & MASUNARI, 2000); U. cordatus (PINHEIRO et al.; 2005); Callinectes danae, C. ornatus (KEUNECKE et al., 2008), dentre outros. Provavelmente, se os caranguejos tivessem sido cultivados na presença de substrato natural do ambiente, e o mesmo tivesse sido renovado a cada troca de água, o crescimento poderia ter sido diferente ou até mesmo mais acentuado, apresentando uma duração mais curta entre os instares. Os juvenis do chama-maré M. rapax no presente estudo demonstraram ser uma espécie bastante resistente, este fato já havia sido confirmado por Zanders e Rojas (1996), onde este braquiuro suporta fatores ambientais adversos, mesmo que o cultivo não tenha as condições adequadas para o seu desenvolvimento, o qual obteve uma duração de aproximadamente 184 dias. O crescimento absoluto dos juvenis de M. rapax em laboratório mostrou-se complexo, indicando um crescimento morfométrico positivo sugerindo diferenças morfológicas ríspidas de um instar para o outro, com alterações bruscas, onde refletem o estado crucial durante o processo de ecdise, (HARTNOLL, 1982). Futuros estudos poderiam ser desenvolvidos para confrontar o crescimento das espécies de caranguejos violinistas sobre várias dietas alimentares, além de comparar o crescimento em laboratório com o crescimento no ambiente natural. O conhecimento biológico de M. rapax acerca de seu crescimento é ainda restrito devido a poucos estudos realizados. No entanto, o número de pesquisas relacionadas ao crescimento de crustáceos vem aumentando, não se restringindo apenas a espécies de interesse econômico, estudos realizados com a fase juvenil de caranguejos decápodes são relativamente escassos quando comparados com o grande número de trabalhos realizados com espécimes adultos. Somente poucas espécies de caranguejos foram consideradas para o estudo do crescimento juvenil.
A compreensão do ciclo de muda torna-se importante para avaliar os efeitos das condições do ambiente de cultivo, na duração do período de muda dos diferentes instares. O método de estudo de crescimento através do uso das carapaças torna-se uma alternativa para pesquisas do crescimento de crustáceos cultivados em laboratório. A análise de crescimento absoluto dos juvenis de M. rapax em laboratório poderá contribuir para ampliar o conhecimento sobre a biologia da espécie e auxiliar em futuras pesquisas sobre análise de crescimento de outros braquiuros.
6. CONCLUSÃO
1. O crescimento de juvenis de M. rapax segue o padrão já descrito em outras espécies de caranguejos violinistas.
2. O cultivo de juvenis de M. rapax em laboratório obteve um crescimento morfométrico, positivo com alterações bruscas de um estágio para o outro em relação a (LC) e (CC).
3. Possivelmente a alimentação ministrada durante o cultivo apresentou um déficit de suplementos orgânicos, causa provável da mortalidade dos juvenis.
4. O estudo demonstrou que apesar da alta taxa de mortalidade apresentada, o cultivo dos juvenis de M. rapax em laboratório é viável havendo condições de serem realizados outros estudos biológicos sobre o desenvolvimento da espécie.
7. REFERÊNCIAS BIBLIOGRÁFICAS
ADIYODI, K. G.; ADIYODI, R. G. Endocrine control of reproduction in decapoda Crustacean. Biological Review,( 45): p 121 – 165, 1970.
ANGELESCU, V.; BOCHI, E. E. Estudio biológico pesquero del langostino de Mar del Plata en conexion com la operatión nivel medio. Servicio de Hidrografia Naval. Marine Ecology Progress series, 1959.
BENETTI, A. S.; NEGREIROS-FRANSOZO, M. L. Relative growth of Uca burguesi (Crustacea,Ocypodidae) from two mangroves in the Southeastern Brazilian Coast. Iherigia Série Zoologia, 94 (1): p 67 – 72, 2004.
BETALANFFY, L. VON. A quantitative theory of organic growth (inquires on growth laws II). Human Biology, 10 (1): p 181 – 213, 1938.
BERTINI, G. et al. Relative growth and sexual maturity of the stone crab Menippe nodifrons Stimpson, 1859 (Brachyura, Xanthoidea) in southeastern Brazil. Brazilian Archives of Biology and Technology, v. 50, p 259-267, 2007.
BOND, G.; BUCKUP, L. O ciclo da intermuda em Macrobrachium borellii (Nobili, 1896) (Crustacea, Decapoda, Palaemonidae): a influência da temperatura e do comprimento do animal. Revista Brasileira de Zoologia, p 5 (1): p 45 – 59, 1988.
CASTIGLIONI, D. S.; NEGREIROS-FRANSOZO, M. L. Comparative analysis of the relative growth of Uca rapax (Smith) (Crustacea, Ocypodidae) from two mangroves in São Paulo, Brazil. Revista Brasileira de Zoologia, 21 (1): p 137 – 144, 2004.
CASTIGLIONI, D. S.; SILVA-CASTIGLIONI, D.; NEGREIROS-FRANSOZO, M. L. Somatic growth of the fiddler crab Uca rapax (Smith, 1870) (Brachyura, Ocypodidae) from two subtropical mangroves. Universidad Y Ciencia, 20 (39): p 15 – 22, 2004.
CHISTTLEBOUGH, RG. Environmental factors affecting growth and survival of juvenile western rock lobsters Panulirus longipes (Milne-Edwards). Australian Journal of Marine and Freshwater Rescarch, 26 (2): p 177 – 196, 1975.
CHRISTI, J. H. Adaptative significance of reproductive cycles in the fiddler crab Uca pugilator: a hypothesis. Science, 15 (199): p 453 – 455, 1978.
COBO, V. J.; FRANSOZO, A. Relative growth of Goniopsis cruentada (Crustacea Brachyura, Grapsidae) on the Ubatuba region, São Paulo, Brasil: Lheringia. Série Zoologia, (84): p 21- 28, 1998.
COLPO, K. D.; NEGREIROS-FRANSOZO, M. L. Reproductive output of Uca vocator (Herbst,1804) (Brachyura,Ocypodidae). From three subtropical mangroves. Crustaceana, 2003.
FLORES, A.; NEGREIROS-FRANSOZO, M. L. Alometry of the seconday sexual charactus of the shore crab Pachygrapus transversus (Gilbes, 1859) (Brachyura, Grapsidae). Crustaceana, 72 (9): p 1051 – 1066, 1999.
FLORES, C. V.; NEGREIROS-FRANSOZO, M. L. Porcellanid crabs (Crustacea, Decapoda) inhabiting sand reefs built by Phraquatopoma lapidosa (Polychaeta, Sabel laridae) at Paranapuã Beach, Brazil. Revista Brasileira de Biologia, 59 (1): p 63 – 73, 1999.
FRANSOZO, A. et al. Distribution and assemblages of Anomuran Crustaceans in Ubatuba Bay, Nort Coast of São Paulo state, Brazil. Acta Biologica Venezuelica, 30 (18): p 17 – 25, 1998.
FRIES, B. G. Observações sobre o lagostin de água doce Parastacus brasiliensis (Von Martins, 1869) em condições de cultivo experimental em laboratório (Crustacea, Decapodas, Parastacidae). Revista Brasileira de Biologia, 44 (4): p 409 – 416, 1984.
LIMA, G. V.; OSHIRO L. M. Y. Crescimento somático do caranguejo uçá Ucides cordatus (Crustácea, Brachyura, Ocipodidae) em laboratório. Iheringia, Série Zoologia, 96 (4): p 467- 472, 2006.
GUIMARÃES, F. J.; NEGREIROS-FRANSOZO, M. L. Juvenile development and growth patterns in the mud crab Eurytium limosum (Say, 1818) (Decapoda, Brachyura, Xanthidae) under laboratory conditions. Journal of Natural History, 39 (23): p 2145 – 2161, 2005.
HANCOCK, D. A; EDWARDS, E. Journal du consul International pour I`exploration de La Mer, 31(2): p 246 – 264, 1967.
HARTNOLL, R. G.; BRYANT, A. D. Growth to maturity of juveniles of the spider crabs Hyas coarctatus Leach and Inachus dorsettensis (Pennant) (Brachyura: Majidae). Journal of Experimental Marine Biology and Ecology, (263): p143 – 158, 2001.
HARTNOLL, R. G. Growth. In: Bliss, D. E. & L. G. Abele (Eds.). The Biology of Crustacea, Embriology, Morphology and Genetics. Academic Press, New York, (2): p.111- 196, 1982.
HARTNOLL, R. G. The determination of relative growth in Crutacea. Crustaceana, 34 (3): p 281 – 289, 1978.
HARTNOLL, R. G.; BRYANT, A. D. Growth to maturity of juveniles of the spider crabs Hyas coarctatus Leach and Inachus dorsettensis (Pennant) (Brachyura: Majidae). Journal of Experimental Marine Biology and Ecology, (263): p 143-158, 2001.
HEBLING, N. J.; FRANSOZO, A.; NEGREIROS-FRANSOZO, M. L. Desenvolvimento dos primeiros estágios juvenis de Panopeus herbstii H. Milne- Edwards, 1834 (Crustacea, Decapoda, Xanthidae) criados em laboratório. Naturalia, São Paulo, 21 (7): p 177- 188, 1982.
HIROSE, G. L.; NEGREIROS-FRANSOZO, M. L. Population biology of Uca maracoani Latreille 1802 – 1803 (Crustacea, Brachyura, Ocypodidae) on the south – eastern coast of Brazil. Pan-American Journal of Aquatic Sciences, 3 (3): p 373 – 383, 2008.
JEFFRIES, D. J. The moulting behaviour Palaemonetes varians (Leach) (Decapoda: Palaemonidae). Hydrobiologia, 24 (4): p 457 – 488, 1964.
KEUNECKE, K. A. et al. Idade e crescimento de Callinectes danae e C. ornatus (Crustacea, Decapoda) na Baía de Guanabara, Rio de Janeiro, Brasil. Iheringia Série Zoologia. 98 (2): p 231 – 235, 2008.
KOCH, V.; WOLFF, M.; DIELE, K. Comparative population dynamics of four fiddler crabs (Ocypodidae, genus Uca) from a North Brazilian mangrove ecosystem. Marine Ecology Progress Series, 22 (291): p 177 – 188, 2005.
KOCH, V; WOLFF, M. Energy budget and ecological role of mangrove epibenthos in the Caeté estuary, North Brazil. Marine Ecology Progress Series, (228): p 119 – 130, 2002.
KOWALCZUK, V. G. L.; MASUNARl, S. Estrutura populacional de Armases angustipes (Dana, 1852) (Decapoda, Brachyura, Grapsidae) da Ilha do Farol, Matinhos, Paraná. Revista Brasileira de Zoologia. 17 (1): p 1 – 16, 2000.
KURATA, H. Studies on the age and growth of Crustacea. Bulletin of Hokkaido Regional Fisheries Research Laboratory. 13 (24): p 1 – 115, 1962.
LEITE, M. M. L. et al. Análise de crescimento alométrico no caranguejo-uçá, Ucides cordatus (Decapoda: Ocypodidae), no estuário do Rio Coreaú, Camocim, Ceará. Arquivo de Ciências do Mar, 39 (1): p 93 – 98, 2006.
LEME, M. H. A. Size at sexual maturity of female crabs Sesarma rectum Randall (Crustacea, Brachyura) and ontogenetic variations in the abdomen relative growth. Revista Brasileira de Zoologia , 22 (2): p 433 – 437, 2005.
LUPPI, T. A.; SPIVAK, E. D.; Bas, C. C.; ANGER, K. Molt and growth of an estuarine crab, Chasmagnathus granulatus (Brachyura: Varunidae), in Mar Chiquita coastal lagoon, Argentina. Journal of Applied Ichthyology, Neu Wulmstorf, 16 (20): p 333 – 344, 2004.
MAUCHLINE. J. Growth of shrimps, crabs and lobsters an assessment. Journal du Conseil Internationale de la Exploration de la Mer, 8 (4): p 323, 1977.
MANTELATTO, F. L. M.; FRANSOZO, A. Size at sexual maturity in Callinectes ornatus. (Brachyura, Portunidae) from the Ubatuba Region (SP), Brazil. Nauplius, Rio Grande, (4): p 29 – 38, 1996.
MASUNARI, S.; DISSENHA, N. Alometria no crescimento de Uca mordax (Smith) (Crustacea, Decapoda, Ocypodidae) na Baía de Guanabara, Paraná, Brasil. Revista Brasileira de Zoologia, 22 (4): p 984 – 990, 2005.
MELO. G. A. S. Manual de Identificação dos Brachyura (Caranguejos e Siris) do Litoral Brasileiro. Editora Plêiade, FAPESP, p 604, 1996.
MILLER, D. C. Growth in Uca. 1. Ontogeny of asymmetry in Uca pugilator (Bosc) (Decapoda, Ocypodidae). Crustaceana, Leiden, (24): p 119 – 131, 1973.
MONTAGUE, C. L. A natural history of temperat western Atlantic fiddler crabs (Genus Uca) with reference to their impact on the salt marsh. Contributions of Marine Science, Port Aransas, 70 (23): p 25 – 55, 1980.
MURAOKA, K. The post-larval development of Uca lactea (de Haan) and Macrophthalmus (Mareotis) japonicus (de Haan) (Crustacea, Brachyura, Ocypodidae). Zoological Magazine, Tokyo, 85 (1): p 40 – 51, 1976.
NEGREIROS – FRANSOZO, M. L.; FRANSOZO, A. Larval stages of Epialtus brasiliensis Dana, 1952 (Decapoda, Brachyura, Majidae) reared in the laboratory, with notes on characteres of the Majid subfamilies. Crustaceana, 60 (2): p 200 – 212, 1991.
NEGREIROS – FRANSOZO, M. L.; COLPO, K. D.; COSTA, T. M. Allometric Growth in the fiddler crab Uca thayeri (Brachyura, Ocypodidae) from a subtropical mangrove. Journal of Crustacean Biology, 23 (2): p 273 – 279, 2003.
NIKOLSKII, G. V. Theory of fish population dynamics as the biological background for rational exploitation and management of fishery resources. Edinburgh: Oliver & Boyd, (17): p 323, 1969.
NOVAK, A.; SALMON, M. Uca panacea, a new species of filddler crabs from the Gulf coast of the United States. Proceedings of the Biological Society of Washington, 87(28): p 313 – 326, 1974.
O` CONNOR, N. J. Settlement and recruitment of the fiddler crabs Uca pugnax and U. pugilator in a North Carolina, USA, salt marsh. Marine Ecology Progress Series, 93(3): p 227 – 234, 1993.
OLIVEIRA T. S., et al Regime alimentar de Stellifer Naso Peciformes Sciaenidae em três Igarapés do Rio Paciência, Ilha de São Luís. Sociedade de ecologia do Brasil, 2007.
OLIVEIRA, T. S. et al. Alometria no crescimento de Uca rapax (Crustacea, Decapoda, Ocypodidae) na Ilha de São Luís, Maranhão. Sociedade de Ecologia do Brasil, 2007.
PINHEIRO, M. A. A.; FRANSOZO, A. Análise de relação biométrica do peso úmido pela largura da carapaça para o siri Arenaeus cribrarius (Lamarck, 1818) (Crustacea, Brachyura, Portunidae). Revista Brasileira de Zoologia, 36 (2): p 331 – 341, 1993.
PINHEIRO, M. A. A.; FISCARELLI, A. G; HATTORI, G.Y. Growth of the mangrove crab Ucides cordatus (Brachyura,Ocipodidae). Journal, of Crustacean Biology, 25 (2): p 293-301, 2005.
RIEGER, P. J.; NAKAGAWA, C. Desenvolvimento juvenil de Chasmagnathus granulata Dana, 1851 (Decapoda, Grapsidae), em laboratório. Nauplius, (3): p 59 – 74, 1995.
RODRIGUES, M. A.; D`ICAO, F. Comparação do Crescimento entre Callinectes sapidus (Crustacea, Decapoda, Portunidae) coletados em campo e mantidos em condições controladas. Iheringia, Série Zoologia, Porto Alegre, 98 (3): p 372 – 378, 2008.
SANTOS, E. P. Dinâmica de populações aplicada à pesca e piscicultura. Hucitec/Edusp, São Paulo, 129 pp., 1978.
SILVA, Zilanda de Souza; OSHIRO, Lídia Miyako Yoshii. Aspectos reprodutivos de Goniopsis cruentata (Latreille)(Crustacea, Brachyura, Grapsidae) na Baía de Sepetiba, Rio de Janeiro, Brasil. Revista Brasileira de Zoologia, v. 19, p. 907-914, 2002.
TRAVIS, D. F. The molting cycle oflhe sping lobster, Panulirus argus Latreille. I. Molting and growth in laboratory-maintained individuals. The Biological. Bulletin, Masschusetts, 107 (3): 433 – 450, 1954.
WARNER, G.F. The life history of the mangrove tree crab. Araraus pisonii. Journal of Zoology, London, (153): p 321 – 325, 1967.
TWEEDALE, W. A.; BERT, T.M.; BROWN, S.D. Growth of post settlement juveniles of the Florida stone crab, Menippe mercenaria (Say) (Decapoda: Xanthidae), in the laboratory. Bulletin of Marine Sciencie, 52 (3): p 873 – 875, 1993.
VALENTI, W. C.; MELLO, J. T. C.; LOBÃO, V. L. Crescimento de Macrobrachium acanthurus (Wiegmann, 1836) do Rio Ribeira de Iguapé (Crustacea, Decapoda, Palaemonidae). Revista Brasileira de Biologia, 47 (3): p 349 – 355, 1987.
VON HAGEN, H. O. Allometric growth in two populations of Uca tangeri from the Guadalquivir estuary (Andalusia). Investigaciones Pesqueras, Montevideo, (51): p 443 – 452, 1987.
ZANDERS, I. P.; ROJAS, W. E. Salinity effects on Cadmium accumulation in various tissues of the tropical fiddler crab Uca rapax. Environmental Pollution, 96 (3): p 293 – 299, 1996.
1Laboratório de Carcinologia / Instituto de Estudos Costeiros (IECOS), Universidade Federal do Pará (UFPA), Campus Universitário de Bragança. Alameda Leandro Ribeiro s/n, Bairro: Aldeia, 68600-000, Bragança, PA, Brasil;
2Secretária de Educação do Estado do Pará (SEDUC-PA).
*Autor correspondente E-mail: marcusalexandre159@gmail.com
Orcid: https://orcid.org/0000-0002-6227-4272
