THE EARLY STAGES OF THE RED ARATU CRAB GONIOPSIS CRUENTATA (LATREILLE, 1803) (DECAPODA: GRAPSIDAE), FROM THE AMAZON REGION, CULTIVATED UNDER LABORATORY CONDITIONS.
LOS ESTADIOS INICIALES DEL CANGREJO ARATU ROJO GONIOPSIS CRUENTATA (LATREILLE, 1803) (DECAPODA: GRAPSIDAE), DE LA REGIÓN AMAZÓNICA, CULTIVADO EN CONDICIONES DE LABORATORIO.
REGISTRO DOI: 10.69849/revistaft/dt10202505311009
Marcus Alexandre Borges Pires1
RESUMO
Três estágios zoeae do grapsídeo G. cruentata são descritos e ilustrados a partir de indivíduos cultivados em laboratório. Fêmeas ovígeras de G. cruentata foram capturadas manualmente no Furo do Café, Nordeste do Estado do Pará, em março de 2022. As zoea I e II de G. cruentata foram alimentadas com a microalga Thalassiosira sp. e rotíferos Brachionus plicatilis. A partir do estágio zoea III, as larvas também foram alimentadas com náuplius de Artemia sp. Amostras de cada estágio larval e exúvias foram fixadas em formol 10% e posteriormente preservadas em álcool etílico 70% + glicerol (1:1). Comparações morfológicas com outras espécies da família são brevemente discutidas.
Palavras-chave: Grapsídeo. Morfologia. Desenvolvimento larval.
ABSTRACT
The early larval stages of red aratu crab Goniopsis cruentata (Latreille, 1803) (Decapoda, Grapsidae), from the Amazon region, cultured under laboratory conditions. Three early larval stages of the grapsid G. cruentata are described and illustrated in detail from individuals reared in the laboratory. Ovigerous females were caught manually in the Furo do Café, northeastern Pará State, Brazil, in March, 2022. The zoeae I and II were fed with microalgae Thalassiosira sp. and rotifers Brachionus plicatilis. Artemia sp. nauplii were added to the culture from zoea III. Samples of each larval stage and exuviae were fixed in formalin solution (10%) and posteriorly preserved ethylic alcohol 70% + glicerol (1:1). Morphological comparisons with previous reported species were briefly discussed.
Keywords: Grapsid. Morphology. Larval development.
RESUMEN
Se describen e ilustran en detalle tres estadios larvales tempranos del cangrejo aratu rojo Goniopsis cruentata (Latreille, 1803) (Decápoda, Grapsidae), provenientes de la región amazónica, cultivados en condiciones de laboratorio. Las hembras ovígeras fueron capturadas manualmente en el Furo do Café, en el noreste del Estado de Pará, Brasil, en marzo de 2022. Las zoeas I y II fueron alimentadas con microalgas Thalassiosira sp. y rotíferos Brachionus plicatilis. Los nauplios de Artemia sp. fueron añadidos al cultivo a partir de la zoea III. Las muestras de cada estadio larval y las exuvias fueron fijadas en una solución de formalina (10%) y posteriormente conservadas en alcohol etílico al 70% + glicerol (1:1). Se discutieron brevemente las comparaciones morfológicas con especies previamente reportadas.
Palabras clave: Grapsido. Morfología. Desarrollo larval.
1. INTRODUÇÃO
No Brasil, G. cruentata distribui-se ao longo da costa desde o Amapá até Santa Catarina (MELO, 1996). É uma espécie com expressiva importância comercial na Região Nordeste do Brasil (OSHIRO et al., 1998), que tem sido bastante capturada e já vem mostrando indícios de diminuição do estoque pela sobre-exploração (BOTELHO et al., 2004). Em outra região do Brasil, mais precisamente em dois Estados da Região Sudeste (Rio de Janeiro e São Paulo), este decápode consta na lista das espécies ameaçadas de extinção (IBAMA, 1989). Este quadro sugere que futuros programas de repovoamento sejam desenvolvidos. No entanto, para o sucesso destes programas é preciso o conhecimento da biologia larval desta espécie.
O desenvolvimento larval da família Grapsidae é muito pouco conhecido. Para os gêneros Grapsus, Geograpsus, Goniopsis, Leptograpsus, Ilyograpsus e Planes dados larvais são restritos apenas ao primeiro estágio zoea (CUESTA et al., 1997; CUESTA & SCHUBART, 1999; CUESTA & RODRIGUEZ, 2000; FLORES et al., 2003; FRANSOZO et al., 1998; WEAR, 1970) e megalopa de planes cyaneus (MURAOKA, 1973). O completo desenvolvimento larval obtido em laboratório é conhecido somente para três espécies do gênero Metopograpsus (FIELDER & GREENWOOD, 1983; KAKATI, 1982; PASUPATHI & KANNUPANDI, 1986) e três espécies de Pachygrapsus: P. crassipes (SCHLOTTERBECK, 1976), P. gracilis (BROSSI-GARCIA & RODRIGUES, 1993) e P. transversus (BROSSI-GARCIA & RODRIGUES, 1997).
Em relação à espécie G. cruentata, Fransozo et al. (1998) realizaram uma descrição detalhada da zoea I a partir de larvas eclodidas em laboratório, não realizando porém, o cultivo larval. Deste modo, as descrições de outros estágios desta espécie não foram mencionadas, assim como, aspectos relativos ao desenvolvimento larval, alimentação e outros não foram observados.
O presente estudo faz uma redescrição do primeiro estágio de G. cruentata e descreve em detalhes os estágios II e III, fazendo comparações morfológicas com outras espécies do gênero descritas na literatura.
2. MATERIAL E MÉTODOS
Duas fêmeas ovígeras de G. cruentata foram capturadas manualmente (um dia antes da eclosão) na maré baixa, nas margens lamacentas da região entremarés de um grande igarapé (Furo do Café) na região de manguezal do estuário do Rio Caeté (00°50’752” S; 046°38’392” W) Estado do Pará, Norte do Brasil. Após a coleta, as fêmeas foram transportadas para o laboratório em baldes contendo água salina do ambiente. No laboratório de Carcinologia do Campus da Universidade Federal do Estado do Pará, os caranguejos foram lavados, em água corrente, e acondicionadas individualmente em aquários (capacidade de 5 L), contendo água marinha na salinidade 25, com aeração constante e submetidas à fotoperíodo artificial de 12/12 horas na presença e ausência de luz, permanecendo sem alimento até a eclosão dos ovos. Logo após o nascimento, as larvas foram transferidas para 100 recipientes plásticos de 200 mL na densidade de 20 larvas/recipiente.
A troca de água da cultura foi realizada a cada 2-3 dias com contagem de larvas mortas e exúvias. A água do mar, usada para o cultivo de larvas de G. cruentata, foi coletada na Praia de Ajuruteua, no norte do Brasil (00°49’751” S; 046°36’248” W) e previamente filtrada (Eheim-Filter, Alemanha; e Diatom-Filter, 5 µm) e armazenada em tanques (500 L) com aeração constante no laboratório.
As larvas foram alimentadas diariamente com rotíferos Brachionus plicatilis (com densidade de 200 indivíduos ∙ mL–1) e microalgas Thalassiosira sp. (com densidade de 4 x 104 células ∙ mL–1). A partir do estágio zoea III, foram acrescentados náuplios recém eclodidos de de Artemia sp. (em uma densidade de aproximadamente 8 indivíduos ∙ mL–1) na alimentação.
Amostras de exúvias e espécimes de cada estágio de desenvolvimento de G. cruentata foram coletadas e preservadas em solução de glicerina + álcool etílico 70% (1:1). Posteriormente, as larvas e exúvias foram dissecadas com o auxílio de finas agulhas (12,7 x 0,33 mm, BD Ultra-Fine®) em lâminas contendo álcool etílico 70% + glicerol (1:1) e ilustradas em um microscópio óptico binocular (Axioskop 40, Zeiss), equipado com disco micrométrico. No presente estudo, as larvas foram observadas em vista lateral, dorsal e ventral e posteriormente, ilustradas em vista lateral direita através de desenho manual com auxílio de um disco micrômetro e régua; a altura da carapaça foi medida da região ocular à margem posterior da carapaça.
A terminologia utilizada nas descrições morfológicas segue Diaz e Ewald (1968), Bousquette (1980), Pereyra-Lago (1987), Magalhães e Medeiros (1998), Cuesta e Anger (2001), Islam et al. (2002, 2004), Guerao et al. (2004), Fransozo et al. (1998), Cuesta et al. (1997), Abrunhosa e Kittaka (1997), Abrunhosa et al. (2005). A fêmea e as amostras de larvas de G. cruentata foram depositadas na Coleção de Invertebrados do Museu Paraense Emílio Goeldi de Belém-PA, sob o código MPEG.CRU 001654.
3. RESULTADOS
Cultivo
As variáveis físico-químicas da água no laboratório foram monitoradas diariamente e todas as larvas de zoea foram criadas em temperatura ambiente de 26,7 ± 1,6 °C, regime de fotoperíodo de 12h claro/12h escuro, pH 8,1 ± 1,0 e sem aeração no meio de cultura. Os valores de amônia e nitrito foram 0,25 – 0,75 mg ∙ mL–1 e 0,25mg ∙ mL–1, respectivamente.
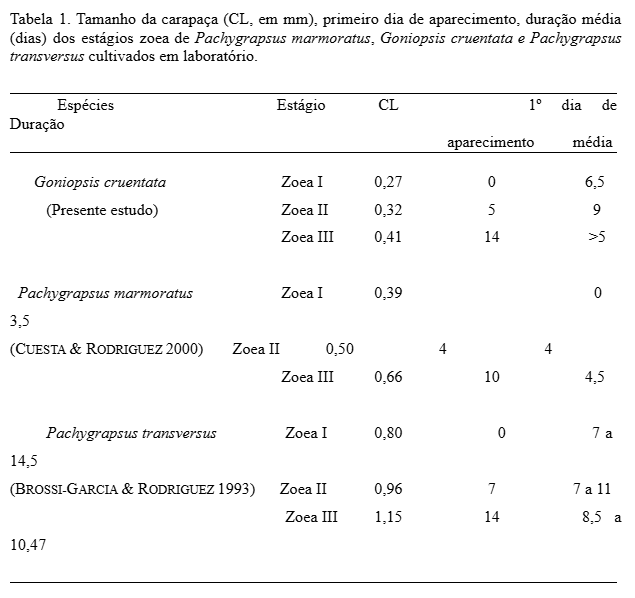
Os resultados foram obtidos em um único tratamento, o de salinidade 25 (condição ideal de salinidade, conforme Abrunhosa e Abrunhosa (2020), no qual os períodos de intermuda dos estágios I e II variaram de 5 a 8 e 9 dias de cultivo, respectivamente. A última larva no estágio III sobreviveu até o 23º dia de cultivo, com duração de 9 dias.
Descrição morfológica dos estágios larvais de Goniopsis cruentata
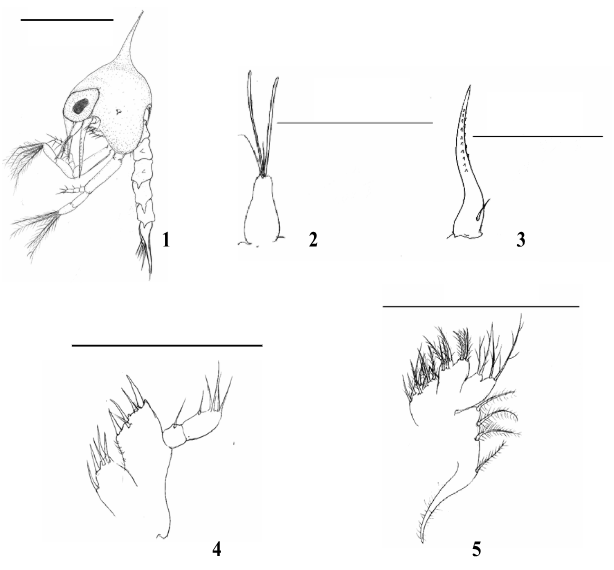
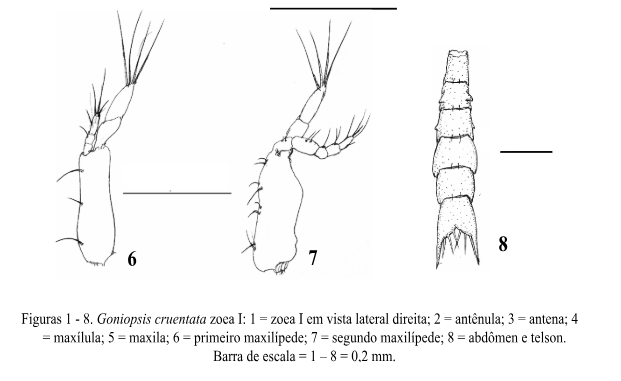
Estágio Zoea I (Fig. 1)
Comprimento da carapaça: 0,27mm (0,25 – 0,28mm).
Carapaça (Fig. 1): Globosa e lisa com 1 espinho dorsal, 1 espinho rostral e 2 espinhos laterais. Espinho dorsal pouco curvado. Espinho rostral voltado para baixo e menor que o protopodito da antena. Espinho lateral pequeno, medindo cerca de 1/9 do espinho dorsal. Margens da carapaça desprovidas de cerdas. Os olhos são sésseis.
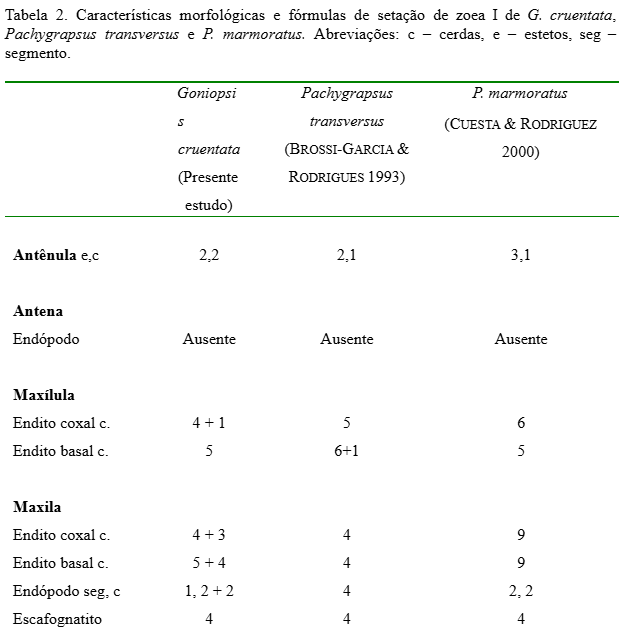
Antênula (Fig. 2): Cônica, uniramosa. O exópodo apresenta 2 longos estetos e 2 cerdas simples na porção terminal. Endópodo ausente.
Antena (Fig. 3): Bem desenvolvida. Protópodo maior que o espinho rostral com duas fileiras de pequenos espinhos. Endópodo ausente. Exópodo presente como uma cerda simples.
Maxílula (Fig. 4): Endópodo 2-segmentado, segmento distal com 4 longas cerdas terminais e 1 cerda média simples, segmento proximal com 1 cerda simples. Endito basal com 4 cerdas plumodenticuladas e 1 cerda simples. Endito coxal com 5 cerdas plumosas. Protópodo ausente.
Maxila (Fig. 5): Escafognatito mostrando 4 cerdas plumosas e um processo alongado coberto por microtriquias. Endópodo não segmentado com 2 + 2 longas cerdas plumosas. Endito basal com lóbulos proximal e distal suportando 3 e 4 cerdas plumosas. Endito coxal com lóbulos proximal e distal parcialmente fundidos com 3 e 5 cerdas plumosas.
Primeiro Maxilípede (Fig. 6): Basípodo mostrando margem interna com 2, 2, 2, 2 cerdas simples. Endópodo 5-segmentado com 2, 2, 1, 2, 5 cerdas, respectivamente. Exópodo 2- segmentado, segmento distal com 4 longas cerdas plumonatatórias.
Segundo Maxilípede (Fig. 7): Basípodo com 3 a 4 cerdas simples. Endópodo 3- segmentado com 0,1, (3 + 1) cerdas, respectivamente. Exópodo 2-segmentado, segmento distal com 4 cerdas longas plumonatatórias.
Abdômen (Fig. 8): Mostrando 5 somitos abdominais; somitos 2 e 3 com um par de espinhos projetando-se anteriormente. Somitos 4 e 5 com parte terminal projetando-se ventralmente. Pleópodos ausentes.
Telson (Fig. 8): Articulado com o 5º somito abdominal e bifurcado posteriormente. Margem interna com 6 (3 + 3) cerdas plumosas.
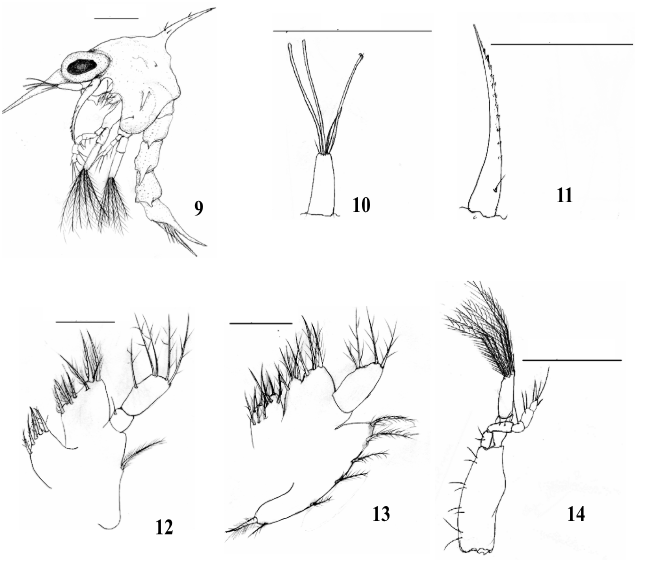
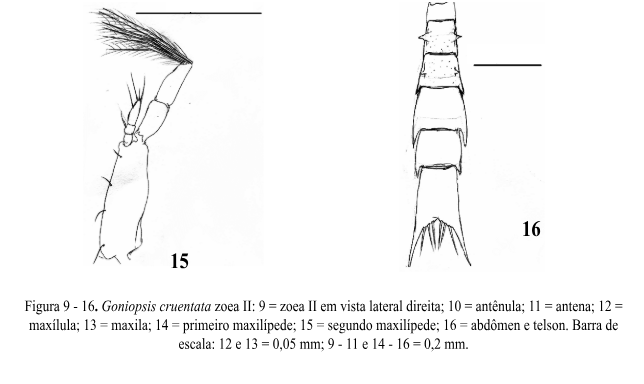
Estágio Zoea II (Fig. 9)
Comprimento da carapaça: 0,32mm (0,31 – 0,33mm).
Carapaça (Fig. 9): Sub-retangular com 2 cerdas. Espinho dorsal com 2 pares de cerdas simples. Rostro mais desenvolvido e ultrapassando o protópodo da antena. Espinhos laterais mais evidentes e direcionados para baixo. Região frontal mostrando uma carena sinuosa indo desde a base do espinho rostral até o espinho dorsal. Os olhos pedunculados.
Antênula (Fig. 10): Exópodo apresenta 3 longos estetos e 2 cerdas simples na porção terminal. Endópodo ausente.
Antena (Fig. 11): Similar ao da zoea I.
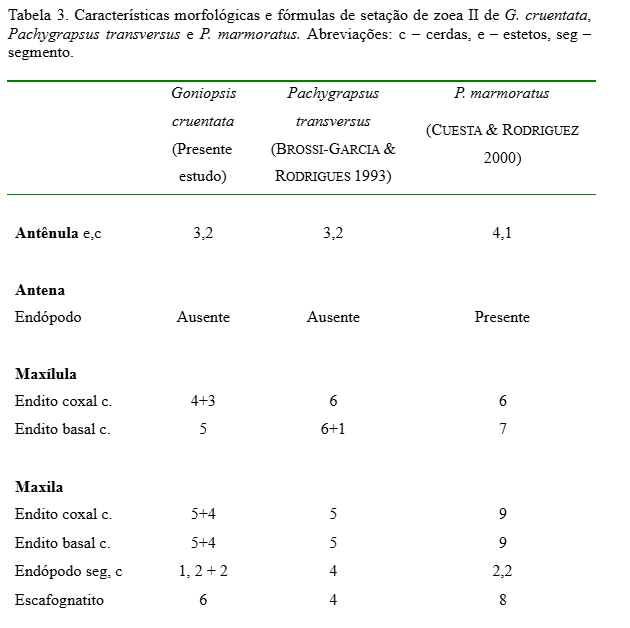
Maxílula (Fig. 12): Endópodo similar ao estágio anterior. Endito basal com 4 + 4 cerdas plumodenticuladas. Endito coxal com 5 cerdas plumosas. Protópodo presente.
Maxila (Fig. 13): Escafognatito mostrando 6 + 1 cerdas plumosas. Endópodo similar ao estágio anterior. Endito basal com lóbulos proximal e distal suportando 4 + 5 cerdas plumosas. Endito coxal com lóbulos proximal e distal parcialmente fundido com 3 + 5 cerdas plumosas.
Primeiro Maxilípede (Fig. 14): Basípodo e Endópodo similar ao da zoea I. Exópodo com 6 longas cerdas plumo-natatórias.
Segundo Maxilípede (Fig. 15): Basípodo e Endópodo sem alteração. Exópodo com 6 cerdas longas plumo-natatórias.
Abdômen e Telson (Fig.16): Similar ao estágio anterior.
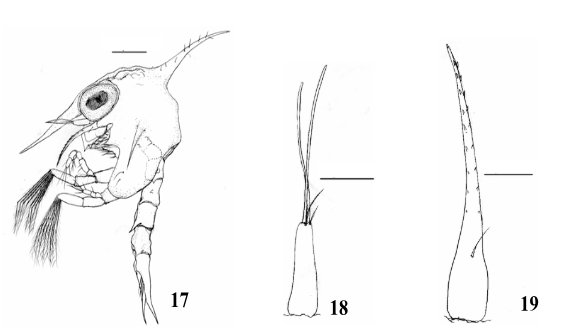
Estágio Zoea III (Fig. 17)
Comprimento da carapaça: 0,41mm (0,40 – 0,43mm).
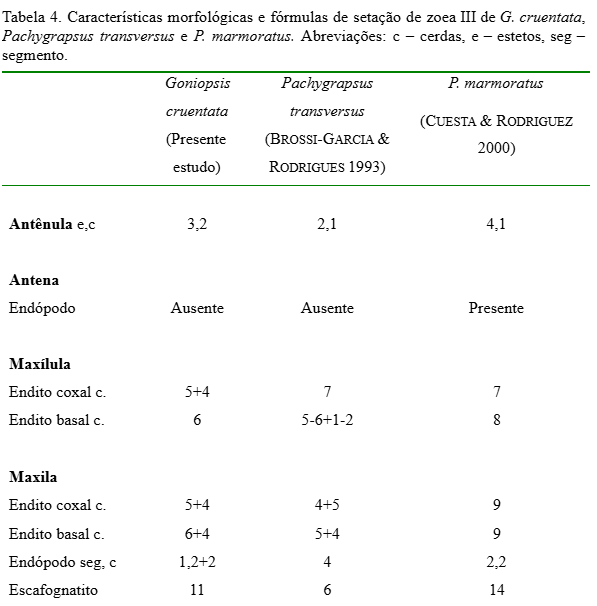
Carapaça (Fig. 17): Subtriangular com superfície irregular e com 1 par de cerdas marginais. Espinho dorsal com 8 a 10 cerdas simples. Espinhos rostral e laterais mais desenvolvidos. Carena da região frontal mais evidente e sinuosa.
Antênula (Fig. 18): Exópodo com 2 longos estetos e 2 cerdas simples terminais. Endópodo ausente.
Antena (Fig. 19): Similar ao estágio anterior.
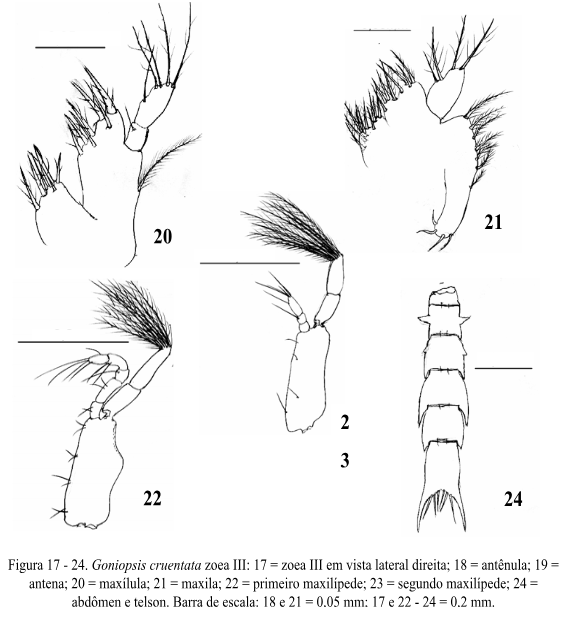
Maxílula (Fig. 20): Endópodo sem alteração. Endito basal com 3+4 cerdas plumodenticuladas. Endito coxal com 6 cerdas plumosas. Protópodo presente com cerda longa plumosa.
Maxila (Fig. 21): Escafognatito com 7+4 cerdas plumosas. Endópodo sem alteração. Endito basal com 4+4 cerdas plumosas. Endito coxal com 4+6 cerdas plumosas.
Primeiro Maxilípede (Fig. 22): Basípodo e endópodo similar ao estágio anterior. Exópodo com 8 longas cerdas plumonatatórias.
Segundo Maxilípede (Fig. 23): Basípodo e endópodo sem alteração. Exópodo com 8 cerdas longas plumonatatórias.Abdômen e Telson (Fig. 24): Similar ao estágio anterior.
4. CONSIDERAÇÕES FINAIS
No presente estudo foram obtidos três estágios larvais. Este fato, parece ser único no gênero, pois não há referências sobre a larvicultura do gênero Goniopsis na literatura. É suposto que se trata de um caranguejo de difícil cultivo e, aspectos relacionados principalmente com a nutrição larval merecem maior investigação.
Para G. cruentata, várias tentativas anteriores no Laboratório de Carcinologia do Instituto de Estudos Costeiros do Campus Universitário de Bragança-PA, foram realizadas nas quais, em experimentos foram testados diferentes tipos de alimentos como a microalga Dunaliella viridis, mas não se obteve sucesso na sobrevivência das larvas. Outro tipo de alimento utilizado foi o rotífero Brachionus plicatilis, que apresenta reduzido tamanho e poderia ser mais adequado. No entanto, experimentos têm indicado que possivelmente, o rotífero não oferece os requerimentos nutricionais suficientes para o desenvolvimento da larva, necessitando ainda de complementação alimentar.
No presente estudo, a microalga Thalasiossira sp. e o rotífero Brachionus plicatilis. foram utilizados como alimento para os dois primeiros estágios. Esta microalga demonstrou ser mais eficiente nesta complementação, pois apesar do reduzido número de larvas que mudaram para o estágio seguinte, obteve-se pela primeira vez sucesso em muda. Cuesta e Rodriguez (2000) utilizaram como alimento no 1º estágio de Pachygrapsus marmoratus microalga Chaetoceros gracilis obtendo sucesso em seu cultivo com o completo desenvolvimento desta espécie em seis estágios larvais. No entanto, é necessária a utilização de outros tipos de alimentos em futuras pesquisas, podendo ser este um dos fatores que está afetando o desenvolvimento larval de G. cruentata.
A duração média para cada estágio foi 6,5 e 9 dias para os estágios I e II, respectivamente. A média para mudança ao estágio II foi quase igual à observada para Pachygrapsus transversus (Tab. 1). Porém, bastante superior àquela observada para P. marmoratus (3,5 dias). No entanto, o período de intermuda do estágio II de G. cruentata foi bastante longo se comparado com P. marmoratus com 4 dias (CUESTA & RODRÍGUEZ, 1994). Este período longo de intermuda pode estar ou não relacionado a problemas nutricionais, afetando o desenvolvimento normal das larvas, ou mesmo ser seu próprio ritmo biológico.
Em relação ao tamanho, G. cruentata apresentou menor tamanho quando comparado com P. marmoratus e P. transversus (Tab. 1). Este reduzido tamanho associado à dificuldade de apreensão de partículas maiores pode ser um dos fatores da alta mortalidade no primeiro estágio de zoea desta espécie.
As características morfológicas observadas no estágio I de G. cruentata foram bastante semelhantes àquelas primeiras larvas descritas anteriormente, eclodidas a partir de fêmeas coletadas em Ubatuba/SP por Fransozo et al. (1998) não havendo divergências morfológicas significativas apesar da distância geográfica em que as fêmeas ovígeras foram coletadas.
As comparações morfológicas dos três estágios de G. cruentata obtidos com os grapsídeos P. marmoratus e P. transversus (Tabelas II, III e IV) mostram que G. cruentata possui estreitas similaridades morfológicas em relação às espécies citadas. Este fato demonstra as estreitas semelhanças morfológicas que existem dentro deste grupo. No entanto, G. cruentata apresentou diferenças no arranjo da setação entre as três espécies, mas com números muito próximos, o que pode ser suficiente para estudos conclusivos de identificação de espécies coletadas no ambiente natural. Entretanto, observa-se em todos os três estágios iniciais um número maior de cerdas nos exópodos dos 1º e 2º maxilípedes (6 cerdas), sendo esta diferença considerada importante para distinções entre estas espécies.
A relevante importância biológica e econômica que G. cruentata representa e ter parte do ciclo larval conhecido, sugere fortemente que futuros estudos que tenham como metas o estudo da biologia larval sejam realizados, para que programas como os de repovoamento em áreas de sobre-exploração desta espécie sejam possíveis.
REFERÊNCIAS BIBLIOGRÁFICAS
ABRUNHOSA, F. A.; KITTAKA, J. Functional morphology of mouthparts and foregut of the last zoea, glaucothoe and first juvenile of the king crabs Paralithodes camtschaticus, P. brevipes and P. platypus. Fisheries Science, Tóquio, v. 63, n. 6, p. 923 – 930, 1997.
ABRUNHOSA, F. A.; PIRES, M. A. B.; LIMA, J. F.; COELHO-FILHO, P. A. Larval development of Lepidophthalmus siriboia Felder & Rodrigues, 1993 (Decapoda: Thalassinidea) from the Amazon region, reared in the laboratory. Acta Amazonica, Manaus, v. 35, n. 1, p. 77 – 84, 2005.
ABRUNHOSA, F. A.; ABRUNHOSA, J. P. Efeito da salinidade sobre o primeiro estágio larval do aratu Goniopsis cruentata (Latreille, 1803) (Decapoda; Grapsidae) cultivado em laboratório. Tropical Journal of Fisheries and Aquatic Science, Belém, v. 20, n. 1, p. 21 – 25, 2020.
BOTELHO, E. R. O; ANDRADE, C. E. R.; SANTOS, M. C. F. Estudo da população de aratu-do-mangue, Goniopsis cruentata (LATREILLE) (Crustacea, Brachyura, Grapsidae) no estuário do rio Camaragibe (Alagoas-Brasil). Boletim Técnico Científico do CEPENE, Tamandaré, v. 12, n. 1, p. 91 – 98, 2004.
BOUSQUETTE, G. D. The larval development of Pinnixa longipes (Lockington, 1877) (Brachyura: Pinnotheridae), reared in the Laboratory. The Biological Bulletin, Miami, v. 159, n. 3, p. 592 – 605. 1980.
BROSSI-GARCIA, A. L.; RODRIGUES, M. D. Zoeal morphology of Pachygrapsus gracilis (Saussure, 1858) (Decapoda, Grapsidae) reared in the laboratory. Invertebrate Reproduction & Development, v. 24, n. 3, p. 197 – 205, 1993.
BROSSI-GARCIA, A. L.; RODRIGUES, M. D. Zoeal morphology of Pachygrapsus transversus (Gibbes) (Decapoda, Grapsidae) reared in the laboratory. Revista Brasileira de Zoologia, Curitiba, v. 14, n. 4, p. 803 – 819, 1997.
CUESTA, J. A.; RODRÍGUEZ, A. Early zoeal stages of Pachygrapsus marmoratus (Fabricius), P. transversus (Gibbes) and P. maurus (Lucas) (Decapoda, Brachyura, Grapsidae) reared in the laboratory. Bulletin of Marine Science, Miami, v. 58, n. 4, p. 323 – 327, 1994.
CUESTA, J. A.; GONZÁLEZ-GORDILLO, J. I.; RODRÍGUEZ, A. First zoeal of Grapsus adscensionis (Osbeck) and Planes minutus (Linnaeus) (Brachyura: Grapsidae) described from laboratory hatched material, with notes on larval characters of the Grapsinae. Journal of Natural History, Londres, v. 31, p. 887 – 900, 1997.
CUESTA, J. A.; SCHUBART, C. D. First zoeal stages of Geograpsus lividus and Goniopsis pulchra from Panama: consistent larval characters within the subfamily Grapsinae (Crustacea: Brachyura: Grapsidae). Ophelia, v. 51, n. 3, p. 163 – 176, 1999.
CUESTA, J. A; RODRIGUEZ, A. Zoeal estages of the intertidal crab Pachygrapsus marmoratus (Fabricius, 1787) (Brachyura, Grapsidae) reared en the laboratory. Hydrobiologia, Amsterdam, v. 436, n. 1 – 3, p. 119 – 130, 2000.
CUESTA, J. A.; ANGER, K. Larval morphology of the sesarmid crab Armases angustipes Dana, 1852 (Decapoda, Brachyura, Grapsoidea). Journal of Crustacean Biology, Kansas, v. 21, n. 3, p. 821 – 838, 2001.
DIAZ, H.; EWALD, J. J. A comparison of the larval development of Metasesarma rubripes (Rathbun) and Sesarma ricordi H. Milne Edwalds (Brachyura, Grapsidae) reared under laboratory conditions. Crustaceana, Netherlands, n. 2, p. 225 – 248, 1968.
FIELDER, D. R.; GREENWOOD, J. G. The complete larval development of Metopograpsus frontalis Miers (Decapoda, Grapsidae), reared in the laboratory. Proceeding Royal Society of Queensland, Queensland, v. 94, p. 51 – 60, 1983.
FLORES, A. A. V; PAULA, J.; DRAY, T. First zoeal stages of grapsoid crabs (Crustacea: Brachyura) from the East African coast. Zoological Journal of the Linnean Society, Londres, v. 137, n. 3, p. 355 – 383, 2003.
FRANSOZO, A.; CUESTA, J. A.; NEGREIROS-FRANSOZO, M. L. The first zoeal stage of two species of Grapsidae (Decapoda, Brachyura) and a key to such larvae from the Brazilian coast. Crustaceana, Netherlands, v. 71, n. 3, p. 331 – 343, 1998.
GUERAO, G. O.; ANGER, K.; NETTELMANN, U. W. E.; SCHUBART, C. D. Complete larval and early juvenile development of the mangrove crab Perisesarma fasciatum (Crustacea: Brachyura: Sesarmidae) from Singapore, with a larval comparison of Parasesarma and Perisesarma. Journal of Plankton Research, Oxford, v. 26, n. 12, p. 1389 – 1408, 2004.
IBAMA. Constituição (1989). Portaria nº 1522, de 19 de dezembro de 1989. Reconhece como lista oficial de espécies da fauna brasileira ameaçada de extinção. Portaria 1522, de 19 de Dezembro de 1989. Seção 1. Disponível em: https://www.ibama.gov.br/sophia/cnia/legislacao/IBAMA/PT1522-191289.PDF. Acesso em: 22 nov. 2024.
ISLAM, M. S; SHOKITA, S.; SHIKATANI, N. Larval development of the mangrove sesarmid crab Neosarmatium indicum (Brachyura: Grapsoidea) described from laboratory-reared material. Journal of Crustacean Biology, Kansas, v. 22, n. 2, p. 916 – 937, 2002.
ISLAM, M. S.; RAHMAN, M. A.; SHIGEMITSU, S. Larval development of the mangrove sesarmid crab Neosarmatium trispinosum (Brachyura: Grapsoidea) described from laboratory-reared material. Journal of Crustacean Biology, Kansas, v. 24, n. 2, p. 356 – 371, 2004.
KAKATI, V. S. Larval development of the Indian Grapsid crab, Metopograpsus latifrons H. Milne Edwards in vitro. Indian Journal of Marine Science, Nova Deli, v. 11, n. 4, p. 311 – 316, 1982.
MAGALHÃES, C.; MEDEIROS, N. The larval development of Palaemonid shrimps from the Amazon Region reared in the Laboratory. In: VII. Abbreviated development of Pseudopalaemon amazonensis Ramos-Porto, 1979 (Crustacea: Decapoda: Caridea). Acta Amazonica, Manaus, v. 28, n. 4, p. 433 – 448, 1998.
MELO, G. A. S. Manual de identificação dos Brachyura (caranguejos e siris) do litoral brasileiro. São Paulo: Plêiade/Fundação de Amparo à Pesquisa do Estado de São Paulo – FAPESP, 1996. 604p.
MURAOKA, K. On the characters of the larva and the seasonal change of occurrence of the Sargassum crab, Planes cyaneus Dana. Bulletin Kanagawa Prefecture Museum, Kanagawa, n. 6, p. 45 – 53, 1973.
OSHIRO, L. M. O.; SILVA, R.; SILVA, Z. S. Composição da fauna de braquiúros (Crustacea, Decapoda) dos Manguezais da Baía de Sepetiba – RJ. Nauplius, Rio Grande, v. 6, p. 31 – 40, 1998.
PASUPATHI, K.; KANNUPANDI, T. Laboratory reared larval stages of the mangrove grapsid crab Metopograpsus maculates H. Milne Edwards. Mahasagar, v. 19, n. 4, p. 233 – 244, 1986.
PEREYRA-LAGO, R. Larval development of Sesarma catenata Ortmann (Brachyura: Grapsidae: Sesarminae) reared in the laboratory. South African Journal of Zoology, Transkei, v. 22, n. 3, p. 200 – 212, 1987.
SCHLOTTERBECK, R. E. The larval development of the lined shore crab, Pachygrapsus crassipes Randall, 1840 (Decapoda, Brachyura, Grapsidae) reared in the laboratory. Crustaceana, Netherlands, v. 30, p. 184 – 200, 1976.
WEAR, R. G. Life-history studies on New Zealand Brachyura: 4. Zoea larvae hatched from crabs of the family Grapsidae. Journal of Marine Freshwater Research, Amsterdam, v. 4, n. 1, p. 3 – 35, 1970.
TABELAS


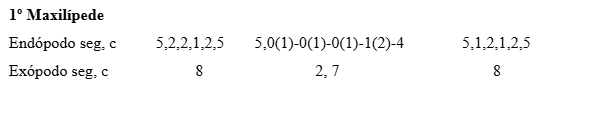

1Orcid: https://orcid.org/0000-0002-6227-4272
