CONTINUOUS USE OF GLUCOCORTICOIDS IN THE TREATMENT OF GRANULOMATOUS MENINGOENCEPHALITIS AND ITS CONSEQUENCES: CASE REPORT
REGISTRO DOI: 10.69849/revistaft/fa10202411211513
Vitória Gabrielly Nogueira Ribeiro¹,
Lenara Benine²,
Marjory Garcia de Oliveira³
RESUMO
A meningoencefalomielite granulomatosa (MEG) é uma doença inflamatória idiopática do sistema nervoso central, em que sua etiologia pode estar relacionada a doenças infecciosas, neoplásicas, imunomediadas e associadas a fatores ambientais e genéticos. Geralmente de evolução rápida e progressiva, atingindo cães de qualquer raça ou idade, principalmente raças pequenas e adultos jovens. Os sinais clínicos variam de acordo com a área acometida e extensão da lesão. O diagnóstico é presuntivo, através de anamnese, exame clínico, exclusão de doenças infecciosas, análise do líquido cefalorraquidiano e exames de imagem. O tratamento baseia-se na imunossupressão através de glicocorticoide a longo prazo, que pode levar a endocrinopatias como hipercortisolismo e diabetes mellitus. O objetivo desse trabalho foi relatar um caso de meningoencefalomielite granulomatosa em um cão, maltês, macho, de oito anos de idade, cujo desenvolveu doenças secundárias devido ao uso prolongado de glicocorticoide, atendido em um hospital veterinário, em Maringá, Paraná.
Palavras-chave: cães; diabetes mellitus; glicocorticoides; hipercortisolismo.
ABSTRACT
Granulomatous meningoencephalomyelitis (GME) is an idiopathic inflammatory disease of the central nervous system, whose etiology may be related to infectious, neoplastic, immune-mediated diseases and associated with environmental and genetic factors. It usually has a rapid and progressive evolution, affecting dogs of any breed or age, mainly small breeds and young adults. Clinical signs vary according to the affected area and extent of the lesion. Diagnosis is presumptive, through anamnesis, clinical examination, exclusion of infectious diseases, analysis of cerebrospinal fluid and imaging tests. Treatment is based on immunosuppression through long-term glucocorticoids, which can lead to endocrinopathies such as hypercortisolism and diabetes mellitus. The aim of this study was to report a case of granulomatous meningoencephalomyelitis in an eight-year-old male Maltese dog, which developed secondary diseases due to prolonged use of glucocorticoids, treated at a veterinary hospital in Maringá, Paraná.
Keywords: dogs; diabetes mellitus; glucocorticoids; hypercortisolism.
INTRODUÇÃO
As lesões de caráter inflamatório do sistema nervoso central vêm se tornando um desafio para o clínico veterinário por ocasionarem comprometimento neurológico grave. Essas inflamações são caracterizadas de acordo com a região acometida, como encéfalo (encefalite), medula espinhal (mielite) ou meninges (meningite), podendo acometer várias regiões simultaneamente. Essas afecções são classificadas em encefalomielites de origem conhecida, apresentando algum agente infeccioso como vírus, bactérias, protozoários e fungos, e as encefalomielites de etiologia não conhecida, de caráter não infeccioso (JERICÓ; ANDRADE NETO; KOGIKA, 2015).
Classifica-se a meningoencefalomielite de etiologia desconhecida não infecciosa em meningoencefalomielite granulomatosa (MEG), sendo uma doença de evolução rápida e progressiva, atingindo cães de qualquer raça e idade, principalmente raças pequenas e adultos jovens (LORENZ et al., 2001; MUÑANA, 2004; CHERUBINI, 2006; DELAHUNTA e GLASS, 2009; GRANGER et al., 2010).
Os sinais clínicos mais comuns da MEG focal são ausência de propriocepção, alterações comportamentais, convulsões, cegueira cortical, andar compulsivo em círculo, compressão da cabeça contra objetos, déficits dos nervos cranianos e hemiparesia ipsilateral. Quando se acomete a medula espinhal, o paciente pode apresentar dor cervical, tetraparesia ou paraparesia e ataxia proprioceptiva (BIRCHARD; SHERDING, 2008; TILLEY; SMITH JR., 2015).
O diagnóstico ante mortem é presuntivo, é realizado através da resenha, anamnese, exame clínico, exclusão de doenças infecciosas, análise do líquido cefalorraquidiano e exames de imagem como tomografia e ressonância magnética (JERICÓ; ANDRADE NETO; KOGIKA, 2015), e posteriormente deve-se realizar a estabilização neurológica do paciente, para que assim o tratamento com imunossupressores se inicie, principalmente com corticosteroides, que retardam ou interrompem a progressão da doença (COATES; JEFFERY, 2014).
A droga imunossupressora de escolha é a prednisolona, podendo ser usada por longos períodos e realizando regime de redução posterior. Com a interrupção da medicação ou doses ineficazes os sinais clínicos podem retornar, entretanto, o uso prolongado de corticosteroide pode ocasionar vários efeitos colaterais (FISHER, 2002; MUÑANA, 2004; DELAHUNTA e GLASS, 2009; SMITH, STALIN, SHAW, et al., 2009; Granger et al., 2010).
Os glicocorticóides são hormônios sintetizados a partir do cortisol, são anti-inflamatórios e antialérgicos que inibem a ação de células e enzimas que agem na inflamação. Esses hormônios podem interferir direta ou indiretamente no metabolismo do organismo, como o processo da gliconeogênese no fígado, a diminuição da utilização de glicose pelos tecidos, devido a uma maior resistência à insulina, e a lipólise (MOURA, 2015).
A administração exógena excessiva de corticóides ocasiona o hipercortisolismo iatrogênico (RHODES, 2005), levando a diminuição do uso das glândulas adrenais ocasionando a hipoplasia da glândula, pois o cortisol exógeno inibe a produção do hormônio adrenocorticotrópico (ACTH) (NICHOLS, 1998; FELDMAN, 1999). Um dos efeitos colaterais é o aumento da glicemia, levando a resistência insulínica, podendo resultar em diabete mellitus tipo 2 (NELSON, 2015).
As endocrinopatias mais comuns ocasionadas pelo uso excessivo de glicocorticoide que acometem os cães são o hipercortisolismo o e a diabetes mellitus e caracterizam-se por aumento nos níveis séricos de cortisol e glicosúria associada à hiperglicemia persistente, respectivamente (NELSON; COUTO, 2010).
O principal sinal clínico do hipercortisolismo é distensão abdominal, pelo acúmulo de glicogênio no fígado causando hepatomegalia (SANTOS; ALESSI, 2017). Polidipsia, poliúria, polifagia, fraqueza muscular e letargia, também são observados no hipercortisolismo e na diabetes mellitus (ROSA et al., 2011; MOURA, 2015; SANTOS; ALESSI, 2017). O diagnóstico de ambas as endocrinopatias se baseia na observação do histórico, sinais clínicos e solicitação de exames como hemograma, perfil renal, perfil hepático e urinálise (CHASTAIN, 1997; NELSON, 2001; RHODES, 2005).
A diabetes mellitus do tipo II caracteriza-se como não dependente de insulina, ocorre uma resistência à insulina e/ou células β disfuncional. A secreção de insulina pode ser elevada, baixa ou normal, porém insuficiente para superar a resistência à insulina nos tecidos (CUNNIGHAN, 2004).
O tratamento da diabetes mellitus em cães com hiperadrenocorticismo pode ser realizado com a insulina de ação intermediária (NPH ou lenta) e, recomenda-se iniciar o tratamento com uma dose de 0,25 UI/kg a cada 12 horas (NELSON; COUTO, 2010).
Objetiva-se com o presente trabalho relatar o caso de um canino macho, maltês, oito anos de idade apresentando sinais neurológicos, diagnosticado em primeiro momento com meningoencefalomielite granulomatosa e, posteriormente, desenvolvendo hipercortisolismo iatrogênico e diabetes mellitus, enfatizando controle, manejo e complicações das patologias citadas.
RELATO DE CASO
No dia 02 de março de 2022 foi atendido em um hospital veterinário em Maringá-PR um cão, da raça maltês, macho, castrado, de oito anos de idade pesando 3,550kg, apresentando ataxia e alterações neurológicas súbitas (hemiparesia a direita, dor superficial em membros, sem propriocepção, anisocoria e nistagmo sendo alterações de nervos cranianos). Os exames hematológicos não demonstraram alterações, então, após estabilização do animal, foi coletado líquido cefalorraquidiano e realizado teste rápido para o vírus da cinomose canina, constatando não reagente. A análise do líquido cefalorraquidiano apresentou coloração discretamente xantocrômica, pH (9,0), proteinorraquia (60,0mg/dL), densidade 1.006, presença de sangue oculto, predomínio de células mononucleares, hemácias livres e íntegras. A tutora optou por não realizar a tomografia do crânio e o diagnóstico presuntivo de meningoencefalomielite granulomatosa foi dado com base no exame neurológico e exclusão de agentes infecciosos, que quando associados indicam inflamação sem doença infecciosa.
O animal foi mantido internado durante o período de cinco dias para estabilização e recebeu alta. Foram prescritos: prednisolona 5mg ¼ cp, BID, por 10 dias, glicopan pet 2ml, BID, uso contínuo e sulfadiazina + trimetoprim 0,5ml, SID, por 10 dias. O animal teve vários retornos desde então para avaliação neurológica e avaliação sistêmica, através de exames físicos e hematológicos e também alteração da dose da prednisolona, descritas na tabela abaixo.
Tabela 1: Alterações da dose da prednisolona de acordo com sinais clínicos
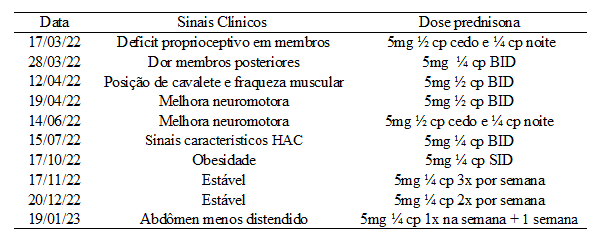
Fonte: Hospital veterinário particular (2022 – 2023).
O animal estava realizando o tratamento com glicocorticoide à quatro meses, pesando 3,800kg, e no dia 15 de julho de 2022 (relatado na tabela) apresentou-se com abdômen distendido, alterações hematológicas: trombocitose (776000mm³; valores de referência: 200000 a 500000 mm³), colesterol (322mg/dL valor e referência: 125 a 250mg/dL), alanina aminotransferase (491UI/L valor de referência: 9 a 88UI/L), fosfatase alcalina (258UI/L valor de referência: 20 a 150UI/L). Na ultrassonografia: esteatose hepática moderada, micronódulos em vesícula biliar, características de hipercortisolismo iatrogênico. O tratamento suporte foi aplicado, havendo também diminuição gradativa da prednisolona durante seu acompanhamento ao longo dos meses. Foi suspenso o uso da prednisolona no dia 28 de janeiro de 2023 após apresentar melhora clínica, e ao retorno no dia 02 de março, 1 ano após o episódio de meningoencefalomielite, obteve alta médica.
Durante todo o período de tratamento do animal outras medicações também foram prescritas para auxiliar na melhora como omeprazol 10mg, amitriptilina 3,4mg, gabapentina 14mg, tramadol 7mg, selegilina 1,8mg, SAMe 73mg + ácido ursodesoxicólico 36mg.
A tutora retornou no dia 22 de maio de 2023 relatando que os mesmos sinais clínicos do cão apresentados anteriormente voltaram, e que havia administrado via oral 2,5mg de prednisolona no dia anterior. Durante o exame físico o animal não se apresentava em estação e possuía deficit proprioceptivo em membros esquerdos. No hemograma constatou linfopenia e na ultrassonografia esteatose hepática e lama biliar. O médico veterinário solicitou tomografia do crânio (figura 1),a qual constatou lesão de caráter inflamatório e/ou infeccioso em parênquima encefálico com leve heterogeneidade difusa do mesmo, sugestivo de meningoencefalomielite, alteração em condutos auditivos podendo indicar otopatia externa, com sinais de leve cronicidade e leve acúmulo de conteúdo fluido/cerúmen em cavidade timpânica direita.
Figura 1: Exame de imagem de tomografia computadorizada de cão. A. Laudo de tomografia computadorizada do paciente. B, C e D. Heterogenicidade difusa em parênquima encefálico.
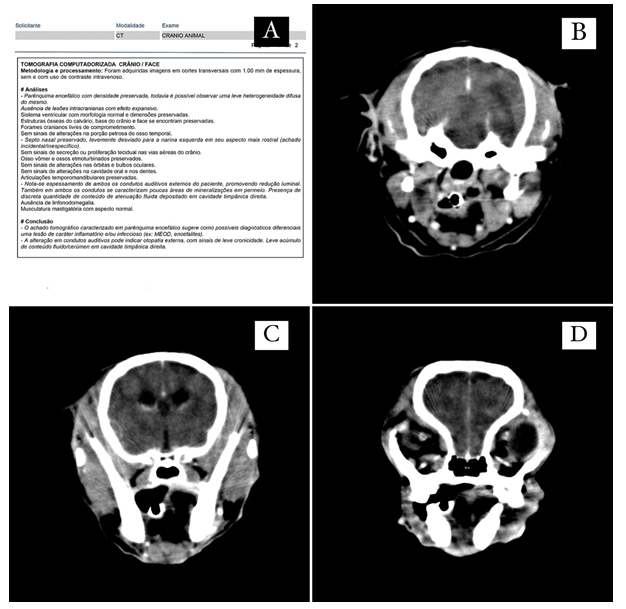
Fonte: Laboratório veterinário particular (2023).
Foram prescritos novamente por tempo indeterminado prednisolona 5mg ½ cp, SID,sulfadiazina + trimetoprim 0,5ml, SID, SAMe e ácido ursodesoxicólico. No dia 26 de maio de 2023 alterou a prednisolona para 3mg/ml, 0,6ml, BID, prescreveu a mais posatex 2gts durante 14 dias. No dia 16 de junho alterou a prednisolona para 0,3ml cedo e 0,6ml à noite.
O animal teve retorno antecipado no dia 28 de junho, pesando 3,100kg, apresentando anorexia a 2 dias, retenção fecal, polidpsia e poliúria. No exame clínico mucosas hipocoradas, no exame hematológico trombocitose 666000mm³, linfopenia leve, hiperglicemia em jejum, glicose (236mg/dL;valores de referência: 70 a 110mg/dL) , colesterol 285UI/L , triglicerídeos 254UI/L, suspeitando-se de diabetes mellitus. O Animal retornou no dia seguinte em jejum para realização da curva glicêmica, feito a mensuração três vezes a cada quatro horas, com um glicosímetro portátil, para diagnóstico.
Tabela 2: Curvas glicêmicas.
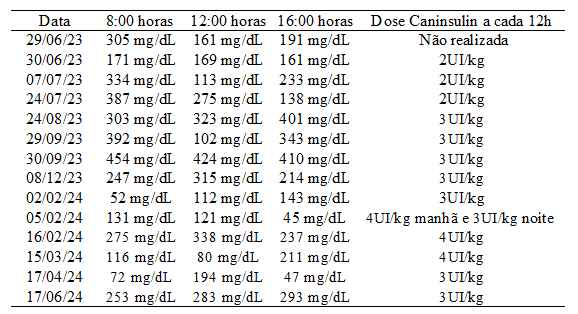
Fonte: Hospital veterinário particular (2023 – 2024).
Devido a hiperglicemia constante, ao histórico de uso prolongado de glicocorticoide e ao hipercortisolismo foi dado o diagnóstico de diabetes mellitus no dia 30 de junho, iniciando o tratamento com insulinoterapia na dose 2UI/kg via subcutânea a cada 12 horas. A primeira aferição do dia da glicemia era realizada no momento da aplicação de insulina e antes da alimentação, e em outros períodos do dia com intenção de identificar hipoglicemia, desta forma alterando a dose caso ocorresse. O animal manteve a utilização do corticoide, diminuindo gradativamente ao decorrer dos meses.
Tabela 3: Alterações da dose e frequência de uso prednisolona
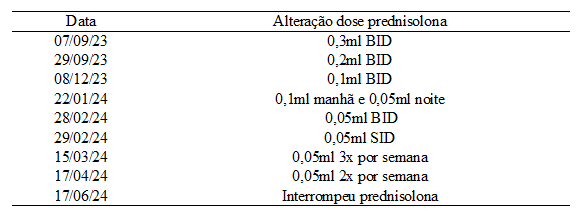
Fonte: Hospital veterinário particular (2023 – 2024).
A tutora não estava oferecendo ao animal alimentação diabética recomendada pelo veterinário, e também não estava fazendo a aplicação de insulina de forma e horário correto, iniciando apenas no dia 30 de setembro. Como consequência da diabetes, o paciente também evoluiu rapidamente para catarata bilateral, que se desenvolve quando ocorre a alta concentração de glicose no cristalino.
No dia 20 de outubro a tutora optou por realizar o procedimento cirúrgico no olho esquerdo para resolução da catarata, que consiste na retirada da lente anormal. Obteve um bom pós-cirúrgico, e no dia 01 de novembro estava enxergando novamente do olho operado, porém em casa acabou lesionando e levando a úlcera de córnea. Esteve em tratamento com colírios e soro autólogo para tentativa de cicatrização do olho, porém, ocorrendo de forma lenta em decorrência do uso de corticoide e da diabetes. O olho cicatrizou completamente no dia 05 de abril de 2024, porém o cão perdeu a visão. O animal se manteve estável durante todos os meses de tratamento, interrompendo novamente o uso do glicocorticoide no dia 17 de junho de 2024. Ao retorno no dia 23 de outubro não apresentava alterações clínicas, pesando 2,150kg, exames hematológicos e bioquímicos dentro dos parâmetros e manteve dose da insulina em 3UI/kg após realização da curva glicêmica durante o dia (1º: 196mg/dL; 2º: 287mg/dL; 3º: 164mg/dL).
DISCUSSÃO
A meningoencefalomielite é uma doença neurológica comum, porém subdiagnosticada. Os sinais clínicos em cães podem variar muito, o que torna dificultoso o diagnóstico presuntivo, pelos recursos necessários para os exames complementares, se dando um diagnóstico por exclusão.
Um diagnóstico definitivo só pode ser dado após a coleta de exames histopatológicos, geralmente após a morte do animal, os quais apresentam microscopicamente granulomas inflamatórios perivasculares, principalmente na substância branca.
Ao se analisar o líquido cefalorraquidiano pode apresentar pleocitose mononuclear, principalmente de linfócitos e macrófagos ativados, com aumento da concentração de proteínas, mas pode ser encontrada pleocitose neutrofilica ou nenhuma anormalidade. No exame de imagem, como a tomografia computadorizada, pode ser observada uma lesão em forma de massa nos quadros focais ou parênquima desuniforme e heterogêneo na forma difusa, embora alguns quadros não apresentem alterações (LORENZ et al. 2001; FISHER, 2002; MUÑANA, 2004; GRANGER, SMITH e JEFFERY, 2010).
O objetivo final do tratamento da meningoencefalomielite é a utilização do corticoide em dias alternados com a menor dose eficaz para manter a remissão dos sinais clínicos ou descontinuação do medicamento. Embora os corticosteroides apresentem uma boa resposta inicialmente, as recidivas são comuns, sendo indicado nesses casos a utilização de doses mais altas (COATES; JEFFERY, 2014).
Nos exames laboratoriais do hipercortisolismo iatrogênico de acordo com Nelson; Couto (2010), o hemograma pode apresentar trombocitose, eritrocitose e neutrofilia com linfopenia, enquanto o exame bioquímico frequentemente apresenta hipercolesterolemia, aumento de fosfatase alcalina, aumento da alanina aminotransferase, densidade urinária frequentemente menor que 1.020 e proteinúria, o que está de acordo com os achados deste caso, onde foram observados trombocitose e elevação dos níveis da fosfatase alcalina e da alanina aminotransferase.
No teste de estimulação pelo ACTH em animais com hiperadrenocorticismo iatrogênico, terá um resultado de hipocortisolismo independente de apresentarem sinais clinicos de hipercortisolismo. (MOURA, 2015). O cortisol basal estará abaixo do normal.
Na diabetes, é possível observar: leucocitose neutrofílica, hiperglicemia, hipercolesterolemia, hipertrigliceridemia, aumento da alanina aminotransferase, aumento da fosfatase alcalina, glicosúria, proteinúria e bacteriúria (NELSON; COUTO, 2010). O controle glicêmico no tratamento com insulina é difícil, e o eficiente controle em geral só é possível quando o hipercortisolismo estiver controlado e houver interrupção de medicações que causam resistência à insulina. Assim, o antagonismo a insulina causado pelo hipercortisolismo será solucionado e ocorrerá uma melhora na sensibilidade tecidual à insulina (NELSON; COUTO, 2010).
O controle do peso do animal e uma alimentação adequada é fundamental para o manejo da doença. A obesidade altera a tolerância tecidual à glicose, podendo causar uma resistência reversível à insulina. O animal obeso necessita de um maior aporte de insulina, podendo levar a uma exaustão das células β do pâncreas (VEIGA, 2005).
Dietas que apresentam uma grande quantidade de fibras são benéficas para o controle glicêmico, além de auxiliar na redução dos níveis de colesterol, glicerol livre e frutosamina sérica (JERICÓ et al., 2014).
Para ajustes na dose da insulina é realizado a curva glicêmica, onde repetidas amostras de sangue são coletadas a cada uma ou duas horas em um período de doze a vinte e quatro horas (MOONEY; PETERSON, 2015).
CONCLUSÃO
Conclui-se que o paciente relatado superou a expectativa de vida da meningoencefalomielite e suas consequências como o hiperadrenocorticismo e diabetes mellitus, obteve resposta aos tratamentos impostos evoluindo para uma ótima melhora clínica. O objetivo do tratamento é eliminar as manifestações clínicas das doenças acometidas além de evitar as complicações crônicas associadas.
O animal relatado suspendeu o uso da prednisolona no dia 17 de junho e se apresentava estável. A suspensão do uso do corticoide também é uma tentativa de o animal deixar de apresentar resistência à insulina, observar se o organismo continua sua produção normal e a mesma ser capaz de realizar sua ação nas células-alvo.
Ademais, cães diabéticos bem controlados não precisam apresentar normoglicemia (80 a 120 mg/dL). Podem se apresentar saudáveis e assintomáticos se os valores de glicemia estiverem entre 100 e 250 mg/dL na maior parte do dia. Pela cegueira causada pela diabetes muitos cuidados em domicílio deverão ser adotados, como evitar o risco de quedas.
Neste relato o tutor foi bastante contribuidora para melhora clínica e controle das doenças, seguindo atenciosamente as recomendações dadas pelo médico veterinário. É de suma importância relatar este caso para que possa servir de auxílio ao clínico veterinário na identificação dos pacientes possivelmente acometidos por meningoencefalomielite granulomatosa, de maneira rápida e eficiente na prática da clínica médica de pequenos animais, visto que, é uma afecção de diagnóstico por exclusão, presuntivo, e de poucos relatos.
REFERÊNCIAS
Birchard, S. J.; Sherding, R. G. Manual Saunders de Clínica de Pequenos Animais. 3. ed. São Paulo, Roca, 2008. 2048 p.
Chastain, C. B. O sistema endócrino e metabólico. In: GOLDSTON, R.T., HOSKINS, J.D. Geriatria e gerontologia cão e gato. Roca: São Paulo, 1997
Cherubini, G. B. Characteristics of magnetic resonance images of granulomatous meningoencephalomyelitis in 11 dogs. Vet. Rec. v. 159, n. 4, p 110-115, 2006.
Coates, J. R.; Jeffery, N. D. Perspectives on Meningoencephalomyelitis of Unknown Origin. Veterinary Clinics Of North America: Small Animal Practice, v. 44, n. 6, p. 1157- 1185, nov. 2014. Elsevier BV.
Cunnigham, J. G. Tratado de fisiologia veterinária. 3. ed. Rio de Janeiro: Guanabara Koogan, 2004, p. 360.
De Lahunta, A.; Glass, E. Veterinary Neuroanatomy and Clinical Neurology. 3ed. Missouri: Saunders Elsevier, 2009. 540 p.
Feldman, E. C. Hiperadrenocorticismo. In: ETTINGER, J. S., FELDMAN, E. C. Tratado de medicina interna veterinária. Manole: São Paulo, 1999.
Fisher, M.; Disseminated granulomatous meningoencephalomyelitis in a dog. Can. Vet. J.; v. 43, n. 1, p 49–51, 2002.
Granger, N.; Smith,P.M.; Jeffery,N.D.; Clinical findings and treatment of noninfectious meningoencephalomyelitis in dogs: A systematic review of 457 published cases from 1962 to 2008. The Vet. J. v. 184, n. 3, p. 290-297, 2010.
Jericó, M. M. et al.Tratado de Medicina Interna de Cães e Gatos. 2. ed. Rio de Janeiro: Editora Guanabara Koogan Ltda, 2014. 2464 p.
Jericó, M. M.; ANDRADE NETO, J. P.; KOGIKA, M. M. Tratado de Medicina Interna de Cães e Gatos. 2. ed. Rio de Janeiro: Roca, 2015. 2394 p.
Lorenz, M. D.; Coates, J. R.; Kent, M. Handbook of Veterinary Neurology. 5 ed. Missouri, Saunders Elsevier, 2001. 545p.
Mooney,Carnel T.; Peterson, Mark E. BSAVA| Manual de Endocrinologia em Cães e Gatos. 4. ed. Rio de Janeiro: Roca, 2015. 356 p.
Moura, F. T. B.; Hiperadrenocorticismo canino: abordagem diagnóstica e terapêuticas. 2015. 91 p. Dissertação (Mestrado Integrado em Medicina Veterinária) – Universidade Lusófona de Humanidades e Tecnologia – Lisboa, Portugal. Disponível em < http://recil.grupolusofona.pt/bitstream/handle/10437/6791/Filipa%20Moura%2014.04. 15%20revJR_FINAL.pdf?sequence=1 >
Muñana, K. R. Head tilt and nystagmus. In: PLATT, S. R.; OLBY, N. J. BSAVA Manual of Canine and Feline Neurology.3ed. London: BSAVA, 2004, p. 155-171.
Nelson, R. W.; COUTO, G. C. Medicina interna de pequenos animais. 4ª Ed. Rio de Janeiro: Elsevier, 2010.
Nelson, R. W. et al. Canine diabetes mellitus Canine and Feline. Endocrinology, v. 4, n. 6, p. 213-257, 2015.
Nichols, R., Peterson, M. E., Muller, H. S. Glândulas adrenais. In: BIRCHARD, S. S., SHERDING, R. G. Clínica de pequenos animais. Roca: São Paulo, 1998.
Rhodes, K. H. Dermatologia de pequenos animais. Revinter: Rio de Janeiro, 2005.
Rosa, V. M.; Carniato, C. H. O; Cavalaro, G. C.; Hiperadrenocorticismo em cães. IN: VII EPCC – Encontro Internacional de Produção Científica CESUMAR, ENCICLOPÉDIA BIOSFERA, Centro Científico Conhecer – Goiânia, v.14 n.26; p. 2017 395 2011, Maringá. Anais eletrônicos… Maringá: CESUMAR.
Santos, R. L., Alessi, A. C. Patologia Veterinária. 2 ed. Rio de Janeiro: Rocca 2017. p.842.
Smith, P.M.; Stalin, C.E.; Shaw, D.; et al.; Comparison of Two Regimens for the Treatment of Meningoencephalomyelitis of unknown etiology. J. Vet. Intern. Med. v. 23, n. 3, p 520–526, 2009.
Tilley, L.P.; Smith JR., F.W.K. Consulta Veterinária em 5 Minutos: espécies canina e felina. 5. ed. Sp: Manole, 2015. 1564 p.
Veiga, Â. P. Medeiros. Obesidade e diabetes mellitus em pequenos animais. In: ANAIS II SIMPÓSIO PATOLOGIA CLÍNICA DA REGIÃO SUL DO BRASIL, 2., 2005,Porto Alegre. Anais […]. Porto Alegre-RS: Universidade Federal do Rio Grande do Sul,2005. p. 82-91.
1UNINGÁ – Centro Universitário Ingá, Departamento Medicina Veterinária E-mail: vitoriangr23@gmail.com
2UNINGÁ – Centro Universitário Ingá, Departamento Medicina Veterinária
3UNINGÁ – Centro Universitário Ingá, Departamento Medicina Veterinária
