REGISTRO DOI: 10.69849/revistaft/cs10202411161612
Mario Augusto Tremante
RESUMO
O mastocitoma é um tumor mesenquimal redondo que acomete mastócitos em tecido cutâneo, representa de 7 a 21% de todos os tumores de pele em cães e cerca de 11 a 27% dos tumores malignos em cães. As raças mais acometidas são Boxer, Boston Terrier e Bulldog Inglês, além do Labrador, Golden Retriever e Shar Pei. Pode ocorrer um único nódulo de comportamento benígno a vários nódulos de comportamento malígno na derme e no tecido subcutâneo, mais pode ocorrer também em conjuntiva, glândula salivar, nasofaringe, laringe, cavidade oral, trato gastrointestinal e coluna. Nos gatos, os mais predispostos são os da raça siamês, machos e jovens e não ocorre predileção por idade. Pode ocorrer como uma massa elevada e firme, avermelhada ou não, com bordo assemelhando-se a uma borbulha e o centro amarelado, ou ainda como uma massa mole, pouco definida que geralmente possui pelos, e raramente é ulcerada ou avermelhada, as suas margens microscópicas estendem-se bastante para além do palpável à superfície. O diagnóstico é feito por citologia aspirativa com agulha fina e avaliação histológica para determinar o grau de malignidade, sendo a melhor forma de graduação, a classificação em baixo e alto grau.Nos felinos o diagnóstico é feito por citologia aspirativa com agulha fina. O tratamento para o mastocitoma em cães, vai depender da avaliação das condições físicas do paciente, além de fatores clínicos, classificação histológica e graduação do tumor. O tratamento mais indicado é a cirurgia, com margem de segurança de 3 cm, e também a radioterapia, e quimioterapia indicada para mastocitomas de alto grau e pode ser empregada com o objetivo de cito-redução ou como adjuvante à cirurgia ou associação dos três. Estudos recentes citam ainda inibidores da tirosina-quinase, eletroquimioterapia, terapêutica fotodinâmica. Em felinos o tratamento indicado é cirúrgico. O prognóstico vai depender da localização, número de tumor e presença de ulceração. Objetivou-se com este trabalho, uma revisão de literatura que trata do mastocitoma cutâneo canino e felino, abordando aspectos de incidência, etiologia, apresentação clínica, estadiamento clínico, diagnóstico, modalidades de tratamento e prognósticos.
Palavras-chave: tumor, diagnóstico, tratamento
1. INTRODUÇÃO
Mastocitoma cutâneo pode se apresentar na forma de lesões pequenas localizadas até neoplasias de comportamento agressivo, em cães de idade em torno de 9 anos, com maior incidência na região caudal do animal,na bolsa escrotal e no flanco, na região perianal e inguinal, focinho, cavidade oral e nasal. Geralmente ocasionam metástases (Prado et al., 2012).
A causa do desenvolvimento dos matocitomas ainda não está bem definida. As inflamações crônicas ou irritação na pele de algumas raças podem ser uma possível causa de base genética e não existem evidências de causa viral. (Furlani et al., 2008). Apresentam comportamento biológico variado sendo necessária a avaliação minuciosa da localização, taxa de crescimento, estágio clínico do tumor, sinais sistêmicos apresentados e, principalmente, o grau histológico do tumor (Lopes, 2016).
O diagnóstico é baseado na citologia e no exame histopatológico das lesões, o exame histopatológico é necessário para determinar o grau histopatológico da neoplasia para o delineamento adequado do tratamento e prognóstico. (Furlani et al., 2008). Mastocitomas podem ser tratados com cirurgia, radioterapia e quimioterapia, (Daleck, 2016).
Nos gatos existem duas formas de mastocitoma: a visceral e a cutânea. A primeira envolve o fígado, baço, linfonodos abdominais e intestino, tendo como sintomas vômitos, depressão, anorexia, perda de peso , esplenomegalia e geralmente o prognóstico é de reservado a ruim. A segunda engloba a pele e o subcutâneo, geralmente com tumores solitários e tem predileção pelas regiões da cabeça e do pescoço, e o seu tamanho varia de 0,2 a 3,0 cm e podendo apresentar alopecia e ulcerações. Em gatos, a classificação é feita em mastocitomas mastocíticos que costumam ser cutâneos, solitários e tem predileção por cabeça e pescoço e os histiocíticos que geralmente são múltiplos, não pruriginosos e têm regressão espontânea. O tratamento indicado é cirúrgico. (Viana, 2014).
2. DESENVOLVIMENTO
2.1 Mastocitoma em cães
Os mastócitos estão relacionados a processos inflamatórios presentes na pele e a maioria dos mastocitomas originam em locais onde há uma lesão de pele , de forma que existe a evidência da relação entre a reação inflamatória local na epiderme e etiopatogenia do mastocitoma cutâneo (London e Seguin, 2003).
A maior parte dos órgãos e tecidos do corpo apresentam mastócitos, células arredondadas de tamanho grande e alongadas nos tecidos, com citoplasma repleto de grânulos metacromáticos , constituídos principalmente por: histamina, heparina , aril-sulfatase, peroxidase e fator quimiotático de eosinófilo e neutrófilo, com membrana plasmática com um grande número e variedade de receptores; (Daleck et al., 2016). Células presentes no tecido conjuntivo, os locais do corpo do animal que mais interagem com o ambiente, como pele, pulmão e trato gastrointestinal, apresenta uma quantidade maior de mastócitos. Em cães, a pele e o fígado apresentam maior quantidade de mastócitos. (Zappulla et al, 2002).
Os mastócitos ativam linfócitos T, sendo assim importantes na defesa do organismo contra helmintos e bactérias. Podem se diferenciar em mastócitos de mucosa, encontrados no pulmão e trato gastrointestinal e os mastócitos de tecido conjuntivo encontrados na derme e em menor número no parênquima do fígado , rins e glândulas adrenais. Os mastócitos do tecido conjuntivo são maiores e apresentam grânulos citoplasmáticos metacromáticos, maiores e em maior quantidade. (Abraham, 2012).
Os mastócitos atuam no sistema imunológico da pele e mucosas, expressam em sua superfície receptores para IgE, ao ocorrer a ligação da imunoglobulina ao seu receptor na superfície dos mastócitos, ativa os mastócitos levando a produção e liberação de mediadores inflamatórios (Daleck, 2016). Os mediadores inflamatórios podem ser pré-formados, a heparina e histamina que são sintetizadas e armazenadas para serem liberadas posteriormente e os mediadores inflamatórios secundários os leucotrienos e prostaglandinas que são sintetizadas e em seguida liberados. (Prado et al., 2012; Daleck, 2016).
Os mediadores inflamatórios vão causar aumento da permeabilidade vascular, vasodilatação, espasmos musculares, prurido, alterações na coagulação, ativação de eosinófilos e neutrófilos que causam reação de hipersensibilidade local e sistêmica (Macedo,2014). Ocorre um acúmulo de mastócitos próximos às células tumorais, antes do início da angiogênese que facilita a propagação da metástase (Macedo, 2014). Em 76% dos casos ocorrem metástases nos linfonodos regionais e os órgãos acometidos são fígado, baço, medula óssea sendo pulmões, rins e coração pouco afetados (Prado et al., 2012).
Tumores formados por mastócitos, que podem ser benignos ou malignos, solitários ou múltiplos, podem ocorrer de forma natural em várias espécies de animais (Feerri,1957). Trata-se de uma proliferação anormal de mastócitos (Melo, 2010).Pode ser formado na derme, subcutâneo, pulmões e no trato gastrointestinal. (Daleck; Rocha; Ferreira, 2016). Este tipo de tumor apresenta-se como uma massa sólida com diâmetro em torno de 10cm, circunscrita, firme com 3 cm de altura em média, pode ter coloração avermelhada com borda circular podendo apresentar coloração amarela no centro (Figura1) ou pode apresentar-se como uma massa mole, não definida com presença de pêlos, normalmente com coloração não avermelhada. Devido a liberação de histamina pelas células neoplásicas, o mastocitoma pode apresentar prurido, eritema, edema e úlcera. (Goldschimidt, 2002; Macy; Macewen, 1989).
As massas tumorais observadas nos animais aumentam e diminuem de tamanho periodicamente em consequência do edema local e da inflamação produzida pela liberação de histamina e enzimas proteolíticas. A manipulação mecânica do tumor durante o exame físico, com retirada de amostras para exames complementares, provoca a degranulação massiva dos mastócitos, levando a uma rápida inflamação da região e surgimento de eritema e prurido que é conhecido como sinal de Darier, o que é de grande importância e significado para a sugestão do diagnóstico clínico do mastocitoma (Prado et al., 2012). É a terceira neoplasia cutânea mais comum em cães. Ocorre em cães idosos de ambos os sexos (Rech et al., 2004; Melo.,2010; Ledur.,2015; Horta.,2016), ocorrência maior em cães sem raça definida e raças braquicefálicas (London; Thamm, 2013; Nelson; Couto, 2015). É a segunda neoplasia cutânea mais comum em felinos (Lopes et al., 2017).
Figura 1 – Mastocitoma cutâneo em cão
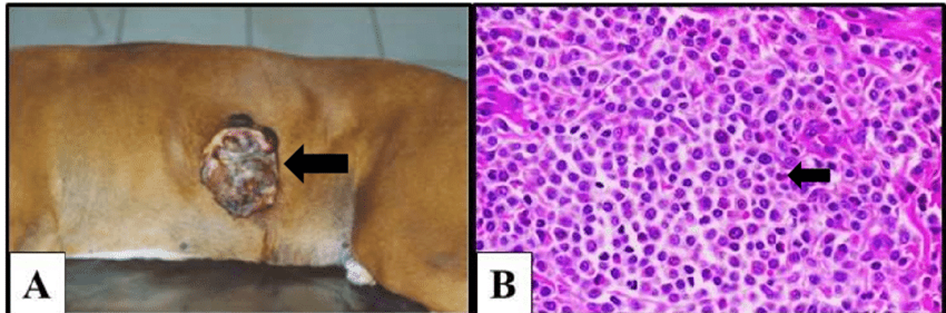
Mastocitoma cutâneo canino. A) Massa alopécica, ulcerada e hemorrágica (seta) na região tóraco-abdominal lateral esquerda de um cão da raça Boxer. B) Fotomicrografia de mastocitoma moderadamente diferenciado, mostrando proliferação de mastócitos neoplásicos em forma de cordões, com citoplasma discretamente granular, moderado pleomorfismo celular, anisocariose, nucléolos evidentes e eosinófilos ocasionais (seta). HE, 400x.
Fonte: A) Adaptado de SOUZA (2005) e B) Adaptado de www.cal.vet.upenn.edu/projects/derm/index.html.
2.2 Mastocitoma em felinos
O mastocitoma cutâneo em felinos (Figura 2), apresenta comportamento benigno na maioria dos casos (Texeira.,2015). Inflamações crônicas, carcinógenos tópicos, fatores hereditários e infecções virais acompanhadas por imunossupressão podem ser a causa dos mastocitomas em gatos. (Daleck; Nardi, 2016). Macroscopicamente pode apresentar-se na derme como uma massa elevada e firme, não encapsulado avermelhada ou não, com bordo assemelhando-se a uma borbulha e o centro amarelado, ou ainda como uma massa mole, pouco definida que geralmente possui pelos, e raramente é ulcerada ou avermelhada. Quando em comportamento maligno os nódulos são múltiplos, firmes ou flutuantes, eritematosos ou ulcerados, aderidos e infiltrativos. Nos casos benignos observamos um único nódulo com dimensão restrita,macio, bem delimitado, não aderido e sem ulcerações(Palma et al., 2009; Daleck; Nardi, 2016).
Nos gatos é comum apresentarem tumores solitários na pele ou subcutâneo e tem predileção pelas regiões da cabeça e do pescoço, e o seu tamanho varia de 0,2 a 3,0 cm podendo apresentar alopecia e ulcerações. A classificação é feita em mastocitomas mastocíticos que costumam ser cutâneos, solitários e tem predileção por cabeça e pescoço e os histiocíticos que geralmente são múltiplos, não pruriginosos e têm regressão espontânea. (Viana, 2014).
Em felinos na maioria dos casos possui comportamento benigno , pode ocorrer devido a inflamações crônicas, carcinógenos tópicos, fatores hereditários, transmissões horizontais e por meio de infecções virais que cursam com imunossupressão, a forma cutânea é caracterizada por nodulações avermelhadas na derme, não encapsulado e com tamanho variando de 1 até 30 cm de diâmetro os nódulos podem ser múltiplos em até 15% dos casos, com grandes dimensões, firmes ou flutuantes, eritematosos ou ulcerados, aderidos e infiltrativo quando em comportamento maligno e apresentação única, de dimensão restrita, macio, bem delimitado, não aderido e sem ulcerações em casos benigno(Da Silva et al.,2020)
Figura 2 -Mastocitoma cutâneo em gato
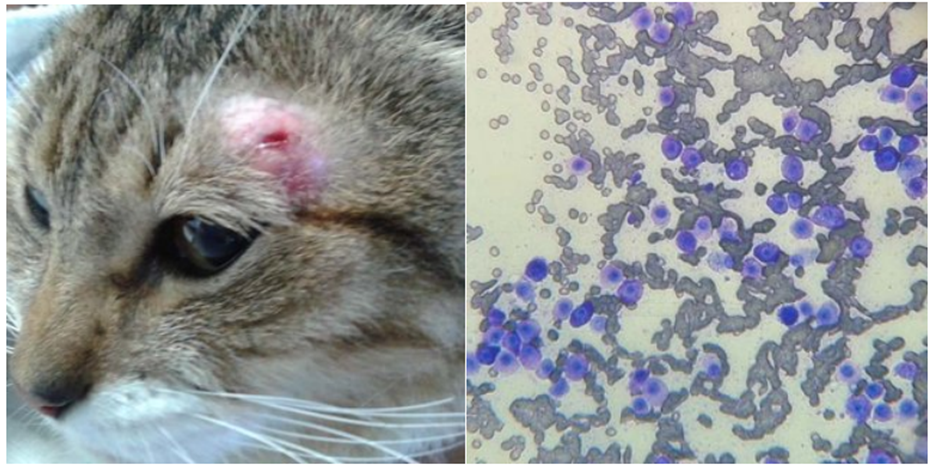
Nódulo na face localizado na região supraorbitária esquerda / Exame citológico da lesão ulcerada do felino, corado com kit de coloração Diff-Quick, sendo visualizados numerosos mastócitos neoplásicos bem diferenciados (objetiva de 20X)
Fonte: Lopes, 2017.
3. DIAGNÓSTICO
A citologia aspirativa é um método muito utilizado por ser minimamente invasivo que analisa as células individualmente, sem considerar a arquitetura tecidual e apresentar reduzida agressão ao processo neoplásico(Goldschmidt; Hendrick, 2002). A citologia aspirativa é um exame restrito onde não é possível determinar o tipo histológico, a origem e a sua natureza (Simenov; Stoikov, 2006). A citologia aspirativa com agulha fina (CAAF) e avaliação histológica para determinar o grau de malignidade, (London; Thamm, 2013).
Para o sucesso da citologia aspirativa com agulha fina (Figura 3), cada passo da técnica deve ser realizado com cuidado e atenção; obtenção da amostra, preparação da lâmina, coloração da lâmina, e o exame citoscópico do material aspirado(Hellmén; Lindgren ,1989).
Figura 3 – Citologia aspirativa por agulha fina
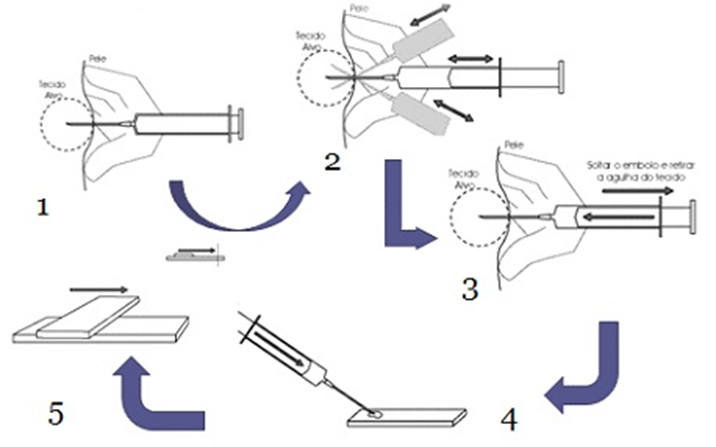
1-Para a punção são indicadas agulhas estéreis de calibre 20, 23 ou 25 e seringas estéreis de 10 ou 20 ml para gerar a pressão de sucção necessária para o procedimento.
2- Após acoplar a agulha na seringa, esta deve ser introduzida na estrutura a ser puncionada por 3 a 4 vezes em pontos diversos do nódulo ou formação, mantendo-se a pressão de sucção de no mínimo 5 ml e no máximo 10 ml. São realizados movimentos com a agulha em várias direções dentro da lesão para garantir a colheita de maior e mais diversa quantidade de representantes celulares.
3- Antes de remover a agulha, deve-se retornar o êmbolo para a posição inicial (vácuo nulo).
4– Retirar a agulha da massa e desencaixá-la na seringa. Encher a seringa de ar, acoplar novamente a agulha e ejetar o aspirado em lâmina nova ou desengordurada. Devem ser feitas, no mínimo, três lâminas do tecido suspeito
5- Se o conteúdo for fluído, deve-se preparar as lâminas como se faz para extensões sanguíneas.
Fonte: Ayele et al., 2017.
A classificação para diferenciar o grau de malignidade do mastocitoma , através do exame citológico é subjetiva , porque não existe um padrão citopatológico (Pedraza et al., 2011). Para determinar o grau de malignidade dos mastocitomas, deve-se analisar alguns critérios como macrocitose e anisocitose, pleomorfismo celular, bi/multinucleação, figuras de mitose, alterações em cromatina, nucléolos evidentes, multinucleolose, quantidade de grânulos citoplasmáticos e aumento da relação núcleo-citoplasma (Strefezzi et al., 2010; Rosolem et al., 2013; Bürger et al., 2015). A neoplasia é considerada maligna quando o número de critérios de malignidade for superior a três. (Lima et al., 2013, Braz et al., 2016). Um dos critérios de malignidade mais avaliado nos mastocitomas é a quantidade de grânulos presentes nas células. Quanto menos granulação a célula possuir(Figura 5), mais indiferenciada ela é, sendo considerada desta forma um marcante critério a ser avaliado (Braz et al., 2016) (Figuras 4 e 5).
Figura 4 – Mastocitoma pouco diferenciado
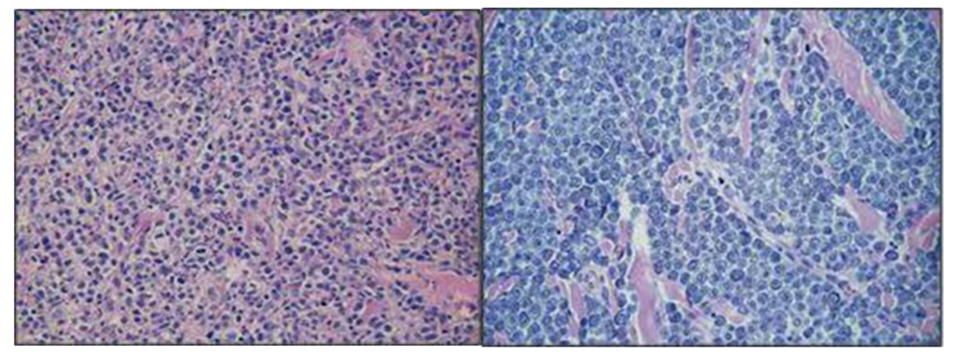
Células pleomórficas não granuladas , núcleos de dimensões variáveis e alto número de figuras mitóticas atípicas .Eosinófilos entremeados às células .Coloração Hematoxilina e Eosina 400x.
Fonte: Welle et al., 2008.
Figura 5 – Mastocitoma bem diferenciado
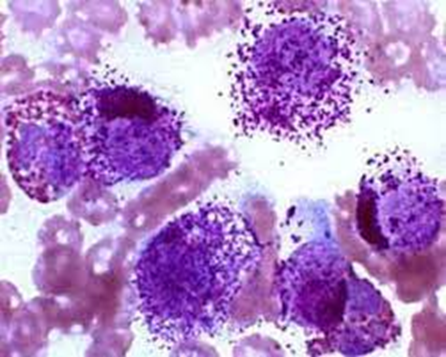
Mastocitoma cutâneo (mastócitos bem diferenciados). Os matócitos possuem numerosos grânulos basofílicos que obscurecem a morfologia nuclear.
Fonte: Retirado do site da Universidade da Geórgia.
Para o diagnóstico complementar pode-se considerar rhemograma, perfil bioquímico, ALT(alanina aminotransferase), AST(aspartato aminotransferase), FA (fosfatase alcalina ), bilirrubina total, direta e indireta, glicose, amilase, proteína total, albumina,globulina, uréia, creatinina, colesterol, Ca, P, Na e K, radiografia abdominal , ecografia e urianálise (O’Keefe, 1990).
Para tumores indiferenciados podemos avaliar o índice de proliferação da neoplasia através da proteína Ki-67 que encontra-se aumentada de acordo com o grau do tumor, através da imuno-histoquimica que avalia o receptor tirosinoquinase presente nas células neoplasicas redondas de pele (Daleck; Nardi, 2016). O receptor tirosinoquinase (KIT) é uma proteína transmembranosa em mastócitos de cães normais. O receptor KIT é encontrado no citoplasma de células neoplásicas indiferenciadas, de forma que o receptor KIT é um fator importante no prognóstico dos mastocitomas.
O anticorpo KIT (CD117) detecta o receptor de membrana da tirosina quinase e o Ki67 detecta células que estão no ciclo celular, exceto na fase Gzero , sendo dessa forma possível identificar tumores que possuem um comportamento biológico mais agressivo (Kiupel et al., 2004; Webster et al., 2006; Sledge et al., 2016)
Os tumores de alto grau estão associados a padrões citoplasmáticos e tumores de baixo grau a padrões perimembranosos (Kiupel et al., 2011).
O diagnóstico definitivo é feito pelo exame histopatológico, sendo possível identificar a taxa de mitose, graus de células diferenciadas, visualização de infiltrado inflamatório, grau e variação morfológica das células e núcleos (Silva, 2019).
O estadiamento clínico deve ser feito, porque todo mastocitoma tem potencial para metástase, sendo necessário a radiografia abdominal e torácica, ultrassonografia abdominal e citologia dos linfonodos e medula óssea, para estadiar o paciente; o hemograma, perfil bioquímico e urinálise não vão influenciar no estadiamento clínico. (Abbas et al., 2000; London; Seguin, 2003).
A extensão da doença no momento do seu diagnóstico está relacionada com o seu estadiamento. A classificação proposta pela organização mundial de saúde é a seguinte:
Estádio 0: tumor único, incompletamente excisado da derme.
Estádio 1: tumor único, confinado a derme, sem envolvimento de linfonodo regional.
Estádio 2: tumor único, confinado a derme, com envolvimento de linfonodo regional.
Estádio 3: tumores múltiplos ou grandes com ou sem envolvimento dos linfonodos regionais.
Estádio 4: tumores com metástase distantes incluindo invasão medular e presença de mastócitos no sangue periférico, ou recorrência com metástases. (Fox ,1998).
4. CLASSIFICAÇÃO / GRADUAÇÃO HISTOLÓGICA
A graduação histológica é a principal ferramenta utilizada para prognóstico do mastocitoma cutâneo canino e é através do grau histológico que vamos estabelecer testes de estadiamento e terapias auxiliares para cães com mastocitoma (Northrup et al., 2005a). Três métodos de graduação já foram propostos, sendo dois deles divididos em três graus (Bostock, 1973; Patnaik et al., 1984), e um, em dois graus (Kiupel et al. 2011).
O primeiro sistema de graduação histológica foi proposto por Bostok (1973) e após dez anos , foi proposto o sistema de Patnaik . O sistema de Patnaik é o método mais utilizado e aplicado nos laboratórios de patologia veterinária, apesar de ser considerado, por muitos, como um sistema de difícil aplicação pelo fato de incluir um grande número de critérios histológicos subjetivos e pela dificuldade na aplicação da graduação o que ocorre principalmente nos mastocitomas grau II. (Northrup et al., 2005a; Northrup et al., 2005b ;Blackwood et al., 2012; Natividade et al.,2014)
Quadro 1 – Sistema Bostock de graduação histológica

Fonte: Bostock, 1973
Quadro 2 – Sistema Patnaik de graduação histológica

Fonte: Adaptado de Kiupel et al., 2011.
Os mastocitomas podem ser classificados em lesões de baixo potencial de malignidade e lesões de alto potencial de malignidade, avaliando os índices mitóticos , presença de células multinucleadas, presença de núcleos bizarros e cariomegalia . As lesões consideradas de alto potencial de malignidade levam os portadores a uma sobrevida média de quatro meses e as lesões de baixo potencial de malignidade levam aos portadores a uma sobrevida maior que dois anos. (Kiupel et al., 2011).
Quadro 3 – Sistema Kiupel de graduação histológica

Fonte: Kiupel et al., 2011
Para um prognóstico correto e um tratamento eficaz, a classificação histológica é de fundamental importância , sendo que o comportamento do mastocitoma cutâneo é imprevisível (Golsdchmidt; Hendrick, 2002).
Para o diagnóstico em gatos a citologia por aspirado de agulha fina é o método mais indicado e sua acurácia pode chegar a 99%, quando a amostra é coletada e processada de forma correta (Ferreira, 2013).
As células neoplásicas apresentam citoplasmas desproporcionais, cromatina frouxa, intensa granulação citoplasmática, grânulos livres. A presença de histaminases no interior dos eosinófilos faz com que sejam atraídos para o local do tumor, devido a presença de histamina. Poucas figuras de mitose são observadas. (Heil, 2007; Rosolem et al., 2013)
O hemograma pode indicar aumento da concentração dos eritrócitos levando a policitemia relativa, anemia e leucocitose com eosinofilia periférica (Texeira, 2015).
5. SINAIS CLÍNICOS
O mastocitoma possui aparência clínica variável, semelhante a diversas lesões cutâneas. Mastocitomas de baixo grau apresentam tumores pequenos, circunscritos, solitários, alopécicos ou não, de crescimento lento, sendo bem diferenciados podendo ficar estáveis durante 14 meses ou anos antes de desencadear um processo proliferativo. Mastocitomas de grau elevado apresentam grandes formações, ulceradas, eritematosas, infiltradas nos tecidos adjacentes, podendo ainda ser observados presença de edema peritumoral e pequenos nódulos satélites, com rápido crescimento e comportando-se de forma agressiva desde o princípio (Prado et al., 2012). No tecido subcutâneo tem aspecto mal circunscrito, de consistência macia, semelhante ao lipoma (Prado et al., 2012; Macedo, 2014). As lesões podem apresentar eritema e pústulas, após sofrer compressão leve ou raspagem, o que se denomina sinal de Darier (Couto, 2010).
O mastocitoma libera substâncias que podem afetar a função de outros tecidos e órgãos, resultando em uma série de sintomas denominados de síndromes paraneoplásicas. Esses sintomas incluem vômitos, diarréia, anorexia, depressão da medula, anemia ferropriva, perfuração gástrica, peritonite,choque anafilático e colapso vascular (London; Thamm, 2013). A degranulação dos mastócitos,liberação de histamina, heparina, fator quimiotático de eosinófilos e enzimas proteolíticas pelos seus grânulos têm como consequência ulceração gástrica (Daleck; Nardi, 2016).
Após a excisão dos nódulos ocorre atraso na cicatrização e no momento da punção aspirativa por agulha fina (PAAF) e/ou cirúrgica ocorre hemorragia (Navega, 2011; Prado et al., 2012). A histamina liberada pelo tumor bloqueia os receptores H1 e H2 dos macrófagos, induzindo a liberação do fator supressor dos fibroblastos, que diminui a síntese de colágeno e consequentemente que atrasa a cicatrização. O excesso de histamina liberada estimula os receptores H2 gástricos o que leva ao excesso na produção de ácido clorídrico pelo estômago, hipermobilidade e lesões vasculares (Navega, 2011).A elevação nos níveis de heparina, promove aumento no tempo de coagulação sanguínea do animal (Prado et al., 2012). A produção excessiva de IL-2 e IL-5 causa elevação nos níveis plasmáticos de eosinófilos, principalmente nos mastocitomas disseminados(PRADO et al., 2012). Episódios de choques hipotensivos súbitos durante procedimentos cirúrgicos já foram descritos, o que indica mais uma complicação, embora rara, provocada pela manipulação tumoral durante a cirurgia (Navega, 2011).
6. TRATAMENTO
O tratamento de mastocitomas pode ser realizado por cirurgia, radioterapia, quimioterapia ou associação dos três (Prado et al., 2012). Estudos recentes citam ainda inibidores da tirosina-quinase, eletroquimioterapia, terapêutica fotodinâmica (Navega, 2011).
Todos os linfonodos presentes na região devem ser aspirados independentemente de estarem alterados ou não. As metástases em linfonodos podem estar presentes mesmo quando estes apresentam-se em tamanho normal (Couto, 2015).
No mastocitoma solitário de grau I ou grau II , deve ser feita ressecção completa com margem de segurança lateral de 3 cm pelo menos uma camada de tecido muscular, em profundidade. O material deve ser encaminhado para histopatológico (Fulcher, 2016)
Os tumores de grau II de diferenciação intermediária e com metástase para linfonodos regionais devem ser tratados com radioterapia, seguido de remoção cirúrgica com ampla margem de segurança. Nesses casos, pode-se ainda recorrer à quimioterapia antineoplásica, porém o seu uso ainda é questionado (Welle, 2008).
Os tumores de grau III são agressivos e possuem grande capacidade de metástase, devendo ser removidos cirurgicamente e usar algumas técnicas de tratamento como a quimioterapia antineoplásica, eletroquimioterapia, inibidores de tirosina quinases e radioterapia, podendo ou não associar algumas outras técnicas (Daleck, 2016).
O protocolo quimioterápico para mastócito canino foi instituído pela Associação da Oncologia Veterinária com o uso de vimblastina com a prednisona e com duração de duas semanas. A vimblastina, na dose de 2,0-2,5 mg/m2 intravenoso, administrado sob infusão lenta, a cada sete dias, e a prednisona na dose de 2,0 mg/kg, a cada vinte e quatro horas, por via oral, com o tempo de duração e desmame de acordo com o protocolo instituído (Navega, 2011; Macedo, 2014).
A vimblastina pertence à classe dos medicamentos microtubulares e age por interromper a divisão celular na fase de metáfase. Os efeitos colaterais citotóxicos desta droga incluem mielossupressão, com leucopenia, trombocitopenia transitória e raramente anemia, entre o quarto e o sétimo dia após a sua administração. São comuns também a náusea e a êmese e caso haja extravasamento do fármaco, pode haver necrose tecidual, flebite e irritação da pele (Weber, 2017).
Na terapia alvo-específica, a droga age em determinados sítios específicos na superfície da célula, chamada de receptores tirosina-quinase (devida a fosforilação de proteínas em tirosina). A tirosina-quinase são enzimas responsáveis pela sinalização celular, transdução de sinais em células normais e a regulação, divisão e diferenciação celular. Essas células quando sinalizam de forma descoordenada ou ineficaz são destruídas por essas drogas, ao mesmo tempo em que seus efeitos adversos são diminuídos em razão de sua seletividade, tendo melhor resposta antineoplásica e consequentemente melhoram a qualidade de vida dos pacientes devido a sua toxicidade reduzida (Pasquale, 2016; Weber, 2017).
A radioterapia no tratamento de mastocitomas é recomendada, tanto no período pré-operatório, quanto no período pós-operatório. No pós-operatório está indicada nos casos em que os bordos cirúrgicos se encontram invadidos por mastócitos neoplásicos na análise histopatológica ou em casos em que não é possível extirpar o tumor cirurgicamente. No pré-operatório a radioterapia é realizada com a finalidade de reduzir a dimensão do tumor e assim obter margens mais seguras. Também está indicada a radioterapia em tratamento e prevenção de mastocitomas com metastização nos linfonodos (Wille, 2008;Navega, 2011).
A eletroquimioterapia é baseada na aplicação local de impulsos elétricos intensos e de curta duração nas células e tecidos após aplicação intratumoral de drogas em doses baixas, ou que possuem fraca ou nenhuma permeabilidade para a membrana celular, com o intuito de desestabilizar e ativar os poros da membrana transitoriamente, tornando-a permeável à entrada de moléculas estranhas para o citoplasma, além de reforçar a atividade citotóxica. Essa modalidade de tratamento reduz os efeitos adversos das drogas, sendo por isso bem tolerado, seguro e minimamente invasivo para os pacientes, muitas vezes requerendo apenas uma única sessão de tratamento, com sucesso de até 80% em tumores primários, recorrentes solitários ou múltiplos, em tumores subcutâneos, como tratamento principal ou complementar e em tumores de grau II ou III (Navega, 2011).
A terapêutica fotodinâmica consiste no uso de fármaco com tropismo para as células neoplásicas, chamado de agente fotossensibilizante e de um tipo de luz com comprimento de onda específica, que ao interagir ativa o agente fotossensibilizante, causando danos aos vasos sanguíneos dos tumores, impedindo-os de receber nutrientes necessários para a sua sobrevida e conduzindo para a diminuição da massa tumoral. Esse tipo de terapia tem a vantagem de tratar o tumor apenas uma vez, ao contrário da radioterapia (Navega, 2011).
Quimioterapia com glicocorticóide mostra-se efetiva na remissão parcial ou completa de mastocitomas caninos devido a sua ação anti-inflamatória e inibição de células neoplásicas. Receptores de glicocorticóides foram encontrados recentemente no citoplasma de mastocitomas caninos, em quantidade e efetividade variada, sendo esses fatores responsáveis pela resistência de alguns desses tumores à quimioterapia com essa droga. O glicocorticóide mais utilizado é a prednisona na dose de 0,5 mg/kg, administrado uma vez ao dia, por via oral, embora alguns autores sugiram a administração intralesional como sendo mais efetiva do que a terapia sistêmica para a doença local (Palma et al., 2009).
A manipulação do tumor de mastocitoma pode desencadear a degranulação maciça de mastócitos conduzindo ao choque hipotensivo e morte. Assim, animais que apresentam mastocitomas volumosos, devem iniciar a terapêutica com antagonistas de receptores H1, como a difenidramina, antes de realizar qualquer procedimento que vá exigir a manipulação desses tumores, de forma a minimizar a degranulação de mastócitos. Os antagonistas de receptores H1 (difenidramina) devem ser usados na dose de 1-2 mg/kg, por via subcutânea, 30 a 60 minutos antes de qualquer procedimento que vá levar a manipulação desses tumores (Navega, 2011).
Com a degranulação de mastócitos elevados níveis de histamina são liberados na circulação e vão estimular as células parietais da mucosa gástrica. As células parietais estimuladas vão desencadear a produção excessiva de ácido clorídrico, levando ao desenvolvimento de úlcera e eventualmente perfuração gastrointestinal. Visando diminuir o excesso de produção de ácido clorídrico, os antagonistas de receptores H2 (cimetidina e famotidina) podem ser uma alternativa eficaz. A cimetidina deve ser usada na dose de 4 mg/kg, por via oral, a cada 8 horas; a famotidina deve ser usada na dose de 0,5-1,0 mg/kg, por via oral ou endovenosa, a cada 8 ou 12 horas. Os antagonistas de receptores H2 podem ser usados isolados ou associados aos inibidores da bomba de prótons (London; Seguin, 2003).
Os inibidores da bomba de prótons (omeprazol) é a melhor alternativa na prevenção de úlcera gástrica, pois além de ser mais potente do que a cimetidina tem longa duração de ação. Deve ser usada na dose de 0,5-1,0 mg/kg, por via oral ou endovenosa, a cada 24 horas (NAVEGA, 2011)
6.1 Protocolos de quimioterapia para o mastocitoma cutâneo em cães
Quadro 4 – Protocolos de quimioterapia para o mastocitoma cutâneo

O tratamento de eleição do mastocitoma cutâneo em gatos é a ressecção cirúrgica, e como a maioria tem comportamento benigno, a cirurgia com excisão ampla não é tão crucial. A avaliação de terapia adjuvante como radiação ou quimioterapia não são sistemicamente realizadas. (Govier, 2003; Wright; Chretin, 2006; Miller et al., 2013).
7. Prognóstico
Mastocitomas localizados no leito ungueal, escroto, prepúcio e focinho são mais agressivos (Gieger et al., 2003; Thamm et al., 2006; Hillman et al., 2010). Os tumores localizados no tecido subcutâneo são menos agressivos (Mullins et al., 2006). Tumores de alto grau ou tumores de grau II e III, apresentam pior prognóstico (Kiupel et al., 2011; Atnaik et al., 1984).
8. CONCLUSÃO
O mastocitoma é um tumor mesenquimal,e pode levar o cão à morte. Os felinos têm menor incidência e a maioria são benignos.
O diagnóstico através da punção aspirativa por agulha fina é o método mais simples e menos invasivo,a avaliação da taxa de proliferação celular através da proteína nuclear i-67, a localização do receptor KIT e mutação do gene c-KIT devem ser aplicados na rotina clínica em cães. Em felinos a apresentação clínica é bastante variável, sendo de extrema necessidade o estudo de outros diagnósticos diferenciais , a citologia aspirativa por agulha fina é possível chegar ao diagnóstico de mastocitoma de forma rápida, prática e de alta especificidade,
O tratamento de mastocitomas em cães pode ser realizado por cirurgia, radioterapia, quimioterapia ou a associação dos três. Em casos específicos o tratamento pode ser feito por inibidores da tirosina-quinase, eletroquimioterapia, terapêutica fotodinâmica, sendo o tratamento cirúrgico o mais indicado. Nos felinos, como a grande maioria dos mastocitomas cutâneos são benignos, o tratamento indicado é a cirurgia.
Torna-se difícil estabelecer um prognóstico preciso, porque ainda não se conhece totalmente o comportamento biológico.
9. REFERÊNCIAS
ABBAS A. K., LICHTMAN, A. H., POBER, J. S. Cellular and molecular immunology. 4.ed. Philadelphia: WB Saunders, 2000. p. 235–67
ABRAHAM L. Kierszenbaum. HISTOLOGIA E BIOLOGIA CELULAR, UMA 5 INTRODUÇÃO À PATOLOGIA. 3ª edição. Elsevier, 2012
AYELE, L.; MOHAMMED, C.; YIMER, L. Review on Diagnostic Cytology: Techniques and Applications in Veterinary Medicine. J. Vet. Sci. Technol., v.8, n.408, 2017. available fron <https://www.omicsonline.org/open-access/review-on-diagnostic-cytology-techniques-and-applications-inveterinary-medicine-2157-7579-1000408.php?aid=85194
BLACKWOOD L. et al. European consensus document on mast cell tumours in dogs and cats. Veterinary and Comparative Oncology, v.10, n.3, p.e1-e29.
BOSTOCK D.E. 1973. The prognosis following surgical removal of mastocytomas in dogs. Journal of Small Animal Practice, v.14, p.27-41. Available from: <http://onlinelibrary.wiley.com/doi/10.1111/j.1748- 5827.1973.tb06891
BRAZ, P. H., Brum, K. B., Souza, A. I. & Abdo, M. A. 2016. Comparação entre a citopatologia por biopsia com agulha fina e a histopatologia no diagnóstico das neoplasias cutâneas e subcutâneas de cães. Pesquisa Veterinária Brasileira, 36, 197-203
BURGER, K. P., Buzza, P. L. T., Neto, E. B., dos Santos, L. R., Rossi, G. A. M. & Martins, A. M. C. V. 2015. Complexo teniose-cisticercose: ocorrência em abatedouro de bovinos e conhecimento de estudantes do ensino médio e consumidores no Estado de São Paulo, Brasil. Revista Brasileira de Ciência Veterinária, 22, 1-10
CAMPS-PALAU, M.A.; LEIBMAN, N.F.; ELMSLIE, R.; LANA, S.E.; PLAZA, S.; MCKNIGHT, J.A.; Risbon, R.; Bergman, P.J. Treatment of canine mast cell tumours with vinblastine, cyclophosphamide and prednisone: 35 cases (1997 – 2004). Veterinary and Comparative Oncology, v.5 , n.3, p.156–167, 2007
COUTO, C. G. Medicina Interna de Pequenos Animais. 4.ed. Rio de Janeiro: Elsevier, 2010. cap.82. p.1201-1205
COOPER, M.; TSAI, X.; BENNETT, P. Combination CCNU and vinblastine chemotherapy for caninemast cell tumours: 57 cases. Veterinary and Comparative Oncology, v.7, n.3, p.196–206, 2009
DALECK, Carlos Roberto; ROCHA, Noeme Sousa; FERREIRA, Marília Gabriele Prado Albuquerque. Mastocitoma. In: DALECK, Carlos Roberto; NARDI, Andrigo Barbosa de. Oncologia Em Cães e Gatos. 2. ed. Rio de Janeiro: Grupo Editorial Nacional, 2016. Cap. 50. p. 955-971.
DALECK, C. R., ROCHA, N. S., FERREIRA, M. G. P. A. MASTOCITOMA. In: 21 DALECK, C. R., DE NARDI, A. B. Oncologia em cães e gatos. Rio de Janeiro: Roca, cap. 22 50, p. 649-659, 2016.
DA SILVA, Rúbia Schallenberger et al. Aspectos clínicos, citológicos e hematológicos de mastocitoma cutâneo em felino: relato de caso. Brazilian Journal of Development, v. 6, n. 3, p. 16249-16256, 2020.
FERRI, Antônio Guimarães; MARTINS, Luiz Ferreira. Mastocitoma em cão. Revista da Faculdade de Medicina Veterinária, Universidade de São Paulo, v. 6, n. 1, p. 17-26, 1957.
FOX, L. E. Mast cell tumors. In: MORRISON, W. B. Cancer in dogs and cats medical and surgical management. 1ª ed. Philadelphia: Linppincott Willians & Wilkins, 1998. cap. 30, p.479-488
FURLANI, J. M. et al. Mastocitoma canino: Estudo retrospectivo dos casos de mastocitoma canino atendidos junto ao serviço de 34 oncologia do hospital veterinário “Governador Laudo Natel” da FCAV / UNESP / Campus Jaboticabal, no período de janeiro de 2001 a junho de 2004. 103p. Dissertação de Mestrado – Curso de Pós-graduação da Faculdade de Ciências Agrárias de Veterinárias, Universidade Estadual de São Paulo (UNESP) – Jaboticabal. 2008. Acessado em 07/12/2018, 16:00
FULCHER, R.; Ludwig, L.; Bergman, P.; Newman, S.; Simpson, A.; Patnaik, Evaluation of a two-centimeter lateral surgical margin for excision of grade i and grade ii cutaneous mast cell tumours in dogs. Journal of American Veterinary Medical Association. 228, 210-215. 2016.
GIEGER, T.L.; THEON, A.P.; WERNER, J.A.; MCENTEE, M.C.; RASSNICK, K.M.; DECOCK, H.E. Biologic behavior and prognostic factors for mast cell tumors of the canine muzzle: 24 cases (1990-2001). Journal of Veterinary Internal Medicine, v.17, p.687-92, 2003
GERRITSEN, R. J.; TESKE, E.; KRAUS, J. S.; RUTTERMAN, G. R. Multiagent chemotherapy for mast cell tumors in the dog. Veterinary Quality, v. 20, p. 28-31, 1998
GOVIER, S. M. Principles of Treatment for Mast Cell Tumors.Clinical Techniques in Small Animal Practice, v.18, n. 2, p. 103-106, 2003.
GOLDSCHIMDT, M. H.; HENDRICK, M. J. Tumors of deskin and soft tissues. In: MEUTEN. D. J. Tumors in domestic animals. 4 ed. Ames: Iowa State Press, 2002. cap.3. p.105-109
HELLMÉN, E.; LINDGREN, A. The Accuracy of Cytology in Diagnosis and DNA Analysis of Canine Mammary Tumors. Journal of Comparative Pathology, v. 101, n. 4, p. 443-450, 1989.
HEIL, Charlotte.Etude rétrospective des cas de mastocytomes cutanés félins vus à l’Ecole Nationale Vétérinaire de Toulouse entre janvier 2000 et mars 2007 et à la clinique vétérinaire de la Rivière entre janvier 1993 et mars 2007. 2007. Tese de Doutorado
HILLMAN, L.A., GARRETT, L.D., LORIMIER, L.P.; CHARNEY, S.C.; BORST, L.B.; FAN, T.M. Biological behavior of oral and perioral mast cell tumors in dogs: 44 cases (1996-2006). Journal of the American Veterinary Medical Association, v.237, p.936-942, 2010
HORTA, Rodrigo dos Santos. PROPOSTAS TERAPÊUTICAS PARA O MASTOCITOMA CANINO BASEADAS EM FATORES PROGNÓSTICOS CLÍNICOS, ANÁTOMO-PATOLÓGICOS, IMUNO-HISTOQUÍMICOS E GENÉTICOS. 2016. 5 v. Tese (Doutorado) – Curso de Colegiado de Pós-graduação em Ciência Animal, Universidade Federal de Minas Gerais Escola de Veterinária, Belo Horizonte, 2016
KIUPEL, M.; WEBSTER, J. D., BAILEY, K. L.; BEST, S., DELAY, J.; DETRISAC, C. J. et 42 al. PROPOSAL OF A 2-TIER HISTOLOGIC GRADING SYSTEM FOR CANINE 43 CUTANEOUS MAST CELL TUMORS TO MORE ACCURATELY PREDICT 44 BIOLOGICAL BEHAVIOR. Veterinary Pathology , v.48, n. 1, 147-155. 2011
LEDUR, Gabriela Reis. Frequência e intensidade de lesões gastroduodenais em cães com mastocitoma cutâneo. 2015. 80 f. Dissertação (Mestrado) – Curso de Programa de Pós-graduação em Ciências Veterinárias, Universidade Federal do Rio Grande do Sul, Porto Alegre, 2015.
LIMA, C. R. O., Rabelo, R. E., Vulcani, V. A. S., Furtado, A. P., Helrigel, P. A., Brito, L. A. B. & Moura, V. M. B. D. 2013. Padrões morfológicos e critérios de malignidade do tumor venéreo transmissível aos exames citopatológico e histopatológico. Brazilian Journal of Veterinary Research and Animal Science, 50, 238-246.
LONDON, Cheryl A.; THAMM, Douglas H. Mast Cell Tumors. In: WITHROW, Stephen J.; VAIL, David M.; PAGE, Rodney L..Small Animal Clinical Oncology. 5. ed. Missouri: Elsevier, 2013. Cap. 20. p335-355.
LONDON, C.A.; SEGUIN, B. Mast cell tumors in the dog. Veterinary Clinics of North America: Small Animal Practice, v.33, p. 473-489, 2003.
LOPES, N. L., Peixoto, A. de P., Costa, T. S., Silva, M. A., Araújo, D. C. C., Antonioli, T., Mascarenhas, M. B., & Fernandes, J. I. (2017). Mastocitoma cutâneo em felino: Relato de caso. Veterinária Notícias, 23, 1. http://www.seer.ufu.br/index.php/vetnot/article/view/33997
LOPES, Natália Lôres et al. Mastocitoma cutâneo em felino–relato de caso. Veterinária Notícias, v. 23, n. 1, p. 71-79, 2017
MACEDO, Thais Rodrigues. COMPARAÇÃO DA EFICÁCIA DO MEZILATO DE 9 IMATINIBE COM A VIMBLASTINA ASSOCIADA A PRENDINISONA NO 10 TRATAMENTO DO MASTOCITOMA CANINO: ESTUDO CLINICO, 11 HISTOPATOLÓGICO, IMUNOHISTOQUIMICO E MOLECULAR. Universidade de São Paulo. Dissertação de doutorado. 2014. 150f.
MACY, D.W.; MACEWEN, E.G. Mast cell tumors. In: WITHROW S.J.; MACEWEN, E.G (Ed.). Veterinary oncology. Philadelphia: J.B. Lippincott, 1989. p.156-165
MELO, PatrÍcia Kelly Silva de. MASTOCITOMA CANINO: REVISÃO DE LITERATURA E RELATO DE PROTOCOLO QUIMIOTERÁPICO. 2010. 28 f. Monografia (Especialização) – Curso de Curso de EspecializaÇÃo em ClÍnica MÉdica VeterinÁria de Pequenos Animais., Universidade Federal Rural do Semi-Árido Departamento de CiÊncias Animais, Belém, 2010.
MILLER, W. H.; GRIFFIN, C. E.; CAMPBELL, K. L. Muller and Kirk’s Small Animal Dermatology, 7ed. Elsevier, 2013, 948p.
MULLINS, M. N., Dernell, W. S., Withrow, S. J., Ehrhart, E. J., Thamm, D. H., & Lana, S. E. (2006). Evaluation of prognostic factors associated with outcome in dogs with multiple cutaneous mast cell tumors treated with surgery with and without adjuvant treatment: 54 cases (1998-2004). Journal of the American Veterinary Medical Association, 228(1), 91–95. https://doi.org/10.2460/javma.228.1.91
NATIVIDADE, F.S. et al. Análise de sobrevida e fatores prognósticos de cães com mastocitoma cutâneo. Pesquisa Veterinária Brasileira, v.34, n.9, p.874-884, 2014.
NAVEGA, P. R. S. MASTOCITOMAS CANIDEOS: ESTUDO RETROSPECTIVO. 22 Universidade Técnica de Lisboa. Dissertação de Mestrado. Lisboa, 2011.
NELSON, Richard W.; COUTO, C. Guillermo. Medicina Interna de Pequenos Animais. 5. ed. Rio de Janeiro: Elsevier, 2015. 4442 p.
NORTHRUP N.C., et al. Variantion among pathologist in histologic grading of canine cutaneous mast cell tumors. Jornaul of Veterinary Diagnostic Investigation, 17:245-248, 2005a.
NORTHRUP N.C., et al. Variantion among pathologist in histologic grading of canine cutaneous mast cell tumors with uniform use of a single grading reference. Jornaul of Veterinary Diagnostic Investigation, 17:561-564, 2005b.
O’KEEFE, D. A., COUTO, C. G., BURKE-SCHWARTZ, C., et. al. Systemic mastocytosis in 16 dogs. Java Veterinary Internal Medicine.,1990
PALMA, Heloisa Einloft et al. Mastocitoma cutâneo canino: revisão.Medvep-Revista Científica de Medicina Veterinária-Pequenos Animais e Animais de Estimação, v. 7, p. 523-528, 2009.
PATNAIK, A.K.; EHLER, W.J.; MACEWEN, E.G. Canine cutaneous mast cell tumors: morphologic grading and survival time in 83 dogs. Veterinary Pathology, v.21, p.469-474, 1984.
PALMA, H. E. et al. MASTOCITOMA CUTÂNEO CANINO – REVISÃO. Medvep – Revista Científica de Medicina Veterinária – Pequenos Animais e Animais de Estimação, v. 7, 35 n. 23, p. 523-528, 2009
PASQUALE, R. INIBIDORES DE TIROSINOQUINASE. In: DALECK, C. R., DE NARDI, A. B. Oncologia em cães e gatos. Rio de Janeiro: Roca, cap. 21, p. 281-291, 2016.
PEDRAZA, F., Grandi, F. & Rocha, N. S. 2011. The need for cytologic/histologic correlation studies to establish a cytologic grading system for canine mast cell tumors in veterinary medicine. Veterinary Clinical Pathology, 40, 280-281
PRADO, A. A. F. et al. MASTOCITOMA EM CÃES: ASPECTOS CLÍNICOS, 2 HISTOPATOLÓGICOS E TRATAMENTO. Enciclopédia Biosfera. Centro Científico 3 Conhecer, Goiânia, v. 8, n. 14, 2012.
RASSNICK, K.M.; MOORE, A.S.; WILLIAMS, L.E.; LONDON, C.A.; KINTZER, P.P.; ENGLER, S.J.; COTTER, S.M. Treatment of canine mast cell tumors with CCNU (Lomustine). Journal of Veterinary Internal Medicine, v.13, p.601–605, 1999
RECH, R.r. et al. Mastocitoma cutâneo canino. Estudo de 45 casos. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, [s.i.], v. 56, n. 4, p.441-448, jan. 2004.
ROSOLEM M. C., Rodigheri, S. M., Corrêa Neto, U. J., Porto, C. D., Hanel, J. S. & Moroz, L. R. 2013. Estudo retrospectivo de exames citológicos realizados em um Hospital Veterinário Escola em um período de cinco anos. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, 65, 735-741.
SANTOS, J. P. M. F. dos. MASTOCITOMA CUTÂNEO CANINO: INFLAMAÇÃO 10 CUTÂNEA CRÓNICA VS DESENVOLVIMENTO DE MASTOCITOMAS. Dissertação 11 de mestrado. Faculdade de Medicina Veterinária da Universidade Lusofóna de Humanidades e Tecnologiass. Lisboa- PT.2017. http://recil.grupolusofona.pt/bitstream/handle/10437/7864/ Disseta%C3%A7%C3%A3o%20de%20mestrado%20Joaquim%20Santos%20.pdf?sequence
SCARPA, F., Sabattini, S., & Bettini, G. (2014). Cytological grading of canine cutaneous mast cell tumours. Veterinary and Comparative Oncology, 14(3), 245–251. https://doi.org/10.1111/vco.12090
SIMEONOV, R.; STOIKOV, D. Study on the correlation between the cytological and histological tests in the diagnostics of canine spontaneous mammary neoplasms. Bulgarian journal of veterinary medicine, Stara Zagora, v. 9, n. 3, p. 211–219,sep, 2006.
SILVA, M.B. Mastocitose sistêmica em um cão – relato de caso. 2019. 32f. TCC (Graduação em Medicina Veterinária) – Universidade Federal de Uberlândia, Uberlânda, 2019
SLEDGE, D. G., Webster, J., & Kiupel, M. (2016). Canine cutaneous mast cell tumors: A combined clinical and pathologic approach to diagnosis, prognosis, and treatment selection. The Veterinary Journal, 215, 43–54. https://doi.org/10.1016/j.tvjl.2016.06.003
SOUZA, T. M. Estudo retrospectivo de 761 tumores cutâneos caninos. 2005. 296f Mestrado (Dissertação). Santa Maria: Universidade Federal de Santa Maria, Centro de Ciências Rurais; 2005.
STREFEZZI R. F., Kleeb, S. R., Xavier, J. G. & Dias, J. L. C. 2010. Avaliação da proliferação celular como indicador prognóstico para mastocitomas cutâneos caninos. Pesquisa Veterinária Brasileira, 30, 559-565.
TEIXEIRA, A. A. Mastocitoma felino: Revisão de literatura, 25-37, 2015. Disponível em: https://docplayer.com.br/59577632-Andre-andrade-teixeira-mastocitoma-felino-revisao-deliteratura.html
THAMM, D.H.; MAULDIN, E.A.; VAIL, D.M. Prednisone and vinblastine chemotherapy for canine mast cell tumor—41 Cases (1992–1997). Journal of Veterinary Internal Medicine, v.13, p.491–497, 1999
TYLER, R. D.; COWELL, R. L.; MEINKOTH J. H. Cutaneous and subcutaneous lesions. In: Cowell, R.L.; Tyler,R.D.; Meinkoth, J.H. (ed): Diagnostic cytology and hemetology of the dog and cat. Mosby, San Luis. P. 20-51, 1999.
VIANA, Danilo Barbosa et al. Mastocitoma felino. Revista de Ciência Veterinária e Saúde Pública, v. 1, p. 90-90, 2014
ZAPPULLA, J. P.; AROCK, M.; MARS, L.T. et al. MAST CELLS: NEW TARGETS FOR 30 MULTIPLESCLEROSIS THERAPY? J. Neuroimmunol, v.131, p.5-20, 2002.
WELLE, M. M.; CARLA ROHRER BLEY, C. R.; JUDITH HOWARD, J.; RÜFENACHT, S. Canine mast cell tumours: a review of the pathogenesis, clinical features, pathology and treatment. Veterinary Dermatology. V. 19, N. 6, p. 321– 339, December 2008.
WEBER, A. P. TRATAMENTO DE MASTOCITOMA CANINO COM INIBIDOR DE TIROSINOQUINASE E USO DA ELETROQUIMIOTERAPIA NO TRATAMENTO DE CARCINOMA ESPINOCELULAR ORAL EM CÃO. Curitiba. 2017.
WEBSTER J.D., YUZBASIYAN-GURKAN V., MILLER R.A., KANEENE J.B.; KIUPEL M. The role of c-KIT in tumorigenesis: evaluation in canine cutaneous mast cell tumors. Neoplasia, v.8 n.2.p.104-111, 2006.
WEBSTER J.D., YUZBASIYAN-GURKAN V., MILLER R.A., KANEENE J.B.; KIUPEL M. Cellular proliferation in canine cutaneous mast cell tumors: associations with c-KIT and its role in prognostication. Veterinay Pathology, 44:298-308, 2007.
WRIGHT, Z.M.; CHRETIN, J.D. Diagnosis and treatment of a feline oral mast cell tumor. Journal of Feline Medicine and Surgery, n.8, p. 285- e289, 2006
