JUDICIALIZATION OF HEALTH AND COOPERATIVE FEDERALISM: LEGAL AND ADMINISTRATIVE REPERCUSSIONS OF TOPIC 1234
REGISTRO DOI: 10.69849/revistaft/ar10202410310916
Eduardo Alvares de Carvalho;
Eduardo Perez Oliveira.
Resumo: O julgamento do Tema 1234 pelo Supremo Tribunal Federal (STF) representa um marco para o direito à saúde no Brasil e consolida a judicialização da saúde no país. A decisão estabelece critérios claros para a distinção entre medicamentos incorporados e não incorporados ao Sistema Único de Saúde (SUS), além de definir as competências federativas para o fornecimento desses medicamentos. O STF reafirmou o princípio da deferência do Poder Judiciário às decisões administrativas do SUS na formulação de políticas públicas de saúde, utilizando Protocolos Clínicos e Diretrizes Terapêuticas, listas oficiais de medicamentos e a medicina baseada em evidências como critérios centrais. O objetivo deste estudo é analisar criticamente os impactos jurídicos, técnicos e econômicos do julgamento, com foco na distribuição de competências federativas e no custeio de medicamentos. Utilizando uma abordagem qualitativa e exploratória, baseada em análise documental e bibliográfica, o artigo discute também os desafios impostos aos pacientes com doenças raras, ultrarraras e câncer, especialmente o ônus excessivo da prova. A viabilidade de acordos de compartilhamento de riscos com a indústria farmacêutica é proposta como solução para reduzir o impacto financeiro de tratamentos de alto custo sobre o SUS. Além disso, destaca-se a criação de uma plataforma nacional para centralizar informações sobre demandas judiciais como um avanço importante. A decisão busca equilibrar a proteção dos direitos fundamentais à saúde e a responsabilidade fiscal, promovendo maior segurança jurídica para os entes federativos.
Palavras-chave: Judicialização da saúde; Competências federativas; SUS; Medicina baseada em evidências; Compartilhamento de riscos.
Abstract: This article analyzes the judgment of Topic 1234 by the Brazilian Supreme Court (STF), which represents a milestone in healthcare law in Brazil. The decision established objective criteria for defining drugs incorporated and not incorporated into the Unified Health System (SUS), as well as the distribution of federal responsibilities for drug provision. Through this ruling, the STF consolidated the judicialization of healthcare in the country, emphasizing the principle of judicial deference to SUS administrative decisions in formulating public health policies. The decision seeks to balance the protection of the fundamental right to health with fiscal responsibility, using Clinical Protocols and Therapeutic Guidelines, official drug lists, and evidence-based medicine as central criteria. Additionally, the article discusses the implications for patients with rare, ultra-rare diseases, and cancer, highlighting the excessive burden of proof on the plaintiff. The adoption of risk-sharing agreements is proposed as an alternative to minimize the financial impact of high-cost treatments on the public health system.
Keywords: Health judicialization; Federative responsibilities; SUS; Evidence-based medicine; Risk-sharing agreements.
INTRODUÇÃO
O Supremo Tribunal Federal (STF) tem enfrentado, há quase duas décadas, questões relacionadas ao fornecimento de medicamentos não incorporados ao Sistema Único de Saúde (SUS), utilizados off label ou não registrados na ANVISA. Desde 2009, com a Suspensão de Tutela Antecipada 175, o STF começou a definir parâmetros importantes para o direito à saúde, estabelecendo a solidariedade entre os entes federativos, a intervenção judicial para garantir a eficácia das políticas públicas de saúde, a exigência de registro na ANVISA e a prioridade dos tratamentos previstos pelo SUS sobre alternativas não incluídas1.
Com base nesses fundamentos, a judicialização da saúde pública evoluiu de uma fase em que liminares eram concedidas com base em direitos constitucionais abstratos, como a vida, saúde e a dignidade da pessoa humana, para um cenário que exige fundamentação concreta em preceitos da medicina baseada em evidências. A concessão de medicamentos fora dos protocolos do SUS ou sem registro na ANVISA passou a requerer maior rigor, levando em consideração tanto a eficácia clínica quanto o impacto econômico sobre a política pública coletiva, visando proteger o equilíbrio do sistema de saúde2.
Apesar dessas diretrizes, o número de ações judiciais para a concessão de medicamentos continua a crescer, o que pode comprometer princípios fundamentais do SUS, como a universalidade e a equidade. Casos como o do medicamento Zolgensma, com valor estimado em US$ 2,1 milhões, são exemplos de como a judicialização pode pressionar financeiramente o sistema.
Uma auditoria do Tribunal de Contas da União (TCU) revelou um aumento de 1.300% nos gastos do Ministério da Saúde com o cumprimento de decisões judiciais entre 2008 e 2015, saltando de R$ 70 milhões para R$ 1 bilhão. Estados como São Paulo, Minas Gerais e Santa Catarina registraram gastos ainda maiores, superando os da União, com mais de 80% dessas despesas concentradas em medicamentos, muitos dos quais não estão na lista do SUS. Apenas 19 fármacos, muitos deles fora da lista do SUS, representaram mais de 50% dos gastos em alguns estados. Entre 2010 e 2015, três medicamentos não incorporados ao SUS (Elaprase, Naglazyme e Soliris) consumiram 54% dos gastos federais com ordens judiciais, totalizando R$ 1,9 bilhão de um montante de R$ 2,7 bilhões3.
Dados do Conselho Nacional de Justiça (CNJ) demonstram que, entre 2020 e 2024, foram ajuizadas 185.641 ações solicitando medicamentos registrados na ANVISA, mas não padronizados pelo SUS, revelando o crescente impacto da judicialização sobre o sistema de saúde4, conforme o gráfico:
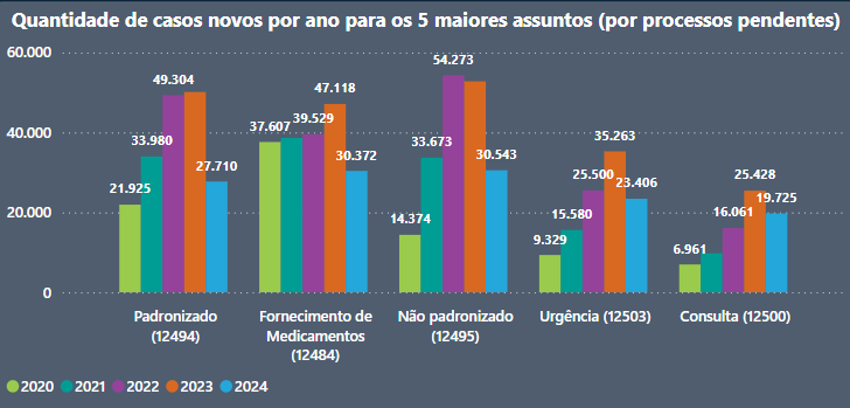
Por conseguinte, o julgamento do Tema 1234 pelo Supremo Tribunal Federal consolida as diretrizes estabelecidas na STA 175, proporcionando maior segurança jurídica aos entes federados no tocante às obrigações relacionadas ao fornecimento de medicamentos, sejam estes padronizados ou não. A decisão delimita com clareza a competência jurisdicional, tanto federal quanto estadual, disciplinando a intervenção judicial nas decisões administrativas dos gestores do SUS quanto à incorporação de novos tratamentos, sempre respeitando o princípio da deferência. Além disso, reafirma a imperatividade da medicina baseada em evidências como requisito fundamental para a concessão de medicamentos fora dos protocolos oficiais. As audiências públicas prévias, que contaram com ampla participação dos atores do sistema de justiça e gestores de todas as esferas governamentais, culminaram na homologação de um acordo pelo Supremo Tribunal Federal, o qual não só reforça a coesão do sistema público de saúde, mas também fortalece a mediação e a conciliação como instrumentos democráticos. O julgamento consagra ainda a autonomia do federalismo sanitário, promovendo o equilíbrio entre a gestão descentralizada da saúde e a preservação dos direitos fundamentais dos cidadãos, sem desconsiderar a sustentabilidade das políticas públicas.
OBJETIVO
O presente artigo tem como objetivo analisar criticamente o julgamento do Tema 1234 pelo Supremo Tribunal Federal, com foco na judicialização da saúde e na distribuição de competências federativas no fornecimento de medicamentos, padronizados ou não, pelo Sistema Único de Saúde (SUS). Busca-se abordar as implicações jurídicas, técnicas e econômicas da decisão, avaliando seu impacto na política pública de saúde, bem como sua contribuição para a consolidação da medicina baseada em evidências, o fortalecimento da mediação e conciliação como instrumentos democráticos, e a preservação da autonomia do federalismo sanitário no Brasil.
MÉTODOS
Este estudo adota uma abordagem qualitativa e exploratória, utilizando pesquisa bibliográfica e análise documental como principais métodos de investigação. Primeiramente, foram analisados os acórdãos do Supremo Tribunal Federal, especialmente o julgamento do Tema 1234, bem como o histórico das decisões relativas à judicialização da saúde, incluindo a Suspensão de Tutela Antecipada 175 (STA 175). Documentos jurídicos e institucionais, como a legislação vigente, relatórios do Tribunal de Contas da União e dados estatísticos do Conselho Nacional de Justiça (CNJ), também foram examinados para compreender o impacto das decisões no fornecimento de medicamentos pelo SUS.
A pesquisa bibliográfica incluiu a análise de doutrina especializada, artigos acadêmicos e pareceres técnicos relacionados ao direito à saúde, ao federalismo sanitário, e à medicina baseada em evidências. A análise foi realizada sob uma perspectiva crítica, visando identificar as implicações práticas e teóricas do julgamento do Tema 1234, com especial atenção à delimitação das competências federativas, ao papel da intervenção judicial, e às consequências econômicas e sociais das decisões para o sistema de saúde público.
Por fim, as informações foram organizadas de forma a oferecer uma visão clara e embasada sobre o impacto do julgamento, contribuindo para a discussão acerca da judicialização da saúde e suas repercussões no âmbito da política pública de saúde no Brasil.
Contextualização Jurídica
Antes da Constituição Federal de 1988, o acesso aos serviços de saúde no Brasil era restrito. Apenas aqueles que podiam pagar pela assistência privada ou que eram segurados da Previdência Social tinham acesso garantido, deixando 3/5 da população brasileira sem qualquer garantia de atendimento. O acesso aos hospitais públicos estava limitado a cerca de 30 milhões de brasileiros. Com o advento da Constituição de 1988, mais de 70 milhões de pessoas passaram a ter direito ao atendimento pelo Sistema Único de Saúde (SUS), que atualmente é a única fonte de acesso à saúde para 152 milhões de brasileiros5. A saúde passou a ser um direito universal e integral, garantido pelo Estado, sem necessidade de contraprestação. No entanto, a inclusão maciça de novos usuários e a ampliação dos serviços ofertados resultaram em subfinanciamento, saturação e desafios na gestão do sistema6.
Nesse contexto, houve a necessidade de uma legislação infraconstitucional para organizar a oferta de serviços e maximizar a qualidade e o alcance das ações de saúde. Assim, surgiu a Lei Orgânica da Saúde (Lei n.º 8.080/90), que regulamenta as condições para promoção, proteção e recuperação da saúde, além de estruturar o funcionamento do SUS. Em seu capítulo VIII, trata da assistência terapêutica e da incorporação de tecnologias em saúde, estabelecendo os critérios para a incorporação e dispensação de medicamentos de acordo com protocolos clínicos e diretrizes terapêuticas, sempre fundamentados na medicina baseada em evidências, com foco na eficácia, acurácia, efetividade, segurança e avaliação econômica comparativa com as tecnologias já incorporadas7.
Entretanto, a evolução rápida da medicina, especialmente no que diz respeito a novos fármacos voltados para terapias oncológicas e doenças raras ou ultrarraras, introduziu no mercado medicamentos de alto custo, muitas vezes sem estudos robustos de longo prazo que comprovem sua efetividade e segurança. Além disso, o processo de registro na Agência Nacional de Vigilância Sanitária (ANVISA), que autoriza a comercialização de medicamentos no país, pode demorar entre 120 e 365 dias8. Após essa etapa, o procedimento para a recomendação de incorporação pela Comissão Nacional de Incorporação de Tecnologias no SUS (CONITEC) pode durar até 270 dias9.
Nesse cenário, uma auditoria realizada pelo Tribunal de Contas da União (TCU) identificou que os gastos com saúde têm aumentado devido à existência de redes de relacionamento entre a indústria farmacêutica, associações de pacientes, advogados e médicos. Verificou-se que a judicialização da saúde gerava realocações emergenciais de recursos, interrompendo tratamentos de pacientes regulares e pressionando os gestores públicos a cumprir decisões judiciais. Além disso, permitia que laboratórios elevassem os preços dos medicamentos em situações de aquisições emergenciais, sem licitação e sem regulação pela Câmara de Regulação do Mercado de Medicamentos (CMED), para atender as ordens judiciais10.
Estudos, como os realizados por Soares, indicam que muitas associações de pacientes foram criadas com a participação do setor farmacêutico, sendo financiadas majoritariamente por indústrias farmacêuticas, que utilizam essas associações como parte de sua estratégia para influenciar autoridades governamentais:
No presente trabalho, importa ressaltar as indicações de que o setor farmacêutico possa estar se valendo de novos caminhos para influenciar a utilização de medicamentos inovadores – incluindo experimentais – no tratamento de diversas doenças, por meio do incentivo à impetração de ações judiciais como forma de acesso aos novos fármacos ou da pressão por sua entrada nos protocolos clínicos aprovados para inserção no SUS. Os produtos são apresentados aos doentes e seus familiares como a melhor tecnologia e, em alguns casos, como a única forma possível de tratamento, muitas vezes estimulado pelos próprios médicos. Os indícios apontam para uma possível atuação dos fabricantes de medicamentos por meio da influência que exercem junto a associações de pacientes, o que evidencia a necessidade urgente de se aprofundar esse tema e de se refletir sobre seu impacto para a saúde e para o SUS. (Soares, 2012, p.319).
A relevância desse tema para a jurisprudência brasileira e seu impacto na sociedade reforçam a importância do julgamento do Tema 1234. Este julgamento estabelece, de forma vinculante para os Poderes Executivo e Judiciário, critérios objetivos para a fixação de competência em ações judiciais envolvendo a saúde, a conceituação de medicamentos não incorporados, a obrigação de custeio pelos entes federados, os limites da análise judicial sobre os atos administrativos que indeferem medicamentos no SUS, além da criação de uma plataforma nacional para centralizar todas as informações sobre demandas administrativas e judiciais referentes ao acesso a medicamentos, bem como o fluxo processual para medicamentos incorporados.
ANÁLISE TÉCNICA DO JULGAMENTO
Aspectos Constitucionais
O julgamento em questão destaca a relevância constitucional ao tratar da repartição de competências materiais entre os entes federativos para o fornecimento de medicamentos no âmbito do SUS. A insegurança jurídica na tramitação de processos relacionados à dispensação de medicamentos gera instabilidade social, econômica e política, afetando o pacto federativo. A Constituição de 1988 instituiu o federalismo cooperativo no Brasil, com o objetivo de assegurar uma atuação solidária e coordenada entre os entes federados11. Neste contexto, destacou-se a necessidade de um processo de diálogo interfederativo e colaborativo com a sociedade, que propiciasse a construção de uma solução autocompositiva para a questão do fornecimento de medicamentos pelo SUS. Esse processo buscava aprofundar o conceito constitucional de solidariedade, municiando a Federação com mecanismos, protocolos e fluxogramas necessários para assegurar o acesso efetivo da população a direitos fundamentais, sem gerar desequilíbrio financeiro ou desprogramação orçamentária.
No entanto, observa-se a existência de omissões na assunção de responsabilidades, a criação de entraves mútuos, desigualdades regionais e locais, a delegação da gestão do sistema ao Judiciário, a incapacidade regulatória do sistema público e a falta de ações coordenadas entre os entes:
Pode-se dizer que o federalismo cooperativo do setor saúde, no Brasil, atualmente, assemelha-se a um pacto de não responsabilização mútua entre os três níveis de governo. A dimensão consensual da democracia nesse caso não peca pelo processo decisório mais lento e negociado, e, sim, por um sistema de vetos cruzados entre os atores federativos (Ministério da Saúde, Conselho Nacional de Secretários Estaduais de Saúde e Conselho Nacional de Secretários Municipais de Saúde) e os societários (Conselho Nacional de Saúde), onde a dimensão contratual e responsável cede lugar à inércia. A persistência de intensas desigualdades regionais e locais, a delegação das funções regulatórias para órgãos de controle e judiciário, a superposição de funções e despesas, as barreiras de acesso intermunicipais e interestaduais e a paralisia política da agenda de regionalização são apenas algumas das muitas evidências nesse sentido. (Ribeiro, p.21, 2016).
O artigo científico intitulado Conflitos de Competência e a Judicialização da Saúde no Federalismo Brasileiro estudou 127 julgados do Supremo Tribunal Federal (STF), analisando as contestações dos entes federativos frente às decisões dos Tribunais Federais e Estaduais em relação à demanda de cidadãos por medicamentos e insumos de alto custo. A pesquisa concluiu que há uma tendência do STF em manter as decisões dos Tribunais inferiores, no sentido de conceder a tutela ao cidadão com relação ao dever dos entes de fornecer medicamentos de alto custo. Esses resultados reforçam a sobreposição do Poder Judiciário sobre o Poder Executivo na regulamentação de sua atuação. Observou-se que, embora os entes federados tenham demonstrado certo inconformismo quanto às decisões dos Tribunais inferiores, o STF tem se posicionado de forma imperiosa, sem, contudo, extrapolar o sistema de freios e contrapesos entre os poderes estatais (Hanai, 2021).
O Supremo Tribunal Federal, ao apreciar o caso, inovou positivamente ao utilizar técnicas autocompositivas. Após uma série de audiências públicas e oito meses de debates com ampla participação de gestores de saúde, sociedade civil, entidades de classe e operadores do direito, o STF homologou o acordo construído pelos entes federativos. O acordo definiu as competências materiais de cada ente no fornecimento de medicamentos, os critérios de participação no custeio, as formas de reembolso, melhorias no processo de incorporação de medicamentos e a limitação da intervenção judicial nas decisões administrativas, resguardando a independência e a harmonia entre os poderes12.
O Ministro Gilmar Mendes destacou a complexidade e a interligação do federalismo sanitário, ressaltando a necessidade de uma solução construída a partir do diálogo permanente entre os atores administrativos e judiciais. A questão, quando analisada apenas sob uma perspectiva processual, frequentemente ignora a intricada rede de relações e as estruturas federativas que viabilizam a efetivação do direito fundamental à saúde. O objetivo é melhorar a coordenação sistêmica, incentivar a cooperação, reduzir as desigualdades regionais e devolver ao Poder Executivo a responsabilidade de gestão, que atualmente é delegada em grande parte ao Judiciário. Busca-se, assim, um equilíbrio entre a responsabilidade social e a responsabilidade fiscal, por meio de propostas tecnicamente viáveis e financeiramente sustentáveis, permitindo a harmonização entre o direito constitucional à saúde e o dever de responsabilidade fiscal13.
ASPECTOS PRÁTICOS DA DECISÃO
Impacto na Jurisprudência
O julgamento do Tema 1234 pelo Supremo Tribunal Federal (STF) teve um impacto relevante sobre decisões anteriores de repercussão geral, tanto da própria corte quanto do Superior Tribunal de Justiça (STJ). Abaixo, são analisados alguns dos principais temas afetados.
O Tema 793 do STF discutiu a existência, ou não, de responsabilidade solidária entre os entes federados pela promoção dos atos necessários à concretização do direito à saúde, tais como o fornecimento de medicamentos e o custeio de tratamento médico adequado aos necessitados.
Tese:
Os entes da federação, em decorrência da competência comum, são solidariamente responsáveis nas demandas prestacionais na área da saúde, e diante dos critérios constitucionais de descentralização e hierarquização, compete à autoridade judicial direcionar o cumprimento conforme as regras de repartição de competências e determinar o ressarcimento a quem suportou o ônus financeiro.
Reconheceu as regras de repartição de competências materiais entre os entes ao determinar o redirecionamento do cumprimento de sentença e o ressarcimento, porém permitiu que a parte ajuizasse a demanda contra qualquer deles ou contra todos ao argumento da solidariedade em relação a prestação de saúde.
O Tema 1234 de forma expressa excluiu a incidência do Tema 793 na judicialização de medicamentos, exclusivamente, no âmbito do SUS, não contemplando produtos que não sejam caracterizados como medicamento, a exemplo de órteses, próteses e equipamentos médicos, procedimentos terapêuticos, em regime domiciliar, ambulatorial e hospitalar. A consequência prática foi que a partir publicação do resultado do julgamento de mérito no Diário de Justiça Eletrônico, a competência de jurisdição federal ou estadual será absoluta conforme as regras delimitadas no acordo homologado.
O Tema 500 do STF discutiu a possibilidade, ou não, de o Estado ser obrigado a fornecer medicamento não registrado na Agência Nacional de Vigilância Sanitária – ANVISA.
Tese:
1. O Estado não pode ser obrigado a fornecer medicamentos experimentais. 2. A ausência de registro na ANVISA impede, como regra geral, o fornecimento de medicamento por decisão judicial. 3. É possível, excepcionalmente, a concessão judicial de medicamento sem registro sanitário, em caso de mora irrazoável da ANVISA em apreciar o pedido (prazo superior ao previsto na Lei nº 13.411/2016), quando preenchidos três requisitos: (i) a existência de pedido de registro do medicamento no Brasil (salvo no caso de medicamentos órfãos para doenças raras e ultrarraras);(ii) a existência de registro do medicamento em renomadas agências de regulação no exterior; e (iii) a inexistência de substituto terapêutico com registro no Brasil. 4. As ações que demandem fornecimento de medicamentos sem registro na ANVISA deverão necessariamente ser propostas em face da União.
O Supremo manteve in totum o conteúdo do Tema 500, em especial para manter a competência da Justiça Federal em relação às ações que demandem fornecimento de medicamentos sem registro na Anvisa, independente do custo anual de tratamento.
O IAC 14 do STJ surgiu em decorrência do julgamento do Tema 793, oportunidade em que Supremo Tribunal Federal reafirmou a responsabilidade solidária dos entes federativos em questões de saúde, porém trouxe uma inovação jurídica ao exigir que o magistrado oriente o cumprimento da obrigação de acordo com as normas de repartição de competências do SUS. Além disso, determinou que o ente político responsável pelo financiamento da assistência sanitária reembolse aquele que arcou com os custos. Essa modificação gerou divergências interpretativas entre os tribunais estaduais e federais, reacendendo o debate sobre a natureza do litisconsórcio em tais situações, o que resultou em um expressivo número de conflitos de competência no STJ.
Tese Firmada
a) Nas hipóteses de ações relativas à saúde intentadas com o objetivo de compelir o Poder Público ao cumprimento de obrigação de fazer consistente na dispensação de medicamentos não inseridos na lista do SUS, mas registrado na ANVISA, deverá prevalecer a competência do juízo de acordo com os entes contra os quais a parte autora elegeu demandar.
b) as regras de repartição de competência administrativas do SUS não devem ser invocadas pelos magistrados para fins de alteração ou ampliação do polo passivo delineado pela parte no momento da propositura ação, mas tão somente para fins de redirecionar o cumprimento da sentença ou determinar o ressarcimento da entidade federada que suportou o ônus financeiro no lugar do ente público competente, não sendo o conflito de competência a via adequada para discutir a legitimidade ad causam, à luz da Lei n. 8.080/1990, ou a nulidade das decisões proferidas pelo Juízo estadual ou federal, questões que devem ser analisada no bojo da ação principal.
c) a competência da Justiça Federal, nos termos do art. 109, I, da CF/88, é determinada por critério objetivo, em regra, em razão das pessoas que figuram no polo passivo da demanda (competência ratione personae), competindo ao Juízo federal decidir sobre o interesse da União no processo (Súmula 150 do STJ), não cabendo ao Juízo estadual, ao receber os autos que lhe foram restituídos em vista da exclusão do ente federal do feito, suscitar conflito de competência (Súmula 254 do STJ).
Em síntese vedou-se a suscitação de conflito de competência entre as justiças estadual e federal em caso de pedido de medicamentos registrados na ANVISA, mas não incorporados as SUS, cabendo a parte livremente escolher o polo passivo, independente das competências materiais do SUS.
O acórdão determinou a comunicação ao relator do IAC 14 no Superior Tribunal de Justiça para adequação ao presente entendimento. Parece que com a fixação de competência absoluta em razão da matéria fixada no julgado em razão de se tratar sobre medicamento incorporado ou não, do valor anual de tratamento, da ausência de registro na Anvisa, o IAC 14 perdeu seu objeto.
Tema 1161 do STF discutiu o dever do Estado de fornecer medicamento que, embora não possua registro na ANVISA, tem a sua importação autorizada pela agência de vigilância sanitária.
Tese:
Cabe ao Estado fornecer, em termos excepcionais, medicamento que, embora não possua registro na ANVISA, tem a sua importação autorizada pela agência de vigilância sanitária, desde que comprovada a incapacidade econômica do paciente, a imprescindibilidade clínica do tratamento, e a impossibilidade de substituição por outro similar constante das listas oficiais de dispensação de medicamentos e os protocolos de intervenção terapêutica do SUS.
Entendemos que com a publicação do acórdão do tema 1234 a tese se mantém incólume, porém a competência jurisdicional é absoluta da justiça federal, bem como o financiamento excluso pela União.
Tema 6 do STF discutiu a obrigatoriedade, ou não, de o Estado fornecer medicamento de alto custo a portador de doença grave que não possui condições financeiras para comprá-lo.
Tese:
1. A ausência de inclusão de medicamento nas listas de dispensação do Sistema Único de Saúde – SUS (RENAME, RESME, REMUME, entre outras) impede, como regra geral, o fornecimento do fármaco por decisão judicial, independentemente do custo. 2. É possível, excepcionalmente, a concessão judicial de medicamento registrado na ANVISA, mas não incorporado às listas de dispensação do Sistema Único de Saúde, desde que preenchidos, cumulativamente, os seguintes requisitos, cujo ônus probatório incumbe ao autor da ação: (a) negativa de fornecimento do medicamento na via administrativa, nos termos do item ‘4’ do Tema 1234 da repercussão geral; (b) ilegalidade do ato de não incorporação do medicamento pela Conitec, ausência de pedido de incorporação ou da mora na sua apreciação, tendo em vista os prazos e critérios previstos nos artigos 19-Q e 19-R da Lei nº 8.080/1990 e no Decreto nº 7.646/2011; (c) impossibilidade de substituição por outro medicamento constante das listas do SUS e dos protocolos clínicos e diretrizes terapêuticas; (d) comprovação, à luz da medicina baseada em evidências, da eficácia, acurácia, efetividade e segurança do fármaco, necessariamente respaldadas por evidências científicas de alto nível, ou seja, unicamente ensaios clínicos randomizados e revisão sistemática ou meta-análise; (e) imprescindibilidade clínica do tratamento, comprovada mediante laudo médico fundamentado, descrevendo inclusive qual o tratamento já realizado; e (f) incapacidade financeira de arcar com o custeio do medicamento. 3. Sob pena de nulidade da decisão judicial, nos termos do artigo 489, § 1º, incisos V e VI, e artigo 927, inciso III, § 1º, ambos do Código de Processo Civil, o Poder Judiciário, ao apreciar pedido de concessão de medicamentos não incorporados, deverá obrigatoriamente: (a) analisar o ato administrativo comissivo ou omissivo de não incorporação pela Conitec ou da negativa de fornecimento da via administrativa, à luz das circunstâncias do caso concreto e da legislação de regência, especialmente a política pública do SUS, não sendo possível a incursão no mérito do ato administrativo; (b) aferir a presença dos requisitos de dispensação do medicamento, previstos no item 2, a partir da prévia consulta ao Núcleo de Apoio Técnico do Poder Judiciário (NATJUS), sempre que disponível na respectiva jurisdição, ou a entes ou pessoas com expertise técnica na área, não podendo fundamentar a sua decisão unicamente em prescrição, relatório ou laudo médico juntado aos autos pelo autor da ação; e (c) no caso de deferimento judicial do fármaco, oficiar aos órgãos competentes para avaliarem a possibilidade de sua incorporação no âmbito do SUS”. Por fim, determinou, tal como no Tema 1.234, que essas teses sejam transformadas em enunciado sintetizado de súmula vinculante, na forma do art. 103-A da Constituição Federal, com a seguinte redação: “A concessão judicial de medicamento registrado na ANVISA, mas não incorporado às listas de dispensação do Sistema Único de Saúde, deve observar as teses firmadas no julgamento do Tema 6 da Repercussão Geral (RE 566.471).
Foi julgado de forma contemporânea ao Tema 1234, havendo uma complementação entre ambos. Reforça a regra da vedação de dispensação judicial de medicamentos não incorporados ao SUS, porém, excepcionalmente é possível em caso de fármaco com registro na ANVISA, cabendo ao autor da ação demonstrar de forma cumulativa: análise judicial do ato administrativo de indeferimento de medicamento pelo SUS nos termos do item ‘4’ do Tema 1234 da repercussão geral; ilegalidade do ato de não incorporação do medicamento pela Conitec, ausência de pedido de incorporação ou da mora na sua apreciação; impossibilidade de substituição por outro medicamento constante das listas do SUS e dos protocolos clínicos e diretrizes terapêuticas; evidência científica de alto nível; imprescindibilidade clínica do tratamento; cabe ao Poder Judiciário: analisar a legalidade do ato administrativo comissivo ou omissivo de não incorporação pela Conitec ou da negativa de fornecimento da via administrativa, sendo vedada a análise do mérito; vedação de fundamentar a decisão unicamente em prescrição, relatório ou laudo médico juntado aos autos pelo autor da ação; no caso de deferimento judicial do fármaco, oficiar aos órgãos competentes para avaliarem a possibilidade de sua incorporação no âmbito do SUS.
RMS 28.487/DF discutiu se o percentual de desconto obrigatório e linear nas vendas de determinados medicamentos ao Poder Público, chamado Coeficiente de Adequação de Preço (CAP), permitindo, assim, que se chegue ao “Preço Máximo de Venda ao Governo” (PMVG), seria constitucional, decidindo positivamente.
No julgamento do Tema 1234 a Corte reafirmou o julgado e avançou no sentido de proibir a compra de medicamentos via judicial por valor acima do PMVG
Súmula Vinculante nº 60 o julgamento representou o entendimento consolidado e reiterado do STF sobre a judicialização da saúde pública desde o julgamento do STA AgR 175 resultando no seguinte enunciado:
O pedido e a análise administrativos de fármacos na rede pública de saúde, a judicialização do caso, bem ainda seus desdobramentos (administrativos e jurisdicionais), devem observar os termos dos 3 (três) acordos interfederativos (e seus fluxos) homologados pelo Supremo Tribunal Federal, em governança judicial colaborativa, no tema 1.234 da sistemática da repercussão geral (RE 1.366.243).
RESPONSABILIDADE FEDERATIVA
Medicamentos Incorporados vs. Não Incorporados:
Para que um medicamento14 seja fabricado ou comercializado no Brasil, é obrigatório seu registro na ANVISA, órgão responsável por atestar sua qualidade, eficácia e segurança15. Posteriormente, ocorre a precificação pela CMED. Para que o medicamento seja incorporado ao SUS, é necessária a avaliação da CONITEC, que considera, além dos benefícios e da segurança para os pacientes, a capacidade do sistema público de ofertá-lo. Após parecer favorável da CONITEC, cabe ao Ministério da Saúde decidir pela incorporação ou não do fármaco.
No julgamento do Tema 1234, foi estabelecida a definição de medicamento incorporado e não incorporado, uniformizando a nomenclatura para fins de análises administrativa e judicial, conforme segue:
Medicamentos incorporados: São os medicamentos previstos na política pública do SUS, divididos em duas categorias: disponibilizados (os que constam nas listas oficiais, como RENAME, RESME e REMUNE, incluindo o uso off-label previsto em PCDT e componente básico da RENAME) e em processo de disponibilização (aqueles cuja portaria de incorporação pelo Ministério da Saúde já foi publicada, mas ainda não foram disponibilizados na rede pública, dentro do prazo legal de até 180 dias, prorrogável por mais 90 dias).
Medicamentos não incorporados: São aqueles que não constam na política pública do SUS; os previstos nos PCDTs para outras finalidades; os que não possuem registro na ANVISA; e os medicamentos off-label16 sem PCDT ou que não fazem parte das listas do componente básico.
Resumidamente, os medicamentos não incorporados são aqueles que não estão contemplados nas listas oficiais (RENAME, RESME e REMUNE) ou que, mesmo constando nessas listas, não têm indicação para a doença específica tratada. Isso inclui também medicamentos sem registro na ANVISA e medicamentos prescritos fora da bula sem previsão no PCDT, ou não integrante da lista do componente básico.
Medicamentos Incorporados: Aqueles previstos na política pública do SUS, que se dividem em:
– Disponibilizados: Medicamentos incluídos nas listas oficiais de medicamentos (RENAME, RESME e REMUNE), incluindo o uso off label previsto nos Protocolos Clínicos e Diretrizes Terapêuticas (PCDT) e no componente básico da RENAME.
– Em processo de disponibilização: Medicamentos cuja portaria de incorporação pelo Ministério da Saúde já foi publicada, mas que ainda estão no processo de serem disponibilizados na rede pública. O prazo para conclusão da disponibilização não deve exceder 180 dias, a contar da data do protocolo de pedido, podendo ser prorrogado por mais 90 dias corridos (dentro do prazo legal) e fora do prazo legal após o termo final17.
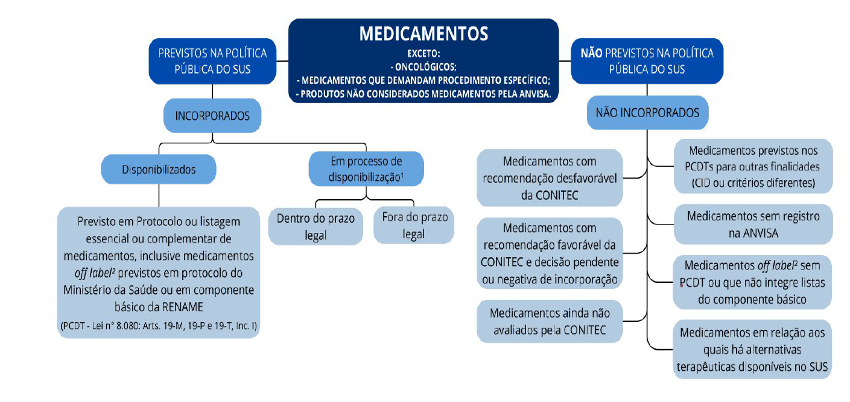
No que se refere a produtos de interesse para a saúde que não são medicamentos, como órteses, próteses e equipamentos médicos, bem como procedimentos terapêuticos em regime domiciliar, ambulatorial ou hospitalar, esses itens não foram discutidos pela Comissão Especial e, portanto, não são contemplados no Tema 1234.
Competência Jurisdicional
A definição dos conceitos de medicamentos incorporados e não incorporados é crucial para a determinação da competência jurisdicional absoluta nos processos judiciais.
– Justiça Federal: Competente para os casos de medicamentos não incorporados cujo custeio anual seja igual ou superior a 210 salários-mínimos. O mesmo critério aplica-se aos medicamentos oncológicos.
– Justiça Estadual: Competente quando o custo anual dos medicamentos não incorporados for inferior a 210 salários-mínimos.
Existindo mais de um medicamento do mesmo princípio ativo e não sendo solicitado um fármaco específico, considera-se, para efeito de competência, aquele listado no menor valor na lista CMED (PMVG, situado na alíquota zero). No caso de inexistir valor fixado na lista CMED, considera-se o valor do tratamento anual do medicamento solicitado na demanda. No caso de cumulação de pedidos, para fins de competência, será considerado apenas o valor do(s) medicamento(s) não incorporado(s) que deverá(ão) ser somado(s), independentemente da existência de cumulação alternativa de outros pedidos envolvendo obrigação de fazer, pagar ou de entregar coisa certa.
Para os medicamentos incorporados, a competência segue o fluxo administrativo e judicial detalhado no anexo I do acordo homologado:
– Justiça Federal: Competente para os medicamentos do Componente Especializado da Assistência Farmacêutica (CEAF), grupo 1A.
– Justiça Estadual: Competente para os medicamentos dos grupos 1B, 2, 3 do CEAF e do Componente Básico da Assistência Farmacêutica.
Nos casos de medicamentos sem registro na ANVISA, a competência é sempre da Justiça Federal, independentemente do custo anual.


Custeio e Ressarcimento
O acordo homologado definiu parâmetros para o custeio e ressarcimento dos medicamentos, conforme segue:
– Justiça Federal (Medicamentos Não Incorporados): Medicamentos cujo custo anual seja igual ou superior a 210 salários-mínimos, sem registro na ANVISA. ou pertencentes ao CESAF (Componente Estratégico da Assistência Farmacêutica) grupo 1A. Nesse caso, o custeio é integralmente de responsabilidade da União, que também deve ressarcir integralmente os entes federativos em caso de redirecionamento.
– Justiça Estadual (Medicamentos Não Incorporados): O ressarcimento pela União ocorre via repasses Fundo a Fundo:
– 65% para medicamentos não incorporados (valor entre 7 e 210 salários-mínimos);
– 80% para o valor global gasto por estados e municípios com medicamentos oncológicos (para ações ajuizadas até 10/06/2024).
Medicamentos não incorporados com custo anual igual ou inferior a 7 salários-mínimos são custeados pelos estados, com a possibilidade de pactuação diferente nas Comissões Intergestores Bipartite.
Exceções: Medicamentos de aquisição centralizada (CBAF), como aqueles destinados à saúde indígena, saúde da mulher, insulinas e kits de calamidade, serão ressarcidos em 100% pela União. Para o CESAF grupo 3, o ressarcimento pela União ocorre em caso de ausência ou insuficiência de financiamento municipal.
Para os medicamentos incorporados deverá ser observada a atribuição de responsabilidade definidas em autocomposição nesta Corte, dividida por medicamentos incluídos no Componente Especializado da Assistência Farmacêutica (CEAF), Componente Básico da Assistência Farmacêutica (CBAF) ou Componente Estratégico da Assistência Farmacêutica (CESAF), da seguinte forma, em regra:
– Justiça Federal (Medicamentos Incorporados):
Pertencentes ao CESAF (Componente Estratégico da Assistência Farmacêutica) ou ao Componente Especializado da Assistência Farmacêutica (CEAF) grupo 1A. Nesse caso, o custeio é integralmente de responsabilidade da União, que também deve ressarcir integralmente os entes federativos em caso de redirecionamento.
– Justiça Estadual (Medicamentos Incorporados):
Relativos Componente Especializado da Assistência Farmacêutica (CEAF) grupos 1B, 2 e 3, assim como o Componente básico da Assistência Terapêutica (CBAF). Nesse caso, o custeio é integralmente de responsabilidade da União no grupo 1B, pelo Estado no grupo 2 e tripartite no grupo 3 e CBAF.


Ressarcimento Interfederativo:
– O ressarcimento abrange os gastos realizados desde 2018;
– Prazo máximo de 5 anos para a satisfação integral do ressarcimento;
– Regulamentação da operacionalização pela instância tripartite em até 90 dias;
Observância do limite temporal de 2018 e outros aspectos acordados, como a prescindibilidade da presença da União no polo passivo e do trânsito em julgado das demandas.
A operacionalização será realizada por meio de rubrica rastreável e identificação única após a publicação do julgado.
Diretrizes Vinculantes para a Magistratura na Gestão de Processos de Judicialização da Saúde Pública de Medicamentos
– CUSTEIO
Nova modalidade de chamamento ao processo e redirecionamento da execução.
Com relação ao custeio do medicamento o acórdão determinou que quando exista mais de um ente compondo o polo passivo é possível que o juiz redirecione de ofício o cumprimento da obrigação para aquele que não possua competência material para tanto, desde que haja impossibilidade de cumprimento pelo ente devedor, devendo o ressarcimento ocorrer via repasses Fundo a Fundo.
Figurando no polo passivo somente o ente com competência material para o fornecimento do medicamento, na impossibilidade de entrega do fármaco, cabe ao magistrado de ofício, promover a inclusão dos demais entes para possibilitar o cumprimento efetivo da decisão, o que não importará em responsabilidade financeira nem em ônus de sucumbência, devendo ser realizado o ressarcimento via repasses Fundo a Fundo.
Entendemos acertada a decisão de redirecionamento da execução e essa nova modalidade de chamamento ao processo18 devido a obrigação solidária dos entes na prestação de ações e serviços de saúde19.
Valor a ser pago pelo medicamento
O acórdão estabelece, de forma expressa e sem exceções, que o pagamento judicial a fabricantes, distribuidores e fornecedores não pode exceder o teto do Preço Máximo de Venda ao Governo (PMVG). A regra é que o valor do medicamento deve ser limitado ao preço com desconto, definido no processo de incorporação pela Conitec, observando o índice de reajuste anual estabelecido pela CMED, ou ao menor valor já praticado em compras públicas. Essa interpretação reforça o comando previsto na Recomendação 146 do CNJ20. Quando se trata de medicamentos não registrados na ANVISA, e, portanto, sem precificação pela CMED, a lacuna pode ser suprida pela apresentação de três orçamentos pela parte autora, conforme também orientado pelo CNJ.
Se houver dificuldade de aquisição pelo ente competente, o juiz pode determinar diretamente ao fornecedor que entregue o medicamento ao ente responsável, aplicando multa em caso de descumprimento. Discussões sobre o preço entre distribuidores, fornecedores ou fabricantes não devem impedir o fornecimento do medicamento ao paciente.
Esse trecho do corpo do acórdão soluciona situações vivenciadas na prática cotidiana em que a farmácia se recusa a vender judicialmente o medicamento pelo PMVG aplicado o CAP ao argumento de prejuízo. É possível que se questione a violação dos princípios constitucionais relativos à ordem econômica (livre-concorrência e livre-iniciativa) em tese por desapropriação a preço injusto e sem compensação pecuniária (RMS 28487 / DF).
A imposição de multas coercitivas (astreintes) a terceiros fora do processo, comum no direito francês, é também uma questão discutida. No Brasil, essa prática é mais restrita, porém, o acórdão admite a possibilidade de astreintes em certos contextos. O Ministro Luiz Fux, no voto vogal, fez uma ressalva sobre as repercussões econômicas desse tipo de penalidade sobre terceiros envolvidos no processo.
Os diversos dispositivos acima citados demonstram que as astreintes, no direito francês, se prestam a reforçar decisões judiciais diversas e não somente aquelas que veiculam a tutela obrigacional propriamente dita. Por exemplo, a multa coercitiva pode, como vimos na lição de Guilherme Amaral, ser utilizada para fins instrutórios (ao contrário do que ocorre aqui no Brasil355). Mais: o artigo 139 do Code de Procédure Civile deixa claro, ainda, que as astreintes não se restringem às partes do feito, podendo atingir terceiros estranhos ao processo (o que também não sucede em solo pátrio). (Margozão, 2013,p.103)
Lado outro, parte da doutrina advoga que explicitamente, o art. 403 do Código de Processo Civil, em seu parágrafo único, admite a fixação de multa em desfavor de terceiros, assim como o art. 77 do mesmo diploma destaca que a multa por violação à dignidade da jurisdição se aplica às partes e “todos aqueles que de qualquer forma participem do processo”, dando margem ao seu arbitramento a qualquer um que participe do processo, ainda que terceiro com dever colateral.
De forma menos explícita, mas ainda assim em conformidade com o poder do magistrado de fazer cumprir suas determinações, vê-se que o art. 139, IV do Código de Processo Civil garante ao julgador cláusula geral que confere poder ao julgador para a adoção de meios necessários à satisfação da obrigação não delineados previamente no diploma legal21. Ou seja, a fim de garantir a obediência à sua ordem, o magistrado pode impor sanções, e como tais ordens podem ser direcionadas a terceiros.
Quanto à jurisprudência, sem necessidade de citar outros julgados, limitamo-nos aqui a recordar o REsp 1.568.445-PR, julgado em 24/06/2020, de relatoria do ministro Rogério Schietti e divulgado no informativo n. 677 do Superior Tribunal de Justiça, que admitiu a aplicação subsidiária do Código de Processo Civil ao processo penal a fim de fixar astreintes (multa diária) como poder geral de cautela diante da teoria dos poderes implícitos do julgador.
A questão deverá ser apreciada quando do julgamento dos Embargos de Declaração.
– ANÁLISE JUDICIAL DO ATO ADMINISTRATIVO DE INDEFERIMENTO DE MEDICAMENTO PELO SUS
O acórdão estabelece que, sob pena de nulidade, o Poder Judiciário deve obrigatoriamente analisar os atos administrativos relacionados à não incorporação de medicamentos pela Conitec, bem como a negativa de fornecimento pela via administrativa, ao apreciar pedidos de concessão de medicamentos não incorporados ao SUS.
Para a tutela de medicamentos não incorporados, o magistrado deve examinar o parecer da Conitec sobre a incorporação do medicamento na política pública de saúde ou a falta de análise sobre o pedido. Também é imprescindível a análise do ato administrativo do ente público que negou a dispensação na fase extrajudicial. As respostas administrativas podem variar entre deferimento, indeferimento, devolução para instrução ou impossibilidade de fornecimento, sendo necessário justificar os motivos para o indeferimento.
Os conselhos profissionais terão um papel ativo no controle ético das prescrições, especialmente quando os medicamentos forem prescritos fora das diretrizes do SUS. Esses conselhos poderão intervir em caso de desvio ético, responsabilizando os profissionais que repetidamente prescrevem medicamentos fora dos protocolos sem justificativa adequada.
É interessante anotar que a existência de uma plataforma única para prescrições eletrônicas permitirá a certificação desses documentos, viabilizando não só seu rastreamento adequado, como também coibindo a realização de fraudes, com o uso de laudos médicos fraudados não assinados pelos profissionais.
No que diz respeito às decisões judiciais, é vedada a análise do mérito administrativo referente à incorporação ou não do medicamento pela Conitec e do administrativo pelo ente público que negou a dispensação do medicamento, sendo o magistrado limitado ao exame da regularidade e legalidade do processo administrativo. No entanto, quando o ato administrativo for discricionário, é necessário verificar a existência e veracidade dos motivos que sustentam a decisão.
No caso de medicamentos não incorporados, é proibido deferir a concessão com base apenas em relatório médico. O ônus de provar a segurança e eficácia do medicamento, fundamentado em Medicina Baseada em Evidências, recai sobre o autor, e só serão aceitos estudos com evidências científicas robustas, como ensaios clínicos randomizados, revisões sistemáticas ou meta-análises.
Para o debate, nos parece que a exigência de negativa administrativa prévia vinculada aos termos do acordo homologado cria uma condição da ação22 e a ausência do documento traz como consequência a extinção do processo sem resolução do mérito por ausência do interesse de agir. As regiões brasileiras devido as variáveis geográficas, sociais, econômicas de demografia de profissionais de saúde estariam aptas para fornecer essa documentação ao paciente? Caso haja a negativa administrativa do medicamento ao paciente e não seja lhe entregue nenhum documento formal, o juiz ao determinar a emenda à inicial, em quanto tempo esses pacientes conseguiria agendar uma nova consulta?
Exigir que a parte autora comprove fundamentado na Medicina Baseada em Evidências, a segurança e a eficácia do fármaco com evidências científicas de alto nível, não seria dificultar o acesso à justiça, considerando que a grande maioria dos pacientes é hipossuficiente, com assistência pelas defensorias públicas? Fomentar o Estado brasileiro a celebrar com os laboratórios acordo de compartilhamento de risco23 na aquisição de medicamentos de alto custo seria uma opção viável?
Nos casos de medicamentos oncológicos, onde o tempo é fator crítico para aumentar as chances de cura ou prolongar a vida dos pacientes, a exigência de estudos de alta evidência científica, muitas vezes demorados, pode tornar o processo excessivamente difícil, especialmente no tratamento de doenças raras ou ultrarraras, em que o número de pacientes é reduzido, dificultando a produção de estudos robustos.
Uma alternativa possível no tocante às evidências científicas seria o uso do NATJUS para avaliar a documentação juntada. Em Goiás e Roraima, ao elaborar a nota técnica o NATJUS enumera os estudos existentes e o nível de evidência do medicamento frente a moléstia que se pretende combater.
Considerar soluções alternativas até que se possa aplicar na íntegra a decisão do Supremo Tribunal Federal é uma necessidade, considerando a extensão continental e estrutural do Brasil, com diferentes condições em cada estado e município. De outro modo seria impor obrigações de difícil ou impossível cumprimento ao paciente, deixando à margem do Judiciário justamente as pessoas com menos condições financeiras e de acesso à saúde, violando o art. 5°, XXXV da Constituição Federal.
O Ministro Luiz Fux fez ressalvas no voto vogal, destacando os possíveis impactos negativos do enrijecimento dos procedimentos a serem adotados pelo magistrado na análise de litígios envolvendo o fornecimento de medicamentos.
Mudanças Legislativas Potenciais
O julgamento levanta a necessidade de ajustes legislativos e regulatórios, como o Projeto de Lei Complementar 108/2022, que trata da análise de novas tecnologias no Sistema Único de Saúde (SUS). Há propostas para modificar a Lei 12.401/2011 e a Lei 8.080/1990, visando aprimorar o processo de incorporação de tecnologias ao SUS, além de refletir sobre ajustes para o setor de saúde suplementar. Um possível resultado seria a padronização da precificação de medicamentos para ambos os setores público e privado, promovendo maior eficiência.
Plataforma Nacional de Acompanhamento
Os Entes Federativos, junto com o Judiciário, criarão uma plataforma nacional para centralizar informações sobre demandas de medicamentos. Com dados acessíveis, a plataforma facilitará tanto a análise administrativa quanto o controle judicial.
Prescrições eletrônicas serão usadas para garantir o controle ético, e a plataforma também identificará quem é responsável pelo custeio dos medicamentos. Ela permitirá o monitoramento de pacientes e o compartilhamento eficiente de informações, respeitando as leis de proteção de dados.
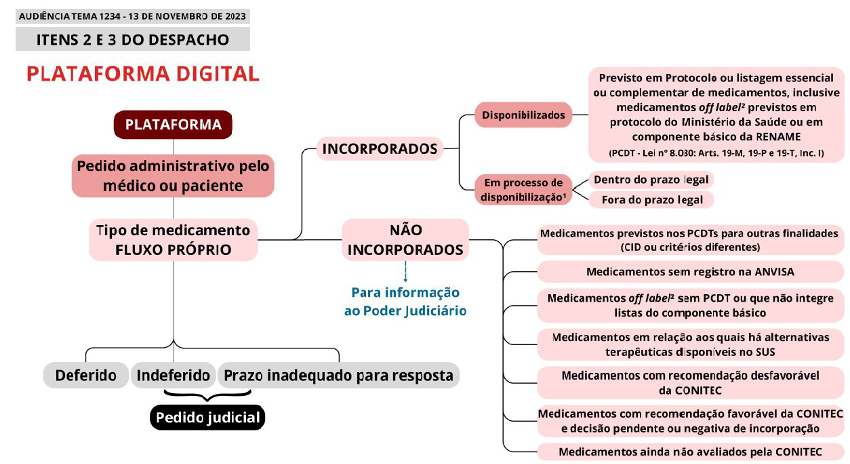
Desafios do Ressarcimento Interfederativo
A decisão estabelece diretrizes claras para que União, Estados e Municípios compartilhem o custo dos medicamentos, especialmente os de alto valor, promovendo uma divisão de responsabilidades que pode aliviar as finanças públicas dos entes locais. No caso de um acordo sobre o ressarcimento, sua execução será viabilizada por meio de uma rubrica específica e rastreável, com identificação única. Dessa forma, o ressarcimento poderá ocorrer semestralmente ou anualmente, permitindo a auditoria pela Controladoria-Geral da União (CGU), sem a necessidade de instrução de pedidos administrativos individualizados para cada processo judicial.
CONCLUSÃO
O julgamento do Tema 1234 pelo Supremo Tribunal Federal representa um marco importante na judicialização da saúde no Brasil, especialmente em relação à definição das competências federativas para o fornecimento de medicamentos. A decisão trouxe maior clareza na repartição de responsabilidades entre União, estados e municípios, além de estabelecer parâmetros objetivos para o custeio e ressarcimento de medicamentos, reduzindo a insegurança jurídica que antes permeava as ações judiciais na área da saúde.
Contudo, o julgamento também levanta preocupações relevantes, especialmente para pacientes que enfrentam doenças graves, como câncer, doenças raras e ultrarraras. A exigência de que o autor da ação comprove, por meio de estudos de medicina baseada em evidências, a segurança e eficácia dos medicamentos não incorporados ao SUS, impõe um ônus que a depender do caso será excessivo, particularmente para aqueles que dependem do sistema público e têm poucos recursos financeiros. Tal exigência pode inviabilizar o acesso a tratamentos essenciais e urgentes, principalmente para doenças que, devido à sua raridade, possuem poucos estudos robustos disponíveis, e tal entendimento fere a justiça aristotélica de tratar os iguais de forma igual e os desiguais de forma desigual, porque há ampla desigualdade em nosso país.
Os autores deste artigo destacam a possibilidade de o Estado adotar acordos de compartilhamento de riscos com laboratórios farmacêuticos como uma alternativa viável para minimizar o impacto financeiro de tratamentos de alto custo. Esse modelo permitiria que o SUS adquirisse medicamentos de forma mais eficiente, vinculando o pagamento ao sucesso clínico dos tratamentos, o que poderia viabilizar o acesso a novas tecnologias sem comprometer os recursos públicos.
A proposta de criação de uma plataforma nacional para o acompanhamento das demandas judiciais e administrativas também se mostra um avanço promissor, promovendo maior controle e transparência no fornecimento de medicamentos, além de facilitar a comunicação entre os entes federativos e o Judiciário.
No entanto, permanecem desafios significativos para garantir que o direito à saúde seja plenamente exercido, sem comprometer a sustentabilidade financeira do sistema público de saúde. O julgamento do Tema 1234 representa um passo importante nesse sentido, ao equilibrar a proteção dos direitos fundamentais com a necessidade de uma gestão fiscalmente responsável, mas o caminho para a implementação dessas diretrizes exigirá esforço contínuo e diálogo entre os diversos atores envolvidos no sistema de saúde brasileiro.
¹BRASIL. Supremo Tribunal Federal. STA 175 AgR. Direito constitucional e sanitário. Recorrente: UNIÃO. Recorrido MINISTÉRIO PÚBLICO FEDERAL, MUNICÍPIO DE FORTALEZA, ESTADO DO CEARÁ: Relator: Min. GILMAR MENDES (Presidente), Tribunal Pleno, julgado em 17-03-2010, DJe-076 DIVULG 29-04-2010 PUBLIC 30-04-2010 EMENT VOL-02399-01 PP-00070). Disponível em: https://portal.stf.jus.br/processos/detalhe.asp?incidente=2570693. Acesso em: 05 out. 2024.
²Art. 1º A República Federativa do Brasil, formada pela união indissolúvel dos Estados e Municípios e do Distrito Federal, constitui-se em Estado democrático de direito e tem como fundamentos: III – a dignidade da pessoa humana; Art. 5º Todos são iguais perante a lei, sem distinção de qualquer natureza, garantindo-se aos brasileiros e aos estrangeiros residentes no País a inviolabilidade do direito à vida, à liberdade, à igualdade, à segurança e à propriedade, nos termos seguintes: Art. 196. A saúde é direito de todos e dever do Estado, garantido mediante políticas sociais e econômicas que visem à redução do risco de doença e de outros agravos e ao acesso universal e igualitário às ações e serviços para sua promoção, proteção e recuperação.
³BRASIL. Tribunal de Contas da União- TCU. Acórdão Nº 1787/2017, Plenário, Relator: Ministro Bruno Dantas, DOU de 05.06.2007. Disponível em: https://pesquisa.apps.tcu.gov.br/documento/acordao-completo/*/KEY:ACORDAO-COMPLETO-2179179/NUMACORDAOINT%20asc/0. Acesso em 05 out. 2024.
⁴https://justica-em-numeros.cnj.jus.br/painel-saude/
⁵http://www.ccs.saude.gov.br/sus/antes-depois.php
⁶Sistema de saúde no Brasil: organização e financiamento / Rosa Maria Marques, Sérgio Francisco Piola, Alejandra Carrillo Roa (Organizadores). – Rio de Janeiro : ABrES ; Brasília : Ministério da Saúde, Departamento de Economia da Saúde, Investimentos e Desenvolvimento ; OPAS/OMS no Brasil, 2016. 260 p. : il.Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/sistema_saude_brasil_organizacao_financiamento.pdf. Acesso em 06 de out. 2024.
⁷Art. 19-M. A assistência terapêutica integral a que se refere a alínea d do inciso I do art. 6o consiste em: I – dispensação de medicamentos e produtos de interesse para a saúde, cuja prescrição esteja em conformidade com as diretrizes terapêuticas definidas em protocolo clínico para a doença ou o agravo à saúde a ser tratado ou, na falta do protocolo, em conformidade com o disposto no art. 19-P; Art. 19-N. Para os efeitos do disposto no art. 19-M, são adotadas as seguintes definições: II – protocolo clínico e diretriz terapêutica: documento que estabelece critérios para o diagnóstico da doença ou do agravo à saúde; o tratamento preconizado, com os medicamentos e demais produtos apropriados, quando couber; as posologias recomendadas; os mecanismos de controle clínico; e o acompanhamento e a verificação dos resultados terapêuticos, a serem seguidos pelos gestores do SUS.
8Art. 17-A . Os prazos estabelecidos para a decisão final nos processos de registro e de alteração pós-registro de medicamento levarão em conta os seguintes critérios:
§ 2º Os prazos máximos para a decisão final nos processos de registro e de alteração pós-registro de medicamento serão, respectivamente:
I – para a categoria prioritária, de cento e vinte dias e de sessenta dias, contados a partir da data do respectivo protocolo de priorização;
II – para a categoria ordinária, de trezentos e sessenta e cinco dias e de cento e oitenta dias, contados a partir da data do respectivo protocolo de registro ou de alteração pós-registro.
9Art. 19-R. A incorporação, a exclusão e a alteração a que se refere o art. 19-Q serão efetuadas mediante a instauração de processo administrativo, a ser concluído em prazo não superior a 180 (cento e oitenta) dias, contado da data em que foi protocolado o pedido, admitida a sua prorrogação por 90 (noventa) dias corridos, quando as circunstâncias exigirem.
10BRASIL. Tribunal de Contas da União- TCU. Acórdão Nº 1787/2017, Plenário, Relator: Ministro Bruno Dantas, DOU de 05.06.2007. Disponível em: https://pesquisa.apps.tcu.gov.br/documento/acordao-completo/*/KEY:ACORDAO-COMPLETO-2179179/NUMACORDAOINT%20asc/0. Acesso em 05 out. 2024.
11Art. 23. É competência comum da União, dos Estados, do Distrito Federal e dos Municípios:
Parágrafo único. Leis complementares fixarão normas para a cooperação entre a União e os Estados, o Distrito Federal e os Municípios, tendo em vista o equilíbrio do desenvolvimento e do bem-estar em âmbito nacional (CF).
12Art. 2º São Poderes da União, independentes e harmônicos entre si, o Legislativo, o Executivo e o Judiciário (CF).
13Art. 163. Lei complementar disporá sobre:
I – finanças públicas; (CF)
Art. 196. A saúde é direito de todos e dever do Estado, garantido mediante políticas sociais e econômicas que visem à redução do risco de doença e de outros agravos e ao acesso universal e igualitário às ações e serviços para sua promoção, proteção e recuperação. (CF)
14Art. 4º – Para efeitos desta Lei, são adotados os seguintes conceitos:
II – Medicamento – produto farmacêutico, tecnicamente obtido ou elaborado, com finalidade profilática, curativa, paliativa ou para fins de diagnóstico; (LEI No 5.991/1973).
15Art. 12 – Nenhum dos produtos de que trata esta Lei, inclusive os importados, poderá ser industrializado, exposto à venda ou entregue ao consumo antes de registrado no Ministério da Saúde.( Lei 6.360/1976).
16Art. 2° Para efeitos desta Resolução, são adotadas as seguintes definições: XXXI – uso off label: compreende o uso intencional em situações divergentes da bula de medicamento registrado na Anvisa, com finalidade terapêutica e sob prescrição.
Pode incluir diferenças na indicação, faixa etária/peso, dose, frequência, apresentação ou via de administração (RDC Nº 406, DE 22 DE JULHO DE 2020)
Art. 19-T. São vedados, em todas as esferas de gestão do SUS:
Parágrafo único. Excetuam-se do disposto neste artigo:
I – medicamento e produto em que a indicação de uso seja distinta daquela aprovada no registro na Anvisa, desde que seu uso tenha sido recomendado pela Comissão Nacional de Incorporação de Tecnologias no Sistema Único de Saúde (Conitec), demonstradas as evidências científicas sobre a eficácia, a acurácia, a efetividade e a segurança, e esteja padronizado em protocolo estabelecido pelo Ministério da Saúde;( LEI Nº 8.080/1990).
17Art. 19-R. A incorporação, a exclusão e a alteração a que se refere o art. 19-Q serão efetuadas mediante a instauração de processo administrativo, a ser concluído em prazo não superior a 180 (cento e oitenta) dias, contado da data em que foi protocolado o pedido, admitida a sua prorrogação por 90 (noventa) dias corridos, quando as circunstâncias exigirem. (LEI Nº 8.080, DE 19 DE SETEMBRO DE 1990.)
18Art. 130. É admissível o chamamento ao processo, requerido pelo réu:
III – dos demais devedores solidários, quando o credor exigir de um ou de alguns o pagamento da dívida comum. (CPC/2015)
19Art. 23. É competência comum da União, dos Estados, do Distrito Federal e dos Municípios:
II – cuidar da saúde e assistência pública, da proteção e garantia das pessoas portadoras de deficiência; (CF)
20Art. 9º Para liquidação do valor da prestação, deve-se observar a regulamentação da Câmara de Regulação do Mercado de Medicamentos (CMED) em relação ao Preço Máximo de Venda ao Governo (PMVG) com redução de valor mediante aplicação do Coeficiente de Adequação de Preço (CAP), nos termos da sua Resolução nº 3/2011 (arts. 2º, 3º, 4º, 6º e 7º), e suas posteriores alterações, e que vincula inclusive distribuidoras, empresas produtoras de medicamentos, representantes, postos de medicamentos, unidades volantes, farmácias e drogarias, ou, ainda, preços registrados em atas de registro de preços que observem a referida regulamentação geral (PMVG/CAP), sempre buscando, em qualquer caso, aquele que seja identificado como o menor valor.
§ 2º Não sendo possível a aferição do valor do medicamento, insumo ou serviço na forma deste artigo, caberá à parte autora apresentar até 3 (três) orçamentos, justificando fundamentadamente eventual impossibilidade.
21Art. 139. O juiz dirigirá o processo conforme as disposições deste Código, incumbindo-lhe:
IV – determinar todas as medidas indutivas, coercitivas, mandamentais ou sub-rogatórias necessárias para assegurar o cumprimento de ordem judicial, inclusive nas ações que tenham por objeto prestação pecuniária; (CPC)
22Art. 17. Para postular em juízo é necessário ter interesse e legitimidade.
Art. 485. O juiz não resolverá o mérito quando:
VI – verificar ausência de legitimidade ou de interesse processual; (CPC/15)
23O Acordo de Compartilhamento de Risco é definido como um acordo no qual o Estado concorda em oferecer acesso temporário a um novo medicamento, enquanto a indústria farmacêutica aceita receber pelo produto conforme o desempenho do medicamento em reais condições de uso. A partilha de risco depende, necessariamente, da coleta de evidências adicionais, que podem se referir aos benefícios terapêuticos ou ao volume de pacientes, conforme avaliação de seu uso na prática. (Vianna, 2020)
REFERÊNCIAS
BARROSO, L. R. Curso de direito constitucional contemporâneo: os conceitos fundamentais e a construção do novo modelo. 9. ed. São Paulo: Saraiva, 2020.
BRASIL. Conselho Nacional de Justiça. Recomendação n. 146, de 28 de novembro de 2023. Dispõe sobre estratégias para o cumprimento adequado das decisões judiciais nas demandas de saúde pública. Brasil: CNJ, 2023.
BRASIL. [Constituição (1988)]. Constituição da República Federativa do Brasil de 1988. Brasília, DF: Presidente da República, [2016]. Disponível em: http://www.planalto.gov.br/ccivil_03/constituicao/constituicao.htm. Acesso em: 11 out. 2024.
https://justica-em-numeros.cnj.jus.br/painel-saude
BRASIL. Decreto n. 7.508, de 28 de junho de 2011. Regulamenta a Lei nº 8.080, de 19 de setembro de 1990, para dispor sobre a organização do Sistema Único de Saúde – SUS, o planejamento da saúde, a assistência à saúde e a articulação interfederativa, e dá outras providências.. Brasília, DF: Presidência da República, 2011. Disponível em: https://www.planalto.gov.br/ccivil_03/_ato2011-2014/2011/decreto/d7508.htm. Acesso em: 11 out. 2024.
BRASIL. Lei n. 8.080, de 19 de setembro de 1990. Dispõe sobre as condições para a promoção, proteção e recuperação da saúde, a organização e o funcionamento dos serviços correspondentes e dá outras providências. Brasília, DF: Presidência da República, 2002. Disponível em: https://www.planalto.gov.br/ccivil_03/leis/l8080.htm. Acesso em: 11 out. 2024.
BRASIL. Supremo Tribunal Federal. Recurso Extraordinário n. 666094/DF. Processo n. 5001330-88.2019.8.24.0081. Direito constitucional e sanitário. Recurso extraordinário. Repercussão geral. Impossibilidade de atendimento pelo SUS. Ressarcimento de unidade privada de saúde. Recorrente: distrito federal. Recorrido Unimed Brasília cooperativa de trabalho médico: Relator: Min. Luís Roberto Barroso, 04 de fevereiro de 2022. Disponível em: https://portal.stf.jus.br/processos/detalhe.asp?incidente=4178086. Acesso em: 11 out. 2024.
BRASIL. Supremo Tribunal Federal. Recurso Extraordinário n. 136624/SC. Processo n. 0020743-81.2008.8.07.0001. Direito constitucional e sanitário. Recurso extraordinário. Repercussão geral. Impossibilidade de atendimento pelo SUS. Ressarcimento de unidade privada de saúde. Recorrente: ESTADO DE SANTA CATARINA. Recorrido: ROGER HENRIQUE TESTA: Relator: MIN. GILMAR MENDES, 16 de setembro de 2024. Disponível em: https://portal.stf.jus.br/processos/detalhe.asp?incidente=6335939. Acesso em: 11 out. 2024.
BRASIL. Tribunal de Contas da União- TCU. Acórdão Nº 1787/2017, Plenário, Relator: Ministro Bruno Dantas, DOU de 05.06.2007. Disponível em: https://pesquisa.apps.tcu.gov.br/documento/acordao-completo/*/KEY:ACORDAO-COMPLETO-2179179/NUMACORDAOINT%20asc/0. Acesso em 05 out. 2024.
CARVALHO, C. de D. ; & CARVALHO, F. de. D. (2020). Judicialização da saúde no Brasil: da história à contemporaneidade. Revista Brasileira de Desenvolvimento, v. 6, n. 12, p. 99759-99777. Disponível em: https://doi.org/10.34117/bjdv6n12-460. Acesso em: 11 out. 2024.
CONSELHO NACIONAL DE JUSTIÇA – CNJ. Estatísticas processuais de direito à saúde. Brasília, DF: Conselho Nacional de Justiça. s.d. Disponível em: https://justica-em-numeros.cnj.jus.br/painel-saude/. Acesso em: 11 out. 2024.
GONÇALVES, M. A. Organização e funcionamento do SUS. Florianópolis: Departamento de Ciências da Administração/UFSC, 2014. 132p.
HANAI, Jorge Leal; ABRANTES, Luis Antônio; PEREIRA, Luiz Ismael. Conflitos de Competência e a Judicialização da Saúde no Federalismo Brasileiro. Revista Brasileira de Políticas Públicas, Brasília, v. 11, n. 3. p. 446-472, 2021.
MARGAZÃO, N.C.B. A MULTA (ASTREINTES) NA TUTELA ESPECÍFICA. 2013. 260 f. Dissertação (Mestrado em Direito) – Faculdade de Direito, Universidade de São Paulo, São Paulo, 2013.
MARQUES, Aline et al. Judicialização da saúde e medicalização: uma análise das orientações do Conselho Nacional de Justiça. Instituto de Estudos Avançados da Universidade de São Paulo, v. 33, n. 95, jan.-apr. 2019. Disponível em: https://doi.org/10.1590/s0103-4014.2019.3395.0014. Acesso em: 11 out. 2024.
MARTIMBIANCO, R. et al. Saúde Baseada em Evidências – Conceitos, Métodos e Aplicação Prática. 1. ed. São Paulo: Atheneu, 2023.
MENDES, G. et al. Curso de Direito Constitucional. 17. ed. São Paulo: Saraiva Jur, 2022.
NETO, G.; SCHULZE, C. Direito à Saúde Análise à Luz da Judicialização. 1. ed. Porto Alegre: Verbo Jurídico, 2013.
RIBEIRO, J. M.; MOREIRA, M. R.. A crise do federalismo cooperativo nas políticas de saúde no Brasil. Saúde em Debate, v. 40, n. spe, p. 14–24, dez. 2016.
Sistema de saúde no Brasil: organização e financiamento / Rosa Maria Marques, Sérgio Francisco Piola, Alejandra Carrillo Roa (Organizadores). – Rio de Janeiro : ABrES ; Brasília : Ministério da Saúde, Departamento de Economia da Saúde, Investimentos e Desenvolvimento ; OPAS/OMS no Brasil, 2016. 260 p. : il.Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/sistema_saude_brasil_organizacao_financiamento.pdf. Acesso em 06 de out. 2024
ROCHA, Danilo et al. Judicialização da saúde no Brasil: do contexto histórico às perspectivas futuras. Revista de Direitos Sociais, Seguridade e Direitos Sociais, v. 6, n. 1, jan.-jun. 2020. Disponível em: http://dx.doi.org/10.26668/IndexLawJournals/2525-9865/2020.v6i1.6395. Acesso em: 11 out. 2024.
SOARES, J. C. R. DE S.; DEPRÁ, A. S.. Ligações perigosas: indústria farmacêutica, associações de pacientes e as batalhas judiciais por acesso a medicamentos. Physis: Revista de Saúde Coletiva, v. 22, n. 1, p. 311–329, 2012.
WANG, D. W. L. Constituição e política na democracia: Aproximação entre direito e ciência política. São Paulo: Marcal Pons, 2014.
Ventura, M. et al. Judicialização da saúde, acesso à justiça e a efetividade do direito à saúde. Physis. 2010;20(1):77-100. Disponível em: https://doi.org/10.1590/S0103-73312010000100006. Acesso em: 11 out. 2024.
VIANNA D, Sachetti CG, Boaventura P. Acordo de Compartilhamento de Risco: projeto-piloto no Sistema Único de Saúde. J Bras Econ Saúde 2022;14(Supl.1):101-7, p.1, 2020. Disponível em: https://docs.bvsalud.org/biblioref/2022/04/1363118/jbes-especialportugues-101-107.pdf. Acesso em: 11 de out. 2024.
VIEIRA, F. Direito à saúde no Brasil: seus contornos, judicialização e a necessidade da macrojustiça. Brasília: Livraria Ipea, 2020. P. 76. Disponível em: https://repositorio.ipea.gov.br/bitstream/11058/9714/1/TD_2547.pdf. Acesso em: 11 out. 2024.
