REGISTRO DOI:10.69849/revistaft/cl10202410171220
Aline Della Pasqua Garrido1; Ana Carolina Lusitani2; Andrea Christina Ferreira Meirelles3; Bruna Carla Veloso Carraro2; Estephany dos Santos Nascimento4; Gabrielle Giovana Pompermayer2; Lieginy da Silva Macedo2; Lucilene Orso Araújo2; Milena Eduarda Dressler de Oliveira2; Paulo Tadeu Figueira3; Rafael Rostirolla Debiage3; Rebeca Lima Fernandes Couto Carneiro5; Robson Silva Araújo Orso6; Rosiara Rosaria Dias Maziero Guaitolini3; Wictor Pinheiro da Silva5;
RESUMO
Este trabalho apresenta um relato de um caso clínico de Leishmaniose Visceral Canina (LVC), uma zoonose crônica causada pelo protozoário Leishmania infantum, em um cão fêmea, da raça Shar-Pei atendida na Clínica Veterinária da Univel, Cascavel – PR. A paciente, oriunda de uma área endêmica da doença, foi diagnosticada com LVC após apresentar sintomas como alopecia, lesões cutâneas, emagrecimento e onicogrifose. O diagnóstico foi confirmado por meio de exames sorológicos (ELISA e RIFI) e complementado por hemograma, bioquímico e ultrassonografia, que revelaram alterações sistêmicas, incluindo esplenomegalia e comprometimento hepático. A paciente foi tratada com Miltefosina, Domperidona e Alopurinol, além de medidas preventivas com coleira repelente para controle do vetor. Apesar da intervenção, a carga parasitária persistiu e a doença progrediu, culminando na necessidade de eutanásia para aliviar o sofrimento da paciente. O estudo discute a importância do diagnóstico precoce, do controle da doença e das complicações que envolvem o manejo de LVC, uma zoonose de notificação obrigatória que representa um risco à saúde pública.
Palavras-chave: Cães; Leishmaniose; Protozoário; Saúde Pública; Zoonose.
ABSTRACT
This paper presents a clinical case report of Canine Visceral Leishmaniasis (CVL), a chronic zoonosis caused by the protozoan Leishmania infantum, in a female Shar-Pei dog attended at the Veterinary Clinic of Univel, Cascavel – PR. The patient, who came from an endemic area of the disease, was diagnosed with CVL after presenting symptoms such as alopecia, skin lesions, weight loss and onychogryphosis. The diagnosis was confirmed by serological tests (ELISA and IFA) and complemented by blood count, biochemistry and ultrasound, which revealed systemic alterations, including splenomegaly and hepatic impairment. The patient was treated with Miltefosine, Domperidone and Allopurinol, in addition to preventive measures with a repellent collar to control the vector. Despite the intervention, the parasite load persisted and the disease progressed, culminating in the need for euthanasia to alleviate the patient’s suffering. The study discusses the importance of early diagnosis, disease control, and complications involving the management of CVL, a notifiable zoonosis that poses a risk to public health.
Keywords: Dogs; Leishmaniasis; Protozoan; Public health; Zoonosis.
1. INTRODUÇÃO
A Leishmaniose Visceral Canina (LVC) é uma zoonose crônica causada pelo protozoário Leishmania infantum chagasi, transmitida pela picada do mosquito-palha Lutzomyia longipalpis. Essa doença afeta animais domésticos, selvagens e seres humanos, sendo os cães os principais reservatórios (Vieira; Figueiredo, 2021). No Brasil, a LVC é uma das seis endemias mais prevalentes e uma das mais negligenciadas pelos órgãos de saúde, com impacto significativo em indivíduos imunossuprimidos (Souza et al., 2023).
Socialmente, a LVC é um problema de saúde pública preocupante, pois a doença pode ser transmitida de cães para humanos, colocando em risco a população, especialmente em áreas endêmicas. Academicamente, o estudo da LVC é relevante para ampliar o conhecimento sobre a epidemiologia, diagnóstico e tratamento dessa zoonose, contribuindo para o desenvolvimento de estratégias mais eficazes de controle e prevenção. Do ponto de vista profissional, o manejo adequado da LVC é essencial para médicos veterinários, uma vez que a doença afeta diretamente a saúde e o bem-estar dos animais (Souza et al., 2023).
Diante desse cenário, surgiu a seguinte problemática: qual é a eficácia de um protocolo terapêutico que inclui medicamentos, dieta e medidas de controle ambiental para o tratamento da leishmaniose visceral em cães, considerando a redução da carga parasitária, melhoria dos sinais clínicos e qualidade de vida dos animais afetados na região oeste do Paraná?
Assim, o objetivo geral deste trabalho foi descrever um relato de caso de um cão acometido pela Leishmaniose visceral no oeste do Paraná. Além disso, buscou-se avaliar a eficácia de um protocolo terapêutico para o tratamento da leishmaniose visceral em cães, considerando a redução da carga parasitária, melhoria dos sinais clínicos e qualidade de vida dos animais. Os objetivos específicos foram: descrever levantamento histórico sobre o surgimento e a proliferação da leishmaniose; apontar aspectos gerais relacionados a doenças; abordar formas de transmissão, sintomas, tratamentos e prevenção; e descrever o método de tratamento que foi realizado.
Para alcançar esses objetivos, foi utilizada a metodologia de relato de caso, que permitiu uma análise detalhada da evolução clínica e resposta ao tratamento de um animal acometido pela LVC na região oeste do Paraná. Além disso, foi realizada uma revisão de literatura para o arcabouço teórico sobre a doença relacionada ao caso investigado.
2. REVISÃO DE LITERATURA
2.1 Leishmanioses
A Leishmaniose Visceral Canina é uma zoonose crônica que pode afetar tanto animais domésticos e selvagens quanto humanos, os cães domésticos são os principais reservatórios dessa doença, o que a torna um sério problema de saúde pública (Freitas et al., 2022). No Brasil, é uma das seis endemias mais prevalentes e uma das mais negligenciadas pelos órgãos de saúde, sendo frequentemente associada a áreas rurais e cujo impacto em indivíduos imunossuprimidos é significativo, incluindo aqueles com HIV (do inglês: Human Immunodeficiency Virus), desnutrição ou outros problemas de imunossupressão (Souza et al., 2023).
A doença pode ser classificada em três formas: Leishmaniose Tegumentar (LT), Leishmaniose Muco-cutânea (LM) e Leishmaniose Visceral (LV). A LT causa lesões na pele, especialmente no rosto, e pode evoluir para LM, comprometendo o septo nasal (Ecco et al., 2000). A LV afeta principalmente órgãos internos como o baço, fígado e linfonodos, além de causar lesões na pele e alopecia (Souza et al., 2023).
A LVC é uma forma específica de LV que acomete cães e é uma doença parasitária zoonótica. O agente causador é o protozoário Leishmania infantum chagasi, transmitido pela fêmea do mosquito flebotomíneo Lutzomyia longipalpis, conhecido como mosquito-palha (Freitas et al., 2022).
Originalmente uma doença esporádica de áreas silvestres, a LVC se tornou uma doença de caráter reemergente, reconhecida como uma doença tropical negligenciada pela Organização das Nações Unidas (ONU), a LVC está atualmente distribuída mundialmente, incluindo Ásia, Europa, Oriente Médio, África e Américas. Na América Latina, 90% dos casos ocorrem no Brasil (Mergen; Souza, 2023).
2.2 Vetores
A Leishmaniose Visceral Canina é causada pelo protozoário do gênero Leishmania spp., sendo a Leishmania infantum (Chagasi) a mais relevante em cães. Além dos cães, os gatos e diversos animais silvestres, como o cachorro-do-mato (Cerdocyon thous), tatus, raposas-do-campo (Dusicyon vetulus) e primatas, podem atuar como reservatórios. Os protozoários tripanosomatídeos da LVC são parasitas intracelulares obrigatórios de células do sistema fagocítico monocelular. No Brasil, além da Leishmania infantum, também são encontradas outras espécies como Leishmania braziliensis e L. amazonensis (Costa et al., 2020).
A transmissão da doença ocorre por meio de flebotomíneos infectados, principalmente o Lutzomyia longipalpis, popularmente conhecido como mosquito-palha. Outros mosquitos também podem transmitir a leishmaniose em áreas rurais e urbanas do Brasil, incluindo Bichromomyia flaviscutellata, Migonemyia migonei, Nyssomyia spp., Pintomyia fischeri e pessoai, Psychodopygus wellcomei e ayrozai, e Trichophoromyia ubiquitalis (Vieira; Figueiredo, 2021).
Os mosquitos machos da espécie L. longipalpis se alimentam exclusivamente de seivas de plantas para sobreviver e se reproduzir. As fêmeas, por sua vez, necessitam de sangue para completar seu ciclo reprodutivo, transmitindo o protozoário através da picada. Este mosquito-palha é um inseto pequeno, medindo de 1 a 3 mm de comprimento, com coloração clara e hábitos noturnos, sendo mais ativo no início da madrugada. Ele pode voar até 400 metros e tem um ciclo de vida de 30 a 45 dias, preferindo ambientes úmidos e ricos em matéria orgânica, como locais com acúmulo de lixo (Freitas et al., 2022).
2.3 Ciclo epidemiológico
A transmissão da Leishmania pelo mosquito Lutzomyia longipalpis ocorre exclusivamente por meio das fêmeas. O ciclo de vida (Figura 1) desse inseto passa por quatro fases: embrionária (7 a 10 dias), larvária (15 a 60 dias), pupa (7 a 14 dias) e adulta, que dura aproximadamente 20 dias. Pode levar até um ano para que os sinais da doença se manifestem. Os flebotomíneos apresentam dois estágios morfológicos: amastigota e promastigota. A forma amastigota é intracelular e se encontra dentro de células como os macrófagos nos vertebrados. A forma promastigota é extracelular e está presente no tubo digestivo e na saliva do mosquito (Fonseca Júnior et al., 2020).
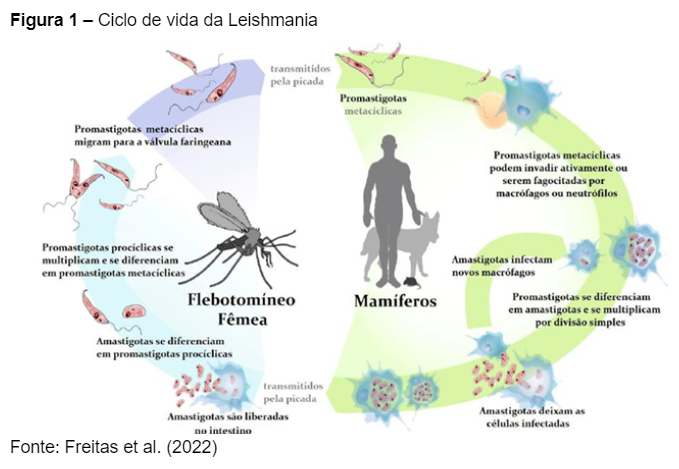
Como explicam Mergen e Souza (2023), quando a fêmea do mosquito começa a se alimentar de sangue, o desenvolvimento dos óvulos é iniciado. Durante essa alimentação, a fêmea ingere os protozoários da Leishmania na forma amastigota, que, após algumas horas, se transformam em promastigotas. Esse processo ocorre no tubo digestivo do mosquito. As promastigotas são liberadas e transmitidas para o hospedeiro durante a picada.
Para se alimentar, a fêmea do mosquito-palha utiliza seu aparelho bucal para rasgar o tecido e vasos sanguíneos do hospedeiro, realizando a telmatofagia, ou seja, a alimentação de sangue. O ciclo epidemiológico da LVC envolve a interação das células do sistema imunológico cutâneo com a resposta imune do animal afetado, essencial para combater o parasita (Freitas et al., 2022).
A resposta imune do hospedeiro à LVC depende da capacidade do sistema imunológico de combater o parasita. A resposta imune é mediada principalmente por células T helper, divididas em Th1 e Th2. As células Th1 aumentam a secreção de IFN-ɣ (Interferon gama), uma citocina antiviral que ativa os macrófagos para produzir óxido nítrico, ajudando a controlar a disseminação da Leishmania (Fonseca Júnior et al., 2020).
Cães assintomáticos geralmente têm altos níveis de IFN-ɣ, baixa sorologia, alta imunidade celular e baixa carga parasitária, permanecendo clinicamente saudáveis, embora ainda infectados. Em contraste, a resposta Th2 está associada a uma maior suscetibilidade à infecção e maior replicação parasitária. Animais com uma resposta Th2 são sintomáticos, apresentando alta sorologia, baixa imunidade celular e alta carga parasitária, caracterizando um quadro clínico doente (Fonseca Júnior et al., 2020; Freitas et al., 2022).
2.4 Outras formas de transmissão
Algumas pesquisas sugerem que a transmissão da Leishmania pode ocorrer além da clássica picada do mosquito. Na transmissão vertical, o parasita pode afetar o sistema reprodutivo, sendo encontrado em lesões inflamatórias nos órgãos genitais de cães, tanto sintomáticos quanto assintomáticos. Nas fêmeas, o protozoário pode estar presente no útero, ovário, tubas uterinas, vulva e vagina, causando dermatite vulvar e inflamações locais (Sereno et al., 2020).
Segundo Freitas et al. (2022), a possibilidade de transmissão da mãe para o filhote via placentária foi confirmada pela primeira vez no Brasil em 2009, através de testes de PCR (do inglês: Polymerase Chain Reaction) e imunohistoquímica em amostras do baço e fígado de dois filhotes natimortos de uma cadela com LVC, além da placenta também testar positivo para a doença.
A transmissão da Leishmaniose da mãe para o filhote ocorre por volta do 23º dia de gestação. Caso ocorra o parto, ele tende a ser prematuro, com filhotes menores que o esperado para a idade gestacional e possivelmente com malformações nos membros. Nos machos, o protozoário também foi identificado em amostras de sêmen e esmegma, indicando a possibilidade de transmissão sexual da doença entre os cães. Além disso, a transmissão venérea pode ocorrer através da glândula mamária (Souza et al., 2023).
Em adição, conforme Sereno et al. (2020), a transfusão sanguínea é outra forma de transmissão da LVC, pois cães assintomáticos doadores podem transmitir a L. infantum durante a doação de sangue. Devido ao longo período de incubação do protozoário, o risco de transmissão por animais suspeitos é elevado. Finalmente, há a possibilidade de transmissão mecânica através do carrapato Rhipicephalus sanguineus. Embora haja relatos de detecção de Ácido Desoxirribonucleico (DNA – do inglês: Deoxyribonucleic Acid) da Leishmania em carrapatos, mais estudos são necessários para confirmar seu papel na transmissão da doença.
2.5 Situação epidemiológica no Paraná
No estado do Paraná, o primeiro caso de Leishmaniose Visceral Canina foi registrado em 2013, na cidade de Foz do Iguaçu. Até março de 2014, o Paraná ainda era considerado uma região com baixa incidência de leishmaniose (Ferreira, 2024). Os dados do Ministério da Saúde referentes à doença são baseados apenas em notificações de casos humanos, com 1.936 casos reportados em 2021 e apenas 2 casos em 2022 (Brasil, 2022). A maior incidência de leishmaniose tem sido observada em cidades que fazem fronteira com Uruguai, Paraguai e Argentina. Um levantamento geográfico realizado em 2021 indicou que Foz do Iguaçu continua sendo a cidade com o maior número de casos tanto em animais quanto em humanos no Paraná (Braatz, 2023).
No entanto, o Paraná enfrenta problemas com a notificação de casos de LVC, incluindo a ausência de um sistema eficaz para registrar dados de animais infectados e a tendência de tratar a LVC apenas como doenças de pele. Na região de Cascavel, essa situação é particularmente preocupante, pois a cidade está localizada em um corredor epidemiológico de cidades endêmicas para a LVC, sugerindo que muitos casos podem estar sendo subnotificados (Braatz, 2023; Ferreira, 2024).
2.6 Sinais Clínicos
A Leishmaniose Visceral Canina é uma doença sistêmica de progressão lenta e insidiosa, cuja gravidade das manifestações clínicas depende da resposta imunológica do animal infectado. Comumente, os animais afetados apresentam sinais como aumento dos linfonodos, diminuição do apetite, crescimento anormal das unhas, perda de peso progressiva, lesões ulceradas no nariz, atrofia muscular, descamação e eczemas especialmente nas áreas do nariz, orelhas e cauda, pelo opaco e hiperqueratose (Sereno et al., 2020).
Outros sintomas que podem ser observados incluem aumento do baço, ceratoconjuntivite, coriza, diarreia, hemorragia intestinal, inchaço dos membros, vômito, coagulopatias, icterícia e anemia. Os sintomas variam conforme o estágio da doença em que o animal se encontra. O tratamento é ajustado de acordo com o estágio da LVC, sendo importante notar que mesmo os animais assintomáticos podem transmitir a doença (Vieira; Figueiredo, 2021).
2.7 Diagnóstico
O diagnóstico da Leishmaniose Visceral Canina é baseado nos sinais clínicos apresentados pelo animal, complementado por exames específicos. Um dos testes comuns é o ELISA (do inglês: Enzyme Linked Immuno Sorbent Assay), amplamente utilizado na medicina veterinária para diagnosticar várias doenças. Neste exame, a amostra do animal infectado é diluída em uma solução salina tamponada de fosfato contendo antígeno solúvel de Leishmania longipalps, sendo frequentemente usado como triagem pela Vigilância Sanitária (Bento et al., 2023).
Outro teste importante é a Reação de Imunofluorescência Indireta (RIFI), também conhecido como teste de anticorpos fluorescentes indiretos (IFA – do inglês: Indirect Fluorescent Antibodies), que é um exame sorológico quantitativo para confirmar a infecção por Leishmania spp. Nele, a amostra do animal é diluída em uma solução salina tamponada e aplicada em lâminas com antígenos de Leishmania major. O efeito da fluoresceína presente no teste indica um resultado positivo, servindo como método confirmatório após a triagem pelo ELISA (Souza et al., 2023).
O PCR é uma técnica altamente sensível e específica para detectar o DNA do parasita em amostras de sangue e tecidos, embora seja caro. Este método é utilizado não apenas para diagnóstico, mas também para monitoramento e estadiamento da doença. A coleta de medula óssea é um procedimento menos invasivo que a biópsia e proporciona resultados precisos; linfonodos também podem ser aspirados, embora a eficácia varie devido à quantidade de amostra. A citologia aspirativa de linfonodos, onde se observa a presença das amastigotas do parasita em lâminas, é uma opção complementar usada principalmente em casos de sorologia duvidosa (Freitas et al., 2022).
Além desses métodos, biópsias de tecidos como baço, fígado e pele podem auxiliar no diagnóstico, especialmente quando os resultados do PCR são inconclusivos. A coleta desses materiais pode ser feita por laparoscopia ou biópsia aspirativa com agulha fina. A coleta de líquido cefalorraquidiano (LCR) também é usada para detectar anticorpos contra o parasita, sendo um procedimento rápido que fornece resultados em pouco tempo. Outros exames complementares, como hemograma, bioquímica sérica, análise de urina e ultrassonografia, são frequentemente solicitados para avaliar a condição clínica geral do animal e ajudar na triagem para o tratamento (Mergen; Souza, 2023).
2.8 Estadiamento
A classificação da Leishmaniose Visceral Canina de acordo com suas manifestações clínicas e exames complementares é essencial para determinar o tratamento adequado. No Brasil, o protocolo de estadiamento mais comum divide a doença em cinco estágios. No Estádio I, o animal não apresenta sintomas aparentes. No Estádio II, a doença é leve ou ausente. O Estádio III caracteriza-se por uma doença moderada. No Estádio IV, a condição é grave, e no Estádio V, a doença é muito grave. Essa classificação ajuda a adaptar o tratamento conforme a gravidade da infecção, fornecendo os medicamentos apropriados para o nível de parasitismo e auxiliando no prognóstico do paciente (Vieira; Figueiredo, 2021).
A importância do estadiamento vai além do tratamento e prognóstico, sendo importante também para o acompanhamento contínuo do estado de saúde do animal. Nos casos mais graves, como no Estádio V, é comum que o animal desenvolva Insuficiência Renal Aguda (IRA) ou Doença Renal Crônica (DRC), frequentemente levando ao óbito. Nesses casos, a aplicação dos protocolos do International Renal Interest Society (IRIS) no tratamento de complicações renais é fundamental para melhorar a qualidade de vida do animal (Souza et al., 2023).
2.9 Tratamento
Atualmente, não há cura para a leishmaniose em cães, mas há opções de tratamento visando reduzir a carga parasitária e aliviar os sintomas clínicos. O plano terapêutico é ajustado de acordo com o estágio da doença, considerando os sinais clínicos e os resultados dos exames. É importante destacar que o tratamento não elimina a doença no animal, apenas controla, especialmente por ser uma zoonose que requer cuidados adicionais (Sereno et al., 2020).
Anteriormente, até 2016, cães positivos para leishmaniose visceral canina eram submetidos à eutanásia conforme o Decreto-Lei nº 51.838/1963 (Brasil, 1963), devido à sua capacidade de servir como reservatórios mesmo com baixa carga parasitária, mas essa prática mudou. Hoje, o Milteforan® é o medicamento regulamentado pelo Ministério da Agricultura e Pecuária e pelo Ministério da Saúde, utilizando a Miltefosina como princípio ativo (Fonseca Júnior et al., 2020).
Essa substância, uma alquifosfocolina, interfere no metabolismo de ácidos graxos e esteróis das amastigotas, levando à sua morte por apoptose. O tratamento consiste na administração de 2mg/kg/dia por via oral, durante 28 dias consecutivos, com possível ocorrência de efeitos colaterais como êmese e diarreia (Fonseca Júnior et al., 2020).
Além do Milteforan®, o Alopurinol, um análogo da hipoxantina, é amplamente usado para reduzir os sinais clínicos e os níveis de anticorpos. Sua administração é de 10-15mg/kg duas vezes ao dia, via oral, podendo ser utilizado por tempo indeterminado. A Domperidona, por sua vez, atua como imunomodulador, aumentando as citocinas do tipo Th1 para combater o parasita. Seu uso é de 1mg/kg duas vezes ao dia por 30 dias. A Marbofloxacina, uma fluoroquinolona, também é empregada no tratamento devido à sua atividade leishmanicida e capacidade de estimular TNF-α e óxido nítrico (Vieira; Figueiredo, 2021).
Adicionalmente, o Artesunato, derivado da artemisinina, tem mostrado potencial no tratamento, embora haja necessidade de mais estudos para avaliar sua eficácia. A vacina Leish-Tec® no Brasil, apesar de comercializada, teve sua efetividade contestada e, recentemente, foi suspensa pela Ceva Saúde Animal devido a problemas de conformidade em lotes específicos. Para o controle da transmissão, coleiras repelentes à base de permetrina ou deltametrina são recomendadas, pois além de repelir, têm efeito letal sobre o mosquito transmissor, com troca indicada a cada quatro meses (Freitas et al., 2022).
2.10 Políticas Públicas
Zoonoses são uma preocupação global devido à sua capacidade de desencadear surtos locais ou pandemias em larga escala. No Brasil, a leishmaniose é uma das doenças que recebe menos atenção da Organização Mundial da Saúde. Iniciativas legislativas como o Decreto Federal nº 51.838, de 1963 (Brasil, 1963), estabelecem a obrigatoriedade de exames em cães para monitorar e controlar essa zoonose. A legislação estadual, como a Lei nº 13.331/2001 do Paraná (Paraná, 2001), também reforça a organização e fiscalização das ações de saúde em todo o território.
A leishmaniose visceral canina é compulsoriamente notificada em áreas endêmicas conforme a Portaria nº 204/2016 do Ministério da Saúde (Brasil, 2016), integrada ao Sistema Único de Saúde (SUS) pelo Decreto nº 5.711/2002 (Paraná, 2002). Essas normativas exigem a notificação imediata de casos suspeitos ou confirmados às autoridades sanitárias. Além disso, permitem que agentes de vigilância sanitária realizem inspeções domiciliares para monitorar e, se necessário, aplicar medidas como exames, tratamento, captura ou eutanásia de animais.
Embora a eutanásia seja amplamente utilizada como método de controle, há debates e propostas para revisões legislativas que permitam aos tutores optarem por tratamentos alternativos. Em estados como o Paraná, iniciativas como a Nota Técnica nº 9/2020 detalham diretrizes específicas para vigilância e controle da leishmaniose visceral canina (Paraná, 2020). Ainda assim, especialistas apontam que medidas focadas no controle do vetor, como mosquitos, poderiam ser mais eficazes para reduzir a incidência da doença, destacando a necessidade de abordagens integradas e eficazes.
3. MATERIAIS E MÉTODOS
Este trabalho constitui-se em um relato de caso clínico, que é uma metodologia qualitativa utilizada para descrever de forma detalhada a evolução de um paciente individual ou grupo de pacientes com condições específicas. Segundo Gil (2022), o relato de caso é uma importante ferramenta de pesquisa, pois permite a análise aprofundada de situações clínicas reais, contribuindo para a prática veterinária ao proporcionar informações sobre diagnósticos, tratamentos e resultados terapêuticos.
No contexto deste estudo, o relato foi realizado na Clínica Veterinária do Centro Universitário Univel, em Cascavel, Paraná, no ano de 2023. As informações foram coletadas diretamente do prontuário médico da paciente canina, complementadas pelo acompanhamento contínuo durante as consultas e procedimentos clínicos ao longo do ano. Essa metodologia é fundamental, pois possibilita a documentação de condições raras ou complexas, fornecendo subsídios para o desenvolvimento de protocolos mais eficazes e embasados cientificamente.
Para a obtenção de dados relevantes, foram utilizados exames complementares que auxiliaram no diagnóstico clínico e permitiram a formulação de um plano terapêutico adequado à condição do animal. Esses exames incluíram análises laboratoriais específicas e exames de imagem, conforme necessidade, para confirmar a presença do protozoário causador da enfermidade.
A revisão bibliográfica realizada neste estudo teve como objetivo ampliar a fundamentação científica e garantir a atualização sobre o tema abordado. Segundo Barbosa (2023), a revisão bibliográfica é uma etapa essencial em qualquer pesquisa, pois possibilita a análise crítica e sistemática de conteúdos previamente publicados, fornecendo um embasamento sólido para o desenvolvimento de novas investigações. Neste trabalho, foram consultadas bases de dados de reconhecida relevância, como PubMed, PubVet, SciELO e Google Acadêmico, priorizando publicações dos últimos cinco anos. As palavras-chave utilizadas incluíram “enfermidades protozoárias em cães”, “diagnóstico de protozooses caninas” e “tratamento de protozooses veterinárias”. Dessa forma, a revisão bibliográfica permitiu identificar estudos recentes e relevantes que contribuíram para a compreensão do diagnóstico e tratamento da protozoose canina relatada, embasando as decisões clínicas e terapêuticas aplicadas no caso.
Dessa forma, a combinação entre a análise de caso clínico e a pesquisa em fontes científicas atualizadas proporcionou uma abordagem robusta, permitindo uma interpretação precisa das manifestações clínicas observadas no animal e facilitando a escolha do melhor tratamento para o quadro diagnosticado.
4. RELATO DE CASO
Em setembro de 2023, foi atendida na Clínica Veterinária do Centro Universitário de Cascavel – Univel (CLIVET) uma cadela da raça Shar-Pei, de coloração caramelo, 2 anos e 5 meses, não castrada, pesando 14,350 kg. A tutora relatou que a paciente, oriunda de Foz do Iguaçu – PR, uma área endêmica para Leishmaniose Visceral Canina (LVC), apresentava sinais clínicos há aproximadamente três meses. Os sintomas incluíam alopecia acentuada na face e membros, secreção ocular, lesões oculares, emagrecimento, além de onicogrifose e lesões interdigitais nas patas.
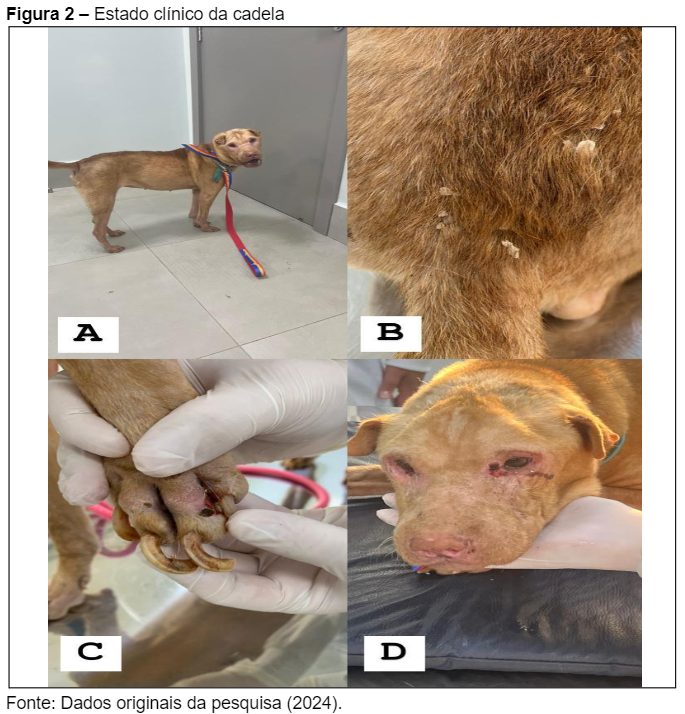
Esses sinais são compatíveis com os descritos por Souza et al. (2023), que ressaltam alopecia, emagrecimento e lesões cutâneas como manifestações clínicas comuns em cães infectados por Leishmania infantum, especialmente em áreas endêmicas. A Figura 2 ilustra o estado clínico da cadela, com emagrecimento evidente (Figura 2A), pelagem opaca e escamosa com lesões (Figura 2B), e onicogrifose associada a lesões interdigitais (Figura 2C). A presença de lesões crostosas e inflamação ao redor dos olhos (Figura 2D) reforça as descrições de Vieira e Figueiredo (2021), que destacam a gravidade das lesões oculares em estágios avançados da LVC.
Durante o exame físico, foi confirmado o estado clínico relatado pela tutora, e foram realizados exames complementares. Como parte do protocolo, foi coletada uma amostra de sangue para análise, incluindo hemograma completo, bioquímica renal e hepática, além de ultrassonografia abdominal. O teste rápido para leishmaniose foi realizado, com resultado positivo, confirmando a suspeita inicial da doença.
Conforme indicado por Freitas et al. (2022), o teste rápido é uma ferramenta eficaz para a triagem da LVC em áreas de alta prevalência. Além disso, exames sorológicos utilizando ELISA e Reação de Imunofluorescência Indireta (RIFI) foram solicitados para confirmação definitiva, seguindo as recomendações de Fonseca Júnior et al. (2020), que enfatizam a importância desses testes laboratoriais para o diagnóstico preciso da leishmaniose.
A integração entre os achados clínicos e os resultados laboratoriais permite identificar claramente o quadro de Leishmaniose Visceral Canina, e a literatura atual destaca a importância do diagnóstico precoce e do manejo adequado da doença para melhorar a qualidade de vida dos animais afetados (Mergen; Souza, 2023). As lesões observadas na paciente, como demonstrado nas figuras, são indicativas da progressão da LVC, e as características descritas encontram respaldo nos estudos que apontam para uma correlação direta entre a gravidade dos sinais clínicos e o estágio avançado da doença em cães infectados.
Após a suspeita clínica de Leishmaniose Visceral Canina (LVC), o tratamento inicial foi estabelecido enquanto se aguardava a confirmação diagnóstica definitiva pelo teste ELISA. A paciente foi submetida a um tratamento domiciliar com o uso de um shampoo manipulado, contendo miconazol 2%, clorexidina 2,5%, extrato glicólico de própolis 5%, óleo de prímula 3%, extrato glicólico de aveia 3% e base hipoalergênica q.s.p. em um frasco de 250 ml (Figura 3B). Este shampoo foi indicado para controlar as lesões cutâneas, a alopecia e aliviar o desconforto causado pelas inflamações da pele. Conforme Souza et al. (2023), o uso de substâncias antifúngicas e anti-histamínicas, como miconazol e clorexidina, é recomendado para controlar as lesões de pele secundárias a infecções ou irritações causadas pela LVC.

Além do shampoo, foi prescrito à tutora o uso da coleira repelente Scalibor®, à base de deltametrina (Figura 2C), com o objetivo de prevenir novas picadas de flebotomíneos, transmissores da LVC, conforme descrito por Freitas et al. (2022), que ressaltam a importância do uso de coleiras repelentes como medida profilática em áreas endêmicas. A aplicação imediata da coleira (Figura 3D) visava reduzir o risco de novas infecções ou agravamento da condição da cadela.
Ainda, para tratar a infestação por ectoparasitas, foi administrado um medicamento oral à base de Simparic®, visando combater as pulgas presentes na paciente, conforme descrito por Vieira e Figueiredo (2021), que destacam a importância do controle parasitário em cães infectados por LVC para evitar complicações secundárias.
As imagens a seguir ilustram os componentes deste tratamento inicial. A Figura 3A mostra o teste rápido positivo para LVC, enquanto a Figura 3B exibe o shampoo manipulado prescrito para o tratamento cutâneo. A Figura 3C demonstra a embalagem da coleira Scalibor®, e a Figura 3D mostra a cadela já utilizando a coleira repelente.
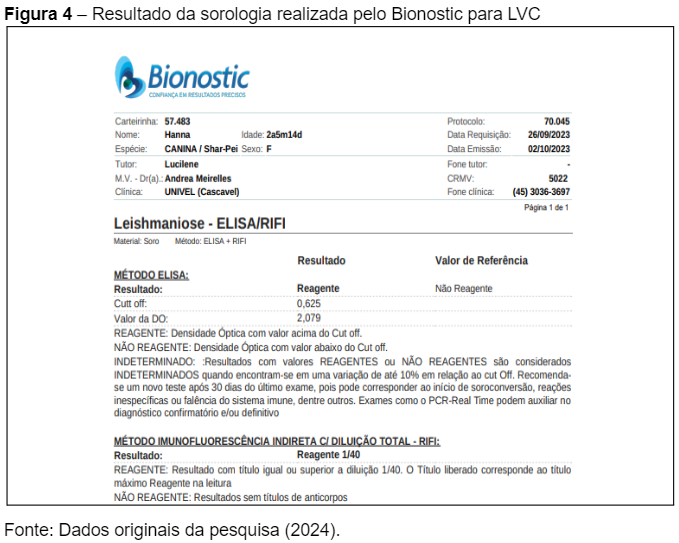
Após a primeira consulta, a paciente e sua tutora retornaram à clínica para receber os resultados laboratoriais. O exame sorológico realizado pelo método ELISA confirmou a presença de Leishmaniose Visceral Canina (LVC), com um valor de densidade óptica (DO) de 2,079, acima do Cut-off de 0,625, indicando um resultado reagente (Figura 4). Esse resultado foi corroborado pelo exame de Reação de Imunofluorescência Indireta (RIFI), que também apresentou título reagente na diluição de 1/40, confirmando o diagnóstico de LVC. Esses testes, como descrito por Fonseca Júnior et al. (2020), são considerados de alta sensibilidade e especificidade para a detecção de Leishmania infantum, validando o diagnóstico inicial obtido através do teste rápido.
Durante o retorno, foi observado que a paciente apresentava melhora significativa no aspecto do pelo e ausência de ectoparasitas, o que indica uma resposta positiva ao tratamento profilático inicial, incluindo o uso do shampoo manipulado e da coleira Scalibor®. Esses tratamentos são recomendados conforme a literatura (Freitas et al., 2022) para controle de infecções secundárias e prevenção da transmissão da LVC.
Foi então realizada uma explicação detalhada à tutora sobre o procedimento usual em casos de LVC, incluindo a recomendação de eutanásia para cães positivos, conforme orientações de políticas públicas de controle de zoonoses, devido à capacidade dos animais infectados de se tornarem reservatórios do parasita. No entanto, a tutora optou por recusar a eutanásia, sendo devidamente orientada quanto aos termos de recusa e sobre sua responsabilidade legal em relação ao tratamento do animal, além de ser informada sobre a necessidade de notificação obrigatória da doença às autoridades sanitárias, visto que a LVC é uma zoonose.
Após a primeira consulta, a paciente e sua tutora retornaram à clínica para receber os resultados laboratoriais. O exame sorológico realizado pelo método ELISA confirmou a presença de Leishmaniose Visceral Canina (LVC), com um valor de densidade óptica (DO) de 2,079, acima do Cut-off de 0,625, indicando um resultado reagente (Figura 4). Esse resultado foi corroborado pelo exame de Reação de Imunofluorescência Indireta (RIFI), que também apresentou título reagente na diluição de 1/40, confirmando o diagnóstico de LVC. Esses testes, como descrito por Fonseca Júnior et al. (2020), são considerados de alta sensibilidade e especificidade para a detecção de Leishmania infantum, validando o diagnóstico inicial obtido através do teste rápido.
Durante o retorno, foi observado que a paciente apresentava melhora significativa no aspecto do pelo e ausência de ectoparasitas, o que indica uma resposta positiva ao tratamento profilático inicial, incluindo o uso do shampoo manipulado e da coleira Scalibor®. Esses tratamentos são recomendados conforme a literatura (Freitas et al., 2022) para controle de infecções secundárias e prevenção da transmissão da LVC.
Foi então realizada uma explicação detalhada à tutora sobre o procedimento usual em casos de LVC, incluindo a recomendação de eutanásia para cães positivos, conforme orientações de políticas públicas de controle de zoonoses, devido à capacidade dos animais infectados de se tornarem reservatórios do parasita. No entanto, a tutora optou por recusar a eutanásia, sendo devidamente orientada quanto aos termos de recusa e sobre sua responsabilidade legal em relação ao tratamento do animal, além de ser informada sobre a necessidade de notificação obrigatória da doença às autoridades sanitárias, visto que a LVC é uma zoonose.
Dessa forma, o próximo passo foi aguardar os exames laboratoriais adicionais solicitados na primeira consulta, que servirão de base para o planejamento de um tratamento mais específico para a paciente, conforme descrito por Vieira e Figueiredo (2021), que destacam a importância de adequar o tratamento à gravidade da infecção e à resposta imunológica do animal.
Os resultados do hemograma da paciente, realizados no dia 27/09/2023, fornecem mais informações sobre o estado geral de saúde da cadela e ajudam a confirmar a gravidade da infecção por Leishmaniose Visceral Canina (LVC). O hemograma (Figura 5) revela uma leve anemia, com valores de hemoglobina de 10,2 g/dL e hematócrito de 30%, além de anisocitose e policromasia moderadas, indicando uma resposta regenerativa, possivelmente associada à cronicidade da infecção.
Esses achados hematológicos corroboram o diagnóstico de LVC, reforçando a necessidade de manejo imediato da doença. A anemia leve a moderada é um achado comum em cães infectados, conforme relatado por Freitas et al. (2022), que associam a destruição dos eritrócitos e a resposta inflamatória ao parasitismo intramacrofágico. Além disso, a linfocitose observada pode indicar uma resposta imunológica ativa.
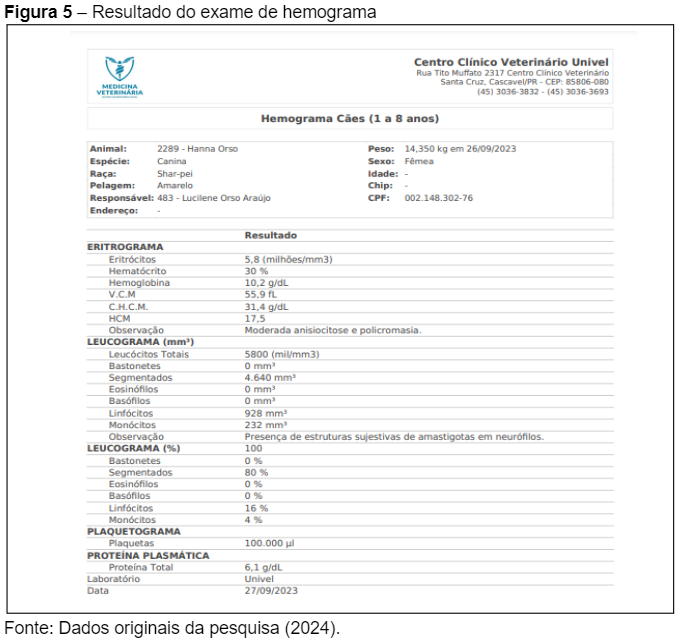
O leucograma revelou um total de leucócitos de 5.800/mm³, com uma predominância de neutrófilos segmentados (4.640/mm³) e um número significativo de linfócitos (928/mm³), sem a presença de eosinófilos ou basófilos. Uma observação importante foi a presença de estruturas sugestivas de amastigotas dentro dos neutrófilos, o que é um achado característico de infecções por Leishmania infantum, conforme descrito por Fonseca Júnior et al. (2020), que destacam a importância do exame microscópico em identificar a presença do parasita em células do sistema imunológico.
A contagem de plaquetas da paciente foi de 100.000/µL, um valor dentro dos limites normais, o que sugere que, apesar da infecção sistêmica, não há indícios de trombocitopenia significativa, um achado que pode ocorrer em infecções graves, segundo Vieira e Figueiredo (2021).
Com base nesses resultados e no quadro clínico da paciente, foi reforçada a importância de manter o acompanhamento e o tratamento contínuo, além de informar a tutora sobre o impacto da doença e a necessidade de monitoramento rigoroso da função hematológica e imunológica ao longo do tratamento.
O exame bioquímico da paciente, realizado em 10/10/2023, revelou parâmetros essenciais para a avaliação da função renal e hepática, além de outros marcadores bioquímicos importantes para o acompanhamento do quadro de Leishmaniose Visceral Canina (LVC). A análise dos resultados (Figura 6) indica níveis normais de ureia (34,64 mg/dL) e creatinina (0,74 mg/dL), o que sugere que, até o momento, não há comprometimento renal significativo. A função renal preservada é um sinal positivo, considerando que em casos avançados de LVC, a insuficiência renal é uma complicação comum, conforme descrito por Fonseca Júnior et al. (2020).
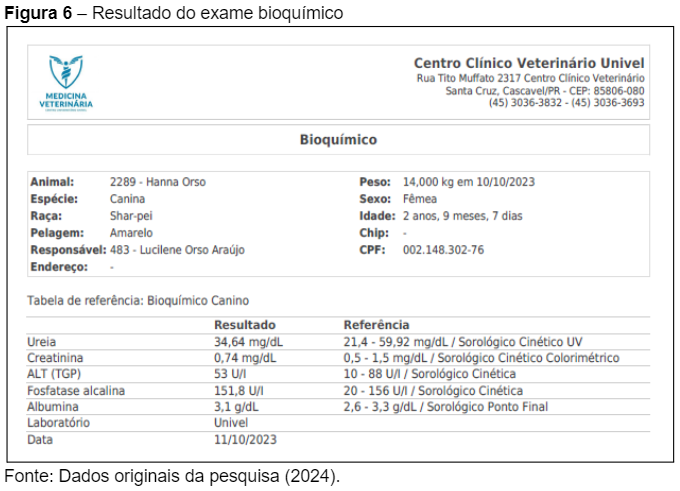
Os níveis de ALT (TGP) de 53 U/l e fosfatase alcalina de 151,8 U/l estão dentro dos valores de referência, indicando que não há sinais evidentes de comprometimento hepático severo, embora seja necessário o monitoramento contínuo, visto que a LVC pode evoluir com envolvimento hepático em estágios mais avançados, como relatado por Vieira e Figueiredo (2021).
O nível de albumina da paciente, 3,1 g/dL, também está dentro da faixa de normalidade (2,6 – 3,3 g/dL), o que indica que, apesar da infecção crônica, o estado nutricional e a função hepática ainda estão preservados, de acordo com os parâmetros esperados para cães nessa condição.
Esses resultados bioquímicos reforçam a importância do monitoramento constante da paciente para detectar possíveis complicações associadas à LVC, como alterações renais e hepáticas, que são frequentes em estágios mais avançados da doença, conforme apontado por Souza et al. (2023). A ausência de disfunções graves até o momento é um indicativo positivo para o manejo clínico, especialmente considerando o quadro geral de melhora clínica relatado pela tutora.
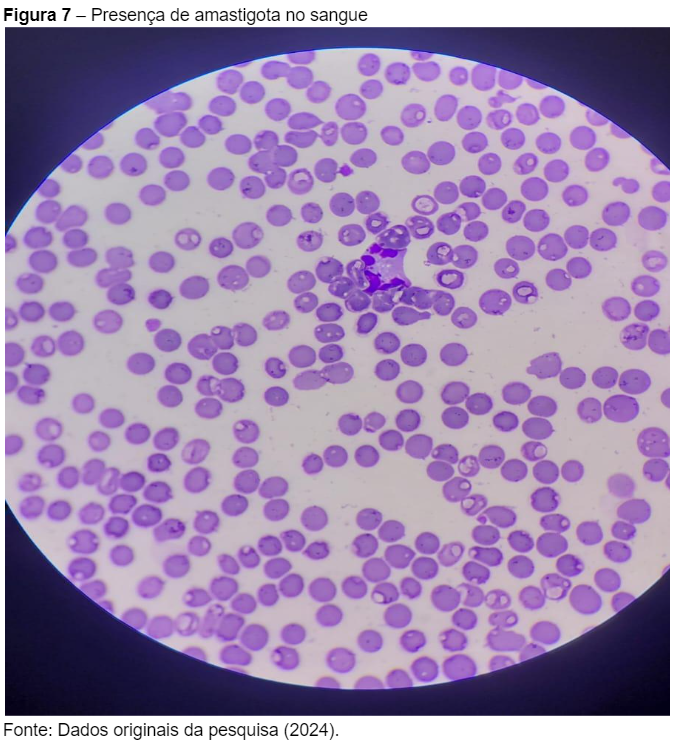
Durante a análise microscópica do sangue da paciente, foi observada a presença de amastigotas intracelulares, que foram visualizadas em amostras de neutrófilos (Figura 7). Essa observação é um achado característico e confirmatório de Leishmaniose Visceral Canina (LVC), reforçando ainda mais o diagnóstico previamente estabelecido com os exames sorológicos e hematológicos.
As amastigotas, formas intracelulares do protozoário Leishmania infantum, estão comumente presentes no interior de células do sistema fagocítico, como neutrófilos e macrófagos, sendo um dos principais indicativos de infecção ativa. De acordo com Fonseca Júnior et al. (2020), a identificação direta de amastigotas em esfregaços sanguíneos é um método diagnóstico que, apesar de menos sensível que os testes sorológicos, oferece evidência direta da presença do parasita no hospedeiro.
Esse achado microscópico, como mostrado na Figura 7, foi fundamental para consolidar o diagnóstico e iniciar o tratamento específico da LVC, destacando a importância da confirmação por diferentes métodos diagnósticos, desde testes rápidos e sorológicos até exames microscópicos.
O exame de urinálise completo foi realizado em 17/10/2023 para avaliar a função renal e detectar possíveis complicações urinárias relacionadas à Leishmaniose Visceral Canina (LVC). O exame foi realizado por cistocentese e a amostra de urina foi analisada utilizando métodos físico-químicos e de sedimentoscopia (Figura 8).
Os resultados demonstraram uma urina de coloração amarelo ouro, com densidade de 1033, dentro do valor de referência esperado (1.025 a 1.050), indicando uma capacidade de concentração renal normal. A análise físico-química não evidenciou a presença de sangue oculto, bilirrubina, cetonas, glicose ou proteínas, sugerindo que não há indícios de disfunção renal significativa no momento.

No exame de sedimentoscopia, foram encontrados raros eritrócitos por campo, o que pode ser compatível com um leve trauma devido à cistocentese, e bactérias (+), indicando possível infecção bacteriana concomitante. Cristais de estruvita (+) também foram detectados, o que pode sugerir uma tendência à formação de cálculos urinários, conforme descrito por Fonseca Júnior et al. (2020), que destacam a necessidade de monitoramento cuidadoso em casos de cristalúria, especialmente em cães com LVC, onde a imunossupressão pode facilitar infecções secundárias.

O pH da urina foi ligeiramente alcalino (pH 8), um achado que pode estar associado à presença de bactérias e cristais de estruvita. Segundo Freitas et al. (2022), a alcalinização da urina pode promover a precipitação de cristais de estruvita, e o manejo dietético ou medicamentoso pode ser indicado para prevenir o desenvolvimento de urolitíase.
Com base nesses resultados, foi recomendada a realização de um exame de cultura de urina para identificar o agente bacteriano presente e ajustar o tratamento antimicrobiano, além de orientar a tutora sobre possíveis ajustes dietéticos para prevenir a formação de cálculos urinários.
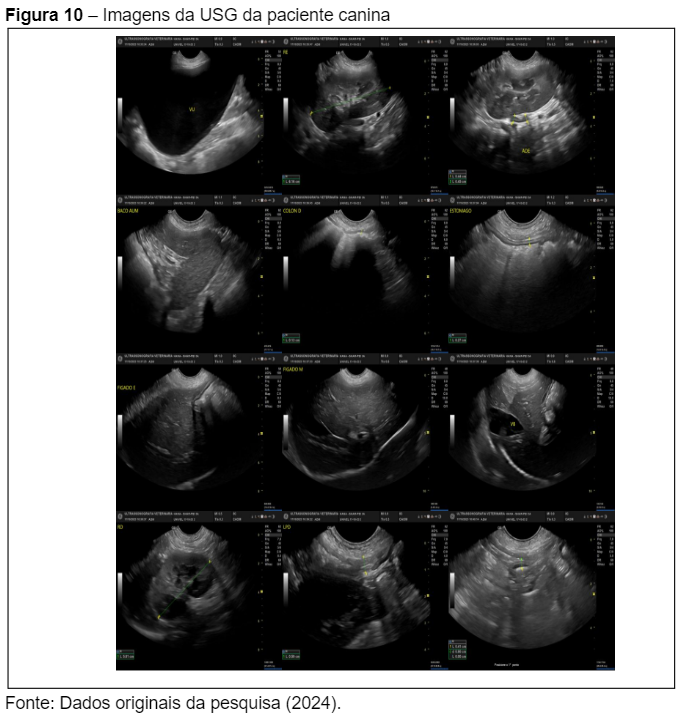
A ultrassonografia abdominal (Figura 9) realizada em 17/10/2023 apresentou como principal achado a esplenomegalia, uma alteração comum em cães com Leishmaniose Visceral Canina (LVC) devido à hiperplasia do tecido linfoide, uma resposta do sistema imunológico à presença de parasitas Leishmania infantum (Figura 10). De acordo com Fonseca Júnior et al. (2020), a esplenomegalia é frequentemente observada em cães com LVC e pode estar associada à tentativa do organismo de eliminar o parasita por meio de ativação de macrófagos e outras células de defesa presentes no baço.
A descrição ultrassonográfica detalhou órgãos como o fígado, rins, vesícula biliar e bexiga, todos com tamanho, forma e ecogenicidade preservados, indicando que não há sinais de comprometimento hepático ou renal grave no momento, o que é corroborado pelos resultados bioquímicos anteriormente mencionados. A observação de alças intestinais preenchidas por conteúdo gasoso e mucoso, sem espessamento significativo, também sugere que não há envolvimento intestinal significativo, algo que pode ocorrer em casos mais avançados de LVC, conforme relatado por Freitas et al. (2022).
Além disso, não foram observados sinais de líquido livre no abdômen, o que exclui a presença de ascite ou peritonite, complicações que podem surgir em casos de LVC grave. A avaliação das adrenais também não indicou alterações, sugerindo que a função adrenal está preservada.
A esplenomegalia, no entanto, é um sinal importante que deve ser monitorado, pois pode se associar a uma maior carga parasitária ou a uma resposta inflamatória sistêmica exacerbada. Conforme a literatura, é necessário um acompanhamento contínuo para avaliar a evolução do quadro e ajustar o tratamento conforme necessário.
Com a confirmação do diagnóstico de Leishmaniose Visceral Canina (LVC) e o quadro clínico estabilizado, foi iniciado o tratamento específico conforme as diretrizes para manejo da doença. O protocolo medicamentoso foi prescrito com o objetivo de controlar a carga parasitária e estimular a resposta imunológica da paciente.
Foi prescrito o uso de Miltefosina 2% (Milteforan™) (Figura 11A), na dose de 1,5 mL a cada 24 horas, administrado via oral por um período de 28 dias. A Miltefosina é um antiprotozoário que atua diretamente na redução da carga parasitária de Leishmania infantum, promovendo a apoptose dos parasitas, conforme descrito por Fonseca Júnior et al. (2020). O medicamento foi administrado com alimentos para evitar irritações gastrointestinais, um efeito colateral comum deste tratamento.
Além da Miltefosina, foi prescrita Domperidona (Figura 11C), na dose de 10 mg/kg, 1 comprimido e meio a cada 24 horas por 30 dias. A Domperidona atua como um imunomodulador, estimulando a produção de células T-helper do tipo 1 (Th1), promovendo uma resposta celular contra a Leishmania, conforme relatado por Freitas et al. (2022).
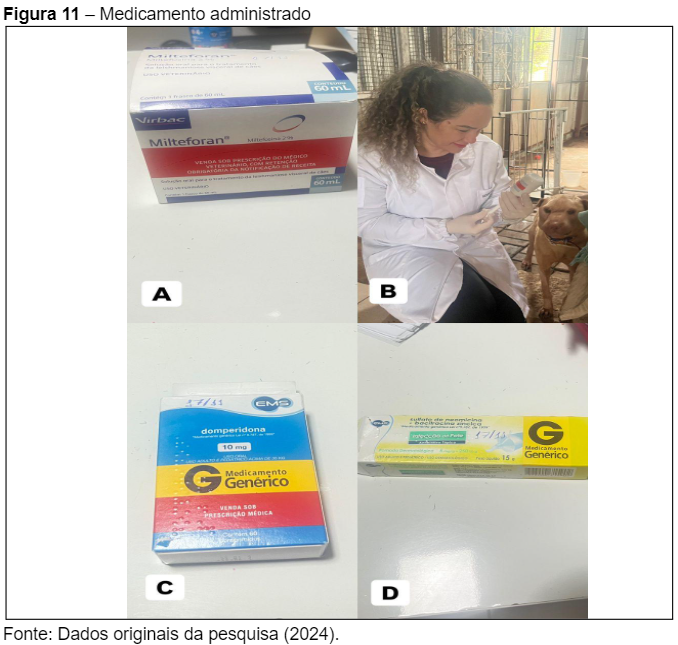
Foi também incluído no protocolo o Alopurinol 100 mg, com a dose de 2 comprimidos a cada 12 horas, de uso contínuo. O Alopurinol tem ação leishmaniostática, inibindo a multiplicação do parasita e auxiliando no controle da infecção a longo prazo. Todos os medicamentos foram fornecidos com alimentos para melhorar a tolerância da paciente ao tratamento.
Para tratar as lesões cutâneas persistentes, foi prescrita a pomada de Sulfato de Neomicina + Bacitracina Zíncica (Figura 11D), um antibiótico tópico indicado para infecções bacterianas secundárias da pele, que deve ser aplicada nas áreas afetadas. Este protocolo tem como objetivo controlar a infecção parasitária, reduzir as lesões de pele, e prevenir novas infecções, proporcionando à paciente uma melhor qualidade de vida, apesar da gravidade da doença.
Após quatro meses de tratamento, a paciente retornou para uma reavaliação clínica e a realização de novos exames.
Durante o exame físico, foi observada uma melhora significativa em seu quadro geral. A alopecia que antes afetava a face da paciente apresentou grande recuperação, com os pelos crescendo de forma uniforme e apresentando brilho saudável (Figura 12A e 12B). As lesões interdigitais nas patas, que anteriormente apresentavam sinais de inflamação e infecção, estavam completamente cicatrizadas, conforme observado na Figura 12C. Além disso, houve uma melhora nas lesões oculares, com cicatrização visível e redução da inflamação (Figura 12D).
Figura 12 – Melhoras da lesões de pele, paciente canino, com LVC
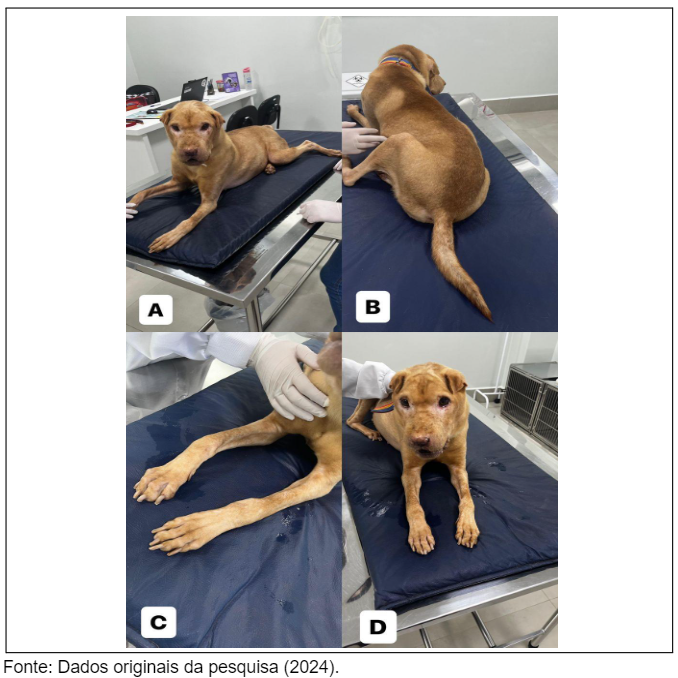
Essas melhorias estão alinhadas com as expectativas de evolução positiva após o uso contínuo dos medicamentos prescritos, como Miltefosina, Domperidona e Alopurinol, que, conforme Souza et al. (2023), são eficazes no controle da Leishmaniose Visceral Canina (LVC) quando utilizados corretamente. A manutenção do uso da coleira repelente Scalibor também desempenhou um papel importante na prevenção de novas infecções por flebotomíneos, conforme relatado por Freitas et al. (2022). Durante a consulta, foram coletadas amostras de sangue para exames complementares, como hemograma completo (Figura 13). e ultrassonografia abdominal. Além disso, foi realizada a coleta de amostras de sangue da medula óssea para avaliar a carga parasitária presente na paciente (Figura 13C).
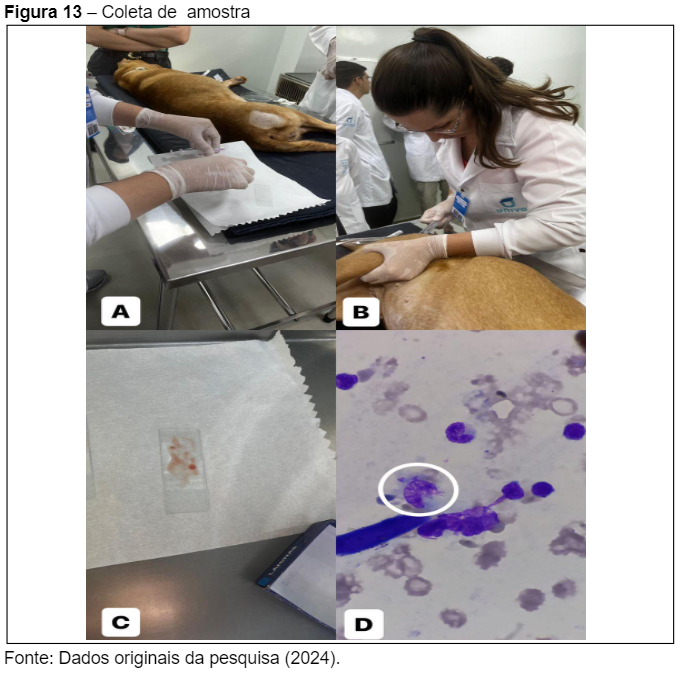
Figura 14 –Resultado do exame de hemograma completo.
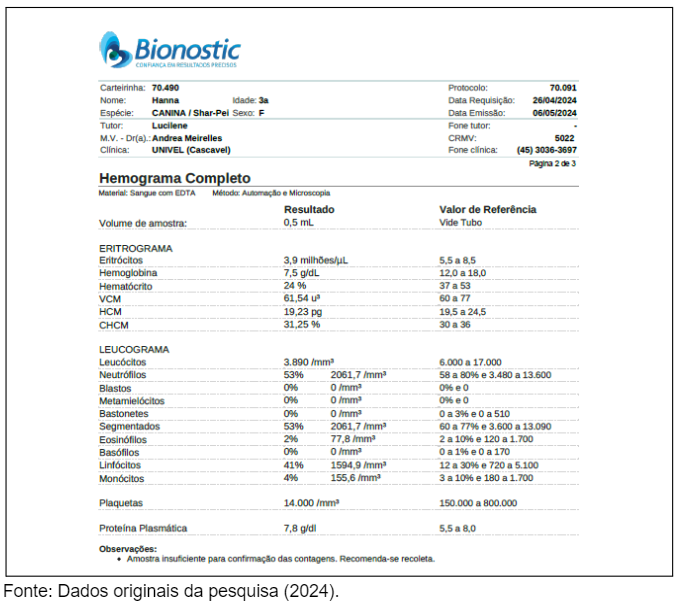
A presença de formas amastigotas do parasita foi confirmada no exame microscópico da medula óssea(Figura 13D), indicando que, apesar da melhora clínica, ainda há presença do parasita no organismo da paciente, exigindo continuidade no tratamento e acompanhamento rigoroso.O hemograma completo realizado em 26/04/2024 revelou alterações hematológicas importantes no quadro da paciente, ainda em acompanhamento para Leishmaniose Visceral Canina (LVC). O exame evidenciou anemia significativa, com valores de hemoglobina (7,5 g/dL), hematócrito (24%) e contagem de eritrócitos (3,9 milhões/μL) muito abaixo dos valores de referência (Figura 14 e 15).

Essas alterações indicam que, apesar da melhora clínica externa, a paciente ainda sofre com as consequências sistêmicas da LVC, conforme descrito por Fonseca Júnior et al. (2020), que relatam que a anemia é um achado comum em cães com infecções prolongadas por Leishmania infantum.
No leucograma, a contagem total de leucócitos foi de 3.890/mm³, abaixo do limite inferior da faixa de referência (6.000 a 17.000/mm³), indicando leucopenia. Este resultado, associado à linfocitose relativa (41%), sugere uma resposta imunológica comprometida, também frequente em cães infectados cronicamente por LVC, conforme relatado por Souza et al. (2023). A neutrofilia (53%) com contagem de 2.061,7/mm³ pode estar relacionada a uma infecção bacteriana secundária, o que reforça a necessidade de monitoramento contínuo e tratamento coadjuvante, conforme as descrições de Vieira e Figueiredo (2021).
Outro achado relevante foi a trombocitopenia, com a contagem de plaquetas de apenas 14.000/mm³, muito abaixo do valor de referência (150.000 a 800.000/mm³). A trombocitopenia é um sinal preocupante e pode estar associada à destruição imunomediada de plaquetas ou ao sequestro esplênico, comumente relatado em casos avançados de LVC (Freitas et al., 2022). Além disso, a paciente apresentou proteína plasmática de 7,8 g/dL, dentro do intervalo normal, indicando que os níveis de proteína estão estáveis, apesar da doença sistêmica.
Esses resultados reforçam a importância de continuar com o tratamento imunomodulador e leishmaniostático, e a necessidade de monitorar regularmente os parâmetros hematológicos da paciente para prevenir complicações graves. O controle da LVC exige atenção contínua às alterações sistêmicas que podem ocorrer mesmo com sinais clínicos externos de melhora.
A paciente retornou para fazer a ultrassonografia abdominal, que revelou a progressão da doença. No exame ultrassonográfico realizado em 26/04/2024 (Figura 16), observou-se que o fígado e o baço apresentavam aumento de tamanho, com contornos abaulados e parênquima heterogêneo. O baço, especificamente, apresentava múltiplas lesões arredondadas, intra e extra-parenquimatosas, algumas com conteúdo anecogênico e outras hiperecogênicas, sugerindo a presença de inflamação crônica e possível infiltração parasitária. Essas lesões são comuns em casos avançados de Leishmaniose Visceral Canina (LVC), conforme descrito por Fonseca Júnior et al. (2020), que associam esses achados à tentativa do sistema imunológico de controlar a replicação do parasita no órgão.
Figura 16 – Resultado do exame de ultrassom
Fonte: Dados originais da pesquisa (2024).
Os rins estavam em topografia habitual, com leve aumento na ecogenicidade das corticais, o que pode ser um indicativo de nefropatia crônica, um achado frequente em cães com LVC avançada, conforme relatado por Freitas et al. (2022). As glândulas adrenais também apresentaram-se preservadas, sem sinais evidentes de comprometimento funcional.
Apesar do tratamento com Miltefosina, a carga parasitária não apresentou redução significativa, e a evolução da doença continuou a deteriorar a saúde da paciente. O quadro clínico progrediu para um estágio mais grave, onde o acometimento sistêmico tornou inviável a continuação do tratamento com melhora esperada.
A Leishmaniose Visceral Canina (LVC) é uma doença infecciosa crônica e progressiva, causada pelo protozoário Leishmania infantum, e transmitida principalmente pela picada de flebotomíneos, conhecidos como mosquitos-palha. A doença apresenta um grande desafio tanto para os profissionais veterinários quanto para os tutores de animais, devido à sua complexidade, à dificuldade no controle parasitário e às graves consequências que provoca, especialmente quando não diagnosticada ou tratada de forma adequada desde os primeiros estágios.
O diagnóstico precoce é crucial para o manejo eficaz da LVC. Conforme os estudos citados (Freitas et al., 2022; Fonseca Júnior et al., 2020), a detecção rápida e o início imediato do tratamento podem reduzir significativamente a progressão da doença, melhorar a qualidade de vida do animal e, em alguns casos, prolongar sua sobrevida. No entanto, devido à natureza insidiosa da LVC, que muitas vezes se manifesta com sinais clínicos vagos e inespecíficos, como perda de peso, apatia, lesões cutâneas e problemas oculares, a identificação precoce pode ser desafiadora. Isso reforça a necessidade de campanhas de conscientização e medidas preventivas, principalmente em regiões endêmicas.
No caso relatado, apesar da administração do tratamento com Miltefosina, um antiprotozoário utilizado para reduzir a carga parasitária, a resposta ao tratamento foi limitada. Esse resultado sublinha a complexidade da LVC, em que o sucesso terapêutico depende de múltiplos fatores, incluindo a resposta imune do animal, o estágio da infecção, e a carga parasitária no momento do diagnóstico. Além disso, o uso concomitante de medicamentos imunomoduladores, como a Domperidona, e leishmaniostáticos, como o Alopurinol, é importante para controlar a infecção, mas não garantem a erradicação total do parasita.
A ultrassonografia final realizada, que revelou esplenomegalia com múltiplas lesões no baço e alterações no fígado, indica que a doença já estava em estágio avançado, com comprometimento significativo dos órgãos internos. O baço, por ser um dos principais órgãos envolvidos na resposta imune contra o parasita, frequentemente apresenta alterações graves em casos de LVC avançada. A presença de lesões hepáticas e renais também sugere que o parasita havia se disseminado sistemicamente, causando inflamação crônica e danos a múltiplos sistemas orgânicos, como relatado por Vieira e Figueiredo (2021).
Outro aspecto crítico do manejo da LVC é o controle dos vetores, principalmente por meio do uso de coleiras repelentes como a Scalibor®, que ajudam a prevenir a reinfecção e a disseminação do parasita. No entanto, mesmo com essas medidas preventivas e o tratamento agressivo, muitos animais, como o apresentado neste caso, podem não responder adequadamente, resultando na progressão inevitável da doença.
A decisão pela eutanásia em casos de LVC avançada deve ser avaliada com cuidado, considerando não apenas o estado clínico do animal, mas também o impacto da doença sobre sua qualidade de vida. No caso descrito, a alta carga parasitária, a falência do tratamento e o comprometimento dos órgãos internos justificaram essa intervenção. A eutanásia, embora seja uma decisão difícil para os tutores, muitas vezes é recomendada em casos de sofrimento prolongado, onde as opções de tratamento não oferecem melhora significativa, como discutido por Souza et al. (2023).
Em última análise, este caso reforça a importância de uma abordagem multidisciplinar no manejo da LVC, combinando diagnóstico precoce, tratamento medicamentoso adequado, controle de vetores e monitoramento frequente. Além disso, destaca a importância de políticas públicas eficazes de controle da leishmaniose, especialmente em regiões endêmicas, para evitar a propagação da doença e melhorar o prognóstico de animais infectados.
5. CONCLUSÃO
Embora a cidade de Cascavel não seja atualmente um foco endêmico de Leishmaniose Visceral Canina (LVC), sua localização no corredor epidemiológico da doença deve ser levada em consideração. A proximidade com áreas de alta prevalência aumenta o risco de disseminação, o que torna fundamental a vigilância e a prevenção, especialmente em regiões limítrofes.
É importante destacar que a LVC é uma zoonose de notificação obrigatória, e a responsabilidade pelo manejo adequado do animal recai tanto sobre o médico veterinário quanto sobre o tutor. O cumprimento das normativas de saúde pública é essencial para a contenção da doença, prevenindo sua disseminação para outros animais e humanos.
O tratamento da LVC, embora seja capaz de melhorar a qualidade de vida do animal e reduzir a carga parasitária, não erradica completamente o parasita do organismo. Isso significa que, mesmo com a carga parasitária baixa, o animal ainda pode transmitir a doença, principalmente se não houver controle adequado dos vetores. Portanto, o uso de coleiras repelentes e outras medidas profiláticas continua sendo indispensável.
Por fim, a eutanásia permanece como a recomendação feita pelos órgãos de saúde pública em casos graves de LVC, sobretudo para animais com alta carga parasitária e sem resposta efetiva ao tratamento. Essa medida visa não apenas o bem-estar do animal, mas também a proteção da saúde pública, reduzindo o risco de transmissão da zoonose.
REFERÊNCIAS
BENTO, Mariana Fagundes et al. Sensitivity of PCR in conjunctival swab samples for the diagnosis of canine visceral leishmaniasis: a systematic review and meta-analysis. Revista Brasileira de Parasitologia Veterinária, v. 32, n. 4, p. 1-10, 2023. Disponível em: https://pubmed.ncbi.nlm.nih.gov/38018627/. Acesso em: 24 jun. 2024.
BRAATZ, Giulio Mendes. Design, assembly, clonagem e preservação de circuitos genéticos paratransgênicos para prevenção da leishmaniose visceral. 2023. Trabalho de Conclusão de Curso (Bacharelado em Biotecnologia) – Instituto Latino-Americano de Ciências da Vida e da Natureza, Universidade Federal da Integração Latino-Americana, Foz do Iguaçu, 2023. Disponível em: http://dspace.unila.edu.br/handle/123456789/7822. Acesso em: 24 jun. 2024.
BRASIL. Decreto-Lei nº 51.838, de 14 de março de 1963. Dispõe sobre medidas de combate à leishmaniose e dá outras providências. Diário Oficial da União: seção 1, Brasília, DF, 14 mar. 1963. Disponível em: https://www.planalto.gov.br/ccivil_03/decreto/1950-1969/d51838.htm#:~:text=DECRETO%20N%C2%BA%2051.838%2C%20DE%2014,que%20lhe%20confere%20o%20art. Acesso em: 24 jun. 2024.
BRASIL. Ministério da Saúde. Portaria nº 204, de 17 de fevereiro de 2016. Define a lista nacional de notificação compulsória de doenças, agravos e eventos de saúde pública nos serviços de saúde públicos e privados em todo o território nacional. Diário Oficial da União: seção 1, Brasília, DF, 18 fev. 2016. Disponível em: https://bvsms.saude.gov.br/bvs/saudelegis/gm/2016/prt0204_17_02_2016.html. Acesso em: 24 jun. 2024.
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Leishmaniose visceral: casos confirmados notificados no Sistema de Informação de Agravos de Notificação – Brasil. Brasília: Ministério da Saúde, 2024. Disponível em: http://tabnet.datasus.gov.br/cgi/tabcgi.exe?sinannet/cnv/leishvbr.def. Acesso em: 24 jun. 2024.
COSTA, Danielle Nunes Carneiro Castro et al. Controle da leishmaniose visceral canina por eutanásia: estimativa de efeito baseado em inquérito e modelagem matemática. Cadernos de saúde pública, v. 36, p. e00221418, 2020. Disponível em: https://www.scielo.br/j/csp/a/bcBmtWnBvLvjp6NFgBvpxtg/?lang=pt. Acesso em: 24 jun. 2024.
ECCO, Roselene et al. Leishmaniose cutânea em cobaias (Cavia porcellus). Ciência Rural, v. 30, p. 525-528, 2000. Disponível em: https://doi.org/10.1590/S0103-84782000000300027. Acesso em: 12 out. 2024.
FERREIRA, Bárbara Freire. Distribuição espacial e temporal de leishmaniose visceral e tegumentar no estado do Paraná dos anos de 2001 a 2022. 2024. Trabalho de Conclusão de Curso (Bacharelado em Ciências Biológicas – Ecologia e Biodiversidade) – Instituto Latino-Americano de Ciências da Vida e da Natureza, Universidade Federal da Integração Latino-Americana, Foz do Iguaçu, 2024. Disponível em: https://dspace.unila.edu.br/bitstreams/3704bc13-160e-4ce0-82bd-a9bdea2d5343/download. Acesso em: 24 jun. 2024.
FONSECA JÚNIOR, José Duarte da et al. Leishmaniose visceral canina: Revisão. Pubvet, v. 15, p. 168, 2020. Disponível em: https://pdfs.semanticscholar.org/4b77/d0507466cc635be78d2719c6895346f31cbe.pdf. Acesso em: 24 jun. 2024.
FREITAS, Adriana et al. Leishmaniose visceral canina: Revisão. Pubvet, v. 16, n. 10, 2022. Disponível em: http://ojs.pubvet.com.br/index.php/revista/article/view/2935. Acesso em: 24 jun. 2024.
MERGEN, Maria Eduarda; SOUZA, Marília Mascarenhas. Leishmaniose Visceral Canina, métodos diagnósticos e tratamento na atualidade – Revisão de literatura. Revista JRG de Estudos Acadêmicos, v. 6, n. 13, p. 1024-1036, 2023. Disponível em: http://revistajrg.com/index.php/jrg/article/view/652. Acesso em: 24 jun. 2024.
PARANÁ. Decreto nº 5.711, de 23 de maio de 2002. Aprova o regulamento da organização e funcionamento do Sistema Único de Saúde no Estado do Paraná (SUS). Diário Oficial do Estado do Paraná, Curitiba, 24 maio 2002. Disponível em: https://leisestaduais.com.br/pr/decreto-n-5711-2002-parana-aprovado-o-regulamento-da-organizacao-e-funcionamento-do-sistema-unico-de-saude-no-estado-do-parana-sus. Acesso em: 24 jun. 2024.
PARANÁ. Decreto nº 5.711, de 23 de maio de 2002. Aprova o regulamento da organização e funcionamento do Sistema Único de Saúde no Estado do Paraná (SUS). Diário Oficial do Estado do Paraná, Curitiba, 24 maio 2002. Disponível em: https://leisestaduais.com.br/pr/decreto-n-5711-2002-parana-aprovado-o-regulamento-da-organizacao-e-funcionamento-do-sistema-unico-de-saude-no-estado-do-parana-sus. Acesso em: 24 jun. 2024.
PARANÁ. Nota Técnica nº 09/2020. Dispõe sobre as ações de vigilância e controle da Leishmaniose Visceral Canina (LVC) no estado do Paraná. 2020. Disponível em: https://www.saude.pr.gov.br/sites/default/arquivos_restritos/files/documento/2022-03/nota_tecnica_lvc_09-2020.pdf. Acesso em: 24 jun. 2024.
PARANÁ. Secretaria de Estado da Saúde. Lei n. 13.331, de 23 de maio de 2001. Código de Saúde do Paraná. Curitiba, 2001. Disponível em: https://www.legislacao.pr.gov.br/legislacao/pesquisarAto.do?action=exibir&codAto=5982&indice=1&totalRegistros=1&dt=12.3.2020.14.10.57.692. Acesso em 24 jun. 2024.
SERENO, Denis et al. Noninvasive Biological Samples to Detect and Diagnose Infections due to Trypanosomatidae Parasites: a systematic review and meta-analysis. International Journal Of Molecular Sciences, v. 21, n. 5, p. 1-49, 29 fev. 2020. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32121441/. Acesso em: 24 jun. 2024.
SOUZA, Ester Viviane de et al. Leishmaniose visceral canina. Resumos Científicos do Curso de Medicina Veterinária, v. 1, n. 8, 2023. Disponível em: http://revista.universo.edu.br/index.php?journal=3universobelohorizonte3&page=article&op=view&path%5B%5D=11687. Acesso em: 24 jun. 2024.
VIEIRA, Vanessa Paulino da Cruz; FIGUEIREDO, Nathalia Mendes. Leishmaniose visceral canina: breve revisão e relatos de casos. Veterinária e Zootecnia, v. 28, p. 1-12, 2021. Disponível em: https://rvz.emnuvens.com.br/rvz/article/view/577. Acesso em: 24 jun. 2024.
1Médica Veterinária – Pós-graduanda em Clínica Médica e Cirúrgica de Animais de Companhia
2Graduanda em Medicina veterinária pela Univel
3Professor(a) de Medicina Veterinária pela Univel
4Graduanda em Medicina Veterinária pela Universidade Federal do Pará
5Graduanda em Medicina Veterinária pela Uniceplac- DF
6Graduando em Medicina Veterinária pela Unemat-MT
