REGISTRO DOI: 10.69849/revistaft/fa10202409301517
Henrique Motta Sales,
Marcella Karine Ferreira de Oliveira,
Orientadora: Professora Dra. Jennifer Ottino,
Co-orientadora: Dra. Kelly Moura Keller.
RESUMO
Aspergillus spp. e Cryptococcus spp. são os gêneros de fungos mais frequentemente envolvidos em doenças infecciosas do trato superior de cães e gatos, respectivamente. A distribuição cosmopolita no ambiente terrestre e a capacidade de provocar doenças em diversas espécies como mamíferos, aves, entre outros, representa um desafio não apenas para a medicina veterinária, mas para a saúde pública. Os testes diagnósticos e tratamentos das afecções fúngicas nos animais não avançaram conforme a crescente resistência às drogas e o surgimento de novas cepas resistentes. Nesse contexto foram revisados mais de 50 trabalhos científicos, dentre eles livros e artigos publicados no período de 1992 a 2024, com o objetivo de traçar um panorama acerca dos principais aspectos relacionados à infecção por Aspergillus spp. e Cryptococcus spp. em canídeos e felídeos domésticos, evidenciando informações da literatura científica.
Palavras-Chave: Fungo, criptococose, aspergilose, felinos, cães, síndrome respiratória.
ABSTRACT
Aspergillus spp. and Cryptococcus spp. are the fungal genera most frequently involved in upper respiratory tract infections in dogs and cats, respectively. Their cosmopolitan distribution in the terrestrial environment and their ability to cause diseases in various species, including mammals and birds, represent a challenge not only for veterinary medicine but also for public health. Diagnostic tests and treatments for fungal diseases in animals have not kept pace with the increasing drug resistance and the emergence of new resistant strains. In this context, more than 50 scientific papers, including books and articles published between 1992 and 2024, were reviewed with the aim of providing an overview of the main aspects related to infection by Aspergillus spp. and Cryptococcus spp. in domestic canines and felines, highlighting information from the scientific literature.
Keyword: Fungus, cryptococcosis, aspergillosis, felines, dogs, respiratory syndrome.
INTRODUÇÃO
A prevalência de fungos nas cavidades nasais de cães e gatos é um tema relevante na medicina veterinária, especialmente devido ao impacto potencial na saúde respiratória desses animais. Os fungos nas cavidades nasais de cães e gatos podem incluir uma variedade de gêneros, desde as mais comuns, como Aspergillus e o Penicillium, até algumas menos frequentes, como Cryptococcus, Rhinosporidium, Mucor e Histoplasma também podem colonizar a cavidade nasal, causando doenças graves em animais, sobretudo naqueles com sistema imunológico comprometido. Esses fungos infectam as vias nasais de mamíferos domésticos, levando a ocorrência de sinais clínicos, como espirros frequentes, corrimento nasal, dificuldade respiratória e, em casos graves, ulceração e destruição do tecido nasal.
A criptococose e a aspergilose são infecções fúngicas importantes, exigindo atenção devido às suas consequências clínicas e à necessidade de diagnóstico e tratamento adequado. A criptococose é causada pelo fungo Cryptococcus spp. e aspergilose é causada pelo fungo Aspergillus spp. Esses fungos são encontrados no ambiente, quando inalados, podem acometer felídeos e canídeos domésticos, causando uma série de sinais clínicos respiratórios, como espirros, corrimento nasal, tosse e dificuldades respiratórias.
Com o objetivo de traçar um panorama abrangente dos principais aspectos relacionados à infecção por Aspergillus spp. em canídeos e Cryptococcus spp. em felinos domésticos, foi realizada uma revisão da literatura científica. Para tal, foram analisados mais de 50 trabalhos científicos nacionais e internacionais, incluindo livros e artigos publicados no período entre 1992 e 2024. As plataformas utilizadas para a busca foram: Scielo, Scopus, Google Scholar, Pubmed e ScienceDirect. Além disso, foram consultados artigos científicos e livros do acervo da biblioteca da Universidade Federal de Minas Gerais. Para a pesquisa dos artigos, as seguintes palavras-chave foram utilizadas: Cryptococcus, Aspergillus, sistema respiratório, felinos, cães e outros termos relacionados.
ANATOMIA, HISTOLOGIA E FISIOLOGIA DA CAVIDADE NASAL
O aparelho respiratório é composto por diferentes estruturas e possui a função principal de troca gasosa, mas para que isso ocorra, as vias aéreas de condução precisam ser bem especializadas, a fim de que o ar inspirado seja aquecido, umidificado e filtrado, além disso, é importante a existência de mecanismos de defesa contra patógenos, de tal modo, o epitélio respiratório apresenta células ciliadas e caliciformes, as primeiras têm como característica a presença de cílios que transportam o muco e particulares em direção a boca, já as segundas são o tipo celular secretório mais comum em mamíferos domésticos, as mesmas produzem um muco rico em glicoproteína sulfatada que funciona como barreira para as partículas inaladas. Também, assim como em outras regiões de mucosa, é encontrada a imunoglobulina A e leucócitos. (EURELL et al., 2012).
Outra parte importante do aparelho respiratório é o sistema olfativo dos mamíferos, responsável pela percepção de odores, consiste em narinas pares (orifícios externos), narinas internas (coanas), câmaras ou cavidades nasais, células receptoras, nervos olfativos e os bulbos olfativos do cérebro (REECE, 2006).
As narinas servem como entrada da cavidade nasal e são sustentadas pelas cartilagens, enquanto as coanas estabelecem a comunicação entre a cavidade nasal e a nasofaringe (LIGHT, 1993). A cavidade nasal é dividida pelo septo nasal em hemilado direito e esquerdo estando localizada no plano mediano, preenchida pelas conchas nasais e etmoidais (Figura 1), que se projetam da parede lateral e quase alcançam o septo nasal, resultando em meatos interpostos estreitos (HARE, 1986). As partes caudal e ventral do septo são de natureza óssea e formadas pela placa perpendicular do etmóide e pelo vômer, respectivamente. A parte cartilaginosa restante do septo é composta de cartilagem hialina. A borda dorsal do septo nasal está associada aos ossos frontal e nasal, e na região rostral, se expande em cada lado para formar as cartilagens laterais dorsais (HARE, 1986) (Figura 2).
Em espécies com olfato aguçado, como os cães e gatos, o epitélio olfativo é rico em células nervosas especializadas conhecidas como receptores olfativos (SJAASTAD, 2010). Esses receptores se ligam às moléculas odoríferas, gerando impulsos nervosos que são transmitidos ao cérebro através dos nervos olfativos (CORREA, 2011). Os bulbos olfativos, localizados na região inferior do cérebro, funcionam como centrais de processamento de informações olfativas, filtrando e decodificando os impulsos nervosos antes de enviá-los para outras áreas do cérebro responsáveis pela identificação e interpretação dos odores (ZANATTA,2007).
Em cães e gatos, além do sistema olfativo principal, ocorre um sistema olfativo acessório, o órgão vomeronasal, especializado na detecção de feromônios, moléculas químicas que influenciam comportamentos sexuais e sociais (CORREA, 2011). No gato, o vômer não se articula com o assoalho da cavidade nasal caudal apresentando apenas a porção rostral. Nos cães, a cavidade nasal é dividida em duas metades ventralmente (HARE, 1986). Essa diferença anatômica pode ter implicações na percepção olfativa e nos comportamentos olfativos entre as duas espécies.
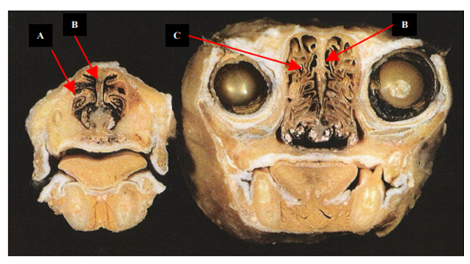
Figura 1. Imagens de cabeça em seção transversal ilustrando a cavidade nasal e os seios paranasais do gato. A-conchas nasais. B – septo nasal. C – conchas etmoidais. (ZANATTA, 2007).
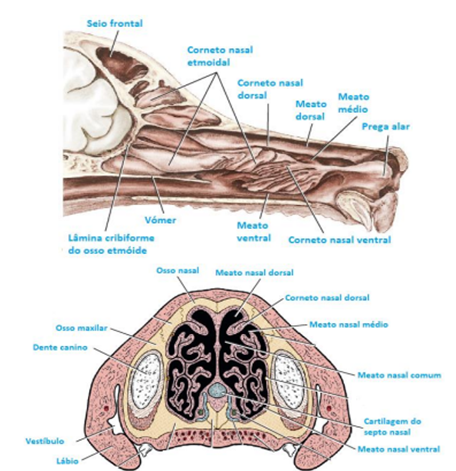
Figura 2. Cavidade nasal de cão normocéfalo em corte sagital (acima) e em corte transversal (abaixo), evidenciando os cornetos e os meatos nasais (CARLOS, 2021).
CRIPTOCOCOSE EM FELINO DOMÉSTICO
INTRODUÇÃO
A criptococose é uma doença fúngica sistêmica que pode afetar mamíferos, aves e humanos. Causada por fungos do gênero Cryptococcus, afeta principalmente o trato respiratório anterior e eventualmente parênquima pulmonar, sistema nervoso central, olhos, pele e outros órgãos de felinos. Adquirida por inalação de fungos presentes em excrementos de aves, vegetais e solo, a doença se manifesta por meio de sinais clínicos variados, como secreção nasal, tosse, dispneia, convulsões, perda de visão, lesões cutâneas, febre entre outros. De acordo com sua disseminação para os tecidos do organismo, a doença pode causar diferentes síndromes como respiratória, neurológica, ocular e síndrome cutânea. O diagnóstico é feito por meio de exames físicos e laboratoriais e o tratamento com antifúngicos varia conforme a gravidade da doença e o estado de saúde do gato.
ETIOLOGIA E PATOGENIA
A criptococose é uma micose sistêmica causada por fungos do gênero Cryptococcus, de evolução aguda ou crônica que acomete mais comumente o trato respiratório anterior (cavidade nasal e tecidos paranasais) de seu hospedeiro podendo se estender para o parênquima pulmonar. A partir do foco primário, a infecção fúngica pode se disseminar por todo o organismo, afetando trato respiratório posterior, o sistema nervoso central, olhos, pele e outros órgãos, tanto em seres humanos quanto em animais domésticos e silvestres (STRADIOTO, 2010).
As leveduras capsuladas pertencentes ao complexo causador da criptococose compreende as espécies Cryptococcus neoformans (sorotipos A, D e AD), sendo a espécie mais prevalente e responsável pela maioria dos casos, e C. gattii (sorotipos B e C). Morfologicamente apresentam células de formato arredondado a ovalado, exibindo dimensões que variam de 3 a 10 micrômetros de diâmetro. (HNILICA & MEDLEAU, 2012).
Microrganismos do gênero Cryptococcus são normalmente adquiridos através da inalação de basidiósporos, estruturas reprodutivas do fungo encontradas em excretas de aves, vegetais e no solo. Ao serem inalados, os basidiósporos se depositam nas vias aéreas anteriores, onde se transformam em leveduras, forma ativa do fungo (PINTO et al., 2019).
Quando a levedura de Cryptococcus spp. invade os tecidos nasais, desencadeia uma resposta imune localizada. As células imunes, como os macrófagos e as células T, liberam citocinas e quimiocinas que atraem mais células imunes para o local da infecção. Com isso, os macrófagos tentam englobar e destruir o fungo, por meio da fagocitose (ABBAS, 2007). No entanto, o Cryptococcus possui mecanismos para evitar a destruição pelos macrófagos (CRUZ, 2010). Com isso, a resposta inflamatória adaptativa é ativada, com células T específicas reconhecendo e atacando o fungo, o que leva a uma inflamação prolongada e intensificada nos tecidos nasais. A inflamação crônica e intensa pode provocar danos aos tecidos nasais, causando lesões que alteram a aparência dos tecidos, dando a impressão de um “nariz de palhaço” (BOAVENTURA, 2013).
As leveduras que penetram no sistema respiratório, podem atingir o parênquima pulmonar. No parênquima pulmonar os macrófagos residentes desempenham um papel central na resposta imunológica. A resposta do organismo hospedeiro à infecção por Cryptococcus envolve predominantemente uma resposta de células T auxiliares com citocinas, tais como fator de necrose tumoral (TNF), interferon-γ e interleucina-2, o que resulta em inflamação granulomatosa (PERFECT, 2005).
A presença de uma cápsula mucopolissacarídica é uma característica marcante do microrganismo e atua como um importante fator de virulência, conferindo resistência à fagocitose por células do sistema imunológico e facilitando a disseminação do patógeno pelo organismo do hospedeiro (FIRACATIVE et al., 2018). Na cápsula, três antígenos são reconhecidos: glucoronoxilomanose, galactoxilomanose e manoproteínas. Estes conferem uma carga negativa às células de C. neofarms, inibindo a migração de leucócitos para a área de infecção, e consequentemente, impedindo o processo de fagocitose. Adicionalmente, a cápsula contém proteases que, por meio de enzimas proteolíticas, podem decompor tecidos e digerir proteínas imunologicamente ativas. Desta forma, demanda mais do sistema imunológico do hospedeiro, induzindo as células fagocíticas a se agruparem ao redor do fungo para tentar impedir sua disseminação, resultando na formação de grânulos. A formação destes grânulos é uma característica observada na espécie felina diante de uma infecção por fungo (CRUZ, 2010).
Em pacientes com comprometimento imunológico, as leveduras podem ser reativadas e encontrar condições favoráveis para proliferar no local da infecção primária, podendo disseminar-se dentro de fagócitos ou como células de levedura, adquirindo assim acesso a outras regiões do corpo, tendo maior predileção por tecidos vascularizados, como o sistema nervoso central, globo ocular, linfonodos e tecido cutâneo (SEYEDMOUSAVI et al., 2018). Sabe-se que as falhas na resposta imune dos hospedeiros permitem a replicação intracelular nas células de defesa, porém cepas específicas de Cryptococcus gattii conseguem proliferar dentro das células de indivíduos imunocompetentes, isto é, o fungo altera a conformação das próprias mitocôndrias, resultando em um aumento da sobrevida celular (MAY, 2009).
Além disso, C. neoformans apresenta uma enzima capaz de catalisar a transformação de compostos difenólicos em melanina. A expressão dessa melanina desempenha um papel de proteger as leveduras contra o estresse oxidativo do hospedeiro, ou seja, protege os fungos do ataque das células efetoras do sistema imunológico (MA & MAY, 2009). Outros elementos de virulência englobam a produção de fosfolipase e urease, além de diversas enzimas associadas à proteção contra estresses oxidativos, proporcionando assim a capacidade de sobrevivência dentro do fagolisossomo (COELHO, 2014).
EPIDEMIOLOGIA
Sabe-se que as espécies causadoras da criptococose, isto é, Cryptococcus neoformans e C. gatti incluem os sorotipos: A, D, AD e B e C, respectivamente, de tal modo que possuem diferenças antigênicas no polissacarídeo capsular, além disso, existem as variedades: C. neoformans variedade neoformans e C. neoformans variedade grubii. (VIVIANE et al., 2009; BENNETT et al., 1977; FRANZOT et al., 1999).
A espécie C. neoformans tende a ter uma distribuição geográfica mundial sendo excretas de aves, restos de árvores e plantas em estado de decomposição locais de encontro do microrganismo no ambiente. Essa espécie possui um maior tropismo pelo sistema nervoso central com maior índice de letalidade, todavia, é considerado um patógeno oportunista que infecta mais comumente indivíduos imunocomprometidos. Distintamente, a espécie C. gatti é identificada em regiões tropicais/subtropicais, naturalmente encontrada em cascas e cavidades de troncos de árvores, por ser uma fonte infectante primária, afeta hospedeiros imunocompetentes, ocasionando alterações macroscópicas e microscópicas nos pulmões (SEVERO et al., 2009; CONTIN et al., 2010; FERNANDES, 2010; FILIÚ et al., 2012; PEREIRA et al., 2014; ROCHA et al., 2014; DESJARDINS et al, 2017; FARRER et al, 2019; ARAÚJO, 2022).
No Brasil, as micoses sistêmicas não integram a lista nacional de doenças com notificação compulsória, de acordo com o Ministério da Saúde, as mesmas não são objeto de vigilância epidemiológica de rotina, alguns estados brasileiros que instituíram essa notificação por iniciativa própria. Por esse motivo, inexistem dados epidemiológicos da ocorrência, magnitude e evolução da criptococose em nível nacional podendo estar subestimada. Entretanto, o C. neoformans é relatado como o principal agente causador da criptococose no território brasileiro, sendo amplamente distribuído pelo país. De maneira oposta, o C. gatti é endêmico nos estados do Amazonas (AM), Bahia (BA), Pará (PA), Roraima (RR), Piauí (PI) e Pernambuco (PE), sendo intensamente associado a infecções em indivíduos imunocompetentes (TRILLES et al., 2008; MARTINS et al., 2011; ARAÚJO, 2022).
Dentre os animais domésticos acometidos destacam-se os cães e gatos, sendo os mais relatados na literatura científica. Embora haja grande prevalência em animais, estima-se que em humanos ocorram mais de 180.000 mortes todos os anos devido as meningites criptocócicas, sendo a taxa de mortalidade de 100% caso os doentes não recebam o tratamento (IYER et al., 2021), o que demonstra a relevância deste problema para a saúde pública.
O Ministério da Saúde considera a inalação dos basidiósporos presentes nas excretas de pombos e em árvores de eucaliptos como a principal forma de transmissão Cryptococcus spp.no homem (Ministério da Saúde, 2024). Assim como acontece nos hospedeiros felinos, as células criptocócicas adentram no pulmão e replicam dentro ou fora dos fagócitos para finalmente disseminarem para os demais tecidos, podendo levar à morte. Em virtude da criptococose ser uma doença infecciosa grave e dos fungos pertencentes ao gênero Cryptococcus serem capazes de infectar seres humanos e outras espécies, faz-se necessário uma vigilância no que diz respeito a esta problemática.
SINAIS CLÍNICOS
A criptococose, manifesta-se por quatro síndromes distintas, de forma isolada ou em conjunto, a depender da suscetibilidade do hospedeiro e do local de colonização do fungo, sendo elas síndrome respiratória, neurológica, ocular e cutânea(QUEIROZ et al., 2008; MÜLLER; NISHIZAWA, 2017). A síndrome respiratória destaca-se como uma afecção frequente entre os felinos. Nesta espécie, a inalação dos basidiósporos leva ao acometimento da cavidade nasal, por ser a primeira porta de entrada do sistema respiratório, sendo menos frequentemente difunde-se para os pulmões (PIMENTA et al., 2015; HONSHO et al., 2003). Tal síndrome caracteriza-se por um conjunto de sinais, incluindo roncos, descarga nasal unilateral ou bilateral sero-sanguinolenta a mucopurulenta, estertores, espirros e dispneia inspiratória. Em casos mais graves, a doença pode evoluir para proliferações anormais no tecido subcutâneo da cavidade nasal (massas firmes), obstruindo as vias aéreas e causando deformidades na região nasal (nariz de palhaço) (Figura 3A-3B), caracterizada pelo aumento da narina e vermelhidão (FARIA, 2015; LAPPIN, 2015; MÜLLER; NISHIZAWA, 2017).
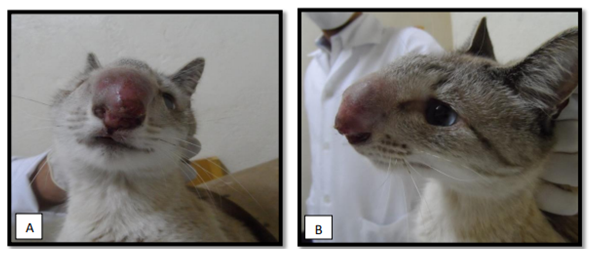
Figura 3. Gato afetado por Cryptococcus neoformans, apresentando deformidade na região nasal (“nariz de palhaço”). A-Vista frontal; B- vista lateral. Fonte: LIMA et al., 2018.
Os sinais neurológicos decorrem de meningoencefalite difusa ou focal causada pela formação granulomatosa. As manifestações clínicas podem incluir caminhar em círculos, depressão, alterações comportamentais, nistagmo, convulsões, cegueira, perda do olfato, ataxia, tetraparesia, paraplegia e doença vestibular periférica (FARIA, 2015; LAPPIN, 2015).
A síndrome ocular se caracteriza por fotofobia, blefaroespasmo, opacidade corneana, edema inflamatório da íris, hifema e em casos extremos, cegueira (MÜLLER; NISHIZAWA, 2017).
Na síndrome cutânea é possível observar em diferentes áreas do corpo do animal nódulos múltiplos na pele de crescimento rápido, firmes ou flutuantes, com ulceração e drenagem de exsudato serosanguinolento (LAPPIN, 2015; MÜLLER; NISHIZAWA, 2017).
DIAGNÓSTICO
O diagnóstico diferencial da criptococose deve considerar diversas doenças que podem apresentar manifestações clínicas semelhantes, sendo o principal entre eles a esporotricose (GUARNER; BRANDT, 2011). Além disso, também pode-se incluir aspergilose, carcinoma de células escamosas, leishmaniose felina e neoplasias (GUARNER; BRANDT, 2011). Diante disso, torna-se de extrema importância o estabelecimento de um diagnóstico preciso, para evitar a disseminação do microrganismo e progressão da doença no hospedeiro decorrente do atraso no tratamento adequado, além de prevenir o uso incorreto de fármacos, o que pode acarretar em consequências para a saúde do paciente e levar à resistência microbiana.
Além de que, felinos infectados por Cryptococcus spp. em trato respiratório podem representar um risco de transmissão da doença para outros animais e, em casos raros, para humanos (GREENE et al.,1998). A principal via de transmissão nesse contexto se dá através da inalação de aerossóis contaminados expelidos pelo animal durante espirros, por isso é fundamental realizar o diagnóstico e tratamento correto a fim de minimizar o risco de transmissão (PIMENTA et al., 2015).
De acordo com PINTO et al. (2019), o diagnóstico se baseia no histórico e exame físico, além do isolamento do fungo e o exame histopatológico de fragmentos de tecido acometido. O exame direto utiliza o corante Tinta da China (tinta nanquim), revelando a levedura encapsulada em sua forma característica, aspecto de “céu estrelado” (Figura 4). Em seguida, o fungo isolado é cultivado em Ágar Sabouraud Dextrose (SDA), onde após cinco dias de incubação a 37°C, apresenta crescimento mucóide, brilhante e de coloração creme (Figura 5). No exame histopatológico a coloração da cápsula do fungo se dá através da utilização do corante Mucicarmim de Meyer em vermelho, facilitando sua identificação colocar (Figura 6).
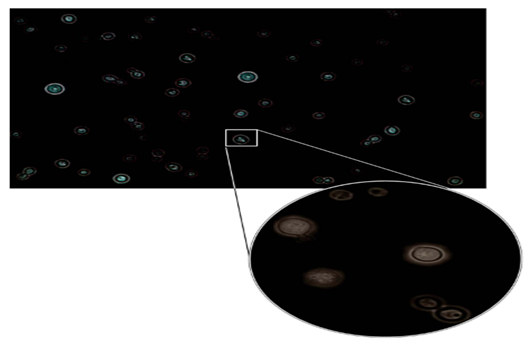
Figura 4. Microscopia óptica de Cryptococcus spp. (400x) preparada com tinta nanquim onde é possível observar diversas leveduras arredondadas ou ovaladas, isoladas ou com brotamento único (comumente chamado de “céu estrelado”). Em destaque a microscopia óptica (1000x) possibilitando a visualização nítida da cápsula. Fonte: PINTO et al., 2019
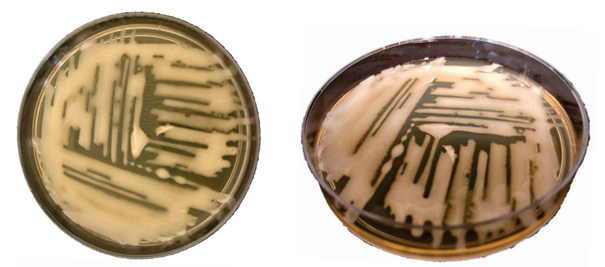
Figura 5. Macroscopia de Cryptococcus spp. em meio Ágar Infusão de Cérebro e Coração (BHI) acrescido de cloranfenicol, incubado em estufa a 37°C durante 48 horas. Colônias mucosas e brilhantes de coloração creme. Fonte: PINTO et al., 2019
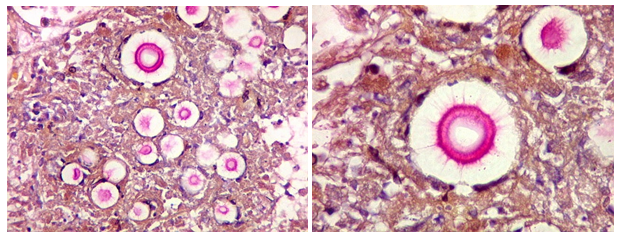
Figura 6. Exame histopatológico de Criptococose Pulmonar preparado com coloração Mucicarmim que realça a cápsula mucopolissacarídica do fungo. A porção interna da cápsula se cora fortemente, enquanto a parte periférica fica incolor, evidenciando finos filamentos radiados que se perdem na periferia. Fonte: CA
TRATAMENTO
Para o tratamento da criptococose são recomendados antifúngicos sistêmicos como anfotericina B, cetoconazol, itraconazol, voriconazol ou 5-fluocitosina (RONDELLI et al., 2010; LAPPPIN, 2015). O itraconazol é o antifúngico de escolha para cães e gatos quando não há comprometimento neurológico, demonstrando sua eficácia ao inibir o crescimento do fungo causador da doença mesmo sendo um tratamento longo. O itraconazol é um derivado triazólicos e atua inibindo a enzima fúngica P450 3A (lanosina 14 alfa-desmetilase), essencial para a conversão do lanosterol em ergosterol, um componente vital da membrana celular dos fungos ((MARTINEZ, 2006). Essa inibição desencadeia a alteração da fluidez da membrana deixando-a mais rígida e menos fluida, dificultando o transporte de nutrientes essenciais e a excreção de resíduos metabólicos, que causará a disfunção enzimática e acúmulo de toxinas, levando à morte celular por apoptose ou necrose (MARTINEZ, 2006).
A alta taxa de absorção garante uma ação rápida e eficaz no combate à infecção, minimizando o risco de reações adversas e proporcionando um tratamento mais seguro. Já em casos em que há acometimento do sistema nervoso central, o fluconazol é a droga de escolha pela sua capacidade de atravessar a barreira hematoencefálica (MOURAD e PERFECT, 2018). Além disso, o fluconazol oferece uma alternativa em casos de resistência ao medicamento de primeira linha. Sua disponibilidade em diversas formas farmacêuticas permite flexibilidade na escolha da forma de administração mais adequada para cada animal, incluindo a possibilidade de uso intravenoso em casos graves ou em animais que não toleram a administração oral (RODRIGUES et al., 2020).
CONTROLE
A determinação da cura em animais com criptococose exige uma avaliação clínica rigorosa, que inclui a ausência de sinais clínicos por um período prolongado, geralmente seis meses ou mais após o término do tratamento. Deve-se realizar cultura em diferentes locais do corpo, como sangue, urina e secreções, que deverão apresentar resultados negativos. (MARTINEZ, 2006).
Os exames laboratoriais como hemograma, bioquímica sanguínea e urinálise devem apresentar resultados dentro dos limites de referência, indicando a resolução da inflamação e da disfunção orgânica causadas pela infecção. Pode ser utilizado também exames de imagem como radiografia de crânio e/ou tórax, tomografia computadorizada e ressonância magnética para avaliar a resolução de lesões pulmonares ou demais alterações causadas pela infecção (MARTINEZ, 2006). É de suma importância que o animal seja monitorado periodicamente por um médico veterinário, com realização de exames complementares para garantir que a infecção não tenha recidiva (Herculano et al., 2020).
É imperativo promover mudanças nos hábitos, tais como restringir o acesso do gato à rua e à fonte de infecção (FARIA, 2015). Recomenda-se a instalação de telas de proteção nas janelas. Além disso, é aconselhável criar um ambiente interno enriquecedor, provendo brinquedos, arranhadores, postes para escalada, áreas de esconderijo e outras formas de entretenimento, de modo que o gato se sinta estimulado e não sinta a necessidade de explorar o ambiente externo. Ademais, caso recomendado pelo médico veterinário responsável, também deve-se considerar a castração do animal (HENZEL, 2014).
ASPERGILOSE EM CÃES DOMÉSTICOS
INTRODUÇÃO
A aspergilose se configura como uma enfermidade complexa, desencadeada por fungos pertencentes ao gênero Aspergillus. Entre as espécies mais comumente envolvidas, destacam-se Aspergillus fumigatus, A. flavus, A. niger e A. terreus. A forma clínica e a gravidade da doença são determinadas por fatores interligados, como o estado fisiológico do animal e a espécie de Aspergillus.
A aspergilose acomete principalmente aves e mamíferos. A principal via de infecção se dá por meio da inalação de conídios, estruturas reprodutivas fúngicas presentes no ar. O desenvolvimento da doença está intimamente relacionado à imunossupressão, ou seja, à redução da capacidade do sistema imunológico em combater agentes infecciosos.
O diagnóstico preciso da aspergilose depende da forma clínica da doença, abrangendo exames laboratoriais, radiológicos e histopatológicos. O tratamento é direcionado ao tipo de aspergilose e à condição do cão, geralmente incluindo antifúngicos e medidas de suporte.
ETIOLOGIA E PATOGENIA
O gênero Aspergillus, composto por mais de 180 espécies, é um importante patógeno para animais, causando a aspergilose,. Dentre as várias espécies já descritas, algumas que se destacam na medicina veterinária são A. fumigatus, A. flavus, A. niger, A. terreus e A. nidulans (JONES et al, 2000). Fatores como a imunidade do animal e a espécie de Aspergillus envolvida influenciam na forma da doença, que pode se manifestar de diversas maneiras, como na forma invasiva, cutânea ou alérgica. A. fumigatus é frequentemente encontrado em infecções localizadas, principalmente no sistema respiratório, enquanto A. terreus está mais associado à aspergilose disseminada, afetando diversos órgãos. (QUINN et al., 2005).
Caracterizados como fungos sapróbios e oportunistas, esses organismos demonstram grande capacidade de adaptação e proliferação em diversos habitats, incluindo solo, água, detritos vegetais, ar atmosférico e até mesmo alimentos (MEIRELES et al., 2009). As espécies de Aspergillus são compostas por hifas septadas, estruturas filamentosas que formam o micélio do fungo. Essas hifas são hialinas, ou seja, apresentam coloração transparente, e possuem um diâmetro médio de 8 µm. Sobre as hifas se erguem estruturas reprodutivas denominadas conidióforos, que apresentam morfologias variadas entre as espécies, podendo ser simples ou ramificados, e servem como suporte para as estruturas de reprodução assexuada do fungo. Por ser um fungo filamentoso, possui muitas vezes um aspecto macroscópico flocoso, algumas espécies apresentam coloração esverdeada como nas figuras 7 e 8. Na extremidade dos conidióforos se encontram as fiálides, células em forma de bastonete que produzem conídios, apresentados na imagem da figura 9, que são responsáveis pela reprodução assexuado do fungo e dispersão no ambiente. (QUINN et al., 2005, 5. LACAZ et al., 2002).

Figura 7. Macroscopia de Aspergillus fumigatus crescido em meio Agar Czapek Extrato de Levedura e 20% de Sacarose (CY20S) incubado em estufa a 25°C por 7 dias. Fonte: PINTO et al., 2019.

Figura 8. Macroscopia de Aspergillus fumigatus crescido em meio Agar Czapek Extrato de Levedura (CYA) incubado em estufa a 37°C por 7 dias. Fonte: PINTO et al., 2019.
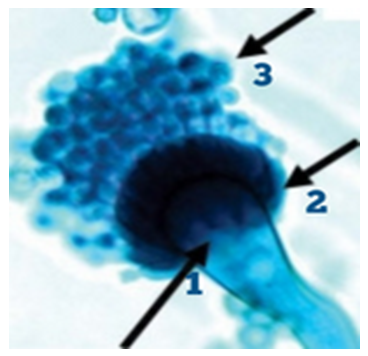
Figura 9. Microscopía óptica (1000x) de Aspergillus fumigatus. Seta 1: vesículas medindo entre 20-30 µm de diâmetro, uniseriadas, sustentam apenas fiálides de 6-8 µm apontadas pela seta 2, dão origem à coluna de conídios. Seta 3: conídios esféricos a subesferoidais de 2,5-3,0 µm de diâmetro com parede finamente rugosa a espinhosa. Corante: Lactofenol Azul de Algodão. Fonte: PINTO et al., 2019.
A principal via de entrada é a inalação de esporos presentes no ar e, embora com menor frequência, pode ocorrer a ingestão de esporos contaminados em alimentos ou água que pode levar à aspergilose pulmonar ou gastrointestinal. Já o trauma tecidual, como feridas abertas ou queimaduras, pode fornecer uma porta de entrada para o fungo, resultando em aspergilose cutânea ou disseminada (QUINN et al., 2005). A capacidade do Aspergillus spp. em invadir o organismo e causar doenças está intimamente relacionada à virulência da espécie fúngica envolvida e à dose infectante, ou seja, a quantidade de conídios inalados (HARKI, 2003).
Na variante não invasiva da aspergilose nasal, observa-se a formação de um aspergiloma que se instala na cavidade nasal, sem, no entanto, invadir a mucosa. Essa forma, pouco frequente em cães, é comum em humanos (BURBIDGE et al.,1997). Já a variante invasiva, a mais comum em cães, apresenta lesões que, embora restritas à cavidade nasal e seios paranasais, causam devastação da mucosa e afetam os tecidos moles periorbitais e ósseos (BRAY et al., 1998; BUTTERWORTH et al., 1995).
Todavia, PEETRS e colaboradores (2005) caracterizaram em um estudo, por histologia, histoquímica e imunohistoquímica, o fenótipo e a distribuição dos leucócitos na mucosa nasal de cães com aspergilose na cavidade nasal e seio frontal, sendo assim, obtiveram um predomínio de plasmócitos IgG, em detrimento de plasmócitos IgA e IgM, assim como um número significativo de macrófagos e células dendríticas expressando moléculas MHC classe II, macrófagos e neutrófilos expressando antígeno L1 e um mix de células T CD4 e CD8, além disso, uma ausência de estruturas fúngicas que invadissem a mucosa, o que assemelha à sinusite fúngica crônica erosiva não invasiva descrita em pacientes humanos.
Os danos na mucosa nasal, seios paranasais, tecidos moles, entre outros, podem ser relativos aos metabólitos secundários produzidos pelos Aspergillus spp. Esses metabólitos são produzidos a partir de reações enzimáticas por meio de acetatos, mevalonatos, malonita e outros aminoácidos, também, são conhecidos como micotoxinas (SEYEDMOUSAVI et al., 2015).
Em um estudo conduzido por REEVES e colaboradores (2004) foi usado um modelo de inseto para avaliar a gliotoxina como fator de virulência de A. fumigatus in vivo, os resultados confirmam que essa micotoxina produzida por A. fumigatus, atua como agente imunossupressor. Além disso, reduz o batimento ciliar e danifica o epitélio respiratório, portanto, um facilitador da permanência do patógeno nos tecidos, isso não restringe a gliotoxina, outros metabólitos secundários sintetizados por essa espécie fúngica podem alterar o funcionamento do aparelho mucociliar (AMITANI et al., 1995).
Na aspergilose disseminada, os esporos fúngicos são inalados e penetram nos pulmões, entrando na corrente sanguínea e causando fungemia. Após essa disseminação hematogênica, o agente alcança seus locais de predileção: espaços intervertebrais, baço, coração, ossos, glomérulos renais e olhos (BURBIDGE et al.,1997).
A formação de microembolias e estagnação do fluxo sanguíneo são fatores relevantes na patogenia da aspergilose disseminada, pois as colônias se desenvolvem em áreas com menor circulação sanguínea (BRAY et al., 1998), sendo comum a presença de broncopneumonia necrótica ou hemorrágica, com reação inflamatória aguda e neutrofílica, e trombose nos vasos da periferia, levando a infarto pulmonar (LACAZ et al., 2002). Apesar da aspergilose disseminada em humanos ser normalmente ocasionada por falhas na resposta imune, ou seja, nas células de defesa como macrofágos e neutrófilos, esse tipo de apresentação nos cães permanece incerto em muitos casos (ELAD, 2019).
A. terreus é uma das espécies que mais estão relacionadas a apresentação disseminada da doença, de tal modo, sabe-se que essa espécie é capaz de produzir os chamados esporos acessórios, os mesmos são conídios que crescem diretamente nas hifas em culturas e, em especial, nos tecidos infectados, o que facilita a disseminação hematógena. Posteriormente, os conídios obstruem capilares e provocam lesões em órgãos alvos cuja circulação sanguínea é reduzida (KABAY, et al., 1985). Os fatores de virulência do A. terreus incluem a aderência, viabilidade, rápido potencial de germinação e menor quantidade de ergosterol na membrana celular (DEAK et al., 2009).
No entanto, em cães a aspergilose nasossinusal é a forma mais diagnosticada (SEYEDMOUSAVI et al., 2015). Mesmo que alguns estudos citam a citocina IL10 como um fator imunossupressor local importante para a restrição da doença em cavidade nasal, devido ao controle inflamatório feito por essa citocina, com consequente, limitação da extensão da lesão tecidual, esse mediador químico está relacionado a cronificação da doença e predomínio da resposta imune Th (TOMEE et al., 2000; VANHERBERGHEN et al.,2012).
EPIDEMIOLOGIA
Ainda que a aspergilose acometa diversas espécies de animais, domésticos, silvestres a seres humanos e outros primatas, os cães são os mais afetados pela doença. Dessa forma a infecção em raças de cães dolicocefálicos e mesocefálicos é mais relatada que em braquicefálicos, assim como a predisposição das raças: Pastor Alemão, Golden Retriever e Rottweiler. O cão que possui a cavidade nasal mais alongada, ao farejar, tem um contato maior com possíveis fontes de contaminação, logo, mais probabilidade de aspirar os conídios. A faixa etária destes canídeos pode variar e contemplar filhotes, adultos e idosos, mas é prevalente em animais de 1 a 7 anos de idade. (JERICÓ et al., 2015; SEYEDMOUSAVI et al., 2015).
Corpos estranhos nasais, infecções nasais preexistentes, trauma resultante em lesão na mucosa nasal, drogas imunossupressoras, uso de antibióticos indiscriminadamente ou por longos períodos, condições ambientais e predisposição genética estão correlacionados ao surgimento da doença (SEYEDMOUSAVI et al., 2015). A aspergilose pode ser caracterizada em nasal, disseminada ou pulmonar, sobretudo, a forma nasal é a mais recorrente nos diagnósticos em cães, sendo o A. fumigatus a principal espécie envolvida (OLGIVIE et al., 1992; WOLF, 1992; PELT et al., 1994; PATTERSON et al., 2009; CARVALHO., 2013; SEYEDMOUSAVI et al., 2015).
SINAIS CLÍNICOS
As manifestações clínicas podem variar de acordo com o órgão acometido, a gravidade das lesões, o tempo de evolução da doença e a resistência do animal (LACAZ et al., 2002). Em cães, a aspergilose é geralmente causada pelo fungo A. fumigatus, que afeta principalmente as cavidades nasais e os seios paranasais, mas diversos outros órgãos podem ser comprometidos, incluindo os olhos (FRASER, 1996).
Animais acometidos por aspergilose podem apresentar letargia, anorexia, depressão, perda de peso, febre e sintomas musculoesqueléticos. Na aspergilose nasal, os principais sinais são espirros, epistaxe, sensibilidade nasal, rinorreia serosa, mucopurulenta ou hemorrágica (dependendo da evolução do quadro), despigmentação ou ulceração nasal e, em casos raros, osteomielite dos seios paranasais.
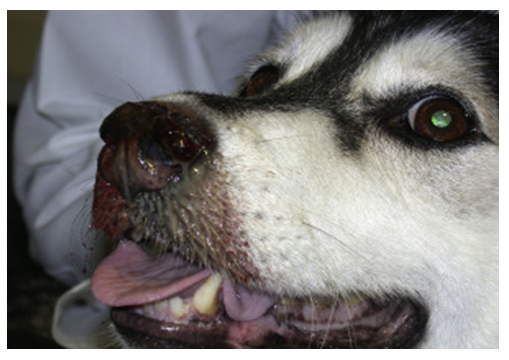
Figura 10. Cadela da raça “Husky Siberiano” de 5 anos de idade com epistaxe, secreção nasal mucopurulenta e perda da pigmentação no plano nasal. O diagnóstico foi aspergilose sinonasal. Fonte: Cohn. Doença nasal canina. Vet Clin North Am Pequeno Anim Pract. 2014; 44(1): 75-89.
Também, os cornetos nasais podem sofrer modificações na conformação ou até destruição/lise como é visto na figura 11 (PEETRS et al., 2007). Em casos em que o pulmão é comprometido, o animal apresenta sinais inespecíficos e tosse persistente que pode ocasionar quadros de pneumonia com hemoptise (TEIXEIRA, 2012; CARVALHO, 2013). Em situações ainda mais raras, a doença pode invadir o sistema nervoso central, mas raramente leva a sinais neurológicos que podem ocorrer pela lesão na placa cribiforme (FRASER, 1996, QUINN et al., 2005).
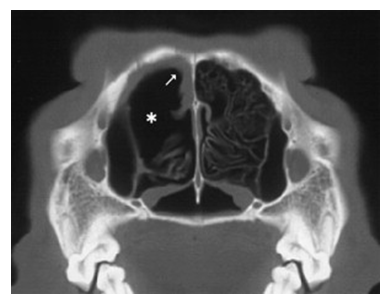
Figura 11. Imagem de TC transversa em cão diagnosticado com aspergilose sinonasal. Lise avançada de cornetos (∗) e borda de partes moles (seta) em fossa nasal esquerda. Fonte: PEETRS et al., 2007
A aspergilose disseminada é notoriamente a forma mais grave da infecção por Aspergillus spp.e representa a disseminação dessa espécie fúngica para diversos órgãos do corpo. Essa forma pode se manifestar de forma aguda, com sintomas intensos e progressão rápida, ou crônica, com sinais mais sutis e evolução prolongada por meses. Os sinais clínicos variam de acordo com os órgãos afetados, destacando a discoespondilite fúngica, uma infecção fúngica nos discos intervertebrais, que pode levar à rigidez, dificuldade de locomoção e dor intensa na coluna vertebral, claudicação por uma osteomielite fúngica. Além de poliúria, polidipsia e hematúria quando há comprometimento renal (ETTINGER et al., 2004).
DIAGNÓSTICO
Diante do histórico, anamnese e dos sinais clínicos apresentados pelos pacientes, o médico veterinário pode definir a SNA (aspergilose sinonasal) como uma suspeita clínica a ser investigada, porém outras doenças nasais compartilham de sinais clínicos semelhantes, ou seja, rinites alérgicas, infecções ocasionadas por outros microrganismos, fístulas oronasais, abscessos radiculares dentários, neoplasias nasais, rinite linfoplasmocitária idiopática, fístulas nasais e corpos estranhos nasais, sendo necessário uma avaliação criteriosa para determinar a sequência de diagnósticos diferenciais a serem excluídos diagnósticas, os equipamentos/modalidades diagnósticas disponíveis e o custo para cada uma dessas, visto que os tutores dos pacientes podem vir a ter restrições financeiras (PEETERS et al., 2007; FERREIRA., 2008; COHN., 2020).
Os exames de imagem são de grande valia para o diagnóstico das doenças nasais como as tomografias computadorizadas (TC) de crânio com ou sem contraste, ressonâncias magnéticas (RM) do crânio, radiografias de face e rinoscopia.
Segundo KUEHN (2009) a TC e a RM nasais provaram ser superiores à radiografia convencional na avaliação minuciosa das doenças da cavidade nasal, seios paranasais, região periorbital, bula timpânica, crânio e avaliação de lesão em placa cribiforme, haja vista que são modalidades com excelente capacidade para determinar a extensão e gravidade do processo patológico presente, também, é importante que os exames complementares de imagem sejam sempre realizados previamente à rinoscopia, pois a rinoscopia gera uma hemorragia capaz de alterar a análise de outros exames de imagem como os radiográficos ( COHN, 2020).
A rinoscopia pode conferir um diagnóstico da SNA sem a necessidade de mais exames, desde que seja possível a visualização das placas fúngicas nas imagens geradas pelo rinoscópio, geralmente tais placas apresentam como estruturas de aparência esverdeada aderidas à mucosa nasal, além disso, há possibilidade de coletar amostras para a realização de exame histopatológico, cultura fúngica e citologia. Porém essa última técnica possui limitações quanto ao uso em pacientes mais debilitados, há necessidade de uma anestesia geral no animal, assim como na RM e TC (PEETERS et al., 2007). É sabido que a cultura fúngica, citologia das secreções nasais, histopatologia das lesões e sorologia são métodos diagnósticos com boa especificidade e que podem ser empregados, mas exprimem uma fraca ou moderada sensibilidade (PEETERS et al., 2007; COHN, 2020; BIÉNÈS et al., 2022). No caso da cultura fúngica e de exames citológicos, a especificidade é boa para excluir diagnósticos diferenciais, mas insuficiente para confirmar o diagnóstico de aspergilose, visto que o agente etiológico é um fungo saprófito, isto é, os resultados podem resultar da microbiota normal da cavidade nasal ou da presença secundária de qualquer doença crônica da cavidade nasal que reduza os mecanismos de defesa do sistema respiratório (SHARMAN et al.,2012)
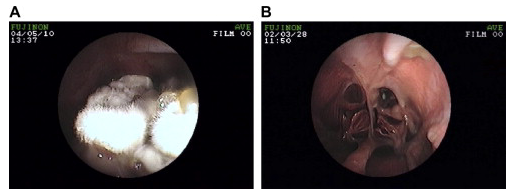
Figura 12. (A) Placa fúngica típica visualizada durante uma rinoscopia em cão com SNA. (B) A visão rinoscópica pós-tratamento da parte distal das fossas nasais em um cão com SNA, é vista lise extensa do septo nasal. Fonte: Peeters & Clercx, 2007
Em um estudo realizado por BIÉNÈS e colaboradores (2022) foi avaliada a presença do DNA fúngico por meio de qPCR quantitativo específico para A. fumigatus e Aspergillus spp. para detecção das demais espécies dentro do gênero e outras múltiplas espécies fúngicas, em amostras obtidas de cavidades nasais de cães com SNA ou outras doenças nasais, além de cães sadios, os resultados demonstram que para A. fumigatus e Aspergillus spp.a sensibilidade e especificidade variou de 65% a 100%, respectivamente, ao retirarem da amostragem os pacientes que utilizavam o Itraconazol, a sensibilidade aumentou para 86% e a especificidade para 93%, portanto, swabs nasais profundos coletados com espéculo esterilizado às cegas podem ser utilizados para a detecção, diagnóstico e tratamento da SNA, principalmente quando os métodos diagnósticos mais invasivos não estão disponíveis ou não podem ser adotados.
Em outro estudo realizado por PRIOR e colaboradores (2024) foram descritos os testes diagnósticos utilizados e seu desempenho comparativo em 475 casos no período de janeiro de 2011 a dezembro de 2021 em cães com diagnóstico de aspergilose nasossinusal (SNA) no Reino Unido, a sensibilidade dos testes complementares foi menor que as relatadas pela literatura, de tal modo que a sensibilidade foi estimada em: citologia 67%, cultura fúngica 59%, histopatologia 47% e PCR em 71%.
Em suma, as decisões de tratamento e manejo devem ser pautadas em uma combinação de métodos diagnósticos, incluindo anmenese, histórico clínico, sinais clínicos, possíveis diagnósticos diferenciais, epidemiologia da doença, recursos disponíveis e achados de imagem e testes complementares, em vez de apenas exames complementares (PRIOR et al., 2024).
TRATAMENTO
O tratamento da aspergilose em cães pode ser feito com terapia antifúngica sistêmica ou tópica, além de procedimentos cirúrgicos para a retirada das placas fúngicas. Nos casos de SNA em que não há comprometimento da placa cribiforme o tratamento tópico é o preconizado, sendo as drogas de escolha o clotrimazol ou enilconazol, ambas atuam na inibição da síntese do ergosterol na parede celular fúngica e ao serem administradas de forma tópica evitam os efeitos colaterais como; hepatotoxicidade e desconfortos abdominais. (SHARP et al., 1993; PEETERS et al., 2007).
A abordagem sistêmica é consideravelmente menos eficiente, o itraconazol (10 mg/kg via oral, 1 vez ao dia) e fluconazol (2,5 mg/kg via oral, 2 vezes ao dia) possuem uma eficácia melhor que o Cetoconazol, em média 70% dos pacientes tratados atingem a cura, a duração do tratamento pode variar de acordo com o paciente, normalmente, perdura por meses. (JERICÓ et al., 2015).
Em casos em que há comprometimento do sistema nervoso central (SNC), o fluconazol é uma melhor opção, uma vez que consegue penetrar na barreira hematoencefálica e atingir uma maior concentração a nível de SNC (PEETERS et al., 2007; FOY et al., 2010; JERICÓ et al., 2015). É importante que o pacientes sejam reavaliados após a melhora clínica e a remissão dos sinais respiratórios, contudo, o período para reavaliação pode variar conforme o tratamento utilizado, nos casos de tratamento tópicos invasivos a rinoscopia pode ser a cada 3 a 4 semanas, assim, é possível avaliar a resolução da doença e realizar as infusões medicamentosas (PEETERS et al., 2007).
Tabela 1. Dosagens de drogas antifúngicas recomendada em cães.
Drogas. Dosagem e via de administração. Período. Anfotericina B convencional 0,5 mg/kg IV A cada 48 horas, infusão lenta para uma dose cumulativa de 4-8 mg/kg Anfotericina B lipossomal 3 mg/kg/dia IV, a uma taxa superior a 90-120 mg/kg 3 vezes por semana, até 12 ciclos de tratamentos Clotrimazol 60 ml a 1% instilados nos seios nasais Por 30 a 60 minutos Enilconazol 10 mg/kg instilados nos seios nasais. Solução a 10% diluída 1:1 com água A cada 12 horas por 14 dias. Itraconazol 2,5 mg/kg ou 5 mg/kg via oral com alimento A cada 12 horas ou a cada 24 horas de 15 a 30 dias Posaconazol De 5 a 10 mg/kg A cada 12 horas ou a cada 24 horas Voriconazol 4 ou 5 mg/kg via oral. A cada 12 horas
Fonte: Adaptado de SEYEDMOUSAVI et al., 2015; MATHEWS et al., 1998; SMITH et al., 1998.
CONTROLE
Aspergillus spp. está amplamente disseminado no ambiente, formas efetivas para impedir que cães entrem em contato com o agente são desconhecidas (SEYEDMOUSAVI et al., 2015).
A transmissão da aspergilose entre os pacientes infectados e indivíduos sadios têm pouca relevância clínica e epidemiologia, uma vez que no tecido animal o Aspergillus spp.cresce usualmente sem o desenvolvimento de conídios, além disso, nos casos em que há esse crescimento, o seu número é limitado, ademais, as espécie de Aspergillus presentes no ambiente liberam uma maior quantidade de conídios, o que denota um maior risco (SEYEDMOUSAVI et al., 2015). Também, alguns estudos evidenciam que o uso de fungicidas no controle de pragas agrícolas podem estar associados aos mecanismos de resistência dos fungos, HOWARD e colaboradores (2006) relataram resistência à triazólicos em infecções envolvendo humanos, assim como uma mutação no gene fúngico Cyp51A que codifica a enzima Esterol 14-desmetilase, ao passo que em outro estudo feito por VERWEIJ e colaboradores (2009) A. fumigatus cultivados a partir do solo e de compostos orgânicos, demonstraram ser previamente resistentes aos fungicidas azólicos e geneticamente semelhantes aos isolados clinicamente resistentes a triazólicos.
Em contraste, pacientes sem terapia prévia com azólicos apresentaram a aspergilose resistente a fluconazol, itraconazol e voriconazol. Assim, é possível que a seleção de fungos resistentes a azólicos no ambiente seja um risco para os indivíduos suscetíveis que inalarem tais conídios (SEYEDMOUSAVI et al., 2015).
SEYEDMOUSAVI e colaboradores (2015) consideram que os dados epidemiológicos, diretrizes e normas para o diagnóstico e tratamento das aspergiloses em animais são ineficientes e preconizam uma rede de vigilância para isolamento e identificação das espécies de Aspergillus, assim, quantificar e caracterizar a distribuição geográfica e as manifestações clínicas associadas nos animais.
Todavia, mesmo com toda a relevância das infecções fúngicas na saúde humana e animal, a micologia médica dispõe de discretos financiamentos em contraste a outras doenças infecciosas. Por exemplo, em nações ricas como a do Reino Unido os investimentos de fontes de financiamento públicas e filantrópicas totalizando ao menos 48,4 milhões de libras após a análise de 171 estudos considerados relevantes ou que possuíam menções específicas a patógenos fúngicos no período de 1997 a 2010, o que representa em torno de 2% do total de investimentos relacionados a todas as doenças de origem infecciosas.
Paralelamente, a Organização Mundial de Saúde (OMS) não possui qualquer programa acerca de infecções fúngicas, além disso, as agências de saúde pública, ou seja, os órgãos públicos responsáveis pela promoção e proteção da saúde da população realizam limitada ou nenhuma vigilância micológica, raras são as exceções como a dos Centros de Controle e Prevenção de Doenças (CDC) dos Estados Unidos da América (EUA) (BROWN et al., 2012; HEAD et al., 2014).
CONSIDERAÇÕES FINAIS
Ambos Cryptococcus spp. e Aspergillus spp. possuem capacidade de infectar primariamente cavidade nasal de animais e humanos, porém apenas o primeiro parece ter importância na transmissão direta dos animais para o homem. A criptococose é uma doença recorrente em felinos domésticos e que pode estar subestimada no país, nenhum ou raros são os indicadores de saúde na literatura quanto à incidência, prevalência e letalidade
O diagnóstico da aspergilose em cães é mais desafiador sendo importante que na ausência da rinoscopia com a visualização das placas fúngicas, o médico veterinário combine os diferentes métodos diagnóstico relatados indicados pela literatura científica a fim de estabelecer um diagnóstico final mais assertivo. Ademais, a resistência a antifúngicos é um problema de saúde global que deve ser melhor descrita e estudada.
REFERÊNCIAS
ABBAS, Abul K. Imunologia básica. 3. ed. Rio de Janeiro: Elsevier Brasil, 2007.
BENTLEY R. T., TAYLOOR A. R., THOMOVSKY S. A., Fungal Infections of the Central Nervous System in Small Animals: Clinical Features, Diagnosis, and Management. Vet Clin North Am Small Anim Pract. 2018; 48 (1): 63-83. doi:10.1016/j.cvsm.2017.08.010.
BERRY W. L, LEISEWITZ A. L.,. Multifocal Aspergillus terreus discospondylitis in two German Shepherd dogs. J South African Vet Assoc. 1996; 67 (4):222-8.
BIÉNÈS T., VANGRINSVEN E., FASTRÈS A., GARIGLIANY M. M., BILLEN F., & CLERCX C. (2022). Utility of fungal polymerase chain reaction on nasal swab samples in the diagnosis and monitoring of sinonasal aspergillosis in dogs. Journal of veterinary internal medicine, 36(4), 1295–1302. https://doi.org/10.1111/jvim.16441.
BOAVENTURA, L. P. Mecanismos de resposta imune à infecção por Cryptococcus gattii e sua evasão do sistema imunológico do hospedeiro. Belo Horizonte, 2013. Trabalho de Especialização em Microbiologia, Instituto de Ciências Biológicas, Universidade Federal de Minas Gerais.
BRAY, J. P., et al.,. Treatment of canine nasal aspergillosis with a new non-invasive technique. Failure with itraconazole. J. Small Anim. Pract., v. 39, n. 5, p. 223-226, 1998.
BROWN G. D., DENNING D. W., GOW N. A., LEVITZ S. M., NETEA M. G, WHITE T. C. Hidden killers: human fungal infections. Sci Transl Med. 2012;4(165):165rv13. doi:10.1126/scitranslmed.3004404
BURBIDGE, H. M., et al.,. Canine nasal aspergillosis: results of treatment using clotrimazole as a topical agent. Aust. Vet. Pract., v. 27, n. 2, p. 79-83, 1997.
BUTTERWORTH S. J., et al.,. Multiple discospondylitis associated with Aspergillus species infection in a dog. Vet. Rec., v. 136, n. 2, p. 38-41, 1995.
CARVALHO G. S.,. Aspergilose pulmonar em cão. 2013. Monografia (Graduação em Medicina Veterinária) – Centro de Saúde e Tecnologia Rural, Universidade Federal de Campina Grande, Patos, PB.
COELHO, C.; BOCCA, A.; CASADEVALL, A. As ferramentas para a virulência de Cryptococcus neoformans. Adv Appl Microbiol. 2014; 87: 1–41.
COHN, Canine Nasal Disease: An Update,Veterinary Clinics of North America: Small Animal Practice, volume: 50, Issue 2, 2020, p. 359-374, ISSN 0195-5616. doi.org/10.1016/j.cvsm.2019.11.002.
CORREA, J.E. The Dog’s Sense of Smell. Alabama Cooperative Extension System – Alabama A & M University and Auburn University, UNP-0066, 2011 LIGHT, G.S. Respiratory System. In: HUDSON, L.C.; HAMILTON, W.P. Atlas of Feline Anatomy for Veterinarians. Philadelphia: Saunders Company, 1993. p 135- 148.
CRUZ, L. C. H. Micologia Veterinária. 2. ed. Rio de Janeiro: Revinter, 2010.
Deak et al. (2009) Aspergillus terreus Accessory Conidia Are Unique in Surface Architecture, Cell Wall Composition and Germination Kinetics. PLOS ONE 4(10): e7673. doi: 10.1371/journal.pone.0007673.
ESPOSTO M. C., COGLIATI M., TORTORANO A. M., VIVIANI M. A. Electrophoretic karyotyping of Cryptococcus neoformans AD-hybrid strains. Mycoses. 2009; 52 (1): 16-23. doi:10.1111/j.1439-0507.2008.01532.
ELAD. Disseminated canine mold infections. The Veterinary Journal,Volume 243,2019,Pages 82-90. ISSN 1090-0233. doi: 10.1016/j.tvjl.2018.11.016.
EURELL, Jo Ann; FRAPPIER, Brian L. Histologia veterinária de Dellmann. 6. ed. Manole, 2012.
ETTINGER, J. S., FELDMAN, C. E.,. Tratado de medicina interna veterinária: Doenças do cão e do gato. Vol. 1. 5 ed. Rio de Janeiro: Guanabara Koogan, 2004.
FARIA, R. O. Fungos dimórficos e relacionados com micoses profundas. In: GERICÓ, M. M.; ANDRADE NETO, J. P.; KOGIKA, M. M. (Org.). Tratado de medicina interna de cães e gatos. Rio de Janeiro: Roca, p. 2395-2419, 2015.
FIRACATIVE C., LIZARAZO J. INAIT-ZARAGOZÍ M.T., CASTAÑEDA E. The status of cryptococcosis in Latin America. Memórias do Instituto Oswaldo Cruz, v.113, n.7, p.1- 23, 2018.
FOY S. D., LAUREN A. Trepanier,Antifungal Treatment of Small Animal Veterinary Patients, Veterinary Clinics of North America: Small Animal Practice. Volume 40, Issue 6,2010,p. 1171-1188. doi.org/10.1016/j.cvsm.2010.07.006.
FRANZOT S. P., SALKIN, I. F., & CASADEVALL A. (1999). Cryptococcus neoformans var. grubii: separate varietal status for Cryptococcus neoformans serotype A isolates. Journal of Clinical Microbiology, 37(3), 838-840. doi:10.1128/JCM.37.3.838-840.1999.
GUARNER J., BRANDT M. E.,. Histopathologic diagnosis of fungal infections in the 21st Century. Clinical Microbiology Reviews, v. 24, n. 2, p. 247-280, Apr 2011.
GUILLOT J.,. Fungal infections in animals: a patchwork of different situations. Medical Mycology, v.56, n.8, p.65–187, 2018.
GREENE C. E., WATSON A. D. J.,. Infectious Diseases of the Dog and Cat. 2. ed. Philadelphia: WBSaunders, 1998.
HARE, W.C.D. Sistema respiratório. In: GETTY, R. Anatomia dos Animais Domésticos. Rio de Janeiro, Guanabara Koogan, 5 ed., v.1, 1986a. p 108-135
HARKIN, K. R.,. Aspergillosis: an overview in dogs and cats. Vet. Med., v. 98, n. 7, p. 602-618, 2003.
HENZEL, M. S. O enriquecimento ambiental no bem-estar de cães e gatos. Universidade Federal do Rio Grande do Sul, Porto Alegre, RS, Brasil, 2014.
HERCULANO, L. F. Silva; GALINDO, V. Reis; CAVALCANTE NETO, T. Saraiva; SANTOS, L. F. Lopes. Criptococose cutânea canina: relato de caso. Medicina Veterinária (UFRPE), Recife, v. 14, n. 4, p. 268-276, 2020.
HIRSH, D. C.; ZEE, Y. C.,. Microbiologia Veterinária. Rio de Janeiro-RJ. Guanabara Koogan, 2003.
HNILICA K. A., & MEDLEAU L. (2012). Dermatologia de pequenos animais: atlas colorido e guia terapêutico. Roca.
HOWARD S. J., WEBSTER I., MOORE C. B., GARDINER R. E., PARK S., PERLIN D. S., & DENNING, D. W. (2006). Multi-azole resistance in Aspergillus fumigatus. International Journal of Antimicrobial Agents, 28 (5), 450–453. doi:10.1016/j.ijantimicag.2006.08
JONES, T. C. HUNT, R. D., KING, N. W. Patologia Veterinária. 6. ed. São Paulo: Malone, 2000.
KABAY et al.,. 1985. The pathology of disseminated Aspergillus terreus. infection in dogs.pdf
KUEHN. (2009) Rhinitis in the dog. In: Kirk’s Current Veterinary Therapy XIV. Eds J. Bonagura and D. Twedt. Saunders Elsevier, St. Louis, MO, USA. pp 609–615.
LACAZ, C. S., et al.,. Tratado de Micologia Médica – Lacaz. 9. ed. São Paulo: Sarvier, 2002.
LIMA Q. P., et al.,. (2018). Criptococose em gato – Relato de caso. Revista Científica de Medicina Veterinária, n°30, janeiro de 2018. Periódico Semestral. Adamantina, São Paulo. ISSN: 1679-7353..
MA, H.; MAY, R. C. Virulence in Cryptococcus Species. In: LASKIN, A. I.; SARIASLANI, S.; GADD, G. M. editors: Adv. in App. Microb., v. 67, Burlington: Academic Press, p. 131-190, 2009.
MARTINEZ, R. (2006). Atualização no uso de agentes antifúngicos. Jornal Brasileiro de Pneumologia, 32(5), 449–460. Recuperado de https://doi.org/10.1590/S1806-37132006000500013
MARTINS S. M. L., WANKE B., LAZÉRA S. M., TRILLES L., BARBOSA G. G, MACEDO et al., (2011). Genótipos de Cryptococcus neoformans e Cryptococcus gattii como agentes de criptococose endêmica em Teresina, Piauí (Nordeste do Brasil). Memórias Do Instituto Oswaldo Cruz , 106 (6), 725–730. doi.org/10.1590/S0074-02762011000600012.
MATHEWS, K.G.; DAVIDSON, A.P.; KOBLIK, P.D., et al. Comparison of topical administration of clotrimazole through surgically placed versus nonsurgically placed datheters for treatment of nasal aspergilosis in dogs: 60 cases (1990-1996). J Am Vet Med Assoc, v.213, n.4, p.501-506, 1998.
MCGILL S., et al., Cryptococcosis in domestic animals in Western Australia: a retrospective study from 1995–2006. Medical Mycology, v. 47, n. 6, p. 625-639, 2009. Disponível em: https://doi.org/10.1080/13693780802512519.
MEIRELES, M. C. A.; NASCENTE, P. S. Micologia Veterinária. Pelotas: Ed. Universitária UFPEL, 2009.
MOURAD A., PERFECT J. R. Present and Future Therapy of Cryptococcus Infections. Journal of Fungi (Basel, Switzerland), v.4, n.3, p.79-88, 2018.
MÜLLER M.; NISHIZAWA M. A criptococose e sua importância na Medicina Veterinária. Revista de Educação Continuada em Medicina Veterinária e Zootecnia do CRMV-SP, v. 15, n. 1, p. 24-29, 2017. Disponível em: https://doi.org/10.36440/recmvz.v15i1.36761.
NEDEL W. L., PASQUALOTTO A. C. Treatment of infections by cryptic Aspergillus species. Mycopathologia. 2014;178(5-6):441-445. doi:10.1007/s11046-014-9811-z.
OGILVIE G. K., LARUE S. M.,. Canine and feline nasal and paranasal sinus tumors. Vet Clin North Am Small Anim Pract. 1992. doi:10.1016/s0195-5616(92)50305-9
PATTERSON K., STREK M. E. Allergic bronchopulmonary aspergillosis. Proc Am Thorac Soc. 2010;7(3):237-244. doi:10.1513/pats.200908-086AL
PEETERS et al.,. .Distribution of Leucocyte Subsets in the Canine Respiratory Tract, Journal of Comparative Pathology, volume 132, Issue 4,2005,p.Pages 261-272, ISSN 0021-9975. doi:/10.1016/j.jcpa.2004.10.003.
PEETRS et al.,. Update on canine sinonasal aspergillosis. Vet Clin North Am Small Anim Pract. 2007;37(5):901-vi. doi:10.1016/j.cvsm.2007.05.005.
PEETERS et al.,. An immunohistochemical study of canine nasal aspergillosis J Comp Pathol. 2005 132 4 283288
PERFECT JR. Cryptococcus neoformans: a sugar-coated killer with designer genes. FEMS Immunol Med Microbiol. 2005 set;45(3):395-404. DOI: 10.1016/j.femsim.2005.06.005. PMID: 16055314.
Peeters et al.,. Quantification of mRNA encoding cytokines and chemokines in nasal biopsies from dogs with sino-nasal aspergillosis. Vet Microbiol. 2006;114(3-4):318-326. doi:10.1016/j.vetmic.2005.11.065.
PIMENTA P. et al.,. Blepharitis due to Cryptococcus neoformans in a cat from northen Portugal. Journal of Feline Medicine and Surgery Open Reports, v. 1, n. 2, 2015. Disponível em: https://journals.sagepub. com/doi/10.1177/2055116915593963.
PINTO, P. N., RODRIGUES, M. P, BISCOTO, G. L., SALVATO, L. A., DIAS, R. R. D. S., NOGUEIRA, M. M., ECCO, R., AZEVEDO, M.I., Keller, K. M. (2019). Atlas de Micologia Médica Veterinária. Cadernos Técnicos de Veterinária e Zootecnia, v. 2019, n. 94, dez. 2019.
PRIOR C., SWALES H., SHARMAN M., et al. Diagnostic findings in sinonasal aspergillosis in dogs in the United Kingdom: 475 cases (2011-2021). J Small Anim Pract. Published online April 28, 2024. doi:10.1111/jsap.13736.
QUEIROZ J. P. A. F. et al. Criptococose: uma revisão bibliográfica. Atlas Veterinária Brasileira, v. 2, n. 2, p. 32-28, 2008. Disponível em: https://doi.org/10.21708/avb.2008.2.2.699.
QUINN P. J., MARKEY B. K., CARTER, M. E., DONELLY, W. J., LEONARD, F. C.,Microbiologia veterinária e doenças infecciosas. Porto Alegre: Artmed, 2005.
REECE, W.O. Dukes Fisiologia dos Animais Domésticos. 12ª ed. Guanabara Koogan, Rio de Janeiro, 2006. 926p.
REEVES EP, Messina CG, Doyle S, Kavanagh K. Correlação entre a produção de gliotoxina e virulência de Aspergillus fumigatus em Galleria mellonella. Micopatologia. 2004; 158(1):73-79. doi:10.1023/b:myco.0000038434.55764.16.
RODRIGUES O. T ., GODOY, R. J., MALANDRIM P., SOSSAI V., DE SOUZA, T. M. Criptococose em felino: relato de caso. Revista de Educação Continuada em Medicina Veterinária e Zootecnia do CRMV-SP, São Paulo, v.18, n.3, 2020. Doi. 0.36440/recmvz.v18i3.38105.
SANCHES P. P., COUTINHO, S. D. A.., Aspergilose em cães – revisão. Revista do Instituto de Ciências da Saúde, v. 25 (4), p. 391-397, 2007.
SAUNDERS et al.,. (2002). Computed tomographic findings in 35 dogs with nasal aspergillosis. Veterinary Radiology and Ultrasound, 43(1), 5–9.
SEVERO C. B., GAZZONI A. F., & SEVERO, L. C.. (2009). Capítulo 3: criptococose pulmonar. Jornal Brasileiro De Pneumologia, 35(11), 1136–1144. https://doi.org/10.1590/S1806-37132009001100012.
SEYEDMOUSAVI S., GUILLOT J., ARNÉ P. et al.,. ‘. Med Mycol. 2015; 53 (8): 765-797. doi:10.1093/mmy/myv067.
SHARMAN M. J., & MANSFIELD C. S. (2012). Aspergilose nasossinusal em cães: uma revisão. Jornal de Prática de Pequenos Animais, 53 (8), 434–444. DOI:10.1111/j.1748-5827.2012.01245.x.
SHARP et al.,. (1993), Treatment of Canine Nasal Aspergillosis with Enilconazole. Journal of Veterinary Internal Medicine, 7: 40-43. https://doi.org/10.1111/j.1939-1676.1993.tb03167.x
SILVA A. C. S. da. Prevalência de turbinados aberrantes e desvio do septo nasal em Bouledogues Franceses. 2021. Dissertação (Mestrado Integrado em Medicina Veterinária) – Escola de Ciências e Tecnologia, Universidade de Évora, Évora, Portugal.
SJAJASTAD O.V., Sand O. & Hove K. Phisiology of Domestic Animals. 2nd Oslo, Scandinavian Veterinary Press, 2010. 804p.
SMITH S.A., ANDEWS, G., BILLER D.S.,. Management of nasal aspergilosis in a dog with a single, noninvasive intranasal infusion of clotrimazole. J Am Anim Hosp Assoc, v.34, n.6, p.487-492, 1998.
TEIXEIRA, F. S.,. Ocorrência de aspergilose pulmonar em cães com sintomatologia respiratória atendidos no HCV – UFRGS, Porto Alegre. 58 f. Dissertação (Mestre em Ciências Veterinárias) – Universidade Federal do Rio Grande do Sul, Faculdade de Medicina Veterinária, Porto Alegre-RS, 2012.
TOMEE J.F., KAUFFMAN H.F.,. Clin Exp Alergia. 2000; 30(4):476-484. DOI:10.1046/j.1365-2222.2000.00796.x
VANHERBERGHEN et al.,. Analysis of gene expression in canine sino-nasal aspergillosis and idiopathic lymphoplasmacytic rhinitis: a transcriptomic analysis. Vet Microbiol 2012 157 1–2 143151
VAN PELT, D. R., & MCKIERNAN, B. C. (1994). Pathogenesis and Treatment of Canine Rhinitis. Veterinary Clinics of North America: Small Animal Practice, 24(5), 789–806. doi:10.1016/s0195-5616(94)50101-3
VENUTO M. A., MOUTA, A. N., HONORATO R. A., FONSÊCA V. D. A., CAVALCANTE A. R. F., MAGALHÃES C. L., MELO S. H. C.,. Criptococose respiratória e cutânea em gato de vida livre da cidade de Sobral/CE. Ciência Animal, Sobral, v. 33, n. 1, p. 152-160, jan./mar., 2023. Disponível em: https://revistas.uece.br/index.php/cienciaanimal/article/view/10498. Acesso em: 06 abr. 2024.
VERWEIJ P. E., SNELDERS E., KEMA G. H., MELLADO E., MELCHERS W. J.,. Azole resistance in Aspergillus fumigatus: a side-effect of environmental fungicide use?. Lancet Infect Dis. 2009;9(12):789-795. doi:10.1016/S1473-3099(09)70265-8.
WOLF A. M.,. Fungal diseases of the nasal cavity of the dog and cat. Vet Clin North Am Small Anim Pract. 1992; 22 (5): 1119-1132. doi:10.1016/s0195-5616(92)50304-7.
YER K. R., REVIE N. M., FU C. et al.,. Treatment strategies for cryptococcal infection: challenges, advances and future outlook. Nat Rev Microbiol 19, 454–466 (2021). https://doi.org/10.1038/s41579-021-00511-0.
ZANATTA, Rosana. Aspectos radiográficos e tomográficos de felinos (Felis catus – Linnaeus, 1775) adultos acometidos por rinite e sinusite. 2007. Dissertação (Mestrado em Medicina Veterinária) – Universidade Estadual Paulista “Júlio de Mesquita Filho”, Faculdade de Ciências Agrárias e Veterinárias, Câmpus de Jaboticabal, Jaboticabal, São Paulo, Brasil.
