CLINICAL EFFECTS OF THE USE OF PROBIOTICS IN CRITICAL ADULT PATIENTS: AN INTEGRATIVE REVIEW
REGISTRO DOI: 10.5281/zenodo.11214868
Raquel Bezerra Barbosa de Moura1, Pollyana Paula Almeida de Araújo2, Gina Araújo Martins Feitosa3, Caroline Sousa Cabral4, Edcleide Oliveira dos Santos Olinto5, Geovanna Torres de Paiva6, Aline Honor Lacerda7, Débora Silva Cavalcanti8, Renan Gondim Araújo9, Flávia Nunes de Lima Barroso10
RESUMO
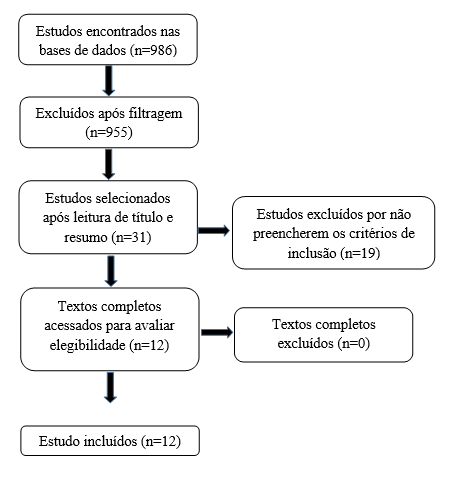
Os pacientes críticos ocorrem diversas alterações fisiopatológicas incluindo modificação da microbiota intestinal, transformando o microbioma em um patobioma sendo um fator predisponente a infecções, refletindo em danos ao epitélio intestinal, absorção de bactérias endógenas e alterações na função imunológica. O uso de probióticos em pacientes de terapia intensiva tem sido investigada pela possibilidade de modular a microbiota intestinal, produzindo efeitos benéficos na integridade e função intestinal, bem como no sistema imunológico. Dessa forma o presente estudo teve como objetivo investigar os efeitos clínicos da administração de probióticos no tratamento de pacientes submetidos a cuidados intensivos. Realizou-se um estudo de revisão integrativa, a partir de levantamento de artigos científicos nas bases de dados USA National Library of Medicine (MEDLINE/PubMed), Literatura Latino-Americana e do Caribe em Ciências da Saúde (LILACS); e na biblioteca eletrônica Scientific Eletronic Library Online (SciELO), publicados nos últimos 10 anos (2013-2023), utilizando os descritores “Cuidados intensivos”, “doença crítica” e “probióticos”, associados pelos operadores booleanos “AND” e “OR”. Foram identificados 986 artigos, sendo 31 selecionados após leitura do título e resumo e excluídos 19 por não atenderem critérios de inclusão, totalizando um final de 12 artigos para leitura na íntegra, dos quais todos foram incluídos nos resultados. Dos 12 estudos, 8 demonstraram benefícios clínicos de alguma natureza, e 1 relatou maior incidência de efeitos adversos nos pacientes que receberam probióticos. Observa-se elevada heterogeneidade metodológica dos trabalhos, no que diz respeito ao tipo de probiótico e a duração do tratamento, sendo necessário mais estudos com amostras maiores e terapêuticas mais homogêneas que possam confirmar ou refutar os resultados encontrados.
Palavras-chave: Probióticos. Cuidados intensivos. Doença crítica.
1 INTRODUÇÃO
Os pacientes críticos são caracterizados por um quadro clínico instável, resultado de diversas alterações fisiopatológicas, com alto risco de morte ou complicações graves, exigindo cuidados de saúde contínuos e especializados (AGUDELO-OCHOA et al., 2020). A microbiota intestinal desses pacientes é alterada por fatores causais endógenos e exógenos, como estresse metabólico, hipotensão, uso de drogas vasoativas, opiáceos, antibióticos e impacto metabólico de procedimentos cirúrgicos. O estado de jejum, comum em pacientes internados em terapia intensiva, também contribui para modificação do microbioma em um patobioma, refletindo em piores desfechos clínicos e nutricionais (AGUDELO-OCHOA et al., 2020; POMAR & ARNAIZ, 2018; AKRAMI & SWEENEY, 2018).
A presença de doença crítica leva a um quadro clínico de disbiose em vários sistemas, incluindo os sistemas respiratório, tegumentar e gastrointestinal. Na microbiota intestinal, observa-se um desequilíbrio na qualidade e quantidade de bactérias intestinais, com redução do número de Lactobacillus e Bifidobacterium, enquanto ocorre aumento de bactérias patogênicas oportunistas. Nesse cenário, a microbiota atua como fator predisponente a infecções, refletindo em danos ao epitélio intestinal, absorção de bactérias endógenas e alterações na função imunológica (AGUDELO-OCHOA et al., 2020; POMAR & ARNAIZ, 2018; AKRAMI & SWEENEY, 2018; PETROF et al., 2012).
Conforme mencionado anteriormente, o uso de antibióticos configura-se como agente etiológico de alterações na microbiota normal. No entanto, os antibióticos são um dos medicamentos mais prescritos na terapia intensiva e um dos principais efeitos colaterais é a diarreia, que por sua vez aumenta os problemas de saúde e a mortalidade (GOODMAN et al., 2021). Além disso, os antibióticos modificam a diversidade de microrganismos presentes no intestino, o que pode causar em um ecossistema restrito, com colonização de espécies nocivas, como Clostridium difficile (LIMA JÚNIOR et al., 2019).
Os probióticos têm sido uma das estratégias utilizadas para controlar a diarreia. São definidos como microrganismos vivos que, quando administrados em quantidades suficientes, produzem efeitos benéficos no hospedeiro (HILL et al., 2014; MALNIR et al., 2021). Tais efeitos são atribuídos a mecanismos que melhoraram a permeabilidade da barreira intestinal, síntese de elementos celulares e metabólicos, aglutinação à mucosa, inibição sincrônica da adesão de micróbios patogênicos e modulações imunológicas (SHIMIZU, OJIMA & OGURA, 2021; BERMUDEZ-BRITO et al., 2012). As cepas de Lactobacillus são as mais estudadas como probióticos no tratamento de distúrbios gastrointestinais, no manejo de diarreias causadas pelo uso de antibióticos e em quadros clínicos de infecções, como pneumonia associada à ventilação mecânica (PAV) e sepse (KHAILOVA et al., 2013).
A suplementação de probióticos em pacientes de terapia intensiva tem sido investigada pela possibilidade de modular a microbiota intestinal, produzindo efeitos benéficos na integridade e função intestinal, bem como no sistema imunológico. Apesar disso, há poucas evidências na literatura sobre o uso de probióticos nesses pacientes (PETROF et al., 2012). Para destacar essas descobertas, esta revisão descreve a compreensão de investigações clínicas sobre os efeitos da administração de probióticos no tratamento de adultos gravemente doentes em terapia intensiva.
2 METODOLOGIA
O estudo trata-se de uma revisão integrativa, cuja metodologia foi subdividida em seis etapas: elaboração da questão norteadora; busca na literatura; coleta de dados; análise crítica dos estudos incluídos; discussão dos resultados e apresentação da revisão (SOUZA, SILVA & CARVALHO, 2010). A questão norteadora, elaborada com base na estratégia PICOT (CALO, FERREIRA & PATINO, 2020), foi a seguinte: quais os efeitos clínicos da suplementação de probióticos em pacientes críticos adultos?
Foi realizado levantamento de artigos científicos nas seguintes bases de dados: USA National Library of Medicine (MEDLINE/PubMed), Literatura Latino-Americana e do Caribe em Ciências da Saúde (LILACS); e na biblioteca eletrônica Scientific Eletronic Library Online (SciELO), utilizando os descritores “Cuidados intensivos”, “doença crítica” e “probióticos”, associados pelos operadores booleanos “AND” e “OR”. Foram incluídos neste estudo os artigos originais, disponibilizados na íntegra, publicados nos últimos 10 anos (2013-2023), aplicados em pacientes críticos adultos, nos idiomas inglês, espanhol ou português. As informações relevantes dos artigos foram extraídas, descritas em tabelas e interpretadas à luz da literatura. Foram excluídos os artigos de revisão, carta ao editor e relato de caso.
Os artigos encontrados foram categorizados por níveis de evidência, conforme Quadro 01.
Quadro 1. Classificação do nível de evidência utilizado nos estudos incluídos.
Nível de Evidência Estudos I Revisão sistemática ou metanálise de ensaios clínicos randomizados e controlados II Ensaio clínico randomizado controlado III Ensaios clínicos sem randomização IV Estudos de coorte e de caso-controle V Revisão sistemática de estudos descritivos e qualitativos VI Estudo descritivo ou qualitativo VII Opinião de autoridades e/ou relatório de comitês de especialistas
3 RESULTADOS E DISCUSSÃO
Após a definição dos critérios de busca, foram identificados 986 artigos nas bases de dados selecionadas para a realização desta pesquisa. Em seguida, com o cumprimento de todas as etapas metodológicas, foram selecionados 12 artigos para serem lidos na íntegra, dos quais todos foram incluídos na presente revisão (figura 1).
Figura 1. Fluxograma de busca da revisão integrativa, João Pessoa, 2023.
Quadro 2. Estudos incluídos na revisão, categorizados por autores, objetivos e Nível de Evidência dos estudos incluídos.
AUTOR/ANO OBJETIVO DO ESTUDO NÍVEL DE EVIDÊNCIA Kwon et al., 2015 Determinar se Lactobacillus rhamnosus GG poderia prevenir com segurança a colonização intestinal por Microorganismos Multiresistentes a Drogas (MMDs) em doentes graves. II Zeng et al., 2016 Avaliar a eficácia do uso de probióticos em reduzir a incidência de pneumonia associada a ventilação mecânica (PAV) e a colonização de Microorganismos Potencialmente Patogênicos (MPPs) no estômago e na orofaringe. II Malik et al., 2016 Investigar o efeito da Preparação de Células Microbianas (PCM) no retorno da função intestinal, níveis de proteína C reativa, número de dias em VM e tempo de internação em UTI. II Kenna et al., 2016 Avaliar a segurança e a eficácia dos probióticos em reduzir a incidência de Infecções Associadas a Assistência à Saúde (IAAS) entre pacientes em um Unidade de Tratamento Neurocrítico (UTN). IV Alberda et al., 2018 Demonstrar segurança e viabilidade da administração de uma bebida probiótica em pacientes internados em uma Unidade de Terapia Intensiva (UTI) e mensurar a ocorrência de Diarreia Associada ao uso de Antibióticos (DAA) ou a Infecção por Clostridium difficile (DAC). IV Mahmoodpoor et al., 2019 Mostrar a eficácia e segurança da administração de um composto probiótico na diminuição da incidência de PAV em pacientes adultos criticamente enfermos em Ventilação Mecânica (VM) por >48 horas admitidos em uma UTI cirúrgica. II Wang et al., 2021 Investigar os efeitos dos probióticos sobre a microbiota intestinal, a barreira intestinal e resultados clínicos em pacientes criticamente enfermos. II Litton et al., 2021 Testar a hipótese de que a administração enteral precoce e sustentada de Lactobacillus plantarum 299v em pacientes adultos melhoraria os resultados clínicos, incluindo redução da mortalidade e aumento da qualidade de vida. II Li et al., 2021 Avaliar o papel dos probióticos em pacientes graves com COVID-19. IV Johnstone et al., 2021 Investigar o impacto da administração de Lactobacillus rhamnosus GG na prevenção da PAV, de demais infecções e de outros desfechos clinicamente relevantes em uma UTI. II Tzikos et al., 2022 Analisar a eficácia de um regime composto por quatro probióticos na redução da incidência de infecção de sítio cirúrgico em pacientes com politraumatismo. II Tsilika et al., 2022 Investigar a eficácia de um regime probiótico no uso profilático para prevenir a PAV. II
Quadro 3. Autores e principais resultados encontrados, João Pessoa, 2021.
AUTOR/ANO METODOLOGIA DE INTERVENÇÃO RESULTADOS Kwon et al., 2015 Os indivíduos do GT receberam 1 cápsula contendo 1010 células de Lactobacillus rhamnosus GG, duas vezes ao dia, por 14 dias ou até saída do estudo (óbito ou alta hospitalar). Não houve diferença significativa entre grupos quando se avaliou a prevenção da colonização intestinal por MMDs ou mesmo na redução da colonização. Não foi observado nenhum evento adverso associado ao uso do probiótico. Zeng et al., 2016 O GT (n=118) recebeu cápsulas com uma combinação de Bacillus subtilis e Enterococcus faecalis a uma concentração de 4,5 × 109/ 0,25 g e 0,5 × 109/ 0,25 g, respect durante um período máximo de 14 dias.ivamente, três vezes ao dia, A incidência de PAV foi significativamente menor no GT (p=0,0031). O tempo para o desenvolvimento de PAV foi superior no grupo que recebeu probióticos (p=0,022). A incidência de colonização gástrica de MPPs foi inferior no GT (p=0,004). Não houve diferença entre os grupos quando se avaliou colonização de MPPs no estômago e a orofaringe ao mesmo tempo Malik et al., 2016 Foi administrado 30 bilhões de UFC de cepas de Lactobacillus,
Lactobacillus casei, Lactobacillus lactis, Bifidobacterium bifidum, Bifidobacterium longum e Bifidobacterium infantis, a partir do dia de início da nutrição enteral, por 7 dias, 2x/dia. No total, foram incluídos 30 pacientes no GT.Pacientes do GT atingiram a meta calórica com diferença média de 96 horas em relação ao grupo controle (p<0,001). O tempo de retorno da função intestinal normal foi 2 vezes maior no GC em comparação com o GT (p<0,0001). Tal otimização na recuperação da função intestinal foi associada a uma diminuição na duração da VM em 40% (p=000,4) e o tempo de estadia na UTI em 31% (p=0,014). Kenna et al., 2016 O probiótico utilizado foi uma combinação de Lactobacillus acidophilus e Lactobacillus helveticus (1g), duas vezes ao dia a todos os pacientes ventilados mecanicamente por mais de 24 horas. A incidência de IAAs foi menor no grupo em que houve a utilização de probióticos (p=0,17). Não houve diferença entre os grupos quando se avaliou os dias de uso de VM, a duração da internação hospitalar e na UTI, a mortalidade hospitalar e alta hospitalar. Não houve eventos adversos com a administração de probióticos. Wan et al., 2018 A população do estudo foi composta por 32 pacientes adultos internados em uma UTI. Foi utilizado uma bebida probiótica contendo 10 bilhões de Unidades Formadoras de Colônia (UFC) de Lactobacillus casei sp., duas vezes ao dia, até 7 dias após a conclusão da antibioticoterapia. Foi demonstrado segurança e viabilidade na administração da bebida probiótica. Não houve diferenças significativas na ocorrência de DAA ou DAC entre os pacientes do Grupo Controle e do Grupo que recebeu a intervenção. Mahmoodpoor et al., 2019 Os pacientes do Grupo de Tratamento (GT) (n=48) receberam 2 cápsulas de preparação probiótica (1 cápsula a cada 12 horas) diariamente por 14 dias. Cada cápsula continha 1010 bactérias das espécies de Lactobacillus, de bifidobacterium e de Streptococcus thermophilus. Os pacientes do GT tiveram uma menor incidência de PAV (p=0,04) e menor duração na ventilação mecânica (p=0,02). A taxa de diarreia também foi menor nestes pacientes (p=0,08), bem como a duração da internação hospitalar (p=0,02). Nenhum evento adverso grave relacionado ao uso de probióticos foi observado. Wang et al., 2021 A amostra foi composta por 28 pacientes no GT (Clostridium butyricum) e por 33 pacientes no grupo controle. A intervenção foi caracterizada pela oferta de dose de 106, 3 vezes ao dia. Amostras de fezes e sangue foram coletadas no 1º dia e 15º dia de administração. O tratatamento com probióticos reduziu significativamente a incidência de constipação (p=0,04), mas não de diarreia. A duração em dias de hospitalização no GT foi significativamente menor do que no grupo controle (p<0,001). Bacteroides reduziram significantemente no GT (p=0,048). O nível sérico de lipossacarídeos (LPS) diminuiu significativamente no GT. Litton et al., 2021 Foi administrado a 110 pacientes 2 x 1010 de UFC do probiótico Lactobacillus plantarum 299v uma vez ao dia, durante 60 dias. Não foram verificadas diferenças significativas entre os grupos com relação à redução da mortalidade hospitalar na UTI e a qualidade de vida geral nos pacientes que tiveram alta. Li et al., 2021 Os pacientes do GT (n=123) utilizaram uma combinação de Bifidobacterium, Lactobacillus, Enterococcus, Bacillus e Streptococcus, durante um período médio de 12,94 dias. Pacientes tratados com probióticos têm níveis mais elevados de células T totais, células T CD8 +, em comparação àqueles que não utilizaram, indicando que os probióticos podem moderar a redução da imunidade em COVID- grave 19 pacientes. O estudo também sugeriu que o uso de probióticos esteve associado à redução dos níveis de Proteína C Reativa, atuando na redução do fator inflamatório. O uso de probióticos não demonstrou efeitos sobre níveis altos de interleucina-6. Johnstone et al., 2021 Participantes elegíveis internos de 44 UTI’s foram alocados para receberem L rhamnosus GG (n=1318) (1 x 1010 UFC) ou placebo (n = 1332), por via enteral, duas vezes ao dia, por até 60 dias, até a alta da UTI ou até que a espécie Lactobacillus fosse isolada de um sítio estéril ou cultivada como organismo único ou predominante em sítio não estéril. 289 (21,9%) pacientes do GT adquiriram PAV em comparação com 284 (21,3%) do GP (HR 1,03; IC 95%:, 0,87 – 1,22; p= 0,73). Não foi possível encontrar diferença significativa entre os grupos para demais desfechos infecciosos, uso de microbianos, ocorrência de diarreia, dias de internação e mortalidade. 15 (1,1%) pacientes do GT em comparação com 1 paciente (1,1%) do GP experimentaram um evento adverso ou um evento adverso grave (OR, 14,02; IC 95%, 1,79-109,58; p = 0,001). Tzikos et al., 2022 Os participantes foram randomizados para receberem uma fórmula probiótica (n=53) (1,75 × 109 UFC de Lactobacillus acidophilus LA-5, 0,5 × 109 UFC de Lactiplantibacillus plantarum UBLP-40, 1,75 × 109 UFC de Bifidobacterium animalis subsp. lactis BB-12 e 1,5 × 10 9 UFC de Saccharomyces boulardii Unique-28), dois sachês, um por via gástrica e outro disperso na orofaringe, duas vezes por dia ou placebo (n=50). Dos pacientes do GP, 23 (46,0%) desenvolveram uma infecção de sítio cirúrgico, enquanto 13 (24,5%) dos pacientes do GT apresentaram a mesma complicação. Essa diferença entre os grupos foi estatisticamente significativa (p = 0,022). Tsilika et al., 2022 Os participantes foram randomizados para receberem uma fórmula probiótica (n=59) (1,75 × 109 UFC de Lactobacillus acidophilus LA-5, 0,5 × 109 UFC de Lactiplantibacillus plantarum UBLP-40, 1,75 × 109 UFC de Bifidobacterium animalis subsp. lactis BB-12 e 1,5 × 109 UFC de Saccharomyces boulardii Unique-28), dois sachês, um por via gástrica e outro disperso na orofaringe, duas vezes por dia ou placebo (n=53). No GT, a taxa de incidência de PAV foi significativamente menor (11,9%; IC 95% 5,8-22,5%) em comparação com o GP (28,3%; IC 95% 17,9-41,6%; HR 0,37; p = 0,034).
Os resultados desta revisão possibilitaram a extração de três temáticas principais, a saber: uso de probióticos como terapêutica na diarreia em pacientes críticos; Utilização de probióticos na melhora de desfechos clínicos em pacientes em cuidados intensivos e Segurança e viabilidade no uso de probióticos em pacientes sob cuidados intensivos.
3.1 USO DE PROBIÓTICOS COMO TERAPÊUTICA NA DIARREIA EM PACIENTES CRÍTICOS
A incidência de diarreia em pacientes sob cuidados intensivos apresenta variação na literatura – entre 2% a 95% – em decorrência principalmente, de divergências conceituais. As definições mais comuns englobam a ocorrência de três ou mais episódios diários de fezes em consistência líquida ou quando volume fecal for superior a 750 ml em 24 horas (DIONNE et al., 2019; PITTA et al., 2019).
A diarreia pode ser discriminada como específica, estando relacionada a patologias diversas, como infecções, insuficiência pancreática, doença inflamatória intestinal; não específica, em virtude de quadros de hipoalbuminemia ou hipoperfusão; bem como medicamentosa, estando associada ao uso de antibióticos, antifúngicos, procinéticos e medicações contendo manitol. A nutrição enteral também tem sido associada, todavia, os estudos utilizados como base para tal foram de natureza retrospectiva e com baixa população amostral, resultando em evidência de baixa qualidade (DIONNE et al., 2019; PITTA et al., 2019).
No paciente crítico, a presença de diarreia é associada com pior prognóstico, com o aumento do tempo de uso de VM, má absorção de nutrientes, distúrbios hidroeletrolíticos, disfunção renal, lesões cutâneas e aumento do tempo de internação na UTI. Portanto, infere-se a importância do uso de estratégias em prol da prevenção e tratamento da diarreia nesta população (DIONNE et al., 2019; PITTA et al., 2019).
Ao analisar os resultados obtidos na presente revisão relacionados a este desfecho, observa-se que no estudo de Mahmoodpoor et al. (2019), foi demonstrado menor taxa de diarreia (p=0,08) após a administração de uma preparação probiótica de espécies de Lactobacillus, Bifidobacterium e Streptococcus thermophilus em pacientes graves.
O achado acima corrobora com o estudo de Linn, Thu & Win (2019) realizado com pacientes oncológicos não críticos submetidos a radioterapia, utilizando 1,75 bilhão de cepas de Lactobacillus e Bifidobacterium, três vezes ao dia, do início ao fim do período de tratamento, onde foi constatado diferenças significativas na incidência e gravidade de diarreia. O estudo de Wietmarschen et al. (2020), com idosos institucionalizados recebendo antibioticoterapia, também apresentou resultados positivos, empregando 1010 UFC de espécies de Bifidobacterium, Enterococcu e Lactobacillus.
Por outro lado, outros estudos (WANG et al., 2021; ALBERDA et al., 2018; COOK et al., 2016) não encontraram diferenças na ocorrência de diarreia. Tais achados estiveram em consonância com um estudo de KAŹMIERCZAK-SIEDLECKA K, et al. (2020), realizado com pacientes oncológicos, onde o GT (n=21) recebeu 1010 UFC de Lactobacillus plantarum por 4 semanas, não sendo evidenciado diferenças na ocorrência de diarreia. Entretanto, apresentaram menores incidências de vômitos e flatulências (p=0,0117).
Os estudos discutidos acima que apresentaram resultados favoráveis na redução do risco ou da gravidade da diarreia tinham como método comum a terapêutica com espécies de lactobacillus e bifidobacterium, em combinação, ou associadas com enterococcus ou streptococcus, distinto dos estudos que não evidenciaram diferenças significativas, sugerindo que o uso específico destas espécies pode ser mais eficaz para este objetivo terapêutico.
Os potenciais mecanismos de ação descritos na literatura em relação ao efeito protetor frente a ocorrência de diarreia, atribuídos aos probióticos, incluem: fixação dos probióticos ao epitélio intestinal, manutenção da integridade de barreira e exclusão competitiva com microorganismos patogênicos (ZENG et al., 2016; EVANS et al., 2016).
3.2 UTILIZAÇÃO DE PROBIÓTICOS NA MELHORA DE DESFECHOS CLÍNICOS DE PACIENTES SOB CUIDADOS INTENSIVOS
Dentre os artigos identificados nos resultados da presente revisão, 05 destes ressaltaram que a utilização de probióticos promoveram resultados positivos na prevenção de infecções, de forma direta ou indireta.
Três estudos encontraram menor incidência de PAV (MAHMOODPOOR et al., 2019; TSILIKA et al., 2022; ZENG et al., 2016). Além disso, Tsilika et al. (2022) constataram maior eficácia preventiva especificamente em relação a. baumannii e P. aeruginosa, e uma redução significativa na incidência de sepse, nos pacientes que receberam o probiótico. Em contraste, um ECR não encontrou diferenças na prevenção de PAV, mesmo após análise de subgrupos (COOK et al., 2016).
Na pesquisa de Wang et al. (2021), demonstrou-se redução significativa de bacteroides intestinais e do nível sérico de LPS; estando este último implicado na indução de sepse causada por bactérias gram-negativas, sendo atribuído à LPS sérica a capacidade de prever a ocorrência de infecção sanguínea. Entretanto, Kenna et al. (2016), não conseguiram comprovar melhora significativa na incidência de IAAs.
Um ECR encontrou um odds ratio para infecção de sítio cirúrgico de 0,11 (IC 95%: 0,03-0,42; p < 0,0001) para pacientes submetidos a uma operação, 1,67 (intervalo de confiança de 95%: 0,33-8,35; p= 0,695) para os submetidos a duas operações e 0,72 (intervalo de confiança de 95%: 0,11-4,62; p = 1,00) para aqueles submetidos a três operações, quando comparado ao GP (TZIKOS et al., 2022).
Foi descrito 3 possíveis mecanismos pelos quais o tratamento oral com probióticos pode acelerar a cicatrização de feridas: (I) papel na imunomodulação, estimulando o recrutamento de linfócitos para o tecido lesionado, aumentando o número de células T γδ e células Th17 nos linfonodos axilares ou baço; (II) otimizando a absorção de vitaminas e minerais envolvidos na regeneração tecidual e (III) pela síntese de moléculas neuroativas e/ou modulação da função secretora de células endócrinas intestinais, resultando na liberação de neuromoduladores com o potencial de aprimorar o reparo tecidual (TZIKOS et al., 2022).
A otimização da imunidade é um dos mecanismos pelos quais poderia se explicar a redução da incidência de infecções. Isso foi verificado em nossos achados, no estudo de Li et al. (2021), que revelaram que o uso de probióticos pode melhorar a resposta imunológica em pacientes com COVID-19. Todavia, Kwon et al. (2015) não encontraram diferenças significativas na colonização por MMDs.
Na população de pacientes com HIV em supressão virológica, Villar-García et al. (2017) apontou mudanças na composição do microbioma intestinal após o tratamento de 12 semanas com Saccharomyces boulardii, através da redução de algumas espécies diretamente associadas com níveis sistêmicos de translocação e inflamação, sugerindo que a identificação de espécies pró-inflamatórias no microbioma intestinal pode atuar como um novo marcador de resposta imunológica deficiente nestes pacientes.
O mecanismo pelo qual os probióticos atuam na imunidade é atualmente bastante ressaltado pela literatura. A fixação dos probióticos ao tecido epitelial pode suscitar uma cascata de sinalização que conduz a modulação imunológica. Os efeitos imunológicos também se expressam pelo aumento da atividade de macrófagos e linfócitos, na elevação da produção de imunoglobulinas e interferon γ e na inibição da produção de toxinas bacterianas (MARKOWIAK & ŚLIŻEWSKA, 2017).
Os potenciais efeitos benéficos dos probióticos no sistema imune pode refletir em redução da mortalidade e do tempo de internação hospitalar, demonstrando que o seu uso pode ser uma estratégia promissora e deve ser estudada e considerada no contexto de UTI’s. Em nossos resultados, o estudo de Malik et al. (2016) revelou redução significativa na duração do uso de VM (p=000,4) e do tempo de internação em UTI (p=0.014). Corroborando, outros estudos demonstraram menor estadia hospitalar (p=0,00) (WANG et al., 2021), redução do tempo de uso de vasopressores e do período de internação hospitalar e na UTI (TSILIKA et al., 2022). Em contraste, outras pesquisas não conseguiram demonstrar diferenças no uso de antimicrobianos (COOK et al., 2016), nos dias em VM, de internação hospitalar e na UTI (KENNA et al., 2016), mortalidade ou qualidade de vida após alta (LITTON et al., 2021).
3.3 SEGURANÇA E VIABILIDADE NO USO DE PROBIÓTICOS EM PACIENTES SOB CUIDADOS INTENSIVOS
No decorrer dos últimos anos têm sido conduzidos diversos estudos com o objetivo de avaliar a eficácia, a viabilidade e a segurança do uso de probióticos em pacientes hospitalizados. O receio da administração de probióticos em alguns grupos de pacientes é embasada na possibilidade da ocorrência de translocação bacteriana por meio do tecido epitelial intestinal, infecção em pacientes imunodeprimidos e a suscitação de resistência a antibióticos em outros microrganismos (BARRAUD et al., 2010; WHELAN & MYERS, 2010).
A Diretriz de Terapia Nutricional em Pacientes Adultos Graves recomenda que quando administrado probiótico nesta população, sejam excluídos pacientes com imunossupressão, em pós-operatório recente de anastomose intestinal, cirurgia de vias biliares e pâncreas, com isquemia intestinal, portadores de doenças hematológicas e reumatológicas. A classificação do nível de evidência dessa recomendação, no entanto, é baixa (CASTRO et al., 2024).
Ao analisar publicações na literatura sobre o tema, observa-se relatos de casos de fungemia, bacteremia, endocardite e sepse relativos a administração de probióticos, em sua maioria em pacientes imunossuprimidos (POMAR & ARNAIZ, 2018; LI et al., 2021). Do total de 12 artigos incluídos na presente revisão, apenas 1 relatou a ocorrência de efeitos adversos (COOK et al., 2016). Neste estudo, 15 pacientes (1,1%) que receberam probióticos apresentaram um evento adverso, em comparação com 1 paciente (1,1%) que recebeu placebo (OR, 14,02; IC 95%, 1,79- 109,58; P = 0,001); 12 dos 15 pacientes que receberam probióticos apresentaram cultura positiva à espécie Lactobacillus rhamnosus GG, probiótico administrado no ensaio.
Em consonância, Yelin (2019) encontrou um aumento de bacteremia em crianças em terapia intensiva. Um total de 6 de 522 crianças apresentaram bacteremia por Lactobacillus em comparação com apenas 2 de 21.652 pacientes que não receberam o probiótico, uma diferença significativa. A análise no GP mostrou semelhança filogenética substancial com o probiótico administrado (Lactobacillus rhamnosus). Contudo, estabelecer uma relação direta entre a administração do probiótico e a ocorrência da bacteremia é difícil devido à ocorrência ocasional de bacteremia por L. rhamnosus, observada no mesmo estudo em pacientes não críticos que também receberam esse probiótico. Estes resultados têm significado tanto para a prática clínica quanto para as diretrizes de saúde, destacando a importância de uma prescrição criteriosa de probióticos em pacientes críticos (YELIN, 2019).
A detecção de espécies probióticas de Lactobacillus em locais estéreis, como o sangue, pode sugerir comprometimento da integridade intestinal, e o isolamento dessas espécies na corrente sanguínea pode indicar contaminação durante a administração do probiótico ao paciente. Bacteremia por lactobacillus pode ser clinicamente relevante, aumentando a mortalidade em casos de comorbidades graves subjacentes(COOK et al., 2016).
Portanto, a utilização de probióticos demonstrou, nesta revisão, ser uma estratégia possivelmente segura e eficaz no tratamento de pacientes críticos. Ao considerar o contexto brasileiro, onde o Sistema Único de Saúde enfrenta desafios impostos devido a um orçamento reduzido, fica evidente que estratégias como essa são fundamentais para a terapia do paciente. A implementação de probióticos pode contribuir para melhorar os resultados clínicos, reduzir o tempo de internação e, consequentemente, impactar positivamente os custos relacionados à saúde.
4 CONCLUSÃO
A análise da literatura publicada nos últimos dez anos acerca dos efeitos clínicos da suplementação de probióticos em pacientes críticos nos permite concluir que esta terapêutica pode ser potencialmente eficaz em variados contextos, especialmente na ocorrência de diarreia e de infecções, com melhora nos desfechos clínicos.
Dos 12 estudos incluídos na presente revisão, 8 demonstraram benefícios clínicos de alguma natureza, e 1 relatou maior incidência de efeitos adversos nos pacientes que receberam probióticos. Observa-se que ainda é incipiente os estudos nesta temática, com elevada heterogeneidade metodológica, no que diz respeito ao tipo de probiótico e a duração do tratamento. Novos estudos com maior rigor metodológico, com amostras maiores e terapêuticas mais homogêneas devem ser realizados para confirmar ou refutar os benefícios aqui apontados, bem como elucidar a segurança da terapia.
REFERÊNCIAS
AGUDELO-OCHOA, Glória M., et al. Gut microbiota profiles in critically ill patients, potential biomarkers and risk variables for sepsis. Gut Microbes. v. 12, n. 1, 2020, p. e1707610.
AKRAMI, Kevan; SWEENEY, Daniel A. The microbiome of the critically ill patient. Current opinion in critical care, v. 24, n. 1, p. 49-54, 2018.
ALBERDA, Cathy, et al. Feasibility of a Lactobacillus casei Drink in the Intensive Care Unit for Prevention of Antibiotic Associated Diarrhea and Clostridium difficile. Nutrients. v. 10, n. 5, 2018, p. 539.
BARRAUD, Damien, et al. Probiotics in the critically ill patient: a double blind, randomized, placebo-controlled trial. Intensive Care Med. v. 36, n. 9, 2010, p. 1540-1547.
BERMUDEZ-BRITO, Miriam, et al. Probiotic mechanisms of action. Annals of Nutrition and Metabolism, v. 61, n. 2, 2012, p. 160-174.
CALO, Natalia Causada; FERREIRA, Juliana Carvalho; PATINO, Cecília Maria. Revisões sistemáticas: uma breve visão geral. Jornal Brasileiro de Pneumologia, v. 46, n. 5, 2020.
CASTRO, Melina Gouveia, et al. Diretrizes brasileiras de terapia nutricional no paciente grave. BRASPEN J. v. 33, 2º supl 2, 2023, p. 2-36. Disponível em: https://www.sbnpe.org.br/diretrizes. Acesso em: 10 de abril de 2024.
COOK, Deborah J, et al. Probiotics: Prevention of Severe Pneumonia and Endotracheal Colonization Trial-PROSPECT: a pilot trial. Trials. V. 17, 2016, p. 377.
DIONNE, Joanna C, et al. Diarrhoea: interventions, consequences and epidemiology in the intensive care unit (DICE-ICU): a protocol for a prospective multicentre cohort study. BMJ Open, v. 9, n. 6, 2019, p. e028237.
EVANS, Malkanthi, et al. Effectiveness of Lactobacillus helveticus and Lactobacillus rhamnosus for the management of antibiotic-associated diarrhoea in healthy adults: a randomised, double-blind, placebo-controlled trial. Br J Nutr. v. 116, n. 1, 2016, p. 94-103.
GALVÃO, Maria Cristina. Níveis de evidência. Acta Paulista de Enfermagem, v. 19, n. 2, 2006, p. 5-6.
GOODMAN, Clare, et al. Probiotics for the prevention of antibiotic-associated diarrhoea: a systematic review and meta-analysis. BMJ open, v. 11, n. 8, 2021, p. e043054.
HILL, Colin, et al. Expert consensus document: The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nature reviews Gastroenterology & hepatology, v. 11, n. 8, 2014, p.506-14.
KAŹMIERCZAK-SIEDLECKA K, et al. Effects of 4 weeks of Lactobacillus plantarum 299v supplementation on nutritional status, enteral nutrition tolerance, and quality of life in cancer patients receiving home enteral nutrition – a double-blind, randomized, and placebo-controlled trial. Eur Rev Med Pharmacol Sci. v. 24, n. 18, 2020, p. 9684-9694.
KENNA, John, et al. Effect of Probiotics on the Incidence of Healthcare-Associated Infections in Mechanically Ventilated Neurocritical Care Patients. Nutr Clin Pract. v. 31, n. 1, 2016, p. 116-120.
KHAILOVA, Ludmila, et al. Lactobacillus rhamnosus GG improves outcome in experimental pseudomonas aeruginosa pneumonia: potential role of regulatory T cells. Shock, v. 40, n. 6, 2013, p. 496-503.
KWON, Jennie H., et al. Randomized Controlled Trial to Determine the Impact of Probiotic Administration on Colonization With Multidrug-Resistant Organisms in Critically Ill Patients. Infect Control Hosp Epidemiol. v. 36, n. 12, 2015, p. 1451-1454.
LI, Cong, et al. Synbiotic Therapy Prevents Nosocomial Infection in Critically Ill Adult Patients: A Systematic Review and Network Meta-Analysis of Randomized Controlled Trials Based on a Bayesian Framework. Frontiers in Medicine. v. 8, 2021, p. 693188.
LI, Qiang, et al. The role of probiotics in coronavirus disease-19 infection in Wuhan: A retrospective study of 311 severe patients. Int Immunopharmacol. v. 95, 2021, p. 107531.
LIMA JÚNIOR, Francisco Alves, et al. Perfil das prescrições de antibioticoterapia em uma unidade de terapia intensiva adulto de um hospital de referência cirúrgica no estado do maranhão. Revista Eletrônica Acervo Saúde, n. 34, 2019, p. e1301.
LINN, Ye Htut; THU, K Khine; WIN, Nang Hla. Effect of Probiotics for the Prevention of Acute Radiation-Induced Diarrhoea Among Cervical Cancer Patients: a Randomized Double-Blind Placebo-Controlled Study. Probiotics Antimicrob Proteins. v. 11, n. 2, 2019, p. 638-647.
LITTON, Edward, et al. Early and sustained Lactobacillus plantarum probiotic therapy in critical illness: the randomised, placebo-controlled, restoration of gut microflora in critical illness trial (ROCIT). Intensive Care Med. v. 47, n. 3, 2021, p. 307-315.
MAHMOODPOOR, Ata, et al. Effect of a Probiotic Preparation on Ventilator-Associated Pneumonia in Critically Ill Patients Admitted to the Intensive Care Unit: A Prospective Double-Blind Randomized Controlled Trial. Nutr Clin Pract. v. 34, n. 1, 2019, p 156-162.
MALIK, Ausama A., et al. Microbial cell preparation in enteral feeding in critically ill patients: A randomized, double-blind, placebo-controlled clinical trial. J Crit Care. v. 32, 2016, p.182-188.
MALMIR, Hanieh, et al. Probiotics as a new regulator for bone health: a systematic review and meta-analysis. Evidence-Based Complementary and Alternative Medicine, 2021, p. 1-35.
MARKOWIAK, Paulina; ŚLIŻEWSKA, Katarzyna. Effects of Probiotics, Prebiotics, and Synbiotics on Human Health. Nutrients. v.9, n. 9, 2017, p. 1021.
PETROF, Elaine O. et al. Probiotics in the critically ill: a systematic review of the randomized trial evidence. Critical care medicine, v. 40, n. 12, 2012, p. 3290-3302.
PITTA, Marina Regueira, et al. Tutorial on Diarrhea and Enteral Nutrition: A Comprehensive Step-By-Step Approach. JPEN J Parenter Enteral Nutr. v. 43, n. 8, 2019, p. 1008-1019
POMAR, Maria D. Ballesteros; ARNAIZ, Elena González. Papel de los prebióticos y los probióticos en la funcionalidad de la microbiota del paciente con nutrición enteral. Nutrir hospital, Madri, v. 35, spe2, 2018, p. 18-26.
SHIMIZU, Kentaro; OJIMA, Masahiro; OGURA, Hiroshi. Gut microbiota and probiotics/synbiotics for modulation of immunity in critically ill patients. Nutrients, v. 13, n. 7, 2021, p. 2439.
SOUZA, Marcela Tavares; SILVA, Michelly Dias; CARVALHO, Rachel. Revisão integrativa: o que é e como fazer. Einstein, São Paulo, v. 8, n. 1, 2010, p. 102-106.
TSILIKA, Maria, et al. A four-probiotic preparation for ventilator-associated pneumonia in multi-trauma patients: results of a randomized clinical trial. International journal of antimicrobial agents, v. 59, n. 1, 2022, p. 106471.
TZIKOS, Georgios, et al. A Four-Probiotic Regime to Reduce Surgical Site Infections in Multi-Trauma Patients. Nutrients, v. 14, n. 13, 2022, p. 2620.
VAN WIETMARSCHEN, Herman A, et al. Probiotics use for antibiotic-associated diarrhea: a pragmatic participatory evaluation in nursing homes. BMC Gastroenterol. v. 20, n. 1, 2020, p. 151
VILLAR-GARCÍA, Judit, et al. Impact of probiotic Saccharomyces boulardii on the gut microbiome composition in HIV-treated patients: A double-blind, randomised, placebo-controlled trial. PLoS One. v.12, n. 4, 2017, p. e0173802
WANG Jie, et al. Effects of exogenous probiotics on the gut microbiota and clinical outcomes in critically ill patients: a randomized controlled trial. Ann Palliat Med. v. 10, n. 2, 2021, p. 1180-1190.
WHELAN, Kevin; MYERS, Clio E. Safety of probiotics in patients receiving nutritional support: a systematic review of case reports, randomized controlled trials, and nonrandomized trials. Am J Clin Nutr. v. 91, n. 3, 2010, p. 687-703.
WRIGHT, Kelly; WRIGHT, Heathcote; MURRAY, Michael. Probiotic treatment for the prevention of antibiotic-associated diarrhoea in geriatric patients: a multicentre randomised controlled pilot study. Australas J Ageing. v. 34, n. 1, 2015, p. 38-42.
YELIN, I. Genomic and epidemiological evidence of bacterial transmission from probiotic capsule to blood in ICU patients. Nature medicine, v. 25, n. 11, 2019, p. 1728–1732.
ZENG, Juan, et al. Effect of probiotics on the incidence of ventilator-associated pneumonia in critically ill patients: a randomized controlled multicenter trial. Intensive Care Med. v. 42, n. 6, 2016, p. 1018-1028.
1Mestra em Gerontologia pela Universidade Federal da Paraíba, Nutricionista da Unidade Multiprofissional no Hospital Universitário Lauro Wanderley (EBSERH), Universidade Federal da Paraíba, João Pessoa, Paraíba, Brasil. e-mail: raquel.barbosa@ebserh.gov.br
2Mestranda em Gerontologia pela Universidade Federal da Paraíba, Especialista em Saúde Pública pelo Centro Universitário Facisa (FACISA), Especialista em Saúde da Família pela Universidade Federal da Paraíba (UFPB), Nutricionista da Unidade Multiprofissional no Hospital Universitário Lauro Wanderley (EBSERH), Universidade Federal da Paraíba, João Pessoa, Paraíba, Brasil. e-mail: pollyana.paula@ebserh.gov.br
3Mestre em Gerontologia pela Universidade Federal da Paraíba, Nutricionista da Unidade Multiprofissional no Hospital Universitário Lauro Wanderley (EBSERH), Universidade Federal da Paraíba, João Pessoa, Paraíba, Brasil. e-mail: gina.araujo@ebserh.gov.br
4Doutora em Ciências da Nutrição pela Universidade Federal da Paraíba, Nutricionista da Unidade Multiprofissional do Hospital Universitário Lauro Wanderley (EBSERH), Universidade Federal da Paraíba, João Pessoa, Brasil. e-mail: carolinescabral@gmail.com
5Especialista em Terapia Nutricional Enteral e Parenteral pela BRASPEN, Nutricionista da Unidade Multiprofissional no Hospital Universitário Lauro Wanderley (EBSERH), Universidade Federal da Paraíba, João Pessoa, Paraíba, Brasil. e-mail: edcleideoliveira@hotmail.com
6Mestra em Ciências da Nutrição pela Universidade Federal da Paraíba, Nutricionista da Unidade Multiprofissional no Hospital Universitário Lauro Wanderley (EBSERH), Universidade Federal da Paraíba, João Pessoa, Paraíba, Brasil. e-mail: geovana_nutri@hotmail.com
7Especialização em Bases nutricionais da atividade física pela Universidade Gama Filho,
Nutricionista da Unidade Multiprofissional no Hospital Universitário Lauro Wanderley (EBSERH), Universidade Federal da Paraíba, João Pessoa, Paraíba, Brasil. e-mail: nutrialinehonor@gmail.com
8Doutora em Nutrição pela Universidade Federal de Pernambuco, Nutricionista da Unidade Multiprofissional no Hospital Universitário Lauro Wanderley (EBSERH), Universidade Federal da Paraíba, João Pessoa, Paraíba, Brasil. e-mail: deborasec@gmail.com
9Especialista em Nefrologia pelo Hospital das Clínicas da Universidade Federal de Pernambuco, em Gerontologia pela Universidade Federal da Paraíba (UFPB) e em cuidados paliativos pela UFPB, Nutricionista da Unidade Multiprofissional no Hospital Universitário Lauro Wanderley (EBSERH), Universidade Federal da Paraíba, João Pessoa, Paraíba, Brasil. e-mail: renangondim88@hotmail.com
10Mestra em Ciências da Nutrição pela Universidade Federal da Paraíba, Nutricionista da Unidade Multiprofissional no Hospital Universitário Lauro Wanderley (EBSERH), Universidade Federal da Paraíba, João Pessoa, Paraíba, Brasil. e-mail: nutriflavialima@gmail.com
