COMPARATIVE ANALYSIS OF BIOLOGICAL HAIR AND SYNTHETIC HAIR IN TOXICOLOGICAL TESTS
REGISTRO DOI: 10.5281/zenodo.11211912
Silva, Mariana Cavalcantea;
Dias, Mirella Pietra de Oliveiraa;
Orientador: Sales, Apolo Salomãob
RESUMO
Este artigo científico tem como finalidade explorar a aplicação da Cromatografia Líquida Acoplada à Espectrometria de Massa (LC-MS) na análise de cabelos biologicos e sintéticos através da pesquisa. Buscamos elucidar as metodologias envolvidas, desde a preparação de amostras até a análise de dados, destacando os desafios enfrentados na diferenciação desses tipos de cabelo. Além disso, abordamos a relevância da LC-MS em contextos forenses, toxicológicos e de conformidade com regulamentações governamentais, como a Lei dos Caminhoneiros, que exige exames toxicológicos em cabelos. Ao fim, este artigo visa fornecer uma compreensão abrangente e prática do papel da LC-MS nessas análises, contribuindo para avanços em investigações forenses, controle de qualidade e pesquisas científicas.
Palavras-chave: (LC-MS), cabelos sintéticos, cabelos biológicos, análise forense, queratina, amostras.
Abstract
This scientific article aims to explore the application of Liquid Chromatography Coupled to Mass Spectrometry (LC-MS) in the analysis of biological and synthetic hair through research. We seek to elucidate the methodologies involved, from sample preparation to data analysis, highlighting the challenges faced in differentiating these hair types. Additionally, we address the relevance of LC-MS in forensic, toxicological and compliance contexts with government regulations, such as the Truckers Law, which requires toxicological testing of hair. Ultimately, this article aims to provide a comprehensive and practical understanding of the role of LC-MS in these analyses, contributing to advances in forensic investigations, quality control and scientific research.
Keywords: (LC-MS), synthetic hair, biological hair, forensic analysis, keratin, samples.
INTRODUÇÃO
A análise de cabelos sintéticos e biológicos desempenha um papel fundamental em diversas aplicações, incluindo investigações forenses, estudos toxicológicos e análise de exposição a substâncias químicas. Para diferenciar e identificar compostos presentes em amostras de cabelo, a Cromatografia Líquida Acoplada à Espectrometria de Massa (LC-MS) emergiu como uma técnica poderosa e versátil1, 2
Os cabelos sintéticos são compostos predominantemente por materiais poliméricos, como polietileno, polipropileno e outros plásticos. Os fabricantes desses cabelos frequentemente desenvolvem tecnologias específicas para melhorar a durabilidade, textura e aparência. Essas fibras podem ser projetadas para resistir ao calor, manter a forma e a cor por períodos prolongados e imitar o movimento natural do cabelo humano1, 3.
Por outro lado, o cabelo biológico, também conhecido como cabelo natural, é composto principalmente de proteínas, sendo a queratina a proteína predominante. Além da queratina, o cabelo contém água, lipídios, pigmentos que determinam a cor do cabelo, minerais e outros elementos. A estrutura do cabelo é dividida em três camadas principais: medula, córtex e cutícula3, 4.
A análise de cabelo por LC-MS é uma técnica poderosa usada para identificar e quantificar diferentes compostos presentes em amostras de cabelo. Essa técnica é frequentemente empregada em estudos forenses, toxicológicos e de exposição a substâncias químicas. O cabelo e pelos são amplamente utilizados como amostras biológicas em exames toxicológicos, devido às suas vantagens, como facilidade de coleta não invasiva e uma janela de detecção prolongada 4, 5
A regulamentação governamental, como a Lei dos Caminhoneiros, estabelece a necessidade de exames toxicológicos em cabelos para certos grupos de profissionais, o que torna a LC-MS uma ferramenta importante na detecção de substâncias de interesse1, 6, 7.
No entanto, a análise de cabelos por LC-MS apresenta desafios, como a possível interferência de tratamentos cosméticos e a falta de correlação direta entre a dose e a concentração de substâncias no cabelo. Ainda assim, as vantagens da LC-MS, incluindo a possibilidade de análises em baixas temperaturas, tornam essa técnica uma escolha valiosa para estudos toxicológicos 8, 9, 10
A Cromatografia Líquida Acoplada à Espectrometria de Massa (LC-MS) é uma técnica poderosa usada na análise de cabelos sintéticos e biológicos. Ela permite a identificação e quantificação de compostos químicos presentes nessas amostras, o que é fundamental em diversas aplicações, como investigação forense, controle de qualidade de produtos cosméticos e pesquisa científica. Abaixo, apresento noções gerais sobre as metodologias envolvidas no uso da LC-MS na análise de cabelos:
1. Preparação de Amostras:
Antes de realizar a análise por LC-MS, é necessário preparar as amostras de cabelo. Isso inclui a coleta de uma amostra representativa, a lavagem para remover contaminantes externos e a secagem.
Em seguida, a amostra é submetida a uma etapa de extração, na qual os compostos de interesse são liberados do cabelo. A escolha do solvente e das condições de extração pode variar dependendo dos compostos que se deseja analisar.
2. Cromatografia Líquida (LC):
A etapa de cromatografia líquida envolve a separação dos compostos extraídos com base em suas afinidades químicas. Isso é realizado utilizando uma coluna cromatográfica na qual os compostos se separam à medida que interagem com uma fase estacionária e uma fase móvel.
A fase móvel é um solvente que percola através da coluna, enquanto a fase estacionária é um material que interage seletivamente com os compostos da amostra. Essa interação resulta na separação dos compostos.
3. Espectrometria de Massa (MS):
Após a separação por LC, os compostos são introduzidos no espectrômetro de massa. Nessa etapa, os compostos são ionizados, gerando íons carregados que podem ser analisados com base em sua razão massa/carga (m/z).
O espectrômetro de massa permite a identificação dos compostos com base em seus espectros de massa, bem como a quantificação com alta sensibilidade.
4. Calibração e Controle de Qualidade
Para garantir resultados precisos, é necessário calibrar o equipamento com padrões de referência. Isso envolve a análise de amostras de referência com concentrações conhecidas dos compostos de interesse.
Além disso, é crucial estabelecer protocolos de controle de qualidade para monitorar e validar a precisão e a precisão da análise.
5. Análise de Dados:
Após a aquisição dos dados de LC-MS, é realizada a análise de dados. Isso inclui a identificação dos compostos com base em seus espectros de massa e a quantificação com base na intensidade dos picos.
A interpretação dos resultados é frequentemente auxiliada por software especializado em LC-MS.
6. Aplicação em Diferenciação de Cabelos Sintéticos e Biológicos:
Na diferenciação de cabelos sintéticos e biológicos, a LC-MS pode identificar componentes químicos exclusivos de cada tipo de cabelo. A composição química distinta dos cabelos biológicos, rica em queratina, pode ser usada como um marcador.
A análise de cabelos sintéticos pode revelar a presença de polímeros e produtos químicos específicos usados em sua fabricação.
A LC-MS é uma técnica altamente versátil que pode ser adaptada para diferentes aplicações. Quando aplicada à análise de cabelos, ela fornece informações valiosas sobre a composição química, o que é fundamental para a diferenciação entre cabelos sintéticos e biológicos e para a detecção de substâncias de interesse em amostras de cabelo. Essa técnica desempenha um papel crucial em diversas áreas, incluindo forense, controle de qualidade e pesquisa científica.
OBJETIVO
VERBO EM AÇÃO
Metodologia
Foram adquiridas para análise um total de 9 amostras de cabelo, sendo 3 matrizes diferentes com repetição do processo 3 vezes em cada uma.
A primeira matriz foi o cabelo biológico. Uma pequena mecha foi separada onde contou-se rente ao couro cabeludo. As amostras provenientes desta coleta foram identificadas como 1, 2 e 3, cada uma com diferencial de 1 centímetro a partir da raiz respectivamente.
A segunda matriz provém de um cabelo sintético com a tonalidade platinada e as amostras foram identificadas como A, B e C.
Já a terceira matriz é provém de um cabelo sintético com a tonalidade castanha clara, as amostras desta matriz foram identificadas como α(Alfa), β(Beta) e γ Gama.

Todas as amostras foram pesadas em balança analítica, e como resultado, o peso das massas ficaram entre 12,1mg e 12,8mg, pesadas diretamente no tubo eppendorf. Em seguida é adicionado duas pequenas esferas de metal em cada tubo para que o cabelo fosse pulverizado a fim de de diminuir a superfície de contato dos fios e homogeneizar.
As amostras foram organizadas na estante separadora sendo as três primeiras as amostras 1, 2 e 3, seguidas de A, B e C, e por fim α, β e γ.


Em seguida, foi adicionado 25,0 μl.do PI (Padrão interno) que irá auxiliar o equipamento na busca especifica pelas drogas de interesse nas amostras. Também é adicionado 0,75 ml do CES (Cocentration Extraction Solution) que se trata da solução com capacidade de extrair do “Lúmen” do cabelo todas as moléculas de substâncias excretas. Todas as amostras foram fechadas em inseridas no pulverizador durante 3 minutos na velocidade de 3,55 m/s.
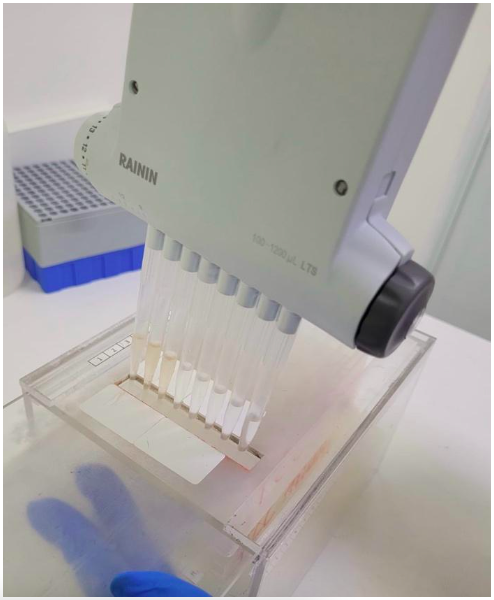
Com as amostras novamente da estante organizadora, é preparado o material de extração que consiste em uma Filter onde qualquer matéria será retida deixando assim somente a parte liquida que contém o material a ser analisado retido em uma Coletora que irá receber as amostras. A Filter é acoplada na coletora e, para que não haja erros na hora de retirar a amostra do tubo eppendorf no processo de depositar o material na Filter, é necessário o auxílio de um suporte para transferência de conteúdo.


Para eficiência e rapidez no processo é utilizada uma pipeta multicanal, que possibilita a extração de até 8 amostras de uma única vez. A mesma, antes de aspirar as amostras, é higienizada com Metanol, um composto orgânico da família dos álcoois, em seguida, é coletado 55 ml do material contido nos tubos sendo então transferido para a Filter.


Deposição das amostras na Filter com o auxílio do suporte (Fonte: Do Autor)
Após identificar que todas as amostras estão na posição correta e com volume semelhante uma a outra, a Filter e Coletora, ainda acopladas, são levadas ao compressor de pressão de ar a fim de fazer com que a solução passe de uma para a outra
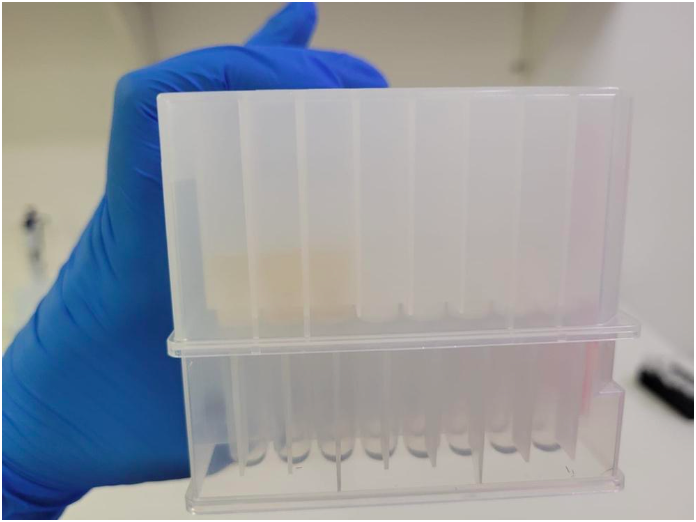

Após garantir que a pressurização foi realizada completamente, utiliza-se uma folha de alumínio para proteger a parte externa da coletora a fim de evitar possíveis contaminações.

Quando todos os processos são realizados corretamente, a coletora é direcionada para o espectrômetro (Xevo TQ S Micro) onde será realizado a análise toxicológica.
Resultados
Conforme a tabela, foi possível observar que a amostra biológica foi detectada a presença da droga denominada Codeína.
Tabela de Resultados
Identificação da amostra opi-Codeine (Concentração) 1 1.4 2 0.9 3 – A – B – C – α – β – γ –
Já nas amostras com conteúdo sintético não foi detectado nenhuma droga.
Conforme visto na tabela o equipamento detectou droga nas amostras biológicas com diferentes níveis de concentração devido ao espaçamento de 1 centímetro de cabelo entre uma amostra e outra. Não foi detectado qualquer concentração de drogas nas sintéticas, porém, está técnica não fez diferenciação entre as matrizes para saber se as mesmas são de caráter biológico ou sintético.
Para que o equipamento possa realizar tal diferenciação entre matriz biológica e sintética seria necessário desenvolver método próprio que busque a detecção de proteínas especificas contidas no cabelo biológico, como por exemplo, a Queratina. Este método não se demonstra viável em casos de análise toxicológica pois as proteínas reduzem a confiabilidade do resultado.
É recomendado que tal diferenciação seja realizada por pelos profissionais da área que utilizam de análise visual e por tato. Este processo geralmente é realizado nos próprios postos de coleta de material, mas pode ser realizado no momento da separação e pesagem das amostras.
Considerações Finais
De acordo com os resultados obtidos na análise das matrizes, foi possível apenas identificar a presença de Codeína na matriz biológica, no entanto, este resultado não foi capaz de segregar uma possível matriz falsa, neste caso, a matriz sintética. 5,11,12.
O método aplicado não possui esta finalidade pois leva-se em conta que na altura deste processo uma possível fraude tenha sido identificada anteriormente.
O processo todo, desde a coleta até a aplicação no maquinário, possui diversas etapas para que não seja possível a ocorrência de fraudes. Caso não seja identificada a fraude antes do processo de extração, a amostra será analisada crendo-se que se trata de uma amostra biológica. Sendo assim, o processo se demonstra passível a fraudes.13,14,15
REFERÊNCIAS
1. Buffoli B, Rinaldi F, Labanca M, Sorbellini E, Trink A, Guanziroli E, et al. The human hair: from anatomy to physiology. Int J Dermatol. 2014 Mar;53(3):331-41
2. Cuypers E, Flanagan RJ. The interpretation of hair analysis for drugs and drug metabolites. Clin Toxicol (Phila). 2018 Feb;56(2):90-100.
3. Koch SL, Tridico SR, Bernard BA, Shriver MD, Jablonski NG. The biology of human hair: A multidisciplinary review. Am J Hum Biol. 2020 Mar;32(2):e23316.
4. Cruz CF, Costa C, Gomes AC, Matamá T, Cavaco-Paulo A. Human Hair and the Impact of Cosmetic Procedures: A Review on Cleansing and Shape-Modulating Cosmetics. 2016;3(3):26.
5. Nikolin B, Imamović B, Medanhodzić-Vuk S, Sober M. High-performance liquid chromatography in pharmaceutical analyses. Bosnian Journal of Basic Medical Sciences. 2004 May;4(2):5-9.
6. Diário Oficial da União. Lei n° 14.599/23. 2023, Jun. Seção (1 ), pp 4-10.
7. Liu SD, Zhang DM, Zhang W, Zhang WF. Confirming Indicators of Qualitative Results by Chromatography-mass Spectrometry in Biological Samples. Fa Yi Xue Za Zhi. 2017 Apr;33(2):181-188.
8.. Gaillard Y, Pépin G. Screening and identification of drugs in human hair by high-performance liquid chromatography-photodiode-array UV detection and gas chromatography-mass spectrometry after solid-phase extraction: a powerful tool in forensic medicine. J Chromatogr A. 1997 Feb 21;762(1-2):251-267.
9. Park AM, Khan S, Rawnsley J. Hair Biology: Growth and Pigmentation. Facial Plast Surg Clin North Am. 2018 Nov;26(4):415-424.
10. Driskell R, Clavel C, Rendl M, Watt FM. Hair follicle dermal papilla cells at a glance. J Cell Sci. 2011 Apr 15;124(Pt 8):1179-82.
11. Pragst F, Balikova MA. State of the art in hair analysis for detection of drug and alcohol abuse. Clin Chim Acta. 2006 Aug;370(1-2):17-49.
12. Cruz CF, Costa C, Gomes AC, Matamá T, Cavaco-Paulo A. Human Hair and the Impact of Cosmetic Procedures: A Review on Cleansing and Shape-Modulating Cosmetics. 2016;3(3):26.
13. De Lima E. Cabelo como Matriz Analítica Alternativa para a determinação de drogas de abuso. Edição 82. News Lab; 2007.
13. Villain, M., Cirimele, V. e Kintz, P. 2004d. Hair analysis in toxicology. Clinical Chemistry And Laboratory Medicine: CCLM / FESCC, 42, pp. 1265-1272.
14. Wennig, R. 2000. Potential problems with the interpretation of hair analysis results. Forensic Science International, 107, pp. 5-12.
15. Wilhelm, M. e Idel, H. 1996. Hair analysis in environmental medicine. Zentrall Hyg Umweltmed, 198, pp. 485-501.
aFaculdades Metropolitanas Unidas (FMU) – Av. da Liberdade, 899 – Liberdade – São Paulo/SP.
bFaculdade Unyleya – Rua do Carmo, 66 – Rio de Janeiro/ RJ
