REGISTRO DOI: 10.5281/zenodo.11192540
Maysa Alves nogueira¹;
Noemi cesar².
Resumo
A leucemia linfoblástica aguda (LLA) é o câncer mais comum na infância, caracterizado pelo crescimento descontrolado de células linfoides imaturas. O diagnóstico precoce é crucial para o sucesso do tratamento. Daí a importância dos profissionais de saúde, pois os mesmos precisam identificar o quanto antes os sinais e sintomas da doença. Os sintomas mais comuns incluem palidez, fadiga, febre persistente, sangramento facial, contusões inexplicadas, dores ósseas e articulares, além de aumento dos gânglios linfáticos. O médico realiza uma avaliação clínica completa, incluindo exame físico e histórico médico detalhado, e solicita exames laboratoriais, como hemograma completo e exame de medula, para confirmar. O papel do enfermeiro é essencial na assistência direta à criança e à família, oferecendo suporte emocional e educacional durante todo o processo diagnóstico e terapêutico, porém não se pode esquecer o trabalho em equipe e, esta equipe tem que ser multidisciplinar, incluindo médicos oncologistas pediátricos, hematologistas, psicólogos, assistentes sociais, biomédicos, dentre outros. Uma vez confirmado o diagnóstico, o tratamento geralmente envolve quimioterapia intensiva, podendo incluir também terapia alvo e transplante de células-tronco em casos específicos. Neste sentido o presente trabalho proposto tem como objetivo geral apontar a participação dos profissionais de saúde no diagnóstico da Leucemia Linfoblástica Aguda em crianças, a finalidade de que esses pacientes possam adquirir a cura. Os procedimentos de coleta dos dados supracitados, foram através de pesquisa bibliográfica e documental, com abordagem quantitativa e qualitativa, com o intuito de relacionar os dados para a interpretação.
Palavras-chave: Diagnóstico, Leucemia infantil, Tratamento, profissionais de saúde, biomédico.
1 INTRODUÇÃO
Diversos estudos apontam o quão tem sido a crescente de doenças que vem afetando o cotidiano de muitas crianças. Uma que merece destaque vem a ser a Leucemia que é um câncer muito comum em adultos e crianças. Cientificamente falando um câncer se trata de crescimento descontrolado e anormal de células no corpo. “As tipologias de câncer são inúmeras e, pensando nisto o presente artigo proposto terá como objeto de estudo a Leucemia; mais especificamente a Leucemia Linfoblástica Aguda” (Ministério da Saúde, 2011).
De acordo com o INCA (2022), a Leucemia tem como característica afetar a medula óssea, tecido esponjoso encontrado dentro dos ossos, responsável pela produção de células sanguíneas comprometendo sua função, e tendo como repercussões o prejuízo ao sistema imunológico, o que leva à ocorrência de infecções potencialmente severas, além de anemia e risco de sangramentos espontâneos, por comprometer a produção dos glóbulos vermelhos e das plaquetas, respectivamente.
A Leucemia Linfocítica Aguda (LLA) é um câncer que afeta as células linfoides imaturas na medula, resultando em uma produção excessiva de linfócitos imaturos e anormais. Essas células cancerígenas, também conhecidas como blastos linfoides, substituem as células sanguíneas normais na medula óssea, prejudicando a produção adequada de glóbulos brancos, glóbulos vermelhos e plaquetas. (SANAR, 2023).
Estudos apontaram que a LLA é a forma mais comum de câncer na infância, compreendendo 70% dos casos; em adultos a incidência é de apenas 20%. (Farias, Castro, 2004). Daí a necessidade de se descobrir a doença o quanto antes e trata-la para que essas crianças possam sobreviver e chegar à fase adulta. Diante disto surge a seguinte situação problema a ser respondida: Qual a relação do diagnóstico precoce e a cura da Leucemia Linfoblástica Aguda?
Com intuito de responder a problemática proposta, o presente artigo terá como Objetivo Geral analisar a importância da participação dos profissionais de saúde no diagnóstico de Leucemia Linfoblástica Aguda. Como suporte a construção do embasamento para resolução da situação problema, o artigo apresentará no decorrer de sua revisão bibliográfica um estudo aprofundado do surgimento da LLA; demonstrará o funcionamento do desenvolvimento de células na medula óssea, em especial os linfócitos e apresentará a necessidade de cada profissional de saúde no diagnóstico e tratamentos da Leucemia Linfoblástica Aguda em crianças de 0 a 10 anos.
Vale destacar que, o trabalho se justifica pelo fato de existir na população infanto-juvenil uma incidência elevadíssima de câncer que afetam as células da linhagem hematopoiética, conhecidos por leucemias; destacando a Leucemia Linfoblástica Aguda (LLA), “doença com origem nas alterações de células precursoras de linfócitos B ou T, sendo a última menos comum. Essas células anormais ocupam espaço na medula impedindo o crescimento de células saudáveis, o que resulta na diminuição da formação de glóbulos brancos e vermelhos” (GONZÁLEZ-HERRERO, 2018).
É notório que a imunidade fica comprometida com esta doença e que, um bom diagnóstico inicial pode reverter completamente o quadro. O exame citomorfológico do sangue periférico e da medula óssea. O estudo imunofenotípico eleva para 99% o percentual de casos corretamente classificados, permitindo identificar a linhagem celular (T ou B) e os diferentes estágios de maturação da célula. Aproximadamente 20% dos casos são de origem de célula T; 75%, precursores de célula B; e 5%, de célula B madura. As técnicas citogenéticas têm contribuído de maneira fundamental para a compreensão da biologia molecular e do tratamento da LLA.
As anormalidades cromossômicas, quando associadas ao painel de imunofenotipagem, constituem o parâmetro mais importante para a classificação das leucemias, e, juntamente com outros fatores clínicos e laboratoriais, possibilitam a estratificação dos pacientes em diferentes grupos de risco, tendo importância fundamental para determinar o prognóstico e estabelecer o tratamento adequado. (FARIAS e CASTRO, 2004).
Portanto o artigo terá como objeto central o papel dos profissionais de saúde para chegada de um diagnóstico precoce, os exames existentes que deem maior precisão nos resultados, para que se possa enfim amentar a cura dessas crianças e consequentemente a sobrevida das mesmas.
Nossa metodologia de cunho bibliográfica o presente artigo é de uma pesquisa exploratória uma revisão literária referente ao tema Leucemia infantil, diagnósticos e técnicas de tratamento, ou seja, coletamos vários dados bibliográficos apontando a importância dos profissionais de saúde neste processo de diagnóstico, tratamento e cura perante esta doença grave.
2 FUNDAMENTAÇÃO TEÓRICA OU REVISÃO DA LITERATURA
2.1 Contexto histórico e conceitos
O primeiro reconhecimento da leucemia é concedido, de maneira independente, a Virchow (Berlin) e Bennett (na Escócia), no ano de 1845. Em 1847, Virchow elegeu o termo “leucemia” (do grego leuk, que significa “células brancas”, e emia, que significa “sangue”) para substituir o termo alemão weisshäme.
Em 1869, a medula óssea começou a ser analisada no microscópio. Franz Ernst C. Neumann descobriu que a hematopoese acontece na medula óssea após estudar fragmentos ósseos. Supondo que o sangue se originava de um precursor comum, ele deu o nome de célula-tronco e também sugeriu que além de leucemias linfáticas e esplênicas, havia também uma leucemia originária da medula óssea, que chamou de leucemia mieloide (LADINES- CASTRO et al., 2016).
Na década de 1970, franceses, americanos e britânicos (Classificação Francesa – Americana-BritÂnica – FAB), neste subsistema, os subtipos de LLA baseiam-se na observação da morfologia da célula neoplásica ao microscópio, nomeadamente do seu tamanho, citoplasma, nucléolo, basofilia e vacuolização especialistas em leucemias dividiram a leucemia linfóide aguda em três subtipos (L1,L2 e L3), baseados na maneira como suas células eram vistas ao microscópio após coloração de rotina. Esse sistema foi substituído em função dos novos exames de laboratório que permitem uma classificação da leucemia linfoide aguda com mais precisão. (LEE, 1998).
2.2 Leucemia linfoide aguda e seus aspectos
A LLA é um tipo de câncer que afeta as células linfoides imaturas na medula óssea, resultando em uma produção excessiva de linfócitos imaturos e anormais. “Essas células cancerígenas, também conhecidas como blastos linfoides, substituem as células sanguíneas normais na medula óssea, prejudicando a produção adequada de glóbulos brancos, glóbulos vermelhos e plaquetas” (SANAR, 2023). cursa, geralmente, com anemia normocítica/normocrômica, neutropenia, plaquetopenia e aumento no número de blastos, o mielograma apresenta células jovens difusas. “Corresponde entre 75% a 80% das leucemias agudas na infância (entre 2 a 5 anos de idade) e 20% a 25% nos adultos. Entretanto, as crianças apresentam uma maior taxa de sobrevida” (MICHEL, 2008). “As crianças do sexo masculino e indivíduos com ataxia-telangiectasia, trissomia do cromossomo 21, síndrome de Bloom e neurofibromatose tipo I tem maior probabilidade de adquirirem LLA” (HAMERSCHLAK, 2012; BRASIL, 2014;).
Dentro das células hematopoiéticas, o acúmulo de um pequeno número de mutações recorrentes inicia a malignidade. Concomitantemente, alterações específicas dos nichos, que sustentam as células-tronco hematopoiéticas e sua progênie, podem atuar como eventos de predisposição, facilitando a sobrevivência e a expansão das células hematopoiéticas mutantes, além de contribuir para a progressão da malignidade e proteger as células malignas da quimioterapia, levando à recaída. (MÉNDEZ-FERRER, S., BONNET, D., STEENSMA, 2020).
A medula óssea é um importante tecido hematopoiético responsável pelo desenvolvimento das células sanguíneas. “Fisiologicamente sua produção é controlada por um sistema de divisão celular, no entanto, quando defeituoso perde o controle e gera a produção anormal das células sanguíneas, podendo acarretar quadros leucêmicos” (SANTOS et al., 2014).
Além de sua função na produção de células sanguíneas, a medula óssea também desempenha um papel importante no sistema imunológico, uma vez que muitos tipos de glóbulos brancos são produzidos nesse tecido e estão envolvidos na defesa contra infecções e doenças. Portanto, “a medula óssea é um componente essencial do corpo humano, responsável pela produção contínua de células sanguíneas e pela manutenção do sistema imunológico (SANAR, 2023)”. A figura a seguir demonstra o funcionamento da medula óssea.
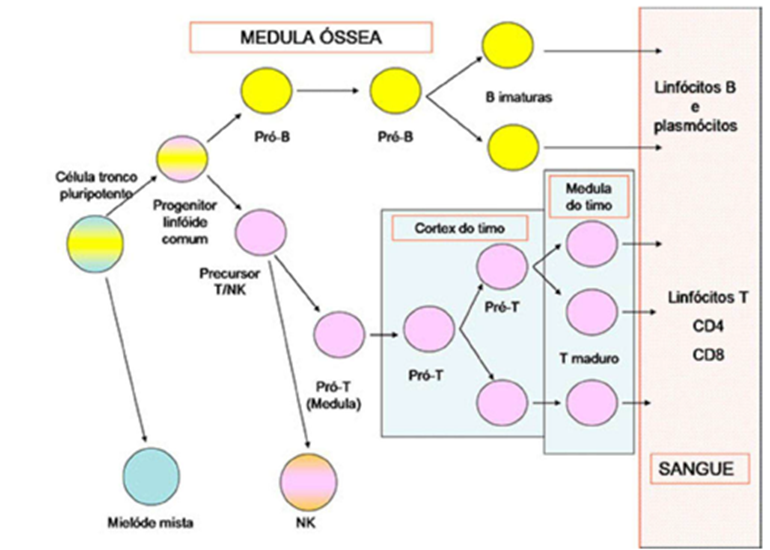
2.3 Classificação e diagnóstico das leucemias
“O diagnóstico e classificação da LLA ou LLC pode ser feito por um conjunto de marcadores imunológicos expressos durante seu estágio de maturação, denominados CDs” (PIER,2008; CHIARETTI; ZINI; BASSAN, 2014; VANDONGEN; ORFAO, 2014; SUKUMARAN et al., 2015).
A primeira classificação da OMS para a LLA surgiu em 1997. Utilizando como critérios apenas a morfologia e o perfil citogenético das células neoplásicas, distinguia três tipos de LLA: LLA-B, LLA-T e Leucemia de Células Burkitt. Em 2008, esta última categoria deixa de ser uma forma de LLA, passando a estar associada ao Linfoma de Burkitt. Para além desta alteração, ocorre também uma subdivisão da LLA-B em LLA-B com anomalias genéticas e LLA-B/Linfoma não especificado separadamente. Por fim, em 2016, a classificação foi novamente atualizada, tendo sido adicionadas novas mutações à lista de alterações genéticas já consideradas. Para algumas destas categorias, o mecanismo pelo qual ocorre a neoplasia ainda não está totalmente descrito (MATIAS, 2019).
O diagnóstico baseado na análise por imunofenotipagem por citometria de fluxo (ICF) de amostras de sangue periférico (SP) e medula óssea (MO) com blastos acima de 20% para determinar o tipo celular e a classificação do tipo de leucemia desenvolvida (SANTOS et al., 2014). Em Sangue Periférico (SP), se o paciente tiver uma linfocitose, a imunofenotipagem permite diferenciar uma linfocitose reacional de uma maligna (ABRALE, 2022).
A Imunofenotipagem de sangue periférico, realiza-se através de coleta de sangue, bem parecido com um hemograma. Se for na medula óssea, a coleta é similar ao mielograma, porém menos invasiva; nesse caso o teste é chamado de imunofenotipagem por citometria de fluxo. Depois de coletado, o material é analisado em uma máquina que compara as células com uma série de marcadores relacionados às doenças investigadas. Conforme as células reagem aos marcadores, é possível identificar de que tipo elas são. Ou seja, se são saudáveis ou não e, caso não sejam, quais características elas têm (ABRALE, 2022).
De acordo com a especialista em Medicina Laboratorial, na biópsia de medula óssea é retirado um fragmento do osso, que será descalcificado, colocado em formol e enviado para a anatomia patológica. “Já a imunofenotipagem por citometria de fluxo vai trabalhar o líquido, então é muito mais rápido e vai ajudar na biópsia, indicando a possibilidade ou não de doença e se ela é B, T ou se é mieloide, facilitando a vida do anatomopatologista. Os dois exames são, na verdade, complementares”, a Drª. Nydia Strachman afirma (ABRALE, 2022). Entretanto o grupo Franco-Americano-Britânico (FAB) sugere que o quadro leucêmico seja determinado quando forem encontrados mais de 30% de blastos em SP ou MO (BRASIL, 2014). Quando pacientes com leucemia, o crescimento celular ocorre descontroladamente e há um rápido aumento de leucócitos anormais. A figura a seguir demonstra bem como isso ocorre:
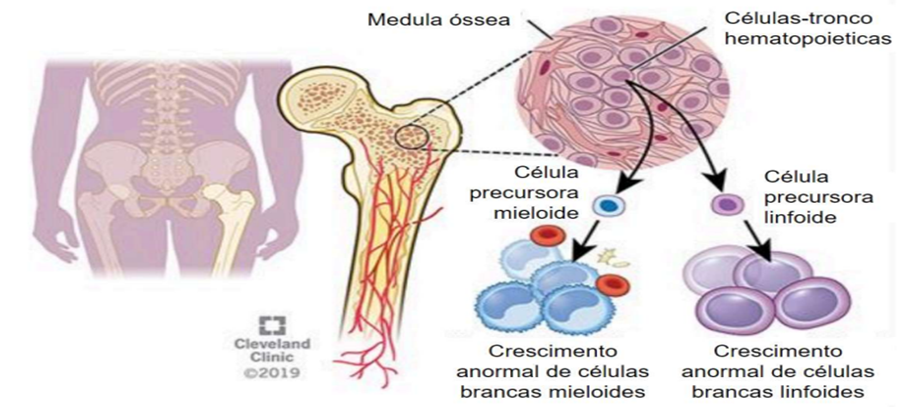
2.4 A Participação dos profissionais de Saúde e os Avanços existentes no Diagnóstico e tratamento da Leucemia Linfoblástica Aguda infantil.
O biomédico Alexander Bibrair, capa da revista Science em 2016, falou com o Conselho Federal de Biomedicina sobre a pesquisa “O nicho das células-tronco hematopoéticas no fígado fetal está associado aos vasos portais”. De acordo com o biomédico, essa pesquisa pode permitir aos investigadores recriar o ambiente da medula óssea em pequenos recipientes usados em laboratórios, método até então inviável para o cultivo desses tipos de células. Ele explica que as células vinculadas aos vasos sanguíneos (pericitos) podem se combinar e formar um nicho que permita promover a expansão das células-tronco hematopoiéticas no fígado.
Em seu artigo intitulado “Nicho das células-tronco hematopoiéticas no fígado fetal está associado aos vasos portais” (Bibrair, 2016). O mesmo demonstrou que os pericitos (células contráteis que envolvem as células endoteliais dos vasos em todo o corpo) expressam Nestin e NG2. Associados com os vasos portais no fígado formam um nicho que promove a expansão das células-tronco hematopoiéticas.
Embora outros tipos de células-tronco sejam rotineiramente cultivados em placas de Petri, as células-tronco hematopoéticas são muito difíceis de cultivar em laboratório. Elas parecem exigir que o ambiente da medula óssea funcione adequadamente. Esta pesquisa pode permitir aos investigadores recriar esse ambiente em uma placa de Petri. O potencial dos pericitos do fígado fetal de promover a expansão das células-tronco hematopoiéticas poderá ser usado para desenvolver complexos sistemas de cultivo destas células em cultura para aplicações clínicas, tais como a expansão de células-tronco hematopoiéticas derivadas do sangue de cordão umbilical.
Entender as alterações no Genes (DNA) na LLA, torna possível criar terapias especificas para Leucemia Linfoide Aguda. Tais como os medicamentos imatinibe e o desatinibe, que são usados em pacientes com LLA, cujas células leucêmicas tem o cromossomo filadelfia. Outros medicamentos estão em desenvolvimento com foco nas alterações das células leucêmicas. (ONCOGUIA, 2022).
Uma grande conquista foi a portaria GM/MS, nº 2251, de 8 de dezembro de 2023, que inclui, na tabela de procedimento, medicamentos, órteses, próteses e materiais especiais do SUS, os procedimentos para tratamento da Leucemia Linfoblástica Aguda (LLA) B derivada pediátrica em primeira recidiva medular de alto risco. (MINISTÉRIO DA SAÚDE, 2023).
A terapêutica da LLA é uma área em renovação. Tratamentos inovadores, com maior especificidade para o alvo terapêutico e menor grau de toxicidade para o organismo, têm vindo a substituir a quimioterapia convencional. É o caso da imunoterapia, que utiliza anticorpos monoclonais contra os marcadores de superfície expressos pelas células neoplásicas, como CD20, CD19 e CD22, conjugados, ou não, com fármacos citotóxicos. Outras terapêuticas emergentes incluem os inibidores do proteossoma e os inibidores de tirosina-cinase. O transplante alogénico de células estaminais hematopoiéticas ainda constitui o tratamento padrão para os casos de doença refratária, mas o transplante autólogo de células T CAR constitui uma alternativa promissora e tem vindo a ser autorizado em alguns países europeus, nomeadamente Portugal (MATIAS, 2019).
Pesquisa realizada pela Sociedade Americana de Câncer, com dados do programa Surveillance, Epidemiology, and End Results (SEER), mostra que a taxa de sobrevida pediátrica em 5 anos, considerando pacientes de até 19 anos de idade, para LLA, passou de 57%, no período de 1975-1979, para 90%, no período de 2003-2009 (WARD et.al, 2014).
Apesar de o câncer ser a primeira causa de morte por doença não infecciosa em crianças e adolescentes (de 1 a 19 anos) no Brasil, contabilizando 8% delas, segundo o Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA), houve um progresso importante no tratamento de câncer para esse público (CRIVELARO et. al, 2022). Mesmo com muito esforço no Brasil ainda existem muitos óbitos por leucemia. Em estudo realizado no ano de 2023, percebeu-se que, segundo a categoria do CID-10, a Leucemia que mais causou óbitos em crianças foi a Linfóide com 2392 mortes no período de 2017 a 2022 (GILIO JUNIOR, et.al, 2023). A seguir teremos a incidência da doença estratificada por região, por atendimento e sua mortalidade conforme ilustra a figura abaixo:
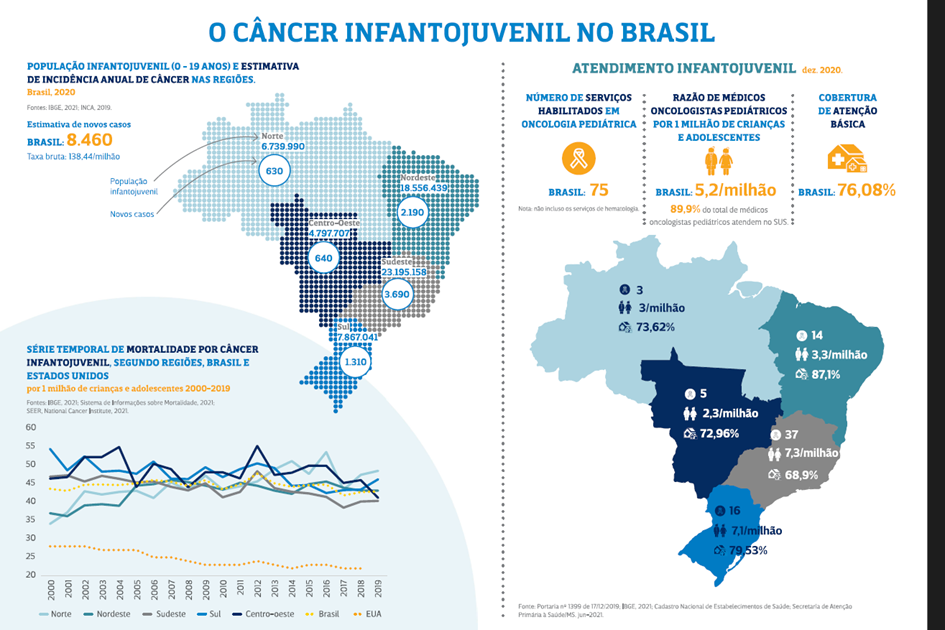
Recentes pesquisas mostram que países de alta renda, como Canadá, Reino Unido, Bélgica, Dinamarca, Alemanha, Suíça e Holanda, possuem taxa de sobrevida de LLA em crianças superioras a 90%, nos anos de 2010 a 2014. Há uma lacuna na literatura brasileira sobre estudos de base populacional sobre a leucemia em crianças. Poucos trabalhos dão ênfase aos indicadores epidemiológicos da leucemia infantil, de forma específica.
A taxa de sobrevida populacional desse tipo de câncer infantil é pouco explorada, devido à dificuldade existente em diversos registros de câncer de base populacional do Brasil. A grande maioria dos trabalhos se refere a características de grupos específicos hospitalares. (SILVA e LATORRE, 2020).
Quando acomete crianças, “a leucemia linfoblástica aguda apresenta cerca de 80% de sobrevida – índice que pode chegar a 90% caso o diagnóstico da LLA seja feito logo no início. Para os adultos que possuem a doença, essa taxa é de 20% a 30%. O tratamento para esse tipo de leucemia dura aproximadamente dois anos” (ONCOGUIA, 2021). Muitas vezes, os primeiros meses são mais intensos e, por isso, é de extrema importância o acompanhamento da equipe médica. Os principais tratamentos para a leucemia linfoide agudam são:
- Quimioterapia – usa fortes medicamentos anticancerígenos, geralmente por via venosa, para destruir as células malignas. O tratamento acaba atingindo também as células saudáveis do organismo, por isso é necessário administrar os possíveis efeitos colaterais, como fadiga, queda de cabelo, náuseas e vômitos, infecções e perda de apetite.
- Terapia alvo – usa medicamentos via oral que agem somente em partes específicas das células cancerígenas.
- Transplante de células tronco – substitui as células doentes da medula óssea do paciente por células saudáveis, que podem vir de um doador, ou da própria pessoa. Nesse último caso, as células são tratadas antes de retornar ao paciente.
- Imunoterapia – usa medicamentos para estimular o próprio sistema imunológico da pessoa a destruir as células cancerígenas.
Cada tratamento deste traz consigo delicadas sensações, onde se encontra o paciente, normalmente bastante fragilizado em função do diagnóstico, prognóstico ou mesmo em consequência de seus tratamentos penosos. A inquietude perante a evolução da doença, a esperança em relação aos tratamentos e à cura, os exames médicos, os momentos de espera face ao que é desconhecido, a hospitalização, os efeitos colaterais, a qualidade de vida, dentre outras questões se faz extremamente necessária a intervenção psico-oncológica por parte do Psicólogo.
A Psico-Oncologia representa uma área do conhecimento da Psicologia da Saúde, tratando dos cuidados com o paciente oncológico, bem como sua família e os profissionais que se encontram envolvidos no seu tratamento. Logo, a Psico-oncologia é uma área voltada para as questões emocionais do paciente portador de câncer (VEIT; CARVALHO, 2010).
Outro Profissional bastante atuante e necessário vem a ser o enfermeiro (a), pois o mesmo precisa atuar em seus diagnósticos específicos com pacientes de leucemias para que não se tenha: risco para infecção, Risco para alteração da temperatura corporal, diarreia, Processos
familiares alterados, nutrição alterada, devendo o profissional de enfermagem executar ações frente a este paciente propiciando um melhor conforto dentro do seu quadro patológico (DA SILVA et.al, 2018). profissional deve conhecer também as principais indicações da transfusão de sangue, checar dados importantes a fim de prevenir a ocorrência de erros, orientar os familiares e os pacientes sobre a transfusão, atuar no atendimento das reações transfusionais e registrar todo processo.
O profissional de serviço social desempenha um papel crucial no tratamento da LLA, fornecendo apoio emocional e psicossocial aos pacientes e suas famílias, facilitando o acesso a recursos e serviços necessários, coordenando os cuidados entre os diferentes profissionais de saúde e defendendo os direitos dos pacientes. Sua contribuição é fundamental para garantir que os pacientes recebam o suporte e os cuidados de que precisam ao longo do processo de tratamento da LLA. Segundo Nogueira e Mioto (2006, p. 282) por estar situado no processo de trabalho coletivo em saúde, o assistente social – pautado na lógica dos direitos e da cidadania e na organização do seu trabalho – “abarca os fatores de ordem política, econômica e social que condicionam o direito a ter acesso aos bens e serviços necessários para se garantir a saúde, bem como exige uma consciência sanitária que se traduz em ações operativas na concretização dos direitos”.
O biomédico por sua vez, com sua experiência e expertise identifica de forma assertiva qual o tipo de LLA que irá ser tratado. De acordo com o inciso II do artigo 2º, da Resolução nº 78, de 29 de abril de 2002, que foi modificada pela Resolução nº277 de 7 de maio de 2013, “o Biomédico é profissional legalmente capacitado e habilitado para assumir o assessoramento e executar trabalhos específicos e relacionados ao processamento semi-industrial e industrial do sangue, correlatos, e realizar todos os procedimentos técnicos de banco de sangue, transfusão, infusão de sangue, hemocomponentes e hemoderivados”.
A referida Lei acima citada nos remete o quão importante é a atuação do Biomédico em exames essenciais para o diagnóstico de Leucemias, como, o Hemograma que avalia a quantidade, aparência e formato das células; a Citometria de Fluxo é utilizada para descobrir leucemia linfoide crônica. Outros exames como, Citogenética, Hibridização Fluorescente in situ (FISH), Exames Moleculares e Biópsias também são utilizados para diagnóstico e mapeamento de Leucemias (DA COSTA, 2022).
Os médicos desempenham um papel central no tratamento da Leucemia Linfoide Aguda, desde o diagnóstico até o acompanhamento após o tratamento. Eles lideram a equipe de saúde, coordenam o cuidado do paciente e trabalham para garantir os melhores resultados possíveis para os pacientes com LLA. O papel do médico ao prescrever tratamentos e medicamentos é fundamental para garantir a recuperação do paciente e prevenir complicações. Após o diagnóstico preciso, o médico é responsável por escolher o tratamento mais adequado para a condição do paciente, levando em consideração fatores como a gravidade da doença, o estado geral de saúde do paciente e quaisquer condições médicas pré-existentes. (MARANHÃO MAIS, 2023).
3 METODOLOGIA
A metodologia do presente artigo, consiste em uma pesquisa bibliográfica de revisão literária, realizada de Junho de 2023 à Maio de 2024, a partir de registros disponíveis, decorrentes de pesquisas anteriores em documentos, como livros, artigos e sites.
Na construção do artigo, foram realizadas buscas sobre a participação dos profissionais de saúde no diagnóstico da Leucemia Linfoblástica Aguda (LLA), bem como o conceito e diagnóstico da doença. Utilizaram-se diferentes bases de dados dentre as quais se destacam a PUBmed (Sistema Online de Busca e Análise de Literatura Médica), Scielo (Scientific Electronic Library Online), INCA (Instituto Nacional do Cancêr), Ministério da Saúde, dentre outros sites no período de 2004 à 2022.
Os descritores utilizados na busca foram: Leucemia Infantil, leucemia linfoblástica aguda, medula óssea, profissionais de saúde, tratamento e diagnóstico da leucemia linfoblástica aguda. Foram considerados aqueles artigos com acesso disponível, cujo contexto era diretamente relacionado ao tema deste trabalho. Os critérios de inclusão para os estudos encontrados foram focados nas técnicas de diagnóstico da leucemia linfoblástica aguda infantil e, os critérios de exclusão foram a leucemia adulta, leucemia mieloide e outros tipos de leucemia que não fosse a linfoblástica. No início utilizou-se uma pesquisa exploratória para entender se a problemática que seria tratada no presente trabalho de fato teria respostas e de acordo com o quadro abaixo chegou-se à solução do problema e a construção dos objetivos. Nós pesquisamos diversos artigos, porém, esses citados na tabela a seguir foram os que mais embasaram os resultados da pesquisa.
Artigos encontrados e selecionado
Nº AUTORES ARTIGOS ANO 1 MARTINS DE CASTRO, Simone; GRANERO FARIAS, Mariela Diagnóstico laboratorial das leucemias linfóides agudas 2004 2 R.SATANA, et al Perfil Epidemiológico das Leucemias em Crianças e Adolescentes no Estado da Bahia. 2006 3 CUNHA ANTUNES SARAIVA, Danúbia; SILVA SANTOS, Sabrina; TORRES REGO MONTEIRO, Gina Tendência de mortalidade por leucemias em crianças e adolescentes nas capitais dos estados brasileiros: 1980-2015 2015 4 FONSECA, Renata e MATTA DE CASTRO, Marcelo A importância da atuação do psicólogo junto a pacientes com câncer: uma abordagem psico-oncológica 2016 5 WAGNER DA SILVA, João et al Ações de Enfermagem ao portador de leucemia: uma revisão integrativa 2018 6 M.REGO, Eduardo; A.S.SANTOS, Guilherme A influência da citometria de fluxo no diagnóstico diferencial das Leucemias Linfoides 2018 7 HOLANDA BEZERRA SANCHEZ, Laís Diagnóstico laboratorial das Leucemias Agudas 2020 8 JOSÉ GREGIANIN, Lauro; LUNARDI BRUNETTO, Algemir; GALVAO DE CASTROJR., Cláudio Análise clínica e epidemiógica do transplante de medula óssea em um serviço de oncologia pediátrica 2020 9 BARBARA DE FREITAS LUNGUINHO, Anna e NATHALY LIMA FALCÃO DE OLIVEIRA, Debora Atuação do profissional biomédico no diagnóstico da leucemia mieloide aguda (LMA) 2022 10 SILVA SANTOS, et al Diagnóstico da leucemia linfoblástica aguda em crianças 2022 11 ARIANE FERREIRA DA COSTA, Marcela Atuação do biomédico no transplante de medula óssea para o diagnóstico do tratamento de leucemias 2022
4 RESULTADOS E DISCUSSÕES OU ANÁLISE DOS DADOS
Com base nos autores pesquisados e seus principais resultados alcançados sobre o estudo de Leucemia Linfoblástica percebeu-se que é necessário se ter um diagnóstico assertivo e precoce, tal resultado e citado em praticamente 90% dos Artigos pesquisados e, evidencia a participação do biomédico nesse diagnostico, pois o mesmo “tem que avaliar e analisar todos os fatores das células para uma boa investigação da doença, logo, são utilizados exames hematológicos (hemograma, leucograma, plaquetograma, esfregaço sanguíneo e medular), citogenética, biologia molecular e a imunofenotipagem por citometria de fluxo” (SILVEIRA; ARRAES, 2012).
O que dá parâmetro ao diagnóstico vem a ser as classificações das Leucemias e, a imunofenotipagem, comumente usada foi estabelecida pelo European Group for Immunophenotyping Leukemias (EGIL), que é baseado na representação imunofenotípica das células, que estão em concordância com a morfologia do caso, possibilitando assim a distinção em subtipos imunológicos. Estudos atestam que após a verificação, pode-se classificar a linhagem celular em (B ou T), e que aproximadamente 20% dos casos são de origem de célula T; 75%, precursores de célula B; e 5%, de célula B madura (CAVALCANTE et.al, 2017).
O grupo French American British (FAB) classificou as LLAs em três subtipos morfológicos – L1, L2 e L3 – com base no diâmetro celular, na forma do núcleo, no número e na protuberância dos nucléolos e na quantidade e no aspecto relativos do citoplasma. Tal divisão na classificação permite um diagnóstico rápido, mas cuidados devem ser tomados na sua interpretação, pois os linfoblastos L2 são facilmente confundidos com mieloblastos M0 e M1 indiferenciados da LMA. Outro problema é que aproximadamente 10% dos pacientes com LLA têm uma população morfologicamente heterogênea de blastos: alguns L1 e outros L2 (FARIAS E CASTRO, 2004).
A incidência da LLA está nas crianças de 0 a 10 anos e, menores de 19 anos com predominância em meninos, isso fica claramente evidenciado em um artigo sobre perfil epidemiológico das Leucemias em Crianças e Adolescentes no Estado da Bahia de 2004 a 2006 onde, constatou-se que, quando os casos de leucemia foram estratificados por grupo etário, 36,4% das leucemias ocorreram entre os 2 e 5 anos, 25,4% na faixa de 6 a 9 anos, 21,1% na faixa de 10 a 14 anos, 10,1% de 29 dias a 1 ano, 6,7% de 15 a 18 anos e 0,3% de 0 a 28 dias (VIANNA et. al, 2006).
O Panorama de Oncologia Pediátrica no Brasil em 2021, realizado pelo Instituto Desiderata, explicitou o quanto crianças morrem em decorrência de Câncer e o Sudeste apresentou o maior índice de morte em comparação a outras regiões do Brasil perfazendo um total de 43,62%, seguido pelo Nordeste que representa 25, 89% de mortes por câncer. Os 30, 49% restante ficam divididos entre as regiões norte, centro oeste e sul. Isso se deve em grande parte pelo fato de o número de oncologistas pediátricos ser insuficiente para atender a demanda. No norte do Brasil em 2021 existiam três oncologistas pediátricos para atender 3 milhões de crianças e adolescentes. Já na Região Nordeste Quatorze oncologistas para três milhões e trezentos (DESIDERATA, 2021). Esses dados nos mostram a criticidade dos profissionais médicos que estejam qualificados nessa área, desta forma chegar a cura torna-se cada vez mais complexo.
No que tange a tratamentos, o transplante de células-tronco hematopoiéticas (TCTH), permanece como melhor opção terapêutica para os pacientes de leucemia com alto risco ao diagnóstico e para a maioria daqueles que sofrem recaída. Em estudo foi realizado com 208 pacientes menos de 19 anos, submetidos a TCTH, por leucemia aguda, no período de Abril de 1990 a Dezembro de 2007, no Hospital de Clinicas (UFPR, Curitiba) e, no Hospital Amaral Carvalho, Jaú em São Paulo, foram transplantados 20 pacientes com leucemia linfoblastica aguda (LLA) em primeira remissão clínica (RC1); destes, 12 tinham citogenética de alto risco (t(9;22), t(4:11) ou hipodiploidia), outros dois pacientes apresentaram resposta pobre a indução com corticoides e os demais pacientes transplantados tinham LLA-T de alto risco (BITENCOURT, et. al, 2010).
Outro importante fato a ser discutido vem a ser a inclusão do psicólogo no tratamento de câncer infantil, profissional este ainda pouco explorado nesse cenário. Questões emocionais e comportamentais foram identificadas no estudo de Hostert, Enumo e Loss (2014) e devem ser considerados como um alerta pelos serviços de atendimento psicológico em hospitais, pois há um alto índice de crianças (61,1%) que necessitam de atendimento psicológico ou psiquiátrico.
Reconhecer que no processo do adoecimento infantil muitas vezes as crianças são pouco informadas sobre os acontecimentos de sua doença, “ou então são confrontadas com a impotência parental frente à doença e à morte, sendo entregues aos perigos da vida, à própria sorte” (Miceli e Zornig, 2012).
5 CONCLUSÃO/CONSIDERAÇÕES FINAIS
O presente trabalho ressalta a importância do diagnóstico e o tratamento da LLA entre diversos autores todos apontavam a importância de um diagnóstico assertivo, coerente, e tratamento eficaz, contudo, entendemos que os profissionais de saúde são importante dentro deste processo de identificar, cuidar, medicar e acompanhar na sobre vida do paciente e o biomédico tem um papel crucial no que tangi no processo de identificar, analisar e aponta o melhor tratamento para o combate desta doença avassaladora, pois, o biomédico em questão conforme as literaturas supracitadas citam que analise do biomédico no diagnóstico é importantíssima no procedimento de conhecer e saber qual família da LLA temos que enfrentar e tratar da melhor maneira possível o paciente, reduzindo os efeitos colaterais do tratamento. Outro ponto importante que a classificação FAB junto com a citometria de fluxo e a imunofenotipagem é a técnica mais eficaz para saber qual LLA estaremos combatendo e evitando iniciar um tratamento errôneo.
Além disso, a abordagem multidisciplinar é fundamental no manejo da LLA, envolvendo não apenas o diagnóstico e tratamento médico, mas também o suporte psicológico, nutricional e social para a criança e sua família. O profissional da saúde desempenha um papel fundamental na coordenação dessa equipe multidisciplinar, garantindo uma abordagem holística e integrada ao cuidado do paciente.
É importante ressaltar também a importância da educação e conscientização da comunidade sobre os sinais e sintomas da LLA, bem como a disponibilidade de serviços de saúde adequados para o diagnóstico e tratamento precoces. Quanto mais cedo a LLA for diagnosticada, melhores serão as chances de sucesso do tratamento e de cura.
Em suma, a participação ativa e diligente do profissional da saúde no diagnóstico da LLA em crianças de 0 a 10 anos é fundamental para garantir um prognóstico favorável e uma melhor qualidade de vida para esses pacientes. É preciso estar sempre atualizado sobre as melhores práticas e diretrizes para o diagnóstico e tratamento da LLA, visando sempre o bem-estar e a saúde das crianças afetadas por essa doença devastadora.
REFERÊNCIAS
ABRALE, 2022(https://revista.abrale.org.br/saude/2022/05/exame-de-imunofenotipagem-o-que-e-e-como-e-feito/
BORGES, R. G. P. A importância da imunofenotipagm por citometria de fluxo no diagnóstico e monitoramentro das Leucemias Linfoides Agudas. Pontifícia Universidade Católica de Goiás, 2020.
COSTA, R. S.; FRANÇA, L. S. A.; PALUCH, L. R. B.; TEIXEIRA, H. M. P.; MELO, A. P. C. A influência da citometria de fluxo no diagnóstico diferencial das Leucemias Linfoides. Textura, 2018.
Castanho P, Fome SP, Smith FO, Carroll WL, Reaman GH. Novas terapias medicamentosas direcionadas para o tratamento da leucemia aguda infantil. Perito Rev Hematol. Junho de 2013; 6(3):301-12. DOI: 10.1586/ehm.13.16. Disponível em: Registros de Câncer de Base Populacional — Instituto Nacional de Câncer – INCA (www.gov.br). Acesso dia 13/03/2024
Estadiamento da leucemia linfoide aguda (LLA) | Instituto Oncoguia
ELIAS, Cassandra e LOURDES SILVA DE ARRUDA MORAIS, Maria – Manifestação oral dos efeitos da quimioterapia em crianças com LLA, julho 2013
Fome SP, Mullighan CG. Leucemia Linfoblástica Aguda em Crianças. N Engl J Med. 2015 15 de outubro; 373(16):1541-52. DOI: 10.1056/NEJMra1400972.
FREITAS DE MORAIS, Everton e ALEXANDRE DA SILVA LIRA, Jadson e AUGUSTO DE PAIVA MACEDO, Rômulo e STEYLLON DOS SANTOS, Klaus e TEXEIRA VALLE
FERREIRA, J. D. et al. Exposições ambientais e leucemias na infância no Brasil:uma análise exploratória de sua associação. Revista Brasileira de Estudos de População, v. 29, p. 477–492, 1 dez. 2012.4.
HILARIO, W. F.; HILARIO, L. S. M. Principais alterações hematológicas da Leucemia Linfocítica Aguda (LLA). PECIBES, 2021.
HILARIO, W. F.; HILARIO, L. S. M. Principais alterações hematológicas da Leucemia Linfocítica Aguda (LLA). PECIBES, 2021.
Leucemia. — Instituto Nacional de Câncer – INCA (www.gov.br).
LARSON, 2014. Leucemia aguda – Richard A. Larson | MedicinaNET
LEE, R, G. et al.Wintrobe Hematologia Clinica. I. ed. São Paulo: Manoele, 1998
CRIVELARO, V. et al. LEUCEMIA MIELOIDE AGUDA SECUNDÁRIA A TRATAMENTO DE LEUCEMIA LINFOCÍTICA CRÔNICA. Hematology, Transfusion and Cell Therapy, v. 44, p. S173, out. 2022
MELO, N. Tendências da mortalidade por leucemia no Brasil.
NONINO, A. Problemas e perspectivas do tratamento da Leucemia Mielóide Crônica no Brasil. Revista Brasileira de Hematologia e Hemoterapia, v. 30, abr. 2008.
ONCOGUIA. Disponível em: https://www.oncoguia.org.br/conteudo/tratamento-tipico-da-leucemia-linfoide-aguda-lla/7861/318/. Acesso em: 27 de Abril de 2024
PEDROSA, Francisco e LINS, Mecneide – Leucemia linfóide aguda: uma doença Curável, Abril 2002
Pui CH, Evans NÓS. Tratamento da leucemia linfoblástica aguda. 2006 12 de janeiro; 354(2):166-78. DOI: 10.1056/NEJMra052603.
Roberts KG, Mullighan CG. Genômica na leucemia linfoblástica aguda: considerações e implicações para o tratamento. Nat Rev Clin Oncol. Junho de 2015; 12(6):344-57. DOI: 10.1038/nrclinonc.2015.63.
SANCHEZ, L. H. B. Diagnóstico laboratorial das Leucemias Agudas. Academia de ciência e tecnologia, 2020.
VIEIRA, A. F.; NEVES, B.; TONELLI, S. R. Perfil epidemiológico da leucemia linfoide nas regiões do Brasil. Revista UNILUS Ensino e Pesquisa, v. 14, n. 37, p. 130-143, 2018.
Ward E, DeSantis C, Robbins A, Kohler B, Jemal A. Childhood and adolescent cancer statistics, 2014. CA Cancer J Clin 2014; 64:83-103
LADINES-CASTRO, W. et al. Morphology of leukaemias. Revista Médica del Hospital General de México, v. 79, n. 2, p. 107–113, abr. 2016.
Veit MT, Carvalho VA. Psico-Oncologia: um novo olhar para o câncer. O Mundo da Saúde[periódico na internet]. 2010[acesso em 2022 out 10]; 34(4): 526-530. Disponível em: <http://www.saocamilo-sp.br/pdf/mundo_saude/79/526a530.pdf>.
Hostert, P. C. C. P., Enumo, S. R. F. &, Loss, A. B. N. (2014). Brincar e problemas de comportamento de crianças com câncer de classes hospitalares. Revista Psicologia: Teoria e Prática, 16(1), 127-140. Acesso em: 21 de Março de 2023. Disponivel em: https://editorarevistas.mackenzie.br/index.php/ptp/article/view/5366
¹Maysa Alves Nogueira, Curso Superior de Biomedicina do Centro Universitário do Norte – UNINORTE e-mail: meisiealves@gmail.com
²Noemi Cesar, Curso Superior de Biomedicina do Centro Universitário do Norte – UNINORTE e-mail: noemicesar987@gmail.co
