FEASIBILITY TEST OF SEWAGE TREATMENT SLUDGE USE AS FERTILIZER
REGISTRO DOI:10.5281/zenodo.10107484
Fernando Guilherme Cardoso Verdugo Piccoli Santana ¹, Victor Zolnerkevic Marangon ¹, Thiago Torres de Lima, ¹ Orientador: Alexandre Correa de Lima
RESUMO
O uso de fertilizantes é uma das práticas mais comuns do agronegócio em todo o mundo. Ainda assim, novas origens e tecnologias são constantemente procuradas no intuito de gerar produtos mais lucrativos às fabricantes, bem aceitos pelos agricultores e pouco danosos ao meio ambiente. Se buscarmos portanto uma origem sustentável para um novo fertilizante encontramos diversas possibilidades em um sistema de tratamento de esgotos, que gera um resíduo de alto valor nutritivo agregado, no caso, o lodo extraído da água após finalização do tratamento. Deste modo, são avaliados os teores de nutrientes do lodo residual do tratamento de esgotos, tal como possíveis rotas de aplicação e seus obstáculos diretos.
Palavras-chave: Fertilizante, tratamento de esgotos, lodo residual, sustentabilidade.
ABSTRACT
The use of fertilizers is one of the most common practices in agribusiness worldwide. Nevertheless, new sources and technologies are constantly sought in order to generate more profitable products for manufacturers, well-accepted by farmers, and less harmful to the environment. Thus, if we seek a sustainable source for a new fertilizer, there are various possibilities in a sewage treatment system, which produces a residue of high nutritional value, namely the sludge extracted from the water after the completion of the treatment. Consequently, the nutrient contents of the residual sewage treatment sludge are evaluated, along with possible application routes and their direct obstacles.
Key words: Fertilizer, sewage treatment, residual sludge, sustainability.
1 INTRODUÇÃO
A ideia de aplicar substâncias ao solo como forma de promover um aumento da sua qualidade para melhor desenvolvimento de culturas que serão futuramente ali semeadas é uma prática que precede muitos séculos à atualidade (TURNER, 2008), ainda assim, a técnica dos fertilizantes persiste, podendo contar hoje múltiplos recursos e alta tecnologia (SHANNON et al., 2020), posicionando o agronegócio como uma dos mais lucrativos no Brasil (MINISTÉRIO DO PLANEJAMENTO E ORÇAMENTO, 2022) e no mundo, correspondendo, por exemplo, à praticamente 25% do PIB nacional em 2022 (MINISTÉRIO DA AGRICULTURA E PECUÁRIA, 2023).
Deve-se ter em mente também que a minimização de impactos ambientais é uma preocupação constante no desenvolvimento de qualquer produto da atualidade, uma vez que, se comprovados efeitos negativos de um produto para a população ou o ambiente, o produto sofre uma grave desvalorização devido à rejeição do produto (DE MENEZES et al., 2012), essa acaba por se projetar de mesmo modo sobre a fabricante. Essa problemática atinge também o ramo agrícola que busca frequentemente alternativas sustentáveis para se posicionar com destaque no mercado.
Uma das alternativas sustentáveis que provoca interesse das indústrias é o reaproveitamento de resíduos (TOCCHETTO, 2005), uma vez que, além de reduzir o volume de material destinado à aterros, gera uma grande economia à produtora no que se refere à aquisição de matérias-primas e operação de processos fabris, uma vez que, caso o resíduo possua valor agregado in natura, não há necessidade de gastos em operações corretivas e de melhoramento.
Avaliando múltiplos rejeitos industriais percebe-se um grande potencial nutritivo no lodo residual do tratamento de esgotos. Esse potencial se deve majoritariamente às substâncias utilizadas nesse processo de tratamento, como a Cal Hidratada e o Cloreto Férrico (CAESB, [201-?]), estas substâncias contribuem, respectivamente, com teores de Cálcio (Ca) e Ferro (Fe), fora isso, espera-se também alta carga orgânica devido à matriz tratada nesse sistema (METCALF & EDDY et al., 2013). Demais nutrientes como Nitrogênio (N), Enxofre (S), Fósforo (P) e outros micronutrientes como Cobre (Cu), Zinco (Zn) e Manganês (Mn) também são cotados como possíveis constitiuintes do lodo, considerando possíveis junções da matriz de esgoto doméstico com a matriz de esgoto industrial, onde tais elementos químicos seriam mais facilmente encontrados (WOODARD, 2001).
2 METODOLOGIA
Inicialmente, em contato com empresas de tratamento de esgoto, foi disponibilizada a possibilidade de coleta de algumas amostras para avaliação química, assim sendo, quatro pontos diferentes do lodo armazenado pela empresa, a qual solicitou que seu nome fosse mantido em sigilo, foram utilizados para amostragem e posterior análise em duplicata, seguindo majoritariamente as metodologias analíticas disponíveis no Manual de Métodos Analíticos Oficiais Para Fertilizantes e Corretivos, disponibilizado oficialmente pelo MAPA (Ministério da Agricultura, Pecuária e Abastecimento). Foram discorridas as determinações de umidade, pH, metais, nitrogênio, fósforo, enxofre e carbono orgânico, todas com caráter investigativo no que se refere à concentração.
2.1 Umidade
O material se configura em uma torta, ou seja, um sólido pastoso. Levando em consideração esse aspecto pode-se esperar uma grande quantidade de água no lodo, nesse caso, espera-se uma alta variação entre os teores de nutrientes em base seca e base úmida, uma vez que o excesso de água do material promoveria uma maior diluição dos compostos ali presentes. Tais teores, uma vez obtidos, serão cruciais para verificar se o lodo possui aplicabilidade enquanto úmido ou necessita de secagem para aumento da concentração de seus nutrientes.
Para a determinação, massas em torno de 16g do material foram pesadas sobre placas de petri secas e previamente pesadas e levadas à uma estufa de circulação à 105°C até apresentar constância de peso, processo esse que levou aproximadamente 5 horas para sua conclusão. Assim que retiradas da estufa, as placas foram levadas a um dessecador até atingirem temperatura ambiente, para serem então novamente pesadas. O lodo antes e depois da secagem é visível, respectivamente, nas Figuras 1 e 2.


2.2 pH
Por mais cotidiana que seja uma análise de pH para um laboratório, esse aspecto é extremamente crítico se tratando de materiais agrícolas, de tal modo a avaliação é feita de modo a investigar se o lodo possui condições de aplicação em uma plantação no seu estado original.
Para a determinação, foram preparadas soluções de 10% m/m do lodo em água deionizada (10g do material + 90g de água), sendo posteriormente lidas em um pHmetro do modelo DM-23-FL, da DIGIMED, devidamente calibrado.
2.3 Metais
Considerando os teores elevados de Cálcio e Ferro que são previstos na amostra, uma análise em absorção atômica de chama foi realizada no equipamento da Varian (modelo AA240FS), a análise foi efetuada não só para os metais esperados, mas também foi feita uma varredura investigativa, para eventualmente verificar a presença de algum outro nutriente disponível na amostra. No caso de Sódio e Potássio o equipamento utilizado foi um Fotômetro de Chama de modelo DM-63 da Digimed. Todos os equipamentos, assim como os insumos foram disponibilizados pela ICL, empresa Israelense do ramo de fertilizantes, especificamente, na unidade de Suzano I.
Visando uma extração completa dos analitos, uma massa de aproximadamente 2,5g do lodo seco foi pesada e submetida a uma digestão ácida em Ácido Clorídrico P.A. (HCl), conforme o manual de métodos do MAPA (2017), todas as soluções foram avolumadas para balões de 250 mL, gerando uma diluição inicial de 100 vezes (ou 1:100). A massa foi pesada a partir do lodo seco para evitar desvios da quantidade de água na amostra original, que pode mascarar a presença de analitos que estejam em baixa concentração.
Algumas amostras, devido ao alto teor encontrado, tiveram que sofrer uma segunda diluição para se adequarem aos parâmetros de leitura dos equipamentos utilizados, a diluição pode ser calculada utilizando a absorbância dada em cada leitura de amostra, em comparação com a leitura de um padrão intermediário de uma curva de calibração do elemento de interesse. Sendo assim, foram determinados os teores de Cálcio, Alumínio, Ferro, Manganês, Magnésio, Zinco, Cobre, Níquel, Cobalto, Molibdênio, Sódio, Potássio, Cádmio, Chumbo e Cromo em porcentagem.
No caso dos elementos Cálcio (Ca), Magnésio (Mg) e Molibdênio (Mo) foram utilizadas, também, soluções supressoras de Cloreto de Lantânio 50g/L (para Cálcio e Magnésio) e de Cloreto de Alumínio 10g/L (para Molibdênio), conforme indicado no manual de métodos mencionado anteriormente para a extração.
2.4 Nitrogênio
Sendo o nitrogênio um dos principais nutrientes no meio agrícola, sua avaliação se torna imprescindível, sendo feita nesse caso pelo Micrométodo da Liga de Raney, que consiste em uma digestão ácida da amostra em Ácido Sulfúrico (H2SO4) juntamente com o Pó Catalítico de Raney (50% Ni, 50% Al em massa) que converte o nitrogênio ali presente em compostos amoniacais, esse processo é seguido por uma destilação alcalina da amônia com Soda Cáustica (NaOH), com o destilado sendo recebido em solução de Ácido Bórico (H3BO3), formando Borato de Amônio (NH4H2BO3–), que é posteriormente titulado com solução de ácido sulfúrico 0,025N. Para o lodo, foi pesado por volta de 1g de amostra e diluído para um balão de 100mL, adotou-se uma alíquota de 10mL para a digestão.
2.5 Fósforo (Como P2O5)
Assim como o Nitrogênio, o Fósforo é um dos nutrientes mais importantes para a planta, estando presente em uma vasta gama de fertilizantes comerciais, logo, sua quantificação foi feita pelo método gravimétrico para amostras contendo fosfito (sais de ácido fosforoso, H3PO3), aqui, a amostra é submetida à uma oxidação em uma mistura de 30 mL de ácido nítrico P.A. (HNO3) e 5 mL de ácido Clorídrico P.A. (HCl), até redução de volume de 2-3 mL, seguida de uma diluição com 90 mL de água deionizada e 10 mL de ácido nítrico 1+1, que é aquecida até fervura suave por 10 minutos, sendo posteriormente precipitada com 50 mL de Quimociac (reagente composto por molibdato de sódio di-hidratado (Na2MoO4.2H2O), ácido cítrico cristalizado (C6H8O7.H2O), ácido nítrico, quinolina sintética (C9H7N) e acetona), onde é fervido por mais 1 minuto, resfriado a temperatura ambiente e filtrado em cadinho de Gooch previamente seco e pesado e levado à secagem em mufla à 240°C por 30 minutos.
Nessa análise foi adotada uma alíquota de 10 mL do mesmo extrato utilizado no método para metais 2.3.
2.6 Enxofre (Como sulfatos – SO42-)
Sendo um macronutriente estrutural, se torna extremamente vantajoso possuir sulfatos na composição de um fertilizante, de tal modo, é feita sua quantificação pelo método gravimétrico, que consiste na extração dos sulfatos da amostra por abertura com Ácido Clorídrico e posterior precipitação com Cloreto de Bário (BaCl2). O precipitado é retido em um filtro faixa azul e lavado com água quente (80-90°C) para a eliminação de cloretos, por fim, é posto em um cadinho de porcelana levado à mufla a 800°C por 30 minutos, resfriado naturalmente à temperatura ambiente e pesado para posterior quantificação.
Para a análise, foram testadas massas de 0,5g, 1g e 2g da amostra seca.
2.7 Carbono Orgânico
Como já citado, devido à matriz que compõe o esgoto doméstico, é esperada elevada carga orgânica, o que se configura em outro aspecto positivo para o uso do lodo como potencial fertilizante. Para a determinação de Carbono Orgânico adota-se o método volumétrico com Dicromato de Potássio (K2Cr2O7), que consiste na oxidação do Carbono em via úmida, com 20 mL do Dicromato e 26 mL de ácido sulfúrico concentrado, sob aquecimento. A solução oxidada obtida dessa destilação é avolumada para um balão de 200mL, onde se adota uma alíquota de 10mL, que é unida a 10mL de ácido fosfórico 1+3 (H3PO4) e 5 gotas do indicador difenilaminasulfonato de bário [Ba(C12H10NO3S)2] e água deionizada suficiente para completar 50-70 mL de solução. Esta, por sua vez, é titulada com solução de Sulfato Ferroso Amoniacal 0,1mol/L ((NH4)2Fe(SO4)2) até surgimento da cor verde pura, uma amostra em branco é feita em paralelo para uso futuro em cálculo.
Como também acredita-se na possibilidade do lodo possuir alta concentração de cloretos advindos também do processo de tratamento, na digestão foi usado Ácido Sulfúrico contendo Sulfato de Prata (Ag2SO4) à 10g/L. Aqui, a prata impede reação do cloreto com o íon cromato (Cr2O72-), que geraria uma superestimativa do teor real de Carbono.
Para a determinação, foram utilizadas massas de 0,1g do lodo seco.
3 DISCUSSÃO DE RESULTADOS
Tendo os resultados obtidos na etapa anterior em mãos, deve-se partir da umidade, determinada pelo cálculo:
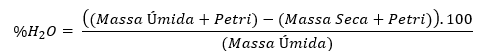
Dado o cálculo, o teor de água nas amostras pode ser visualizado na Tabela 1:
Tabela 1: Resultados de Umidade das amostras A, B, C e D.
AMOSTRA REPLICATA RESULTADO A 1 66,39% 2 63,58% B 1 68,37% 2 65,67% C 1 68,92% 2 67,31% D 1 68,97% 2 69,89%
Fonte: Acervo pessoal, 2023.
Tendo um valor de umidade média de 67,39% (Com desvio padrão de 1,95%), pode-se afirmar que, na amostra original, mais da metade da massa do material é apenas relativa à água e, se visando uma concentração mais significativa de nutrientes, a amostra é preferencialmente utilizável em base seca. Devido a isso, as próximas determinações, exceto pelo pH, terão seus resultados informados em base seca.
O pH por sua vez é outro aspecto gera dúvidas acerca da aplicação in natura do lodo, seus valores elevado, por volta de 11, visíveis na Tabela 2, se mostram extremamente danosos se aplicados em grandes quantidades, uma vez que em solos com pH acima de 8,5 notamos deficiência de nutrientes como Ferro, Manganês e Zinco, que se precipitam em formas insolúveis, sendo dificilmente absorvidos por plantas (HINSINGER, 2001), também se sabe, segundo Rengel (2002), que perante uma alta alcalinidade alta, microrganismos benéficos, como bactérias fixadoras de nitrogênio tem sua atividade inibida, reduzindo a disponibilidade Nitrogênio para plantas. Ainda assim, existe possibilidade de uso lodo como corretor de acidez para solos com pH inferior à 5,5, que, entre outros fatores, podem promover o aumento de concentração de íons tóxicos, como alumínio no solo (SUMNER, 2007).
Tabela 2: Resultados de pH das amostras A, B, C e D
RESULTADOS
RESULTADOS AMOSTRA REPLICATA 1 REPLICATA 2 A 11,17 11,14 B 11,02 11,05 C 11,07 11,00 D 11,03 11,10
Fonte: Acervo pessoal, 2023
Para os teores de metais na amostra, os resultados são apresentados na Tabela 3.
Tabela 3: Teores de metais em amostras secas
Elemento A1 A2 B1 B2 C1 C2 D1 D2 Ca 14,3147 14,6975 15,3116 13,8271 14,2999 14,1177 14,1328 14,1809 Al 2,3977 2,5199 2,4311 2,5741 2,4905 2,7976 2,7057 2,6934 Fe 3,0140 3,0877 2,9095 3,0934 3,3553 3,5636 3,4863 3,5040 Mn 0,0633 0,0654 0,0671 0,0679 0,0673 0,0672 0,0675 0,0864 Mg 0,3565 0,3857 0,3471 0,3488 0,3420 0,3490 0,3697 0,3554 Zn 0,0885 0,0865 0,0895 0,1275 0,0957 0,0933 0,0931 0,0957 Cu 0,0218 0,0251 0,0210 0,0227 0,0215 0,0217 0,0250 0,0379 Ni 0,0067 0,0063 0,0057 0,0057 0,0057 0,0057 0,0059 0,0056 Co 0,0040 0,0039 0,0038 0,0039 0,0040 0,0041 0,0040 0,0040 Mo 0,0060 0,0057 0,0062 0,0059 0,0058 0,0061 0,0062 0,0064 Na 0,0967 0,1067 0,1154 0,1050 0,1137 0,0968 0,1128 0,1120 K 0,0509 0,0599 0,0549 0,0547 0,0549 0,0459 0,0577 0,0538 Cd 0,0008 0,0006 0,0006 0,0006 0,0006 0,0006 0,0007 0,0007 Pb 0,0137 0,0135 0,0142 0,0143 0,0149 0,0150 0,0152 0,0155 Cr 0,0071 0,0064 0,0067 0,0068 0,0067 0,0073 0,0067 0,0067
Fonte: Acervo Pessoal, 2023
Dentre os metais avaliados, os que possuem teor mais notável são Cálcio (~14,36%), Ferro (~3,25%), Alumínio (~2,57%) e Magnésio (~0,36%), os demais metais presentes, exceto pelo Cádmio, Chumbo, Cromo e Níquel, que serão tratados adiante, possuem baixas concentrações em comparação com os quatro mencionados inicialmente, de tal modo, não se evidencia benefício algum em aceitar tais metais como um diferencial do lodo quando comparado à outros fertilizantes comerciais.
Outros teores que merecem destaque são os de Fósforo, Nitrogênio e Carbono Orgânico, que tiveram suas concentrações determinadas pelos cálculos relativos às etapas 2.4, 2.5 e 2.7:

Onde C é a concentração real da solução titulante, Vb é o volume gasto na titulação do branco, Va é o volume gasto na titulação da amostra e m a massa pesada para a análise.Os resultados encontrados de Nitrogênio, Fósforo e Carbono podem ser vistos nas Tabelas 4, 5 e 6, respectivamente.
Tabela 4: Resultados de Nitrogênio por Micrométodo de Raney.
A1 A2 B1 B2 C1 C2 D1 D2 Nitrogênio (N) 2,58 2,49 2,72 2,65 2,45 2,31 2,21 2,19
Fonte: Acervo pessoal, 2023
Tabela 5: Resultados de Fósforo por gravimetria
A1 A2 B1 B2 C1 C2 D1 D2 Fósforo (P2O5) 1,81 1,83 1,74 1,68 1,65 1,69 1,92 1,87
Fonte: Acervo pessoal, 2023
Tabela 6: Resultados de Carbono Orgânico por titulação
A1 A2 B1 B2 C1 C2 D1 D2 Carbono Org 22,13 22,75 22,04 21,98 21,66 21,77 21,52 21,89
Fonte: Acervo pessoal, 2023
A concentração média desses três elementos possui similaridade notável em comparação à muitas linhas disponíveis no mercado de fertilizantes comerciais, demonstrando portanto que os teores encontrados são competitivos no ramo e, subsequentemente, aplicáveis.
O enxofre, por sua vez, mesmo sendo testado em três massas distintas, não apresentou precipitação com o método descrito em 2.6, o que indica que não há presença de enxofre na forma de Sulfato na amostra.
Devido ao teor de carbono encontrado próximo aos 22%, o lodo poderia ser classificado como um fertilizante orgânico sólido, nesse caso, segundo consta o Anexo V da Instrução Normativa SDA n° 27, de 5 de junho de 2006, os teores máximos permitidos de Cádmio, Chumbo, Cromo hexavaente e Níquel são respectivamente de 3, 150, 2 e 70 ppm (ou mg/kg). De tal modo, o teor de Cádmio viola a lei, estando por volta de 4 ppm acima do limite máximo. Como o Cromo determinado em 2.3 se baseia em todas as formas do metal encontradas na amostra e não apenas em sua forma hexavalente, não pode-se afirmar que necessariamente esse teor excede os limites legais. Ainda assim, há possibilidade de diluição do lodo em outro substrato para redução da concentração destes contamimantes. Também há possibilidade de adequação do lodo como substrato para plantas, conforme o Anexo IV da mesma Instrução Normativa, de tal modo, esses teores podem ser tolerados de acordo com a aplicação desejada para o lodo.
A última ressalva entre os compostos encontrados no lodo se direciona ao teor de Alumínio (por volta de 2,57% m/m em base seca), que se configura no maior obstáculo de aplicação do lodo, pois mesmo que órgãos como o MAPA e a ANVISA, não determinem teor máximo de aluminio em um fertilizantes, a ação desse metal já é amplamente conhecido no meio acadêmico e agrícola.
O Alumínio é um metal criticamente tóxico à plantas, causando, entre outras situações, má formação radicular, ou seja, as raízes de plantas contaminadas por alumínio apresentam grande espessura e pouco comprimento, causando consequentemente uma deficiência mineral e estresse hídrico (ECHART, 2000), que faz as plantas apresentarem desenvolvimento precário da parte aérea e diminuição da produtividade (para frutíferas, principalmente). O metal também causa interferências nos processos fisiológicos normais da planta, além de atuarem na danificação de estruturas celulares vegetais (FOY et al., 1978).
Deste modo, o lodo se mostra inaplicável in natura, sendo imprescindível um tratamento que elimine o alumínio ali presente, viabilizando seu uso como fertilizante.
4 POSSÍVEIS TRATAMENTOS
Tendo em vista a necessidade de remoção do alumínio do lodo, a primeira ideia a ser testada é a precipitação ou dissolução seletiva do metal, para tal, basta a reação com um ânion que isolasse o Alumínio em uma fase distinta dos demais nutrientes, mentalizando que o produto seja aproveitado por uma indústria de fertilizantes, o custo do processo se torna essencial para sua aprovação. De tal modo, uma opção se torna forte candidata à remoção do Alumínio, o Hidróxido de Sódio (NaOH) uma base forte comercializada em larga escala e encontrada em diversos processos produtivos, tanto no ramo agrícola como em diversas outras vertentes, não possui elevado custo de produção, se tornando relativamente barato para uso industrial. De tal modo, o reagente foi empregado nos métodos da extração de Bayer e na precipitação seletiva do alumínio, a fim de verificar a eficiência da extração de ambos.
Sua reação com o metal gera o Hidróxido de alumínio, insolúvel em água, que poderia ser futuramente submetido à uma filtração, que removeria o precipitado e permitiria o uso do sobrenadante como fertilizante líquido.
4.1 Extração de Bayer
Inicialmente, foi testada a extração de Bayer para verificar a capacidade de remoção do alumínio do lodo, o método consiste na digestão alcalina da amostra sob aquecimento para precipitação do alumínio na forma de Hidróxido. Nesse caso, o processo adotado se assemelha ao utilizado por Mahecha-Rivas et.al (2021) em um processo de remoção de alumínio do lodo da indústria metalúrgica. Foram usados 700 mL de uma solução de NaOH 2M para a digestão de aproximadamente 46,7g da amostra de lodo (ou seja, havia uma parte de lodo para cada 15 partes de NaOH). Essa mistura foi submetida a aquecimento de 70-80°C por uma hora, então reservada para resfriamento em temperatura ambiente, onde, por fins didáticos, foi deixada por 24 horas em repouso, a fim de verificar a separação natural de fases. Ao fim desse dia de descanso uma fase sólida foi bem definida, a outra, líquida, apresentava turbidez considerável, visível na Figura 3.

Tendo em vista o aspecto da solução sobrenadante, uma filtração à vácuo foi adotada para separação definitiva das duas fases, uma vez separadas, a fase sobrenadante adquiriu aspecto límpido. Tendo feito esse procedimento, cada uma das fases teve uma massa de 1g submetida à uma digestão ácida e posterior avolumação para 250mL. Esse extrato foi conduzido à uma segunda análise de absorção atômica para verificação dos teores metálicos principais (Ca, Al, Fe e Mg).
Nessa etapa analítica, porém, foi verificado que a fase líquida, embora tingida (que poderia ser um indício positivo da funcionalidade da extração), apresentou teores praticamente nulos de todos os analitos, não ultrapassando 50 ppm (parte por milhão) em qualquer um dos analitos. Esses teores, sendo muito inferiores aos originais em base seca, tornam essa fase líquida irrelevante quando pareada à fertilizantes comerciais.
A parte sólida por sua vez, ao ser submetida à mesma análise, apresentou teores similares aos valores que deveriam ser encontrados no lodo úmido (valor teórico calculado ao subtrair a umidade percentual do teor do analito em base seca), uma ocorrência plausível, uma vez que o lodo tratado nessa extração foi uma média úmida das amostras A, B, C e D. Para o precipitado, os teores encontrados são verificáveis na Tabela 7.
Tabela 7: Teores do precipitado da extração de Bayer.
Teor (%) Ca 4,1628 Al 0,7615 Fe 0,8955 Mg 0,1138
Fonte: Acervo pessoal, 2023
Acredita-se, majoritariamente, que a extração foi falha devido ao Kps (constante do produto de solubilidade) dos hidróxidos desses metais possuírem valores próximos uns aos outros, logo, o excesso do íon OH– promoveria a precipitação de todos os metais e não exclusivamente para o alumínio, ainda assim, utilizando NaOH para a extração, há outra alternativa utilizável.
4.2 Precipitação seletiva com variação de pH
É conhecido na química que alguns metais precipitam para o mesmo ânion em faixas de pH distintas, esse é o caso para os hidróxidos de Cálcio, Magnésio, Ferro e Alumínio, sendo precipitados nas seguintes faixas:
Tabela 8: Faixa de pH para precipitação como Hidróxidos.
Metal pH Cálcio 11 – 12 Magnésio 10,5 – 11,5 Ferro 7 – 9 Alumínio 8 – 9,5
Fonte: UFMG, 2009
A ideia do processo é elevar gradativamente o pH do meio para promover a precipitação dos cátions de modo isolado, para a remoção do alumínio e reinserção do ferro anteriormente precipitado.Para realização do teste, o lodo previamente seco foi submetido à uma extração ácida em HCl, para os nutrientes metálicos serem trazidos ao meio líquido. O extrato apresenta parte insolúvel, que se trata da parcela orgânica do lodo, esta foi isolada por filtração para ser reintegrada ao extrato após a remoção do alumínio, conforme visível na Figura 4.

Ao extrato, foram lentamente adicionadas pequenas doses de NaOH 45% sob agitação, até pH ~7,8, onde a solução anteriormente límpida adquiriu caráter turvo, visível na Figura 5.

Dado certo tempo após a mudança de aspecto, foi feita uma filtração a vácuo para isolar os insolúveis gerados, visíveis na Figura 6.

A elevação de pH foi continuada até pH ~9,5, o aumento de turbidez, agora menos intenso também comprovou a precipitação. Uma nova filtração foi realizada para remoção do precipitado, visível na Figura 7.

Nessa etapa, o extrato foi levado à absorção atômica, onde foi constatado que os teores de Ferro e Alumínio eram de, respectivamente, 18 e 17ppm. Confirmando a extração de ambos os metais, de tal modo, mesmo que a literatura disponível não seja clara quanto à quantidade de alumínio que passa a danificar a vida da planta, a drástica redução do teor (~2,57% para 0,0017%) torna o lodo mais facilmente aplicável, pois sua aplicação, sendo feita em dispersão, não apresentaria focos concentrados do metal, em teoria.
A última etapa do ensaio consiste na reinserção do retido na primeira filtração ao meio e sua reacidificação para verificar se o Ferro eliminado na primeira etapa pode recuperado. Para isso, o filtro contendo o retido foi reinserido na solução, que foi acidificada até pH próximo a 6 e submetida a aquecimento em chapa elétrica por 10 minutos. O papel filtro foi removido da solução, e a mesma foi levada mais uma vez à absorção para a determinação dos principais minerais, Cálcio, Magnésio, Ferro e Alumínio, conforme a Tabela 8.
Tabela 8: Concentração dos metais após extração.
Metal Teor (%) Cálcio 13,6412 Magnésio 0,3155 Ferro 1,8230 Alumínio 1,7600
Fonte: Acervo pessoal, 2023
Mesmo havendo uma baixa no teor de alumínio em comparação com a amostra original, o teor encontrado (1,76%) é relativamente complexo de ser ministrado em uma plantação de modo a evitar focos concentrados de alumínio. Vale ressaltar também que os demais minerais também sofreram baixas em suas concentrações, principalmente ainda no caso do Ferro.
Ainda assim, os demais metais ainda possuem valor relativamente próximos à amostra seca original, podendo eventualmente ser aplicados em alguma concentração benéfica, de tal modo, o principal empecilho para a aplicação, segue sendo a remoção deficiente de alumínio. Como o principal obstáculo da aplicação não foi completamente removido, as análises de Fósforo, Nitrogênio, Carbono Orgânico e da gama de contaminantes (como coliformes, ovos de helmintos, selênio, mercúrio e arsênio) citada nos anexos da Instrução Normativa citada anteriormente foram descontinuadas.
Deve-se ressalvar que a eficiência do lodo como fertilizante está sendo tratada apenas pela via teórica, ou seja, se possui conhecimento de elementos químicos mencionados ao longo do artigo como benéficos estando presentes em concentrações similares em fertilizantes disponíveis no mercado. Ainda assim, testes de aplicabilidade podem ser efetuados em projetos futuros, para diferentes culturas e em proporções variáveis, a fim de concluir se as formas em que tais elementos se apresentam no lodo podem ser absorvidas por uma planta, além de evidenciar os prós e contras de sua aplicação a longo prazo.
5 CONCLUSÃO
Perante tais resultados, é irrefutável que, ainda que haja grande potencial do lodo como fertilizante, seu uso in natura é inviável devido ao excessivo teor de alumínio presente no material. Também é válida a ressalva que, caso não queira se obter um fertilizante rico em ferro, a extração do alumínio em Soda Cáustica é uma alternativa, uma vez que os teores de Magnésio e Cálcio foram minimamente afetados pela extração mencionada em 4.2. Por fim, deve-se destacar que empresas do ramo agrícola, especificamente voltadas à área de fertilizantes, trabalham em melhoramentos constantes em suas matérias-primas e, mesmo que o lodo não se configure em um fertilizante ideal para pronto uso, pode se mostrar um excelente insumo, quando tratado, para compor base de fertilizantes via solo, que, além do lodo, poderiam ser acrescidos de outros compostos que gerasse mais valor agregado ao produto ali gerado.
REFERÊNCIAS
AGILENT TECHNOLOGIES, INC. Flame Atomic Absorption Spectrometry: Analytical Methods. Mulgrave, Victoria/AU, ed. 13, 2015.
BARBER, Stanley A. Soil nutrient bioavailability: a mechanistic approach. John Wiley & Sons, 1995.
BARCELÓ, J., POSCHENRIEDER, Ch; VÁZQUEZ, M.D., et al. Aluminum phytotoxicity. Fertilizer Research, The Hague, v.43, p.217-223, 1996.
BRASIL. Instrução Normativa SDA nº 27, de 5 de junho de 2006. Dispõe sobre a importação ou comercialização, para produção, de fertilizantes, corretivos, inoculantes e biofertilizantes. [S. l.], 5 jun. 2006.
BLUMENTHAL, Ursula J. et al. Guidelines for wastewater reuse in agriculture and aquaculture: recommended revisions based on new research evidence. WELL study, Task, n. 68 Part 1, p. 67, 2000.
CETESB. Aplicação de biossólidos de sistemas de tratamento biológico em áreas agrícolas – Critérios para projeto e operação (P4230). São Paulo: CETESB, 1999.
COMO A Água é Tratada?. Brasília: Companhia de Saneamento Ambiental do Distrito Federal, [201-?]. Disponível em: https://www.caesb.df.gov.br/como-a-agua-e-tratada.html#:~:text=Os%20reagentes%20utilizados%20s%C3%A3o%20denominados,atua%C3%A7%C3%A3o%20mais%20efetiva%20do%20coagulante. Acesso em: 15 abr. 2023.
CRUZ, Ivan et al. Efeito do nível de saturação de alumínio em solo ácido sobre os danos de Spodoptera frugiperda (JE Smith) em milho. Anais da Sociedade Entomológica do Brasil, v. 25, n. 2, p. 293-297, 1996.
DAKORA, Felix D.; PHILLIPS, Donald A. Root exudates as mediators of mineral acquisition in low-nutrient environments. Food security in nutrient-stressed environments: exploiting plants’ genetic capabilities, p. 201-213, 2002.
DELHAIZE, E., RYAN P.R. Aluminum toxicity and tolerance in plants. Plant Physiology, Minneapolis, v.107, p.315-321, 1995.
DELHAIZE, E., CRAIG, S., BEATON, C.D., et al. Aluminum tolerance in wheat (Triticum aestivum L.). I. Uptake and distribution of aluminum in root apices. Plant Physiology, Minneapolis, v.103, p.685-693, 1993a.
DELHAIZE, E., RYAN, P.R., RANDALL, P.J. Aluminum tolerance in wheat (Triticum aestivum L.). II. Aluminum-stimulated excretion of malic acid from root apices. Plant Physiology, Minneapolis, v.103, p.695-702, 1993b.
DE MENEZES, Uiara Gonçalves et al. INOVAÇÃO SUSTENTÁVEL: ESTRATÉGIA EM EMPRESAS DO SETOR QUÍMICO 10.5773/rgsa. v5i2. 373. Revista de Gestão Social e Ambiental, v. 5, n. 2, 2012.
ECHART, C. L.; CAVALLI-MOLINA, S.. Fitotoxicidade do alumínio: efeitos, mecanismo de tolerância e seu controle genético. Ciência Rural, v. 31, n. 3, p. 531–541, maio 2001.
FOY, C. D.; CHANEY, RL t; WHITE, M. C. The physiology of metal toxicity in plants. Annual review of plant physiology, v. 29, n. 1, p. 511-566, 1978.
FOY, C.D. Physiological effects of hydrogen, aluminum and manganese toxicities in acid soil. In: ADAMS, F. (ed.). Soil acidity and liming. Madison: ASA-CSSA-SSSA, 1984. n.12, p.57-97. (Agron. Monogr.).
HANG, A. Molecular aspects of aluminum toxicity. CRC Critical Reviews in Plant Sciences, Boca Raton, v.1, p.345-373, 1984.
HINSINGER , Philippe. Bioavailability of soil inorganic P in the rhizosphere as affected by root-induced chemical changes: A Review. Plant and Soil, [s. l.], v. 237, p. 173-195, 2001. Disponível em: https://www.researchgate.net/publication/225852665_Bioavailability_of_soil_inorganic_P_in_the_rhizosphere_as_affected_by_root-induced_chemical_changes_A_review. Acesso em: 17 jun. 2023
LÓPEZ-VALDEZ, Fernando; FERNÁNDEZ-LUQUEÑO, Fabián. Fertilizers: Components, uses in agriculture and environmental impacts. Nova Science Publishers, Inc., 2014.
LUCENA NETO, Marciano Henrique de. Estudo da influência de tensoativos em sistemas microemulsionados na extração de gálio e alumínio. 2005.
METCALF & EDDY et al. Wastewater engineering: treatment and resource recovery. McGraw Hill Education, 2013.
MINISTÉRIO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO (Brasília/DF). Secretaria de Defesa Agropecuária. Manual de Métodos Analíticos Oficiais para Fertilizantes e Corretivos. Brasília: [s. n.], 2017. 240 p.
MINISTÉRIO DO PLANEJAMENTO E ORÇAMENTO (Rio de Janeiro/RJ). IBGE. Produção Agropecuária. [S. l.], 2022. Disponível em: https://www.ibge.gov.br/explica/producao-agropecuaria/. Acesso em: 9 set. 2023.
PRECIPITAÇÃO FRACIONADA E TRANSFORMAÇÕES METATÉTICAS. Minas Gerais/MG: Universidade Federal de Minas Gerais, 2009. Disponível em: https://www2.ufjf.br/quimicaead/wp-content/uploads/sites/224/2013/05/FQAnalitica_Aula12.pdf. Acesso em: 17 jun. 2023.
PROJEÇÕES do Agronegócio: Brasil – 2022/23 a 2032/33. Brasília: MAPA, 2023. Disponível em: https://www.gov.br/agricultura/pt-br/assuntos/politica-agricola/todas-publicacoes-de-politica-agricola/projecoes-do-agronegocio/projecoes-do-agronegocio-2022-2023-a-2032-2033.pdf/#:~:text=A%20%C3%A1rea%20de%20gr%C3%A3os%20deve,crescimento%20com%20ganhos%20de%20produtividade. Acesso em: 15 abr. 2023.
B. VAN RAIJ. Recomendações de adubação e calagem para o Estado de São Paulo. Campinas: IAC, 1996.
RENGEL, Zdenko (Ed.). Handbook of soil acidity. CRC Press, 2003.
SHANNON, D. Kent; CLAY, David E.; KITCHEN, Newell R. Precision agriculture basics. John Wiley & Sons, 2020.
SUMNER, M. E.; RENGEL, Z. Soil Acidity and Plant Nutrients. In Handbook of Soil Acidity, p. 61-83. CRC Press, 2007.
TOCCHETTO, Marta Regina Lopes. Gerenciamento de resíduos sólidos industriais. Santa Maria: UFSM, v. 97, 2005.
TURNER, Nancy J. The earth’s blanket: Traditional teachings for sustainable living. D & M Publishers, 2008.
WOODARD, Frank. Industrial waste treatment handbook. Elsevier, 2001.
WRIGHT, R.J. Soil aluminum toxicity and plant growth. Communications in Soil Science and Plant Analysis, New York, v.20, p.1479-1497, 1989.
