REGISTRO DOI: 10.69849/revistaft/ch10202506151009
Júlia Santos Azevedo1
Iasmin Ferreira de Souza2
Carlos Nelson Elias3
Victor Talarico Leal Vieira4
Paulo Henrique de Souza Picciani5
Fabiano Luiz Heggendorn6**
RESUMO
O objetivo deste estudo foi sintetizar e caracterizar membranas poliméricas de poli(ácido lático) (PLA) e poli(álcool vinílico) (PVA), depositadas in loco sobre superfícies de implantes dentários usados por meio da técnica de solution blow spinning (SBS), avaliando suas propriedades microestruturais e adesivas para o desenvolvimento de agentes terapêuticos na peri-implantite. Implantes dentários extraídos de pacientes foram recobertos com soluções de PLA e PVA a 10% (m/v), aplicadas com aerógrafo sob condições controladas. A análise morfológica e microestrutural das imagens de microscopia eletrônica de varredura revelaram que o PLA formou mantas fibrosas contínuas e aderidas, enquanto que o PVA resultou em filmes microporosos com boa adesão ao substrato metálico. As diferentes morfologias dos materiais sugerem aplicações específicas: o PLA, para estruturas tridimensionais, pode favorecer integração tecidual e regeneração óssea; o PVA, para formação de filmes microporosos, que pode atuar como substrato bioativo. Os resultados obtidos indicaram que a técnica de SBS é promissora para a biofuncionalização de superfícies metálicas de implantes, permitindo a deposição controlada de biomateriais com propriedades adequadas para aplicação terapêutica em peri-implantite. Conclui-se que as membranas de PVA e PLA produzidas por meio da técnica de solution blow spinning apresentaram características microestruturais distintas, porém ambas demonstraram potencial significativo para aplicação terapêutica na peri-implantite. Dessa forma ressaltamos que a escolha do polímero e o controle dos parâmetros de deposição são fundamentais para otimizar o desempenho clínico dos implantes dentários, evidenciando que a técnica de solution blow spinning é promissora para a biofuncionalização de superfícies implantáveis.
Palavras-chave: peri-implantite. regeneração tecidual guiada. membranas poliméricas.
ABSTRACT
The aim of this study was to synthesize and characterize polymeric membranes of poly(lactic acid) (PLA) and poly(vinyl alcohol) (PVA), deposited in situ on the surfaces of dental implants used by the solution blow spinning (SBS) technique, evaluating their microstructural and adhesive properties for the development of therapeutic agents in peri-implantitis. Dental implants extracted from patients were coated with 10% (w/v) PLA and PVA solutions, applied with an airbrush under controlled conditions. Morphological and microstructural analysis by scanning electron microscopy revealed that PLA formed continuous and adherent fibrous sheets, while PVA resulted in microporous films with good adhesion to the metal substrate. The different morphologies suggest specific applications: PLA, due to its three-dimensional structure, can favor tissue integration and bone regeneration; PVA, due to the formation of a microporous film, can act as a bioactive substrate. The results indicated that the SBS technique is promising for the biofunctionalization of implant surfaces, allowing the controlled deposition of biomaterials with properties suitable for therapeutic application in peri-implantitis. It was concluded that the PVA and PLA membranes produced by the solution blow spinning technique presented distinct microstructural characteristics, but both demonstrated significant potential for therapeutic application in peri-implantitis. Thus, the choice of polymer and the control of deposition parameters are essential to optimize the clinical performance of dental implants, evidencing that the solution blow spinning technique is promising for the biofunctionalization of implant surfaces.
Keywords: peri-implantitis, guided tissue regeneration, polymeric membranes.
INTRODUÇÃO
O uso de implantes dentários é amplamente aceito em odontologia para a reabilitação de pacientes edêntulos. Este método é reconhecido por sua capacidade de restaurar funções mastigatórias e estéticas com segurança e eficiência (Pirih et al., 2018). O progresso nas técnicas cirúrgicas e o desenvolvimento de novos materiais aumentaram as taxas de sucesso dos implantes, tornando-os uma abordagem amplamente utilizada. No entanto, um dos maiores desafios relacionados ao uso de implantes é a ocorrência de peri-implantite (Monje et al., 2019).
A peri-implantite é uma doença inflamatória que afeta os tecidos moles e ósseos ao redor dos implantes dentários. Em casos avançados, pode levar à perda progressiva de osso e até a falência do implante (Monte et al., 2019). Um diagnóstico precoce e tratamento adequado são fundamentais para evitar a progressão dessa condição, que muitas vezes é assintomática em seus estágios iniciais, o que dificulta sua detecção e tratamento (Derdeyn et al., 1995). A falta de protocolos terapêuticos padronizados e a variabilidade da resposta inflamatória acarretam em prognósticos “pessimistas” no tratamento da peri-implantite. As abordagens terapêuticas envolvem intervenções mecânicas, como a descontaminação da superfície do implante e o uso de agentes antimicrobianos. No entanto, os resultados são limitados, especialmente em casos de perda óssea significativa (Pirih et al., 2000).
Considerada uma técnica cirúrgica, a regeneração óssea guiada (ROG) utiliza membranas de barreira que impedem a migração de tecidos moles para o local do defeito, favorecendo a neoformação óssea em áreas com atresias alveolares (Ayub et al., 2011). O uso de membranas poliméricas em técnicas de ROG tem se mostrado eficaz na manutenção do espaço ósseo e na promoção da neoformação óssea (Derdeyn et al., 1995). No contexto da peri-implantite, essas membranas podem atuar não só como barreiras protetoras, mas também como agentes terapêuticos, promovendo a regeneração óssea e controlando infecções ao redor dos implantes.
Neste cenário, os biomateriais surgem como alternativas promissoras, oferecendo novas perspectivas para a regeneração dos tecidos afetados e a recuperação da saúde peri-implantar (Heggendorn et al., 2024). Materiais como poli(ácido lático) (PLA) e poli(álcool vinilico) (PVA) são amplamente utilizados em aplicações biomédicas devido à sua biocompatibilidade e capacidade de modular a resposta celular (Pathan et al., 2015). Esses polímeros, quando empregados na forma de membranas, podem atuar como barreiras oclusivas, do tipo barreira, isolando sítios com defeitos ósseos (Heggendorn et al., 2024).
Derivado da hidrólise do polímero acetato de polivinila, o PVA é um polímero solúvel em água que apresenta características desejáveis para um biomaterial, como: biocompatibilidade, não-toxicidade e propriedades físicas estáveis. Entretanto, o PVA apresenta limitações relacionadas à sua estabilidade química e resistência mecânica (Pathan et al., 2015; Sabbagh et al., 2023).
Já o PLA possui aplicações relevantes como um biopolímero em diversas áreas. Sua biocompatibilidade e propriedades de barreira se destacam em sua atuação na indústria farmacêutica e na produção de fios de sutura (Derdeyn et al., 1995; Doiron et al., 2009; Serna et al., 2003).
Paralelamente, a fiação por sopro, ou solution blow spinning (SBS) é considerada uma técnica promissora no desenvolvimento e deposição de membranas em superfícies diversas. Esse método oferece possibilidades no controle da espessura das membranas formadas, modulando o tempo de deposição sobre a superfície, o que pode potencializar a neoformação óssea (Heggendorn et al., 2024). A SBS permite a criação de fibras, resultando em membranas que podem ser aplicadas diretamente sobre superfícies (Heggendorn et al., 2024; Derdeyn et al., 1995). A escolha adequada da concentração, envolvendo combinações de diferentes polímeros, bem como a inclusão de fatores de crescimento e outras biomoléculas, são consideradas estratégias que podem otimizar os resultados terapêuticos (Pirih et al., 2000).
O presente estudo teve como objetivo sintetizar e caracterizar membranas poliméricas de Poli(ácido lático) (PLA) e Poli(álcool vinílico) (PVA), depositadas in loco sobre superfícies de implantes dentários usados por meio da técnica de Solution Blow Spinning (SBS), avaliando suas propriedades microestruturais e adesivas, objetivando o desenvolvimento de um possível agente terapêutico inovador para o tratamento da peri-implantite.
MATERIAIS E MÉTODOS
Poli(ácido) Láctico: PLA
Os polímeros de PLA (2003D, Nature Works) foram pesados em balança de precisão analítica (Shimadzu AY220), obtendo-se o percentual de m/v da solução polimérica indicada. As soluções foram mantidas sob constante agitação em placa magnética (IKA C-MAG HS 7), em temperatura ambiente, de 30 a 40 min, até completa homogeneização das soluções.
Poli(álcool) Vinílico: PVA
As amostras de PVA (Sigma-Aldrich – 87-90% hydrolyzed) foram pesadas em balança de precisão analítica (Shimadzu AY220), obtendo-se o percentual de m/v da solução polimérica indicada. Após realizar as diluições, as amostras permaneceram sob agitação constante em placa magnética, a 80 °C, de 30 a 40 min, até completa homogeneização da solução. Previamente a aplicação sobre as superfícies, as soluções foram acondicionadas em cuba ultrassônica durante 5 min.
Caneta de Aerógrafo
Após o preparo das soluções, foi utilizada uma caneta de aerógrafo comercial (Nasedal®), adaptada à saída de ar de um compressor odontológico, com pressão entre 50 e 60 psi, com ponta de injeção de 0,5 mm de diâmetro e agulha de injeção de 0,2 mm, operando sob pressão de 25 psi, posicionado a 10 cm de distância dos implantes. Para cada teste, foram depositados 3 mL de cada solução polimérica.
Os implantes utilizados foram provenientes de pacientes atendidos na Clínica de Traumatismo Dentário da UNIGRANRIO. O estudo foi submetido e aprovado pelo Comitê de Ética em Pesquisa da UNIGRANRIO, sob o número: 6.164.229.
Para este estudo, os pacientes foram convidados a participar do projeto mediante a leitura e assinatura do Termo de Consentimento Livre e Esclarecido.
Foram utilizados seis implantes dentários usados, de marcas desconhecidas, provenientes de pacientes com fibrointegração e perda de osseointegração confirmada por meio de tomografia e/ou radiografia periapical, associada à mobilidade do implante dentário. As superfícies dos implantes foram limpas, imersas em acetona e submetidas à agitação em cuba ultrassônica aquecida (Sanders Medical SoniClean 6), a 40 KHz por 5 minutos. Posteriormente, os implantes foram secos com jato de ar e incubados em dessecadora por sete dias em temperatura ambiente.
Utilizando a técnica de solution blow spinning (SBS), as deposições poliméricas foram realizadas por meio de um aerógrafo (Nasedal®). As mantas poliméricas foram produzidas utilizando dois polímeros distintos: poli(ácido lático) (PLA) e poli(álcool vinílico) (PVA). Para a preparação das soluções, o PLA foi dissolvido em clorofórmio (CHCl₃) na concentração de 10% (m/v) (PLA 10% – CHCl₃), enquanto o PVA foi dissolvido em água (H₂O) na mesma concentração de 10% (m/v) (PVA 10% – H₂O).
Deposições por SBS
As deposições ocorreram em temperatura ambiente controlada, entre 24 °C e 26 °C. Foram utilizados três implantes para cada grupo de posição: grupo PLA 10% (G.PLA10%) e grupo PVA 10% (G.PVA10%). Sobre a superfície de cada grupo de implantes (n = 3), foram aplicados 3 mL de solução polimérica.
Microscopia eletrônica de varredura
Os espécimes foram analisados em Microscopia eletrônica de varredura, em diferentes aumentos. Os grupos estudados foram recobertos com carbono utilizando um revestidor por pulverização Leica EM ACE600. A microscopia eletrônica de varredura foi realizada com um MEV Quanta FEI 250, com aumentos variados de 35 a 2200 x. O tempo de varredura estabelecido para todas as imagens foi de 10µs. A corrente utilizada foi 20KV, com spot size de 5.0.
RESULTADOS
A técnica da solution blow spinning (SBS) utilizando o aerógrafo (Nasedal®) possibilitou a formação de mantas poliméricas no G.PLA10%, nos 03 implantes depositados. Já a deposição no G.PVA10%, demonstrou ausência de formação de manta polimérica, demostrando um filme (Splash) sobre as superfícies dos 03 implantes. (Figura 1)
Figura 1 – Análise Macroscópica após as deposições – G.PVA10% e G.PLA10%.

Fonte: produção própria dos autores.
Para a análise microscópica, o material excedente do grupo G.PLA10% foi removido para posterior observação em microscopia eletrônica de varredura (MEV).
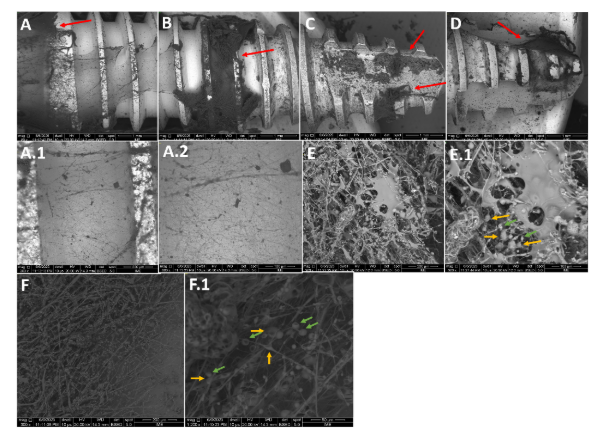
As fibras de PLA depositadas apresentaram distribuição irregular, com áreas de deposição mais densa (setas vermelhas, Fig. 2 A, B, C e D) nas superfícies dos implantes, formando uma rede tridimensional com fibras orientadas de forma aleatória, característica típica de materiais obtidos por deposição via técnica SBS (Fig. 2 A.1, A.2, E, E.1, F e F.1). Destaca-se na Fig. 2 F, uma região com intensa deposição polimérica e outra com a superfície do implante, com menor deposição.
As imagens obtidas sugerem a formação de fibras com diâmetro predominantemente micrométrico, com variações locais, característico do método de deposição. Os nós (ou junções) foram evidentes nas imagens com ampliações de 600X (Fig. 2 E.1, setas amarelas) e 1200X (Fig. 2 F.1, setas amarelas), em regiões onde múltiplas fibras se cruzam e se fundem. Essas junções apresentaram morfologia irregular, resultante do acúmulo local de material polimérico devido à dinâmica do jateamento da solução durante o processo SBS.
Em algumas regiões, observou-se a presença de pequenas esferas associadas aos nós, o que indica uma rápida solidificação da solução de PLA durante o processo de deposição (Fig. 2 E.1 e F.1, setas verdes).
Figura 2 – Deposições G.PLA10% sobre as superfícies dos implantes. Áreas com densa deposição de PLA sobre a superfície dos implantes indicadas por setas vermelhas (A, B, C e D). Área em fundo de vale de rosca (A.1 e A.2) indicando a presença de fibras de PLA aderidas. Imagem E, E.1 e F.1, demonstrando a microestrutura da manta polimérica com a presença de nos (setas amarelas, Imag. E.1 e F.1) e de esferas (setas verdes, Imag. E.1 e F.1). Imagem F, demostrando uma região de deposito polimérico intenso associado a uma área de exposição da superfície metálica do implante.
As micrografias obtidas por MEV do G.PVA10% demonstraram superfícies metálicas revestidas por um filme (Splash) polimérico. As deposições apresentaram áreas de maior concentração de polímero, principalmente nas regiões de topo de rosca e câmara de cicatrização (setas vermelhas, Fig. 3 A, B e C). Nessas regiões, o recobrimento acompanhou o relevo das roscas, sem apresentar áreas visivelmente descobertas, indicando boa aderência do filme ao substrato metálico.
Na Figura 3.D, D.1 e D.2, detalhou-se progressivamente (círculo vermelho, Figura 3.D) o recobrimento da superfície, evidenciando a presença de uma matriz rugosa e microporosa, sugerindo poros de diferentes tamanhos distribuídos de forma irregular, resultantes do filme depositado. Essa microporosidade superficial, desenvolvida a partir da rápida evaporação do solvente, é característica dos filmes formados por SBS.
Nesse sentido, na Figura 3.F, G e G.1, observa-se a presença de poros com regiões densas, intercaladas, conferindo ao filme uma estrutura microporosa com tamanhos e diâmetros variados. A presença dessas estruturas sugere um potencial revestimento para aplicações em casos de peri-implantite, favorecendo, teoricamente, a adesão celular e a difusão de nutrientes.
Figura 3 – Deposições G.PVA10% sobre as superfícies dos implantes. Áreas de topo de rosca (A e B) e câmara de compensação (C) demonstrando densa deposição de filme (Splash) polimérico (setas vermelhas). Na imagem D destaca-se região de interesse com maior magnificação (D.1 e D.2), demonstrando uma matriz rugosa e microporosa. Imagem F, G e G.1, observa-se a presença de um filme microporoso, com poros de diferentes diâmetros.

DISCUSSÃO
As membranas reabsorvíveis têm sido utilizadas para promover a neoformação óssea em defeitos causados por doenças periodontais, periapicais ou por exodontias (Fonseca, 2018). Atualmente, há um grande interesse em produzir materiais de alto desempenho, com base na associação de polímeros biocompatíveis e moléculas bioativas, sendo reconhecidos por seus resultados em sistemas biomiméticos na regeneração tecidual (Zamora-Ledezma et al, 2023). Tais biomateriais devem possuir como características desejáveis: biocompatibilidade, boa tolerância para com os tecidos adjacentes, potencial de renovabilidade, dentre outras propriedades (Gregory et al, 2021).
Grande parte da literatura destaca o desenvolvimento de mantas poliméricas por meio da técnica de eletrofiação. Zamora-Ledezma et al. (2023) relataram a produção de mantas eletrofiadas utilizando PVA 15%. Zhou et al. (2021) empregaram uma solução composta por PVA 50% em H2O e colágeno animal a 1,5%. De modo semelhante, Sabbagh et al. (2023) descreveram o uso de uma mistura de PVA 50% com K-carragenina a 50% para a obtenção das mantas poliméricas.
Este estudo apresenta uma abordagem inovadora para a funcionalização de superfícies de implantes dentários através da utilização da técnica de SBS. A técnica foi adaptada para a deposição in situ de polímeros bioativos, permitindo a formação controlada de mantas (G.PLA10%) ou filmes poliméricos (G.PVA10%) diretamente sobre a superfície do implante. Esta metodologia oferece uma alternativa promissora aos métodos convencionais de revestimento, com potencial para melhorar a biocompatibilidade, osteointegração e propriedades antimicrobianas em implantes dentários relacionados a casos de peri-implantite.
No trabalho aqui apresentado, o filme de PVA 10% depositado sobre os implantes dentários, através da técnica da SBS, apresentou uma morfologia homogênea, recobrindo as roscas, principalmente os topos de rosca, dos implantes, sugerindo aderência ao substrato. Destaca-se ainda que a microestrutura porosa, característica do método de deposição utilizado, pode ser vantajosa para aplicações em implantes com roscas expostas, aumentando a área superficial e, possivelmente, favorecendo a integração tecidual. A presença destes poros no filme pode ser atribuída à dinâmica de solidificação do polímero durante a SBS, onde a rápida evaporação do solvente e a deposição em substrato tridimensional promovem a formação de microcavidades.
A literatura aponta que o PLA, por ser um biopolímero com propriedades mecânicas superiores e baixa toxicidade (Monje et al., 2019), podendo ser ideal para aplicações em regeneração tecidual. As membranas de PLA são consideradas alternativas promissoras para a regeneração tecidual guiada em lesões periodontais humanas, especialmente quando combinadas com PVA, que apresenta potencial significativo para essa finalidade (Abdal-Hay et al., 2015; Robert et al., 1994).
Georgiou et al. (2007) avaliaram membranas compostas por 80% de PLA associadas a biovidros, enquanto Blaker et al. (2003) desenvolveram membranas com 60% de PLA e 40% de biovidros. Anteriormente, Robert et al. (1994) já haviam investigado três tipos de membranas desenvolvidas com PLA a 10% e 30%, com o objetivo de promover a regeneração tecidual guiada em defeitos periodontais criados cirurgicamente em modelos animais in vivo. Os autores observaram que as membranas foram capazes de promover a regeneração tecidual nas diferentes concentrações testadas, apresentando diferenças significativas na região epitelial, além de estimular a regeneração óssea alveolar, a inserção de tecido conjuntivo e a neoformação de cemento no grupo experimental.
A análise microscópica das deposições no grupo G.PLA10% evidenciou que o método SBS foi eficiente no recobrimento da superfície dos implantes, formando um revestimento composto por mantas fibrosas contínuas e aderidas. A estrutura porosa e interconectada das fibras de PLA sugere um potencial biomaterial para aplicações em roscas expostas, pois pode favorecer, em estudos futuros, a adesão celular e a integração óssea, além de permitir, teoricamente, a difusão de nutrientes e fatores de crescimento. A presença de nós reforça a estabilidade mecânica da rede fibrosa, contribuindo para a resistência ao descolamento e à degradação precoce do recobrimento.
As membranas reabsorvíveis têm sido amplamente utilizadas para promover o crescimento ósseo em defeitos causados por doenças periodontais, lesões periapicais ou extrações dentárias (Fonseca, 2018). O controle da distância da caneta de aerografia e da temperatura é um fator crítico para a formação de membranas homogêneas e estáveis. A distância e a pressão durante a ejeção desempenham um papel significativo, afetando diretamente a espessura das membranas e a distribuição das fibras (Derdeyn, 1995). A eficácia terapêutica das membranas depende de sua estabilidade e distribuição uniforme, fatores que ainda requerem ajustes nos protocolos atualmente utilizados (Monje et al., 2019).
Assim como nos resultados apresentados aqui, Anteriormente Heggendorn et al. (2024) já demonstraram que através da técnica da SBS, adaptada a uma caneta aerográfica, a sua aplicabilidade na deposição in situ de membranas poliméricas à base de PLA e PVA, obtendo uma estrutura final diferenciada entre os polímeros utilizados. A deposição das soluções de PLA (20%, 25% e 20%/TFE) resultou na formação de mantas poliméricas, quando aplicada a uma distância de 10 cm da superfície. Essas membranas apresentaram boa cobertura e adesão tanto em superfícies metálicas quanto ósseas, com microestrutura fibrilar, entrelaçadas e com presença de poros (gaps) entre os filamentos. Em contraste, as soluções de PVA (20%, 25% e 20%) geraram filmes aderentes com baixa formação de fibras, caracterizando uma morfologia predominantemente granulada. Indo de acordo com a análise comparativa das superfícies de implantes dentários recobertas no G. PLA10% e G.PVA10%, depositados por SBS, que evidenciou diferenças microestruturais na nos recobrimentos.
CONCLUSÃO
As membranas de PVA e PLA produzidas por meio da técnica de solution blow spinning apresentaram características microestruturais distintas, porém ambas demonstraram potencial significativo para aplicação terapêutica na peri-implantite. O revestimento de PLA formou mantas poliméricas com uma rede fibrosa contínua e robusta, sugerindo ser adequado para integração tecidual e regeneração óssea. Por outro lado, o revestimento de PVA resultou na formação de um filme aderente com superfície microporosa, indicando um possível substrato bioativo.
Dessa forma, a escolha do polímero e o controle dos parâmetros de deposição são fundamentais para otimizar o desempenho clínico dos implantes dentários, evidenciando que a técnica de solution blow spinning é promissora para a biofuncionalização de superfícies implantáveis.
REFERÊNCIAS BIBLIOGRÁFICAS
Abdal-Hay A, Makhlouf AS, Vanegas P. A novel approach for facile synthesis of biocompatible PVA-coated PLA nanofibers as composite membrane scaffolds for enhanced osteoblast proliferation. In: Makhlouf AS, Scharnweber D, editors. Handbook of nanoceramic and nanocomposite coatings and materials. Elsevier; 2015. p. 87-113.
Albrektsson, T. Consensus report of session IV. In: Proceedings of the first European workshop on periodontology. Quintessence Publishing, 1994. p. 365-369.
Ayub LG, Müller PR, Sader MS, Soares GA, Boschi AO. Regeneração óssea guiada e suas aplicações terapêuticas. Braz J Periodontol. 2011;21(4):24-31.
Blaker JJ, Gough JE, Boccaccini AR. In vitro evaluation of novel bioactive composites based on Bioglass®-filled polylactide foams for bone tissue engineering scaffolds. J Biomed Mater Res A. 2003;67(4):1401–11.
Brånemark PI, Adell R, Breine U, Hansonn BO, Lindström J, Ohlsson A. Intraosseous anchorage of dental prostheses. I. Experimental studies. Scand J Plast Reconstr Surg. 1969;3:81-100.
Derdeyn AP, Wagner JR, Campbell AA. Polymeric materials for dental applications. Polym Eng Sci. 1995;35(24):2036-45.
Doiron AL, Chu K, Ali A, Braden RL, Miller DL, Ntziachristos V, et al. Poly(lactic-co-glycolic) acid as a carrier for imaging contrast agents. Pharm Res. 2009;26:674–82.
Fonseca GF. Síntese e caracterização de scaffolds de Pcl/Biovidro: estudo in vitro da biocompatibilidade e da diferenciação celular [dissertação]. São Paulo: Universidade Estadual Paulista (UNESP); 2018.
Georgiou G, Knowles JC, Athanasiou AE, Giuliani A, Bozec L, Brown RA, et al. Polylactic acid–phosphate glass composite foams as scaffolds for bone tissue engineering. J Biomed Mater Res B Appl Biomater. 2007;80(2):322–31.
Gonçalves AG, Sousa DF, Silva IL. Advances in tissue engineering and its challenges in dentistry. Rev Odontol Bras Central. 2015;24(2):95-101.
Gregory P, Zamora-Ledezma C, Rohman A, Rosmarini R, Amaral-Labat G, Muniz E, et al. Introduction: biopolymers and biocomposites. Phys Sci Rev. 2021;1:10.1515/psr-2020-0065.
Heggendorn, F. L., dos Santos, E., Viana, M. E. S., Fernandes, P. L., de Miranda, A. H. V., & Picciani, P. H. de S. (2024). Application of Solution Blow Spinning (SBS) Through Airbrush Pen for in situ Generation of Barrier Membranes. Journal of the California Dental Association, 52(1). https://doi.org/10.1080/19424396.2024.2386089
Monje A, Aranda L, Diaz KT, González N, D’Avila S, Benavides E, et al. Risk indicators for peri-implant disease: A systematic review and meta-analysis. J Periodontol. 2019;90(3):190-203.
Pathan SG, Singh R, Patil S. Cytotoxicity associated with electrospun polyvinyl alcohol. J Biomed Mater Res B Appl Biomater. 2015;103(8):1652-62.
Pirih FQ, Le C, Pink C, Falbe J, Adami GR, Periyasamy-Thandavarayan P, et al. Oral inflammation: A unifying factor in peri-implantitis and periodontitis. Periodontol 2000. 2018;77(1):225-40.
Robert PM, Frank RM. Periodontal guided tissue regeneration with a new resorbable polylactic acid membrane. J Periodontol. 1994;65(5):414-22.
Rong Z, Zhao L, Zuo Y, Zhang L, Li Y, Ding J, et al. Enhanced bioactivity of osteoblast-like cells on poly (lactic acid)/poly (methyl methacrylate)/nano-hydroxyapatite scaffolds for bone tissue engineering. Fibers Polym. 2015;16:245-53.
Sabbagh F, Khatir NM, Kiarostami K. Synthesis and characterization of k-carrageenan/PVA nanocomposite hydrogels in combination with MgZnO nanoparticles to evaluate the catechin release. Polymers. 2023;15(2):272.
Serna L, Guzmán A, Barrios MA, Mora D. Ácido poliláctico (PLA): propiedades y aplicaciones. Ing Competit. 2003;5(1):16–26.
Sowmya S, Mony U, Jayachandran P, Reshma S, Viji CH, Shantikumar VN, et al. Role of nanostructured biopolymers and bioceramics in enamel, dentin, and periodontal tissue regeneration. Prog Polym Sci. 2013;38(10-11):1748-1772.
Vasconcelos AGF, Fonseca MS, Silva RF. Biopolímeros para regeneração óssea na odontologia: uma prospecção tecnológica. Ciência e Engenharia de Materiais. 2021;1(1):128-46.
Zamora-Ledezma C, Machado LM, Fonseca MS, Espinoza-Castañeda M, Azevedo S, Vasconcelos IM, et al. Fabrication, physical–chemical and biological characterization of retinol-loaded poly (vinyl alcohol) electrospun fiber mats for wound healing applications. Polymers. 2023;15(12):2705.
Zhou T, Lin H, Zheng Y, Hu Z, Song X, Song Y, et al. Fabrication and characterization of collagen/PVA dual-layer membranes for periodontal bone regeneration. Front Bioeng Biotechnol. 2021;9:630977.
1ORCID: https://orcid.org/0009-0005-3640-7843
e-mail: dra.juliaazevedo10@gmail.com
Faculdade de Odontologia, Universidade do Grande Rio, Unigranrio, , Rua Prof. José de Souza Herdy, 1160, bloco C, 2º andar – 25 de agosto – Duque de Caxias/Rio de Janeiro, Brasil – CEP: 25071-202.
2ORCID: https://orcid.org/0009-0009-8295-5778
e-mail: iasmin200003@gmail.com
Faculdade de Odontologia, Universidade do Grande Rio, Unigranrio, , Rua Prof. José de Souza Herdy, 1160, bloco C, 2º andar – 25 de agosto – Duque de Caxias/Rio de Janeiro, Brasil – CEP: 25071-202.
3e-mail: elias@ime.eb.br
Instituto Militar de Engenharia, Seção de Engenharia Mecânica e de Materiais, Laboratório de Biomateriais – Praça General Tibúrcio, 80, 22290-270, Praça Vermelha, Rio de Janeiro, RJ, Brasil.
4ORCID: https://orcid.org/0000-0001-6434-2622
e-mail: victortalarico@gmail.com
Programa de Pós-Graduação em Odontologia da Universidade do Grande Rio (UNIGRANRIO), Rua Prof. José de Souza Herdy, 1160, bloco C, 2º andar – 25 de agosto – Duque de Caxias/Rio de Janeiro, Brasil – CEP: 25071-202.
5ORCID: https://orcid.org/0000-0001-8344-1482
Email: picciani@ima.ufrj.br
IMA – Instituto de Macromoleculas Professora Eloisa Mano, Universidade Federal do rio de Janeiro – Av. Horácio Macedo, 2030. Technology Center, Bloco J – Rio de Janeiro / Rio de Janeiro, Brasil – Zip Code: 21941-598
6**ORCID: https://orcid.org/0000-0002-2687-0165
Email: fabianohegg@gmail.com
Programa de Pós-Graduação em Odontologia da Universidade do Grande Rio (UNIGRANRIO), Rua Prof. José de Souza Herdy, 1160, bloco C, 2º andar – 25 de agosto – Duque de Caxias/Rio de Janeiro, Brasil – CEP: 25071-202.
– IMA – Instituto de Macromoleculas Professora Eloisa Mano, Universidade Federal do rio de Janeiro – Av. Horácio Macedo, 2030. Technology Center, Bloco J – Rio de Janeiro / Rio de Janeiro, Brasil – Zip Code: 21941-598
**Correspondência: fabianohegg@gmail.com; Telefone: +55(21) 99411-9341; Programa de Pós-Graduação em Odontologia da Universidade do Grande Rio (UNIGRANRIO), Rua Prof. José de Souza Herdy, 1160, bloco C, 2º andar – 25 de agosto – Duque de Caxias/Rio de Janeiro, Brasil – CEP: 25071-202.
