REGISTRO DOI: 10.5281/zenodo.10642277
1Rafael André Ferreira
2Ludmilla Ferreira de Assis
3Reinaldo Reis Pimentel
4Ana Clara Fernandes de Souza
5Pollyanne Nunes Bonfim Gouvêa
6Fabiane de Carvalho Silva
7Fabio Oliveira de Souza
8Geisiane Barbosa de Bastos
9Murillo Monteiro de Oliveira
10Ricardo Viana Velloso
Resumo: A vancomicina é um antimicrobiano utilizado no tratamento de infecções graves causadas por bactérias Gram-positivas. Com um peso molecular de aproximadamente 1450 Da, é administrada principalmente por via intravenosa, com um perfil farmacocinético complexo de 2 ou 3 compartimentos. Seus usos clínicos incluem tratamento de infecções por Staphylococcus aureus resistente à meticilina (MRSA) e outras bactérias Gram-positivas. A síntese da vancomicina é explorada, desde seus primórdios até os avanços atuais, destacando sua evolução ao longo do tempo. A metodologia envolve revisões da literatura realizadas no segundo semestre de 2023, priorizando fontes como Scielo e PubMed, enquanto o referencial teórico aborda as etapas críticas no processo de síntese desse fármaco. Além disso, destaca-se as indicações para o uso da vancomicina, como tratamento de infecções intestinais e MRSA, e explora seu mecanismo de ação, que se dá por meio da inibição da polimerização de peptidoglicanos na parede celular bacteriana. São discutidas as características da administração como formas intravenosa e oral, por exemplo, aspectos farmacocinéticos e farmacodinâmicos, incluindo distribuição, ligação às proteínas, metabolismo, clearance e excreção. Efeitos adversos associados à injeção intravenosa, como nefrotoxicidade e reações de hipersensibilidade, são mencionados. Na conclusão, destaca-se a importância do controle no uso da vancomicina devido à resistência crescente, ressaltando o papel crucial da equipe multiprofissional para garantir uma administração adequada e monitoramento constante, visando resultados ideais para o paciente.
Palavras-chave: vancomicina, antimicrobianos, antibacterianos, síntese de medicamentos.
Abstract: Vancomycin is an antimicrobial agent used in the treatment of severe infections caused by Gram-positive bacteria. With a molecular weight of approximately 1450 Da, it is primarily administered intravenously, exhibiting a complex pharmacokinetic profile with 2 or 3 compartments. Clinical applications include the treatment of infections caused by methicillin-resistant Staphylococcus aureus (MRSA) and other Gram-positive bacteria. The synthesis of vancomycin is explored, spanning from its origins to current advances, highlighting its evolutionary path over time. The methodology involves literature reviews conducted in the second semester of 2023, prioritizing sources such as Scielo and PubMed, while the theoretical framework addresses critical stages in the drug synthesis process.Furthermore, the indications for vancomycin use, such as in the treatment of intestinal infections and MRSA, are emphasized. The mechanism of action involves inhibiting the polymerization of peptidoglycans in the bacterial cell wall. The characteristics of administration, both intravenous and oral forms, as well as pharmacokinetic and pharmacodynamic aspects, including distribution, protein binding, metabolism, clearance, and excretion, are discussed. Adverse effects associated with intravenous injection, such as nephrotoxicity and hypersensitivity reactions, are mentioned. In conclusion, the importance of controlled vancomycin use due to increasing resistance is underscored, emphasizing the crucial role of the interprofessional team in ensuring proper administration and constant monitoring for optimal patient outcomes.
Keywords: vancomycin, antimicrobials, antibacterials, drug synthesis.
1 INTRODUÇÃO
A vancomicina é um medicamento amplamente utilizado no tratamento de infecções bacterianas graves causadas por bactérias Gram-positivas. Pertencente à classe de medicamentos antimicrobianos inibidores da síntese da parede celular, a vancomicina é um composto glicopeptídico de grande tamanho, com um peso molecular de aproximadamente 1450 Da. Ela não é absorvida significativamente por via oral e é eliminada principalmente via renal, com mais de 80%–90% sendo recuperada inalterada na urina dentro de 24 horas após a administração de uma única dose (WILHELM MP, 1991; KAMPMEIER S et al., 2018).
O perfil farmacocinético da vancomicina é complexo e pode ser caracterizado por um perfil farmacocinético de 2 ou 3 compartimentos. O medicamento é administrado por via intravenosa, com um tempo padrão de infusão de pelo menos 1 hora para minimizar efeitos adversos relacionados à infusão. Em pacientes com depuração de creatinina normal, a vancomicina possui uma fase de distribuição α de aproximadamente 30 minutos a 1 hora, e uma meia-vida de eliminação β de 6–12 horas. O volume de distribuição é de 0,4–1 L/kg (MONTEIRO JF et al., 2018).
A ligação da vancomicina às proteínas foi relatada na literatura variando de 10% a 50%. Fatores que afetam a atividade global da vancomicina incluem sua distribuição nos tecidos, a dose administrada e os efeitos de ligação às proteínas (YABLON SA, KROTENBERG R, FRUHMANN K., 1992).
Nesse sentido se faz necessária a presente abordagem por situar os achados relevantes em relação à síntese do fármaco antimicrobiano vancomicina, os mecanismos de ação e aplicação clínica, e importantes aspectos farmacológicos de relevância desse medicamento sintético no cenário terapêutico, além dos avanços científicos convergentes com as possibilidades de melhorias nas tecnologias de produção de medicamentos antimicrobianos.
Destaque-se, por fim, a exploração da evolução da síntese da vancomicina desde sua introdução como parte das primeiras drogas antimicrobianas até os dias atuais. Discutiremos também a importância desse medicamento antimicrobiano o qual é um dos mais utilizados na prática clínica, focando na sua estrutura, função e características mais relevantes.
2 METODOLOGIA
O estudo foi elaborado a partir de dados obtidos por meio de revisões bibliográficas. A revisão da literatura foi realizada durante o segundo semestre de 2023 por meio de pesquisa em livros e revistas científicas e em sites de busca como Scielo, PubMed e Google Acadêmico. Ao todo foram selecionados 27 trabalhos para revisão sistemáticas os quais podem ser consultados no decorrer do texto ou na sessão “referências”. Foram realizadas buscas utilizando o descritor “vancomicina” com ênfase em seus princípios de ação, características químicas, estruturais e farmacológicas, interações e principais indicações. Foram também destacadas informações como implicações clinicas e efeitos adversos. .
3 REFERENCIAL TEÓRICO E DISCUSSÃO
3.1 Indicações para o uso da vancomicina
A vancomicina é um antibiótico glicopeptídico tricíclico originalmente derivado do organismo Streptococcus orientalis (figura 01). É usado para tratar e prevenir várias infecções bacterianas causadas por bactérias Gram-positivas, incluindo Staphylococcus aureus resistente à meticilina (MRSA). Também é eficaz contra estreptococos, enterococos e infecções por Staphylococcus aureus sensíveis à meticilina (MSSA). A vancomicina tem diversas indicações aprovadas pela agencia que administra e fiscaliza a produção de alimentos e medicamentos dos Estados Unidos, a FDA (sigla em inglês para “Food and Drug Administration”) (MONTEIRO JF et al., 2018).
Em relação às suas indicações mais recorrentes na prática clínica podemos citar: diarreia associada a Clostridioides difficile (administração oral), enterocolite estafilocócica, colite pseudomembranosa, endocardite (espécies diftéricas, enterococos, estafilococos e estreptococos), infecções estafilocócicas (septicemia, infecções de pele e tecidos moles, infecções ósseas, infecções do trato respiratório inferior) (YABLON SA, KROTENBERG R, FRUHMANN K., 1992).
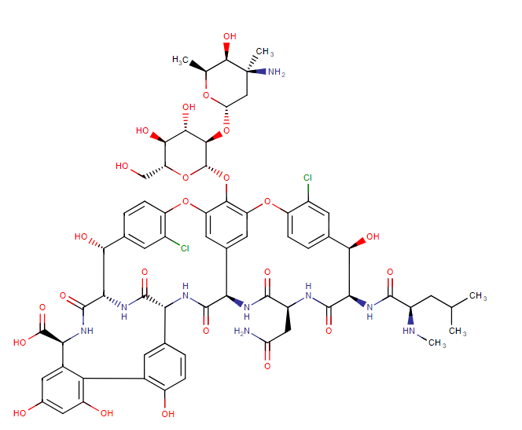
Figura 1: Estrutura química da vancomicina (disponível em https://go.drugbank.com/drugs/DB00512, acesso em 01/11/2023).
3.2 Mecanismo de ação
A vancomicina é um antibiótico glicopeptídico que exerce seu efeito bactericida inibindo a polimerização de peptidoglicanos na parede celular bacteriana (figura 02) (KOYAMA N, INOKOSHI J, TOMODA H., 2012).
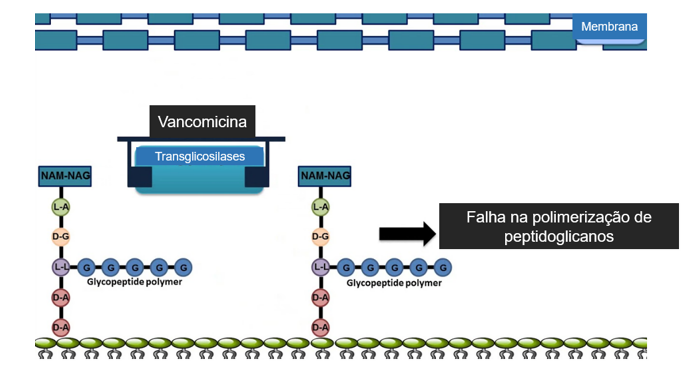
Figura 2: Visão esquematizada do mecanismo de inibição da polimerização de peptideoglicanos pela vancomicina Quando atinge a parede celular de uma bactéria gram-positiva suscetível em divisão ativa, à vancomicina se liga à porção acil-D-ala-D-ala da parede celular em crescimento. Após a ligação, impede que a parede celular forme a ligação cruzada necessária para mantê-la forte. (disponível em https://go.drugb ank.com/drugs/, acesso em 01/11/2023).
A parede celular bacteriana contém uma camada rígida de peptidoglicano com uma estrutura altamente cruzada composta por longos polímeros de ácido N-acetilmurâmico (NAM) e N-acetilglicosamina (NAG). A vancomicina se liga ao D-alanil D-alanina, inibindo a glucosiltransferase (peptidoglicano sintase) e o transportador de fosfolipídios P, impedindo assim a síntese e polimerização de NAM e NAG dentro da camada de peptidoglicano (LEE T et al., 2019; BARTOLETTI M et al., 2018).
Essa inibição enfraquece as paredes celulares bacterianas e, em última instância, causa vazamento de componentes intracelulares, resultando na morte da célula bacteriana (BARTOLETTI M et al., 2018).
A vancomicina é ativa apenas contra bactérias Gram-positivas (BUTLER-LAPORTE G et al., 2018).
3.3 Características das de administração da vancomicina
A vancomicina é aprovada pela FDA para administração por injeção intravenosa ou via oral. A administração retal é uma utilização não aprovada de vancomicina útil no tratamento da infecção por Clostridium difficile ea segurança e eficácia da aplicação da vancomicina por via intratecal ainda não foram submetidas a avaliação. Estudos observacionais mostraram que a administração intraperitoneal de vancomicina, durante a diálise peritoneal contínua em ambiente ambulatorial, resultou na manifestação de uma síndrome de peritonite química (ISHII H et al., 2018; GERDING DN et al.,2018)
A administração depende do tipo e localização da infecção. Devido à baixa biodisponibilidade oral, a administração é realizada principalmente por via intravenosa para tratar a maioria das infecções (BARTOLETTI M et al., 2018; BUTLER-LAPORTE G et al., 2018; GERDING DN, SAMBOL SP, JOHNSON S, 2018).
A injeção intravenosa (IV) de vancomicina pode tratar infecções por MRSA e outros microrganismos gram-positivos suscetíveis. De modo geral, ela está disponível em solução IV de 5 mg/mL, 10 mg/mL em solução de NaCl 0,9% ou 5 mg/mL em solução de glicose a 5% ou NaCl 0,9% (LACTMED, 2022; GERSTEIN W, COLOMBO E, HARJI F, 2018).
Também está disponível como pó estéril para reconstituição em frascos de 500 mg, 1 g, 1,25 g, 1,5 g e 10 g. A dose de vancomicina necessária depende do tipo e gravidade da infecção, apresentação clínica geral do paciente, função renal e peso corporal. A dose intravenosa desejada deve ser administrada lentamente por pelo menos 60 minutos (BRUNIERA FR et al., 2015).
A frequência de administração varia em torno de 8 a 24 horas e deve ser ajustada com base na função renal, idade e concentrações séricas mínimas. As concentrações séricas mínimas requerem monitoramento constante em todos os pacientes (CIESLAK PR et al., 1999; (KOYAMA N, INOKOSHI J, TOMODA H., 2012).
A vancomicina oral tem baixa absorção sistêmica e é eficaz apenas no tratamento de infecções intestinais. Portanto, suas únicas indicações são para o tratamento de diarreia associada a Clostridioides difficile (CDAD), colite pseudomembranosa e enterocolite estafilocócica. A vancomicina oral não é uma opção de tratamento apropriada para infecções sistêmicas que afetam outros órgãos ou partes do corpo (GERDING DN, SAMBOL SP, JOHNSON S 2018; LEE T et al., 2019).
A vancomicina oral está disponível como cápsulas de 125 mg e 250 mg e solução oral de 250 mg/5 mL. Geralmente, é administrada quatro vezes ao dia por 7 a 10 dias. No entanto, a determinação da dose exata e da duração da terapia depende de vários fatores, incluindo a indicação, avaliação da apresentação clínica do paciente e a gravidade da infecção (LEVITUS M, REWANE A, PERERA TB, 2022).
Devido à baixa absorção sistêmica, a vancomicina oral não requer ajuste de dose para pacientes com insuficiência renal. Além disso, o monitoramento rotineiro das concentrações séricas mínimas não é recomendado para pacientes que recebem apenas vancomicina oral (MARISSEN J et al., 2020).
3.4 Caraterísticas farmacocinéticas e farmacodinâmicas da vancomicina
A seguir são sumarizadas na tabela 1 as principais características farmacocinéticas e farmacodinâmicas da vancomicina:
Tabela 1: Caraterísticas farmacocinéticas e farmacodinâmicas da vancomicina (Adaptado de Patel S., Preuss C.V., Bernice F., 2023).
Parâmetro Característica Via de administração: Intravenosa, oral, administração retal. Inibição do crescimento bacteriano: Lentamente bactericida. Absorção: A vancomicina oral tem uma biodisponibilidade inferior a 10%. Início de ação: A vancomicina tem um início de ação rápido, com uma concentração sérica máxima imediatamente após a conclusão da infusão intravenosa. O início de ação da vancomicina oral é atualmente desconhecido. Distribuição: Volume grande de distribuição (0,4 L/kg a 1,0 L/kg) nos tecidos e fluidos corporais, excluindo o líquido cefalorraquidiano (LCR) com meninges não inflamadas. Ligação às proteínas: Aproximadamente 55%. Metabolismo: Sem metabolismo evidente (excretado inalterado). Clearance: 0,71 mL/minuto/kg a 1,31 mL/minuto/kg em adultos com função renal normal. Meia-vida: A vancomicina tem uma meia-vida de eliminação bifásica, com uma meia-vida inicial relativamente rápida e uma meia-vida terminal de 4 a 6 horas em adultos saudáveis com função renal normal. A meia-vida de eliminação é significativamente prolongada em pacientes com disfunção renal. Monitoramento próximo é necessário para esses pacientes. Excreção: A administração intravenosa de vancomicina é eliminada principalmente por filtração glomerular no rim (75% via urina). A vancomicina oral é predominantemente excretada nas fezes.
3.5 Efeitos adversos injeção intravenosa de vancomicina
Os efeitos adversos comuns da injeção intravenosa de vancomicina incluem nefrotoxicidade, hipotensão e reações de hipersensibilidade. A anafilaxia é um tipo de reação de hipersensibilidade que pode ocorrer com a vancomicina (CHAN JOS et al., 2018; GERSTEIN W, COLOMBO E, HARJI F, 2018).
A síndrome de flushing da vancomicina (VFS), anteriormente conhecida como síndrome de Redman, é uma reação relacionada à infusão associada à infusão intravenosa rápida de vancomicina. Os sintomas incluem rubor, prurido e uma erupção eritematosa no rosto, pescoço e parte superior do tronco (MARISSEN J et al., 2020).
Efeitos adversos gastrointestinais, como dor abdominal e náuseas, são comumente observados com a vancomicina oral. Além disso, a disgeusia ou distorção do sentido do paladar é um efeito adverso comum exclusivo da solução oral de vancomicina. Os pacientes devem procurar atendimento médico se esses efeitos adversos forem graves e incômodos. Vale ressaltar que muitos desses efeitos adversos são temporários (XU G et al., 2018; LEVITUS M, REWANE A, PERERA TB, 2022).
4 CONCLUSÃO E CONSIDERAÇÕES FINAIS
A vancomicina, um antimicrobiano de fundamental importância no tratamento de infecções graves causadas por bactérias gram-positivas, destaca-se não apenas por sua eficácia clínica comprovada, mas também por sua evolução ao longo do tempo, desde os estágios iniciais de síntese até as aplicações clínicas contemporâneas. Este estudo proporcionou uma análise aprofundada de vários aspectos relacionados à vancomicina, abrangendo desde sua complexa farmacocinética até seu mecanismo de ação preciso e aplicações clínicas abrangentes.
A administração predominantemente intravenosa da vancomicina, com um perfil farmacocinético caracterizado por dois ou três compartimentos, reflete a complexidade envolvida na otimização de seu uso clínico. O medicamento é uma ferramenta essencial no tratamento de infecções causadas por Staphylococcus aureus resistente à meticilina (MRSA) e outras bactérias Gram-positivas, demonstrando seu papel vital na prática médica atual.
Ao longo do estudo, abordamos detalhes críticos, desde sua síntese até características farmacodinâmicas e farmacocinéticas, incluindo distribuição, ligação às proteínas, metabolismo, clearance e excreção. As formas de administração, seja intravenosa ou oral, foram exploradas em profundidade, proporcionando uma compreensão holística de como a vancomicina interage no organismo.
A conclusão ressalta a importância do controle rigoroso no uso da vancomicina, especialmente diante do desafio crescente da resistência bacteriana. Destaca-se o papel crucial da equipe interprofissional na garantia de uma administração adequada e no monitoramento constante para alcançar resultados ideais para o paciente. A conscientização sobre os potenciais efeitos adversos, como a nefrotoxicidade e reações de hipersensibilidade associadas à administração intravenosa, é enfatizada como parte integrante do uso responsável deste antimicrobiano.
Em última análise, a vancomicina permanece como uma ferramenta valiosa na luta contra infecções graves, e sua gestão cuidadosa é essencial para preservar sua eficácia e contribuir para abordagens terapêuticas bem-sucedidas em um cenário clínico em constante evolução.
4 REFERÊNCIAS
- BARTOLETTI M, GIANNELLA M, TEDESCHI S, VIALE P. Multidrug-Resistant Bacterial Infections in Solid Organ Transplant Candidates and Recipients. Infect Dis Clin North Am. 2018 Sep;32(3):551-580.
- BOUKOUVALA F. et al., “Computer-Aided Flowsheet Simulation of a Pharmaceutical Tablet Manufacturing Process Incorporating Wet Granulation,” J. Pharm. Innov., vol. 8, no. 1, pp. 11–27, Jan. 2013.
- BRASIL. Ministério da Saúde. Agência Nacional de Vigilância Sanitária (ANVISA). Resolução da Diretoria Colegiada – RDC n° 17, de 16 de abril de 2010, dispõe sobre Boas Práticas de fabricação de Medicamentos. Diário Oficial da União, Poder Executivo, Brasília, DF, 17 de abr. 2010b.
- BRASIL. O que devemos saber sobre medicamentos? Cartilha da Agência Nacional de Vigilância Sanitária (Anvisa). São Paulo, 104 p, 2010a.
- BRUNIERA FR, FERREIRA FM, SAVIOLLI LR, BACCI MR, FEDER D, DA LUZ GONÇALVES PEDREIRA M, SORGINI PETERLINI MA, AZZALIS LA, CAMPOS JUNQUEIRA VB, FONSECA FL. The use of vancomycin with its therapeutic and adverse effects: a review. Eur Rev Med Pharmacol Sci. 2015 Feb;19(4):694-700.
- BUTLER-LAPORTE G, DE L’ÉTOILE-MOREL S, CHENG MP, MCDONALD EG, LEE TC. MRSA colonization status as a predictor of clinical infection: A systematic review and meta-analysis. J Infect. 2018 Dec;77(6):489-495.
- CARON S.,THOMSON N. M., “Pharmaceutical process chemistry: Evolution of a contemporary data-rich laboratory environment,” J. Org. Chem., vol. 80, no. 6, pp. 2943–2958, 2015.
- CHAN JOS, BAYSARI MT, CARLAND JE, SANDARADURA I, MORAN M, DAY RO. Barriers and facilitators of appropriate vancomycin use: prescribing context is key. Eur J Clin Pharmacol. 2018 Nov;74(11):1523-1529.
- CIESLAK PR, STRAUSBAUGH LJ, FLEMING DW, LING JM. Vancomycin in Oregon: who’s using it and why. Infect Control Hosp Epidemiol. 1999 Aug;20(8):557-60.
- DRUGS AND LACTATION DATABASE (LactMed®) [Internet]. National Institute of Child Health and Human Development; Bethesda (MD): Jun 20, 2022. Vancomycin.
- GERDING DN, SAMBOL SP, JOHNSON S. Non-toxigenic Clostridioides (Formerly Clostridium) difficile for Prevention of C. difficile Infection: From Bench to Bedside Back to Bench and Back to Bedside. Front Microbiol. 2018;9:1700.
- GERSTEIN W, COLOMBO E, HARJI F. Documented vancomycin-induced severe immune-mediated thrombocytopaenia. BMJ Case Rep. 2018 Aug 27;2018.
- ISHII H, HIRAI K, SUGIYAMA K, NAKATANI E, KIMURA M, ITOH K. Validation of a Nomogram for Achieving Target Trough Concentration of Vancomycin: Accuracy in Patients With Augmented Renal Function. Ther Drug Monit. 2018 Dec;40(6):693-698.
- KAMPMEIER S, KOSSOW A, CLAUSEN LM, KNAACK D, ERTMER C, GOTTSCHALK A, FREISE H, MELLMANN A. Hospital acquired vancomycin resistant enterococci in surgical intensive care patients – a prospective longitudinal study. Antimicrob Resist Infect Control. 2018;7:103.
- KOYAMA N, INOKOSHI J, TOMODA H. Anti-infectious agents against MRSA. Molecules. 2012 Dec 24;18(1):204-24.
- LEE S. L. et al., “Modernizing Pharmaceutical Manufacturing: from Batch to Continuous Production,” J. Pharm. Innov., vol. 10, no. 3, pp. 191–199, 2015.
- LEE T, PANG S, ABRAHAM S, COOMBS GW. Antimicrobial-resistant CC17 Enterococcus faecium: The past, the present and the future. J Glob Antimicrob Resist. 2019 Mar;16:36-47.
- LEVITUS M, REWANE A, PERERA TB. StatPearls [Internet]. StatPearls Publishing; Treasure Island (FL): Jul 18, 2022. Vancomycin-Resistant Enterococci.
- MARISSEN J, FORTMANN I, HUMBERG A, RAUSCH TK, SIMON A, STEIN A, SCHAIBLE T, EICHHORN J, WINTGENS J, ROLL C, HEITMANN F, HERTING E, GÖPEL W, HÄRTEL C. Vancomycin-induced ototoxicity in very-low-birthweight infants. J Antimicrob Chemother. 2020 Aug 01;75(8):2291-2298.
- MONTEIRO JF, HAHN SR, GONÇALVES J, FRESCO P. Vancomycin therapeutic drug monitoring and population pharmacokinetic models in special patient subpopulations. Pharmacol Res Perspect. 2018 Jul;6(4):e00420.
- SIMON L. L. H., et al., “Assessment of recent process analytical technology (PAT) trends: A multiauthor review,” Org. Process Res. Dev., vol. 19, no. 1, pp. 3–62, 2015.
- STEENSMA M. et al., “Modelling and experimental evaluation of reaction kinetics in reactive extraction for chiral separation of amines, amino acids and amino-alcohols,” Chem. Eng. Sci., vol. 62, no. 5, pp. 1395–1407, Mar. 2007.
- WEGNER J, CEYLAN S., KIRSCHNING A., “Flow Chemistry – A Key Enabling Technology for (Multistep) Organic Synthesis,” Adv. Synth. Catal., vol. 354, no. 1, pp. 17–57, Jan. 2012.
- WILHELM MP. Vancomycin. Mayo Clin Proc. 1991 Nov;66(11):1165-70.
- XU G, CHEN E, MAO E, CHE Z, HE J. [Research of optimal dosing regimens and therapeutic drug monitoring for vancomycin by clinical pharmacists: analysis of 7-year data]. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue. 2018 Jul;30(7):640-645.
- YABLON SA, KROTENBERG R, FRUHMANN K. Diarrhea in hospitalized patients. Am J Phys Med Rehabil. 1992 Apr;71(2):102-7.
- YU L. X., “Pharmaceutical Quality by Design: Product and Process Development, Understanding, and Control,” Pharm. Res., vol. 25, no. 4, pp. 781–791, 2008.
1Biomédico pelo Centro Universitário UNA – MG, Mestre em Bioquímica e Imunologia pela Universidade Federal de Minas Gerais – UFMG, Doutorando em Educação pela Universidad Internacional Iberoamericana – Porto Rico (EUA), Especialista em Analises Clinicas e Microbiologia pela Faculdade Venda Nova do Imigrante – ES (FAVENI – ES);
2Biomédica pela Universidade Paulista (UNIP), Aluna do curso de Pós-Graduação Lato Sensu em Hematologia Clínica e Banco de Sangue, Hemoterapia e Terapia Celular pelo Instituto Monte Pascoal – GO;
3Biólogo pela Faculdade Araguaia – GO (UniAraguaia), Aluno do curso de Pós-Graduação Lato Sensu em Microbiologia Aplicada ao Laboratório Clínico pelo Instituto Monte Pascoal – GO;
4Enfermeira pela Faculdade Padrão – GO, Especialista em UTI e Urgência e Emergência pela Faculdade Afirmativo – MT;
5Acadêmica do curso de Nutrição pelo Centro Universitário Leonardo da Vinci (UNIASSELVI);
6Acadêmica do curso de Biomedicina pelo Centro Universitário Leonardo da Vinci (UNIASSELVI); Técnica em Enfermagem pelo Instituto de Técnologia e Educação de Goiás – GO (ITEG);
7Biomédico pela Pontifícia Católica de Goiás – GO (PUC-GO), Mestre em Genética Pontifícia Católica de Goiás – GO (PUC-GO);Especialista em Gestão e Biossegurança em Estética e Cosmética pela Universidade Estadual de Goiás – GO (UEG);
8Biomédica pela Universidade Paulista (UNIP), Aluna do curso de Pós-Graduação Lato Sensu em Hematologia Clínica e Bioinformática pela Faculdade Unyleya – DF;
9Biomédico pela Universidade Paulista (UNIP), Aluno do curso de Pós-Graduação Lato Sensu em Hematologia Clínica e Banco de Sangue, Hemoterapia e Terapia Celular pelo Instituto Monte Pascoal – GO;
10Licenciado em Letras pela Universidade Candido Mendes – RJ, Doutor em Educação pela Universidade São Francisco – SP (USF) Mestre em Educação pela Universidade Estadual de Minas Gerais – MG (UEMG), Especialista em Ensino da Língua Portuguesa pela Universidade Candido Mendes – RJ.
Instituição: 1,2,4,6,7,8Unidade de Pronto Atendimento 24 horas (UPA 24 horas) / Secretaria Municipal de Saúde do Município de Senador Canedo – GO; 2,3,9Instituto Monte Pascoal – GO; 1,5,6Centro Universitário Leonardo da Vinci (UNIASSELVI); 10Universidade Federal de Minas Gerais – MG (UFMG).
