USE OF LIPOSOMAL FORMULATION ASSOCIATED WITH PACLITAXEL TO REDUCE ADVERSE EFFECTS IN THE TREATMENT OF BREAST CÂNCER.
REGISTRO DOI: 10.5281/zenodo.12701897
Ariane Dias da Conceição Lira1; Beatriz Saisse dos Santos Araújo2; Gabriela Serpa Pinheiro3; Isabelli Borges Pereira4; Darlan Ferreira de Souza5.
RESUMO
O carcinoma de mama é uma doença agressiva que requer tratamentos. Diante disto, os tratamentos propostos são cirúrgicos, hormonais e/ou com quimioterapia. O principal problema deste artigo de intervenção está em torno dos efeitos adversos gerados pela quimioterapia, em especial com o medicamento Paclitaxel, justificando assim a proposta de adaptação, a partir de tecnologia farmacêutica, deste fármaco. Este presente trabalho direciona-se para uma pesquisa intervencionista com intuito de propor a adaptação do fármaco Paclitaxel à nanotecnologia lipossomal, que se trata de uma tecnologia vastamente utilizada para o melhor direcionamento farmacológico, a fim de reduzir os efeitos adversos presentes.
Palavras-chave: Carcinoma de Ductos Infiltrante; Taxoides; Nanotecnologia.
ABSTRACT
Breast carcinoma is an aggressive disease that requires treatments. In view of this, the proposed treatments are surgical, hormonal and/or with chemotherapy. The main problem of this intervention project is around the adverse effects generated by chemotherapy, especially with the drug Paclitaxel, thus justifying the proposed adaptation, based on pharmaceutical technology, of this drug. This present work is directed towards an interventionist research with the aim of proposing the adaptation of the drug Paclitaxel to liposomal nanotechnology, which is a widely used technology for better pharmacological targeting, in order to reduce the adverse effects present.
Keywords: Ductal breast carcinoma; Taxoids; Nanotechnology.
INTRODUÇÃO
Em contextos atuais, o câncer de mama tem acometido grande porcentagem de mulheres brasileiras e, sendo ele uma neoplasia importante, possui tratamentos que requerem rigor.
Pode-se afirmar que os tumores de mama são os que mais acometem a população feminina brasileira, perdendo somente para os tumores de pele não melanoma. São, portanto, a enfermidade que mais mata mulheres no país. Dados ainda mostram grande possibilidade de alta em taxas de carcinoma de mama. De acordo com o Instituto Nacional do Câncer (INCA), estima-se o surgimento de 66.280 novos casos a serem detectados até dezembro de 2020 (INCA, 2019).
É importante dizer que o carcinoma de mama é entendido como o desenvolvimento tumoral invasivo ou não invasivo de células malignas e seus subtipos são diferenciados de acordo com o posicionamento do tumor. Caso não invasivos, são considerados in situ. Também são subclassificados de acordo com seus posicionamentos fisiológicos, sendo conhecidos como ductal, lobular, mucinoso, medular e papilar (BREASTCANCER.ORG, 2020).
Para tratar esses tumores, é possível o tratamento cirúrgico, sendo associado ou não com radioterapia e/ou quimioterapia e hormonioterapia, de acordo com a gravidade do quadro do paciente. Dando ênfase ao tratamento medicamentoso, a quimioterapia ocasiona muitos efeitos adversos que são indesejados (WALKS; WINTER, 2019)
O carcinoma ductal invasivo é o subtipo tumoral maligno que mais atinge a população, sendo assim 81% dos casos reconhecidos como este. É valido informar que este tipo de tumor requer tratamento sistêmico como quimioterapia, sempre levando em consideração o estágio em que o desenvolvimento tumoral se encontra e seus subtipos (AMERICAN CANCER SOCIETY, 2019).
Dentro dos esquemas terapêuticos é encontrado o Paclitaxel, fármaco de primeira escolha para o tratamento quimioterápico, podendo ser associado com outras classes e hormonioterapia. Este fármaco possui boa resposta terapêutica, mas possuem efeitos adversos importantes (BRUNTON; HILAL-DANDAN; KNOLLMANN,2019). Diante do uso do Paclitaxel no tratamento do câncer de mama, depara-se com um problema recorrente: a presença de efeitos adversos que tornam o tratamento mais complexo, fazendo com que sua aplicabilidade seja cautelosa.
No quadro abaixo, é possível verificar os efeitos adversos mais comuns (recorrentes em acima de 10% dos casos):
Quadro 1: Efeitos adversos mais presentes diante a administração de Paclitaxel.
Tecido atingido Efeitos adversos frequentes Observações Hepático Possível hepatotoxicidade Relacionado à doentes hepáticos crônicos Linfático Mielossupressão, anemia, neutropenia, trombocitopenia, leucopenia, febre e sangramento Supressão da medula óssea ocasionando redução da produção da série branca Cardiovascular Bradicardia, quadros hipertensivos e hipotensivos X Nervoso Neuropatia periférica Condição relacionada a danos nas inervações periféricas, prejudicando a transmissão de sinapses ao sistema nervoso central Óptico Danos reversíveis ao nervo óptico Ocasionam visão turva, fotopsia e presença de escotomas cintilantes. Gastrintestinais Náuseas, vômitos e diarréias X Epitelial Alopécia Relacionado à perda de cabelo e pelos
Além dos efeitos adversos supracitados, existem possíveis chances de processos de erupções locais, hipersensibilidade, e em casos mais graves deste último citado, choque anafilático (BMS, 2016).
Antes mesmo da administração da formulação tradicional do Paclitaxel, os pacientes recebem tratamento com anti-histamínicos e glicocorticoides, a fim de minimizar possíveis reações de hipersensibilidades. Ainda neste contexto, houve a adaptação deste medicamento, ligando-o à albumina (nab-paclitaxel), proporcionando a segurança de administração sem a necessidade de administrar glicocorticóides e anti-histamínicos (BRUNTON; HILAL-DANDAN; KNOLLMANN, 2019).
Apesar deste grande avanço, a Agência Nacional de Vigilância Sanitária (Anvisa) autoriza o uso deste medicamento somente para o tratamento de câncer do pâncreas, fazendo com que a busca de um possível tratamento com menos efeitos adversos para o câncer de mama continue (ANVISA, 2017).
Lipossomas são vesículas esféricas compostas por bicamada de fosfolipídios. Permite incorporar fármacos de natureza hidrofílica na fase aquosa e na dupla camada lipídica, fármacos hidrofóbicos (PACE,2013).
Podem ser apresentados em uma ou mais bicamadas, denominadas lamelas. As vesículas multilamelares (MLV) são constituídas por mais de uma bicamada, enquanto vesículas unilamelares são constituídas apenas por uma, podendo ser subdividas em: vesículas unilamelares gigantes (GUV), vesículas unilamelares grandes (LUV) e vesículas unilamelares pequenas (SUV) (Nogueira; Gomes; Preto; Paulo, 2015).
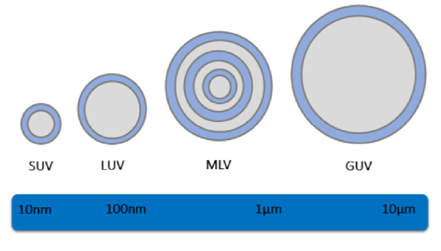
Figura 1: Representação esquemática dos lipossomas segundo seu número de bicamadas. Retirado de Nogueira; Gomes; Preto; Paulo, 2015.
O uso da nanotecnologia alterou terapias convencionais oncológicas, apresentando diversas vantagens como a vetorização de determinados fármacos, permitindo a liberação da carga terapêutica no local desejado e a redução da toxicidade não específica (DUNCAN; GASPAR, 2011).
Junto a isto, destaca-se as formulações lipossomais que, através da encapsulação, reduz os efeitos adversos aos tecidos normais, liberam lentamente o fármaco resultando em um efeito farmacológico direcionado, permitindo a proteção do fármaco contra degradação química e biológica relacionada à via de administração (PACE, 2013).
Diversos quimioterápicos presentes na terapêutica oncológica têm grande eficácia em eliminar células cancerígenas. Em contrapartida, são pouco específicos e induzem sua toxicidade em células saudáveis. Outro desafio que limita o tratamento é o processo de resistência tumoral ao quimioterápico utilizado.
A resistência pode ocorrer durante o tratamento, onde inicialmente o tumor era sensível à droga e, após sofrer alguma mutação, as células tumorais já não respondem ao tratamento (HOLOHAN; VAN SCHAEYBROECK; LONGLEY; JOHNSTON, 2013).
Um dos mecanismos de resistência contra ação de quimioterápicos vastamente estudados é a bomba de efluxo, capaz de retornar com a droga para o meio extracelular. Proteínas transportadoras do tipo ABC (ATP-binding Cassette Protein) regulam na membrana a entrada de variados quimioterápicos. A proteína transmembranar mais relacionada a este tipo de resistência quimioterápica chama-se glicoproteína-P (P-gp) Entretanto, o gene resistente a múltiplas drogas 1 (MRD1, Multi-drug-resistance) ,quando superexpresso, modula a proteína transmembranar, responsabilizando-se pela eliminação de várias drogas do meio intracelular. A superexpressão da MRD1 é associada ao fracasso quimioterápico em vários tipos de células cancerígenas como: próstata, mama e pulmão (BAO; HAZARI; MEHRA; KAUSHUAL; MOROZ; DASH, 2012).
Conhecer esse processo permite identificar a fragilidade tumoral, possibilitando o emprego de uma vetorização ativa, onde a interação do ligante presente no lipossoma e o alvo especifico presente no receptor proporcione uma liberação direcionada do fármaco. O ancoramento de moléculas para biorreconhecimento provocando a internalização celular do fármaco presente no nanosistema, evita que fique sujeito ao mecanismo de resistência (MOHANTY; DAS; KANWAR; SAHOO, 2011).
Associado ao sistema de liberação torna-se interessante uso de alguns ligantes, conferindo maior vetorização do fármaco ao sitio desejado. As superfícies de algumas células expressam em maior quantidade, receptores que possam ser utilizados para aumentar afinidade do fármaco ao tecido alvo.
O receptor de folato é superexpresso na superfície de muitas células cancerosas como: ovário, endométrio, mama, pulmão e rins. Demostrando que o ácido fólico é interessante para vetorização, por ser a forma mais estável do folato, possui boa compatibilidade com a matéria orgânica e tem mínima imunogenicidade (PENG; ZHANG, TONG; GAO, 2011).
Desta forma a proposta de uma apresentação lipossomal do Paclitaxel, “peguilada” e ancorada com ácido fólico, demonstra maior vetorização a célula tumoral e menor efeito adverso.
METODOLOGIA
Este artigo tem como abordagem uma pesquisa intervencionista, pois, além da revisão bibliográfica realizada, conjuntamente é proposto a implementação de uma solução para os problemas encontrados.
Foram utilizadas as seguintes palavras-chave: Carcinoma de Ductos Infiltrante; Taxoides; Nanotecnologia.
Os dados utilizados para o desenvolvimento do artigo possuem ano de publicação entre 2002 e 2023, dispondo como fonte de pesquisa as plataformas: PubMed, Google Acadêmico e Scielo.
Publicações realizadas pelo Instituto Nacional do Câncer e pela American Cancer Society possibilitaram a coleta de dados necessária – incluindo a fisiologia e tratamento do câncer – para determinar o tipo e subtipo de câncer de mama, comumente encontrado em mulheres brasileiras: o Câncer de Mama Ductal Invasivo.
Ante o exposto acima, e tendo em vista a revisão bibliográfica realizada sobre a fisiologia do câncer, tratamento, e sobre nanotecnologia, em especifico a formulação lipossomal, este artigo propõe a implementação da formulação lipossomal ao fármaco Paclitaxel, utilizado como fármaco de primeira escolha para o tratamento quimioterápico, a fim de reduzir os efeitos adversos oriundos da utilização deste durante a quimioterapia, tornando-a menos agressiva e prejudicial aos pacientes, produzindo substancial acréscimo à adesão ao tratamento.
DESENVOLVIMENTO
O carcinoma de mama é uma doença proveniente do desenvolvimento desordenado de células tumorais que possui tratamento por quimioterapia, cirúrgico, radioterapia e por hormonioterapia, estando estes tratamentos, relacionados com os tipos e subtipos tumorais.
O câncer de mama possui tipos e subtipos diferentes, dentre a classificação dos subtipos estão os biomarcadores HER2, Receptor de estrogênio e Receptor de progesterona. Reconhecer os biomarcadores permite que a escolha terapêutica se torne mais efetiva. Abaixo as características principais de cada um deles:
HER2 (Receptor do tipo 2 de crescimento epidérmico humano): Esta proteína está relacionada a regulação do crescimento das células epiteliais, através de sinais ao núcleo celular por meio de sua ligação com o fator de crescimento epidérmico. Ela é codificada pelo proto-oncogene ERBB2, que diante de uma mutação, causa desordem na ação do HER2, gerando maior número de ligações às moléculas do fator de crescimento, produzindo crescimento, divisão e multiplicação celular descontrolada, o que leva ao câncer de mama HER2-positivo, um dos mais agressivos (ARCILA, 2012).
Receptor de estrogênio: É classificado em dois tipos: Alpha (α), encontrado no útero, fígado, rins, sistema cardiovascular e glândulas mamárias; e Beta (β), encontrado nas células da granulosa, tecido ósseo e nas células do sistema nervoso central. Tanto o receptor α quanto o β, demandam que o estrogênio se ligue a um deles à superfície do núcleo celular, formando um complexo capaz de invadir o núcleo para auxiliar a enzima responsável pela transcrição gênica. Por esta razão, quando o câncer de mama se dá através da ação dos receptores de estrogênio, deve ser realizada a inativação desses receptores para inibir a transcrição gênica (STANCEL, 2005).
Receptor de progesterona: O complexo formado através da ligação da progesterona com seus receptores oportuniza a ativação e aumento da transcrição gênica. Deste modo, para tratamento de câncer de mama advindo dessa desordem, é necessário o uso de antagonistas dos receptores de progesterona (GOMES, 2006).
Tendo em vista os biomarcadores apresentados, segue abaixo o quadro explicativo, a fim de salientar a nomenclatura de cada subtipo de câncer de mama.
Quadro 2: Classificação dos subtipos de câncer de mama em razão da presença ou ausência dos receptores.
Diagnóstico biomarcador HER2 Receptor de estrogênio Receptor de progesterona Triplo positivo Sim Sim Sim Hormonais positivos, HER2 negativo Não Sim Sim Hormonais negativos, HER2 positivo Sim Não Não Triplo negativo Não Não Não
Tendo em vista o exposto e, sabendo que o organismo dos seres humanos produz hormônios naturalmente, o tratamento hormonal almeja impedir que as células tumorais sejam alcançadas por esses hormônios, a fim de reduzir o desenvolvimento exacerbado celular, visto que estes estimulam seu desenvolvimento (STANCEL, 2005).
Além do tratamento hormonal, quando aplicável, é comumente utilizada a quimioterapia, tratando de forma sistêmica diversos tipos de câncer, incluindo o carcinoma ductal invasivo, abordado nesta pesquisa como o mais recorrente (HOSPITAL ISRAELITA ALBERT EINSTEIN, 2020).
O Paclitaxel é um medicamento quimioterápico sistêmico, utilizado como tratamento farmacológico para diversas neoplasias consideradas resistentes a terapias convencionais, especialmente no carcinoma de mama e ovário. O desafio da terapêutica é a manutenção do equilíbrio entre eficácia e a toxicidade, sabendo que este medicamento pode ocasionar grandes efeitos adversos.
Para discorrer sobre o mecanismo de ação do Paclitaxel é necessário ter conhecimento mínimo sobre os processos que ocorrem em uma célula, afinal este fármaco atua durante a intérfase, a fase mais longa da mitose celular.
Nesta fase, claramente é possível observar o preparo celular para a divisão propriamente dita. Nesta, encontram-se as fases G1, S e G2. Em G1 a célula promove a produção proteica e a expressão gênica; em S a replicação do material genético; em G2 o preparo para a formação dos fusos mitóticos através dos centrossomas e microtúbulos (SOUZA, 2004).
As subunidades que compõem os microtúbulos são ALFA E BETA-tubulinas, e uma de suas funções é compor a estrutura do fuso mitótico. Esse mesmo fuso participa da partilha igualitária de material genético entre as células filhas. É um momento fundamental que dará continuidade ao processo de mitose, divisão celular (SOUZA, 2004).
Assim, o Paclitaxel bloqueia a fase G2 e consequentemente a Mitose. Responsável por estabilizar as estruturas dos microtúbulos, o fármaco se liga a subunidade beta-tubulina dos microtúbulos impedindo a despolimerização exigida no processo de replicação celular. Portanto, impossibilita a continuação das seguintes fases (BRUNTON; HILAL-DANDAN; KNOLLMANN, 2019).
Dos propósitos oferecidos por esta pesquisa, será abordada no desenvolvimento toda a parte de tecnologia farmacêutica proposta para a remodulação nanotecnológica do fármaco Paclitaxel, amplamente utilizado na quimioterapia. Na visão da pesquisa intervencionista, há a sugestão de inserção deste medicamento em um lipossoma unilamelar, envolto em uma camada delgada de PEG e, aderido à superfície, a incorporação de ácido fólico.
As fases para obtenção de lipossoma podem ser divididas em: dissolução do material lipídico em solvente orgânico apropriado; remoção do solvente orgânico geralmente com formação de filme ou pó lipídico; hidratação da fase lipídica com a formação das vesículas; redução e calibração do tamanho das vesículas. O método mais utilizado para redução do tamanho da vesícula em indústria é por extrusão com filtro e homogeneização em alta pressão (WAGNER; VORAUER, 2011).
Os métodos para encapsulamento do fármaco variam de acordo com suas propriedades físico-químicas e estão ligados diretamente ao desempenho na biodistribuição do medicamento. Podemos destacar o uso de fosfatidilcolinas e colesterol sendo os mais utilizados na preparação do lipossoma.
As moléculas de lipídios são expostas ao ambiente aquoso e interações como pontes de hidrogênio entre os grupos polares e ligações de van der Waals entre as cadeias de hidrocarbonetos são observados durante o processo de formação (OHVO; RAMSTEDT; LEPPIMAKI; SLOTTE; 2002).
As composições podem variar na formulação obtendo espécies lipídicas catiônicas, aniônicas e neutras. No entanto, o mesmo método de preparação pode ser usado para todas as vesículas lipídicas, independentemente da composição.
Propriedades referentes à superfície do lipossoma são importantes por contribuir na distribuição e podem interagir com determinadas proteínas e componentes do soro. Determinando a carga da superfície temos o potencial Zeta, que origina partículas catiônicas ou aniônicas. Este fator reflete o potencial elétrico das partículas e pode ocorrer influência pela composição do seu transportador ou com o fármaco encapsulado. Partículas com potencial acima de -30mV e abaixo de +30mV são mais estáveis em suspensão e apresentam menor agregação (SWAMI; SHI; GADDE; VOTRUBA; KOLISHETTI; FAROKHZAD,2012).
Sobre o PEG, trata-se de um polímero caracterizado por moléculas neutras e hidrofílicas nos quais ajudam a melhorar o tempo de circulação no sangue e distribuição (BAMBERGER, HOBERNIK, KONHAUSER, BROS, WICH, 2017).
O PEG atua como carreador de fármacos, portando, quando manipulado junto à nanoparticulas, a sua função é revestir e conferir resistência, driblando o sistema imunológico a fim de melhor direcionar o nanossistema ao tumor alvo (LOPES, TORRES, 2019).
Após o processo de inserção de camada delgada de PEG, há o interesse total da exploração dos receptores de folato das células tumorais. Porém, antes de falar sobre estes receptores, é de extrema importância a necessidade do entendimento do mecanismo de resistência tumoral mais recorrente: o mecanismo de efluxo.
Trata-se de um mecanismo que gera a superexpressão ou a modificação conformacional de receptores transmembranares do tipo ABC. Estes são capazes de realizar o efluxo do fármaco para o meio extracelular. A principal proteína transmembranar relacionada à múltipla resistência quimioterápica é a glicoproteína P, encontrada em diversos tecidos (BAO, HAZARI, MERHA, KAUSHAL, MOROZ, DAHS, 2012).
Esta glicoproteína transmembranar é mediada por genes MDR1, que carreiam substâncias através de sua parte interna, mediada por ligação ao ATP, feitas através de um sítio de ligação de nucleotídeo (STENHAM, CAMPBELL, SANSON, HIGGINS, KER, LINTON, 2003).
Das principais teorias propostas para este mecanismo de resistência, este artigo intervencionista aborda o chamado “aspirador hidrofóbico”, retratando que as duas subunidades da glicoproteína P se designam a um canal de transporte único capaz de redirecionar ao meio extracelular os fármacos hidrofóbicos (SIARHEYAVA, LOPEZ, GLAUBITZ, 2006).
Algumas adaptações a este modelo foram feitas, e são apresentadas no esquema abaixo:
Figura 1: Adaptações da teoria de “aspirador hidrofóbico” propostas ao longo de pesquisas, levantadas por Higgins e Stein

Esquema autoral, realizado com informações de SIARHEYAVA, LOPEZ, GLAUBITZ, 2006.
Após o entendimento deste mecanismo de resistência, é de grande relevância enaltecer o uso do ácido fólico como marcador lipossomal.
Há duas formas de marcação e acumulação de nanopartículas conhecidas: através da vetorização passiva e ativa. Na vetorização passiva, há a possibilidade de introdução de nanopartículas menores que 200 nanômetros em neovasos tumorais cujas aberturas na vascularização correspondem de 100 a 780 nanômetros. Esta adesão ocorre a partir da inserção de películas de proteção como PEG (DANHIER, FERON, PRÉAT, 2010).
Quanto à vetorização ativa, é bem entendido que sua principal característica é a incorporação de ligantes à membrana lipossomal, podendo esta ser feita a partir de vitaminas, anticorpos e/ou seus fragmentos, ácidos nucleicos, carboidratos e peptídeos (PEER, KARP, HONG, FAROKHZAD, MARGALIT, LANGER, 2007).
DISCUSSÃO
A proposta deste artigo está voltada a proposição de uso de ácido fólico direcionado aos receptores tumorais de folato (FR), uma vez que esta vitamina é comumente necessária em células com constante e rápido processo de desenvolvimento, a fim de produzir ácidos nucleicos.
Os receptores FR são altamente expressos em tumores como os de câncer de mama, ovários e pulmões, sendo assim, uma promessa ao desenvolvimento de fármacos ou adaptação de medicamentos já existentes (WANG, ZHU, YU, SHI, 2013).
Células cancerígenas possuem constante desenvolvimento e necessidade de produção de ácidos nucleicos relacionados ao aumento metabólico, portanto demandam de alto consumo de ácido fólico (TOMASINA, GAUDUCHON, RAULT, MALZERT-FRÉON, 2013).
Levando em consideração todas as colocações acima, sugere-se que o ácido fólico seja a possibilidade ideal de marcador membranar, uma vez que células cancerígenas demandam grande quantidade desta biomolécula para seu desenvolvimento e, consequentemente, ludibriam possíveis mecanismos de resistência quimioterápica. As células tumorais reconhecem primeiramente a biomolécula devido à grande quantidade de receptores FR, e possibilitando assim o influxo do lipossoma marcado, evidenciando a necessidade de ácido fólico para a multiplicação de ácidos nucleicos.
Diante das informações citadas no artigo, é evidente a importância da assistência farmacêutica (AF) no âmbito oncológico, a fim de aperfeiçoar o conforto terapêutico e, consequentemente, a adesão ao tratamento. É notório que, este artigo intervencionista visa contribuir cientificamente para o acesso a uma nova formulação nano tecnológica do Paclitaxel para redução de efeitos adversos, proporcionando o uso adequado deste medicamento (SILVA; OSÓRIO-DE-CASTRO, 2019).
Portanto, surge a oportunidade de usufruir de um segmento da AF: A Atenção Farmacêutica. A abordagem desse processo abrange todos os cuidados farmacêuticos voltados ao paciente, desde a admissão até sua alta médica. É válido lembrar que, todos os cuidados relacionados a essa prática estão completamente atrelados ao conforto terapêutico citado neste artigo.
Vale ressaltar que, é de extrema importância que toda atividade direcionada ao paciente desenvolvida pelo farmacêutico deve ser redigida em prontuário, com intuito de registro e valorização do serviço farmacêutico prestado.
Espera-se que, a partir da adaptação do fármaco Paclitaxel à formulação lipossomal devidamente “peguilada” e vetorizada, a possibilidade de melhor direcionamento do tratamento quimioterápico ao tumor-alvo, neste caso, do carcinoma de mama.
Além deste fato, com o direcionamento quimioterápico, os tecidos adjacentes tendem a ser menos afetados pela citotoxicidade do medicamento, reduzindo então a possibilidade de efeitos adversos.
Ao usufruir da vetorização ativa por ácido fólico, espera-se também que o mecanismo de efluxo (relacionado á resistência quimioterápica) seja ludibriado, uma vez que há interesse da célula tumoral por esta biomolécula.
E, diante de todos os resultados esperados acima, há o anseio da possibilidade do desenvolvimento de pesquisas a fim de ofertar a comunidade científica dados e materiais que contribuam para a possível criação da formulação lipossomal do Paclitaxel.
CONCLUSÃO
Ao encerrar a pesquisa intervencionista, foi possível obter vasto entendimento sobre empregabilidade de nanotecnologia farmacêutica, fisiologia do carcinoma de mama, possíveis tratamentos e efeitos adversos.
Levando em consideração a proposta de uso de nanotecnologia carreadora para melhor direcionamento quimioterápico, cresce a esperança da possibilidade de redução de riscos de efeitos adversos relacionados a cito toxicidade do Paclitaxel, consequentemente melhorando a adesão ao tratamento e promovendo conforto terapêutico ao paciente.
A abrangência da assistência farmacêutica e, consequentemente, atenção farmacêutica, possibilitando a terapêutica e aos pacientes o contato com uma nova tecnologia capaz de direcionar o medicamento as células-alvo e, por conseguinte, a redução das possibilidades de efeitos adversos relacionados à citotoxicidade às células saudáveis adjacentes.
Todavia, dos cuidados com o paciente desde a sua admissão até a alta terapêutica, é fundamental a presença do profissional farmacêutico, a fim de exercer as atividades voltadas à atenção, promovendo segurança e conforto aos pacientes diante ao uso de neoplásicos como abordado neste artigo: o Paclitaxel.
REFERÊNCIAS
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA (ANVISA). Parecer Público de Avaliação do Medicamento. Disponível em: https://consultas.anvisa.gov.br/ . Acesso em: 24 set. 2020.
SOCIEDADE AMERICANA DO CÂNCER. Fatos e números do câncer de mama. 2019-2020. Disponível em: https://www.cancer.org/content/dam/cancer-org/research . Acesso em: 18 set. 2020.
BAMBERGER, D.; HOBERNIK, D.; KONHAUSER, M.; BROS, M.; WICH, PR. Modificação de superfície de nano partículas à base de polissacarídeo com PEG e dextrano e os efeitos na ligação de células imunológicas e características estimulatórias. 2017. Disponível em: https://pubs.acs.org . Acesso em: 12 out. 2020.
BAO, L.; HAZARI, S.; MERHA, S.; KAUSHAL, D.; MOROZ, K.; DASH, S. Expressão aumentada de P-glicpproteína e quimiorresistência à doxorrubicina do câncer de mama é regulada por miR-298. Am J Pathol, v. 180, n. 6, pág. 2490-2506, 2012.
BRASTCANCER.ORG. Tipos de Câncer de Mama. 2020. Disponível em: https://www.breastcancer.org/symptoms/types . Acesso em: 18 set. 2020.
BRISTOL-MYERS SQUIBB FARMACÊUTICA LTDA. Bula do medicamento Taxol/Paclitaxel. 2016. Disponível em: https://www.bms.com . Acesso em: 18 set. 2020.
BRUNTON, L.L; HILAL-DANDAN, R.; KNOLLMANN, B.C. As bases farmacológicas da terapêutica de Goodman & Gilman. 13ª ed. Porto Alegre: AMGH, 2019. ISBN: 978-85-8055-615-5.
CASTRO, M. Z. F. Formulações lipossomais injetáveis: análise sistemática para fins regulatórios. 157f. Dissertação de mestrado. Universidade Federal de Minas Gerais, Belo Horizonte-MG, Brasil, 2015.
DANHIER, F.; FERON, O.; PRÉAT, V. Explorar o microambiente tumoral: direcionamento passivo e ativo de nanocarreadores para administração de drogas anti-câncer. Journal of Controlled Release, v. 148, n. 1, pág. 46-135, 2010.
DUNCAN, R.; GASPAR, R. Nanomedicina(s) ao microscópio. Farmacêutica Molecular, v. 8, n. 6, pág. 2101-2141, 2011.
HOLOHAN, C.; VAN SCHAEYBROECK, S.; LONGLEY, DB; JOHNSTON, PG. Resistência às drogas contra o câncer: um paradigma em evolução. Nature Reviews Câncer, v. 13, n. 10, pág. 714-726, 2013.
INSTITUTO NACIONAL DE CÂNCER (INCA). Detecção Precoce do Câncer de Mama. 2019. Disponível em: https://www.inca.gov.br/publicacoes . Acesso em: 18 set. 2020.
KANG, M. J.; PARK, S. H.; KANG, M. H.; PARK, M. J.; CHOI, Y. W. Folic acid-tethered Pep1 peptide-conjugated liposomal nanocarrier for enhanced intracellular drug delivery to cancer cells: conformational characterization and in vitro cellular uptake evaluation. International Journal of Nanomedicine, v. 8, p. 1155–1165, 2013.
LOPES, C. J.; TORRES, P. L. M. Utilização de Nanopartículas no Tratamento do Câncer: Aspectos Gerais, Mecanismos de Ação Antineoplásicos e Aplicabilidades Tumorais. 2019. Disponível em: https://rbc.inca.gov.br/revista/. Acesso em: 09 out. 2020.
MOHANTY, C.; DAS, M.; KANWAR, J. R.; SAHOO, S. K. Receptor mediated tumor targeting: an emerging approach for cancer therapy. Current Drug Delivery, v. 8, p. 45-58, 2011.
NOGUEIRA, E.; GOMES, A. C.; PRETO, A.; PAULO, A. C. Design of liposomal formulations for cell targeting. Colloids and Surfaces B: Biointerfaces, v. 136, p. 514–526, 2015.
OHVO-REKILA, H.; RAMSTEDT, B.; LEPPIMAKI, P.; SLOTTE, P. Cholesterol interactions with phospholipids in membranes. Progress in Lipid Research, v. 41, n. 1, p. 66–97, 2002.
PACE, R. C. C.; XINLI, L.; MING, S.; SHUFANG, N.; ZHANG, J.; QINGSONG, C.; WEMIN, G.; PAN, X.; ZHAOYANG, F.; WANG, S. Anticancer activities of ()-epigallocatechin-3-gallate encapsulated nanoliposomes in MCF7 breast cancer cells. Journal of Liposome Research, v. 23, n. 3, p. 187-196, 2013.
PEER, D.; KARP, J. M.; HONG, S.; FAROKHZAD, O. C.; MARGALIT, R.; LANGER, R. Nanocarriers as an emerging platform for cancer therapy. Nature Nanotechnology, v. 2, n. 12, p. 751-760, 2007.
PENG, C. Y.; ZHANG, Y. Y.; TONG, W. J.; GAO, C. Y. Influence of folate Conjugation on the Cellular Uptake Degree of Poly (allylamine hydrochloride) Microcapsules. Journal of Applied Polymer Science, v. 121, p. 3710-3716, 2011.
SIARHEYEVA, A.; LOPEZ, J. J.; GLAUBITZ, C. Localization of multidrug transporter substrates within model membranes. American Chemical Society, v. 45, n. 19, p. 6203–6211, 2006.
SILVA, M. J. S.; OSORIO-DE-CASTRO, C. G. S. Organização e práticas da assistência farmacêutica em oncologia no âmbito do Sistema Único de Saúde. Interface (Botucatu), v. 23, n. 180297, p. 1-17, 2019.
SOUZA, M. V. N. D. Novos produtos naturais capazes de atuar na estabilização de microtúbulos, um importante alvo no combate ao câncer. Química Nova, v. 27, n. 2, p. 308-312, 2004.
STENHAM, D. R.; CAMPBELL, J. D.; SANSON, M. S. P.; HIGGINS, C. F.; KER, J. D.; LINTON, K. J. Anatomic detail model for the human ATP binding cassette transporter P‐glycoprotein derived from disulphide cross‐linking and homology modeling. The FASEB Journal, v. 17, p. 2287-2289, 2003.
SWAMI, A.; SHI, J.; GADDE, S.; VOTRUBA, A.; KOLISHETTI, N.; FAROKHZAD, O. Nanoparticles for Targeted and Temporally Controlled Drug Delivery. Springer US, 2012. p. 9-29.
TOMASINA, J.; LHEUREUX, S.; GAUDUCHON, P.; RAULT, S.; MALZERT-FRÉON, A. Nanocarriers for the targeted treatment of ovarian cancers. Biomaterials, v. 34, n. 4, p. 1073-1101, 2013.
WAGNER, A.; VORAUER-UHL, K. Liposome Technology for Industrial Purposes. Journal of Drug Delivery, 2011. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3065896/. Acesso em: 07 out 2020.
WALKS, A. G.; WINER, E. P. Breast Cancer Treatment: A Review. JAMA, v. 321, n. 3, p. 288-300, 2019.
WANG, C.; ZHU, G.; YU, L.; SHI, B. Preparation, in vitro, and in vivo antitumor activity of folate receptor-targeted nanoliposomes containing oridonin. Drug Development Research, v. 74, n. 1, p. 43–49, 2013.
1Graduada em Farmácia pelo Centro Universitário Augusto Motta
Av. Paris, 84 – Bonsucesso – Rio de Janeiro – RJ, 21041-020
Email: ariane.lirah@gmail.com
2Graduada em Farmácia pelo Centro Universitário Augusto Motta
Av. Paris, 84 – Bonsucesso – Rio de Janeiro – RJ, 21041-020
biasaissee@gmail.com
3Graduada em Farmácia pelo Centro Universitário Augusto Motta
Av. Paris, 84 – Bonsucesso – Rio de Janeiro – RJ, 21041-020
Email: gabiserpaa11@gmail.com
4Graduada em Farmácia pelo Centro Universitário Augusto Motta
Av. Paris, 84 – Bonsucesso – Rio de Janeiro – RJ, 21041-020
Email: isa1borges@outlook.com
5Mestre em Ciências pela Universidade Federal Fluminense, UFF
Farmacêutico da Atenção Básica no Município do Rio de Janeiro e
Docente do curso de Farmácia do Centro Universitário
Augusto Motta, UNISUAM, Rio de Janeiro, RJ.
E-mail: darlanferreira@souunisuam.com.br
