USE OF ORAL FORMULATION OF ANGIOTENSIN-(1-7) AND PHYSICAL EXERCISE IN INFARCTED RATS
REGISTRO DOI: 10.69849/revistaft/dt10202503311927
Giancarla Aparecida Botelho Santos1
Ana Luiza Carvalho Arnhold2
Victor Ferreira da Silva3
RESUMO
As doenças cardiovasculares constituem a principal causa de morte, sendo associadas a diversos fatores, como hábitos de vida inadequados e sedentarismo. A Angiotensina-(1-7) [Ang-(1-7)] surge como um importante cardioprotetor e antifibrótico, ao antagonizar as ações da Angiotensina II (Ang II). Em ratos com falência cardíaca crônica, o treinamento aeróbio aumentou a razão Ang-(1-7)/Ang II plasmática. Assim, objetivou-se avaliar os efeitos da formulação oral de Ang-(1-7) associada ao exercício aeróbio, no remodelamento cardíaco de ratos infartados com isoproterenol. Foram utilizados ratos Wistar subdivididos nos seguintes subgrupos: grupo controle treinado, grupo infartado e treinado e grupo infartado, treinado e tratado com formulação oral de HPβCD/Ang-(1-7). Os animais treinados e tratados com formulação oral de Ang-(1-7) quando comparados com os animais apenas treinados, apresentaram menor hipertrofia cardíaca, assim como um menor escore final das alterações histológicas. Tais dados sugerem que a Ang-(1-7) associada ao exercício físico possui um importante papel cardioprotetor, ao interferir de forma positiva no remodelamento cardíaco.
Palavras-chaves: Sistema renina angiotensina. Infarto agudo do miocárdio. Exercício aeróbio.
INTRODUÇÃO
As doenças cardiovasculares constituem a principal causa de morte, tanto nos países desenvolvidos como naqueles em desenvolvimento. Segundo a American Heart Association vários fatores estão envolvidos, como maus hábitos de vida e sedentarismo. Ambos podem resultar em infarto agudo do miocárdio (IAM) ou em acidente vascular encefálico1.
O IAM caracteriza-se como uma das afecções coronarianas mais comuns. Nela, ocorre um padrão de trombose e trombólise associadas a vasoespasmo, o que causa obstrução do fluxo sanguíneo e embolização distal2 resultando, então, em morte dos cardiomiócitos3.
Após sua ocorrência inicia-se o processo de remodelação acompanhada de espessamento do músculo cardíaco com resultante diminuição do tamanho das câmaras cardíacas. Os ventrículos direito e esquerdo sofrem uma redução de seus tamanhos com consequente disfunção diastólica seguida, mais tardiamente, por disfunção sistólica4.
Como umas das causas da disfunção ventricular, que caracteriza a hipertrofia cardíaca concêntrica patológica, têm-se as alterações das proteínas contráteis, acúmulo de colágeno e deposição de matriz extracelular5. O colágeno presente no miocárdio é responsável pela interdigitação e pela transmissão da força entre os miócitos durante o processo de contração. Logo, alterações patológicas na rede de colágeno presente no coração, pode comprometer a função sistólica6.
O sistema renina angiotensina (SRA) exerce importante papel na evolução do remodelamento cardíaco. A redução da atividade do eixo clássico enzima conversora de angiotensina (ECA)/ angiotensina (Ang) II/ receptor AT1 da Ang II tem demonstrado importante ação protetora contra o desenvolvimento da hipertrofia cardíaca patológica4. A Ang II agindo em seu receptor AT1 aumenta a expressão gênica, proliferação e densidade dos fibroblastos e hipertrofia dos miócitos, todas características da remodelação após a ocorrência do IAM7.
Foi demonstrado que esse eixo clássico pode ser contrabalanceado pelo eixo ECA2/Ang-(1-7)/receptor Mas. A ECA2 é capaz de clivar a Ang II em Ang-(1-7), o qual possui efeitos vasodilatador, antitrófico e antifibrótico e exerce suas ações via receptor Mas8. Foi observado que o aumento da Ang-(1-7) no coração atenua a fibrose cardíaca induzida pelo isoproterenol em ratos transgênicos9, e o tratamento oral com formulação de Ang-(1-7), produz efeitos cardioprotetores em ratos com oclusão coronariana10. Pesquisadores observaram que Ang-(1-7) foi capaz de reduzir as alterações metabólicas induzidas pela Ang II associadas à ativação de fibroblastos cardíacos11.
Dentro deste contexto cardioprotetor, foi observado que em ratos com falência cardíaca crônica e superativação do eixo ECA/Ang II/receptor AT1, o treinamento aeróbio aumentou a razão Ang-(1-7)/Ang II plasmática, sugerindo que o exercício físico é capaz de deslocar as ações do SRA em direção ao eixo ECA2/Ang-(1-7)/receptor Mas12.
Dessa forma, considerando a possibilidade de usar a Ang-(1-7) para tratar doenças cardiovasculares, o objetivo deste estudo foi investigar a influência do tratamento oral com formulação de Ang-(1-7) em ratos infartados com isoproterenol e submetidos ao treinamento físico.
MATERIAS E MÉTODOS
Animais
Os cuidados e procedimentos animais ocorreram de acordo com as diretrizes convencionais para experimentação com animais (Instituto Nacional de publicação em Saúde). Este estudo foi aprovado pelo comitê de Ética no Uso de Animais da Universidade Federal de Lavras (protocolo nº 048/14).
Ratos machos Wistar, com 60 dias de idade, foram usados neste estudo. Os animais foram fornecidos pelo biotério de ratos da Universidade Federal de Lavras e foram mantidos em gaiolas de polipropileno (47x34x18 cm) e alimentados com ração comercial e água ad libitum. Durante os dez primeiros dias ficaram em processo de adaptação na área experimental com controle de temperatura e umidade e mantidos no ciclo claro e escuro.
Os seguintes subgrupos foram usados no protocolo: grupo controle treinado (Grupo 1; n = 5); grupo infartado e treinado (Grupo 2; n = 5) e grupo infartado, treinado e tratado com formulação oral de HPβCD/Ang-(1-7) (Grupo 3; n = 5).
Medidas e procedimentos
Eletrocardiograma
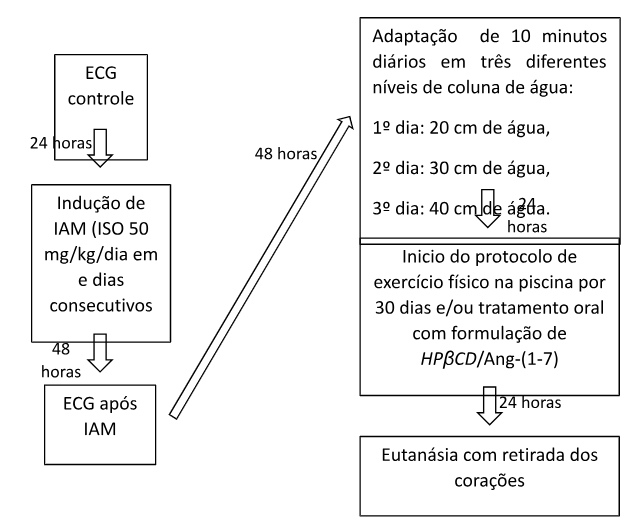
Foi realizado exame eletrocardiográfico de todos os animais para verificação da atividade elétrica cardíaca (eletrocardiograma controle). Após 24 horas, induziu-se infarto nos animais que fariam parte dos grupos 2 e 3, ou seja submetidos ao uso do isoproterenol. Nesses animais, o eletrocardiograma (ECG) foi repetido 48 horas após a finalização da indução para avaliação da presença de lesão miocárdica. Os animais supostamente infartados mas que não demonstraram lesão miocárdica no segundo ECG, foram descartados do experimento.
O eletrocardiograma foi realizado pelo método convencional monocanal (ECG 6 Ecafix). Para isso, os animais foram sedados com Thiopentax na dose de 40 mg/kg pela via intraperitoneal e posicionados em decúbito dorsal. Os eletrodos do tipo jacaré foram posicionados imediatamente proximal ao olécrano no aspecto caudal dos membros torácicos e ao longo do ligamento patelar no aspecto cranial dos membros pélvicos (figura 1). As derivações I, II, III, aVR, aVL e aVF foram registradas e examinadas por observador experiente.
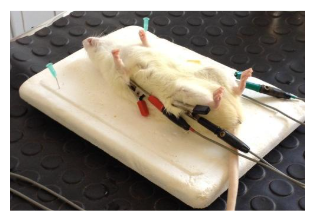
Tratamento com Cloridrato de Isoproterenol
A disfunção cardíaca, ou seja, o infarto, foi induzida nos grupos 2 e 3 pela administração subcutânea de cloridrato de isoproterenol (ISO), numa dose de 80 mg/kg/dia diluída em 2 ml de solução salina, durante dois dias consecutivos, com intervalo de 24 horas entre as aplicações (adaptado de Lobo-Filho et al., 2011)13. O falso infarto (grupo controle) seguiu o mesmo protocolo, porém com administração subcutânea de 2 ml de solução salina. O ISO foi obtido da empresa Sigma e as doses aplicadas foram calculadas conforme o peso dos animais.
Tratamento com composto de HPβCD/Angiotensina-(1-7)
O tratamento com HPβCD/Ang-(1-7) (76 μg/kg por dia em água destilada via gavagem) iniciou no quinto dia após a indução do infarto, e foi mantido por um período de 30 dias, período equivalente ao tempo de treinamento físico na piscina. O volume final diário da gavagem (HPβCD/Ang-(1-7)) foi de aproximadamente 0,5 mL. O composto HPβCD/Ang-(1-7) foi gentilmente cedido pelo Laboratório de Hipertensão da Universidade Federal de Minas Gerais.
Protocolo de treinamento na piscina
A atividade física com natação foi realizada em ambiente com temperatura controlada a 30º C, usando uma piscina com 90 cm de comprimento e 70 cm de altura. No entanto, antes de iniciar o protocolo de treinamento físico, todos os animais passaram por uma adaptação 48 horas após a realização do segundo exame eletrocardiográfico, que consistiu em um treinamento com duração de 10 minutos em três diferentes níveis de coluna de água: 20 cm de água no primeiro dia, 30 cm no segundo dia e 40 cm no último dia (Cosmo et al., 2012). Após a adaptação, deu-se início ao treinamento físico, que ocorreu durante 30 dias, 5 vezes semanais e sem carga adicional. Na primeira semana, o treinamento teve duração de 20 minutos, com acréscimo de 5 minutos a cada semana treinada. O protocolo de treinamento foi elaborado conforme trabalho de Gomes Filho et al., 200814.
Coleta do coração
Ao término do treinamento físico na piscina e/ou tratamento com HPβCD/Ang-(1-7), os animais receberam anestesia de Thiopentax na dose de 40 mg/kg pela via intraperitoneal. Após eutanásia, tiveram seus corações retirados inteiros após perfusão com cloreto de potássio na concentração de 16 mEq/l.
As amostras teciduais foram fixadas em formalina-PBS a 10% por pelo menos 24h e processadas pelos métodos de rotina. Cortes medindo 5 µm foram corados com Hematoxilina-Eosina (HE). As lâminas foram examinadas as cegas por uma patologista veterinária, sendo utilizados critérios macroscópicos e histológicos pré-estabelecidos para o diagnóstico das lesões cardíacas prováveis, bem como foram levadas em consideração quaisquer tipos de lesões observadas macro e microscopicamente no tecido cardíaco. O protocolo experimental feito nos animais encontra-se resumido na figura 2.
Análise Histológica dos Corações
A descrição e avaliação das alterações histopatológicas foram baseadas nas adaptações feitas por Fontanetti et al. (2014)15 do protocolo padronizado por Bernet et al. (1999). A gravidade e a extensão do infarto foram observadas para cada caso. O patologista não sabia a qual grupo correspondia cada lâmina avaliada. A avaliação incluiu a inspeção de ventrículos, pericárdio, endocárdio e artérias coronárias. Para a análise das alterações histopatológicas observadas, foram atribuídos fatores de importância (w) para cada lesão observada de acordo com sua importância patológica, ou seja, de acordo com o grau de impacto no funcionamento do órgão do animal. As alterações foram classificadas seguindo os seguintes fatores de importância: (1) lesões de importância patológica mínima, facilmente reversíveis ao tirar-se a exposição ao agente estressor (degeneração); (2) lesões de importância patológica moderada, podendo ser reversíveis se o agente estressor for neutralizado (infiltrado inflamatório); (3) lesões de importância patológica grave, geralmente irreversíveis e podem levar à perda parcial ou total da funcionalidade do órgão (necrose e fibrose). As alterações patológicas também foram classificadas de acordo com a metodologia adaptada de Khorrami et al. (2014)16. Desta forma, de acordo com o grau/extensão das alterações (a) foram atribuídos valores arbitrários correspondentes à porcentagem da área total analisada, sendo: (0) – normal/lesão ausente; (2) – lesões presentes em 1-5% da área total analisada; (4) – 6-10%; (6) – 11-30%; (8) – > 30%. Por fim, calculou-se o escore final das alterações de cada animal através da multiplicação do fator de importância (w) pelo grau/extensão das alterações (a), de acordo com a seguinte fórmula: Escorefinal/indivíduo= ∑(w x a).
A padronização desse método de avaliação permitiu uma análise semi quantitativa das alterações histopatológicas do coração dos animais, abrangendo variáveis como a extensão das lesões e o grau de importância patológica das lesões.
Análise Morfométrica dos Corações
Para a avaliação das áreas celulares e nucleares dos cardiomiócitos foram obtidas em torno de 20 fotomicrografias de cada coração. Posteriormente, as fotomicrografias foram analisadas através do software ImageJ versão 1.51 (Research Services Branch, U.S. National Institutes of Health, Bethesda, MD, USA.), em cortes longitudinais em que foram medidos os volumes nucleares através do maior e do menor diâmetro de 50 núcleos por rato, sendo os valores aplicados na seguinte fórmula: v = a².b/1,91 onde a = menor diâmetro, b = maior diâmetro e 1,91 é uma constante. É importante ressaltar que núcleos próximos às áreas necrosadas e com fibrose foram excluídas das análises, para obter-se um resultado mais fidedigno. Conforme os resultados dos 50 núcleos eram obtidos e seus valores aplicados na fórmula supracitada, era feito a média do volume dos núcleos e organizados em uma planilha separada para cada grupo, em que foi possível analisar-se o volume geral dos núcleos de cada grupo e compará-los.
Análise estatística
A partir dos escores individuais, as médias e desvio padrão foram calculados para cada grupo (controle e tratados) e o teste de Mann-Whitney para comparação de médias, que foram estatisticamente analisados utilizando-se o teste de Kruskal-Wallis e, como pós-teste, o teste de Comparações Múltiplas de Dunn, com o objetivo de comparar os resultados e diferenças estatísticas entre todos os três grupos.
RESULTADOS
Procedimentos e mortalidade
10 ratos Wistar machos infartados (de 40 animais) e 5 controles, com peso médio de 323±10,43g, fizeram parte do estudo. Os animais que sofreram a injeção subcutânea de isoproterenol na dose de 120 mg/kg/dia por dois dias consecutivos (25 ratos), conforme protocolo de Lobo-Filho et al. (2011) tiveram taxa de mortalidade de 100% após a injeção da segunda dose. Baseado nisto, a dose foi reduzida para 80 mg/kg/dia. Nesta dose, a taxa de mortalidade reduziu para 20% e foi suficiente para promover alterações eletrocardiográficas indicativas de infarto (figura 3b).
Traçados Eletrocardiográficos (ECG)
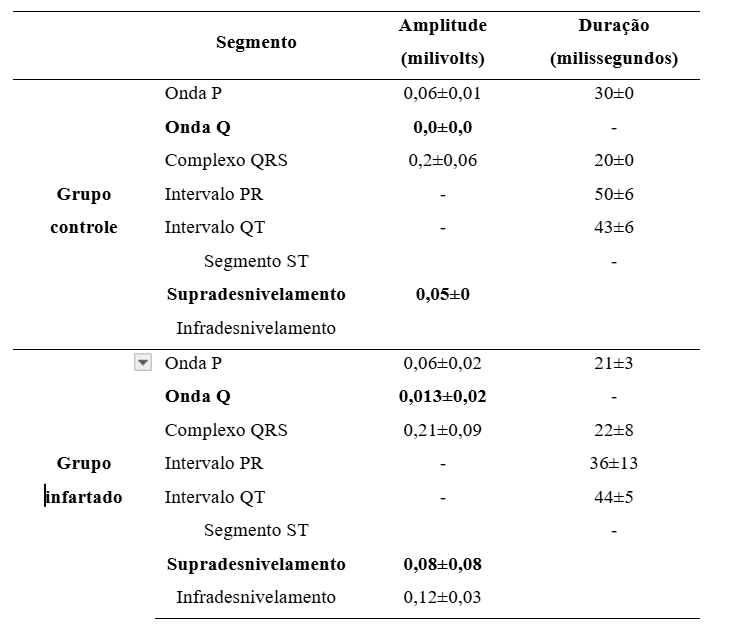
A lesão miocárdica foi confirmada pelos traçados eletrocardiográficos, que demonstraram marcante onda Q ou supradesnivelamento do segmento ST (figura 3; tabela 1).
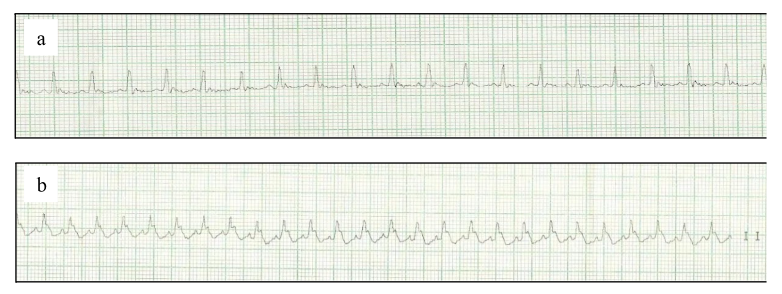
Tabela 1. Segmentos dos traçados eletrocardiográficos de ratos controle (n=5) e infartados (n=10).
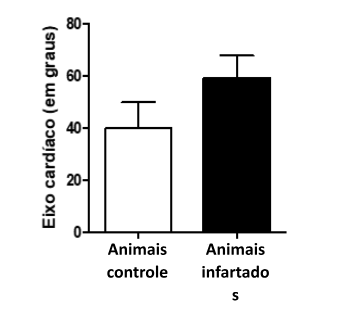
Ao comparar a frequência cardíaca dos animais controle com os infartados tratados ou não com a HPβCD/Ang-(1-7), não foi observado diferença significativa estatística (446 ± 68 bpm versus 468 ± 48,7 bpm; p > 0,05 no teste de Mann-Whitney). Resultado similar foi encontrado com relação ao eixo cardíaco. No entanto, observou-se que nos animais infartados (50,6º±38,05), esse eixo cardíaco tendeu a ser superior ao dos animais controle (40º±17), indicando áreas de necrose tecidual compatível com o infarto (figura 4).
Avaliação da histologia cardíaca
Na avaliação da histologia cardíaca foram constatadas lesões de miocitólise caracterizados por aumento de eosinofilia, perda de estriação nos cardiomiócitos, aspectos degenerativos hialinos e/ou de necrose flocular, muitos destes acompanhados por vacuolização/tumefação intracelular. Núcleos picnóticos eram frequentemente observados e, em algumas células, esteve ausente. Estas observações foram vistas em maior ou menor grau e frequência em todas as regiões cardíacas analisadas. No entanto, constatou-se que as que apresentavam gravidade mais elevada eram mais frequentes no endocárdio.
Fibroplasia caracterizada por formação de feixes colagenosos entre os cardiomiócitos foram observados em graus distintos quanto à localização e à quantidade. Localizados em pontos distintos do tecido cardíaco, quanto mais lesões dessa natureza nas camadas endocárdicas, miocárdicas e epicárdicas eram observadas, maior sua interferência na arquitetura original do órgão.
Infiltrado inflamatório predominantemente mononuclear foi verificado, sobretudo, associado às zonas de fibrose ou às regiões perivasculares, sendo constituído prevalentemente por linfócitos, em médio grau por mastócitos e em menor número por plasmócitos e macrófagos. Neutrófilos foram esporadicamente vistos, e eosinófilos não foram observados.
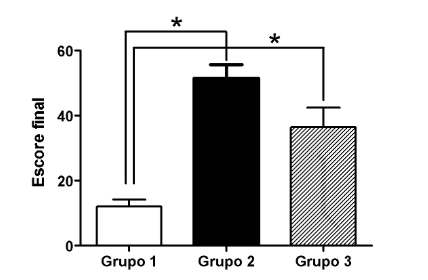
O escore final calculado para cada grupo de ratos a partir da análise das alterações histopatológicas cardíacas considerando o fator de importância (w) para cada lesão observada e o grau/extensão das alterações (a) (tabela 3), foi significativamente menor nos animais do grupo 1 (12±2,19) quando comparado aos escores dos animais dos grupos 2 (51,50±4,11) e 3 (36,40±6,01) sugerindo, dessa forma, a presença de processo inflamatório, degeneração miofibrilar, necrose e fibrose decorrentes do infarto. Não houve diferença significativa entre os escores dos ratos pertencentes aos grupos 2 e 3, embora o escore final do grupo 3 tendeu a ser menor (figura 5).
Tabela 3. Alterações histopatológicas dos corações de ratos não infartados (Grupo 1; n=5), infartados e submetidos ao treinamento físico (Grupo 2; n=5) e infartados, treinados e tratados com HPβCD/Ang-(1-7) (Grupo 3; n=5).
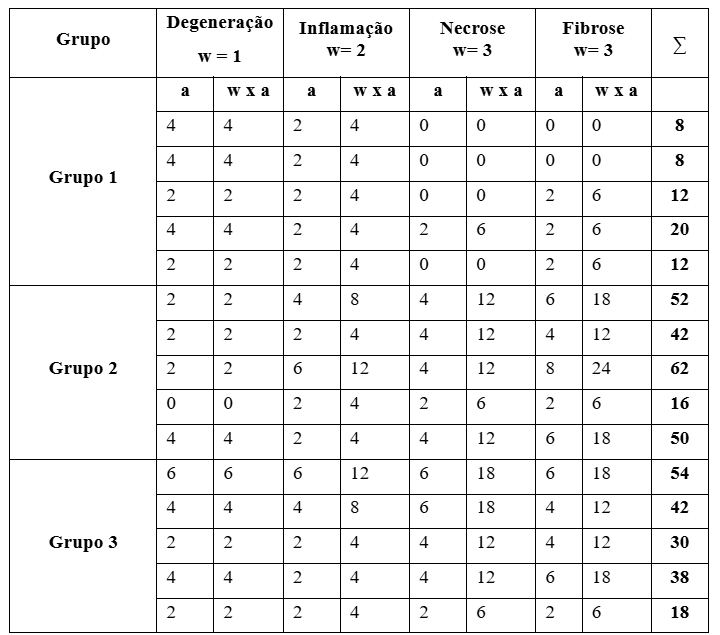
(w) fatores de importância: (1) lesões de importância patológica mínimas facilmente reversíveis ao tirar-se a exposição ao agente estressor (degeneração); (2) lesões de importância patológica moderada, podendo ser reversíveis se o agente estressor for neutralizado (infiltrado inflamatório); (3) lesões de importância patológica grave, geralmente irreversíveis e podem levar à perda parcial ou total da funcionalidade do órgão (necrose e fibrose). (a) Grau/extensão das alterações: (0) – normal/lesão ausente; (2) – lesões presentes em 1-5% da área total analisada; (4) – 6-10%; (6) – 11-30%; (8) – > 30%. ∑(w x a) Escore final /indivíduo.
Morfologia cardíaca
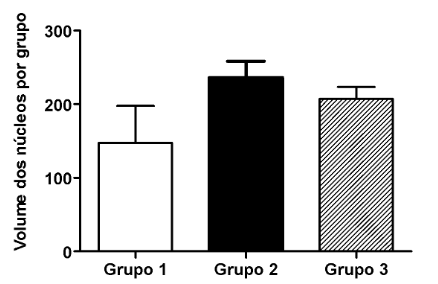
Com relação à morfometria cardíaca, observa-se que os animais do grupo 2 apresentaram maior diâmetro dos cardiomiócitos quando comparado aos animais dos grupos 1 e 3, embora essa diferença não tenha alcançado significância estatística. O tratamento com Ang-(1-7) (grupo 3) tendeu a reduzir o volume dos núcleos cardíacos quando comparado aos animais do grupo 2 (figura 6), demonstrando seu efeito anti-hipertrófico.
DISCUSSÃO
O coração é um órgão que mediante eventos isquêmicos apresenta capacidade regenerativa mínima, com consequente redução de sua capacidade contrátil17 e desenvolvimento de tecido cicatricial predominantemente fibroproliferativo18. Em decorrência de um infarto do miocárdio ocorre necrose dos cardiomiócitos, resposta inflamatória local com extensa liberação de citocinas pró-inflamatórias, degradação da matriz extracelular e deposição de tecido cicatricial rico em fibras colágenas. A deposição de colágeno, por sua vez, promove o remodelamento cardíaco, o qual resulta em dilatação das câmaras cardíacas, hipertrofia, perda da funcionalidade e redução no débito cardíaco, que virá acompanhado de perfusão periférica insuficiente. Para compensar tais perdas, as atividades do sistema nervoso simpático e do sistema renina-angiotensina aumentam19.
O isoproterenol, ao promover uma maior demanda de consumo de oxigênio por parte dos cardiomiócitos, é capaz de causar lesões anatômicas semelhantes ao do infarto agudo do miocárdio20. Assim, é um modelo que vem sendo amplamente utilizado para indução de IAM. Conforme estudos de LOBO-FILHO13, a dose de 120 mg/kg/dia em dois dias consecutivos, é suficiente para induzir mudanças significativas na histologia cardíaca com baixa taxa de mortalidade (25%). No entanto, no presente estudo utilizou-se doses menores de isoproterenol, tendo em vista a taxa de mortalidade de 100% com esta dose. Com isso, buscou-se uma dose suficiente para desencadear alterações patológicas na anatomia do músculo cardíaco. As alterações observadas no eletrocardiograma, com a dose de 80 mg/kg/dia, foram onda Q pronunciada ou supradesnivelamento do segmento ST implicando, respectivamente, em presença de área miocárdica eletricamente inativa (infartada) ou repolarização lenta dos ventrículos21.
Para corroborar com os dados eletrocardiográficos, utilizou-se também a análise do eixo elétrico cardíaco, que também pode ser indicativo de infarto do miocárdio, já que sua posição representa a direção da despolarização ventricular. Normalmente, o vetor médio que retrata a despolarização se dirige para baixo e para a esquerda no plano frontal e seu valor varia entre 0 a +90º, com o valor aproximado de +40º sendo o mais usual. No infarto do miocárdio ocorre morte do tecido cardíaco, com consequente ausência de atividade elétrica e desvio do eixo para o lado oposto ao da lesão22. No presente trabalho, observou-se que o eixo cardíaco dos ratos infartados estava direcionado para a direita em relação aos ratos controle, indicando a presença de áreas de necrose na parede ventricular direita.
Com relação a frequência cardíaca esperava-se encontrar valores maiores nos animais infartados comparados aos controles, porém, esta foi similar entre os grupos. Em corações infartados ocorre aumento do tônus simpático para contrabalancear os prejuízos na perfusão periférica tecidual e redução na fração de ejeção19. Contudo, a FC pode ter sofrido influência do exercício físico. Este pode levar a uma melhora da capacidade cardiovascular ao promover hipertrofia excêntrica dos cardiomiócitos, dilatação e aumento da massa ventricular, espessamento das paredes dos ventrículos e aumento do diâmetro das cavidades, além de resultar em frequências cardíacas submáxima e de repouso mais baixas23. Porém, exames ecocardiográficos seriam necessários para avaliar essas variáveis e diferenciar o tipo de hipertrofia cardíaca desenvolvida.
Na análise histológica observou-se lesões necróticas focais determinadas por edema intracelular e intercelular. A resposta inflamatória distribuiu-se conforme as lesões necróticas e foi composta principalmente de leucócitos mononucleares. O processo fibrótico foi caracterizado pela deposição de colágeno. Tais alterações foram mais pronunciadas nos ratos do grupo 2, onde o escore final foi mais alto, demonstrando assim as alterações histológicas induzidas pelo isoproterenol. Em ratos infartados com isoproterenol observou-se maior deposição de colágeno tipo III no esqueleto cardíaco, resultando em prejuízos na capacidade de contração do órgão24. Porém, no presente trabalho não foram avaliados a configuração arquitetônica das fibras de colágeno e os subtipos de colágeno, mas a fração da área de colágeno, o que já evidenciou que a injeção de isoproterenol causou influxo mononuclear agudo, com essa atividade inflamatória dando lugar a um processo fibroproliferativo.
No grupo 3 o escore final das alterações histológicas foi menor que o do grupo 2, demonstrando o efeito positivo da Ang-(1-7) sobre o remodelamento cardíaco. Vários estudos têm demonstrado que a Ang-(1-7) é um importante peptídeo envolvido na regulação da pressão sanguínea25, função cardíaca26, remodelamento cardíaco27 e crescimento celular28, sugerindo um potencial alvo terapêutico para tratar diversas doenças cardiovasculares. A infusão de Ang-(1-7) ou administração oral de seu análogo não peptídico AVE 0991, protege o coração contra lesões induzidas pelo infarto29. Os mesmos autores demonstraram que a administração oral do composto HPβCD/Ang-(1-7) inibiu completamente a vasoconstrição vista em corações infartados29. Outros estudos demonstraram os efeitos antitrófico e antifibrótico da Ang-(1-7) em células cardíacas10, 30, 31.
Os animais do grupo 3 também apresentaram menor hipertrofia cardíaca. A análise do diâmetro dos cardiomiócitos revelou que o tratamento com o HPβCD/Ang-(1-7) reduziu o efeito hipertrófico induzido pelo isoproterenol, corroborando com os achados de Marques et al.10. Os autores observaram que o tratamento com HPβCD/Ang-(1-7) amenizou a hipertrofia cardíaca em ratos infartados com isoproterenol.
CONSIDERAÇÕES FINAIS
Este estudo sugere o papel cardioprotetor da Ang-(1-7) associada ao exercício físico aeróbico em animais infartados. Estudos pré clínicos tem demonstrado forte evidência que a Ang-(1-7) efetivamente previne o remodelamento cardíaco, sugerindo ser uma importante estratégia terapêutica.
REFERENCIAL BIBLIOGRÁFICO
- Passinho RS, Sipolatti WGR, Fioresi M et al. SINAIS, SINTOMAS E COMPLICAÇÕES DO INFARTO AGUDO DO MIOCÁRDIO. Rev enferm UFPE on line., Recife, 12(1):247-64, jan., 2018.
- Pesaro AEP, Serrano Jr. CV, Nicolau JC. Iinfarto agudo do miocárdio – síndrome coronariana aguda com supradesnível do segmento ST. Rev Assoc Med Bras 2004; 50(2): 214-20
- Siervuli MTF, Silva AS, Silva AC, Muzzi RAL, Santos GAB. Infarto do Miocárdio: Alterações Morfológicas e Breve Abordagem da Influência do Exercício Físico. Rev Bras Cardiol. 2014;27(5):349-355.
- Guimarães GG, Santos SHS, Oliveira ML, Pimenta-Velloso EP, Motta DF, Martins AS, Alenina N, Bader M, Santos RAS, Campagnole-Santos MJ. Exercise induces renin-angiotensin system unbalance and high collagen expression. In the heart of Mas-deficient mice. Peptides 2012; 38: 54-61.
- Zornoff LAM, Paiva SAR, Duarte DR, Spadaro J. Remodelação Ventricular Pós-Infarto do Miocárdio: Conceitos e Implicações Clínicas. Arq Bras Cardiol 2009;92(2):157-164.
- Locatelli J, Assis LVM, Araújo CM, Alzamora AC, Lima WG, Campagnole-Santos MJ, Santos RA, Isoldi MC. Swimming training promotes cardiac remodeling and alters the expression. Of mRNA and protein levels involved in calcium handling in hypetensive rats. Life Sciences 2014; 117: 67-74.
- Diez J. Profibrotic effects of angiotensin II in the heart: a matter of mediators. Hypertension. 2004; 43: 1164-5.
- Dias-Peixoto MF, Santos RA, Gomes ER, Alves MN, Almeida PW, Greco L, et al. Molecular mechanisms involved in the angiotensin-(1-7)/Mas signaling pathway in cardiomyocytes. Hypertension 2008; 52: 542-8.
- Ferreira AJ, Castro CH, Guatimosim S, Almeida PW, Gomes ER, Dias-Peixoto MF et al. Attenuation of isoproterenol-induced cardiac fibrosis in transgenic rats harboring na angiotensin-(1-7)-producing fusion protein in the heart. Ther Adv Cardiovasc Dis 2010; 4: 83-96.
- Marques FD, Ferreira AJ, Sinisterr RD, Jacoby BA, Sousa FB, Caliari MV et al. An oral formulation of angiotensin-(1-7) produces cardioprotective affects in infarcted and isoproterenol-treated rats. Hypertension 2011; 57: 477-83.
- Zhang F, Tang H, Sol S, Luo Y, Ren X, Chen A, Xu y, Li P, Han Y. Relaxamento vascular induzido por angiotensina(1-7) em ratos espontaneamente hipertensos Óxido nítrico Volume 88, 1º de julho de 2019, páginas 1-9
- Frantz EDC, Prodel E, Braz ID, Giori IG, Bargut TCL, Magliano DAC, Nobrega ACL. Modulation of the renin–angiotensin system in white adipose tissue and skeletal muscle: focus on exercise training. Clinical Science (2018) 132 1487–1507.
- Lobo Filho HD, Ferreira NL, Sousa RB, Carvalho ER, Lobo PLD, Lobo Filho JG. Modelo experimental de infarto do miocárdio induzido por isoproterenol em ratos. Rev Bras Cir Cardiovasc 2011;26(3):469-76.
- Gomes-Filho A, Ferreira AJ, Santos SHS, Neves SRS, Camargos ERS, Becker LK, Belchior HA, Dias-Peixoto MF, Pinheiro SVB, Santos RAS. Selective increase of angiotensin(1–7) and its receptor in hearts of spontaneously hypertensive rats subjected to physical training. Exp Physiol 93.5 pp 589–598, 2008.
- Fontanetti et al. Sugar cane vinasse in water bodies: Impact assessed by liver histopathology in tilapia. Ecotoxicology and Environmental Safety, 110, 239-245. Elsevier Inc, September, 2014.
- Khorrami et al. Tacrolimus ameliorates functional disturbances and oxidative stress in isoproterenol-induced myocardial infarction. DARU Journal of Pharmaceutical Sciences, 22:68, 2014.
- Marcin Bujak M and Frangogiannis NG. The role of TGF-β Signaling in Myocardial Infarction and Cardiac Remodeling. Cardiovasc Res. 2007 May 1; 74(2): 184–195.
- Zimbro Morales, J. (2017). Efecto de la pirfenidona sobre los mecanismos de regulación del Caᶧᶧ citosólico del fibroblasto cardiaco en un modelo de fibrosis “ in vitro”. Benemérita Universidad Autónoma de Puebla https://hdl.handle.net/20.500.12371/626
- Mill JG, Vassalli DV. Hipertrofia cardíaca. Rev Bras Hipertens 8: 63-75, 2001.
- Prince PS, Dhanasekar K, Rajakumar S. Preventive effects of vanillic acid on lipids, bax, bcl-2 and myocardial infarct size on isoproterenol-induced myocardial infarcted rats: a biochemical and in vitro study. Cardiovasc Toxicol. 2011;11(1):58-66.
- Mansur PHG, Cury LKP, Destro-Filho JB, Resende ES, Destro JPB, Oliveira LM, de Moraes DCG, de Freitas GRR, Rocha LSS. Análise de registros eletrocardiográficos associados ao infarto agudo do miocárdio. Arq. Bras. Cardiol. vol.87 no.2 São Paulo Aug. 2006
- Gehrmann J, Frantz F, Maguire CT, Vargas M, Ducharme A, Wakimoto H, Lee RT, Berul CL. Electrophysiological characterization of murine myocardial ischemia and infarction. Basic Res Cardiol 96: 237 – 250 (2001).
- Barry SP, Davidson SM, Townsend PA. Molecular regulation of cardiac hypertrophy. Int J Biochem Cell Biol 2008; 40 (10): 2023-39.
- Portes AMO, Costa SFF, Leite LB, Miranda DC, Moura AG, Soares LL, Isoldi VNMC,2 Antônio José Natali. O Treinamento Resistido Atenua a Remodelação Cardíaca Induzida por uma Dieta Hiperlipídica em Roedores: Uma Revisão Sistemática. Arq Bras Cardiol. 2024; 121(4):e20230490.
- Santiago NM, Guimarães PS, Sirvente RA, Oliveira LA, Irigoyen MC, Santos RA, Campagnole-Santos MJ. Lifetime overproduction of circulating Angiotensin-(1-7) attenuates deoxycorticosterone acetate-salt hypertension-induced cardiac dysfunction and remodeling. Hypertension. 2010;55:889–896. doi: 10.1161/HYPERTENSIONAHA.110.149815.
- Botelho-Santos GA, Bader M, Alenina N, Santos RAS. Altered regional blood flow distribution in Mas-deficient mice. Therapeutic Advances in Cardiovascular DiseaseVolume 6, Issue 5, October 2012, Pages 201-211
- Wysocki J, Wilsbacher L, Batlle D. Angiotensins and the heart: is ang 1-7 cardioprotective? Published in final edited form as: Hypertension. 2015 August ; 66(2): 260–262. doi:10.1161/HYPERTENSIONAHA.115.05093.
- Simões ACS, Silveira KD, Ferreira AJ, Teixeira MM. ACE2, angiotensin-(1-7) and Mas receptor axis in inflammation and fibrosis. British Journal of Pharmacology (2013)169477–492.
- Santos RAS, Ferreira AJ, Verano-Braga T, Bader M. Angiotensin-converting enzyme 2, angiotensin-(1–7) and Mas: new players of the renin–angiotensin system. Journal of Endocrinology (2013) 216, R1–R17
- Santos RA, Ferreira AJ, Nadu AP, Braga AN, de Almeida AP, Campagnole-Santos MJ, Baltatu O, Iliescu R, Reudelhuber TL, Bader M. Expression of an angiotensin-(1-7)-producing fusion protein produces cardioprotective effects in rats. Physiological genomics. 2004; 17:292–299. [PubMed: 15039487]
- Almeida PWM, Melo MB, Lima RF, Gavioli M, Santiago NM, Greco L, Jesus ICG, Nocchi E, Parreira A, Alves MNM, Mitraud L, Resende RR, Campagnole-Santos MJ, Santos RAS, Guatimosim S. Beneficial Effects of Angiotensin-(1–7) Against Deoxycorticosterone Acetate–Induced Diastolic Dysfunction Occur Independently of Changes in Blood Pressure. HypertensionVolume 66, Issue 2, August 2015; Pages 389-395.
1Docente do Curso de Medicina da Universidade Federal de Lavras. Doutora em Fisiologia e Farmacologia (ICB/UFMG). e-mail: giancarla@ufla.br – ORCID: 000-0002-6017-5086
2Mestre em Educação (UFLA). e-mail: anacarnhold97@gmail.com – ORCID: 0000-0002-2984-4886
3Doutor em Estatística e Experimentação Agropecuária (UFLA). e-mail: victor.est.ufop@gmail.com
ORCID: 0000-0003-1452-6831
