USE OF STEM CELLS IN THE TREATMENT OF NEUROPATHIC PAIN DUE TO SPINAL CORD INJURY
REGISTRO DOI: 10.69849/revistaft/ra10202504301154
Karol Dal Pupo Giordani1
Lucca Cronemberger Nogueira Lages Rebêlo2
Jacqueline Lima Monteiro de Carvalho3
Gustavo Cardoso da Silva Neves4
Resumo
INTRODUÇÃO: A dor neuropática (DN) é uma condição crônica causada por lesões no sistema nervoso, frequentemente associada à lesão medular (LM). Atinge até 10% da população e afeta 80% dos pacientes com LM, reduzindo significativamente a qualidade de vida. Os tratamentos convencionais são limitados e com efeitos adversos. As terapias com células-tronco (CTs) surgem como alternativa promissora, promovendo regeneração neural e alívio da dor, sendo uma opção eficaz para casos refratários de DN. OBJETIVOS: Produzir uma revisão sistemática sobre o uso das CTs no tratamento de DN por LM para destacar os benefícios dessa terapêutica visando a melhora da qualidade de vida nos pacientes afetados. METODOLOGIA: Foi realizada revisão sistemática nas bases de dados: PubMed, Periódicos Capes, Scielo utilizando os descritores DECS/MESH e operador booleano AND para estratégia de busca. Foram incluídos 04 estudos que investigavam a aplicabilidade das CTs no tratamento da DN em LM. DISCUSSÃO: As Células-Tronco Mesenquimais (MSCs) surgem como alternativa promissora, com efeitos anti-inflamatórios, neuroprotetores e moduladores da dor. Estudos recentes demonstraram que a administração de MSCs, isoladas ou combinadas com células de Schwann, pode reduzir significativamente a DN e promover neuroregeneração. Além disso, a segurança e tolerabilidade dessas terapias foram confirmadas, mesmo em casos crónicos. No entanto, ainda são necessários estudos mais amplos e padronizados para validar sua eficácia clínica a longo prazo. CONCLUSÃO: A DN por LM é um desafio clínico significativo, com impacto severo na qualidade de vida dos pacientes. As terapias celulares, especialmente com MSCs, destacam-se como alternativas promissoras, devido às suas propriedades imunomodulatórias, anti-inflamatórias e neuroregenerativas. Estudos indicam melhora na dor e recuperação funcional, sobretudo quando associadas a células de Schwann, potencializando os efeitos terapêuticos. Assim, o transplante de CTs oferece uma abordagem inovadora e eficaz para o tratamento da DN, com foco na restauração neurológica e no bem-estar dos pacientes.
Palavras-chave: Células-tronco. Dor neuropática. Lesão medular.
1 INTRODUÇÃO
A dor neuropática (DN) é uma doença progressiva do sistema nervoso, que ocorre em associação com uma lesão primária ou disfunção do Sistema Nervoso Somatossensorial (SNS). Essa doença neurovegetativa apresenta fisiopatologia ainda pouco estudada que desencadeia mecanismos inflamatórios e imunes, ocasionando dor crônica de aspecto amplo, podendo variar de sensação de formigamento, queimação ou até mesmo hipersensibilidade (Ford et al., 2020; Xavier Filho et al., 2022).
Estudos recentes apontam que a DN afeta em média 7% a 10% da população mundial, atingindo as vias aferentes somatossensoriais do Sistema Nervoso Central (SNC) e/ou Sistema Nervoso Periférico (SNP), culminando na redução da inibição central na medula espinhal (Fiusa; Knaut; Carraro, 2023). A DN periférica crônica é causada por alterações patológicas ou doenças do SNS periférico, que inclui principalmente neuralgia do trigêmeo, lesão do nervo periférico, polineuropatia dolorosa e neuralgia pós-herpética. Enquanto a DN central crônica é causada por danos ou doenças do SNS central, associada a lesão da medula espinhal, lesão cerebral, pós-AVC e por múltiplas escleroses (Liu et al., 2020).
A Lesão Medular (LM) causa dano axonal e desmielinização, morte de células neurais e perda abrangente de tecido, resultando em disfunção neurológica devastadora (FORD et al., 2020). Os sintomas clínicos da LM incluem DN, déficits motores, e comprometimento das funções sensoriais e autonômicas. Em casos mais graves, pode resultar em paralisia e incapacidade permanente (Yin et al., 2024). Como um dos problemas clínicos mais comuns e complexos associados à LM, a DN afeta aproximadamente 75 a 80% dos pacientes com LM e tem um efeito substancial na qualidade de vida dos pacientes (Cheng et al., 2022).
Nesse contexto, devido a heterogeneicidade das causas da DN existem dificuldades relacionadas ao diagnóstico e o tratamento continua desafiador por ter baixa eficiência, produzir efeitos colaterais indesejáveis e/ou dependência a longo prazo (Yoo et al., 2020). O tratamento médico da DN utiliza atualmente estratégias de manejo inespecíficas, como antiepilépticos, antidepressivos e, em alguns casos, opioides (Ford et al., 2020; Oliveira et al., 2020).
As terapias com Células-Tronco (CTs) avançaram clinicamente no tratamento de tecidos danificados e diversas doenças degenerativas, especialmente aquelas que afetam o sistema nervoso (Bryk et al., 2022). As doenças neurodegenerativas como DN são frequentemente caracterizadas por comprometimento funcional irreversível e/ou perda de células e regeneração limitada do sistema nervoso adulto. A substituição celular, portanto, representa uma estratégia crítica para o tratamento eficaz de doenças neurodegenerativas como DN por LM (Ford et al., 2020).
As CTs são células imaturas capazes de auto-renovação e diferenciação em tipos de células funcionais. Os critérios fundamentais da classificação envolvem sua origem (derivada de tecido embrionário ou adulto) e potência de diferenciação, que indica as linhagens potenciais para as quais uma determinada célula pode amadurecer. Os tipos de CTs mais extensivamente estudados incluem CTs estromais mesenquimais, induzidas CTs pluripotentes e CTs embrionárias. Estas células diferem principalmente no potencial de diferenciação, atividade parácrina e segurança biológica, o que afeta a sua aplicabilidade na medicina regenerativa (De Abreu Rodrigues; Carvalho, 2022).
A DN é frequentemente refratária às estratégias terapêuticas disponíveis e há poucas opções de tratamento baseado em evidência científica. Diante da limitação dos tratamentos DN por LM, se faz necessária uma intervenção mais eficiente, já que a LM causa danos às células nervosas. Diante disso, o transplante de CTs são uma opção de tratamento para redução da DN pois fornece benefícios terapêuticos para o reparo neural na LM, principalmente por já serem utilizadas de forma eficaz para os tratamentos de doenças degenerativas. Os recentes estudos demonstraram melhora do quadro de DN por LM, pois as CTs além de executarem regeneração das células nervosas, foram úteis para reduzir os marcadores de DN em animais e proporcionar melhora do quadro sindrômico (Opretzka, Evangelista; Villarreal, 2023).
A capacidade de regeneração celular é explorada em diversas áreas da medicina nos tratamentos de várias doenças por representar avanço das terapias que envolvem recuperação de tecidos lesionados. Assim, as CTs são aliadas para corrigir a injúria tecidual que evolui com DN em pacientes com LM, já que a DN é uma manifestação sindrômica que afeta diretamente a qualidade da recuperação dos afetados e o desconhecimento desse procedimento significaria decaimento no serviço médico em respeito ao bem-estar do paciente. Diante do exposto, o presente artigo tem como objetivo realizar uma revisão sistemática sobre o uso das CTs no tratamento de DN por LM para destacar os benefícios dessa terapêutica visando a melhora da qualidade de vida nos pacientes afetados.
2 METODOLOGIA
Trata-se de um estudo em artigos selecionados sob consulta, por meio de busca eletrônica, desenvolvido em produção científica nas bases de dados SciELO, Lilacs, Cochrane e PubMed, realizando a leitura de cada um dos trabalhos, com resultados de amplo conhecimento sobre a aplicabilidade das células-tronco no tratamento da dor neuropática em lesão medular utilizando os descritores DECS/MESH e operador booleano AND para estratégia de busca com a seguinte combinação: células-tronco AND dor neuropática AND lesão medular e seus equivalentes em inglês, foram rastreados artigos publicados na íntegra no período compreendido entre 2020 e 2025 que atendessem aos critérios de inclusão adotados no estudo, que estivessem dentro da estratégia PICO (P – Paciente/Problema, I – Intervenção ou Indicadores, C – Comparação e O – Resultado/Desfecho) para delinear a pergunta de investigação e orientar a seleção dos estudos. A temática em estudo foi estruturada da seguinte forma:
P – indivíduos com lesão medular;
I – utilização de células-tronco como intervenção terapêutica;
O – alívio ou modulação da dor neuropática.
Não foi incluído um comparador específico (C), dado o foco da revisão na eficácia das intervenções com células-tronco.
A elaboração desse estudo seguiu os passos estabelecidos pelo método Preferred Reporting Items for Systematic Reviews and Meta-Analyses – PRISMA. Os critérios de inclusão do estudo: 1) Ensaios Clínicos Randomizados (ECR); 2) Estudo com intervenção de células tronco na dor neuropática pós lesão medular; 3) Publicações entre os anos de 2020 a 2025, disponíveis na íntegra, em língua inglesa ou portuguesa, com boa qualidade metodológica. Como critérios de exclusão, as publicações repetidas de uma mesma pesquisa encontradas em bases de dados diferentes foram computadas em apenas uma das bases, considerando a seguinte ordem de prioridade: PubMed, Cochrane, SciELO e Lilacs, artigos com foco em outros tipos de patologias ou sem foco em uso de células de célulastronco, artigos de baixa qualidade metodológica com um risco alto ou moderado de viés.
Quanto aos aspectos éticos, as informações específicas extraídas dos artigos foram acessadas por meio de bancos/bases de dados, não necessitando de autorização dos pesquisadores para utilizá-las por se tratarem de material pertencente ao domínio público.
3 RESULTADOS E DISCUSSÕES
Na triagem dos dados realizados para a revisão sistemática, foram encontrados 18.843 estudos e após o processo de seleção de acordo com os critérios de inclusão, restaram apenas 4 artigos, conforme apresentado na Figura 1.
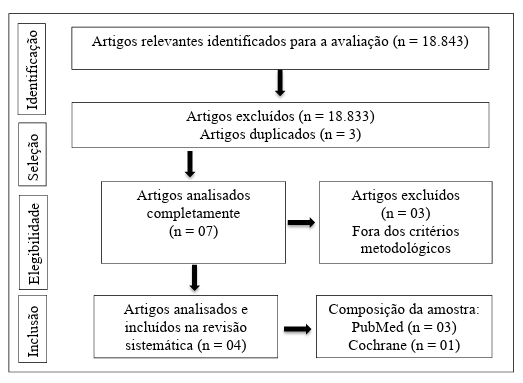
Figura 1. Fluxograma com estratégia de busca e seleção de estudos.
O quadro 1 representa a análise metodológica dos artigos incluídos para a revisão sistemática onde estão descritas as características dos 4 artigos incluídos no estudo.
Quadro 1. Descrição dos estudos escolhidos para a revisão sistemática.
| Autor/Ano/País | Título | Delineamento/ Amostra | Intervenção | Instrumentos de coleta | Desfechos |
| YANG, Y. et al., 2020 – CHINA | Therapeutic effect ofmesenchymal stem cell in spinal cord injury | Estudo clínico experimental n = 68 | Células-tronco mesenquimais aplicadas em lesão medular | Avaliações clínicas e laboratoriais(não especificadas no resumo) | Indicou efeitos terapêuticos positivos na regeneração da medula espinhal |
| ALBU, S. et al., 2021 –ESPANHA | Clinical effects of intrathecal administration of expanded Wharton jellymesenchymal stromal cells in patients with chronic complete spinal cordinjury: a randomized controlled study | Ensaio clínico randomizado n = 10 | Administração intratecal de células do cordão umbilical | Escalas neurológicas e funcionais | Mostrou efeitos clínicos benéficos, com segurança e melhoria funcional |
| AWIDI, A. et al., 2024– JORDÂNIA | Safety and potential efficacy of expandedmesenchymal stromal cells of bone marrow and umbilical cord origins in patients with chronic spinal cord injuries: a phase I/II study | Estudo faseI/II n = 20 | Células mesenquimais da medula óssea e cordão umbilical | Avaliações de segurança e função neurológica | Demonstrou segurança e benefícios potenciais |
| AKHLAGHPASAND,M. et al., 2025 – IRÃ | Effects of CombinedIntrathecal Mesenchym al Stem Cells and Schwann Cells Transplantati on Neuropathic Pai in Complete Spinal CordInjury: APhase II Randomized Active Controlled Trial | Ensaio clínico fase II randomizado n = 67 | Células-tronco mesenquimais+ células de Schwann | Escalas de dor neuropática | Redução significativa da dor neuropática nos pacientes tratados |
A dor neuropática ocasionada por uma lesão medular representa um grande desafio no manejo clínico de pacientes com trauma espinhal, pois ainda possui alta complexidade fisiopatológica e à limitada eficácia dos tratamentos convencionais. Dessa forma, o uso de Células-Tronco Mesenquimais (MSCs) aparece como uma estratégia terapêutica inovadora, pois seu uso promove efeitos anti-inflamatórios, neuroprotetores e moduladores da dor.
Seguindo essa linha de raciocínio, no estudo realizado por Albu et al. (2021), foi avaliada a administração intratecal de MSCs derivadas da geleia de Wharton em pacientes com lesão medular completa crônica. Os resultados indicaram uma melhora funcional discreta, assim como reduções significativas nos escores de dor neuropática, mostrando assim, que a ação imunomodulatória das MSCs pode atenuar a hipersensibilidade central e a excitabilidade neuronal anormal.
Complementando esses achados, Yang et al. (2020) explorou os efeitos terapêuticos das MSCs em modelos de lesão medular, destacando mecanismos como: a inibição da apoptose neural, a redução da inflamação local e a liberação de fatores tróficos, que favorecem a neuroregeneração e atuam diretamente na modulação da dor. Esses mecanismos multifatoriais tornam as MSCs especialmente promissoras para tratar uma condição tão complexa quanto a dor neuropática.
A segurança do uso dessas células é um aspecto fundamental, especialmente considerando o uso clínico em longo prazo. Nesse sentido, o estudo de Awidi et al. (2024) demonstrou que MSCs tanto da medula óssea quanto do cordão umbilical apresentam bons perfis de segurança e tolerabilidade, mesmo em pacientes com lesão crônica da medula espinhal. Além disso, observou-se uma tendência à melhora nos sintomas dolorosos em alguns participantes
Por fim, Akhlaghpasand et al. (2025) propuseram uma abordagem combinada, utilizando MSCs e células de Schwann administradas por via intratecal. Evidenciando uma redução significativa da dor neuropática em comparação ao grupo controle, reforçando assim, a hipótese de que o uso combinado de diferentes tipos celulares pode potencializar os efeitos analgésicos das terapias celulares. Essa combinação sugere um possível efeito sinérgico, já que as células de Schwann contribuem para a remielinização e suporte estrutural, enquanto as MSCs atuam na modulação inflamatória e regeneração neuronal. Portanto, de forma geral, os estudos analisados indicam que o uso de células-tronco, especialmente MSCs, pode representar uma alternativa viável e segura para o tratamento da dor neuropática em pacientes com lesão medular, embora ainda sejam necessários estudos de maior escala, com acompanhamento de longo prazo e padronização das metodologias, para consolidar sua eficácia.
4 CONCLUSÃO
A dor neuropática por lesão medular é uma condição clínica desafiadora nas áreas de neurologia e reabilitação, deliberante quanto à qualidade de vida dos pacientes. As terapias convencionais, embora amplamente utilizadas, ainda apresentam limitações quanto à eficácia, segurança e manejo dos efeitos adversos. Nesse cenário, as terapias celulares surgem como uma opção terapêutica inovadora e promissora.
Evidências recentes demonstram que as MSCs possuem propriedades imunomodulatórias, anti-inflamatórias e neuroregenerativas que contribuem diretamente para atenuar a hipersensibilidade central e a excitabilidade neuronal anormal, resultando em alívio da dor neuropática e recuperação funcional após lesões da medula espinhal. Estudos clínicos demonstram melhora na dor e na neuroproteção, reforçando o potencial dessas células como agentes terapêuticos eficazes. Além disso, abordagens combinadas de células mesenquimais e de schwann tem capacidade de potencializar o efeito analgésico das terapias celulares.
Dessa forma, o transplante de CTs representa um avanço significativo no tratamento da dor neuropática por lesão medular, oferecendo uma nova perspectiva para pacientes que convivem com os efeitos incapacitantes dessa condição. Ao integrar ciência e inovação, essa abordagem, promove um cuidado mais sensível, resolutivo e eficaz, com foco na recuperação da função neurológica e na melhoria da qualidade de vida.
REFERÊNCIAS
AKHLAGHPASAND, M. et al. Effects of Combined Intrathecal Mesenchymal Stem Cells and Schwann Cells Transplantation on Neuropathic Pain in Complete Spinal Cord Injury: A Phase II Randomized Active-Controlled Trial. Cell Transplantation, v. 34, p. 09636897241298128, 2025.
ALBU, S. et al. Clinical effects of intrathecal administration of expanded Wharton jelly mesenchymal stromal cells in patients with chronic complete spinal cord injury: a randomized controlled study. Cytotherapy, v. 23, n. 2, p. 146-156, 2021.
AWIDI, A. et al. Safety and potential efficacy of expanded mesenchymal stromal cells of bone marrow and umbilical cord origins in patients with chronic spinal cord injuries: a phase I/II study. Cytotherapy, v. 26, n. 8, p. 825-831, 2024.
BRYK, M. et al. Mesenchymal stem cells and extracellular vesicles for the treatment of pain. Journal of Translational Medicine, [S.l.], v. 20, n. 1, p. 1–15, 2022. Disponível em: https://link.springer.com/article/10.1186/s12967-022-03297-8.
CHENG, H. et al. Cell-based and stem-cell-based treatments for spinal cord injury: evidence from clinical trials. Cell Transplantation, [S.l.], v. 31, p. 1–13, 2022. Disponível em: https://journals.sagepub.com/doi/full/10.1177/09636897221111910.
DE ABREU RODRIGUES, F.; CARVALHO, L. F. C. Células-tronco no tratamento da dor. RECISATEC-REVISTA CIENTÍFICA SAÚDE E TECNOLOGIA, v. 2, n. 7, p. e27156-e27156, 2022.
FIUSA, J. M.; KNAUT, S. DE A. M.; CARRARO, E. Rehabilitation protocols in neuropathic pain: bibliometric review. BrJP, v. 6, n. 4, p. 448–453, out. 2023.
FORD, J. et al. Mesenchymal stem cells transplantation for neuropathic pain induced by peripheral nerve injury in animal models: a systematic review. Pain Research and Management, [S.l.], v. 2020, p. 1–10, 2020. Disponível em: https://www.hindawi.com/journals/prm/2020/8852143/.
LIBERATI, A. et al. The PRISMA statement for reporting systematic reviews and metaanalyses of studies that evaluate healthcare interventions: explanation and elaboration. Bjm, v. 339, 2009.
LIU, M. et al. Stem cells in the treatment of neuropathic pain: research progress of mechanism. Stem Cells International, v. 2020, n. 1, p. 8861251, 2020.
OLIVEIRA, R. A. A. DE. et al. Tratamento farmacológico da dor neuropática central: consenso da Academia Brasileira de Neurologia. Arquivos de Neuro-Psiquiatria, v. 78, n. 11, p. 741–752, nov. 2020.
OPRETZKA, L. C. F.; EVANGELISTA, A. F.; VILLARREAL, C. F. Tratamentos com células-tronco e seus derivados podem levar à cura da dor neuropatia?, 2023.
XAVIER FILHO, D. G. et al. Dor neuropática na prática clínica: ênfase nos instrumentos diagnósticos. Rev. méd. Minas Gerais, p. 32211-32211, 2022.
YANG, Y. et al. Therapeutic effect of mesenchymal stem cell in spinal cord injury. Int J Clin Exp Med, v. 13, n. 3, p. 1979-1986, 2020.
YIN, Z. et al. “ROS: Carrasco de regulação da morte celular na lesão da medula espinhal.” Fronteiras em imunologia, v. 15, 1330678, 23 de janeiro de 2024.
YOO, J. Y. et al. Generation of iPSC-derived insulin-producing cells from patients with type 1 and type 2 diabetes compared with healthy control. Stem Cell Research, [S.l.], v. 45, p. 101807, ago. 2020. DOI: https://doi.org/10.1016/j.scr.2020.101807. Disponível em: https://www.sciencedirect.com/science/article/pii/S1873506120301463.
1 Discente do Curso Superior de Medicina do Centro Universitário Uninovafapi. e-mail: karoldalpupogiordani@gmail.com
2 Discente do Curso Superior de Medicina do Centro Universitário Uninovafapi. e-mail: luccacron@gmail.com
3 Discente do Curso Superior em Biomedicina do Centro Universitário Uninovafapi. e-mail: jackelinemonteiro148@gmail.com
4 Docente do Curso Superior de Medicina do Centro Universitário Uninovafapi. Doutor em Biotecnologia em Saúde (RENORBIO/UFPI). e-mail: gustavo.neves@uninovafapi.edu.br
