REGISTRO DOI: 10.5281/zenodo.6607718
Autores:
Julia Figueredo dos Santos1
Letícia Sanchez Labadia Hypolito2
Sarah de Oliveira Libório3
Daniel Moreno Garcia4
RESUMO
As doenças respiratórias e pulmonares estão dentre as principais causas de mortalidade no mundo. Os tratamentos atuais agem principalmente na redução da gravidade dos sintomas e nenhum deles apresentou-se capaz de trazer uma redução na progressão dessas doenças. O único procedimento não paliativo para doenças crônicas pulmonares em estágio avançado é o transplante de pulmão, porém, essa alternativa enfrenta falta de doadores compatíveis, rejeição do órgão e outros impeditivos. Há uma carência na rede de saúde para novos tratamentos e abordagens terapêuticas que possam restabelecer completamente a qualidade de vida dos portadores dessas doenças. Evidências sugerem que, no pulmão, as células-tronco (CTs) participam não só da regeneração do tecido lesado como também da homeostase. Em casos de inflamação crônica, como ocorre na DPOC, a capacidade do pulmão se desenvolver ou se regenerar é afetada ou impedida. Então, além de seu potencial regenerativo, as CTs são consideradas uma terapia promissora devido aos seus efeitos imunomoduladores e anti-inflamatórios, portanto a reparação tecidual por via dessas células é uma grande esperança para que haja uma alternativa de tratamento para a DPOC e a diminuição da fila de transplantes.
Palavras-chave: DPOC, células tronco, regeneração, pulmão e COVID-19.
ABSTRACT
Respiratory and pulmonary diseases are among the main causes of mortality in the world. Current treatments act mainly on reducing the severity of symptoms and none of them has been able to bring about a reduction in the progression of these diseases. The only non-palliative procedure for end-stage chronic diseases is lung transplantation, however, this alternative faces a lack of compatible donors, organ rejection and other impediments. There is a lack in health for new treatments and therapeutic approaches that can completely restore the quality of life of patients with these diseases. Evidences suggest that, in the lung, stem cells (SCs) participate not only in the regeneration of injured tissue but also in homeostasis. In cases of chronic inflammation, as in COPD, the lung’s ability to develop or regenerate is affected or impeded. So, in addition to their regenerative potential, CTs are considered a promising therapy due to their immunomodulatory and anti-inflammatory effects, so tissue repair via these cells is a great hope for an alternative treatment for COPD and reduction of the transplant queue.
Keywords: COPD, stem cells, regeneration, lung and COVID-19.
1. INTRODUÇÃO
De acordo com o Ministério da Saúde, as doenças Respiratórias Crônicas (DRC) são uma das maiores causas de internações e sobrecarregam o sistema de saúde (SAÚDE BRASIL, 2018). Dentre as DRCs, uma amplamente mencionada pelo o crescimento na taxa de mortalidade é a Doença Pulmonar Obstrutiva Crônica (DPOC) que foi a causa de mais de 37 mil pessoas em 2015 no Brasil, de acordo com Sistema de Informações do SUS. Os principais sintomas estão a tosse e dispneia crônica que são acarretados em uma progressiva obstrução crônica do fluxo aéreo (LIPSI et al., 2014). Geralmente a DPOC está associada a uma resposta inflamatória crônica anormal dos pulmões diante da inalação de partículas e/ou gases tóxicos, principalmente a fumaça de cigarros e, por isso, é altamente relacionada ao tabagismo, porém fatores genéticos também podem desencadear a DPOC. (TORALDO, M; TORALDO, S; CONTE, 2018).
Há evidencias que o estresse oxidativo e a inflamação podem estar envolvidos nos mecanismos de desenvolvimento dos efeitos sistêmicos e isso pode aumentar o risco para outras doenças como infarto agudo do miocárdio, câncer de pulmão (DOURADO et al, 2006) e infecções respiratórias, como a COVID-19, por exemplo (SONG et al, 2020). Alterações estruturais como nos brônquios (bronquite crônica), estreitamento das pequenas vias áreas e a destruição do parênquima pulmonar (enfisema) são decorrentes da resposta inflamatória crônica nos pulmões e que acarretam a limitação progressiva do fluxo aéreo (RUFINO et al, 2013).
As opções de tratamento variam de acordo com o grau da doença, onde o uso de broncodilatadores inalatórios são a base no tratamento dos sintomas da DPOC, porém em alguns casos devem ser associados a corticoides inalatórios para conter a inflamação, e quando há infecção respiratória, também deve-se fazer o uso de antibióticos (LEAL et al, 2014). Em pacientes hipoxêmicos, a oxigenioterapia é indicada, mas em estágios avançados da doença, é preciso fazer o transplante de pulmão (HACKETT et al., 2010). De maneira geral, todas as opções terapêuticas visam suprimir os sintomas e melhorar a qualidade de vida dos pacientes, porém não resolvem o cerne do problema pois o tecido pulmonar lesado não possui tal capacidade de regeneração, portanto é imprescindível a procura de novas terapias (KUBO, 2012).
Nos últimos anos, houve um avanço significativo no ramo da medicina regenerativa, cujo objetivo é estimular ou regenerar células, tecidos ou órgãos a fim de restabelecer ou estabelecer a função normal (RAMIREZ, 2011). Diversas pesquisas na área de biotecnologia têm sido realizadas a respeito de terapias regenerativas e foi notável o avanço nos estudos com células-tronco que se mostraram promissoras no tratamento de algumas doenças pulmonares como enfisema pulmonar e COVID-19 (SONG at al, 2020).
Em dezembro de 2019, houve um surto global de Síndrome Respiratória Aguda Grave, conhecida por COVID-19 e cerca de um ano depois já haviam mais de 253.640.000 casos de infecção e 5.104.899 mortes subsequentes em todo o mundo (CHEN et al, 2021). A falta de tratamento para doença impulsionou diversas pesquisas, algumas direcionadas ao uso de células-tronco. A urgência em criar um tratamento eficaz e o volume de estudos sendo desenvolvidos, podem ajudar, de modo geral, a evolução das investigações acerca de terapias celulares para doenças pulmonares (CHEN et al, 2021).
Células-tronco são células que tem capacidade de se diferenciar em novas células, e quando estão totalmente diferenciadas, podem serem programadas para desenvolver funções específicas em diversos tecidos (SOUZA et al., 2010). A princípio, elas podem ser divididas em células adultas, que são interessantes para o uso e células embrionárias, que envolvem questões éticas, legais e burocráticas atualmente (CHEN et al, 2021).
O reparo tecidual de órgãos lesados ainda é experimental, com isso, em ensaios envolvendo as CTs são necessários avanços para que não haja ação do sistema imune contra as células transplantadas (SHAH et al, 2022). O objetivo do uso de células-tronco no tratamento da DPOC é poder retardar a destruição progressiva do pulmão ou reconstruir a estrutura pulmonar destruída, sendo o uso das células tronco mesenquimais (CTMs) uma terapia potencial por possuir benefícios baseados na sua capacidade imunomoduladora, de produzir fatores de crescimento e algumas citocinas anti-inflamatórias (COSTA et al, 2009). Embora do uso de CTs estejam em constante expansão, é importante reconhecer o potencial clínico que elas projetam. O presente trabalho apresenta um levantamento teórico sobre a DPOC, onde a saúde do pulmão se torna um tema ainda mais relevante devido as inúmeras complicações recentes causadas pelo vírus da COVID-19 a nível global (CHEN et al, 2021). Nesse contexto, as terapias de regeneração pulmonar visam reverter os déficits estruturais e funcionais na DPOC, seja pelo emprego de células pulmonares exógenas para substituir o tecido perdido ou para induzir um efeito imunomodulador (COSTA et al, 2021). Portanto, essa revisão abordará o desenvolvimento de tratamentos para a DPOC através da medicina regenerativa, uma vez que a terapia baseada em células tronco tem se mostrado promissora.
2. OBJETIVOS
O objetivo geral deste trabalho é realizar um levanto bibliográfico de pesquisas e trabalhos acadêmicos com o objetivo de investigar terapias que utilizem célulastronco mesenquimais no tratamento regenerativo pulmonar causado pela DPOC.
Entre os objetivos específicos estão:
◉ Identificar tratamentos promissores com células-tronco mesenquimais através da medicina regenerativa para reparo do pulmão.
◉ Avaliar o potencial terapêutico das células-tronco mesenquimais.
◉ Apontar os mecanismos necessários para que o uso de células-tronco mesenquimais neste tratamento seja bem-sucedido.
3. METODOLOGIA
O estudo realizado nesta pesquisa científica leva em consideração o levantamento bibliográfico nas plataformas PubMed, DataSUS, NCBI e Scielo no período que englobam os anos de 2011 a 2021 sobre o uso de células-tronco mesenquimais no reparo tecidual pulmonar. A revisão integrativa é a metodologia utilizada para analisar as variáveis do mesmo assunto, sintetizar as informações obtidas e, por meio deste trabalho, comparar as opiniões e teses de diferentes autores com o objetivo de obter uma conclusão sobre o tema proposto.
Foram considerados artigos que continham os seguintes descritores: Doença Pulmonar Obstrutiva Cônica (DPOC), sistema respiratório, funcionalidade do pulmão, enfisema pulmonar, células-tronco mesenquimais, medicina regenerativa e uso de células-tronco em reparação tecidual com enfoque na DPOC. Os critérios excludentes abrangem artigos publicados fora dos anos anteriormente citados e não serão considerados conteúdos em idiomas que não sejam na língua portuguesa, espanhola e inglesa.
4. DESENVOLVIMENTO
4.1 Doenças Respiratórias
O sistema respiratório é composto por trato respiratório superior (nariz, faringe e laringe) e trato respiratório inferior (traqueia e pulmão) (JUNQUEIRA, 2017). O corpo humano possui dois pulmões que tem como principal finalidade realizar a hematose, onde o pulmão direito é divido por fissuras transversas e oblíquas em três lobos e o esquerdo possui uma fissura oblíqua e dois lobos, que são divididos em segmentos bronco alveolares e possuem brônquios segmentares, acompanhado de veias, artérias, nervos e vasos sanguíneos para realizar as trocas gasosas (JUNQUEIRA, 2017). Na inspiração o ar percorre o caminho do trato respiratório superior (TRS), passa pela traqueia que se bifurca em brônquios principais direito e esquerdo, então esse ar entra nos pulmões e percorre até chegar nos bronquíolos, que são ramificações menores que penetrarão os alvéolos (JUNQUEIRA, 2017). Os alvéolos são constituídos de duas camadas de epitélio pavimentoso simples separadas por capilares sanguíneos, fibras reticulares e elásticas, fibroblastos e substância fundamental amorfa do tecido conjuntivo (UNIVERSIDADE FEDERAL DE ALFENAS, 2022). Com isso, são encontrados macrófagos alveolares responsáveis pelo epitélio alveolar, células endoteliais dos capilares, pneumócito tipo I que atuam na troca gasosa e no impedimento da passagem de líquidos, e pneumócito do tipo II que produz substância surfactante que impede o colabamento alveolar por tensão superficial (JUNQUEIRA, 2017).
De acordo com o Ministério da Saúde (2010), as Doenças Crônicas Respiratórias (DRC) são doenças que afetam as vias respiratórias superiores e inferiores, sendo divididas em dois grandes grupos: restritivas e obstrutivas. As doenças obstrutivas, como o próprio nome sugere, obstruem as vias áreas. Esse processo ocorre após um estímulo lesivo que causa uma inflamação, essa lesão ativa o sistema imune e as proteases pulmonares começam a trabalhar para que essa lesão seja curada, porém, quando esse estímulo lesivo é constante, há falha na reparação tecidual, e o que anteriormente era epitélio simples pavimentoso, em razão da metaplasia, se torna epitélio escamoso estratificado (Figura 1) (UNIVERSIDADE FEDERAL DE ALFENAS, 2022).
A Doença Pulmonar Obstrutiva Crônica é uma doença respiratória crônica inflamatória das vias áreas pulmonares (LIPSI, et al., 2014). De acordo com Sistema de Informações do SUS em 2015 mais de 37 mil pessoas morreram de DPOC no Brasil. O Global Burden of Disease (GBD) estima que em 2017, a DPOC representa um gasto total de 72 milhões para o SUS e no mesmo ano foi a quarta principal causa de morte no mundo (CRUZ, PEREIRA, 2020). O cigarro está entre o principal fator de risco para o desenvolvimento da DPOC, de acordo com a Organização Mundial da Saúde (OMS), 90% dos fumantes irão desenvolver DPOC ao longo da vida. No grupo de risco estão homens, fumantes e com mais de 40 anos. Também há um estudo de 2011 do Center for Disease Control and Prevention (CDC) que mostra que temperaturas baixas extremas como o Alaska também é possível ser um fator de risco para desenvolver DPOC.
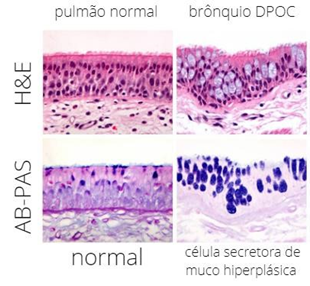
A DPOC é uma fusão do enfisema pulmonar com bronquiolite aguda, onde os principais sintomas são dispneia, muco e tosse seca (LIPSI et al, 2014). Quando em contato com agente lesivo, ocorre uma resposta inflamatória no local, mediada por neutrófilos e proteases que atuarão no auxílio ao reparo tecidual. Quando esse processo é contínuo, a α-1 antiprotease não é suficiente para conter a ação das proteases e o processo inflamatório se torna constante (GODOY, 2016). Os brônquios ficam inflamados e há formação de muco gerando a “tosse de fumante”, afetando também os bronquíolos e alvéolos que são obstruídos e a saída de ar é dificultada (LIPSI et al, 2014). Também é possível que o indivíduo desenvolva a DPOC por falha genética com a ausência da α-1 antitripsina, porém esse representa menos de 1% dos casos de DPOC (RUFINO et al, 2013). As causas conhecidas para que isso ocorra são em sua maioria pessoas com hábitos tabagistas ou por exposição à fumaça constantemente, como poluição ou trabalhadores de carvoarias, fornos a lenha e indústrias que utilizem fornalhas (LIPSI et al, 2014).
4.2 Pandemia de COVID-19 e a relação com a DPOC
Em março de 2020, a OMS decretou pandemia global por um vírus respiratório preexistente em animais que infectava humanos também. O COVID 19 é síndrome respiratória aguda grave causada pelo vírus SARs-CoV-2 que acarretou em mais de 4,7 milhões de casos e quase 150 mil mortes no Brasil (SOUZA, 2021).
O vírus SARs-CoV-2 utiliza a enzima conversora de angiotensina 2 (ECA-2) para invadir as células hospedeiras e há uma grande expressão dela em todo trato respiratório, sendo que é encontrada predominantemente no epitélio nasal, seguido pelo epitélio das vias aéreas maiores e também é encontrada em menor quantidade nas regiões pulmonares mais distais e alveolares (POLVERINO; KHERADMAND, 2021). Não há evidências claras de que a DPOC aumente a suscetibilidade do COVID19, porém estudos demonstram que DPOC está associada ao aumento da expressão ECA-2 nas células epiteliais das vias aéreas inferiores (FEKETE et al, 2022), o que pode aumentar a vulnerabilidade das células hospedeiras à infecção pelo SARS-CoV2 (SONG et al, 2020). O SARs-Cov-2 quando vinculado à ECA-2, promove uma mudança no equilíbrio ECA/ECA-2 fazendo com que predomine ECA, o que resulta no aumento de efeitos pró-inflamatórios e danos teciduais (LEUNG et al, 2020).
A DPOC acomete pessoas com 40 anos ou mais e o COVID-19 pode afetar pessoas em qualquer faixa etária, mas causa principalmente doenças mais graves em pacientes nessa faixa etária (FEKETE et al, 2022). O envelhecimento está relacionado a exacerbação do COVID-19 por conta da imunossenescência relacionada à idade (FEKETE et al, 2022).
Os pacientes com DPOC, principalmente fumantes, também têm respostas imunes inatas e adaptativas prejudicadas (FEKETE et al, 2022) e, em decorrência disso, ocorre o comprometimento dos mecanismos de defesa, gerando um atraso na eliminação dos vírus respiratórios (GERAYELI et al, 2021). Fatores como o aumento da ECA-2 e a questão das respostas imunes estarem desreguladas, podem facilitar a propagação do SARS-CoV-2 nos pulmões de pacientes com DPOC, levando à rápida deterioração clínica e progressão para casos graves de COVID-19 (GERAYELI et al, 2021). O tratamento da DPOC com uso de corticoides a longo prazo, por ser um medicamento imunossupressor, também pode aumentar o risco e a gravidade das infecções virais (POLVERINO; KHERADMAND, 2021). Um estudo feito na Coréia do Sul, denominado “Impacto da DPOC no prognóstico da COVID-19: um estudo nacional de base populacional na Coreia do Sul” (2021), investigou sobre o impacto da DPOC no risco de insuficiência respiratória e na mortalidade em pacientes com COVID-19, fazendo um comparativo (Figura 2) entre pacientes com DPOC e sem DPOC, dentre os pacientes infectados pelo vírus do COVID-19 (LEE et al, 2021).
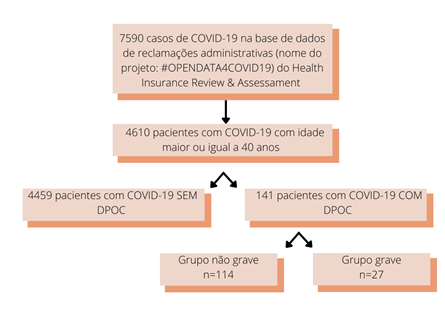
O mesmo estudo comparou os desfechos clínicos entre os grupos sem DPOC e com DPOC, afirmando que a taxa de hospitalização, a duração que o paciente ficou hospitalizado e a quantidade total de recursos médicos relacionados ao COVID-19 não diferiram entre os grupos. Entretanto, as proporções de admissões na UTI e o uso de ventilação mecânica foram maiores no grupo de DPOC, além do mais, a mortalidade foi maior no grupo com DPOC do que no grupo sem (LEE et al, 2021). Em suma, a DPOC está relacionada ao aumento da suscetibilidade a infecções respiratórias, e os vírus estão entre as principais causas de exacerbações agudas da DPOC (POLVERINO; KHERADMAND, 2021).
4.3 Transplante de pulmão: única solução atual
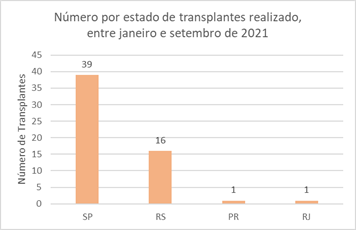
Por não haver cura, apenas tratamento, a DPOC tem também suma importância clínica. O custo com as complicações é alto para o SUS e a única forma conhecida de reverter a situação seria com transplante de pulmão, porém, de acordo com o Registro Brasileiro de Transplantes (RBT), havia 241 pessoas na fila de espera para o transplante de pulmão, sendo que de janeiro a setembro de 2021 foram feitos apenas 57 transplantes no Brasil (Figura 3 adaptada). Os transplantes são feitos em 7 centros atuantes em 4 estados: São Paulo, Rio Grande do Sul, Rio de Janeiro e Paraná. Os transplantes não são uma opção viável pois é necessário um doador e receptor compatíveis, uma equipe médica especializada para realizar o procedimento cirúrgico e um acompanhamento pós-operatório vitalício para que o corpo não rejeite o órgão posteriormente. Portanto, é importante o investimento em novas abordagens que curem o paciente sem a necessidade de ser transplantado (Registro Brasileiro de Transplantes, 2021).
4.4 Terapia Celular em doenças pulmonares
Os tratamentos existentes atualmente contribuem para a melhora na qualidade de vida do paciente, porém não são capazes de alterar o curso da doença e, consequentemente, não resultam na cura (SANTANA, 2015). Com isso, na esperança de proporcionar uma nova terapia aos pacientes de DPOC, existem diversos estudos acerca do uso de células-tronco adultas e embrionárias que demonstram resultados promissores com grandes perspectivas terapêuticas em diferentes patologias, incluindo as pulmonares (SANTANA, 2015). Baseado em dados da literatura, tem se destacado a administração de células-tronco mesenquimais (CTMs) ou meio condicionante de cultura de células mesenquimais com o objetivo de restituir a função e estrutura pulmonar (SANTANA, 2015).
4.5 Células-Tronco
Células-tronco são definidas como células indiferenciadas com capacidade de autorrenovação e diferenciação em tipos celulares especializados, além disso, apresentam propriedades imunomoduladoras e efeitos parácrinos que ocorrem mediante injúria tecidual e, dessa forma, são capazes de tratar lesões ou doenças, como também substituir células danificadas ou perdidas (ZUTTION et al, 2013). As CTs são classificadas em dois tipos principais de acordo com a origem e com a plasticidade, ou seja, a capacidade de diferenciação (ZUTTION et al, 2013). Referente a origem, quando presentes no embrião, elas são células-tronco embrionárias (CTE), e quando obtidas através de um tecido adulto são células-tronco adultas (CTA) (ZUTTION et al, 2013) e é importante ressaltar que a capacidade de diferenciação ocorre tanto na fase embrionária como na fase adulta (SANTANA, 2015).
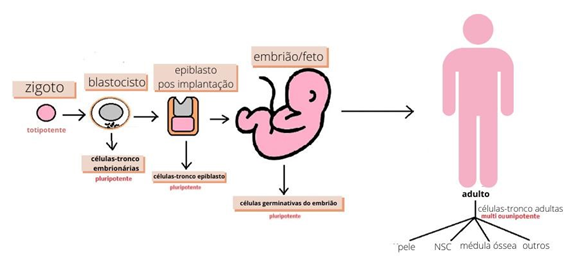
Quanto ao nível de diferenciação, elas podem ser divididas em: a) totipotentes, capazes de se diferenciarem em qualquer tipo celular, além de também ter a capacidade de formar estruturas embrionárias e extraembrionárias (ZAKRZEWSKI et al, 2019). São representadas pelos blastômeros, que durante o desenvolvimento embrionário são encontradas até a fase de mórula (ISTOE et al, 2020), e esse tipo celular pode se originar de um organismo totalmente completo (ISTOE et al, 2020); b) pluripotentes, também são capazes de se diferenciarem em qualquer tipo celular, com exceção dos anexos embrionários e a placenta. Elas formam a massa interna do blastocisto depois dos quatro dias de vida e participam da formação de todos os tecidos do organismo (JANZ, 2018); c) multipotentes, são células mais limitadas e estão presentes no indivíduo adulto, originam apenas o tipo celular do tecido que são provenientes, possibilitando a regeneração tecidual (JANZ, 2018); d) unipotentes, possuem uma capacidade restrita de se diferenciarem a uma linhagem celular, podendo originar apenas um tipo celular como as células da epiderme, por exemplo (LENOCH, 2015).
As células-tronco embrionárias, como o nome já sugere, são encontradas na massa interna do embrião, quando ele se encontra no estágio de blastocisto, em torno de 4-5 dias após a fecundação (REDE NACIONAL DE TERAPIA CELULAR – RNTC, 2022). São pluripotentes (Figura 4 adaptada) e capazes de originar todos os tecidos do organismo (MARCON, 2014).
Células-tronco adultas (CTA) são multipotentes e possuem capacidade de autorrenovação. Nos tecidos, desempenham funções de homeostase e regeneração tecidual após alguma injúria (JANZ, 2018). Estão presentes em regiões diferenciadas do organismo já formado, sendo capazes de gerar subtipos celulares de tecidos das quais provém (Revista Saúde em Foco, 2019). São obtidas principalmente na medula óssea e no sangue do cordão umbilical (REDE NACIONAL DE TERAPIA CELULAR – RNTC, 2022). No entanto, segundo pesquisas, as CTAs demonstram-se capazes de dar origem a tecidos e órgãos diferentes daqueles dos quais se originaram, fenômeno conhecido como transdiferenciação (MARCON, 2014).
As CTAs podem ser divididas em grupos e dentre eles estão as células-tronco hematopoiéticas (CTH) e células-tronco mesenquimais (CTM) (LENOCH, 2015). As células-tronco hematopoiéticas são responsáveis pela formação do tecido sanguíneo (SANTANA, 2015) e pela renovação do sistema sanguíneo e imunológicos (FLORENTINO, 2018). Entretanto, as CTMs se destacam dentre as células-tronco adultas, por serem as mais utilizadas atualmente em estudos básicos, pré-clínicos e clínicos ao redor do mundo (JANZ, 2018).
As células-tronco embrionárias por possuírem uma grande capacidade de proliferação e diferenciação, podem causar, quando infundidas no organismo receptor, o risco de formação de tumores (MARCON, 2014). Por outro lado, as CTAs por terem uma menor capacidade de diferenciação e de proliferação faz com que o risco de formação de tumores seja menor, ou seja, faz com que a aplicação destas células em terapias regenerativas seja considerada mais segura (MARCON, 2014). As CTMs são de fácil obtenção, quando comparadas às CTEs, por estarem presentes em diversos órgãos e tecidos adultos, fato este favorável a questões éticas e religiosas (KIM; PARK, 2017).
4.6 Células-tronco mesenquimais: Isolamento e propriedades biológicas
O uso de células-tronco mesenquimais como tratamento da DPOC, está cada vez mais presente nos estudos e pesquisas sobre o tema, isso se dá pelo seu poder regenerativo e por secretarem fatores de crescimento e moléculas anti-inflamatórias (MUSHAHARY et al, 2017). Esse tipo celular pode ser encontrado em praticamente todos os órgãos e tecidos pós-natais podendo se diferenciar não apenas em osteoblastos, condrócitos e adipócitos, como também, em células endoteliais. (GOLCHIN, A., 2022)
A International Society for Cellular Therapy, propôs em 2006 um conjunto de marcadores e características celulares para identificação de CTM humanas, que são amplamente aceitos até hoje. De acordo com a instituição, as CTMs devem possuir capacidade de autorrenovação, multipotência com potenciais osteogênicos, condrogênicos e adipogênicos, e devem expressar um conjunto característico de marcadores de superfície, como aglomerado de diferenciação (CD)73, CD90 e CD105. Ademais, as CTMs devem apresentar crescimento aderente ao plástico e precisam ser expansíveis in vitro (MUSHAHARY et al, 2017).
Entre as várias fontes de CTMs, as derivadas do tecido adiposo são muito atraentes para fins terapêuticos, isso, devido seu fácil isolamento e sua abundância, além disso, possuem alta capacidade de proliferação in vitro, são capazes de sofrer uma extensa diferenciação em diversas linhagens celulares e também secretam múltiplos fatores de crescimentos que estimulam a regeneração tecidual (CHEN, FINE, 2016). As CTMs provenientes da medula óssea também apresentam características favoráveis para sua utilização com fins terapêuticos, pois são de fácil acessibilidade, tem vasta capacidade de diferenciação e são capazes de se adaptar à vários fenótipos diferentes. (GOLCHIN, A., 2022)
As CTMs podem ser facilmente isoladas de um pequeno aspirado de tecido e podem ser multiplicadas com alta efetividade, elas têm grande potencial terapêutico, pois expressam baixos níveis de antígenos HLA classe I e classe II e baixos níveis de moléculas coestimuladoras, limitando o reconhecimento pelo sistema imunológico. (TORALDO, M; TORALDO, S; CONTE, 2018).
Geralmente as CTMs são isoladas através de procedimentos simples abrangendo, trituração de tecidos, digestão enzimática opcional e crescimento celular em uma superfície plástica. Os procedimentos geralmente podem ser divididos em protocolos enzimáticos e de explantes (MUSHAHARY et al, 2017).
De acordo com Mushahary et al, (2017), na cultura de explantes, o tecido de origem é lavado, afim de remover células sanguíneas, e em seguida é dividido em pedaços pequenos (apenas alguns milímetros de comprimento). É importante que os pedaços sejam pequenos para que ocorra melhor difusão de gases e nutrientes em direção às células, porém a fragmentação excessiva pode acartar na destruição celular. As partes são colocadas em meio de crescimento em recipientes plásticos e as CTM crescem a partir de pedaços dos tecidos na superfície de placas de cultura celular e após um certo período, os pedaços de tecido podem ser removidos. (MUSHAHARY et al, 2017).
No método enzimático, os passos são similares, entretanto, nessa técnica o tecido é divido grosseiramente, e então é incubado em uma solução enzimática que degrada a matriz extracelular. Posteriormente as células ou os pequenos agregados celulares, isolados são desprendidos do tecido e transferidos para as placas de cultura (MUSHAHARY et al, 2017).
Deve-se entrever que o cultivo de CTM altera seus atributos biológicos, e que seu cultivo é essencial, pois para aplicação clínica, são necessários grandes números de células. Estudos revelaram inconsistências quanto ao efeito dos procedimentos de isolamento, cultura e expansão nas características biológicas das CTMs. Porém foi possível avaliar surgimento de diferentes perfis de marcadores, sendo isso consequência dos diferentes procedimentos de cultivo (UDER et al, 2017). A importância funcional dos antígenos de superfície em CTMs ainda permanece imprecisa, entretanto a expressão de moléculas de adesão celular como a integrina α1, α2, α3, α5, α6, αV, bem como β1, β3 e β4 podem cumprir uma importante função na migração celular, homing e integração tecidual destas células (UDER et al, 2017).
Outra característica importante das CTMs é sua baixa expressão do principal complexo de histocompatibilidade (MHC) tipo 1 e ausência de expressão constitutiva do MHC tipo 2 e das moléculas coestimuladoras CD80, CD86 e CD40, permitindo transplante alogênico dessas células, sem resposta imune significativa do hospedeiro. (SUEBLINVONG, V., WEISS, D., 2010).
4.7 Terapias com células-tronco autólogas versus alogênicas
As terapias celulares podem ser divididas em dois grupos, as autólogas, onde as células-tronco serão extraídas, manipuladas e depois aplicadas no mesmo indivíduo, e as alogênicas, onde as células serão provenientes de um doador (LOPES; SINCLAIR; FROHLICH, 2018).
A terapia celular autóloga apresenta benefícios em relação a segurança no transplante pois possuem menor risco de rejeição, menor chance de contrair infecções e reações imunes indesejadas (SHAH et al, 2022). Entretanto, de acordo com Lopes, Sinclair e Frohlich (2018) a produção autóloga, possui alguns empecilhos, a variabilidade do paciente e a incapacidade de aproveitar as economias de escala no fornecimento de tratamento para um grande número de pacientes, tornam essa opção excessivamente cara e demorada (LOPES; SINCLAIR; FROHLICH, 2018) Além disso, eventualmente, os pacientes cronicamente doentes possuem a qualidade celular comprometida, ou incapacidade de doar tecido devido ao possível risco da cirurgia, também deve ser levada em consideração, a circunstância onde o tecido auto derivado contenha fatores genéticos subjacentes que serão a causa da doença (LOPES; SINCLAIR; FROHLICH, 2018).
Segundo Shah et al, (2022), a terapia alogênica, também possui alguns obstáculos como a adequação para uma população diversificada e a possibilidade de transportar antígenos estranhos, provocando resposta imune indesejada e até mesmo rejeição do tecido. Ainda assim, atualmente a terapia alogênica é mais vantajosa em comparação à autóloga. Os obstáculos citados anteriormente foram superados com a minuciosa triagem de saúde dos doadores. Outras vantagens incluem os custos dessa terapia que são diluídos por conta da capacidade de produção em larga escala e pelo fato dessa terapia também poder ser viabilizada como um medicamento congelado, facilitando a administração e a rapidez de acesso ao tratamento (SHAH et al., 2022).
Especificamente sobre as CTMs derivadas da medula óssea, estudos demostraram que, em pacientes idosos, a utilização autóloga é desinteressante, pois as células expressariam altamente genes relacionados à senescência, com comprimento de telômero mais curto, baixa proliferação e baixa capacidade de diferenciação (CHEN et al, 2021). Tanto as CTMs derivadas do tecido adiposo quanto da medula óssea, em idosos, podem provocar certo grau de dor no processo de aquisição. Algumas reações adversas relacionadas à punção e lipoaspiração podem ocorrer. Portanto, para pacientes idosos, as células-tronco alogênicas podem ser a melhor escolha. A decisão sobre utilização de células-tronco autólogas ou alogênicas caberá aos pesquisadores com base na particularidade de cada caso (CHEN et al, 2021).
4.8 Tratamento com CTMs para DPOC
O pulmão humano adulto é um órgão complexo, é composto por alvéolos que são formados a partir de diversos tipos especializados de células epiteliais ao longo das vias respiratórias, e sua funcionalidade envolve uma série de mecanismos. (TORALDO, M; TORALDO, S; CONTE, 2018). E, de acordo com Santana (2015), o maior desafio do desenvolvimento do tratamento é promover um efetivo reparo funcional do pulmão, pois isso implica em um conjunto de fatores, além de reparar a estrutura alveolar e mediar resposta inflamatória, é necessário a restauração do suprimento sanguíneo local, não apenas para nutrição celular, mas também para promover a principal função pulmonar, a troca gasosa.
Atualmente, diversas pesquisas vêm sendo realizadas em modelos animais, com diferentes fontes de células-tronco, diferentes métodos, doses e tempos de administração (CHEN et al, 2021). Existem três mecanismos pelos quais as CTMs podem exercer sua forma terapêutica: Primeiro, a terapia pode agir, reduzindo a apoptose das células epiteliais nos pulmões melhorando a estrutura do tecido pulmonar danificado. Segundo a terapia com CTMs pode induzir a proliferação de células no pulmão e facilitar o autorreparo do tecido pulmonar. Terceiro, a terapia pode reduzir a resposta inflamatória sistêmica e promover a secreção de uma diversidade mediadores anti-inflamatórios (CHEN et al, 2021).
Como explicado anteriormente, uma das principais causas da DPOC é o tabagismo, (DOURADO et al, 2006) a fumaça do cigarro ativa células mononucleares do sangue no pulmão, levando à liberação de uma variedade de citocinas inflamatórias que resultam na progressão da doença (CHEN et al, 2021).
Foi demonstrado que as CTMs são capazes de diminuir essa resposta inflamatória por conta da baixa liberação de citocinas de macrófagos ativados clássicos, incluindo interleucina (IL)-1β, IL-6, TNF alfa, proteína quimiotática de monócitos 1 e promovendo a liberação de mediadores anti-inflamatórios, como IL-10, fator transformador de crescimento-β, indoleamina 2,3 dioxigenase 1, interrompendo a progressão da doença (CHEN et al, 2021) (figura 5).

Segundo o levantamento feito por CHEN et al, (2021) o desequilíbrio de proteases e antiproteases é outro fator importante para a patogênese da DPOC, ele é responsável por causar degradação da matriz extracelular, promover apoptose das células da estrutura da parede alveolar, aumentar ainda mais a secreção de muco e por fim, levar a destruição da parede alveolar e à expansão do espaço aéreo e, segundo o autor, foi demonstrado que as CTMs são capazes de inibir efetivamente a progressão da DPOC regulando o equilíbrio entre proteases e antiproteases.
Além disso, as CTMs agem de maneira imunomoduladora, esse efeito ocorre sob estimulo de fatores pró inflamatórios, as CTMs secretam mediadores imunomoduladores para inibir a atividade e proliferação de células T. Por exemplo, o crescimento de fator β (TGF-β), interleucina-6 (IL-6), prostaglandina E2 (PGE2) e exossomos podem inibir a ação pró-inflamatória proliferação de células imunes e função imune, e promover o aumento de células imunes anti-inflamatórias (Ma YM, Ma MZ, 2021)
Na literatura, evidencia-se que o enxerto de células-tronco adultas é raro. Os estudos demonstraram que o enxerto de epitélio das vias aéreas alveolares, com células-tronco derivadas da medula óssea adulta, acontece sob certas condições, geralmente após indução de lesão pulmonar prévia. Portanto, contatou-se que o enxerto é geralmente um evento raro de significado fisiológico incerto (SUEBLINVONG, V.; WEISS, D., 2010). Além disso, as células que não se enxertam nos tecidos frequentemente mostram supressão de respostas biológicas significativas (TORALDO, M; TORALDO, S; CONTE, 2018).
Além de todos os mecanismos terapêuticos das CTMs citados, a reparação do tecido pulmonar lesionado também é um grande foco dos pesquisadores, segundo Toraldo, Toraldo e Conte (2018), a recriação da arquitetura tridimensional do parênquima pulmonar in vitro para transplante têm sido um grande desafio para bioengenharia. Por conta disso, os muitos estudos atuais em camundongos têm se concentrado no conhecimento do desenvolvimento pulmonar, na esperança de que essa tecnologia possa ser transferida para pacientes que precisam de reparo pulmonar (TORALDO, M; TORALDO, S; CONTE, 2018).
O tratamento ainda está em desenvolvimento e existem poucos dados disponíveis sobre o valor de terapia pulmonar baseadas em células-tronco, portanto é difícil estimar os custos, em comparação a tratamentos com células-tronco para diferentes patologias, é possível prever valores altos. Nos EUA, por exemplo, simples injeções de células-tronco nas articulações podem custar quase US$ 1.000 e tratamentos mais avançados podem custar até US$ 100.000, dependendo da condição, da forma de cultivo e expansão celular. Os valores variam de acordo com a área e o problema a ser tratado, pois são necessários diferentes tipos de células, contagens e protocolos do tratamento (CONA, 2021).
5. CONCLUSÃO
A Doença Pulmonar Obstrutiva Crônica é uma doença obstrutiva das vias respiratórias que tem como principais sintomas dispneia e tosse podendo levar a óbito. Essa doença ocorre principalmente por exposição prolongada de gases tóxicos, tabagismo e deficiência na α-1antitripsina, que é uma proteína que interrompe a atuação das proteases pulmonares no processo inflamatório (GODOY, 2016). A DPOC não tem cura e os tratamentos têm como função melhorar o fluxo aéreo, porém as complicações geram custos altíssimos ao SUS. A única cura existente é o transplante de pulmão, mas pela necessidade de compatibilidade, disponibilidade e ser um procedimento invasivo se torna inviável para a grande maioria dos casos. Portanto, a busca de novas terapias é necessária para melhorar a vida dos portadores de DPOC e diminuir os custos com internações existentes (RUFINO, et al, 2013).
As terapias atuais visam melhorar a limitação do fluxo aéreo, mas não atuam sob a prevenção da destruição alveolar ou no declínio da capacidade de troca aérea (WANG et al, 2021). Desde o começo da pandemia do vírus SARs-CoV-2, houveram esforços a nível mundial para controlar o COVID-19, e com isso fez se necessário o desenvolvimento de novos tratamentos, tanto para tratar as complicações causadas pela SARs-CoV-2, para reduzir a mortalidade e melhorar os resultados clínicos (CHEN et al, 2022) como também desenvolver um tratamento curativo para a DPOC a partir de células-tronco. Tendo em vista que nos últimos anos, vários estudos demonstraram que a regeneração tecidual pode ser aplicada no tratamento de várias doenças pulmonares além da DPOC, como lesão pulmonar aguda, fibrose pulmonar idiopática, síndrome do desconforto respiratório agudo, câncer de pulmão e asma, por exemplo (CHEN et al, 2022).
Diversos estudos concluíram que o transplante de CTM derivadas da medula óssea, é capaz de reduzir significativamente a inflamação pulmonar e alterações patológicas em camundongos enfisêmicos, resultados estes, que envolvem a modulação da inflamação, apoptose e equilíbrio protease/antiprotease, o que torna o transplante de CTM uma estratégia potencialmente promissora no tratamento para DPOC (CHEN et al, 2022).
Entretanto, a carência de dados e segurança a longo prazo das CTMs em pacientes com DPOC é um dos principais obstáculos à aplicação clínica delas (PASSI, et al, 2020). Pois apesar das pesquisas mais avançadas não demonstrarem toxicidade de infusão ou atribuída à morte do paciente tratado durante 2 anos de acompanhamento, ensaios clínicos em larga escala ainda são necessários para avaliar cuidadosamente a eficácia e segurança a longo prazo do uso de CTMs (ZHAO, et al. 2014).
Devido a urgência por tratamentos ocasionada pelo atual cenário pandêmico, o ritmo das pesquisas está acelerado. Segundo Golchin (2021), no último semestre do ano de 2021, mais de 80 ensaios clínicos baseados em células foram iniciados para tratamentos contra a COVID-19, o que pode trazer soluções para algumas das questões apresentadas no parágrafo anterior.
É de conhecimento, que um dos principais problemas do tratamento com CTMs para a DPOC é o alto custo, diferentemente das terapias convencionais, as terapias celulares devem ser produzidas sob demanda, e apesar do progresso significativo, o uso clinico dessas células não é considerada uma opção custo-efetiva (CONA, 2021).
Portanto, o uso medicina regenerativa a partir do uso de células-tronco mesenquimais é promissora para o tratamento da DPOC e consequentemente tem potencial para melhorar a qualidade de vida dos pacientes que são portadores dela, porém há questões a serem esclarecidas e por isso necessitam de mais estudos antes de serem implementadas.
REFERÊNCIAS BIBLIOGRÁFICAS
ASSOCIAÇÃO BRASILEIRA DE TRANSPLANTE DE ÓRGÃOS. Dados Numéricos da doação de órgãos e transplantes realizados por estado e instituição no período: JANEIRO / SETEMBRO – 2021. RBT – Registro Brasileiro de Transplantes, São Paulo, n. 3, ed. Ano XXVII, 2021.
BRASIL, Cadernos de Atenção Básica – Doenças Respiratórias Crônicas. Secretaria de Atenção à Saúde, Departamento de Atenção Básica, Brasília: Ministério da Saúde, 2010. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/doencas_respiratorias_cronicas.pdf. Acesso em: 07 set. 2021
CENTER FOR DISEASE CONTROL AND PREVENTION (CDC). COPD among Adults in ALASKA. 2011. Disponível em: https://www.cdc.gov/copd/maps/docs/pdf/AK_COPDFactSheet.pdf. Acesso em: 20 ago. 2021
CHEN, F.; FINE, A. Stem Cells in Lung Injury and Repair, National Library of Medicine, 2016. Disponível em: https://pubmed.ncbi.nlm.nih.gov/27524796/. Acesso em: 13 set. 2021
CHEN, L.; QU, J.; KALYANI, F.S.; ZHANG, Q.; FAN, L.; FANG, Y.; LI, Y.; XIANG, C. Mesenchymal stem cell-based treatments for COVID-19: Status and future perspectives for clinical applications, Nature Cell Biology, 2022. Disponível em: https://link.springer.com/article/10.1007/s00018-021-04096y#citeas. Acesso em: 15 mar. 2022
CHEN, Y.; MIAO, K.; ZHOU, L. XIONG, W. Stem cell therapy for chronic obstructive pulmonary disease. Chinese Medical Journal, [S.L.], v. 134, n. 13, p. 1535-1545, 15 jun. 2021. Ovid Technologies (Wolters Kluwer Health). Disponível em: http://dx.doi.org/10.1097/cm9.0000000000001596. Acesso em: 13 mai. 2022
CRUZ, M. M.; PEREIRA, M. Epidemiologia da Doença Pulmonar Obstrutiva Crônica no Brasil: uma revisão sistemática e metanálise, Ciência & Saúde Coletiva, 2020. Disponível em: https://www.scielo.br/j/csc/a/Bk3RFBFzBmYxtmZP6HHZwYd/?lang=en. Acesso em: 20 mai. 2022
CONA, Louis A. The Cost of Stem Cell Therapy in 2022. 2021. Disponível em: https://es.dvcstem.com/post/stem-cell-therapy-cost-2020. Acesso em: 23 dez. 2021
COSTA, C.H.; RUFINO, R.; SILVA, J.R.L. Células inflamatórias e seus mediadores na patogênese da DPOC, Revista da Associação Médica Brasileira, 2009. Disponível em: https://www.scielo.br/j/ramb/a/nRMcHBnm9Wrp8xsKFQP9Kqm/?lang=pt. Acesso em: 20 set. 2021
DOMINICI, M.; LE BLANC, K.; MULLER, I.; SLAPER-CORTENBACH, I.; MARINI, F.; KRAUSE, D.; DEANS, R.; KEATING, A.; PROCKOP, D.; HORWITZ, E. Critérios mínimos para definir células estromais mesenquimais multipotentes. Declaração de posição da Sociedade Internacional de Terapia Celular, 2006. Disponível em: https://pubmed.ncbi.nlm.nih.gov/16923606/. Acesso em: 01 mar. 2022
DOURADO, V.Z.; TANNI, S.E.; VALE, S.A.; FAGANELLO, M.M.; SANCHEZ, F, F.; GODOY, Manifestações sistêmicas na doença pulmonar obstrutiva crônica, Jornal Brasileiro de Pneumologia, 2006. Disponível em: https://www.scielo.br/j/jbpneu/a/tBx4LPB6g5zZHLbdRzCnsRs/?lang=pt. Acesso em: 8 out. 2021
EITELVEN, Tatiane et al. Aplicações Biológicas de Células-tronco: Benefícios e Restrições. Revista Interdisciplinar de Ciência Aplicada, [S. L.], v. 2, n. 3, p. 13-20, maio 2017. Disponível em: https://sou.ucs.br/revistas/index.php/ricaucs/article/view/31/24. Acesso em: 22 mai. 2022
ESENDAGLI, D.; OZCAN, A.G. From Stem Cell Biology to The Treatment of Lung Diseases, National Library of Medicine, 2017. Disponível em: https://pubmed.ncbi.nlm.nih.gov/28545380/. Acesso em: 8 out. 2021
FEKETE, Monika; SZARVAS, Zsofia; FAZEKAS-PONGOR, Vince; FEHER, Agnes; DOSA, Norbert; LEHOCZKI, Andrea; TARANTINI, Stefano; VARGA, Janos Tamas. COVID-19 infection in patients with chronic obstructive pulmonary disease: from pathophysiology to therapy. mini-review. Physiology International, [S.L.], v. 109, n. 1, p. 9-19, 10 mar. 2022. Akademiai Kiado Zrt. Disponível em: https://akjournals.com/view/journals/2060/109/1/article-p9.xml. Acesso em: 18 mai. 2022
FLORENTINO, Alvaro Deangelles Pereira. AVALIAÇÃO DA CICATRIZAÇÃO DA CARTILAGEM TROCLEAR POR MEIO DE MICROSCOPIA DE LUZ EM RATOS (WISTAR) UTILIZANDO ENXERTOS AUTÓLOGOS DO APÊNDICE XIFÓIDE, CARTILAGEM E OSSO SUBCONDRAL. 2018. 65 f. Dissertação (Mestrado) – Curso de Mestrado em Ciência Animal Tropical, Universidade Federal Rural de Pernambuco, Recife, 2018. Disponível em: http://www.pgcat.ufrpe.br/sites/pgcat.ufrpe.br/files/documentos/dissertacao_alvaro_deangelles_pereira_florentino.pdf. Acesso em: 01 mar. 2022
FREEMAN, B.J.; STARKEY, M.R. Bronchioalveolar Stem Cells in Lung Repair, Regeneration and Disease, National Library of Medicine, 2020. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32737996/. Acesso em: 5 set. 2021
GERAYELI, Firoozeh V.; MILNE, Stephen; CHEUNG, Chung; LI, Xuan; YANG, Cheng Wei Tony; TAM, Anthony; CHOI, Lauren H.; BAE, Annie; SIN, Don D. COPD and the risk of poor outcomes in COVID-19: a systematic review and meta-analysis. Eclinicalmedicine, [S.L.], v. 33, p. 100789, mar. 2021. Elsevier BV. http://dx.doi.org/10.1016/j.eclinm.2021.100789. Disponível em: https://www.sciencedirect.com/science/article/pii/S2589537021000699. Acesso em: 15 mai. 2022
GODOY, Irma. Prevalência da deficiência de alfa-1 antitripsina na DPOC. Jornal Brasileiro de Pneumologia. [S.I], p. 307-308. out. 2016. Disponível em: https://cdn.publisher.gn1.link/jornaldepneumologia.com.br/pdf/completo_v42n 5_PT.pdf. Acesso em: 24 mai. 2022.
GOLCHIN, A. Cell-Based Therapy for Severe COVID-19 Patients: Clinical Trials and Cost-Utility, Stem Cell Rev and Rep, 2021. Disponível em: https://link.springer.com/article/10.1007/s12015-020-10046-1#citeas. Acesso em 06 abr. 2022.
GUTIERREZ, T.M; ARAUJO, I.; MORALES, M.M.; GARCIA, C.S.N.B.; ROCCO, P.R.M. Terapia com Células-Tronco na Síndrome do Desconforto Respiratório Agudo, Revista Brasileira de Terapia Intensiva, 2009. Disponível em: https://www.scielo.br/j/rbti/a/KDQG9cFWhhStsssdvK66sJf/abstract/?lang=pt. Acesso em: 8 out. 2021
HAN, J.; LIU, Y.; LIU, H.; LI, Y. Genetically Modified Mesenchymal Stem Cell Therapy for Acute Respiratory Distress Syndrome, National Library of Medicine, 2019. Disponível em: https://pubmed.ncbi.nlm.nih.gov/31843004/. Acesso em: 20 ago. 2021
HACKETT, T.L.; KNIGH, D.A.; SIN, D.D.; Potential role of stem cells in management of COPD, National Library of Medicine, 2010. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2865028/. Acesso em: 20 set. 2021
ISTOE, R.S.C.; MANHÃES, F.C.; SOUZA, C.H.M. Envelhecimento humano, inovação e criatividade: diálogos interdisciplinares, Brasil Multicultural, 2020. Disponível em: https://encontrografia.com/wp-content/uploads/2020/03/ebook-Envelhecimento-humano.pdf#page=305. Acesso em: 13 jan. 2022
JANZ, Felipe de Lara. Células tronco mesenquimais: definição, características e principais fontes de obtenção. 2018. 14 f. Tese (Doutorado) – Curso de História da Ciência, Universidade de São Paulo, São Paulo, 2018. Disponível em: https://portal.unisepe.com.br/unifia/wpcontent/uploads/sites/10001/2018/06/034_celulas_tronco_mesenquimais.pdf. Acesso em: 21 mar. 2022
JUNQUEIRA, L. C.; CARNEIRO, J. Histologia básica. 13ª edição. Rio de Janeiro – RJ: Guanabara Koogan, 2017.
KAMARUZAMAN, N.A.; KARDIA, E.; KAMALDIN, N.A.; LATAHIR, A.Z.; YAHAYA, B.H. The Rabbit as a Model for Studying Lung Disease and Stem Cell Therapy, National Library of Medicine, 2013. Disponível em: https://pubmed.ncbi.nlm.nih.gov/23653896/. Acesso em: 20 ago. 2021
KIM, Hee Jung; PARK, Jeong-Soo. Usage of Human Mesenchymal Stem Cells in Cell-based Therapy: advantages and disadvantages. Development & Reproduction, [S.L.], v. 21, n. 1, p. 1-10, mar. 2017. Korean Society of Developmental Biology. Disponível em: http://dx.doi.org/10.12717/dr.2017.21.1.001. Acesso em: 02 fev. 2022
KOLIOS, G.; MOODLEY, Y. Introduction to Stem Cells and Regenerative Medicine, National Library of Medicine, 2012. Disponível em: https://pubmed.ncbi.nlm.nih.gov/23257690/. Acesso em: 5 set. 2021
KUBO, H. Concise Review: Clinical Prospects for Treating Chronic Obstructive Pulmonary Disease with Regenerative Approaches, National Library of Medicine, 2012. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3659729/ Acesso em: 8 out. 2021
LEAL, Lisiane Freitas; BERTOLDI, Andrea Dâmaso; MENEZES, Ana Maria Baptista; BORGES, Rogério Boff; MENGUE, Sotero Serrate; GAZZANA, Marcelo Basso; PIZZOL, Tatiane da Silva dal. Indicação, acesso e utilização de medicamentos para doenças respiratórias crônicas no Brasil: resultados da pesquisa nacional sobre acesso, utilização e promoção do uso racional de medicamentos no brasil (pnaum), 2014. Cadernos de Saúde Pública, [S.L.], v. 34, n. 10, p. 1-13, 11 out. 2018. FapUNIFESP (SciELO). http://dx.doi.org/10.1590/0102-311×00208217. Disponível em: https://www.scielosp.org/article/csp/2018.v34n10/e00208217/pt/#:~:text=Para%20DPOC%2C%20em%202012%2C%20passaram,e%20salmeterol%20(broncodilatadores%20inalat%C3%B3rios). Acesso em: 24 mai. 2022
LEE, Sang Chul; SON, Kang Ju; HAN, Chang Hoon; PARK, Seon Cheol; JUNG, Ji Ye. Impact of COPD on COVID-19 prognosis: a nationwide population-based study in south korea. Scientific Reports, [S.L.], v. 11, n. 1, 12 fev. 2021. Springer Science and Business Media LLC. http://dx.doi.org/10.1038/s41598-021-83226-9. Disponível em: https://www.nature.com/articles/s41598-021-83226-9#citeas Acesso em: 17 mai. 2022
LENOCH, Camila Yamaguti. ESTRATÉGIAS PARA CRIOPRESERVAÇÃO DE CÉLULAS TRONCO MESENQUIMAIS DE TECIDO ADIPOSO BOVINO. 2015. 87 f. Dissertação (Mestrado) – Curso de Mestrado em Ciência Animal, Universidade do Estado de Santa Catarina, Lages, 2015. Disponível em: https://www.udesc.br/arquivos/cav/id_cpmenu/1286/CAMILA_dissertacao_versao_digital_camila_yamaguti_lenoch_15671751390354_1286.pdf Acesso em: 20 fev. 2022
LEUNG, Janice M.; NIIKURA, Masahiro; YANG, Cheng Wei Tony; SIN, Don D. COVID-19 and COPD. European Respiratory Journal, [S.L.], v. 56, n. 2, p. 2002108, ago. 2020. European Respiratory Society (ERS). http://dx.doi.org/10.1183/13993003.02108-2020. Disponível em: https://erj.ersjournals.com/content/56/2/2002108 Acesso em: 15 mai. 2022
LOPES, A.; SINCLAIR, A.; FROHLICH, B. Cost Analysis of Cell Therapy Manufacture: autologous cell therapies, part 1. Bioprocess Internacional, [S.I.], 27 mar. 2018. Disponível em: https://bioprocessintl.com/manufacturing/cell-therapies/analysis-cost-of-celltherapy-manufacturing-autologous-cell-therapies-part-1/. Acesso em: 05 maio 2022.
LIPSI, R.; ROGLIANI, P.; CALZETTA, L.; SEGRETI, A.; CAZZOLA, M. The Clinical Use of Regenerative Therapy in COPD, National Library of Medicine, 2014. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4271722/ Acesso em: 10 out. 2021
MA, Y. MA, M . Células- tronco mesenquimais estão sendo usadas em várias doenças – Perspectivas de tratamento na DPOC- Pesquisa em Microambiente e Microecologia, TRM Journals, 2021. Disponível em: https://www.tmrjournals.com/public/articlePDF/20210924/f1308b7313bdfff23125890599409fbc.pdf. Acesso em: 26 abr. 2022
MARCON, Bruna Hilzendeger. RIBOSOME PROFILING: APLICAÇÃO NO ESTUDO DO PROCESSO DE DIFERENCIAÇÃO DE CÉLULAS-TRONCO OBTIDAS DE TECIDO ADIPOSO HUMANO. 2014. 108 f. Dissertação (Mestrado) – Curso de Mestrado em Biociências e Biotecnologia, Instituto Carlos Chagas, Curitiba, 2014. Disponível em: https://www.arca.fiocruz.br/bitstream/icict/8966/2/Disserta%C3%A7%C3%A3o%20Bruna%20Hilzendeger%20Marcon.pdf. Acesso em: 09 mai. 2022
MUSHAHARY, D.; SPITTLER, A.; KASPER, C.; WEBWE, V.; CHARWAT, V. Isolation, cultivation, and characterization of human mesenchymal stem cells, Cytometry Part A, 2017. Disponível em: https://onlinelibrary.wiley.com/doi/full/10.1002/cyto.a.23242?casa_token=PfrGpACjei8AAAAA%3AU-BWurQpiSuGeSYkbjwiLDmN5onMk-RvJF5A_QuDb7cu9zN89GS9ji83wWaI6PcKSwFacS6FniLgaR-XFA. Acesso em 10 abr. 2022
O USO TERAPÊUTICO DE CÉLULAS TRONCO. Indaiatuba: Revista Saúde em Foco, v. 11, 2019. Disponível em: https://portal.unisepe.com.br/unifia/wpcontent/uploads/sites/10001/2019/11/O-USO-TERAP%C3%8AUTICO-DEC%C3%89LULAS-TRONCO-1291-a-1302.pdf. Acesso em: 13 nov. 2021
PAES, J.T.R; BILAQUI, A.; GRECO, O.T.; RUIZ, M.A.; MORAES, L.B.C.A.; FARIA C.A.; STESSUK, T. Terapia Celular em Doenças Pulmonares: Existem Perspectivas? Revista Brasileira de Hematologia e Hemoterapia, 2009. Disponível em: https://www.scielo.br/j/rbhh/a/RjXWLJrtMCN8Z53YZtSrLmg/?lang=pt. Acesso em: 7 nov. 2021
PASSI, M.; SHAHID, S.; CHOCKALINGAM, S.; SUNDAR, I.K.; PAKIRISAMY, G. Abordagens Convencionais e Baseadas em Nanotecnologia para Combater a Doença Pulmonar Obstrutiva Crônica: Implicações para Doenças Crônicas das Vias Aéreas, International Journal of Nanomedicine, 2020. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7266405/. Acesso em: 23 abr. 2022
PEREIRA, L.V. A importância do uso das células tronco para a saúde pública, Ciência & Saúde Coletiva, 2008. Disponível em: https://www.scielo.br/j/csc/a/Jxx3B5stXPw4L9t5LVrxszq/?lang=pt. Acesso em: 15 out.2021
POLVERINO, Francesca; KHERADMAND, Farrah. COVID-19, COPD, and AECOPD: immunological, epidemiological, and clinical aspects. Frontiers In Medicine, [S.L.], v. 7, p. 0-0, 18 jan. 2021. Disponível em: https://www.frontiersin.org/articles/10.3389/fmed.2020.627278/full. Acesso em: 10 mai. 2022
RAMÍREZ, P.H. Medicina regenerativa e aplicações de células-tronco: uma nova revolução na medicina, Revista cubana de medicina, 2011. Disponível em: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75232011000400001. Acesso em 16 mai. 2022
RANDELL, S. H. Airway Epithelial Stem Cells and the Pathophysiology of Chronic Obstructive Pulmonary Disease. Proceedings Of The American Thoracic Society, [S.L.], v. 3, n. 8, p. 718-725, 1 nov. 2006. American Thoracic Society. http://dx.doi.org/10.1513/pats.200605-117sf. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2647659/. Acesso em: 10 mai. 2022
REDE NACIONAL DE TERAPIA CELULAR – RNTC. O que são células-tronco? Disponível em: http://www.rntc.org.br/ceacutelulas-tronco.html. Acesso em: 14 jan. 2022
REVISTA SAÚDE EM FOCO. Indaiatuba, Sp: Centro Universitário Max Planck, v. 11, 2019. Disponível em: https://portal.unisepe.com.br/unifia/wpcontent/uploads/sites/10001/2019/11/O-USO-TERAP%C3%8AUTICO-DEC%C3%89LULAS-TRONCO-1291-a-1302.pdf. Acesso em: 23 mar. 2022
RUFINO, Rogério; COSTA, Cláudia Henrique da. Patogenia da doença pulmonar obstrutiva crônica. Hupe, Rio de Janeiro, v. 12, n. 1, p. 1-14, abr. 2013. Disponível em: https://www.epublicacoes.uerj.br/index.php/revistahupe/article/view/8495. Acesso em: 15 mai. 2022
SANTANA-NETA, Dulce de. Avaliação do potencial terapêutico das células-tronco mesenquimais de medula óssea e do meio condicionado em modelo experimental de enfisema pulmonar. 2015. 57 f. Monografia (Especialização) – Curso de Medicina, Universidade Federal da Bahia, Salvador, 2015. Disponível em: https://repositorio.ufba.br/bitstream/ri/18236/1/Dulce%20de%20Santana_Neta.pdf. Acesso em: 02 abr. 2022
SAÚDE BRASIL 2018. Brasília – Df: Departamento de Vigilância de Doenças e Agravos Não Transmissíveis e Promoção da Saúde, v. 1, 2019. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/saude_brasil_2018_analise_situacao_saude_doencas_agravos_cronicos_desafios_perspectivas.pdf. Acesso em: 01 abr. 2022
SHAH, Kiran; SHAH, Nirali; GHASSEMI, Fatameh; LY, Carolyn; GEORGE, Teena; LUTZ, Carla; SUMER, Huseyin. Alloreactivity of Allogeneic Mesenchymal Stem/Stromal Cells and Other Cellular Therapies: a concise review. Stem Cells International, [S.L.], v. 2022, p. 1-8, 9 mar. 2022. Hindawi Limited. http://dx.doi.org/10.1155/2022/9589600. Disponível em: https://www.hindawi.com/journals/sci/2022/9589600/. Acesso em: 02 abr. 2022
SONG, J.; ZENG, M.; WANG, H.; QIN, C.; HOU, H.; SUN, Z.; XU, S.; WANG, G.; GUO, C.; DENG, Y.; WANG, Z.; MA, J.; PAN, L.; LIAO, B.; DU, Z.; FENG, Q.; LIU, Y.; XIE, J.; LIU, Z. Distinct effects of asthma and COPD comorbidity on disease expression and outcome in patients with COVID-19, European Journal of Allergy and Clinical Immunology, 2020. Disponível em: https://onlinelibrary.wiley.com/doi/full/10.1111/all.14517. Acesso em: 14 mai. 2022
SOUZA, Alex Sandro Rolland; AMORIM, Melania Maria Ramos; MELO, Adriana Suely de Oliveira; DELGADO, Alexandre Magno; FLORENCIO, Anna Catharina Magliano Carneiro da Cunha; OLIVEIRA, Thaise Villarim de; LIRA, Lara Caline Santos; SALES, Lucas Martins dos Santos; SOUZA, Gabriela Albuquerque; MELO, Brena Carvalho Pinto de. General aspects of the COVID19 pandemic. Revista Brasileira de Saúde Materno Infantil, [S.L.], v. 21, n.1, p. 29-45, fev. 2021. FapUNIFESP (SciELO). http://dx.doi.org/10.1590/1806-9304202100s100003. Disponível em: https://www.scielo.br/j/rbsmi/a/8phGbzmBsSynCQRWjpXJL9m/?lang=pt. Acesso em: 20 mai. 2022
SUEBLINVONG, V.; WEISS, D.J. Stem Cells and Cell Therapy Approaches in Lung Biology and Diseases, National Library of Medicine, 2010. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4201367/. Acesso em: 7 out. 2021
TORALDO, Domenico Maurizio; TORALDO, Sara; CONTE, Luana. The Clinical Use of Stem Cell Research in Chronic Obstructive Pulmonary Disease: A Critical Analysis of Current Policies. Journal Of Clinical Medicine Research.
UDER, C.; BUCKNER, S.; TAUTENHAHN, W.; CHRIST, B. Mammalian MSC from selected species: Features and applications, Cytometry part A, 2017. Disponível em: https://onlinelibrary.wiley.com/doi/10.1002/cyto.a.23239. Acesso em: 02 mar. 2022
UNIVERSIDADE FEDERAL DE ALFENAS (Minas Gerais) (org.). Sistema Respiratório. Disponível em: https://www.unifal-mg.edu.br/histologiainterativa/sistema-respiratorio/. Acesso em: 24 mai. 2022.
WANG, Xiaofan; ZHAO, Yu; LI, Dandan; FENG, Yun; XIE, Yusang; ZHOU, Yueqing; ZHOU, Min; WANG, Yujia; QU, Jieming; ZUO, Wei. Intrapulmonary distal airway stem cell transplantation repairs lung injury in chronic obstructive pulmonary disease. Cell Proliferation, [S.L.], v. 54, n. 6, 7 maio 2021. Disponível em: https://onlinelibrary.wiley.com/doi/full/10.1111/cpr.13046. Acesso em: 10 mai. 2022.
WEISS, D.J. Current Status of Stem Cells and Regenerative Medicine in Lung Biology and Diseases, National Library of Medicine, 2014. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4208500/ Acesso em: 10 out. 2021
WORLD HEALTH ORGANIZATION. Tobacco. Disponível em: at: https://www.who.int/news-room/fact-sheets/detail/tobacco. Acesso em: 25 abr. 2022
ZAKRZEWSKI, W.; DOBRZYNSKI, M.; SZYMONOWICZ, M.; RYBAK, Z. Células-tronco: passado, presente e futuro, [S.I.], 2019. Disponível em: https://link.springer.com/article/10.1186/s13287-019-1165-5#article-info. Acesso em: 13 jan. 2022
ZHAO, Y.; XU, A.; XU, Q.; ZHAO, W.; 1 LI, D.; FANG, X.; REN, Y. Transplante de células-tronco mesenquimais de medula óssea para tratamento de ratos enfisêmicos, International Journal of Clinical and Experimental Medicine, 2014. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4057848/ Acesso em: 19 abr. 2022
ZUTTION, M.S.S.R.; WENCESLAU, C.V.; LEMOS, P.A.; TAKIMURA, C.; KERKIS, I. Células-Tronco de Tecido Adiposo e a Importância da Padronização de um Modelo Animal para Experimentação Pré-Clínica. Revista Brasileira de Cardiologia Invasiva, 2013. Disponível em: https://www.scielo.br/j/rbci/a/cZgzrGLxRc7v8BhFXdKNjvn/?format=pdf&lang=pt Acesso em: 08 mar. 2022
1Discente da Universidade Anhembi Morumbi, São Paulo / SP, Brasil.
2Discente da Universidade Anhembi Morumbi, São Paulo / SP, Brasil.
3Discente da Universidade Anhembi Morumbi, São Paulo / SP, Brasil.
4Docente da Universidade Anhembi Morumbi, São Paulo / SP, Brasil.
