USE OF AN AMEROID CONSTRICTOR RING TO CORRECT A CONGENITAL EXTRAHEPATIC PORTOSYSTEMIC SHUNT PORTO AZYGOS: CASE REPORT
REGISTRO DOI: 10.69849/revistaft/cl10202508141708
Luís Alfredo Pinheiro da Costa1; Luciano Dolzany de Godoy2; Jessica Stephany Moreira Borges3; Andressa de Cassia Martini Mendes4; Maisa Cristina Petruzza Carvalho5; Renata Alves Soares6; Laura Garcia Cunha7; Maria Clara Caiado Amaral Rodrigues8; Bárbara Franco Bueno Fernandes9; Leticia Ferreira Sousa10; Carlos Eduardo Fontoura da Silva11; Cindy Stefhani dos Santos Silva12; Marcella Alves Ferreira Leão13; Mariana Gimenes Santos14; Amanda Ludovico Dantas Estivallet15
Resumo: Os shunts portossistêmicos congênitos extra-hepáticos são anomalias vasculares que desviam o sangue da veia porta diretamente para a circulação sistêmica, comprometendo a função hepática. Essa condição resulta na falha do fígado em metabolizar toxinas como a amônia, o que pode desencadear encefalopatia hepática, especialmente em cães de raças pequenas. Este estudo teve como objetivo relatar um caso clínico de shunt portossistêmico congênito extra-hepático do tipo porto ázigos em um cão, abordando o diagnóstico e a correção cirúrgica com a utilização de anel constritor ameróide. Trata-se de um cão macho, sem raça definida, de sete meses de idade, que apresentava sinais neurológicos compatíveis com encefalopatia hepática. Foram realizados exames complementares de imagem e laboratoriais que puderam reportar o diagnóstico de shunt porto ázigos único. O animal foi submetido à estabilização clínica e, posteriormente, à cirurgia para implantação de anel ameróide no vaso anômalo, promovendo a oclusão gradual do desvio. O pós-operatório incluiu suporte nutricional, hepatoprotetores, dieta hepática, monitoramento laboratorial e por imagem. Os resultados foram satisfatórios, com melhora clínica progressiva. Conclui-se que o uso do anel constritor ameróide é uma alternativa segura e eficaz para o tratamento definitivo de shunts portossistêmicos congênitos extra-hepáticos, promovendo a restauração funcional do fígado e melhora do quadro neurológico. O diagnóstico precoce, aliado a uma abordagem multidisciplinar, é essencial para o sucesso terapêutico e prognóstico favorável.
Palavras-chave: Anomalia vascular congênita, construção gradual, encefalopatia hepática e lactulona.
Abstract: Congenital extrahepatic portosystemic shunts are vascular anomalies that divert blood from the portal vein directly into the systemic circulation, compromising liver function. This condition results in the liver’s failure to metabolize toxins such as ammonia, which can trigger hepatic encephalopathy, especially in small breed dogs. The aim of this study was to report a clinical case of a congenital extrahepatic portosystemic shunt in a dog, looking at the diagnosis and surgical correction using an ameroid constrictor ring. This was a seven-month-old male dog of no defined breed, who presented with neurological signs compatible with hepatic encephalopathy. Complementary imaging and laboratory tests were carried out, which led to the diagnosis of a single portoazygos shunt. The animal underwent clinical stabilization and then surgery to implant an ameroid ring in the anomalous vessel, promoting gradual occlusion of the shunt. The post-operative period included nutritional support, hepatoprotectants, a liver diet and laboratory and imaging monitoring. The results were satisfactory, with progressive clinical improvement. It is concluded that the use of the ameroid constrictor ring is a safe and effective alternative for the definitive treatment of extrahepatic congenital portosystemic shunts, promoting functional restoration of the liver and improvement of the neurological condition. Early diagnosis, combined with a multidisciplinary approach, is essential for therapeutic success and a favorable prognosis.
Keywords: Congenital vascular anomaly, gradual construction, hepatic encephalopathy and lactulone.
INTRODUÇÃO
Os shunts portossistêmicos (SPS) são distúrbios vasculares hepatobiliares que se caracterizam por desviar o sangue da veia porta por meio de um vaso anômalo para algum outro vaso de circulação sistémica, como veia cava ou ázigos majoritariamente (Nelson e Couto, 2015). Estes podem ser congênitos, sendo mais incidente a presença de um único vaso anômalo extra-hepático, entretanto apresentações intra-hepáticas podem ocorrer (Fossum, 2015). Os SPS também podem ser adquiridos no decorrer da vida, sendo secundário a um quadro de hipertensão da veia porta, que por sua vez, decorre de um processo de cirrose hepática, estes tendem a ser múltiplos e extra-hepáticos, não sendo possível tratamento cirúrgico. Em geral o SPS é considerado uma patologia incomum e subdiagnosticada, mesmo sendo a doença congênita vascular mais frequente do sistema hepatobiliar em cães (Ettinger e Feldman, 2022).
Em um animal normal o sangue oriundo de intestinos, estômago, baço e pâncreas são direcionados para a veia porta, que por sua vez entra no parênquima hepático, se ramificando e sendo um dos componentes da tríade portal dos lóbulos hepáticos. No lóbulo o sangue passa pelos sinusóides até a veia central na qual desemboca na veia cava caudal, saindo do parênquima (Dyce, 2010). Os hepatócitos, unidade funcional do fígado, fazem suas variadas funções, são elas; síntese de proteínas plasmáticas e fatores de coagulação, armazenamento de glicogênio, síntese de bile e ácidos biliares, biotransformação de fármacos (I e II) e metabólitos, ciclo da ureia, função detoxificação corporal e pode realizar hemocaterese se necessário (Canani, 2013).
Quando ocorre um shunt portossistêmico, o sangue que normalmente seria direcionado ao fígado é desviado para a circulação sistêmica, resultando em diversas repercussões para o organismo. A ausência do aporte sanguíneo hepático reduz a chegada de hormônios pancreáticos, como insulina e glucagon, comprometendo o metabolismo, o armazenamento de nutrientes e diversas funções hepáticas. Com o tempo, essa disfunção pode evoluir para insuficiência hepática e atrofia do órgão (Ettinger e Feldman, 2022).
As repercussões sistêmicas do SPS estão associadas ao acúmulo de substâncias tóxicas na circulação, sendo a amônia (NH₃) a principal molécula envolvida. Por ser instável, altamente solúvel e capaz de atravessar a barreira hematoencefálica, a amônia contribui diretamente para a manifestação dos sinais clínicos do SPS, culminando em um quadro conhecido como encefalopatia hepática (EH) (Santos, 2018; Thrall et al., 2024).
A EH é a principal síndrome neurológica associada ao shunt, estando diretamente relacionada à hiperamonemia e à toxicidade para o sistema nervoso central (SNC). A amônia atua no córtex cerebral como antagonista dos receptores GABA e agonista dos receptores NMDA, resultando em um aumento da excitabilidade cortical (Stefanescu et al., 2025). Como consequência, os sinais clínicos clássicos da EH incluem crises epilépticas, incoordenação, tremores, amaurose, head pressing e outras alterações comportamentais (Nelson e Couto, 2015). A gravidade e a frequência dos sinais clínicos estão diretamente relacionadas ao nível de exposição à amônia, o que, por sua vez, depende do calibre do vaso anômalo, da ingestão proteica na dieta, do tipo de shunt presente e de outros fatores. Em casos de hepatite crônica a EH se manifesta quando há perda de pelo menos 70% da função hepática (Ettinger e Feldman, 2022).
Em relação à epidemiologia, entre 66% e 75% dos shunts portossistêmicos (SPS) são congênitos, únicos e de localização extra-hepática, sendo mais frequentemente observados em cães de raças toy (Fossum, 2015). Os shunts intra-hepáticos tendem a acometer raças de grande porte, enquanto os extra-hepáticos são mais comuns em raças de pequeno porte (Santos, 2018). De acordo com Paepe (2009), as raças com maior predisposição incluem Yorkshire Terrier, Havanês, Maltês, Pug, Schnauzer e Dachshund. Não foi observada associação significativa entre a ocorrência de SPS e o sexo dos animais. Em gatos, os casos congênitos são raros, e, quando presentes, geralmente correspondem a shunts extra-hepáticos únicos (Ettinger e Feldman, 2022).
O shunt portossistêmico congênito extra-hepático é a apresentação do distúrbio mais incidente segundo a literatura, sendo comum que cães apresentem sinais clínicos durante os primeiros meses de vida, se enquadrando como uma doença de animal jovem (Pedro et al., 2011). Os sinais clínicos variam de acordo com a gravidade do desvio sanguíneo e a capacidade do fígado de metabolizar toxinas, estes podem ser neurológicos, gastrointestinais e urinários, presentes geralmente após a alimentação (Soares et al., 2024).
Entre os sinais mais frequentes, destacam-se crises epilépticas e alterações comportamentais, como deambulação compulsiva, amaurose e head pressing, todos indicativos de uma localização neurológica central, com foco em estruturas cerebrais. Além disso, podem ocorrer sinais relacionados ao tronco encefálico, como déficits de nervos cranianos, rebaixamento do nível de consciência e síndrome vestibular (De Lahunta e Glass, 2016). Em geral, os sinais neurológicos são os mais incidentes em shunts, estando presente em aproximadamente 95% dos casos (Jericó et al., 2015). Em geral, os sinais clínicos tendem a se manifestar ou intensificar após a alimentação (Ernandes, 2018).
Para levantar a suspeita de shunt portossistêmico, deve-se realizar uma triagem inicial, avaliando cuidadosamente o histórico do animal, os sinais clínicos e uma anamnese minuciosa. Essa avaliação deve ser complementada com exames laboratoriais, como hemograma, urinálise, bioquímica sérica com ênfase em parâmetros de função hepática, incluindo ácidos biliares (Camargo et al., 2019). Após a triagem diagnóstica, o diagnóstico definitivo é obtido por meio da tomografia computadorizada, que permite a visualização direta do vaso anômalo (Takeuchi, 2025). Outra técnica que pode ser utilizada tanto para triagem diagnóstica quanto para acompanhamento pós-operatório é a ultrassonografia Doppler, sendo uma ferramenta útil para monitorar a oclusão gradual do shunt (Feliciano, 2019).
O tratamento do shunt portossistêmico congênito extra-hepático envolve tanto abordagens clínicas quanto cirúrgicas, sendo fundamental a associação entre ambas, uma vez que se complementam (Fossum, 2015). A terapia clínica inclui o uso de rações com proteínas de alta digestibilidade, lactulona, hepatoprotetores e, quando necessário, terapia antiepiléptica, sendo o brometo de potássio o fármaco de escolha. O uso de antibióticos também pode ser considerado em casos de encefalopatia hepática para reduzir microbiota produtoras de amônia em intestinos (Brunetto, 2007; Brum et al., 2007; Podell et al., 2015; Webster et al., 2019; Ettinger e Feldman, 2022; Freitas et al., 2023).
O tratamento definitivo do shunt portossistêmico congênito extra-hepático consiste na oclusão gradual do vaso anômalo. A obstrução total e imediata não é recomendada devido à alta relação com mortalidade (Medeiros; Correia; Moraes, 2023). Desse modo, a oclusão gradual é preferível, sendo duas técnicas cirúrgicas preferíveis; a colocação de uma banda de celofane e o uso do anel constritor ameróide, sendo a técnica padrão ouro (Fossum, 2015). Desse modo, o presente trabalho tem como objetivo relatar um caso de shunt portossistêmico congênito extra-hepático do tipo porto ázigo em um cão submetido à implantação de anel constritor ameróide para correção cirúrgica.
MATERIAIS E MÉTODOS
Foi atendido no setor de neurologia de um hospital veterinário privado um cão, macho, yorkshire, com aproximadamente 5 meses de idade e 3 kg de peso. A queixa apresentada pelos tutores foi a presença de um tipo de distúrbio neurológico e inapetência. Segundo estes, o animal apresentava andar compulsivo, pressionava a cabeça contra a parede (head pressing) e demonstrava incoordenação quando chamado. Os episódios ocorriam de três a quatro vezes por semana e, geralmente, durava de cinco a seis horas, isto desde os primeiros meses de vida e que os sinais observados se intensificavam após as refeições.
Ao exame físico geral o animal apresentou comportamento e consciência reduzida, escore corporal 3%, postura normal, mucosas normocoradas, tempo de preenchimento capilar (TPC) menor que 2 segundos, normohidratado, frequências cardíaca e respiratória normofonéticas e dentro dos valores de referência, temperatura de 38.1 °C, palpação abdominal e torácica sem sinais de alterações ou algia. No que se diz acerca da avaliação neurológica, o animal se manteve com estado de consciência reduzido, em ataxia proprioceptiva e tetraparesia ambulatorial com reflexos mantidos nos quatro membros. Na avaliação dos nervos cranianos, apresentou resposta à ameaça negativa bilateral, no reflexo foto pupilar tendeu-se a miose do olho alvo e seu contralateral no reflexo foto pupilar, sugestivo então de uma lesão em facial e não óptico, confirmado pela ausência de reflexo palpebral, a sensibilidade nasal se encontrava reduzida bilateralmente. Os reflexos segmentares e palpação epaxial se mantiveram dentro da normalidade e por fim o teste de propriocepção evidenciou-se reduzido nos 4 membros.
Foram solicitados exames complementares laboratoriais para triagem, sendo hemograma completo no qual se mostrou dentro da normalidade. Os exames de bioquímicas séricas seguem abaixo (Quadro 1).
Quadro 1. Valores de bioquímicas séricas solicitadas para o paciente do estudo.
Fonte: Thrall (2024)
A urinálise também foi solicitada. A densidade se encontrou isostenúrica e aspecto levemente turvo ao exame físico. Na análise química, o pH encontrava-se dentro dos valores de referência, porém foram observadas alterações significativas, como presença de hemácias (4+), proteínas (4+) e bilirrubinas (3+). Já na sedimentoscopia, identificaram-se hemácias, cristais de estruvita (4+) e de biurato de amônio (4+), alteração sugestiva de shunts portossistêmicos.
Devido ao aumento dos ácidos biliares, associado aos sinais clínicos apresentados, foi levantada a suspeita de um shunt portossistêmico. Desse modo, o animal foi encaminhado para tomografia computadorizada (TC) com contraste. Os resultados, evidenciaram a presença de estrutura vascular de trajeto tortuoso, desvio do tipo porto-ázigos, com confluência da veia esplênica e veia gástrica esquerda, microhepatia, congestão da veia ázigos e achados sugestivos de hipertensão portal (Figs. 1 e 2).
Figura 1: Imagem tomográfica que evidenciou a presença de estrutura vascular de trajeto tortuoso), oriunda da face lateral esquerda da veia porta-hepática (D), com afluência da veia esplênica (C) e gástrica esquerda ao vaso (A), se estendendo cranialmente e dorsalmente em direção e desembocando em face ventral da veia ázigos em altura de T13.
Fonte: Arquivo pessoal, 2025
Figura 2: Imagem tomográfica evidenciando vaso anômalo congesto (shunt), possuindo espessura de 0,60 cm com destino a veia ázigos.
Fonte: Arquivo pessoal, 2025.
Diante disso, iniciou o tratamento clínico para estabilização do animal, com objetivo da intervenção cirúrgica sendo a oclusão gradual do shunt, visando restaurar o fluxo sanguíneo hepático adequado.
O tratamento clínico foi iniciado com dieta específica (ração hepática) e administração de lactulona (via oral, 100 mg/kg), além do uso de hepatoprotetores manipulados por via oral, incluindo S-adenosilmetionina (SAMe) na dose de 20 mg/kg, vitamina E na dose de 20 UI/kg e ácido ursodesoxicólico na dose de 15 mg/kg. Recomendou-se a manutenção do animal em ambiente de internação para monitoramento contínuo, estabilização e com plano de intervenção para crises epilépticas incluindo a utilização de terapia antiepiléptica de emergência caso necessário.
No pré-operatório, o animal foi medicado 30 minutos antes do procedimento com meloxicam (via intravenosa, 0,1 mg/kg) e dipirona (via intravenosa, 25 mg/kg). O objetivo dessas medicações foi iniciar a terapia analgésica e anti-inflamatória antes da injúria cirúrgica. A classificação de risco anestésico da American Society of Anesthesiologists (ASA) foi definida como III, uma vez que o shunt causa repercussões sistêmicas de moderadas a graves. Como medicação pré-anestésica, foi utilizada metadona (0,3 mg/kg). Em cirurgias vasculares, é essencial manter a hemodinâmica do paciente estável, evitando tanto vasodilatação quanto vasoconstrição, garantindo assim a segurança e o sucesso do procedimento. A indução anestésica foi realizada com propofol (5 mg/kg) e cetamina (1 mg/kg) como co-indutor. O animal foi submetido à anestesia geral, com manutenção por anestesia inalatória utilizando o circuito não reinalante, baraka no fluxo de oxigênio 100ml/kg/min. Para o anestesio inalatório foi usado isoflurano a 1,4% em vaporizador calibrado. Além disso, foi administrada uma infusão contínua de remifentanil (0,4 mcg/kg/min) para analgesia intraoperatória.
Foi aplicada a técnica de correção cirúrgica o anel constritor ameróide para o tratamento de um shunt portossistêmico congênito único e extra-hepático do tipo porto ázigos, considerada a técnica padrão-ouro nesse contexto. Durante o procedimento, também foi realizada uma biópsia hepática, indicada para investigar alterações histológicas compatíveis com hipoplasia de sinusóides.
Sobre a técnica cirúrgica, o acesso se dá por meio de celiotomia pré-umbilical, com abertura cuidadosa plano a plano até a completa exposição da cavidade abdominal. A cavidade abdominal deve ser exposta adequadamente com uso do afastador de Gosset, em seguida uma inspeção de cavidade e principalmente fígado deve ser realizada. Para localizar a veia porta o duodeno é retraído para a esquerda e ventralmente, precisa ser cuidadosamente inspecionada a fim de localizar o vaso anômalo. Para identificar a veia cava caudal, é necessário observar a face dorsal do mesoduodeno, onde se encontra posicionada. Em localização mais dorsal e adjacente à cava, encontra-se a veia ázigos de interesse para o caso.
Uma vez identificado o vaso anômalo, do tipo shunt porto ázigos, este foi dissecado com extremo cuidado, o mais próximo possível da veia porta, preservando a integridade da estrutura vascular. Com o trajeto ao redor do vaso devidamente liberado, procedeu-se à colocação do implante constritor (Figura 3), foi utilizado fio poliglecaprone 3-0 para fixação. Após devida técnica aplicada e biópsia hepática realizada, seguiu-se para celiorrafia, com padrão simples contínuo com fio polidioxanona 3-0. A redução de subcutâneo foi feita em padrão contínuo do tipo zigue-zague com fio poliglecaprone 3-0 e a dermorrafia com padrão simples separado com o fio poliamida 3-0.
Figura 3: Imagem fotográfica do transoperatório na inserção do anel constritor ameróide no vaso anômalo apontado pela seta.
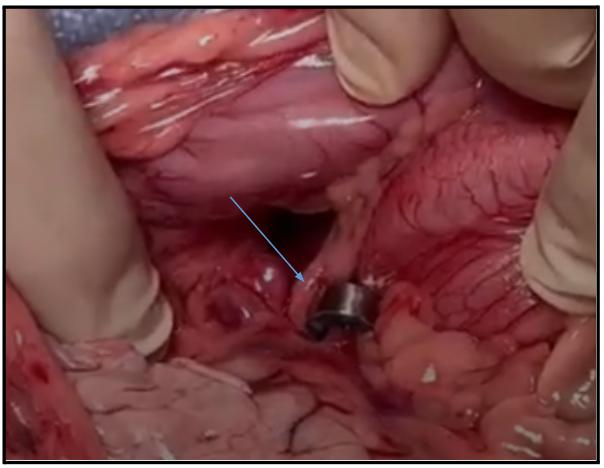
Fonte: Arquivo pessoal, 2025.
No pós-operatório, o animal permaneceu em âmbito hospitalar sob fluidoterapia com solução de ringer com lactato na taxa de 2 ml/kg/hora. No primeiro dia, foi instituída terapia analgésica com metadona (0,1 mg/kg) e dipirona (25 mg/kg), além de terapia anti-inflamatória com meloxicam (0,1 mg/kg). Foram mantidas medicações hepatoprotetoras por via oral uma vez ao dia, como SAMe (20 mg/kg), bem como medicações colestáticas, incluindo ácido ursodesoxicólico (15 mg/kg) e vitamina E (20 UI/kg). Além disso, a lactulona, via oral a cada 8 horas na dose de 100mg/kg, foi mantida como parte do manejo da encefalopatia hepática, associada à dieta hepática específica. O animal demonstrou boa recuperação no pós-operatório, sem muitas repercussões em período de internação nas primeiras 24 horas, se alimentando e defecando normalmente e com demais parâmetros estáveis. O mesmo recebeu alta após a primeira internação de 24 horas. No receituário para casa foram mantidos os hepatoprotetores nas mesmas doses e frequência da internação, para uso contínuo. O mesmo ocorreu para lactulona por duração de mais 7 dias. A ração hepática foi recomendada a divisão de 3 porções ao dia para um cão de 3 kilos. Por fim foi instituído uso de meloxicam na dose de 0,1 mg/kg uma vez ao dia por 3 dias, recomendado uso de roupa cirúrgica e curativo diário com gaze e solução fisiológica 0,9%. O animal retirou os pontos em 14 dias e seguiu sendo acompanhado nas próximas semanas com ultrassonografia doppler e ácidos biliares, objetivando monitorar a oclusão do shunt, este ocorreu por total na 9.º semana.
O exame histopatológico do fígado evidenciou acentuada degeneração de hepatócitos, em padrão aleatório e distribuição difusa, com sinusóides hepáticos hipoplásicos, além numerosas arteríolas de pequeno calibre e ausência da veia porta em algumas porções do lóbulo hepático. Além disso, foi evidenciado degeneração glicogênica, constatado pela coloração com ácido periódico de Schiff positivo.
RESULTADOS E DISCUSSÃO.
O caso relatado trata se de um shunt portossistêmico congênito extra-hepático em um cão, yorkshire de 5 meses, corroborando com a predisposição e epidemiologia bem descrita pela literatura (Paepe, 2009; Fossum, 2015; Santos, 2018).
Diante o caso em questão, ao unir anamnese e exame físico neurológico é possível dizer que o animal tinha lesão em prosencéfalo, entretanto o mesmo apresentava outros sítios de lesões, como déficit proprioceptivo e alterações com características de simetria em pares de nervos cranianos. Devido a ataxia proprioceptiva e tetraparesia ambulatorial com reflexos mantidos em 4 membros, existe presente uma síndrome de neurônio motor superior, entretanto de origem não segmentar. De acordo com De Lahunta e Glass (2016), os sinais clínicos de shunts portossistêmico ocorrem em consequência da encefalopatia hepática e, geralmente, se apresentam de forma simétrica, acometendo principalmente o cérebro e o tronco encefálico majoritariamente. Os sinais relacionados ao tronco encefálico incluem déficits de nervos cranianos e rebaixamento do nível de consciência, controlado pelo sistema ativador reticular ascendente (SARA), síndrome vestibular central e déficits proprioceptivos decorrentes da lesão em tronco (De Lahunta e Glass, 2016).
Os diagnósticos diferenciais incluem patologias multifocais, como encefalopatia hepática ou doença congênita neurodegenerativa, ao pensar na idade do animal. Devido às informações captadas na anamnese, por ser um animal jovem, com mau desenvolvimento corporal e os sinais se intensificando em período pós prandial, a primeira suspeita é shunt portossistêmico congênito. O autor Ernandes (2018) afirma que os sinais clínicos tendem a se intensificar no período pós-prandial, uma vez que a ingestão de proteínas leva à produção de amônia como subproduto da digestão, agravando o quadro de hiperamonemia e, consequentemente, os efeitos tóxicos sobre o sistema nervoso central.
No hemograma, por mais que não apresentava nenhuma alteração em série eritrocitárias, leucocitária ou em plaquetas, vale ressaltar que o shunt pode acompanhar uma anemia microcítica e hipocrômica. Essa alteração ocorre diante da hipoplasia hepática e da insuficiência funcional do fígado em reciclar do ferro. Como consequência, instala-se um quadro semelhante à anemia ferropriva, inclusive com morfologia eritrocitária compatível, o que pode levar à confusão diagnóstica caso não se considere a possibilidade de um distúrbio hepático subjacente (Fossum, 2015; Thrall ,2024).
As enzimas hepáticas solicitadas, ALT e FA aumentadas estão relacionadas, principalmente em cães, à lesão hepática e à colestase, respectivamente, de acordo com de acordo com Thrall (2024). No entanto, essas alterações bioquímicas não possuem forte valor diagnóstico em casos de shunts portossistêmicos, devido à sua inespecificidade, conforme apontado por Freitas et al. (2023).
A creatinina apresentou-se no limite inferior de referência, sendo avaliada por sua utilidade na detecção de possível insuficiência renal. Embora seja um marcador tardio, indicando lesão apenas após a perda de aproximadamente 75% dos néfrons. Neste caso específico, a creatinina poderia estar diminuída devido ao quadro de caquexia já apresentado pelo animal, devido ser uma enzima correlacionado com músculos segundo Thrall (2024).
A ureia, enzima comumente associada à função renal, pode estar diminuída nestes casos. É uma alteração que pode sugerir um quadro clássico em shunts. Isso ocorre quando o ciclo da ureia, responsável por converter amônia em uréia no fígado, está afuncional, resultando na diminuição da ureia e aumento da amônia. Entretanto esta situação é mais frequentemente associada a SPS adquiridos, uma vez que apresentam cirrose hepática, uma vez que, nos SPS congênitos a insuficiência hepática e seus sinais não são comumente presentes (Freitas et al., 2023).
A dosagem dos ácidos biliares séricos aumentados, é característico nos shunts, sendo um exame altamente sensível para o diagnóstico, embora não seja definitivo, segundo Hoffman (2025). Os ácidos biliares são compostos ativos produzidos no fígado a partir do colesterol, armazenados na vesícula biliar e liberados no intestino durante a digestão. Após exercerem sua função na emulsificação de gorduras, são reabsorvidos no íleo e retornam ao fígado por meio da veia porta, em um processo conhecido como circulação entero-hepática. Em condições fisiológicas, esses compostos não devem estar presentes em concentrações elevadas na circulação sistêmica, pois são quase totalmente recaptados pelo fígado. Portanto, a presença aumentada de ácidos biliares na circulação central sugere que houve um desvio do fluxo portal, caracterizando um shunt portossistêmico (Hoffman, 2025).
Neste caso em questão não foram realizados a dosagem de ácidos biliares em dois momentos, uma vez que é recomendado: em jejum (pré-prandial) e duas horas após a alimentação (pós-prandial), permitindo avaliar a resposta hepática à reabsorção dos ácidos biliares. Valores persistentemente elevados, especialmente no período pós-prandial, indicam que esses compostos estão sendo desviados da veia porta para a circulação sistêmica, fortalecendo a suspeita de SPS (Hofman, 2025).
A dosagem da amônia, embora teoricamente seja o parâmetro ideal para avaliar a encefalopatia hepática e o shunt portossistêmico, não é comumente realizada na prática clínica veterinária. Isso se deve ao fato de a amônia ser uma molécula instável, altamente volátil e sujeita à interferência de diversos fatores pré-analíticos, como o tempo de processamento da amostra, a temperatura de armazenamento e a manipulação inadequada. Essas variáveis comprometem a confiabilidade dos resultados e reduzem a sensibilidade do exame na rotina hospitalar. Dessa forma, apesar de a amônia ser o composto nitrogenado diretamente envolvido na patogênese da encefalopatia hepática, sua mensuração não é considerada um exame prático ou eficaz no contexto clínico-veterinário atual (Hofman, 2025).
Outros exames de funções hepáticas poderiam ser solicitados, uma vez que com o fígado hipoplásico, pode evidenciar alguns sinais de insuficiência. Vale relembrar que a insuficiência hepática é mais relacionado ao SPS adquirido, dentre os achados laboratoriais mais comuns, destaca-se a hipoalbuminemia, decorrente da redução da síntese hepática de albumina, assim como a hipoproteinemia geral, pela diminuição na produção de outras proteínas plasmáticas, incluindo os fatores de coagulação. As bilirrubinas podem estar elevadas devido à deficiência na conjugação hepática (Soares, 2024). A hipocolesterolemia também pode ser observada, refletindo a incapacidade do fígado em sintetizar colesterol (Freitas et al., 2023).
A urinálise possui uma importância diagnóstica, sendo um dos achados mais característicos em animais com shunt portossistêmico a presença de cristais de biurato de amônia. Esses cristais podem evoluir para a formação de urólitos de urato de amônio, decorrentes da excreção renal aumentada de amônia, que ocorre devido à hiperamonemia persistente característica da condição. Além dos cristais, é comum a observação de sinais compatíveis com cistite secundária à presença de urólitos, como hematúria, proteinúria inflamatória, bacteriúria e leucocitúria. Esses achados reforçam a importância da urinálise na triagem de distúrbios hepáticos vasculares, especialmente quando associados a sinais clínicos sistêmicos e neurológicos (Burger et al., 2023).
A tomografia computadorizada (TC) é considerada o diagnóstico definitivo do distúrbio, sendo uma técnica de alta sensibilidade que permite a reconstrução tridimensional da vascularização hepática, oferecendo excelente definição anatômica. Essa modalidade de imagem possibilita a identificação precisa da origem do vaso anômalo, a classificação do tipo de shunt e o planejamento cirúrgico adequado, otimizando a abordagem terapêutica (Takeuchi, 2025).
Outra técnica complementar é a ultrassonografia com Doppler, a qual permite a avaliação do sistema porta e a identificação de vasos anômalos, bem como a análise da direção e velocidade do fluxo sanguíneo (Feliciano, 2019). No entanto, esse método possui sensibilidade inferior à tomografia e não é considerado diagnóstico definitivo. Além disso, não oferece a mesma acurácia para o planejamento cirúrgico pré-operatório. Sua principal indicação é no acompanhamento pós-operatório, para monitorar a oclusão gradual do vaso anômalo, sendo o Doppler uma ferramenta útil na confirmação da redução ou interrupção do fluxo (Santos et al., 2019).
O tratamento clínico, embora não seja curativo, tem como principal objetivo o controle dos sinais clínicos e a estabilização do paciente no período pré-operatório. Dentre as medidas recomendadas, destacam-se o manejo dietético com dietas de proteína altamente digestível e de baixo teor proteico, o uso de lactulona para reduzir a absorção intestinal de amônia, administração de antibióticos intestinais para modular a microbiota e diminuir a produção de compostos nitrogenados, além da terapia antiepiléptica, quando indicada, para controle de crises convulsivas decorrentes da encefalopatia hepática (Mullins, 2022).
A ração hepática se trata de uma alimentação formulada com proteínas de alta digestibilidade, ou seja, capaz de ser eficientemente digerida em pequenas quantidades, o que reduz a sobrecarga do trato gastrointestinal, especialmente do duodeno, e contribui para a diminuição da produção de glutamina, um importante transportador de amônia para o fígado (Ettinger e Feldman, 2022). Além do perfil proteico adequado, essas dietas apresentam alta digestibilidade de carboidratos e são enriquecidas com gorduras monoinsaturadas, favorecendo a oferta energética sem sobrecarregar o metabolismo hepático já insuficiente, segundo Brunetto (2007).
A lactulona é um dissacarídeo sintético não absorvível que, ao ser fermentado pelas bactérias colônicas, promove a acidificação do conteúdo intestinal. Esse ambiente ácido converte a amônia (NH₃) em íons amônio (NH₄⁺), forma menos lipossolúvel e, portanto, com menor capacidade de absorção pelo intestino, contribuindo para a redução da hiperamonemia. Além disso, a lactulona exerce um efeito laxativo osmótico, acelerando o trânsito intestinal e diminuindo o tempo de exposição às toxinas de origem entérica (Brum et al., 2007).
É um equívoco atribuir exclusivamente os altos níveis de amônia à ingestão de proteínas na dieta. Estudos demonstram que uma parcela significativa da amônia circulante é produzida endogenamente, principalmente pela ação de bactérias intestinais produtoras de urease, que metabolizam compostos nitrogenados em amônia, e pela enzima glutaminase, responsável por converter glutamina em glutamato e amônia. Em condições fisiológicas, o fígado metaboliza essa amônia por meio do ciclo da ureia, no entanto, em casos de shunt portossistêmico, a função hepática está comprometida ou bypassada, o que impede a excreção adequada da amônia, permitindo seu acúmulo na circulação sistêmica e contribuindo para o desenvolvimento da encefalopatia hepática (Patel e; Shawcross, 2015).
A terapia com antibióticos também pode ser utilizada como medida coadjuvante, com o objetivo de reduzir a população de bactérias intestinais produtoras de urease, sendo uma enzima que metaboliza compostos nitrogenados em amônia. Entre os antimicrobianos indicados para esse fim, destacam-se a ampicilina, o metronidazol, a neomicina e, em menor grau, a própria lactulona, que não apresenta leve ação bactericida ou bacteriostática, mas aumenta o fluxo intestinal eliminando bactérias e auxiliando neste controle, vale ressaltar que a constipação é um fator complicante para pacientes com shunts portossistêmicos, uma vez que estão mais expostos a absorção de amônia pelos intestinos e piorando o quadro de EH, segundo Freitas et al (2023).
O uso de hepatoprotetores é recomendado em casos de shunt portossistêmico. O S-adenosilmetionina (SAMe) possui propriedades antioxidantes e efeito antifibrótico, contribuindo para a preservação da função hepática residual, segundo Webster et al (2019). Além disso, o uso do ácido ursodesoxicólico e vitamina E podem ser benéficos, especialmente diante da possibilidade de colestase secundária à hipoplasia dos sinusóides hepáticos e pela ação antioxidante (Webster et al., 2019).
A encefalopatia hepática pode cursar com sinais neurológicos diversos, incluindo as crises epilépticas, que são consideradas emergências neurológicas, especialmente nos casos de status epilepticus ou cluster seizures (De Lahunta e; Glass, 2016). O manejo adequado dessas crises é fundamental para evitar danos neurológicos irreversíveis e estabilizar o paciente. Nas emergências, especialmente em ambiente hospitalar, o controle das crises deve ser feito com benzodiazepínicos, como o diazepam e o midazolam, os quais atuam rapidamente no controle das convulsões, sendo considerados fármacos de primeira linha (Podell et al., 2015).
O tratamento antiepiléptico de manutenção de primeira linha geralmente envolve o uso de fenobarbital, administrado na dose de 2 a 6 mg/kg a cada 12 horas (BID). No entanto, seu uso não é recomendado em casos de SPS, uma vez que o fenobarbital é metabolizado de forma significativa pelo fígado, órgão que, nesses casos, encontra-se frequentemente hipoplásico e funcionalmente comprometido (Podell et al., 2015). Isso pode comprometer a eficácia do fármaco e aumentar o risco de toxicidade hepática.
Dessa forma, opta-se por terapias de segunda linha, como o brometo de potássio, cuja metabolização hepática é mínima. Por ser um sal, sua eliminação ocorre predominantemente por via renal, o que o torna uma escolha mais segura nesses pacientes (Podell et al., 2015). Durante o acompanhamento, é comum observar uma hipercloremia relativa em exames de hemogasometria, uma vez que os equipamentos podem interpretar o íon brometo como cloreto (Trotter; Wagner, 2019).
O tratamento definitivo do shunt portossistêmico congênito extra-hepático consiste na oclusão gradual do vaso anômalo, o objetivo do tratamento é restaurar o fluxo sanguíneo hepático adequado e minimizar as complicações metabólicas associadas a EH e ao desenvolvimento de hipertensão portal, segundo Fossum (2015). A obstrução total e imediata do desvio pode desencadear hipertensão portal severa e insuficiência hepática aguda, podendo levar à morte súbita do paciente (Medeiros; Correia; Moraes, 2023). Por essa razão, a oclusão progressiva é preferida, permitindo que o fígado se adapte gradualmente ao aumento do fluxo sanguíneo portal. Duas técnicas são amplamente utilizadas para essa finalidade: a colocação de uma banda de celofane, que induz fibrose reativa ao redor do vaso, e o anel constritor ameróide, que se expande lentamente por absorção de fluido, promovendo oclusão gradual do shunt (Fossum, 2015).
A técnica do anel constritor ameróide é considerada padrão-ouro, embora seja mais onerosa. Estudos demonstram que animais submetidos a essa técnica apresentam uma taxa de sucesso clínico excelente em 80% dos casos (Kyles, Mehl; Gregory, 2002). O mecanismo de ação do anel ameróide baseia-se em uma substância higroscópica que, ao absorver líquidos, promove a constrição gradual do vaso anômalo até sua oclusão completa, induzindo fibrose ao redor do vaso. A estrutura externa do anel é composta por aço inoxidável, com uma fenda que facilita sua colocação e uma trava que impede deslocamentos indesejados. Para cães de pequeno porte, recomenda-se a utilização de anéis com diâmetro interno entre 3,5 e 5 mm (Fossum, 2015). O pós-operatório exige um acompanhamento rigoroso, tanto para tratamento quando para monitorar oclusão do vaso, inclui se controle dos níveis de ácidos biliares, suporte nutricional adequado e acompanhamento clínico para avaliar a adaptação hepática ao novo fluxo sanguíneo (Fossum, 2015).
Algumas complicações pós-operatórias incluem hemorragias, ascite e crises epilépticas, sendo essas intercorrências relativamente comuns após a correção cirúrgica de shunt portossistêmico. A taxa de mortalidade pós-operatória é estimada em aproximadamente 23%, sendo que 6% ocorrem no período imediato ao procedimento. Acredita-se que essas mortes estejam associadas, em grande parte, à oclusão excessiva e precoce do vaso anômalo, levando a um quadro de hipertensão portal aguda. Apesar dos riscos, a maioria dos cães apresentam excelentes prognósticos quando submetidos à correção com o anel ameróide. A taxa de complicações associadas ao uso do anel é de cerca de 15,4% em cães, demonstrando sua relativa segurança e eficácia (Fossum, 2015).
O acompanhamento pós-operatório de animais submetidos à oclusão gradual de um shunt portossistêmico é essencial para avaliar a eficácia do procedimento e monitorar a oclusão (Freitas et al., 2024). A oclusão completa do vaso anômalo é esperada entre 8 e 12 semanas após a cirurgia, sendo fundamental seguir um protocolo de monitoramento clínico e laboratorial estruturado por etapas. Na primeira semana, recomenda-se repetir hemograma, ácidos biliares e enzimas hepáticas, buscando avaliar o pós-operatório imediato. Na quarta semana, recomenda-se avaliação com ultrassonografia doppler para monitorar o grau de oclusão gradual. Na sexta semana, recomenda-se dosar novamente os ácidos biliares, pois, à medida que ocorre a oclusão, é esperada uma redução desses valores. Entre a 8ª e a 12ª semana, recomenda-se repetir o ultrassom e a dosagem dos ácidos biliares, período em que se espera alcançar a oclusão completa (Fossum, 2015; Freitas et al., 2024).
O exame histopatológico é realizado com intuito de avaliar o parênquima hepático, uma vez que tende a apresentar alterações compatíveis com a redução do fluxo sanguíneo portal. Alterações como hipoplasia de sinusóides hepáticos, pode indicar que este animal possui uma alteração dentro de parênquima, no qual pode continuar apresentando hipertensão portal, esta condição não é passível de correção cirúrgica, sendo necessário manejo clínico. Outras alterações podem ser evidenciadas como ausência da veia porta em algumas porções do lóbulo hepático, degeneração de hepatócitos e até degeneração glicogênica corada com ácido periódico de Schiff (PAS) positivo. Todas estas alterações encontradas são justificadas pela diminuição de fluxo sanguíneo ao parênquima, gerando atrofia hepática, tudo isto secundário ao SPS bem descrito por Sobczak-Filipiak (2018).
CONCLUSÃO
Conclui-se, portanto, que os shunts portossistêmicos possuem uma complexidade do diagnóstico, que exige uma abordagem em múltiplas etapas, incluindo triagem laboratorial e exames de imagem avançados. Ressalta-se a importância do tratamento clínico de suporte e suas particularidades. No entanto, esse manejo não deve substituir o tratamento definitivo, que é a correção cirúrgica no vaso anômalo. Dentre as opções cirúrgicas, a oclusão gradual por meio do anel constritor ameróide é considerada o padrão-ouro nos casos operáveis de shunt portossistêmico extra-hepático congênito.
REFERÊNCIAS
BRUM, Alexandre Martini de et al. Utilização de probiótico e de lactulose no controle de hiperamonemia causada por desvio vascular portossistêmico congênito em um cão. Ciência Rural, v. 37, n. 2, p. 572–574, abr. 2007. Disponível em: http://dx.doi.org/10.1590/S0103-84782007000200045. Acesso em: 25 mar. 2025.
BROOME, C. J.; WALSH, V. P.; BRADDOCK, J. A. Congenital portosystemic shunts in dogs and cats. New Zealand Veterinary Journal, v. 52, n. 4, p. 154-162, ago. 2004. Disponível em: https://doi.org/10.1080/00480169.2004.10749424. Acesso em: 1 abr. 2025.
BRUNETTO, Márcio Antônio et al. Manejo nutricional nas doenças hepáticas. Acta Scientiae Veterinariae, Porto Alegre, v. 35, supl. 2, 2007. Disponível em: https://www.ufrgs.br/actavet/35-suple-2/05-ANCLIVEPA.pdf. Acesso em: 7 abr. 2025.
BURGER, N. et al. Presence of urolithiasis in dogs long-term after gradual attenuation of congenital extrahepatic portosystemic shunts. Journal of the American Veterinary Medical Association, v. 261, n. 9, 2023. Disponível em: https://doi.org/10.2460/javma.23.02.0087. Acesso em: 6 abr. 2025.
CAMARGO, Jéssica et al. Desvio portossistêmico em cães: revisão. Pubvet, Londrina, v. 13, n. 8, p. 1–6, 2019. Disponível em: https://ojs.pubvet.com.br/index.php/revista/article/view/777. Acesso em: 5 abr. 2025.
CANANI, J. K. et al. Fisiologia hepática. Ação Odonto, Joaçaba, v. 1, n. 1, p. 11, 2013. Disponível em: https://periodicos.unoesc.edu.br/acaodonto/article/view/3794 . Acesso em: 23 mar. 2025.
DE LAHUNTA, Alexander; GLASS, Eric N.; KENT, Marc. Veterinary Neuroanatomy and Clinical Neurology. 4. ed. St. Louis: Elsevier, 2015. Disponível em: https://books.google.com/books/about/Veterinary_Neuroanatomy_and_Clinical_Neu.html?id=MyXAoAEACAAJ. Acesso em: 1 abr. 2025.
DYCE, K. M.; SACK, W. O.; WENCEWICZ, P. Tratado de Anatomia Veterinária. 5. ed. Rio de Janeiro: Guanabara Koogan, 2010. Acesso em: 22 mar. 2025.
ERNANDES, Mariane Ceschin. Avaliação do metabolismo proteico e aminoacídico de cães com shunt portossistêmico. 2018. Tese (Doutorado em Nutrição e Produção Animal) – Faculdade de Medicina Veterinária e Zootecnia, Universidade de São Paulo, Pirassununga, 2018. Disponível em: https://doi.org/10.11606/T.10.2019.tde-04122018-115325. Acesso em: 6 abr. 2025.
ETTINGER, Stephen J.; FELDMAN, Edward C.; CÔTÉ, Etienne (Orgs.). Tratado de Medicina Interna Veterinária – Doenças do Cão & do Gato. 8. ed. Rio de Janeiro: Guanabara Koogan, 2022. Acesso em: 11 mar. 2025.
FELICIANO, M. A. R. Ultrassonografia em cães e gatos. MedVet, p. 264–323, 2019. Disponível em: https://www.medicinaveterinaria.med.br/. Acesso em: 20 mar. 2025.
FOSSUM, T. W. Small Animal Surgery. 4. ed. St. Louis: Elsevier, 2013. Disponível em: https://books.google.com/books/about/Small_Animal_Surgery.html?id=klBUDwAAQBAJ. Acesso em: 2 mar. 2025.
FREITAS, P. M. C. et al. Desvio portossistêmico congênito em cães e gatos: tratamento, complicações e prognóstico. Veterinary Sciences, v. 10, n. 5, p. 346, 2023. Disponível em: https://www.mdpi.com/2306-7381/10/5/346. Acesso em: 23 mar. 2025.
GRIMM, K. A.; LAMONT, L. A.; TRANQUILLI, W. J.; GREENE, S. A.; ROBERTSON, S. A. Lumb & Jones: anestesiologia e analgesia em veterinária. 5. ed. Rio de Janeiro: Elsevier, 2017. Disponível em: https://www.amazon.com.br/dp/8527731290 . Acesso em: 16 abr. 2025.
HOFMANN, Alan F. The enterohepatic circulation of bile acids in mammals: form and functions. Frontiers in Bioscience, v. 14, n. 7, p. 2584–2598, 2009. Disponível em: https://doi.org/10.2741/3399. Acesso em: 7 abr. 2025.
JERICÓ, Márcia Marques; ANDRADE NETO, João Pedro de; KOGIKA, Márcia Mery. Tratado de Medicina Interna de Cães e Gatos. 1. ed. Rio de Janeiro: Roca, 2015. p. [número da página]. Disponível em: https://repositorio.usp.br/item/002649418. Acesso em: 7 abr. 2025.
KYLES, A. E. et al. Evaluation of ameroid ring constrictors for the management of single extrahepatic portosystemic shunts in cats: 23 cases (1996–2001). Journal of the American Veterinary Medical Association, v. 220, n. 9, p. 1341–1347, 2002. Disponível em: https://doi.org/10.2460/javma.2002.220.1341. Acesso em: 5 abr. 2025.
MEDEIROS, Letícia França et al. Correção cirúrgica de desvio portossistêmico extra-hepático com utilização de banda de celofane em Yorkshire: relato de caso. Revista FT, v. 1, n. 45, p. 82–90, 2023. Disponível em: https://revistaft.com.br/correcao-cirurgica-de-desvio-portossistemico-extra-hepatico-com-utilizacao-de-banda-de-celofane-em-yorkshire-relato-de-caso/. Acesso em: 1 abr. 2025.
MULLINS, Ronan A. et al. Postattenuation neurologic signs after surgical attenuation of congenital portosystemic shunts in dogs: A review. Veterinary Surgery, v. 51, n. 1, p. 23–33, jan. 2022. Disponível em: https://pubmed.ncbi.nlm.nih.gov/34585759/. Acesso em: 27 mar. 2025.
NELSON, R. W.; COUTO, C. G. Medicina de pequenos animais. 3. ed. Rio de Janeiro: Elsevier, 2015. Acesso em: 10 mar. 2025.
PAEPE, Dominique et al. Portosystemic shunts in dogs and cats: definition, epidemiology and clinical signs of congenital portosystemic shunts. Vlaams Diergeneeskundig Tijdschrift, v. 76, n. 4, p. 234–240, 2007. Disponível em: https://openjournals.ugent.be/vdt/article/id/87575/. Acesso em: 15 mar. 2025.
PATEL, Vishal C.; SHAWCROSS, Debbie L. Current concepts in the pathophysiology and management of hepatic encephalopathy. Gastroenterology & Hepatology, v. 7, n. 4, p. 279–289, abr. 2011. Disponível em: https://www.gastroenterologyandhepatology.net/archives/april-2011/current-concepts-in-the-pathophysiology-and-management-of-hepatic-encephalopathy/. Acesso em: 2 abr. 2025.
PEDRO, S. et al. Desvio portossistêmico em cão: relato de caso. Revista de Educação Continuada em Medicina Veterinária e Zootecnia do CRMV-SP, v. 9, n. 2, p. 30, 2011. Disponível em: https://www.revistamvez-crmvsp.com.br/index.php/recmvz/article/view/382. Acesso em: 1 abr. 2025.
PODELL, Michael et al. 2015 ACVIM Small Animal Consensus Statement on Seizure Management in Dogs. Journal of Veterinary Internal Medicine, v. 30, n. 2, p. 477–490, 2016. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4913615/. Acesso em: 5 abr. 2025.
SANTOS, C. J. et al. Ultrassonografia e portografia no diagnóstico de shunt portoázigos em um cão: relato de caso. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, v. 71, n. 3, p. 863–868, 2019. Disponível em: https://www.scielo.br/j/abmvz/a/sGc6xKLShrXRp7XbQjF5xGL/?format=pdf. Acesso em: 7 abr. 2025.
SANTOS, Thaís Kelly Lima. Shunt portossistêmico em cães. 2018. 42 f. Trabalho de Conclusão de Curso (Graduação em Medicina Veterinária) – Universidade Federal do Recôncavo da Bahia, Cruz das Almas, 2018. Disponível em: https://repositorio.ufrb.edu.br/handle/123456789/1374. Acesso em: 14 mar. 2025.
SOARES, Bruna Ros et al. Correção de shunt portossistêmico múltiplo congênito extra-hepático com uso de banda de celofane em cão: relato de caso. Research, Society and Development, v. 13, n. 3, e9313345342, 2024. Disponível em: https://rsdjournal.org/index.php/rsd/article/view/45342. Acesso em: 5 abr. 2025.
SOBCZAK-FILIPIAK, M. et al. Lipogranulomas and pigment granulomas in livers of dogs with portosystemic shunt. Polish Journal of Veterinary Sciences, v. 21, n. 2, p. 265–272, jun. 2018. Disponível em: https://pubmed.ncbi.nlm.nih.gov/30450864/. Acesso em: 29 mar. 2025.
STEFANESCU, D. et al. Características eletroencefalográficas de encefalopatia hepática presumida em um cão pediátrico com derivação portossistêmica — relato de caso. PubMed, 2025. Disponível em: https://pubmed.ncbi.nlm.nih.gov/36577935/. Acesso em: 14 mar. 2025.
TAKEUCHI, Ryo et al. Use of computed tomography angiography has potential in planning surgical treatment of an extrahepatic portosystemic shunt in dogs. American Journal of Veterinary Research, v. 86, n. 4, 2025. Disponível em: https://doi.org/10.2460/ajvr.24.11.0333. Acesso em: 7 abr. 2025.
THRALL, M. A. et al. Hematologia, Citologia e Bioquímica Clínica Veterinária. 3. ed. São Paulo: Roca, 2024. Acesso em: 20 mar. 2025.
TROTTER, E. J.; WAGNER, M. C. Potassium bromide toxicosis and chloride interference in a dog. Journal of the American Animal Hospital Association, v. 55, n. 6, p. 343–349, 2019. Disponível em: https://pubmed.ncbi.nlm.nih.gov/31769814/. Acesso em: 5 abr. 2025.
WEBSTER, Cynthia R. L. et al. Declaração de consenso da ACVIM sobre o diagnóstico e tratamento da hepatite crônica em cães. Journal of Veterinary Internal Medicine, v. 33, n. 3, p. 1173–1200, maio/jun. 2019. Disponível em: https://pmc.ncbi.nlm.nih.gov/articles/PMC6524396/. Acesso em: 1 abr. 2025.
1Graduado em Medicina Veterinária – Instituição de formação: Centro Universitário de Goiás (UNIGOIÁS) – Endereço Institucional: Av. João Candido de Oliveira, 115 – Cidade Jardim, Goiânia – GO, 74423-115. E-mail: luisalfredopinheirons@gmail.com
2Graduado em Medicina Veterinária – Instituição de formação: Centro Universitário de Goiás (UNIGOIÁS) – Endereço Institucional: Av. João Candido de Oliveira, 115 – Cidade Jardim, Goiânia – GO, 74423-115.
3Graduado em Medicina Veterinária – Instituição de formação: Centro Universitário de Goiás (UNIGOIÁS) – Endereço Institucional: Av. João Candido de Oliveira, 115 – Cidade Jardim, Goiânia – GO, 74423-115.
4Graduada em Medicina Veterinária – Instituição de formação: Centro Universitário de Goiás (UNIGOIÁS) – Endereço Institucional: Av. João Candido de Oliveira, 115 – Cidade Jardim, Goiânia – GO, 74423-115.
5Graduada em Medicina Veterinária – Instituição de formação: Pontifícia Universidade Católica de Goias (PUC – GO) – Endereço Institucional: Av, Universitária 1.440, Setor Universitário. CEP: 74605-010 – Goiânia, Goiás. E-mail: maisapetruzza01@hotmail.com
6Graduada em Medicina Veterinária – Instituição de formação: Pontificia Universidade Catolica de Goias (PUC – GO) – Endereço Institucional: Av, Universitária 1.440, Setor Universitário. CEP: 74605-010 – Goiânia, Goiás. E-mail: renatalves0307@gmail.com
7Graduada em Medicina Veterinária – Instituição de formação: Universidade Federal de Goiás (UFG) – Endereço Institucional: Rodovia Goiânia, km 8 s/n – Campus – Samambaia, Goiânia – GO, 74690-900. E-mail: lauragarciacunga43@gmail.com
8Graduanda em Medicina Veterinária – Instituição de formação: Centro Universitário de Goiás (UNIGOIÁS) – Endereço Institucional: Av. João Candido de Oliveira, 115 – Cidade Jardim, Goiânia – GO, 74423-115. E-mail: marciaclaracaiado@gmail.com
9Graduada em Medicina Veterinária – Instituição de formação: Universidade Federal de Goiás (UFG) – Endereço Institucional: Rodovia Goiânia, km 8 s/n – Campus – Samambaia, Goiânia GO, 74690-900. E-mail: barbarabueno100@hotmail.com
10Graduanda em Medicina Veterinária – Instituição de formação: Centro Universitário de Goiás (UNIGOIÁS) – Endereço Institucional: Av. João Candido de Oliveira, 115 – Cidade Jardim, Goiânia – GO, 74423-115. E-mail: ferreiraleticia0103@icloud.com
11Graduando em Medicina Veterinária – Instituição de formação: Pontifícia Universidade Católica de Goiás (PUC – GO) – Endereço Institucional: Av, Universitária 1.440, Setor Universitário. CEP: 74605-010 Goiânia, Goiás. E-mail: carloseduardo.silvafontoura@hotmail.com
12Graduada em Medicina Veterinária – Instituição de formação: Centro Universitário de Goiás (UNIGOIÁS) – Endereço Institucional: Av. João Candido de Oliveira, 115 – Cidade Jardim, Goiânia – GO, 74423-115. E-mail: cindysthefani_94@hotmail.com
13Graduanda em Medicina Veterinária – Instituição de formação: Universidade Federal de Jataí. E-mail: marcellalves8@gmail.com
14Graduanda em Medicina Veterinária – Instituição de formação: Centro Universitário de Goiás (UNIGOIÁS) – Endereço Institucional: Av. João Candido de Oliveira, 115 – Cidade Jardim, Goiânia – GO, 74423-115. E-mail: marianagimeness0303@gmail.com
15Graduando em Medicina Veterinária – Instituição de formação: Pontifícia Universidade Católica de Goiás (PUC – GO) – Endereço Institucional: Av, Universitária 1.440, Setor Universitário. CEP: 74605-010 – Goiânia, Goiás. E-mail: amanda.dantaz@gmail.com
