A REFLECTION ON THE USE OF CANNABINOID EXTRACTS AS COMPLEMENTARY THERAPY IN THE TREATMENT OF MULTIPLE SCLEROSIS
REGISTRO DOI:10.5281/zenodo.12753155
Layra D’andrea Faustino1; Renata Beatriz Magalhães de Oliveira1; Mateus Germano Pires1; Deusilene Souza Vieira Dall’Acqua2;
RESUMO
Introdução: A cannabis, planta com uma história rica que remonta a milhares de anos, passou por períodos de controvérsia e, mais recentemente, por um renascimento como objeto de pesquisa para tratamentos terapêuticos. Recentemente, seus compostos têm sido estudados devido ao seu potencial terapêutico em uma variedade de condições neurológicas, incluindo a esclerose múltipla. Este ressurgimento tem sido acompanhado por uma crescente aceitação de sua utilização como uma alternativa de tratamento, especialmente para sintomas como espasticidade e dor neuropática crônica associados à esclerose múltipla. Objetivos: investigar a fundo os efeitos dos canabinóides no alívio da espasticidade e da dor neuropática em pacientes com esclerose múltipla. Resultados: Os canabinóides presentes na planta, como o THC e o CBD, despertaram interesse devido aos seus diversos efeitos terapêuticos, incluindo alívio da dor, redução da ansiedade, propriedades anti-inflamatórias e neuroprotetoras. Essas substâncias têm sido estudadas no contexto de uma ampla gama de condições médicas, desde transtornos neuropsiquiátricos até doenças neurodegenerativas como a esclerose múltipla e o Alzheimer. O Sativex®, um spray oral de cannabis, mostrou eficácia no tratamento da esclerose múltipla, destacando o potencial terapêutico dos canabinoides para uma variedade de enfermidades. A crescente compreensão dos mecanismos de ação dos canabinóides oferece perspectivas promissoras para o futuro da medicina. Conclusão: Os canabinóides mostraram um amplo potencial terapêutico em condições neurológicas, incluindo a esclerose múltipla, destacando-se como uma opção promissora para tratamentos mais eficazes. Investimentos contínuos nessa área podem levar a uma abordagem mais holística e personalizada da medicina, beneficiando pacientes em escala global.
Palavras-chave: Canabinóides; Efeito terapêutico; Esclerose múltipla.
ABSTRACT
Introduction: Cannabis, a plant with a rich history dating back thousands of years, has gone through periods of controversy and, more recently, a renaissance as a subject of research for therapeutic treatments. Recently, its compounds have been studied for their therapeutic potential in a variety of neurological conditions, including multiple sclerosis. This resurgence has been accompanied by a growing acceptance of its use as an alternative treatment, especially for symptoms such as spasticity and chronic neuropathic pain associated with multiple sclerosis. Objectives: to thoroughly investigate the effects of cannabinoids in relieving spasticity and neuropathic pain in patients with multiple sclerosis. Methodology: an integrative search was carried out through the PUBMED platform, identifying around 814 articles published between 2014 and 2024, which match and provide the necessary data to prepare the article. Results: The cannabinoids present in the plant, such as THC and CBD, aroused interest due to their diverse therapeutic effects, including pain relief, anxiety reduction, anti- inflammatory and neuroprotective properties. These substances have been studied in the context of a wide range of medical conditions, from neuropsychiatric disorders to neurodegenerative diseases such as multiple sclerosis and Alzheimer’s. Sativex®, an oral cannabis spray, has shown efficacy in the treatment of multiple sclerosis, highlighting the therapeutic potential of cannabinoids for a variety of illnesses. The growing understanding of the mechanisms of action of cannabinoids offers promising perspectives for the future of medicine. Conclusion: Cannabinoids have shown broad therapeutic potential in neurological conditions, including multiple sclerosis, standing out as a promising option for more effective treatments. Continued investment in this area could lead to a more holistic and personalized approach to medicine, benefiting patients on a global scale.
Key-words: Cannabinoids; Therapeutic effect; Multiple sclerosis.
INTRODUÇÃO
A cannabis, uma planta originária da Ásia pertencente à família Cannabaceae, possui uma rica trajetória de uso na história da humanidade, datando aproximadamente de 2.700 a.C. Nos primeiros anos do século XX, devido a efeitos colaterais e à repercussão social negativa vinculada ao seu consumo recreativo, a utilização dos extratos da cannabis foi desconsiderada (DOS REIS ROSA FRANCO et al., 2021). Recentemente, no século XXI, a cannabis emergiu como objeto de pesquisa para propósitos terapêuticos. Esse ressurgimento está sendo acompanhado por uma aceitação crescente como alternativa de tratamento para várias condições neurológicas (RAMOS et al., 2021).
Os canabinóides, estudados no tratamento de enfermidades neurológicas desde a década de 1990, demonstraram melhorias na qualidade do sono de pacientes com Parkinson e propriedades anti-inflamatórias, retardando a neurodegeneração associada à doença de Alzheimer (ANDRADE et al., 2020). Essas substâncias apresentam potencial terapêutico abrangente em condições como esquizofrenia, transtornos do espectro autista, cefaleias, dor neuropática, esclerose múltipla, depressão e ansiedade. No contexto específico da esclerose múltipla, os canabinóides revelam-se promissores, proporcionando alívio sintomático e sugerindo avanços significativos no manejo dessa condição neurodegenerativa (FRAZÃO et al., 2022; HANS EN et al., 2021).
A esclerose múltipla (EM) é uma doença autoimune crônica que afeta o sistema nervoso central, possuindo ação dos autoanticorpos fazendo desmielinização e neurodegeneração dos axônios neuronais (FURGIUELE et al. 2021). Esta enfermidade afeta mais de dois milhões de pessoas globalmente, principalmente mulheres entre 20 e 45 anos. No Brasil, foram relatados mais de 40 mil casos, afetando também mulheres na mesma faixa etária, sendo destacada a região Sudeste com maior número de internações por EM (COELHO et al., 2023).
A espasticidade e a dor neuropática crônica são sintomas significativos em pessoas com esclerose múltipla, agravando-se com a progressão da doença.
Medicamentos tradicionais têm benefícios limitados, levando à crescente procura por tratamentos sintomáticos com canabinóides, como o Δ 9 -tetrahidrocanabinol (Δ 9 – THC) e o canabidiol (CBD), derivados da Cannabis sativa (FILIPPINI et al., 2022). Esses canabinóides demonstram eficácia no manejo da espasticidade e da dor em pacientes com EM. Além disso, evidências indicam propriedades imunomoduladoras e imunossupressoras dos canabinóides, sugerindo seu potencial terapêutico (FURGIUELE et al., 2021).
Desta forma, objetiva-se investigar de maneira mais aprofundada os efeitos dos canabinóides no alívio da espasticidade e da dor neuropática em pacientes com esclerose múltipla, buscando compreender melhor seus mecanismos de ação e contribuir para a otimização das opções terapêuticas disponíveis.
METODOLOGIA
A metodologia empregada consiste em uma revisão bibliográfica de caráter integrativo, realizada na plataforma PUBMED com o intuito de selecionar artigos que abordem a interação entre Canabinóides e esclerose múltipla. Foram utilizadas palavras-chave relacionadas aos Canabinóides e seu impacto na esclerose múltipla, com especial atenção para a melhoria da eficácia no manejo da espasticidade e da dor em pacientes afetados por essa condição. O foco principal é explorar os possíveis benefícios dos Canabinóides no tratamento da esclerose múltipla, proporcionando insights para a compreensão e o aprimoramento da terapêutica nesse contexto clínico, abordando não apenas sua eficácia no manejo de sintomas, mas também explorando mecanismos de ação, efeitos no curso da doença e implicações terapêuticas. Foram selecionados estudos bibliográficos e observacionais, excluindo relatos de casos e séries de casos. Na pesquisa conduzida, identificou-se 814 artigos publicados entre 2014 e 2024 (PubMed: 814). A exclusão de artigos baseou-se em critérios como títulos, resumos, relevância para o estudo, ano de publicação e tipo de estudo (N= 335). Dos 479 restantes, 290 não atenderam aos critérios de elegibilidade, resultando na seleção de 189 artigos para avaliação do texto completo. Todos os estudos eram de natureza bibliográfica e observacional, alinhando-se aos critérios de inclusão definidos.
1. DESENVOLVIMENTO
3.1 OS CANABINÓIDES
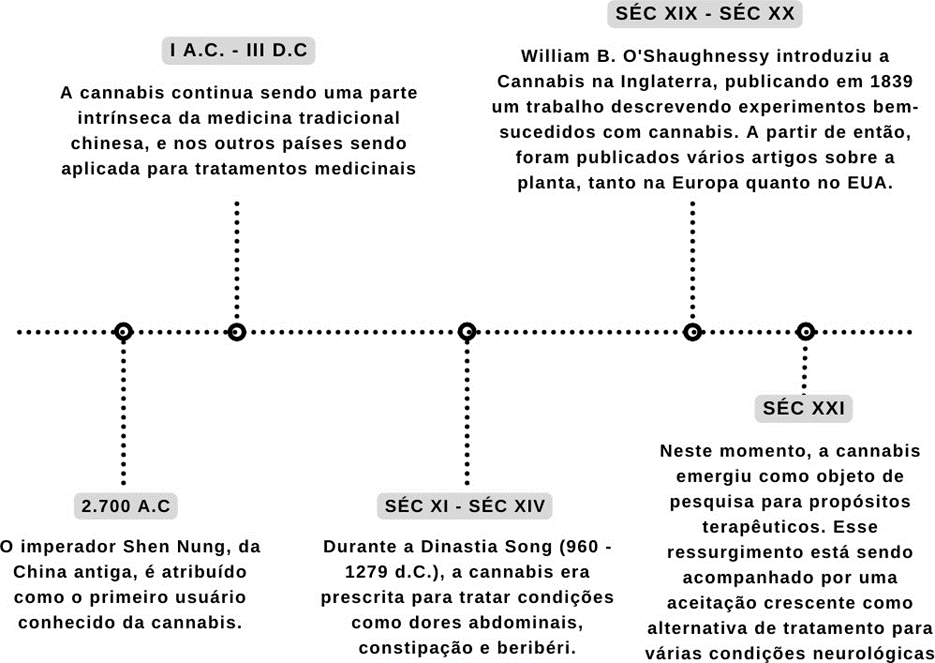
A história da relação entre os seres humanos e a cannabis é rica e complexa, remontando a milênios atrás. No epicentro dessa narrativa está a China antiga, onde o imperador Shen Nung é atribuído como o primeiro usuário conhecido da planta por volta de 2.700 a.C. Inicialmente, a cannabis era valorizada por suas propriedades industriais, sendo cultivada para a produção de fibras, alimentos e óleo. Os ensinamentos de Shen Nung foram registrados no Shen Nung Pen-ts’ao Ching, um livro datado do século II, que documenta os usos medicinais e práticos da planta (CHAYASIRISOBHON S, 2020).
Em um achado surpreendente datado de aproximadamente 750 a.C., próximo às Montanhas Flaming, na região turística de Xinjiang-Uighur, na China, foi descoberto o túmulo de um indivíduo da cultura Tochariana. O túmulo continha uma quantidade significativa de cannabis cultivada, com um alto teor de Δ 9 -tetraidrocanabinol (THC), evidenciando a presença antiga e disseminada da planta como substância psicoativa (PAIN S, 2015).
Ao longo dos séculos, a cannabis continuou a ser uma parte intrínseca da medicina tradicional chinesa, sendo aplicada no tratamento de uma variedade de condições médicas, desde problemas menstruais até mais de 100 doenças diferentes. Os chineses exploram principalmente as sementes da planta, reconhecendo seus benefícios medicinais (ANDRE CM et al., 2016; CHANDY, et al., 2024).
Figura 1: Linha do tempo sobre o histórico da Cannabis
Fonte: Autoria própria.
A linha do tempo da história do cannabis é uma representação visual valiosa que destaca os principais eventos e marcos ao longo da trajetória dessa planta ao longo do tempo, como demonstra a Figura 1. Desde seu uso inicial em civilizações antigas até sua criminalização em tempos modernos e posteriormente seu reconhecimento pelos benefícios medicinais, a linha do tempo oferece uma perspectiva abrangente sobre a evolução das atitudes e políticas em relação à cannabis.
No entanto, com o avanço da medicina moderna, a cannabis perdeu espaço para sedativos e analgésicos sintéticos, como a aspirina. A introdução de leis restritivas nos Estados Unidos, como a Lei do Imposto sobre a Marihuana em 1937, marcou um ponto de virada na história da cannabis, dificultando significativamente a pesquisa sobre seus efeitos medicinais e encerrando o que alguns consideravam a “Era Dourada” da cannabis (LOWE et al., 2021).
No século 19, William B. O’Shaughnessy introduziu a Cannabis sativa na Inglaterra após servir na Índia, publicado em 1839 um trabalho descrevendo experimentos bem-sucedidos com cannabis para tratar espasmos musculares, reumatismo e convulsões. Isso impulsionou o interesse terapêutico na cannabis, resultando na publicação de mais de 100 artigos científicos na Europa e nos EUA (CHAYASIRISOBHON S, 2020).
A partir desse interesse, foi descoberto que a planta cannabis possui várias espécies principais, incluindo C. sativa, C. indica e C. ruderalis, e mais de 500 compostos foram isolados dela, sendo cerca de 100 canabinoides, com destaque para o Δ-9-tetrahidrocanabinol (THC), canabidiol (CBD), terpenos e flavonóides, causando a sensação de “euforia”, sendo somente a forma do CBD que não possui tal ação (JONES et al, 2020).
A descoberta do THC e do CBD permitiu identificar as vias canabinóides no corpo humano. O THC interage com o receptor canabinóide tipo 1 (CB1), enquanto o CBD atua no receptor canabinóide tipo 2 (CB2). Essas descobertas abriram novos caminhos para a compreensão do papel dos canabinoides no corpo humano (AL- GHEZI et al., 2019).
3.2 ABORDAGEM TERAPÊUTICA DA CANNABIS
O sistema endocanabinóide, presente em todo o reino animal, desempenha uma ampla gama de funções para manter o equilíbrio do organismo. Os receptores e ligantes canabinóides são encontrados não apenas no sistema nervoso, mas também em outros tecidos, como os ossos e o sistema imunológico. Esse sistema neuromodulator está envolvido em processos como anti-nocicepção, cognição, memória, regulação endócrina, função gastrointestinal, inflamação e reconhecimento imunológico (PETZKE F et al., 2022).
A cannabis é uma planta extraordinariamente complexa do ponto de vista químico, apresentando uma impressionante diversidade de compostos naturais. Um dos grupos mais estudados de compostos encontrados na planta são os canabinóides, que incluem o Δ9-THC (Δ9-ácido tetraidrocanabinólico) e o CBD (canabidiol). O Δ9-THC, conhecido por seu efeito psicoativo, é convertido a partir do seu precursor, o Δ9-ácido tetraidrocanabinólico (Δ9-THCA), através de um processo chamado descarboxilação (YANG et al., 2020; WISHART, et al., 2024).
Além dos canabinóides, a cannabis também contém uma ampla gama de outros compostos, como fenóis, flavonoides, terpenos e alcalóides. Esses compostos contribuem para a complexidade química da planta. Os fenóis, com suas propriedades antioxidantes, e os flavonóides, conhecidos por suas propriedades anti-inflamatórias, são exemplos de compostos que desempenham papéis importantes na saúde e no bem-estar. Os terpenos, que conferem o característico aroma da cannabis, e os alcalóides, embora presentes em quantidades menores, também desempenham funções relevantes (HERREROS et al., 2019).
Figura 2: Biossíntese do ácido tetraidrocanabinólico (THCA) e canabinóides relacionados
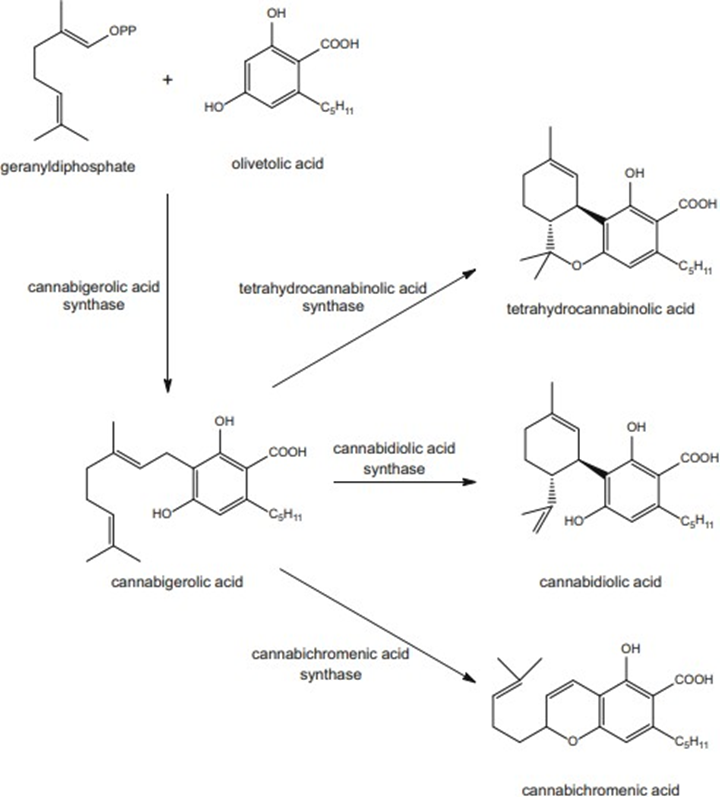
Fonte: Elsohly, et al., 2017.
A Figura 2 mostra o processo de biossíntese do ácido tetraidrocanabinólico (THCA) e outros canabinóides relacionados na planta de cannabis. Os fitocanabinoides, que incluem o THCA, são compostos terpenofenólicos com estrutura em anel derivado de um pirofosfato de geranil. Esses compostos são sintetizados por meio de vias metabólicas específicas, como a via do mevalonato citosólico e a do fosfato de metileritritol (MEP) plástidico, responsáveis pela produção de terpenoides vegetais. O fosfato de metileritritol plástidico desempenha um papel crucial na biossíntese da parte terpenoide dos canabinóides. A olivetol sintase é uma enzima importante nesse processo, convertendo o ácido olivetólico em precursores que culminam na formação de diversos fitocanabinoides, incluindo o THCA, o ácido canabidiólico e o ácido canabicromênico. Essa síntese é um passo essencial na produção desses compostos com propriedades farmacológicas e terapêuticas únicas (ELSOHLY, et al., 2017).
Os fitocanabinoides presentes na Cannabis sativa, como o THC e o CBD, são de particular interesse médico devido aos seus efeitos terapêuticos. O THC, principal constituinte ativo, possui propriedades psicoativas e analgésicas, enquanto o CBD, com baixa afinidade pelos receptores canabinóides, pode atenuar os efeitos negativos do THC e também possui propriedades anti-inflamatórias e ansiolíticas (LOWE H et al., 2021).
A compreensão dos mecanismos de ação dos canabinóides abriu novas perspectivas para o tratamento de uma variedade de condições médicas. Pesquisas sugerem que eles podem ser eficazes no manejo da dor crônica, distúrbios cognitivos, distúrbios emocionais e outras condições, oferecendo uma abordagem promissora para a medicina moderna (Al-Ghezi et al., 2019; HIDDING, et al., 2024).
Entre vários estudos associados com o uso dos canabinóides, a ansiedade é uma área de investigação significativa. A ansiedade, considerada uma reação natural do corpo a situações de perigo ou ameaça, é marcada pelo aumento da responsividade e vigilância. Transtornos neuropsiquiátricos relacionados à ansiedade, como o Transtorno de Pânico e Transtorno de Ansiedade Social, são prevalentes globalmente, resultando em um fardo significativo na sociedade e economia (BLESSING E.M. et al., 2015; TOURJMAN, et al., 2023).
No entanto, os medicamentos atualmente disponíveis para tratar a ansiedade e a depressão têm eficácia limitada, tolerabilidade restrita e perfil de efeitos colaterais desfavoráveis. Nesse contexto, os canabinóides emergem como promissores agentes terapêuticos alternativos, apresentando uma nova abordagem para o tratamento desses transtornos (STAMPANONI BASSI et al., 2018; BELETSKY, et al., 2024).
Estudos recentes também destacam a implicação do sistema endocanabinoide (ECS) no controle da dor, com os canabinóides alvejando componentes do ECS, como os receptores CB1R, CB2R e outros (VUČKOVIĆ S et al.,2018). Assim, a pesquisa sobre o uso terapêutico dos canabinoides não apenas lança luz sobre a ansiedade, mas também abre novas perspectivas para o manejo da dor crônica e outros transtornos neuropsiquiátricos (HÄUSER, et al., 2023).
Ademais, os canabinóides têm despertado interesse devido às suas propriedades anti-inflamatórias e cardioprotetoras, reduzindo o risco de doenças cardíacas, controlando arritmias e prevenindo aterosclerose. Além disso, essas substâncias demonstraram eficácia em aliviar sintomas de doenças neurológicas e neurodegenerativas, como esclerose múltipla e Alzheimer, oferecendo alívio para dor e ansiedade (BURSTEIN S et al., 2015; STANLEY C.P. et al., 2013; FAROOQI, et al., 2023).
Canabinóides, como o Δ9-THC, têm efeitos terapêuticos contra sintomas da esclerose múltipla, como dor neuropática e espasticidade. O Sativex®, um spray oral feito com extrato de cannabis, é eficaz no tratamento da esclerose múltipla sem efeitos adversos significativos. Estudos em modelos animais mostram que os canabinóides suprimem a inflamação associada à esclerose múltipla (MARKOVÀ J et al., 2019; BELL, et al., 2024).
Na Tabela 1, uma lista detalhada de doenças e condições médicas para as quais os canabinóides são utilizados terapeuticamente é fornecida, destacando sua versatilidade e potencial clínico.
Tabela 1: Doenças para as quais os canabinoides podem oferecer tratamentos terapêuticos potenciais.
DOENÇAS AÇÃO DOS CANNABIS REFERÊNCIAS Esquizofrenia As propriedades antipsicóticas, anti- inflamatórias e neuroprotetoras do CBD o tornam uma alternativa de tratamento mais segura, tolerável e promissora para transtornos psicóticos como a esquizofrenia HAMILTON I et al., 2019; MANSEAU et al., 2015 Epilepsia Relatos tanto informais quanto científicos respaldam a eficácia da cannabis medicinal na diminuição da frequência de crises convulsivas em pacientes que não responderam ao tratamento convencional com medicamentos antiepilépticos. LATTANZI S et al., 2018 Dor crônica Evidências anedóticas e científicas apoiam o uso de C. sativa L. e seu metabólito secundário para o tratamento geral da dor, e é eficaz mesmo contra a dor crônica. VUČKOVIĆ S et al., 2018 Desregulação da barreira hematoencefálica por doenças neurológicas autoimunes CB1R e CB2R pode fornecer neuroproteção via proteção contra processos que danificam a BHE, como inflamação (CB2R-mediada), excitotoxicidade (CB1R-mediada) e morte celular (CB1R-mediado) e estresse oxidativo VENDEL E et al., 2017 AVC Δ9-O THC demonstrou efeitos positivos na oxigenação cerebral e no aumento do fluxo sanguíneo hemodinâmico para o córtex pré- frontal, KELES H.O et al., 2017 Diabetes O CBD e o Δ9-THCV, um canabinóide não psicoativo, demonstraram influenciar o metabolismo lipídico e glicídico em estudos com animais, sugerindo possíveis benefícios no controle do açúcar no sangue em pacientes com diabetes tipo 2. JADOON K.A et al., 2016 Esclerose múltipla O Sativex, um spray oral contendo uma combinação de Δ9-THC e CBD, é um medicamento aprovado pela FDA. Ele é feito a partir de extrato de cannabis de planta inteira e mostrou ser eficaz no alívio de sintomas de esclerose múltipla que variam de moderados a graves. RUSSO M et al., 2015 Transtornos de humor e ansiedade Ativação do receptor canabinóide 1 (CB1R) medeia recompensas naturais (como interação social, relação sexual e comida deliciosa) e recompensas de drogas (efeitos desejáveis). PARSONS L.H et al 2015 Doenças dermatológicas Os compostos canabinóides têm mostrado benefícios terapêuticos significativos no tratamento de lesões cutâneas, queimaduras e coceira associada a diversas condições dermatológicas. MANAÇO A.G.C 2014; CLARKE et al., 2013 Câncer Os canabinóides têm demonstrado propriedades analgésicas, antinauesantes, antidepressivas, antieméticas, antinociceptivas e orexígenas para tratamento paliativo. Além de indução de apoptose, autofagia e parada do ciclo celular, inibição da migração de células cancerosas, metástase, angiogênese, neovascularização, adesão e/ou invasão RAMER R et al., 2017; MASSI P et al 2013 Doença cardiovascular Estudos têm demonstrado que os canabinóides, incluindo o CBD, têm um papel cardioprotetor – prevenindo danos cardíacos, reduzindo os riscos e mantendo um coração e uma vasculatura “saudáveis” STANLEY C.P et al., 2013 Distúrbios do intestino e doença inflamatória intestinal Os receptores CB1 estão presentes no sistema nervoso entérico (ENS) e no eixo intestino-cérebro (GBA), uma comunicação vital entre o cérebro e o intestino. Isso sugere que problemas gastrointestinais podem ser abordados com medicamentos que visam especificamente esses receptores e a sinalização canabinóide no ENS. Galligan J.J 2009 Inflamação Endocanabinóides, como AEA e 2-AG, e fitocanabinóides, como Δ9-THC e CBD, demonstraram propriedades anti-inflamatórias e imunossupressoras via CB1R e CB2R NAGARKATTI P et al., 2009
Fonte: Autoria própria
A tabela fornece uma visão abrangente das doenças que podem potencialmente ser tratadas com canabinóides, destacando sua versatilidade e capacidade de interagir com o corpo humano de várias maneiras. A pesquisa sobre os benefícios terapêuticos dos canabinóides está em constante evolução, e os estudos citados fornecem uma base sólida para continuar explorando seu potencial medicinal.
3.3 A ESCLEROSE MÚLTIPLA
A esclerose múltipla (EM) é uma doença inflamatória autoimune que afeta o sistema nervoso central, principalmente a substância branca, levando a danos progressivos nos nervos em pessoas geneticamente predispostas. Nas últimas cinco décadas, houve grandes avanços na compreensão dos fatores genéticos de risco, na forma como o sistema imunológico é afetado e no desenvolvimento de diferentes tratamentos que ajudam a controlar a doença e melhorar a qualidade de vida das pessoas afetadas (DOSHI A et al., 2016).
Figura 3: Lesões desmielinizantes características de esclerose múltipla vista pela ressonância magnética.
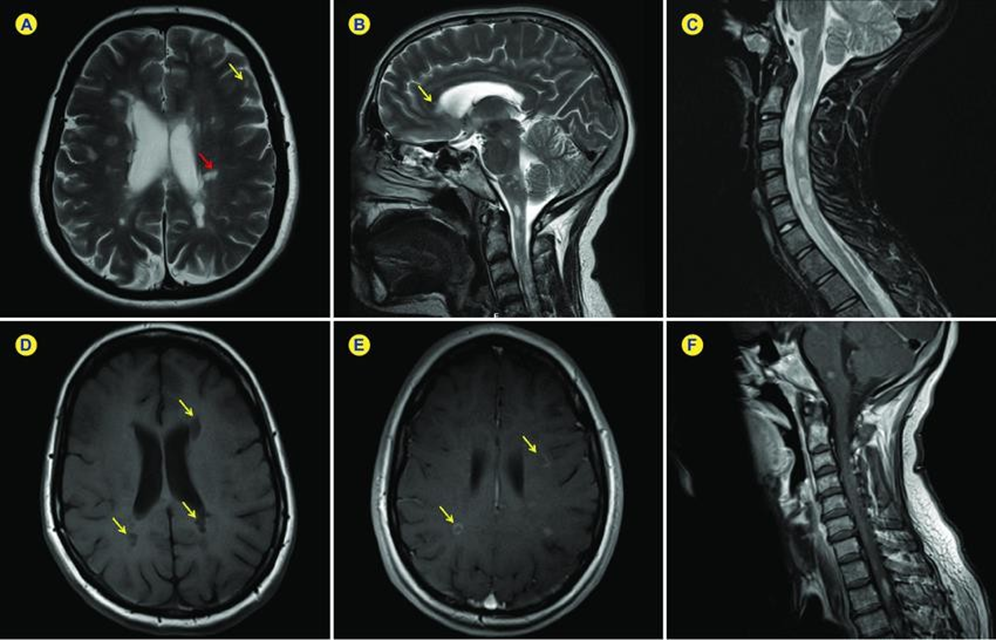
Fonte: PEIXOTO et al., 2016
As imagens de ressonância magnética (RM) fornecem informações cruciais sobre as lesões desmielinizantes características da esclerose múltipla (EM). Nas imagens ponderadas em T2 do cérebro (A e B) e da medula espinhal cervical (C), observam- se lesões hiperintensas na substância branca, próximas à superfície do córtex cerebral e ao redor dos ventrículos cerebrais. Algumas dessas lesões, chamadas de “lesões em dedos de Dawson”, são identificadas como áreas periventriculares de desmielinização perivascular. No cérebro, também é possível notar lesões no corpo caloso, uma característica comum da EM. Em contraste, as imagens ponderadas em T1 (D) revelam lesões hipointensas conhecidas como “black holes”. Após a administração de gadolínio endovenoso, as imagens em T1 realçam as lesões com captura de gadolínio (E e F), indicando inflamação ativa e disrupção da barreira hematoencefálica. As imagens da medula espinhal cervical (C) e torácica (F) mostram múltiplas lesões desmielinizantes, caracterizadas por sua relativamente pequena extensão, geralmente afetando até dois segmentos vertebrais. Essas informações são essenciais para o diagnóstico e monitoramento da EM, orientando o tratamento e a gestão clínica dos pacientes.
Devido a esta doença, foi originado o Agosto Laranja pela Lei federal nº 11.303, em 11 de maio de 2006, sendo dedicado à conscientização sobre a Esclerose Múltipla (EM). A conscientização desempenha um papel fundamental de apoio para pacientes e suas famílias (CÂMARA MUNICIPAL DE SP, 2023).
Epidemiologicamente, a EM é o distúrbio desmielinizante mais comum, obtendo uma prevalência de 1 por 1.000 indivíduos nos Estados Unidos e na Europa, com uma incidência progressiva e perceptível. Qualquer idade pode ser acometida, tendo um nível raro de acometimento em indivíduos maiores de 50 anos ou infantis. Na comparação de gêneros, as mulheres se tornam duas vezes mais afetadas em relação aos homens. Se um familiar de 1º grau possuir a doença, a chance de desenvolvimento aumenta 15 vezes, podendo ser 150 vezes maior se houver um gêmeo monozigótico afetado. O alelo HLA-DRB1*1501 também se relaciona (KUMAR, et al., 2018 – Robbins Patologia Básica).
Cassiano et al. (2020) constata através com dados coletados no DATASUS no período de 2008 a 2019, o número total de internações por Esclerose Múltipla no Brasil. Foram relatados 29.088 casos nas Regiões Norte, Nordeste, Sul, Sudeste e Centro-Oeste do país. Para um critério comparativo, o artigo também forneceu o número total de habitantes para a respectiva data, conforme dados do IBGE de 2020, totalizando aproximadamente 212 milhões de habitantes.
No período de 2012 a 2022, houve um total de 41.173 hospitalizações relacionadas à esclerose múltipla no Brasil, conforme mostrado na Tabela 2. O ano com o maior número de hospitalizações foi 2022, com 7.296 casos (17,8% do total), enquanto o menor número ocorreu em 2013, com 1.793 casos (4,3%). Ao longo desse período, observou-se um aumento gradual nas hospitalizações, variando de 1.806 (4,4%) em 2012 a 5.506 em 2021 (13,4%). Regionalmente, a região Norte teve o menor número de hospitalizações, com 802 casos (1,9% do total), em comparação com 3.043 no Nordeste (7,4%), 5.947 no Sul (14,4%) e 3.253 no Centro-Oeste (7,9%). Por outro lado, a região Sudeste registrou o maior número de internações durante o período, totalizando 28.128 casos (68,3% do total) (COELHO, et al., 2023).
Tabela 2: Número de internações por Esclerose Múltipla no período entre 2012 a 2022 por região do Brasil
ANO/REGIÃO NORTE NORDESTE SUDESTE SUL CENTRO- OESTE TOTAL ANUAL 2012 70 157 966 521 92 1.806 2013 49 157 911 581 95 1.793 2014 58 235 1.075 577 76 2.021 2015 64 231 1.053 604 126 2.078 2016 74 227 2.144 469 254 3.168 2017 81 216 2.689 483 670 4.139 2018 82 232 3.265 552 842 4.973 2019 78 354 3.365 533 94 4.424 2020 65 240 3.062 512 90 3.969 2021 114 453 4.129 502 308 5.506 2022 67 541 5.469 613 606 7.296 TOTAL 802 3.043 28.128 5.947 3.253 41.173
Fonte: Adaptado de Coelho et al. (2023)
A tabela que apresenta o número de internações por Esclerose Múltipla entre 2012 e 2022 por região do Brasil revela importantes insights sobre a distribuição e o impacto da doença ao longo do tempo. Notavelmente, o Sudeste emerge como a região com o maior número de internações, seguido de perto pelo Nordeste e Sul, sugerindo uma possível correlação entre densidade populacional e acesso aos serviços de saúde.
Gráfico 1 – Distribuição mundial de indivíduos com Esclerose Múltipla por 100,000 pessoas.
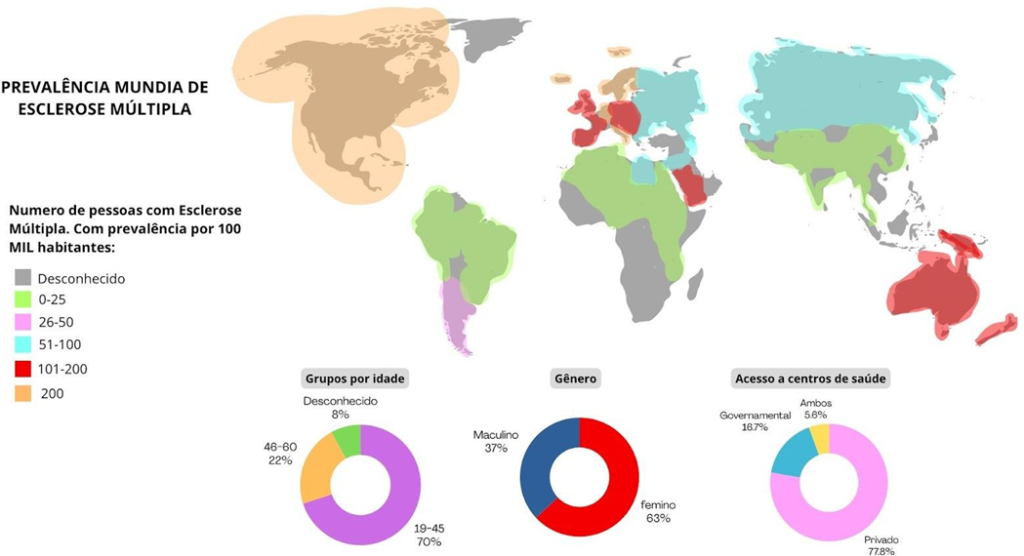
Fonte: Autoria própria.
Gráfico demonstrando a prevalência da EM em regiões distantes da Linha do Equador em uma distribuição mundial de pacientes com EM por 100.000 indivíduos.
A fisiopatologia e a origem da Esclerose Múltipla (EM) são intrincadas, abrangendo diversos elementos ambientais, infecciosos (como o vírus de Epstein- Barr), genéticos, nutricionais (como a carência de vitamina D) e epigenéticos, que podem influenciar o desenvolvimento e a progressão da condição. A causa inicial da inflamação na EM é alvo de especulação, mas é amplamente aceito que seja multifatorial, envolvendo influências genéticas e ambientais que desencadeiam uma resposta auto imune adaptativa, na qual os linfócitos T e B atacam o sistema nervoso central (SNC) (ELLIOTT C et al., 2019).
A genética desempenha um papel importante na suscetibilidade à doença, possivelmente combinada com fatores ambientais. Embora alguns pesquisadores sugerem uma ligação direta entre agentes infecciosos e a doença, esses agentes podem apenas criar um ambiente favorável para uma resposta autoimune contra a mielina do sistema nervoso central (PRYCE G et al., 2015).
Dessa forma, o complexo principal de histocompatibilidade e o sistema imune estão enormemente interligados. Conforme a Figura 3 e 4, é notável a grande influência das células TH1 e TH17, as quais agem diretamente no processo de desmielinização ao secretar e recrutar células imunes (macrófagos e leucócitos), as quais destroem a mielina através da formação de placas (lesões Einterespaçadas na substância branca) (KUMAR, et al., 2018 – Robbins Patologia Básica).
Figura 3: Fisiopatologia da Esclerose Múltipla
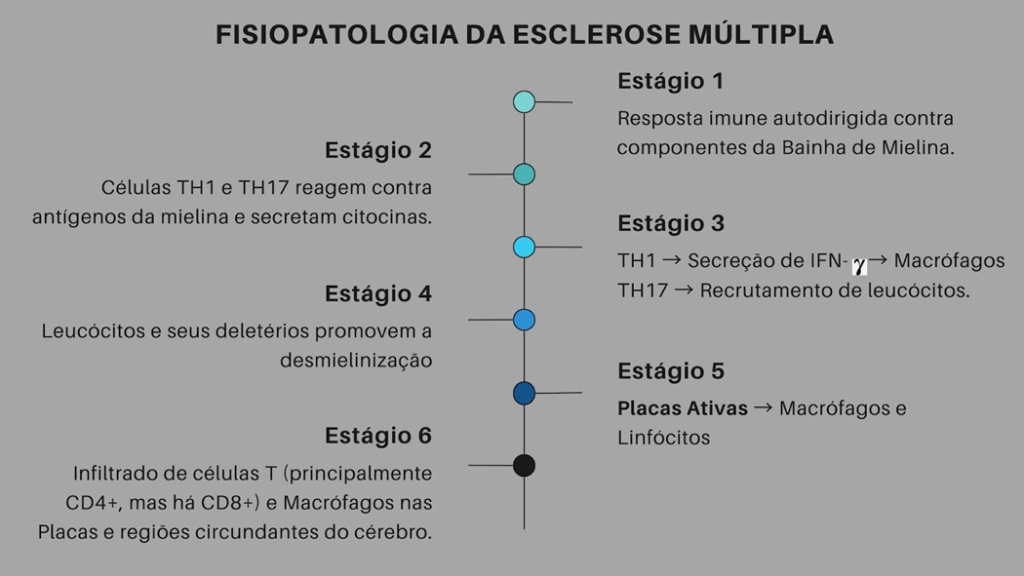
Fonte: Adaptado de Kumar et al. (2018) – Robbins Patologia Básica
A formação da esclerose múltipla envolve estágios distintos, como demonstrado na Figura 3. Inicialmente, uma resposta imune auto dirigida contra componentes da bainha de mielina ocorre, seguida pela ativação de células de defesa e desmielinização promovida por leucócitos. Isso leva à formação de placas ativas e infiltrado contínuo de células T, contribuindo para a progressão da doença. Essa sequência de eventos destaca a complexidade do processo patológico subjacente à esclerose múltipla.
A descrição clássica das lesões da EM envolve desmielinização inflamatória ao redor dos vasos sanguíneos, com a presença de linfócitos T, linfócitos B e células plasmáticas infiltradas. A neurodegeneração progressiva pode ocorrer independentemente da inflamação aguda, caracterizada pela perda de fibras nervosas e atrofia das regiões branca e cinzenta do cérebro. Embora a degeneração das fibras nervosas seja considerada o principal mecanismo biológico subjacente à progressão da doença, há um crescente reconhecimento de que a inflamação crônica também contribui para a perda de tecido cerebral e a acumulação de incapacidades (AMIN et al., 2023).
Figura 4: Atuação das células T e B na fisiopatologia da EM.
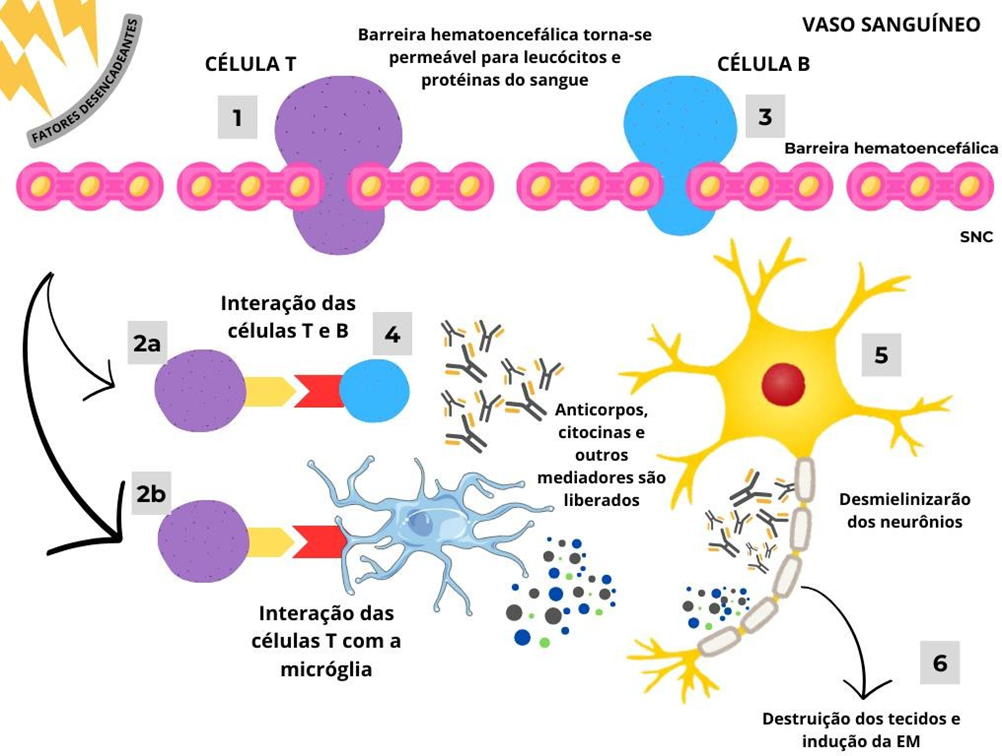
Fonte: Autoria própria.
A imunopatogênese da esclerose múltipla (EM) envolve a ativação de células T autorreativas na periferia, possivelmente por mimetismo molecular ou outros mecanismos desconhecidos. Essas células T ativadas atravessam a barreira hematoencefálica (BBB) interagindo com moléculas de adesão no endotélio da BBB e secretando metaloproteases da matriz para degradá-la. Uma vez no sistema nervoso central (SNC), as células T reativadas encontram antígenos locais do SNC através de interações com células apresentadoras de antígenos, como macrófagos ou micróglias, ou células B. Isso desencadeia a liberação de citocinas pró- inflamatórias pelas células T e a produção de anticorpos contra a mielina pelos plasmócitos, levando à destruição da bainha de mielina. A inflamação contínua no SNC recruta mais células inflamatórias, e a ativação da micróglia resulta na liberação de radicais livres, óxido nítrico e proteases, contribuindo para o dano tecidual e perda axonal.
Os tratamentos para esclerose múltipla evoluíram significativamente ao longo dos anos, com a transição de terapias injetáveis para opções orais mais eficazes, como fingolimod e ocrelizumabe, que demonstraram melhor tolerabilidade e eficácia aprimorada. Além disso, terapias de infusão, como natalizumab e alemtuzumabe, também mostraram eficácia significativa, apesar dos riscos associados, como leucoencefalopatia multifocal progressiva e reações adversas, exigindo monitoramento rigoroso durante o tratamento (GOLDSCHMIDT C et al., 2021).
É importante ressaltar que os canabinóides, outra opção terapêutica, têm mostrado potencial para melhorar a sintomatologia da esclerose múltipla sem causar efeitos colaterais graves, oferecendo assim uma abordagem terapêutica adicional para os pacientes (PRYCE G et al., 2015).
Figura 5: Mecanismos para a progressão da EM e seus sintomas
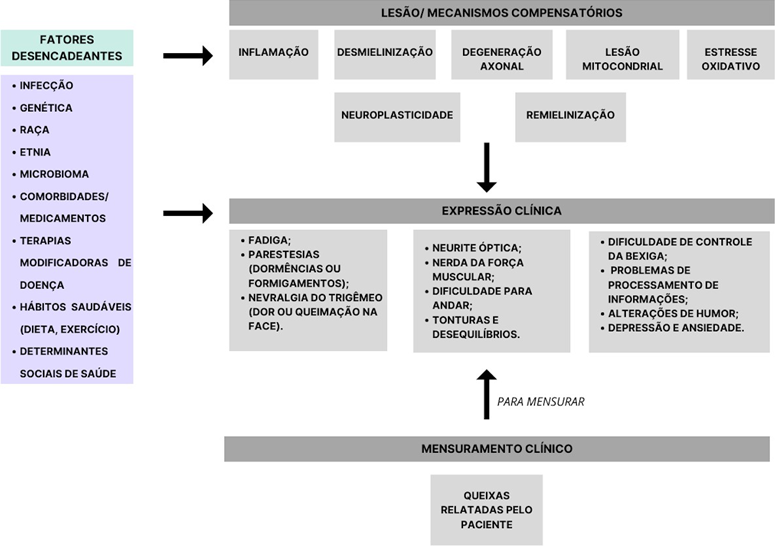
Fonte: Autoria própria.
A progressão da esclerose múltipla (EM) resulta de uma interação complexa entre mecanismos de lesão e compensação que ocorrem ao mesmo tempo no corpo, como evidenciado na Figura 5. Esses mecanismos começam a agir desde o início da doença, marcando o período inicial chamado de prodrômico. Durante todo o curso da EM, a expressão dos sintomas é determinada pelo equilíbrio desses mecanismos, juntamente com o processo de reparo tecidual. Além disso, a capacidade do corpo de se recuperar diminui com a idade, o que também influencia a progressão dos sintomas. É importante desenvolver medidas clínicas e biológicas sensíveis para monitorar continuamente a apresentação da doença e identificar lesões e mecanismos compensatórios nos pacientes. Além disso, diferentes fatores, chamados mediadores, podem ter efeitos positivos ou negativos nos mecanismos da doença, afetando a expressão dos sintomas ao longo do tempo.
1.4 ESCLEROSE MÚLTIPLA E O PAPEL DA CANNABIS: PERSPECTIVAS TERAPÊUTICAS E DESAFIOS
Pacientes com esclerose múltipla (EM) enfrentam uma ampla gama de sintomas. A espasticidade, marcada pelo aumento do tônus muscular, é uma complicação comum e séria que se agrava com a progressão da doença, levando a uma diminuição na mobilidade, fraqueza e fadiga. Além disso, contraturas nos músculos, tendões e articulações podem surgir, agravando ainda mais a capacidade de movimento e função dos membros (FILIPPINI, et al., 2022; HIDDING et al., 2024).
Figura 6: Divisão de tratamento para o manejo da EM.
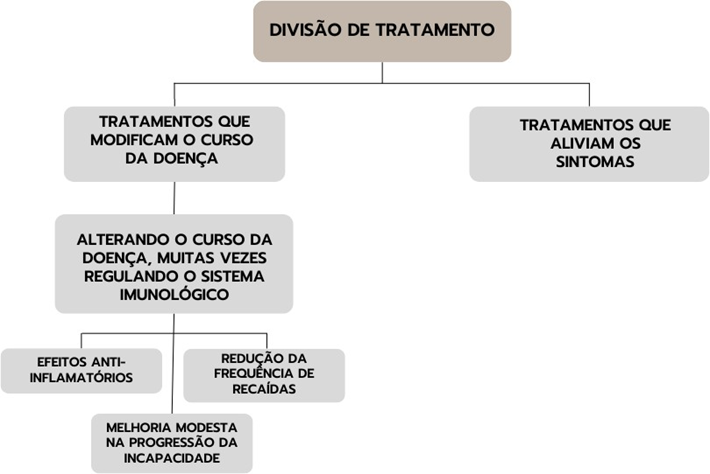
Fonte: Autoria própria.
Os medicamentos utilizados para o manejo da esclerose múltipla são geralmente divididos em dois grupos principais: tratamentos que modificam o curso da doença e tratamentos que aliviam os sintomas. Os tratamentos modificadores da doença atuam alterando o curso da doença, muitas vezes regulando o sistema imunológico. Esses tratamentos têm efeitos anti-inflamatórios, principalmente durante fases de recidiva da esclerose múltipla, reduzindo a frequência de recaídas, retardando o acúmulo de lesões observadas em exames de ressonância magnética e, em alguns casos, melhorando modestamente a progressão da incapacidade (NOUH, et al., 2024).
No entanto, os tratamentos sintomáticos têm como objetivo aliviar os sintomas, mas frequentemente são limitados pela sua toxicidade. Por exemplo, o uso prolongado de analgésicos para tratar a dor relacionada à esclerose múltipla levanta preocupações devido aos potenciais efeitos hepatotóxicos e ao risco de overdose prejudicial, especialmente em casos de dor intensa (HAUSER, et al., 2020; BRITO, et al., 2024).
Um estudo recente mostrou que o uso de cannabis em pacientes com EM pode alterar os níveis de citocinas pró-inflamatórias e anti-inflamatórias no sangue. Essas descobertas destacam o potencial terapêutico dos canabinoides na EM (MUSTAFA, et al., 2021; DUNCAN et al., 2024). Dessa forma, o uso de cannabis tem se tornado cada vez mais frequente e benéfico.
Nabiximols, também conhecido comercialmente como Sativex, é um extrato de cannabis que contém uma combinação de THC (tetrahidrocanabinol) e CBD (cannabidiol) em proporções específicas. É administrado como um spray bucal e é utilizado principalmente para o tratamento de sintomas relacionados à esclerose múltipla (EM), como espasticidade muscular (FILIPPINI et al., 2022).
Quando se trata de ensaios clínicos envolvendo nabiximols, é crucial estabelecer a dose ideal para cada paciente. Isso geralmente requer uma fase de titulação, na qual a dose é gradualmente aumentada até que o alívio ideal dos sintomas seja alcançado. Este processo é fundamental porque a resposta individual à cannabis pode variar significativamente de paciente para paciente (MÜLLER-VAHL et al., 2023).
Em ensaios clínicos com pacientes com EM, foi observado que a dose média eficaz de nabiximols é de cerca de oito pulverizações por dia, conforme relatado por Hazekamp et al. em 2018. No entanto, é importante ressaltar que essa dose média é apenas um ponto de referência e não deve ser considerada universalmente aplicável a todos os pacientes. Alguns pacientes podem requerer doses mais altas ou mais baixas para alcançar o alívio adequado dos sintomas (WANG et al., 2023).
O uso de produtos contendo canabinóides têm o potencial de afetar tanto os mecanismos patogênicos quanto os sintomas da EM. Eles podem suprimir a inflamação no sistema nervoso (via ativação de CB2) e exercer efeitos neuroprotetores no SNC (via ativação de CB1) (MESTRE, et al., 2018; BARRÉ, et al., 2023).
Os canabinóides também podem influenciar o sistema imunológico, relevante devido à hipótese autoimune da EM, demonstrada pelo aumento dos receptores CB1 e CB2 em amostras de sangue de pacientes. Ademais, experimentos em animais mostraram efeitos imunomoduladores dos canabinóides durante processos inflamatórios na EM (FITZPATRICK, et al., 2017; MESTRE, et al., 2018; OLÁH, et al., 2017; MARTINI, et al 2023).
Internacionalmente, as orientações sobre o uso de canabinóides na esclerose múltipla variam. Por exemplo, a Associação de Neurologistas Britânicos (ABN 2018) recomenda o uso de nabiximols em casos de resposta insatisfatória a tratamentos convencionais, enquanto a Academia Americana de Neurologia (AAN 2018) não apoia a prescrição de maconha medicinal para a EM, mas apoia pesquisas científicas sobre o tema (CAUCHI et al., 2022).
Apesar das divergências nas recomendações, a Agência Europeia de Medicamentos (EMA 2014) autorizou o uso de nabiximols para tratar espasticidade em adultos com EM que não responderam a tratamentos convencionais. No entanto, a FDA (Food and Drug Administration) ainda não aprovou medicamentos à base de canabinoides para a EM nos Estados Unidos. Essas informações refletem o crescente interesse e a necessidade de mais pesquisas sobre o uso terapêutico dos canabinoides na esclerose múltipla (RESTON, 2019; BRITO, et al., 2024).
1.5 AVANÇOS NO USO DE CANABINÓIDES NO TRATAMENTO DA ESCLEROSE MÚLTIPLA
Atualmente, a falta de um tratamento convencional universal para todos os estágios da esclerose múltipla (EM) persiste, enquanto o uso limitado de canabinóides aprovados pela FDA é devido à eficácia inconsistente, direcionamento inadequado e falta de compreensão da estabilidade das formulações comerciais de cannabis (NOUH, et al 2024).
Os canabinóides são lipofílicos, resultando em absorção e distribuição oral variáveis, afetados por flutuações na temperatura e exposição à luz, levando à rápida degradação. A biodisponibilidade limitada e a propensão à auto-oxidação complicam ainda mais seu uso generalizado (ADUSUMILLI, et al., 2021; HANSEN JS, et al., 2023).
No entanto, cientistas têm explorado nanotecnologia para superar essas limitações. Incorporando canabinóides em sistemas terapêuticos baseados em nano, busca-se melhorar sua estabilidade, reduzir a dosagem necessária e contornar a barreira hematoencefálica, direcionando especificamente lesões de EM com toxicidade mínima para tecidos neurais e células normais (LUCAS, et al., 2018; RAINKA, M et al 2023).
Estudos têm desenvolvido várias formulações de nanocanabinoides, incluindo nanopartículas lipídicas, micelas, nanopartículas de sílica e nanotubos de carbono. Esses avanços representam uma abordagem promissora para aprimorar o uso terapêutico de canabinóides no tratamento da esclerose múltipla, oferecendo potencial para redução de efeitos colaterais e melhoria da eficácia (MILLAR, et al., 2020; NOUH, et al 2024).
Esses avanços na formulação de nanocanabinoides representam uma nova fronteira na pesquisa sobre tratamentos para esclerose múltipla. Ao encapsular os canabinóides em nanoestruturas, os cientistas visam não apenas melhorar a estabilidade e a biodisponibilidade desses compostos, mas também direcioná-los de forma mais eficaz para as áreas afetadas no sistema nervoso central, onde podem exercer seu potencial terapêutico com maior precisão e menor toxicidade para os tecidos circundantes (ONAIVI, et al., 2020; NOUH, R. et al., 2023).
Além disso, a utilização de nanotecnologia permite explorar estratégias de liberação controlada, prolongando os efeitos terapêuticos dos canabinóides ao longo do tempo. Esses sistemas podem ser projetados para liberar gradualmente os compostos ativos, garantindo uma concentração terapêutica estável no organismo e potencialmente reduzindo a necessidade de doses frequentes e elevadas, minimizando assim os riscos e efeitos adversos (REBELATTO, et al., 2023; de Fátima M. et al., 2024).
Tabela 3: pesquisas utilizadas para dados dos avanços da cannabis no tratamento da EM
AUTORES ANO PESQUISA NOUH, et al 2024 “Unveiling the Potential of Cannabinoids in Multiple Sclerosis and the Dawn of Nano-Cannabinoid Medicine” REBELATTO, et al 2023 “An update of nano-based drug delivery systems for cannabinoids: Biopharmaceutical aspects & therapeutic applications” ADUSUMILLI, et al 2021 “Nanotechnology to deliver cannabinoids in dermatology” ONAIVI, et al 2020 “Challenges of cannabinoid delivery: How can nanomedicine help?” MILLAR, et al 2020 “Towards Better Delivery of Cannabidiol (CBD) Pharmaceuticals” LUCAS, et al 2018 “The pharmacokinetics and the pharmacodynamics of cannabinoids”
Fonte: autoria própria.
A tabela apresenta uma série de pesquisas recentes sobre o uso de canabinóides no tratamento da esclerose múltipla (EM) e em outras áreas terapêuticas. Esses estudos refletem o crescente interesse científico na utilização de canabinóides, especialmente com avanços na nanotecnologia, visando melhorar a eficácia e a entrega desses compostos medicinais.
2. CONCLUSÃO
Em suma, os canabinóides demonstram um amplo espectro de ação terapêutica, oferecendo promessa significativa para tratamentos mais eficazes e seguros em diversas condições médicas. Esses resultados promissores não apenas apontam para a melhoria da qualidade de vida dos pacientes com EM, mas também sugerem um potencial terapêutico ainda maior em outras condições neurológicas. Deste modo, investir em pesquisa de ponta e promover uma prática clínica baseada em evidências é essencial para oferecer tratamentos mais eficazes e seguros para EM e outras doenças.
Além disso, os resultados encorajadores observados em relação à EM apontam para um potencial terapêutico ainda maior em outras condições neurológicas, destacando a importância de explorar essa via de tratamento com mais profundidade. Nesse contexto, investir em pesquisa de ponta e promover uma prática clínica baseada em evidências emerge como uma necessidade imperativa. Ao fazer isso, não apenas podemos aprimorar os tratamentos disponíveis para pacientes com EM, mas também abrir novas perspectivas terapêuticas para outras doenças neurológicas.
Portanto, é essencial que os esforços sejam direcionados para aprofundar nossa compreensão dos efeitos dos canabinóides, bem como para desenvolver abordagens terapêuticas mais personalizadas e eficazes. Esta abordagem holística tem o potencial de transformar significativamente a maneira como enfrentamos não apenas a EM, mas uma variedade de condições médicas, melhorando assim a qualidade de vida dos pacientes em todo o mundo.
REFERÊNCIAS
RAMOS, Layane Andressa Martins et al. As principais doenças do sistema nervoso atendidas em ambulatórios de fisioterapia e suas repercussões na atenção à saúde: Revisão Narrativa. Revista CPAQV–Centro de Pesquisas Avançadas em Qualidade de Vida, v. 13, n. 1, p. 2, 2021.
DOS REIS ROSA FRANCO, Graziella; SMID, Scott; VIEGAS, Cláudio. Phytocannabinoids: general aspects and pharmacological potential in neurodegenerative diseases. Current Neuropharmacology, v. 19, n. 4, p. 449- 464, 2021.
FURGIUELE, Alessia et al. “Immunomodulatory Potential of Cannabidiol in Multiple Sclerosis: a Systematic Review.” Journal of neuroimmune pharmacology : the official journal of the Society on NeuroImmune Pharmacology. vol. 16,2, p. 251-269, 2021. doi:10.1007/s11481-021-09982-7 COELHO, V. B. C. P.; SALVADOR, V. L.; RODRIGUES, F. G.; WINGESTER, E.
L. C. Análise dos aspectos epidemiológicos da Esclerose Múltipla no Brasil durante o período de 2012 a 2022. Brazilian Journal of Health Review. v. 6, n. 6, p. 27513–27527, 2023. DOI: 10.34119/bjhrv6n6-078. Disponível em: https://ojs.brazilianjournals.com.br/ojs/index.php/BJHR/article/view/64693.
FILIPPINI G, MINOZZI S, BORRELLI F, CINQUINI M, DWAN K. Cannabis and cannabinoids for symptomatic treatment for people with multiple sclerosis. Cochrane Database Syst Rev. Maio, 2022 May. doi: 10.1002/14651858.CD013444.pub2.
HANSEN JS, HANSEN RM, PETERSEN T, et al. The Effect of Cannabis-Based Medicine on Neuropathic Pain and Spasticity in Patients with Multiple Sclerosis and Spinal Cord Injury: Study Protocol of a National Multicenter Double-Blinded, Placebo-Controlled Trial.
Brain Sci. Set, 2021. doi: 10.3390/brainsci11091212. ANDRADE, Wellington César; CASIMIRO, Luis Fernando Calheiros. Reflexões sobre o uso do Canabidiol no tratamento de doenças neurológicas: Direito fundamental à saúde e à vida. NATIVA-Revista de Ciências, Tecnologia e Inovação, v. 2, n. 1, p. 306-317, 2022.
FRAZÃO, Henrique Tostes; OLIVEIRA, Carla Resende Vaz; REIS, Bruno Cezario Costa. O uso de cannabis medicinal em portadores de transtornos psiquiátricos: uma revisão da literatura. Revista Eletrônica Acervo Médico, v. 20, p. e11076- e11076, 2022.
CHAYASIRISOBHON, S. Mecanismos de ação e farmacocinética da cannabis. Perm J. v. 25, p. 1-3, dez. 2020. DOI: 10.7812/TPP/19.200. PMID: 33635755; PMCID: PMC8803256.
PAIN, S. A potted history. Nature, v. 525, n. 7570, p. S10-1, set. 2015. DOI: 10.1038/525S10a. PMID: 26398731.
JONES, É.; VLACHOU, S. A Critical Review of the Role of the Cannabinoid Compounds Δ9-Tetrahydrocannabinol (Δ9-THC) and Cannabidiol (CBD) and their Combination in Multiple Sclerosis Treatment. Molecules, v. 25, n. 21, p. 4930, out. 2020. DOI: 10.3390/molecules25214930.
ANDRE, C. M.; HAUSMAN, J. F.; GUERRIERO, G. Cannabis sativa: The Plant of the Thousand and One Molecules. Front Plant Sci. fev. 2016. DOI: 10.3389/fpls.2016.00019.
LOWE, H. ET AL. The Endocannabinoid System: A Potential Target for the Treatment of Various Diseases. International journal of molecular sciences. ago. 2021. DOI: 10.3390/ijms22179472.
AL-GHEZI, Z. Z.; MIRANDA, K.; NAGARKATTI, M.; NAGARKATTI, P. S.
Combination of Cannabinoids, Δ9-Tetrahydrocannabinol and Cannabidiol, Ameliorates Experimental Multiple Sclerosis. Front Immunol. ago. 2019. DOI: 10.3389/fimmu.2019.01921. PMID: 31497013; PMCID: PMC6712515.
PETZKE, F.; TÖLLE, T.; FITZCHARLES, M. A.; HÄUSER, W. Medicamentos à base de cannabis e cannabis medicinal para dor neuropática crônica. Drogas do SNC, v. 36, n. 1, p. 31-44, jan. 2022. DOI: 10.1007/s40263-021-00879-w. EPub 21 de novembro de 2021. PMID: 34802112; PMCID: PMC8732831.
LOWE, H.; TOYANG, N.; STEELE, B.; BRYANT, J.; NGWA, W. O Sistema Endocanabinóide: Um Alvo Potencial para o Tratamento de Várias Doenças. Int J Mol Sci, v. 22, n. 17, p. 9472, ago. 2021. DOI: 10.3390/ijms22179472. PMID: 34502379; PMCID: PMC8430969.
BLESSING, E. M.; STEENKAMP, M. M.; MANZANARES, J.; MARMAR, C. R.
Cannabidiol as a Potential Treatment for Anxiety Disorders. Neurother. J. Am. Soc. Exp. Neurother., v. 12, p. 825–836, 2015. doi: 10.1007/s13311-015-0387-1. STAMPANONI BASSI, M.; GILIO, L.; MAFFEI, P.; DOLCETTI, E.; BRUNO, A.;
BUTTARI, F.; CENTONZE, D.; IEZZI, E. Exploiting the Multifaceted Effects of Cannabinoids on Mood to Boost Their Therapeutic Use Against Anxiety and Depression. Front. Mol. Neurosci., v. 11, p. 424, 2018. doi: 10.3389/fnmol.2018.00424.
VUČKOVIĆ, S.; SREBRO, D.; VUJOVIĆ, K. S.; VUČETIĆ, Č.; PROSTRAN, M.
Cannabinoids and Pain: New Insights From Old Molecules. Front. Pharmacol., v. 9, p. 1259, 2018. doi: 10.3389/fphar.2018.01259.
BURSTEIN, S. Cannabidiol (CBD) and its analogs: A review of their effects on inflammation. Bioorg. Med. Chem., v. 23, p. 1377–1385, 2015. doi: 10.1016/j.bmc.2015.01.059.
STANLEY, C. P.; HIND, W. H.; O’SULLIVAN, S. E. Is the cardiovascular system a therapeutic target for cannabidiol? Br. J. Clin. Pharmacol., v. 75, p. 313–322, 2013. doi: 10.1111/j.1365-2125.2012.04351.x.
MARKOVÀ, J. et al. Sativex as add-on therapy vs. further optimized first-line ANTispastics (SAVANT) in resistant multiple sclerosis spasticity: A double-blind, placebo-controlled randomised clinical trial. *International Journal of Neuroscience*, v. 129, p. 119–128, 2019. doi: 10.1080/00207454.2018.1481066. AL-GHEZI, Z. Z.; MIRANDA, K.; NAGARKATTI, M.; NAGARKATTI, P. S.
Combinação de canabinóides, δ9-tetrahidrocanabinol e canabidiol, melhora a esclerose múltipla experimental suprimindo a neuroinflamação através da regulação de vias de sinalização mediadas por miRNA. Imunol frontal., v. 10, p. 1921, 2019. doi: 10.3389/fimmu.2019.01921.
MANAÇO, A. G. C. Composição para o Tratamento de Lesões de Pele. US20140302185A1. Patente dos EUA. 9 de outubro de 2014.
CLARKE, R. C.; MERLIN, M. D. Cannabis: Evolução e Etnobotânica. Imprensa da Universidade da Califórnia; Berkeley, CA, EUA: 2013.
GALLIGAN, J. J. Sinalização canabinóide no sistema nervoso entérico. Neurogastroenterol. Motil., v. 21, p. 899–902, 2009. doi: 10.1111/j.1365- 2982.2009.01372.x.
RUSSO, M. et al. Sativex no manejo da espasticidade relacionada à esclerose múltipla: Papel da modulação corticoespinhal. Neural. Plast., v. 2015, 2015. doi: 10.1155/2015/656582.
VENDEL, E.; DE LANGE, E. C. M. Funções do CB1 e CB2 Receptores em Neuroproteção ao Nível da Barreira Hematoencefálica. Neuromol., v. 16, p. 620– 642, 2014. doi: 10.1007/s12017-014-8314-x.
LATTANZI, S. et al. Eficácia e segurança do canabidiol na epilepsia: uma revisão sistemática e metanálise. Drogas., v. 78, p. 1791–1804, 2018. doi: 10.1007/s40265-018-0992-5.
HAMILTON, I., MONAGHAN, M. Cannabis e psicose: estamos mais próximos de entender a relação. *Curr. Rep. de Psiquiatria*, 2019; 21:48. DOI: 10.1007/s11920-019-1044-x.
MANSEAU, M. W., GOFF, D. C. Canabinóides e Esquizofrenia: Riscos e Potencial Terapêutico. *Neurother. J. Am. Soc.*, 2015; 12:816–824. DOI: 10.1007/s13311-015-0382-6.
RAMER, R., HINZ, B. Canabinóides como drogas anticancerígenas. *Adv. Farmacol.*, 2017; 80:397–436. DOI: 10.1016/bs.apha.2017.04.002.
KELES, H. O. et al. Usando espectroscopia funcional no infravermelho próximo para medir os efeitos do Delta 9-tetrahidrocanabinol na atividade pré-frontal e memória de trabalho em usuários de cannabis. *Frente. Hum.*, 2017; 11:488. DOI: 10.3389/fnhum.2017.00488.
JADOON, K. A. et al. Eficácia e segurança do canabidiol e tetrahidrocanabinarina em parâmetros glicêmicos e lipídicos em pacientes com diabetes tipo 2: um estudo piloto randomizado, duplo-cego, controlado por placebo, de grupo paralelo. *Atenção ao Diabetes*, 2016; 39:1777–1786. DOI: 10.2337/dc16-0650. STANLEY, C. P., HIND, W. H., O’SULLIVAN, S. E. O sistema cardiovascular é um alvo terapêutico para o canabidiol? *Irmão J. Clin. Farmacol.*, 2013; 75:313–322. DOI: 10.1111/j.1365-2125.2012.04351.x.
PARSONS, L. H., HURD, Y. L. Sinalização endocanabinóide em recompensa e dependência. *Rev. Neurosci.*, 2015; 16:579–594. DOI: 10.1038/NRN4004.
VUČKOVIĆ, S. et al. Canabinóides e Dor: Novos Insights de Moléculas Antigas.
*Frente. Farmacol.*, 2018; 9:1259. DOI: 10.3389/fphar.2018.01259. GOLDSCHMIDT, C., MCGINLEY, D. Avanços no Tratamento da Esclerose Múltipla. *Neurol Clin*, Fev 2021; 39(1):21-33. DOI: 10.1016/j.ncl.2020.09.002. EPub 2020 7 de novembro.
DOSHI, A., CHATAWAY, J. Esclerose múltipla, uma doença tratável. *Clin Med (Lond)*, 2016 Dez; 16 (Suppl 6): s53-s59. DOI: 10.7861/clinmedicine.16-6-s53. PRYCE, G. et al. Neuroproteção na Encefalomielite Autoimune Experimental e Esclerose Múltipla Progressiva por Canabinóides à Base de Cannabis. *J Farmacol Neuroimune*, 2015; 10(2):281-292. DOI:10.1007/s11481-014-9575-8.
AMIN, M., HERSH, C. M. Updates and advances in multiple sclerosis neurotherapeutics. *Neurodegenerative disease management*, vol. 13,1, 2023, pp. 47-70. doi:10.2217/nmt-2021-0058.
KUMAR, V. Robbins Patologia Básica. 10ª Edição. Guanabara Koogan, 2018. ELLIOTT, C., WOLINSKY, J. S., HAUSER, S. L. et al. Lesões de expansão/evolução lenta como marcador de ressonância magnética de lesões de esclerose múltipla crônica ativa. *Mult. Escler.*, v. 25, p. 1915–1925, 2019.
CASSIANO, D. P. et al. Estudo epidemiológico sobre internações por esclerose múltipla no Brasil comparando sexo, faixa etária e região entre janeiro de 2008 a junho de 2019. *Brazilian Journal of Health Review*, 2020.
MESTRE, L. et al. Microbiota intestinal, sistema canabinóide e interações neuroimunes: novas perspectivas na esclerose múltipla. *Farmacologia Bioquímica*, 2018; 157:51-66.
RESTON, V. A. MMJ arquiva pedido de aprovação rápida da FDA para a droga da esclerose múltipla da cannabis [comunicado de imprensa]. Fevereiro de 2019. Disponível em markets.businessinsider.com/news/stocks/mmj-files-fda-fast-track- approval-application-for-cannabis-multiple-sclerosis-drug-1027948379.
ASSOCIAÇÃO DE NEUROLOGISTAS BRITÂNICOS. Diretrizes provisórias do ABN: uso de produtos à base de cannabis em neurologia. Dezembro de 2018. Disponível em https://cdn.ymaws.com/www.theabn.org/resource/collection/6750BAE6-4CBC- 4DDB-A684-116E03BFE634/ABN_2018_Guidelines_-_Use_of_cannabis- based_pr.pdf.
NEWSOME, S. D. et al. A estrutura de cuidados na esclerose múltipla, parte 2: cuidados sintomáticos e além. *Revista Internacional de MS Care*, 2017; 19(1):42-56.
MUSTAFA, W. et al. O efeito da cannabis nos perfis clínico e de citocinas em pacientes com esclerose múltipla. *Esclerose Múltipla Internacional*, 2021; 5 fev; 2021:6611897.
FITZPATRICK, J. K.; DOWNER, E. J. Sinalização do receptor toll-like como alvo canabinóide na esclerose múltipla. *Neurofarmacologia*, 2017; 113 (Pt B): 618- 26.
OLÁH, A.; SZEKANECZ, Z.; BÍRÓ, T. Visando a sinalização canabinoide no sistema imunológico: perguntas, possibilidades e desafios “altamente emocionantes”. *Fronteiras em Imunologia*, 2017; 8:1487.
FILIPPINI, G. et al. Cannabis e canabinóides para tratamento sintomático para pessoas com esclerose múltipla. *Cochrane Database Syst Rev*, 2022 5 de maio; 5(5):CD013444. DOI: 10.1002/14651858.CD013444.pub2.
HAZEKAMP, A. O problema com o óleo CBD. Cannabis medicinal e canabinóides, 2018; 1:65–72.
NOUH, R. A. et al. Unveiling the Potential of Cannabinoids in Multiple Sclerosis and the Dawn of Nano-Cannabinoid Medicine. *Pharmaceutics*, 2024 Feb 7;16(2):241. doi: 10.3390/pharmaceutics16020241. PMID: 38399295; PMCID: PMC10891830.
HAUSER, S. L.; CREE, B. A. C. Tratamento da Esclerose Múltipla: Uma Revisão.
*Am. J. Med.*, 2020; 133:1380–1390.e2. DOI: 10.1016/j.amjmed.2020.05.049.
ADUSUMILLI, N. C. et al. Nanotechnology to deliver cannabinoids in dermatology. *Precis. Nanomed.*, 2021;4:787–794. doi: 10.33218/001c.24597. LUCAS, C. J.; GALETTIS; SCHNEIDER, J. The pharmacokinetics and the pharmacodynamics of cannabinoids. *Br. J. Clin. Pharmacol.*, 2018;84:2477. doi: 10.1111/bcp.13710.
MILLAR, S. A. et al. Towards Better Delivery of Cannabidiol (CBD) Pharmaceuticals. 2020;13:219. doi: 10.3390/ph13090219.
ONAIVI, E. S. et al. Challenges of cannabinoid delivery: How can nanomedicine help? *Nanomedicine*, 2020;15:2023–2028. doi: 10.2217/nnm-2020-0221.
REBELATTO, E. R. L. et al. An update of nano-based drug delivery systems for cannabinoids: Biopharmaceutical aspects & therapeutic applications. *Int. J. Pharm.*, 2023;635:122727. doi: 10.1016/j.ijpharm.2023.122727.
YANG, Y. et al. Bioactive Chemical Composition of Cannabis Extracts and Cannabinoid Receptors. *Molecules*, 2020;25(15):3466. Published 2020 Jul 30. doi:10.3390/molecules25153466.
HERREROS, I. et al. Prejuízo de adaptação motora em usuários crônicos de cannabis avaliado por uma tarefa de rotação visomotora. *J. Clin.*, 2019; 8:1049. DOI: 10.3390/jcm8071049.
CONTE, A. et al. Cannabinoid-induced effects on the nociceptive system: a neurophysiological study in patients with secondary progressive multiple sclerosis. *European Journal of Pain*, 2009;13(5):472-7. – PubMed
COREY-BLOOM, J. et al. Smoked cannabis for spasticity in multiple sclerosis: a randomized, placebo-controlled trial. *Canadian Medical Association Journal*, 2012;184:1143–50. – PMC – PubMed
SVENDSEN, K. B. et al. Does the cannabinoid dronabinol reduce central pain in multiple sclerosis? Randomised double blind placebo controlled crossover trial. *BMJ*, 2004;329(7460):253. – PMC – PubMed
KATONA, S. et al. Cannabinoid influence on cytokine profile in multiple sclerosis.
*Clinical and Experimental Immunology*, 2005;140(3):580-5. – PMC – PubMed ZAJICEK, J. P. et al. Multiple sclerosis and extract of cannabis: results of the MUSEC trial. *Journal of Neurology, Neurosurgery and Psychiatry*, 2012;83:1125–32. – PubMed
BALL, S. et al. The Cannabinoid Use in Progressive Inflammatory brain Disease (CUPID) trial: a randomised double-blind placebo-controlled parallel-group multicentre trial and economic evaluation of cannabinoids to slow progression in multiple sclerosis. *Health Technology Assessment (Winchester, England)*, 2015;19(12:vii-viii, xxv-xxxi):1-187. – PMC – PubMed
ZAJICEK, J. et al. Effect of dronabinol on progression in progressive multiple sclerosis (CUPID): a randomised, placebo-controlled trial. *Lancet Neurology*, 2013;12(9):857-65. – PMC – PubMed
BLACK, N. et al. Cannabinoids for the treatment of mental disorders and symptoms of mental disorders: a systematic review and meta-analysis. *Lancet Psychiatry*, 2019;6(12):995-1010. – PMC – PubMed
GREENBERG, H. S. et al. Short-term effects of smoking marijuana on balance in patients with multiple sclerosis and normal volunteers. *Clinical Pharmacology & Therapeutics*, 1994;55(3):324-8. – PubMed
GRIMALDI, A. E. et al. The influence of physiotherapy intervention on patients with multiple sclerosis-related spasticity treated with nabiximols (THC:CBD oromucosal spray). *PLOS One*, 2019;14(7):e0219670. – PMC – PubMed NOTCUTT, W. et al. Initial experiences with medicinal extracts of cannabis for chronic pain: results from 34 ‘N of 1’ studies. *Anaesthesia*, 2004;59(5):440-52. – PubMed
PRATT, M. et al. Benefits and harms of medical cannabis: a scoping review of systematic reviews. *Systematic Reviews*, 2019;8(1):320. – PMC – PubMed REZAPOUR-FIROUZI, S. et al. Erythrocyte membrane fatty acids in multiple sclerosis patients and hot-nature dietary intervention with co-supplemented hemp-seed and evening-primrose oils. *African Journal of Traditional, Complementary, and Alternative Medicines: AJTCAM*, 2013;10(6):519-27. – PMC – PubMed
WARE, M. A. et al. Smoked cannabis for chronic neuropathic pain: a randomized controlled trial. *CMAJ: Canadian Medical Association Journal*, 2010;182(14):E694-701. – PMC – PubMed
WILSEY, B. et al. A randomized, placebo-controlled, crossover trial of cannabis cigarettes in neuropathic pain. *Journal of Pain*, 2008;9(6):506-21. – PMC – PubMed
WILSEY, B. et al. Low-dose vaporized cannabis significantly improves neuropathic pain. *Journal of Pain*, 2013;14(2):136-48. – PMC – PubMed Panagis G., MACKey B., VLACHOU S. Cannabinoid Regulation of Brain Reward
Processing with an Emphasis on the Role of CB1 Receptors: A Step Back into the Future. **Front. Psychiatry.** 2014;5:92. doi: [10.3389/fpsyt.2014.00092](https://doi.org/10.3389/fpsyt.2014.00092).
BRUNI N., DELLA PEPA C., OLIARO-BOSSO S., Pessione E., GASTALDI D., DOSIO F. Cannabinoid Delivery Systems for Pain and Inflammation Treatment.
**Molecules.** 2018;23:2478. doi: [10.3390/molecules23102478](https://doi.org/10.3390/molecules23102478).
RICE J., CAMERON M.H. Cannabinoids for Treatment of MS Symptoms: State of the Evidence. **Curr. Neurol. Neurosci. Rep.** 2018;18:50. doi: [10.1007/s11910- 018-0859-x](https://doi.org/10.1007/s11910-018-0859-x).
GIACOPPO S., RAJAN T.S., GALUPPO M., Pollastro F., GRASSI G., BRAMANTI P., MAZZON E. Purified Cannabidiol, the main non-psychotropic component of Cannabis sativa, alone, counteracts neuronal apoptosis in experimental multiple sclerosis. **Eur. Rev. Med. Pharmacol. Sci.** 2015;19:4906–4919. doi: [N/A](https://pubmed.ncbi.nlm.nih.gov/).
FITZPATRICK J.-M.K., DOWNER E.J. Toll-like receptor signalling as a cannabinoid target in Multiple Sclerosis. **Neuropharmacology.** 2017;113:618– 626. doi: [10.1016/j.neuropharm.2016.04.009](https://doi.org/10.1016/j.neuropharm.2016.0 4.009).
RUDICK R.A. Disease-modifying drugs for relapsing-remitting multiple sclerosis and future directions for multiple sclerosis therapeutics. **Arch. Neurol.** 1999;56:1079–1084. doi: [10.1001/archneur.56.9.1079](https://doi.org/10.1001/archneur.56.9.1079). PERTWEE R.G. Targeting the endocannabinoid system with cannabinoid receptor agonists: Pharmacological strategies and therapeutic possibilities.
**Philos. Trans. R. Soc. B Biol. Sci.** 2012;367:3353–3363. doi: [10.1098/rstb.2011.0381](https://doi.org/10.1098/rstb.2011.0381).
GUERRERO-ALBA R., BARRAGAN-IGLESIAS P., GONZALEZ-HERNANDEZ A., VALDEZ-MORÁLES E.E., GRANADOS-SOTO V., CONDÉS-LARA M., RODRÍGUEZ M.G., MARICHAL-CANCINO B.A. Some Prospective Alternatives for Treating Pain: The Endocannabinoid System and Its Putative Receptors GPR18 and GPR55. **Front. Pharmacol.** 2019;9:1496. doi: [10.3389/fphar.2018.01496](https://doi.org/10.3389/fphar.2018.01496).
DE PETROCELLIS L., DI MARZO V. An introduction to the endocannabinoid system: From the early to the latest concepts. **Best Pr. Res. Clin. Endocrinol. Metab.** 2009;23:1–15. doi: [10.1016/j.beem.2008.10.013](https://doi.org/10.1016/j.beem.2008.10.013).
UJVÁRY I., HANUŠ L. Human Metabolites of Cannabidiol: A Review on Their Formation, Biological Activity, and Relevance in Therapy. **Cannabis
Cannabinoid Res.** 2016;1:90–101. doi: [10.1089/can.2015.0012](https://doi.org/10.1089/can.2015.0012). WATKINS A.R. Cannabinoid interactions with ion channels and receptors. 2019;13:162–167. doi:[10.1080/19336950.2019.1615824](https://doi.org/10.1080/19336950.2019.16158 24).
MILLAR S.A., STONE N.L., YATES A.S., O’SULLIVAN S.E. A Systematic Review on the Pharmacokinetics of Cannabidiol in Humans. **Front. Pharmacol.** 2018;9:1365. doi:
[10.3389/fphar.2018.01365](https://doi.org/10.3389/fphar.2018.01365). HILLIARD A., STOTT C., WRIGHT S., GUY G., PRYCE G., AL-IZKI S., BOLTON
C., GIOVANNONI G. Evaluation of the Effects of Sativex (THC BDS: CBD BDS) on Inhibition of Spasticity in a Chronic Relapsing Experimental Allergic Autoimmune Encephalomyelitis: A Model of Multiple Sclerosis. **ISRN Neurol.** 2012;2012:1–7. doi:[10.5402/2012/802649](https://doi.org/10.5402/2012/802649).
MECHA M, FELIU A, INIGO PM, MESTRE L, CARRILLO-SALINAS FJ, GUAZA C. Cannabidiol provides long-lasting protection against the deleterious effects of inflammation in a viral model of multiple sclerosis: a role for A2A receptors.
Neurobiol Dis. (2013) 59:141–50. [10.1016/j.nbd.2013.06.016](https://doi.org/10.1016/j.nbd.2013.06.016).
PRYCE G, RIDDALL DR, SELWOOD DL, GIOVANNONI G, BAKER D.
Neuroprotection in experimental autoimmune encephalomyelitis and progressive multiple sclerosis by cannabis-based cannabinoids. J Neuroimmune Pharmacol. (2015) 10:281–92. [10.1007/s11481-014-9575-8](https://doi.org/10.1007/s11481-014-9575-8).
CONFAVREUX C, VUKUSIC S, MOREAU T, ADELEINE P. Relapses and progression of disability in multiple sclerosis. **N Engl J Med.** (2000) 343:1430– 8. [10.1056/NEJM200011163432001](https://doi.org/10.1056/NEJM2000111634320 01).
HOJSGAARD CHOW H, SCHREIBER K, MAGYARI M, AMMITZBOLL C, BORNSEN L, CHRISTENSEN JP, ET AL. . Progressive multiple sclerosis, cognitive function, and quality of life. Brain Behav. (2018) [10.1002/brb3.875](https://doi.org/10.1002/brb3.875).
HUANG WJ, CHEN WW, ZHANG X. Multiple sclerosis: pathology, diagnosis and treatments. Exp Ther Med. (2017) 13:3163–6. [10.3892/etm.2017.4410](https://doi.org/10.3892/etm.2017.4410).
NAGARKATTI P, PANDEY R, RIEDER SA, HEGDE VL, NAGARKATTI M.
Cannabinoids as novel anti-inflammatory drugs. Future Med Chem. (2009) 1:1333–49. [10.4155/fmc.09.93](https://doi.org/10.4155/fmc.09.93).
FELIU A, MORENO-MARTET M, MECHA M, CARRILLO-SALINAS FJ, DE LAGO E, FERNANDEZ-RUIZ J, ET AL. . A Sativex((R)) -like combination of phytocannabinoids as a disease-modifying therapy in a viral model of multiple sclerosis. Br J Pharmacol. (2015) 172:3579–95. [10.1111/bph.13159](https://doi.org/10.1111/bph.13159).
KENDALL DA, YUDOWSKI GA. Cannabinoid receptors in the central nervous system: their signaling and roles in disease. Front Cell Neurosci. (2016) 10:294. [10.3389/fncel.2016.00294](https://doi.org/10.3389/fncel.2016.00294).
ROUSE M, SINGH NP, NAGARKATTI PS, NAGARKATTI M. Indoles mitigate the development of experimental autoimmune encephalomyelitis by induction of reciprocal differentiation of regulatory T cells and Th17 cells. Br J Pharmacol. (2013) 169:1305–21.[10.1111/bph.12205](https://doi.org/10.1111/bph.12205).
WANG H, XU W, SHAO Q, DING Q. miR-21 silencing ameliorates experimental autoimmune encephalomyelitis by promoting the differentiation of IL-10– producing B cells. Oncotarget. (2017) 8:94069–79. [10.18632/oncotarget.21578](https://doi.org/10.18632/oncotarget.21578).
RIBEIRO A, FERRAZ-DE-PAULA V, PINHEIRO ML, VITORETTI LB, MARIANO-SOUZA DP, QUINTEIRO-FILHO WM, ET AL. . Cannabidiol, a non-psychotropic plant-derived cannabinoid, decreases inflammation in a murine model of acute lung injury: role for the adenosine A(2A) receptor. Eur J Pharmacol. (2012) 678:78–85.[10.1016/j.ejphar.2011.12.043](https://doi.org/10.1016/j.ejphar.2011.12.043). SISAY S, PRYCE G, JACKSON SJ, TANNER C, ROSS RA, MICHAEL GJ, ET
AL. . Genetic background can result in a marked or minimal effect of gene knockout (GPR55 and CB2 receptor) in experimental autoimmune encephalomyelitis models of multiple sclerosis. PLoS ONE. (2013) 8:e76907. [10.1371/journal.pone.0076907](https://doi.org/10.1371/journal.pone.0076907). MCPARTLAND JM, DUNCAN M, DI MARZO V, PERTWEE RG. Are cannabidiol and Delta(9) -tetrahydrocannabivarin negative modulators of the endocannabinoid system? A systematic review. Br J Pharmacol. (2015) 172:737–53. [10.1111/bph.12944](https://doi.org/10.1111/bph.12944).
TURRI M, TEATINI F, DONATO F, ZANETTE G, TUGNOLI V, DEOTTO L, ET AL. . Pain modulation after oromucosal cannabinoid spray (SATIVEX((R))) in patients with multiple sclerosis: a study with quantitative sensory testing and laser-evoked potentials. Medicines. (2018) 5:59. [10.3390/medicines5030059](https://doi.org/10.3390/medicines5030059).
YANG X, HEGDE VL, RAO R, ZHANG J, NAGARKATTI PS, NAGARKATTI M.
Histone modifications are associated with Delta9–tetrahydrocannabinol-mediated alterations in antigen-specific T cell responses. J Biol Chem. (2014) 289:18707–18. [10.1074/jbc.M113.545210](https://doi.org/10.1074/jbc.M113.545210). GASTON TE, BEBIN EM, CUTTER GR, LIU Y, SZAF LARSKI JP, THE UAB CBDPROGRAM . Interactions between cannabidiol and commonly used antiepileptic drugs. **Epilepsia** (2017) 58:1586–92. [10.1111/epi.13852](https://doi.org/10.1111/epi.13852).
IACOBAEUS E, DOUAGI I, JITSCHIN R, MARCUSSON-STÅHL M, TÖRNQVIST ANDRÉN A, GAVIN C, ET AL. Phenotypic and functional alterations of myeloid derived suppressor cells during the disease course of multiple sclerosis.
**Immunol Cell Biol** (2018). [10.1111/imcb.12042](https://doi.org/10.1111/imcb.12042).
BÖRNSEN L, ROMME CHRISTENSEN J, RATZER R, HEDEGAARD C, SØNDERGAARD HB, KRAKAUER M, ET AL. Endogenous interferon-β-inducible gene expression and interferon-β-treatment are associated with reduced T cell responses to myelin basic protein in multiple sclerosis. **PLoS One** (2015) 10:e0118830.
[10.1371/journal.pone.0118830](https://doi.org/10.1371/journal.pone.0118830). CANTONI C, CIGNARELLA F, GHEZZI L, MIKESELL B, BOLLMAN B, BERRIEN-ELLIOTT MM, ET AL. Mir-223 regulates the number and function of myeloid-derived suppressor cells in multiple sclerosis and experimental autoimmune encephalomyelitis. **Acta Neuropathol** (2017) 133:61–77. [10.1007/s00401-016-1621-6](https://doi.org/10.1007/s00401-016-1621-6). HEGDE VL, SINGH UP, NAGARKATTI PS, NAGARKATTI M. Critical role of mast cells and peroxisome proliferator-activated receptor γ in the induction of myeloid- derived suppressor cells by marijuana cannabidiol in vivo. **J Immunol** (2015) 194:5211–22.
[10.4049/jimmunol.1401844](https://doi.org/10.4049/jimmunol.1401844). JACKSON AR, HEGDE VL, NAGARKATTI PS, NAGARKATTI M.
Characterization of endocannabinoid-mediated induction of myeloid-derived suppressor cells involving mast cells and MCP-1. **J Leukoc Biol** (2014) 95:609–19. [10.1189/jlb.0613350](https://doi.org/10.1189/jlb.0613350).
HEGDE VL, TOMAR S, JACKSON A, RAO R, YANG X, SINGH UP, ET AL.
Distinct microRNA expression profile and targeted biological pathways in functional myeloid-derived suppressor cells induced by Δ9-tetrahydrocannabinol in vivo regulation of CCAAT/enhancer-binding protein α by microRNA-690. **J Biol Chem** (2013) 288:36810–26. [10.1074/jbc.M113.503037](https://doi.org/10.1074/jbc.M113.503037).
GOCKE AR, CRAVENS PD, BEN L-H, HUSSAIN RZ, NORTHROP SC, RACKE MK, ET AL. T-bet regulates the fate of Th1 and Th17 lymphocytes in autoimmunity. **J Immunol** (2007) 178:1341–8. [10.4049/jimmunol.178.3.1341](https://doi.org/10.4049/jimmunol.178.3.1341). HEGDE VL, NAGARKATTI PS, NAGARKATTI M. Role of myeloid-derived suppressor cells in amelioration of experimental autoimmune hepatitis following activation of TRPV1 receptors by cannabidiol. **PLoS One** (2011).
SIDO JM, NAGARKATTI PS, NAGARKATTI M. Δ9-Tetrahydrocannabinol attenuates allogeneic host-versus-graft response and delays skin graft rejection through activation of cannabinoid receptor 1 and induction of myeloid-derived suppressor cells. **J Leukoc Biol** (2015) 98:435–47. [10.1189/jlb.3A0115- 030RR](https://doi.org/10.1189/jlb.3A0115-030RR).
Rainka, M. M., Aladeen, T. S., Mattle, A. G., Lewandowski, E., Vanini, D., McCormack, K., & Mechtler, L. (2023). Esclerose Múltipla e Uso de Cannabis Medicinal: Uma Revisão Retrospectiva de uma População Ambulatorial de Neurologia. Revista internacional de cuidados com a EM, 25(3), 111–117. https://doi.org/10.7224/1537-2073.2022-006
Nouh, R. A., Kamal, A., & Abdelnaser, A. (2023). Canabinóides e Esclerose Múltipla: Uma Análise Crítica dos Potenciais Terapêuticos e Preocupações de Segurança. Farmacêutica, 15(4), 1151. https://doi.org/10.3390/pharmaceutics15041151
Hansen JS, Gustavsen S, Roshanisefat H, et al., Medicina à Base de Cannabis para Dor Neuropática e Espasticidade-A Multicêntrico, Randomizado, Duplo- Cego, Placebo-Controlled Trial. Produtos farmacêuticos (Basileia). 2023; 16(8):1079. Publicado em 28 de jul de 2023. DOI:10.3390/ph16081079 de Fátima Dos Santos Sampaio M, de Paiva YB, Sampaio TB, Pereira MG, Coimbra NC.
Aplicabilidade terapêutica do canabidiol e outros fitocanabinóides na epilepsia, esclerose múltipla e doença de Parkinson e na comorbidade com transtornos psiquiátricos. Clin Pharmacol Toxicol Básico. Publicado online em 13 de março de 2024. DOI:10.1111/bcpt.13997
Duncan RS, Riordan SM, Gernon MC, Koulen P. Canabinóides e endocanabinóides como terapêutica para doenças do sistema nervoso: modelos pré-clínicos e estudos clínicos. Regeneração Neural Res. 2024; 19(4):788-799. DOI:10.4103/1673-5374.382220
Müller-Vahl, K. R., Pisarenko, A., Szejko, N., Haas, M., Fremer, C., Jakubovski, E., Musil, R., Münchau, A., Neuner, I., Huys, D., van Elst, L. T., Schröder, C., Ringlstetter, R., Koch, A., Jenz, E. B., & Großhennig, A. (2023). CANNA-TICS: Eficácia e segurança do tratamento oral com nabiximols em adultos com transtornos crônicos de tique – Resultados de um estudo prospectivo, multicêntrico, randomizado, duplo-cego, placebo controlado, fase IIIb de superioridade. Pesquisa em psiquiatria, 323, 115135. https://doi.org/10.1016/j.psychres.2023.115135
Wang, R., Trigo, J. M., & Le Foll, B. (2023). Efeitos de nabiximols subcrônicos sobre marcadores biológicos de indivíduos submetidos a um ensaio clínico para o tratamento de transtorno por uso de cannabis. Revista americana de pesquisa translacional, 15(8), 5228–5238.
Hidding U, Mainka T, Buhmann C. Uso terapêutico da Cannabis medicinal em doenças neurológicas: uma atualização clínica. J Neural Transm (Viena). 2024; 131(2):117-126. DOI:10.1007/s00702-023-02719-1 de Brito Siqueira ALG, Cremasco PVV, Bahú JO, et al. J Tradit Complemento Med. 2023; 13(6):575-587. Publicado em 26 de ago de 2023. DOI:10.1016/j.jtcme.2023.08.006
Barré T, Testa D, Santos M, et al. A gravidade dos sintomas é um dos principais determinantes do uso de produtos à base de cannabis entre pessoas com esclerose múltipla. J Clin Nurs. 2023; 32(17-18):6460-6473. DOI:10.1111/jocn.16674
Martini S, Gemma A, Ferrari M, Cosentino M, Marino F. Efeitos do Canabidiol na Imunidade Inata: Evidências Experimentais e Relevância Clínica. Int J Mol Sci. 2023; 24(4):3125. Publicado em 4 de fev de 2023. DOI:10.3390/ijms24043125 Cauchi M, Willis M, Andrews A, et al. Esclerose múltipla e o risco de infecção: diretriz de consenso da Association of British Neurologists. Pract Neurol.
Publicado online em 21 de julho de 2022. DOI:10.1136/practneurol-2022-003370 Chandy M, Nishiga M, Wei TT, Hamburgo NM, Nadeau K, Wu JC. Impacto Adverso da Cannabis na Saúde Humana. Annu Rev Med. 2024;75:353-367. DOI:10.1146/annurev-med-052422-020627
ElSohly MA, Radwan MM, Gul W, Chandra S, Galal A. Fitoquímica da Cannabis sativa L. Prog Chem Org Nat Prod. 2017;103:1-36. DOI:10.1007/978-3-319- 45541-9_1
Wishart DS, Hiebert-Giesbrecht M, Inchehborouni G, et al. J Agric Alimentos Chem. Publicado online em 5 de janeiro de 2024. DOI:10.1021/acs.jafc.3c06616 Hidding U, Mainka T, Buhmann C. Uso terapêutico da Cannabis medicinal em doenças neurológicas: uma atualização clínica. J Neural Transm (Viena). 2024; 131(2):117-126. DOI:10.1007/s00702-023-02719-1
Tourjman SV, Buck G, Jutras-Aswad D, et al. Canadian Network for Mood and Anxiety Treatments (CANMAT) Task Force Report: A Systematic Review and Recommendations of Cannabis use in Bipolar Disorder and Major Depressive Disorder. Pode J Psiquiatria. 2023; 68(5):299-311. DOI:10.1177/07067437221099769
Beletsky A, Liu C, Lochte B, Samuel N, Grant I. Cannabis e ansiedade: uma revisão crítica. Med Cannabis Canabinóides. 2024; 7(1):19-30. Publicado em 23 fev 2024. DOI:10.1159/000534855
Häuser W, Welsch P, Radbruch L, Fisher E, Bell RF, Moore RA. Medicamentos à base de cannabis e cannabis medicinal para adultos com dor oncológica. Banco de Dados Cochrane Syst Rev. 2023; 6(6):CD014915. Publicado em 5 de junho de 2023. DOI:10.1002/14651858.CD014915.pub2
Farooqi T, Bhuyan DJ, Low M, Sinclair J, Leonardi M, Armour M. Cannabis e endometriose: os papéis da microbiota intestinal e do sistema endocanabinóide. J Clin Med. 2023; 12(22):7071. Publicado em 13 de nov de 2023. DOI:10.3390/jcm12227071
Bell AD, MacCallum C, Margolese S, et al., Diretrizes de Prática Clínica para Cannabis e Medicamentos à Base de Canabinóides no Manejo da Dor Crônica e Condições Co-Ocorrentes. Cannabis Canabinóide Res. 2024; 9(2):669-687. DOI:10.1089/can.2021.0156
Coelho VB, Salvador VL, Rodrigues FG, Wingester EL. Análise dos aspectos epidemiológicos da Esclerose Múltipla no Brasil durante o período de 2012 a 2022. Brazilian Journal of Health Review, 2595-6825, v. 6, n. 6, p. 27513-27527.2023
MS International Association. Atlas of MS. 3rd edition, p. 23, 2023. Acesso em 03/05. Link de acesso: https://www.atlasofms.org/map/global/epidemiology/number-of-people-with-ms
